Журнал физической химии, 2021, T. 95, № 9, стр. 1408-1413
Физико-химические особенности сорбции 4-гидрокси-3-метоксибензальдегида активированным углем Norit GAC 1240W в статических условиях
А. А. Сушкова a, А. Ю. Шолохова b, Т. В. Елисеева a, *, И. В. Воронюк a
a ФГБОУ ВО “Воронежский государственный университет”
Воронеж, Россия
b Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
* E-mail: tatyanaeliseeva@yandex.ru
Поступила в редакцию 05.12.2020
После доработки 05.12.2020
Принята к публикации 03.01.2021
Аннотация
Проведена оценка равновесных характеристик сорбции 4-гидрокси-3-метоксибензальдегида (ванилина) активированным углем Norit GAC 1240W при различных температурах. Выявлено, что в исследуемом диапазоне температур поглощение данного замещенного гидроксибензальдегида активированным углем имеет мономолекулярный характер и описывается уравнением Ленгмюра. Получены значения термодинамических характеристик сорбции ванилина применяемым сорбентом и установлено, что процесс является экзотермическим. Показано, что при поглощении рассматриваемого гидроксибензальдегида гранулированным углем Norit энтропийный фактор вносит определяющий вклад в свободную энергию процесса. В работе исследовано влияние температуры на кинетику сорбции ванилина, определено время достижения равновесия в системе сорбент–сорбат. Экспериментальными методами установлено, что стадия внешней диффузии сорбата лимитирует процесс поглощения ванилина активированным углем Norit во всем диапазоне исследуемых температур.
4-гидрокси-3-метоксибензальдегид (ванилин) широко применяется в кондитерской и пищевой промышленности, в парфюмерии. За счет наличия в структуре молекулы гидроксильной, метоксильной и альдегидной групп данный дизамещенный бензальдегид может служить исходным соединением для получения на его основе целого ряда новых химических веществ, обладающих ценными и полезными свойствами. Его также используют при синтезе и модификации полимерных материалов [1, 2]. Натуральный ванилин, выделяемый из стручков растения семейства Орхидных, является дорогостоящим и не позволяет удовлетворять увеличивающийся мировой спрос на данный ароматизатор, поэтому большая часть используемого продукта производится синтетическим путем из эвгенола, гваякола и лигнинсодержащего сырья [3, 4]. В связи с этим актуальной задачей представляется разработка способов извлечения ванилина из производственных растворов, содержащих помимо него значительное количество различных примесей. Одним из эффективных методов выделения органических веществ является сорбция, лежащая в основе многих известных технологических процессов.
Ванилин, как известно из литературы, может быть выделен из жидких сред с использованием различных сорбентов. Установлена возможность использования неионогенных сорбентов для его извлечения из водных растворов по механизму физической адсорбции [5, 6]. Специальное модифицирование может способствовать увеличению емкости сорбента по гидроксибензальдегиду. В частности, в работе [7] проведено модифицирование макропористого хлорметилированного полистирола различными количествами анизола и установлено, что повышенная адсорбционная способность таких сорбентов по отношению к ванилину обусловлена образованием водородной связи между гидроксильной группой молекулы сорбата и атомом кислорода метоксигруппы анизола.
Селективность по отношению к гидроксибензальдегидам проявляют низкоосновные анионообменники [8, 9]. Их поглощение такими анионообменниками осуществляется за счет химического взаимодействия между карбонильной группой гидроксибензальдегида и первичными, а также вторичными аминогруппами сорбента с образованием ковалентных связей (хемосорбция). Дополнительный вклад в поглощение вносят водородные связи, образующиеся между гидроксильными группами ванилина и третичными аминогруппами сорбента.
Имеются данные по извлечению ванилина из водных растворов высокоосновными анионообменниками [10]. В этом случае основной механизм поглощения – перезарядка молекулы ванилина в щелочной среде внутреннего раствора фазы сорбента с образованием ванилат-ионов с последующим ионным обменом ванилат-ионов с функциональными группами анионообменника. Возможны также взаимодействия за счет слабых физических сил.
Изучение особенностей сорбции ванилина на активированном угле является малоизученной и актуальной задачей. Оно необходимо для оценки возможности применения и эффективности активированного угля как сорбента в промышленной технологии для извлечения и выделения ароматических альдегидов из технологических растворов. Активированные угли не являются селективными сорбентами, однако могут эффективно извлекать органические вещества из смесей с минеральными солями. При этом они имеют достаточно высокую емкость и отличаются более низкой ценой, по сравнению, в частности, с функциональными полимерными материалами.
Цель данной работы – установление влияния температуры на равновесные и кинетические параметры сорбции ванилина гранулированным активированным углем Norit в статических условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве сорбента в работе использован гранулированный активированный уголь Norit GAC 1240W. Данный уголь активируется паром, характеризуется высокой твердостью, что позволяет проводить его реактивацию. Общая площадь поверхности 1100 м2/г, эффективный размер частиц 0.6–0.7 мм.
Изотермы сорбции ванилина получали методом переменных концентраций [11] при температурах 298 ± 2 и 348 ± 2 K. Навески угля массой около 0.5 г, взятые с точностью ±0.0002 г, заливали 200.0 см3 раствора ванилина с концентрациями в интервале от 0.5 до 24.0 ммоль/дм3 и выдерживали до установления равновесия в системе сорбент-раствор сорбата при постоянном перемешивании. После достижения равновесия в системе определяли концентрацию ванилина во внешнем растворе методом спектрофотометрии (прибор СФ-2000).
Изучение кинетики сорбции проводили в статических условиях с использованием метода ограниченного объема. Навески активированного угля массой около 0.5 г, взятые с точностью ±0.0002 г, помещали в водный раствор ванилина объемом 200.0 см3 с заданной концентрацией и выдерживали при постоянном перемешивании. Через определенные промежутки времени спектрофотометрическим методом определяли концентрацию ванилина в растворе до установления в исследуемой системе равновесия. Количество поглощенного сорбентом ванилина рассчитывали по его убыли во внешнем растворе. По полученным данным строили кинетические кривые в координатах F–t, где F = Qt/Qmax – степень достижения равновесия сорбции; Qt – емкость сорбента в момент времени t, ммоль/г, Qmax – емкость сорбента в состоянии равновесия для данной концентрации исходного раствора Сисх, ммоль/г, t – время, мин.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
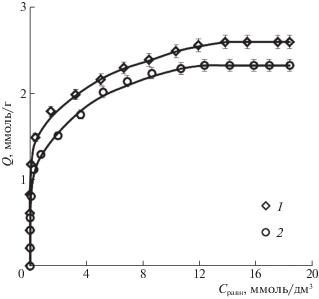
Для оценки равновесных характеристик сорбции ванилина активированным углем в статических условиях получены изотермы сорбции при температуре 298 ± 2 и 348 ± 2 K, которые представлены на рис. 1.
Рис. 1.
Изотермы сорбции 4-гидрокси-3-метоксибензальдегида (ванилина) активированным углем Norit GAC 1240W при различных температурах: 298 (1), 348 K (2).
Для описания равновесия сорбции использованы уравнения моделей Ленгмюра, Фрейндлиха и Темкина соответственно [12]:
Полученные в работе изотермы сорбции с наибольшим коэффициентом корреляции описываются уравнением типа Ленгмюра (R2 = 0.997), следовательно, поглощение ванилина активированным углем в исследуемом диапазоне температур носит мономолекулярный характер. Наличие на поверхности гранулированного активированного угля GAC Norit 1240 карбонильных и гидроксильных функциональных групп показано в работе [13]. Вероятно, значительный вклад в поглощение ванилина активированным углем вносят водородные связи с участием гидроксильных и карбонильных групп как гидроксибензальдегида, так и сорбента.
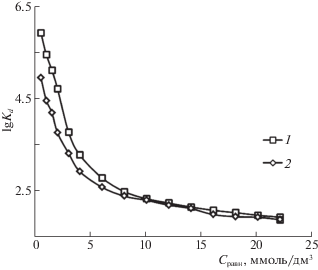
Рассчитанные на основе изотерм сорбции коэффициенты распределения ванилина между активированным углем и раствором (Kd) имеют достаточно высокие значения. С увеличением концентрации ванилина во внешнем растворе наблюдается закономерное уменьшение коэффициента распределения, обусловленное стерическими затруднениями при сорбции ванилина из более концентрированных растворов. Зависимости логарифма коэффициента распределения ванилина в системе раствор сорбата – сорбент от концентрации внешнего раствора при температурах 298 ± 2 и 348 ± 2 K представлены на рис. 2.
Рис. 2.
Зависимости логарифма коэффициента распределения ванилина в системе раствор сорбата – сорбент (гранулированный активированный уголь Norit) от концентрации ванилина во внешнем растворе при 298 (1) и 348 (2) K.
Величина коэффициента сорбционного равновесия Ks и емкость монослоя Qmax при температуре 298 ± 2 и 348 ± 2 K определены из линеаризованной модели Ленгмюра и представлены в табл. 1.
Таблица 1.
Равновесные параметры сорбции 4-гидрокси-3-метоксибензальдегида (ванилина) гранулированным активированным углем Norit GAC 1240W, рассчитанные по уравнению Ленгмюра
| Т, K | Qmax, ммоль/г | Ks |
|---|---|---|
| 298 | 2.58 | 2882.4 |
| 348 | 2.36 | 2201.9 |
Отмечено, что увеличение температуры приводит к уменьшению величин данных равновесных параметров сорбции ванилина на активированном угле. Сравнение полученных результатов с данными, представленными в работе [10], показывает, что активированный уголь обладает большей емкостью по ванилину по сравнению с неионогенным сверхсшитым полистирольным полимерным сорбентом MN-202, не имеющим в своей структуре функциональных групп. В то же время, емкость угля по гидроксибензальдегиду ниже по сравнению с емкостью макропористого высокоосновного анионообменника АВ-17-2П в гидроксильной форме с функциональными группами четвертичного аммониевого основания.
Рассчитаны термодинамические параметры сорбции ванилина активированным углем – кажущаяся энергия мономолекулярной сорбции, энтальпия и энтропия сорбционного процесса соответственно:
Таблица 2.
Термодинамические характеристики сорбции ванилина активированным углем Norit при различной температуре
| T, K | $ - \Delta G{\kern 1pt} '$, кДж/моль | $ - \Delta H{\kern 1pt} '$, кДж/моль | $T\Delta S{\kern 1pt} '$, кДж/моль |
|---|---|---|---|
| 298 | 19.69 | 5.35 | 14.33 |
| 348 | 22.09 | 16.73 |
Здесь $~\Delta G{\kern 1pt} '$ – кажущаяся энергия процесса сорбции, кДж/моль, ${{K}_{{{{T}_{i}}}}}$ – константа сорбционного равновесия при температуре Ti; R = 8.314 Дж/(моль K) – универсальная газовая постоянная.
Процесс сорбции ванилина активированным углем является экзотермическим и сопровождается уменьшением свободной энергии Гиббса, свидетельствующим о самопроизвольности процесса. Кажущаяся энергия сорбции $( - \Delta G{\kern 1pt} ')$ ниже, чем при использовании высокоосновных анионообменников; это обусловлено различным механизмом сорбции ванилина на активированном угле и высокоосновных анионообменниках. При сорбции ванилина активированным углем наблюдается возрастание энтропии, и вклад энтропийного фактора определяет свободную энергию процесса. Поглощение ванилина приводит к нарушению упорядоченности системы за счет разрушения водородных связей, образуемых гидрофильными группами в структуре активированного угля Norit, в частности, гидроксильными группами с молекулами растворителя, а также разрушением гидратной оболочки молекулы ванилина при вхождении в поры сорбента. В случае сорбции ароматического альдегида на высокоосновных анионообменниках свободную энергию процесса определяет энтальпийный фактор [10].
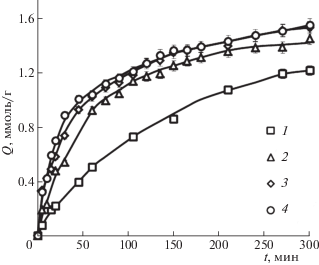
В работе также рассмотрено влияние температуры на кинетические характеристики сорбции ванилина из раствора с исходной концентрацией 6.0 ммоль/дм3. Кинетические кривые при температурах 298, 323 и 348 ± 2 K, представлены на рис. 3.
Рис. 3.
Кинетические кривые сорбции ванилина активированным углем Norit из раствора с Сисх = = 6.0 ммоль/дм3 при различных температурах: 348 (1), 323 (2), 298(3) K.

Установлено, что с увеличением температуры уменьшается время достижения равновесия в исследуемой системе, так, при 298 К оно достигается за 780 минут, а при 348 К – за 135 мин. При увеличении температуры от 298 до 348 К наблюдается уменьшение сорбционной способности угля к ванилину с 1.84 до 1.56 ммоль/г.
Следует отметить, что полная емкость по ванилину высокоосновного анионообменника АВ-17-2П с функциональными группами четвертичного аммониевого основания выше в сравнении с активированным углем, и процесс сорбции ароматического альдегида протекает значительно быстрее. Однако активированный уголь не склонен к органическому отравлению в растворе ванилина, в отличие от высокоосновного анионообменника [14]. При этом сорбционная способность угля Norit по отношению к ванилину несколько больше емкости неионогенного полимерного сорбента MN-202 [10]. Это согласуется с данными, полученными при рассмотрении равновесных параметров сорбции. Данные закономерности объясняются различной структурой сорбентов, от которой непосредственно зависят их емкостные характеристики.
Установление влияния стадии внешней диффузии сорбата на общую скорость процесса сорбции проводили, оценивая ее зависимость от экспериментальных факторов. Начальные участки кинетических кривых сорбции ванилина активированным углем при различной скорости перемешивания раствора представлены на рис. 4. Увеличение интенсивности перемешивания внешнего раствора приводит к возрастанию скорости поглощения ванилина углем. Наличие такой зависимости является весомым критерием внешнедиффузионного механизма кинетики.
Рис. 4.
Начальные участки кинетических кривых сорбции ванилина активированным углем Norit при различной скорости перемешивания внешнего раствора (Сисх = 6.0 ммоль/дм3): 150 (1), 175 (2), 200 (3), 250 (4) об./мин.
Для доказательства лимитирующей стадии сорбционного процесса проведен опыт с прерыванием контакта сорбента с раствором гидроксибензальдегида. Соответствующие кинетические кривые сорбции ванилина углем Norit при исходной концентрации раствора 6.0 ммоль/дм3, полученные без прерывания контакта сорбента с раствором ванилина и с прерыванием контакта данных фаз, представлены на рис. 5.
Рис. 5.
Кинетические кривые сорбции ванилина активированным углем Norit (Сисх = 6.0 ммоль/дм3): 1 – без прерывания, 2 – с прерыванием контакта фаз.

Как видно из полученных зависимостей, после возобновления контакта фаз скорость сорбционного процесса не изменяется, что также доказывает преобладание внешнедиффузионного механизма кинетики при исследуемой концентрации ванилина.
Таким образом, на основании полученных изотерм сорбции установлено, что поглощение ванилина активированным углем Norit GAC 1240W имеет мономолекулярный характер. Рассчитаны значения термодинамических параметров сорбции ванилина исследуемым углем, установлено, что процесс является экзотермическим. При этом свободную энергию процесса определяет вклад энтропийного фактора. Кажущаяся энергия сорбции имеет значения, характерные для молекулярной адсорбции. Значительный вклад в поглощение ванилина вносят, вероятно, водородные связи с участием карбонильных и гидроксильных групп сорбата и сорбента.
Установлено, что увеличение температуры сопровождается уменьшением времени достижения равновесия в системе сорбент–раствор сорбата и снижением полной емкости активированного угля по ванилину.
На основе влияния экспериментальных факторов на скорость сорбции проведена оценка лимитирующей стадии сорбционного процесса и установлено, что процессом, контролирующим скорость сорбции гидроксибензальдегида активированным углем Norit, является внешняя диффузия.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках государственного задания вузам в сфере научной деятельности на 2020–2022 годы, проект № FZGU-2020-0044.
Список литературы
Jiang H., Sun L., Zhang Y. et al. // Polymer Degradation and Stability. 2019. V. 160. № 1. P. 45. https://doi.org/10.1016/j.polymdegradstab.2018.12.007
Mora A.S., Tayouo R., Boutevin B. et al. // Green Chem. 2018. V. 20. № 17. P. 4075. https://doi.org/10.1039/C8GC02006J
Евстигнеев Э.И., Майорова Е.Д., Платонов А.Ю. // Химия древесины. 1990. № 6. С. 41.
Фенгел Д., Вегенер Г. Древесина (химия, ультраструктура, реакции). M.: Лесная промышленность, 1988. 512 с.
Шолохова А.Ю., Патрушев Ю.В., Елисеева Т.В. // Сорбционные и хроматографические процессы. 2018. Т. 18. № 2. С. 916. https://doi.org/10.17308/sorpchrom.2018.18/500
Samah R. A., Zainol N., Abd-Aziz S. et al. // Adsorption Science and Technology. 2013. V. 31. № 7. P. 599. https://doi.org/10.1260/0263-6174.31.7.599
Jin X., Huang J. // Advances in Polymer Technology. 2013. V. 32. № S2. P. 221. https://doi.org/10.1002/adv.21268
Воронюк И.В., Елисеева Т.В., Ищенко К.Ю. и др. // Сорбционные и хроматографические процессы. 2010. Т. 10. № 2. С. 260.
Лобова Н.А., Родионова Д.О., Воронюк И.В. и др. // Сорбционные и хроматографические процессы. 2014. Т. 14. № 6. С. 1040.
Шолохова А.Ю. Физико-химические особенности сорбции ванилина высокоосновными анионообменниками: Дис. … канд. хим. наук. Воронеж, 2018. 143 с.
Селеменев В.Ф., Славинская Г.В., Хохлов В.Ю. и др. Практикум по ионному обмену. Воронеж: Изд-во Воронеж. ун-та, 2004. 160 с.
Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М.: Химия, 1988. 464 с.
Gunjate J.K. // International Journal of Applied Environmental Sciences. 2017. V. 12. № 6. P. 1045.
Шолохова А.Ю., Шашков М.В., Елисеева Т.В. и др. // Физикохимия поверхности и защита материалов. 2020. Т. 56. С. 47. https://doi.org/10.31857/S0044/85619060299
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


