Журнал физической химии, 2022, T. 96, № 1, стр. 70-75
Исследование состава сольватных комплексов перхлората лития с сульфоланом методом вакуумной гравиметрии
Е. В. Карасева a, *, А. А. Саввина a, **, Е. В. Кузьмина a, С. Э. Мочалов a, В. С. Колосницын a
a Уфимский Институт химии Уфимского федерального исследовательского центра РАН
Уфа, Россия
* E-mail: karaseva@anrb.ru
** E-mail: asavvina@gmail.com
Поступила в редакцию 08.05.2021
После доработки 02.06.2021
Принята к публикации 04.06.2021
- EDN: YZIIVR
- DOI: 10.31857/S0044453722010150
Аннотация
Методом автоматизированной вакуумной гравиметрии в режиме изотермического испарения растворителя изучено влияние температуры (40, 50, 60 и 70°С) на состав образующихся сольватных комплексов перхлората лития с сульфоланом. Обнаружено, что состав сольватных комплексов перхлората лития с сульфоланом определяется температурой их образования. Увеличение температуры приводит к уменьшению количества молекул сульфолана, входящих в состав сольватного комплекса – при 40°С образуется тетрасольват перхлората лития с сульфоланом, а при 50, 60 и 70°С – дисольваты. Состав сольватных комплексов перхлората лития с сульфоланом также подтвержден методом термогравиметрии. Предположено, что различия в составе сольватных комплексов, существующих в системе “перхлорат лития–сульфолан” при различных температурах, обусловлены различиями в их строении.
Сольватные комплексы литиевых солей с апротонными диполярными растворителями (АДР), находящиеся в жидкофазном состоянии при нормальных условиях, относят к новому типу электролитных систем – сольватным ионным жидкостям (СИЖ) [1–6]. Сольватные ионные жидкости обладают высокой электрохимической устойчивостью, что позволяет их использовать в аккумуляторах с положительными электродами на основе высокопотенциальных активных материалов. Предполагается, что применение СИЖ в качестве электролитов в литий-ионных и литиевых аккумуляторах [7–9] позволит существенно улучшить их эксплуатационные свойства, в частности, увеличить удельную энергию, длительность циклирования и повысить безопасность [10].
В отличие от концентрированных растворов литиевых солей в АДР [11–13], в сольватных ионных жидкостях отсутствует свободный растворитель. Все молекулы растворителя связаны в сольватных оболочках центральных атомов литиевых солей [14]. Высокая химическая и электрохимическая стабильность СИЖ обусловлена уменьшением реакционной способности молекул растворителей, поскольку их функциональные центры (электроно-донорные группы) связаны с ионом лития [15].
Основными требованиями к свойствам электролитных систем, предназначенных для применения в электрохимических накопителях электрической энергии (электрохимических аккумуляторах), являются высокая электропроводность, химическая и электрохимическая устойчивость [16].
Свойства электролитных систем на основе сольватных комплексов литиевых солей с АДР определяются их составом, природой растворителей и солей [17, 18]. Химическая и электрохимическая устойчивость сольватных комплексов зависит в основном от свойств компонентов, а электропроводность – от состава. Наибольшей электропроводностью будут обладать сольватные комплексы литиевых солей, у которых ацидолиганд размещен во внешней координационной сфере.
Состав и строение сольватных комплексов литиевых солей определяются конкурентными взаимодействиями нейтральных и кислотных лигандов с ионом лития. Для вытеснения ацидолигандов во внешнюю координационную сферу иона лития их сольватирующие свойства должны быть ниже, чем нейтральных лигандов. Поэтому для получения сольватных ионных жидкостей, обладающих высокой электропроводностью, используют литиевые соли с объемными анионами (ацидолигандами), обладающими низкими донорными свойствами, такие как перхлорат лития (LiClO4), гексафторфосфат лития (LiPF6), трифторметансульфонилимид лития (LiN(SO2CF3)2), а в качестве нейтральных лигандов – АДР, обладающие хорошей сольватирующей способностью по отношению к иону лития и высокой электрохимической устойчивостью.
В качестве перспективного класса растворителей для применения в электролитных системах энергоемких литий-ионных и литиевых аккумуляторов большой интерес вызывают сульфоны и, в частности, сульфолан. Он обладает высокой термической, химической и электрохимической стабильностью, высокой диэлектрической проницаемостью, хорошо растворяет литиевые соли, обеспечивая высокую степень их электролитической диссоциации [19–21].
Поскольку в системе “растворитель–соль” могут существовать сольватные комплексы различного состава, для получения электролитов с желаемым набором электрохимических свойств важно определить состав сольватов и условия их образования [22–24].
Удобным методом определения состава сольватов, существующих в системе “растворитель–соль”, является метод вакуумной гравиметрии. Гравиметрические методы широко используются в аналитической химии и физико-химических исследованиях свойств различных веществ и материалов. Например, широко используемым является метод термогравиметрического анализа, основанный на измерении изменения веса веществ при их нагреве [25, 26]. Для проведения термогравиметрического анализа промышленностью выпускается множество высокоточных автоматизированных приборов.
Метод вакуумной гравиметрии, как правило, применяется для определения содержания летучих компонентов в различных веществах [27]. На практике метод вакуумной гравиметрии реализуется периодическим взвешиванием веществ после их выдержки в вакууме при определенной температуре. Такой способ реализации метода вакуумной гравиметрии трудоемок и не всегда позволяет получать результаты с желаемой точностью.
Для повышения информативности, производительности и точности метода вакуумной гравиметрии нами был разработан и изготовлен автоматический прибор, который мы назвали “Вакуумный гравиметрический анализатор”. Преимущество разработанного нами прибора состоит в том, что он позволяет регистрировать при испарении растворителя в вакууме в непрерывном режиме кривую потери массы исследуемого объекта, по форме которой можно судить о составе соединений, образующихся в системе “растворитель–соль” при испарении растворителя из растворов солей.
Целью настоящей работы была оценка возможности применения метода автоматизированной вакуумной гравиметрии для определения состава сольватных комплексов, образующихся в системе “перхлорат лития–сульфолан” при различных температурах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тетраметиленсульфон (сульфолан, tкип = 285–287°С [19], 99%, Sigma-Aldrich) осушали выдержкой над свежепрокаленными молекулярными ситами (цеолитами) 4 Å и очищали двойной вакуумной перегонкой. Перхлорат лития получали путем нейтрализации гидроксида лития (“х.ч.”, ГОСТ 8595-83) хлорной кислотой (“х.ч.”, ТУ 6-09-2878-84). Очистку соли осуществляли перекристаллизацией из водного раствора с последующей осушкой в вакуумном шкафу при температуре 100°С в присутствии молекулярных сит (цеолитов) 4 Å.
Для исследований объемно-весовым методом был приготовлен 1М раствор LiClO4 в сульфолане. Все работы проводили в перчаточном боксе в атмосфере сухого воздуха (содержание воды в атмосфере бокса было 10–20 ppm). Содержание воды в приготовленном электролитном растворе, определенное методом кулонометрического титрования с помощью титратора Titroline®7500 KF trace (SI Analytics, Германия) в среде реактива Фишера, составило 41 ± 8 ppm. Приготовленный электролитный раствор хранили в герметичных стеклянных пузырьках в перчаточном боксе в атмосфере сухого воздуха при комнатной температуре (≈23 ± 2°С).
Изучение состава сольватных комплексов перхлората лития в сульфолане (LiClO4 ⋅ nSolv) проводили методом вакуумной гравиметрии с помощью вакуумного гравиметрического анализатора11. Принципиальное устройство и фото автоматизированного вакуумного гравиметрического анализатора представлено на рис. 1.
Рис. 1.
Схема и фото вакуумного гравиметрического анализатора:1 – вакуумный насос, 2 – система осушки атмосферного воздуха, 3 – манометр, 4 – термостатируемые весы, 5 – стеклянный купол прибора, 6 – управляющий компьютер, 7 – цифровой терморегулятор.

Испарение свободного растворителя из 1М раствора LiClO4 в сульфолане проводили при температурах 40, 50, 60 и 70°С в режиме динамического вакуума (производительность вакуумного насоса составляла 51 л/мин, остаточное давление в вакуумной камере было 0.13 Па).
Определение состава сольватных комплексов осуществляли следующим образом. В перчаточном боксе в тигель объемом 2.2 см3 (диаметр 3.5 см, высота стенки 0.23 см, площадь испарения ≈9.6 см2), изготовленный из нержавеющей стали, с помощью шприца вносили 1.5 мл 1М раствора LiClO4 в сульфолане и взвешивали с точностью ±0.0001 г. Тигель со взвешенным раствором электролита переносили в эксикаторе, заполненным молекулярными ситами (цеолитами) 4 Å, и устанавливали на термостатируемые весы вакуумного термогравиметрического анализатора. С помощью цифрового терморегулятора устанавливали заданную температуру, в течение 30 мин термостатировали весы и платформу для взвешивания с установленным тиглем с исследуемым раствором при заданной температуре и в условиях динамического вакуума регистрировали кривую потери массы электролита. Интервал времени измерения массы анализируемого вещества составлял 80 с. Процесс проводился в режиме вакуумного изотермического испарения свободного растворителя при различных температурах. Эксперимент проводили до достижения постоянной массы образца (обычно время испарения сульфолана составляло 70–80 часов). Для оценки воспроизводимости эксперимент при каждой температуре проводили 2 раза.
О составе сольватного комплекса судили по пересечению касательных в точке перегиба на кривых потери массы. Сольватное число образующихся сольватных комплексов (LiClO4 ⋅ nSolv) рассчитывали из кривой потери массы, согласно уравнению:
(1)
$n = \left( {\frac{{m({\text{ост}}.) - m({\text{LiCl}}{{{\text{O}}}_{4}})}}{{M({\text{Solv}})}}} \right){\text{/}}\left( {\frac{{m({\text{LiCl}}{{{\text{O}}}_{4}})}}{{M({\text{LiCl}}{{{\text{O}}}_{4}})}}} \right),$Состав сольватных комплексов и их термическую устойчивость исследовали методом термогравиметрии с помощью модернизированного дериватографа марки МОМ-1000 (Q-Derivatograph system F. Paulik, J. Paulik, L. Erdey, Венгрия). Измерения проводили в атмосфере воздуха в закрытом платиновом тигле. Скорость нагрева исследуемых образцов составляла 5 K/мин, масса навески была 100 мг, чувствительность весов – 100 мг, термопары – платино-платинородиевые.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поскольку прибор снабжен функцией автоматической регистрации массы исследуемого образца, то результатом проведения экспериментов были кривые потери массы 1М раствора LiClO4 в сульфолане (рис. 2).
Рис. 2.
Кривые потери массы и изменения мольного отношения растворитель : соль (сольватное число, n) 1М растворов LiClO4 в сульфолане, полученные при вакуумном изотермическом испарении растворителя при различных температурах. Температура испарения растворителя представлена в легенде.
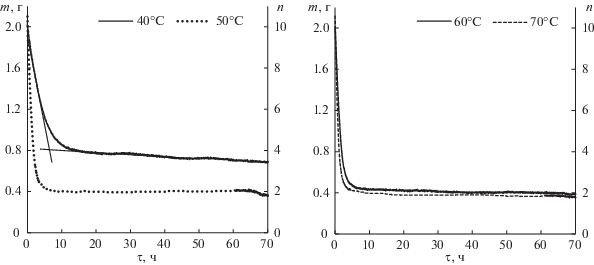
Кривые потери массы исследуемого раствора, полученные при различных температурах, схожи между собой по форме. Первоначально, в течение 5–10 часов, наблюдается резкое уменьшение массы растворов, затем масса растворов практически не изменяется, либо изменяется с очень малой скоростью. Температура испарения растворителя влияет на наклон начального участка уменьшения массы исследуемого раствора, по которому может быть оценена скорость удаления растворителя из исследуемого раствора. Так, при 40°С быстрое уменьшение массы исследуемого раствора до ее стабилизации происходит в течение примерно первых 10-ти часов, а при 50, 60 и 70°С – в течение первых 4–6-ти часов.
Температура испарения растворителя влияет и на состав образующихся сольватов перхлората лития с сульфоланом. При температуре 40°С образуется тетрасольват, а при 50, 60 и 70°С – дисольваты перхлората лития с сульфоланом.
Интересно отметить, что при 40°С после точки перегиба на кривой потери массы наблюдается небольшой наклон, указывающий на продолжение испарения растворителя. Вероятно, в тетрасольвате перхлората лития из-за слабого межмолекулярного взаимодействия между катионом лития и молекулами растворителя, при длительном вакуумировании даже при низкой температуре происходит удаление растворителя из сольватной сферы.
Состав сольватных комплексов перхлората лития с сульфоланом, полученных испарением избыточного растворителя, был также подтвержден методом термогравиметрии. О составе сольватов судили по величине зольности исследованных веществ. Для правильной интерпретации термограмм сольватных комплексов перхлората лития с сульфоланом были также получены термограммы перхлората лития и сульфолана. Результаты термогравиметрических исследований представлены на рис. 3, возможные схемы термической деструкции изученных веществ представлены в табл. 1.
Рис. 3.
Термограммы перхлората лития (а), сульфолана (б) и сольватных комплексов перхлората лития с сульфоланом: LiClO4 ⋅ 4Сульфолан (в), LiClO4 ⋅ 4Сульфолан (г). Условия: модернизированный дериватограф МОМ-1000, закрытый платиновый тигель, скорость нагрева 5 K/мин.

Таблица 1.
Возможные схемы термической деструкции перхлората лития, сульфолана и сольватных комплексов перхлората лития с сульфоланом
| Исследуемое вещество | Уравнение реакции | Зольность, % | |
|---|---|---|---|
| расчет | эксперимент | ||
| LiClO4 | LiClO4 = LiCl + 2O2↑ | 39.8 | 37.0 |
| Сульфолан | C4H8SO2 = SO2↑ + C4H8↑ | 0 | 0 |
| LiClO4 ⋅ 4Сульфолан | LiClO4 ⋅ 4C4H8SO2 = 0.5Li2SO4 + летучие продукты | 9.4 | 12.3 |
| LiClO4 ⋅ 4Сульфолан | LiClO4 ⋅ 2C4H8SO2 = 0.5Li2SO4 + летучие продукты | 15.9 | 15.3 |
Термическое разложение перхлората лития осуществляется в 2 стадии – на первой стадии (в диапазоне 420–450°С) перхлорат лития разлагается с образованием хлорида лития [28]. Образовавшийся хлорид лития (tпл = 610°С [29]) плавится с небольшим эндо-эффектом при температуре 578°С. При дальнейшем нагреве происходит медленное испарение хлорида лития.
Потеря массы сульфолана при его нагреве происходит в одну стадию. Однако можно предположить, что первоначально, при нагреве примерно до 250°С, происходит испарение сульфолана, а при более высоких температурах – его разложение, сопровождающееся эндо-эффектом, наблюдаемым на кривой дифференциального термического анализа.
Кривые потери массы сольватных комплексов перхлората лития с сульфоланом имеют сложную форму. Потеря массы обоих сольватных комплексов сопровождалась одним эндо- и двумя экзо-эффектами. Эндо-эффект мы относим к термическому разложению сульфолана, а экзо-эффекты – к разложению перхлората лития и образованию сульфата лития.
Расчеты показывают, что при нагреве сольватных комплексов в условиях термогравиметрического анализа сначала происходит испарение сульфолана, а затем – химическое взаимодействие перхлората лития с оставшимся сульфоланом, приводящее к образованию сульфата лития. Образование сульфата лития было подтверждено нами проведением качественной реакции на сульфат-ионы с раствором хлорида бария. Качественная реакция на хлорид-ионы с раствором нитрата серебра показала их отсутствие в продуктах термодеструкции сольватных комплексов.
Сравнение кривых потери массы сульфолана и сольватных комплексов перхлората лития с сульфоланом показало, что испарение сульфолана из его сольватных комплексов с перхлоратом лития начинается при более высоких температурах, чем индивидуального сульфолана. Кроме того, чем меньше сульфолана находится в составе сольватных комплексов, тем выше температура начала его испарения.
На примере системы “сульфолан–перхлорат лития” оценена возможность использования метода автоматизированной вакуумной гравиметрии для исследования состава сольватных комплексов, образующихся в системе “растворитель–соль”. Показано, что метод изотермической вакуумной гравиметрии является информативным и удобным методом для исследований состава сольватных комплексов, существующих в системе “растворитель–соль”.
Обнаружено, что температура вакуумного испарения растворителя влияет на состав образующихся сольватных комплексов. Так, при испарении растворителя из 1М раствора перхлората лития в сульфолане при 40°С образуется тетрасольват, а при более высоких температурах – дисольват. Предположено, что различия в составе образующихся сольватных комплексов перхлората лития с сульфоланом обусловлены различиями в их строении.
Результаты термогравиметрических исследований подтвердили состав сольватных комплексов, установленный методом вакуумной гравиметрии. Показано, что термическое разложение индивидуального перхлората лития и сольватных комплексов перхлората лития происходит различным образом. Термическое разложение перхлората лития происходит с образованием хлорида лития, а сольватных комплексов перхлората лития с сульфоланом – с образованием сульфата лития.
Авторы выражают благодарность н.с. лаборатории электрохимии УфИХ УФИЦ РАН, к.х.н. Шеиной Л.В. за регистрацию термограмм объектов исследований.
Работа выполнена при финансовой поддержке Российского научного фонда (совместный проект с Государственным фондом естественных наук Китая, NSFC), проект RSF-NSFC № 21-43-00006 “Ион-сольватные комплексы полисульфидов лития и их электрохимическое поведение в литий-серных аккумуляторах”.
Список литературы
Kawazoe T., Hashimoto K., Kitazawa Y. et al. // Electrochim. Acta. 2017. V. 235. P. 287. https://doi.org/10.1016/j.electacta.2017.03.125
Armand M., Endres, F., MacFarlane D.R. et al. // Nat. Mater. 2009. V. 8. P. 621. https://doi.org/10.1038/NMAT2448
Ueno K., Yoshida K., Tsuchiya M. et al. // J. Phys. Chem. B. 2012. V. 116. № 36. P. 11323. https://doi.org/10.1021/jp307378j
Plechkova N.V., Seddon K.R. // Chem. Soc. Rev. 2008. V. 37. P. 123. https://doi.org/10.1039/b006677j
Galiński M., Lewandowski A., Stępniak I. // Electrochim. Acta. 2006. V. 51. № 26. P. 5567. https://doi.org/10.1016/j.electacta.2006.03.016
Kido R., Ueno K., Iwata K. et al. // Ibid. 2015. V. 175. P. 5. https://doi.org/10.1016/j.electacta.2015.01.067
Yoshida K., Tsuchiya M., Tachikawa N. et al. // J. Electrochem. Soc. 2012. V. 159. № 7. P. A1005. https://doi.org/10.1149/2.050207jes
Tachikawa N., Yamauchi K., Takashima E. et al. // Chem. Commun. 2011. V. 47. № 28. P. 8157. https://doi.org/10.1039/c1cc12415c
Tamura T., Yoshida K., Hachida T. et al. // Chem. Lett. 2010. V. 39. № 7. P. 753. https://doi.org/10.1246/cl.2010.753
Black J.J., Dolan A., Harper J.B., and Aldous L. // Phys. Chem. Chem. Phys. 2018. V. 20. P. 16558. https://doi.org/10.1039/C8CP02527D
Yamada Y., Yamada A. // J. Electrochem. Soc. 2015. V. 162. № 14. P. A2406. https://doi.org/10.1149/2.0041514jes
Jeong S.-K., Inaba M., Iriyama Y. et al. // Electrochem. Solid-State Lett. 2003. V. 6. № 1. P. A13. https://doi.org/10.1149/1.1526781
Jeong S.-K., Inaba M., Iriyama Y. et al. // J. Power Sources. 2008. V. 175. № 1. P. 540. https://doi.org/10.1016/j.jpowsour.2007.08.065
Dokko K., Tachikawa N., Yamauchi K. et al. // J. Electrochem. Soc. 2013. V. 160. № 8. P. A1304. https://doi.org/10.1149/2.111308jes
De Vos N., Maton C., Stevens C.V. // ChemElectroChem. 2014. V. 1. № 8. P. 1258. https://doi.org/10.1002/celc.201402086
Yoshida K., Nakamura M., Kazue Y. et al. // J. Am. Chem. Soc. 2011. V. 133. P. 13121. https://doi.org/10.1021/ja203983r
Тулибаева Г.З., Шестаков А.Ф., Волков В.И., Ярмоленко О.В. // Журн. физ. химии. 2018. Т. 92. № 4. С. 625. https://doi.org/10.7868/S0044453718040180
Tretyakov D.O., Prisiazhnyi V.D., Gafurov M.M. et al. // J. Chem. Eng. Data. 2010. V. 55. № 5. P. 1958–1964. https://doi.org/10.1021/je9009249
Гайле А.А., Сомов В.Е., Варшавский О.М., Семенов Л.В. Сульфолан: свойства и применение в качестве селективного растворителя. СПб.: Химиздат, 1998. 144 с.
Колосницын В.С., Шеина Л.В., Мочалов С.Э. // Электрохимия. 2008. Т. 44. № 5. С. 620.
Xuan X., Wang J., Lu J. et al. // Spectrochimica Acta Part A. 2001. V. 57. № 8. P. 1555. https://doi.org/10.1016/s1386-1425(00)00486-8
Tang S., Baker G.A., Zhao H. // Chem. Soc. Rev. 2012. V. 41. № 10. P. 4030. https://doi.org/10.1039/c2cs15362a
Egorova K.S., Gordeev E.G., Ananikov V.P. // Chem. Rev. 2017. V. 117. № 10. P. 7132. https://doi.org/10.1021/acs.chemrev.6b00562
Neale A.R., Murphy S., Goodrich P. et al. // ChemPhysChem. 2017. https://doi.org/10.1002/cphc.201700246
Комплексный термический анализ: учебное пособие / В.И. Альмяшев [и др.] / Под ред. В.В. Гусарова. СПб.: Лема, 2017. 193 с.
Saadatkhah N., Garcia A.C., Ackermann S. et al. // The Can. J. Chem. Eng. 2020. V. 98. P. 34. https://doi.org/10.1002/cjce.23673
Vičar M., Krajíček Z., Pražák D. et al. // Measurement Science and Technology. 2018. V. 29. № 9. P. 095011. https://doi.org/10.1088/1361-6501/aad1e2
Aurbach D. Nonaqueous electrochemistry. New York: Marsel Dekker, Ink., 1999. 602 p.
Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., испр. / Под ред. Р.А. Лидина. М.: Химия, 2000. С. 17.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


