Журнал физической химии, 2022, T. 96, № 10, стр. 1436-1443
Кинетика и механизм окисления ферроценилметанола йодом в отсутствие и в присутствии хлорной кислоты в протонных и апротонных растворителях
В. М. Фомин a, Н. Н. Шуклина a, *
a Национальный исследовательский Нижегородский государственный университет имени Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: niih325@bk.ru
Поступила в редакцию 22.12.2021
После доработки 11.04.2022
Принята к публикации 15.04.2022
- EDN: LNMHLC
- DOI: 10.31857/S0044453722100090
Аннотация
На основании результатов исследования кинетики и механизма окисления ферроценилметанола FcCH2OH йодом в протонных и апротонных растворителях установлено, что способность I2 выступать в роли окислителя в отсутствие и в присутствии сильной кислоты HClO4 и возможность образования катиона ферроцения при протонировании FcCH2OH обусловливают характерные особенности окисления металлокомплекса как в сравнении с его же окислением п-хиноном, проявляющим окислительные свойства только в присутствии кислот, так и в сравнении с окислением йодом ферроцена, не содержащего функциональных групп, способных протонироваться.
Изучению механизмов окисления ферроцена и его производных с различными функциональными группами окислителями различной природы, включая кислород и гидропероксиды [1], орто- и пара-хиноны [2] и I2 [3–6] посвящено значительное число работ. Особенность окисления металлокомплексов (МК) этими окислителями (за исключением I2) – как правило, необходимость участия сильной кислоты в этих процессах для повышения скорости реакции, роль которой сводится к увеличению стандартного редокс-потенциала окислителя. Присутствие кислоты приводит также к протонированию МК с образованием соответствующих катионов ферроцения в результате редокс-изомерии образующихся ферроценилкарбениевых или ацильных ионов [7–11], что на примере ферроценилметанола FcCH2OH можно проиллюстрировать уравнением:
(1)
$\begin{gathered} {\text{FcC}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}} + {{{\text{H}}}^{ + }}\;\overset K \leftrightarrows \;{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \;{\text{Fc}}{{{\text{C}}}^{{\text{ + }}}}{{{\text{H}}}_{2}}\;\xrightarrow{{{{k}_{2}}}}\;{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{C}}}^{ \bullet }}{{{\text{H}}}_{2}} \to \frac{1}{2}{{({\text{F}}{{{\text{c}}}^{{\text{ + }}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{2}}. \\ \end{gathered} $В результате этого происходит наложение процесса протонирования МК на процесс его окисления, которое усложняет как механизм реакции, так и кинетические уравнения, описывающие его, что убедительно показано в работе [12], посвященной окислению FcCH2OH п-хиноном, в которой проанализировано влияние протонирования МК на скорость его окисления. Согласно [12], каждый из этих процессов оказывает влияние на скорость протекания другого, причем степень влияния зависит прежде всего от сольватирующих свойств используемых растворителей –диоксана, ацетонитрила, этанола, ДМФА и др., их способности к прямому взаимодействию с FcC+H2 и соотношения начальных концентраций FcCH2OH и НХ, влияющих в совокупности на выход карбокатиона и его способность к редокс-изомерии, вероятность которых в диоксане оказалась значительно выше, чем во всех остальных указанных растворителях. О влиянии протонирования FcCH2OH на скорость его окисления п-хиноном свидетельствует экстремальный характер зависимости скорости накопления катиона ферроцения ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}}}}$ от концентрации МК в условиях, когда [FcCH2OH]0 ≫ [HClO4]0, которая повторяет экстремальную зависимость ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}} = f({{[{\text{FcC}}{{{\text{H}}}_{2}}{\text{OH}}]}_{0}})$, полученную при протонировании МК в тех же условиях. Причина экстремального характера указанных зависимостей в первом случае – полное израсходование кислоты на протонирование МК по мере роста его концентрации, в результате чего п-хинон теряет свои окислительные свойства, во втором – стабилизация образовавшегося карбокатиона FcC+H2 за счет координации с материнским соединением, учет которой при анализе схемы протонирования FcCH2OH приводит к следующему уравнению для скорости редокс-изомерии карбокатиона ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}}$ [12]:
(2)
$\begin{gathered} {{W}_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}} = \\ = \frac{{{{k}_{2}}K{{{{\text{[}}{{{\text{H}}}^{{\text{ + }}}}{\text{]}}}}_{{\text{0}}}}[{\text{FcC}}{{{\text{H}}}_{2}}{\text{OH]}}{}_{{\text{0}}}}}{{{{{\text{H}}}_{{\text{2}}}}{\text{O}} + K{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\text{OH}}]}}_{0}} + K{{K}_{a}}[{\text{FcC}}{{{\text{H}}}_{2}}{\text{OH}}]_{{_{0}}}^{2}}}, \\ \end{gathered} $Представляло определенный интерес изучить влияние протонирования FcCH2OH на процесс его окисления йодом, который в отличие от п-хинона, способного выступать в роли окислителя только в присутствии сильных кислот (стандартный редокс-потенциал φ0 = 0.72 В [2]), может проявлять свои окислительные свойства как в отсутствие кислоты, так и в ее присутствии. Это убедительно было показано при изучении процесса окисления ферроцена в различных растворителях, скорость реакции в которых увеличивалась по мере роста их диэлектрической проницаемости, а именно в ряду: Diox < EtOH < MeCN, причем ускорение процесса под действием HClO4 рассматривается как специфический кислотный катализ (вопрос о влиянии кислоты на редокс-потенциал I2 пока остается открытым), что иллюстрируется схемой [6]:
Схема 1
Здесь Н+=НХ. В этаноле и ацетонитриле кислоты HClO4 и HI полностью диссоциированы, а в диоксане находятся в виде сольватно-разделенной ионной пары [13]. В соответствии со схемой 1 и данными [6], основной продукт реакции ферроцена с I2 при избытке последнего – трийодид ферроцения. При окислении алкильных производных ферроцена состав аниона в образующемся продукте реакции не меняется. Если же заместитель в ферроцене является сильным акцептором электронов, как в ацетилферроцене, продукт реакции – пентайодид ферроцения [14]. Речь идет о твердом продукте, однако не факт, что в растворе состав аниона ${\text{I}}_{5}^{ - }$ остается неизменным, поскольку велика вероятность его диссоциации с образованием ${\text{I}}_{3}^{ - }$, вследствие того, что энергия связи первой молекулы I2 с I– существенно выше, чем второй [15]. Приведенная схема может быть распространена и на окисление ферроценилметанола, в котором заместитель по своей электронно-донорной способности практически не отличается от атома водорода. Для сравнения отметим, что продукт окисления FcCH2OH п-хиноном в присутствии хлорной кислоты – соль ферроцения Fc+CH2OH⋅${\text{Cl}}{{{\text{O}}}^{{4 - }}}$, продукт восстановления п-хинона в этих условиях – гидрохинон [2, 12]. Совершенно очевидно, что механизм окисления FcCH2OH йодом в присутствии кислоты должен учитывать не только аналогичные стадии приведенной схемы, но и образование катиона ферроцения в результате протонирования МК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электронные спектры поглощения реакционных смесей снимали в области 200–1100 нм в атмосфере аргона на спектрометре ShimadzuUV-1800 с использованием кварцевых кювет 10 мм. Работу проводили в спектральном режиме, который предполагал сканирование по длине волны с последующей обработкой спектра.
Для проведения опытов готовили концентрированные растворы реагентов в ампулах, заполненных аргоном, после чего раствор ферроценилметанола переносили в кювету и разбавляли тем же растворителем до нужной концентрации. Далее снимали фоновый спектр. После этого в кювету вводили капилляр, через который раствор продували аргоном в течение 3 мин. Не прерывая барботажа, в кювету вводили необходимое количество либо раствора йода, либо смеси I2 с HClO4, капилляр вынимали, кювету изолировали от воздуха, и этот момент времени принимали за начало реакции. Время появления максимума на полосе поглощения катиона ферроцения после смешения реагентов принимали за время реакции (8–10 с) – первая точка на кинетической кривой в координатах А–t(c), для построения которой с интервалом в 15–20 с снимали следующие спектры раствора в течение 3 мин. Далее по кинетической кривой рассчитывали начальную скорость реакции для конкретных концентраций реагентов. Примеры кинетических кривых приведены при обсуждении результатов исследований.
Необходимо отметить, что при окислении FcСН2ОН йодом в присутствии кислоты фиксируется суммарная полоса поглощения катионов ферроцения Fc+СН2ОН и (Fc+СН2)2 поскольку они имеют полосы поглощения с близким значением λmax = 626–628 нм.
Использованные растворители квалификаци “х.ч.” и “ч.д.а.” дополнительной очистке не подвергали. Ферроценилметанол был предоставлен ООО “СИНОР”, за что авторы выражают свою благодарность его научному руководителю А.Н. Татарникову.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как и следовало ожидать, кинетические закономерности окисления FcCH2OH йодом в отсутствие кислоты аналогичны установленным для окисления ферроцена, т.е. наблюдается первый порядок процесса по концентрациям обоих реагентов при их малых значениях (рис. 1) и увеличение скорости реакции в том же ряду растворителей, что и при окислении ферроцена. Стремление скорости реакции к максимальному значению ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{\text{max}}}}}$ при больших концентрациях реагентов (FcCH2OH) свидетельствует о протекании реакции через стадию образования молекулярного комплекса FcCH2OHI2 по аналогии с комплексом Fc⋅I2 в схеме 1 . Отметим, что наличие заместителя в МК и его способность к специфическому взаимодействию с растворителями обусловливают более низкую скорость реакции с I2 по сравнению с ферроценом за счет влияния электронного и стерического факторов заместителя.
Рис. 1.
Влияние концентрации FcCH2OH (1) и I2 (2) на скорость окисления МК в ацетонитриле; $С_{{{{{\text{I}}}_{2}}}}^{0}\left( 1 \right) = 0.001{\text{\;М}}$, $С_{{{\text{МК}}}}^{0}\left( 2 \right) = 0.002{\text{\;М}},{\text{\;}}$Т = 23°С.

В присутствии кислоты картина процесса существенно меняется, на что указывает прежде всего прямо противоположное влияние природы растворителя на скорость реакции, которая характеризуется рядом: Diox > EtOH > MeCN, что следует из сравнения интенсивностей полос поглощения катиона ферроцения и кинетических кривых его накопления в этих растворителях (рис. 2).
Рис. 2.
Электронные спектры и кинетические кривые образования катиона ферроцения при окислении FcCH2OH йодом в отсутствие HClO4 (а) и в ее присутствии (б) в диоксане (1), этаноле (2) и ацетонитриле (3); $С_{{{\text{МК}}}}^{0} = 0.002{\text{\;М}}$, $С_{{{{{\text{I}}}_{2}}}}^{0} = 0.004{\text{\;М}}$, $С_{{{\text{HCl}}{{{\text{O}}}_{4}}}}^{0}$ = 0.1 M.
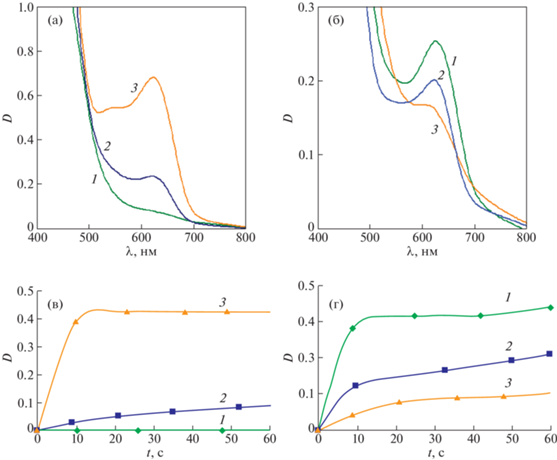
Причина такой инверсии обусловлена тем, что в диоксане начинает доминировать процесс образования катиона ферроцения за счет протонирования FcCH2OH, в то время как в этаноле этот процесс не играет существенной роли, и образование катиона ферроцения происходит в результате реакции МК с I2, протекающей с меньшей скоростью, чем процесс его протонирования в диоксане. В ацетонитриле выход карбокатиона FcC+H2 при протонировании FcCH2OH не меньше, чем в диоксане [9], однако он не склонен к редокс-изомерии вследствие неспецифической сольватации [10]. Но его образование приводит к снижению текущей концентрации МК и, как следствие, к падению скорости реакции с I2 (рис. 3). В пользу этого свидетельствуют и приведенные на рис. 3 зависимости скорости образования катиона ферроцения ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}}$, при взаимодействии FcCH2OH с I2 от концентрации последнего в присутствии HClO4 в ацетонитриле и диоксане. В первом из этих растворителей, несмотря на его высокую диэлектрическую проницаемость (ε = = 36.5) значение ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}}$ существенно ниже, чем во втором (ε = 2), причем зависимость ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}} = $ $ = f({{[{{{\text{I}}}_{2}}]}_{0}})$ в ацетонитриле выходит из начала координат, а в диоксане – из некоторой точки на координате скоростей, которая характеризует скорость редокс-изомерии катиона FcC+H2 в условиях проведения реакции, иллюстрируя тем самым, наряду с приведенными выше данными, влияние процесса протонирования МК на скорость его окисления йодом.
Рис. 3.
Влияние концентрации I2 на скорость окисления FcCH2OH в присутствии HClO4 в диоксане (1) и ацетонитриле (2); $С_{{{\text{МК}}}}^{0}(1) = 0.01{\text{\;М}}$, $С_{{{\text{МК}}}}^{0}(2) = 0.002{\text{\;М}}$, $С_{{{\text{HCl}}{{{\text{O}}}_{4}}}}^{0}(1,2) = 0.1{\text{\;М}}$.

Зависимость начальной скорости реакции от концентрации кислоты в указанных растворителях, приведенная на рис. 4, указывает на то, что при небольших значениях последней, она описывается уравнением:
(3)
${{W}_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}} = W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}}}^{{}} + {{k}_{{{\text{эфф}}}}}{{[{\text{FcC}}{{{\text{H}}}_{2}}{\text{OH}}]}_{{\text{0}}}}{{[{{{\text{I}}}_{{\text{2}}}}]}_{{\text{0}}}}{{[{{{\text{H}}}^{{\text{ + }}}}]}_{{\text{0}}}},$(4)
$W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}^{{}} = W_{{{\text{F}}{{{\text{c}}}^{ + }}}}^{{}} + a{{[{{{\text{H}}}^{{\text{ + }}}}]}_{{\text{0}}}}.$Рис. 4.
Влияние концентрации HClO4 на скорость окисления FcCH2OH йодом в диоксане (1), этаноле (2) и ацетонитриле (3); $С_{{{\text{МК}}}}^{0} = 0.002{\text{\;М}},{\text{\;}}С_{{{{{\text{I}}}_{2}}}}^{0} = 0.004{\text{\;М}}.$

При больших концентрациях кислоты скорость реакции в этаноле стремится к предельному значению ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}} = {{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}{\text{max}}}}}$, что указывает на протекание реакции через стадию образования комплекса FcCH2OHI2Н+.
Как уже отмечалось выше, влияние процесса протонирования FcCH2OH на его окисление п-хиноном наиболее наглядно проявляется в экстремальном характере зависимости ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}} = $ $ = f({{[{\text{МК}}]}_{0}})$, полученной в диоксане в условиях, когда [MK]0 ≫ [HX]0 (рис. 5, кривая 1 [12]). В этой связи логично исследовать, как процесс протонирования МК влияет на его окисление йодом в тех же условиях. Полученный результат (рис. 5, кривая 2) свидетельствует о том, что зависимость ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}} = f({{[{\text{МК}}]}_{0}})$, при использовании I2 в качестве окислителя не является экстремальной, обнаруживая четкую тенденцию к увеличению скорости накопления катиона ферроцения с ростом концентрации МК. Наблюдаемое различие в характере приведенных зависимостей обусловлено различием в свойствах используемых окислителей – при избытке концентрации МК по сравнению с концентрацией кислоты последняя полностью расходуется на его протонирование до карбокатиона, в результате чего п-хинон теряет свои окислительные свойства, в то время как I2 способен окислять МК и в отсутствие НХ. Образовавшийся при протонировании МК карбокатион FcC+H2 в этих условиях не способен к редокс-изомерии [12] вследствие его стабилизации за счет координации с материнским соединением.
Рис. 5.
Зависимости скорости накопления катиона ферроцения от концентрации ферроценилметанола при его окислении п-хиноном (1) и йодом (2, 3) в диоксане; $~~С_{{{\text{HCl}}{{{\text{O}}}_{4}}}}^{0}(1,2) = 0.001{\text{\;М}}$, $~С_{{{\text{HCl}}{{{\text{O}}}_{4}}}}^{0}(3) = 0.1{\text{\;М}}$, $~С_{{{\text{ПХ}}}}^{0} = 0.005{\text{\;М}}$, $~С_{{{{{\text{I}}}_{2}}}}^{0} = 0.004{\text{\;М}}$.
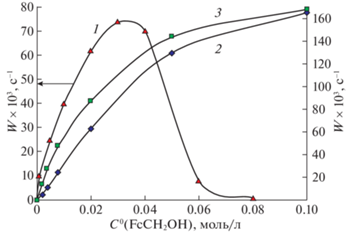
При избытке кислоты по сравнению с МК, последний протонируется с образованием карбокатиона FcC+H2, который в диоксане изомеризуется в катион ферроцения. Однако образование аниона ${{{\text{I}}}^{ - }}$ при окислении FcCH2OH йодом (чему способствуют высокие концентрации МК и НХ) приводит к нейтрализации FcC+H2, что снижает выход катиона ферроцения при его редокс-изомерии и, как следствие, уменьшает вклад процесса протонирования МК в общую скорость накопления катиона ферроцения ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}}$. Зависимость ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}} = f({{[{\text{МК}}]}_{0}})$, полученная в этих условиях (рис. 5, кривая 3), характеризуется закономерной тенденцией к увеличению скорости накопления катиона ферроцения с ростом концентрации МК, как и зависимость (2), и близким с ней значением этой скорости при больших концентрациях FcCH2OH за счет равенства концентраций I2, которые при избытке МК и определяют эти значения. В указанных условиях продуктом окисления МК скорее всего является не трийодид ферроцения, а его йодид, что подробно обсуждалось в работе [6]. При небольших концентрациях FcCH2OH скорость реакции ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}}$ (3), заметно выше скорости ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}}$ (2).
На основании приведенных выше результатов исследований и установленных ранее механизмов окисления ферроцена йодом и протонирования FcCH2OH можно предложить следующую схему окисления данного МК йодом в кислой среде (безотносительно природы используемого растворителя, что позволяет сделать ее кинетический анализ более полным):
Cхема 2
Здесь Н+=НХ. Схема 2 справедлива при любом соотношении начальных концентраций НХ и МК. Принимается, что конечным продуктом окисления FcCH2OH йодом при его избытке относительно МК является трийодид ферроцения, как и при окислении ферроцена.
В соответствии со схемой 2 , образование катиона ферроцения происходит в результате протонирования FcCH2OH и его окисления йодом, общая скорость которого ${{W}_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}}$ равна
(5)
$ = {{k}_{6}}[{\text{Fc}}\mathop {\text{C}}\limits^{\text{ + }} {\kern 1pt} {{{\text{H}}}_{2}}{\text{]}} + {{k}_{4}}{{K}_{1}}[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH][{{{\text{I}}}_{2}}{\text{]}} + $Вариант 1
(6)
${{{\text{[}}{{{\text{H}}}^{{\text{ + }}}}{\text{]}}}_{{\text{0}}}} = {\text{[}}{{{\text{H}}}^{{\text{ + }}}}{\text{]}} + [{\text{Fc}}\mathop {\text{C}}\limits^{\text{ + }} {\kern 1pt} {{{\text{H}}}_{2}}] + [{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH\, \cdot \,{{{\text{I}}}_{2}}\, \cdot \,{{{\text{H}}}^{{\text{ + }}}}] = $(7)
$ - \;{{k}_{{ - 3}}}[{\text{Fc}}\mathop {\text{C}}\limits^{\text{ + }} {\kern 1pt} {{{\text{H}}}_{2}}][{{{\text{H}}}_{2}}{\kern 1pt} O] - {{k}_{6}}[{\text{Fc}}\mathop {\text{C}}\limits^{\text{ + }} {\kern 1pt} {{{\text{H}}}_{2}}{\text{]}} - $(8)
$[{\text{Fc}}\mathop {\text{C}}\limits^{\text{ + }} {\kern 1pt} {{{\text{H}}}_{2}}] = \frac{{{{k}_{3}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{\text{[}}{{{\text{H}}}^{{\text{ + }}}}{\text{]}}}}{{{{k}_{{ - 3}}}[{{{\text{H}}}_{2}}{\kern 1pt} O] + {{k}_{6}} + {{k}_{8}}[{{{\text{I}}}^{ - }}]}}.$(9)
$[{{{\text{H}}}^{{\text{ + }}}}] = \frac{{{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}}}{{1 + {{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{I}}}_{{\text{2}}}}{\text{]}}}}_{{\text{0}}}} + \frac{{{{k}_{3}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}}}{{{{k}_{{ - 3}}}[{{{\text{H}}}_{2}}{\kern 1pt} O] + {{k}_{6}} + {{k}_{8}}[{{{\text{I}}}^{ - }}]}}}}.$(10)
$ = \frac{{{{k}_{6}}{{k}_{3}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}}}{{({{k}_{{ - 3}}}[{{{\text{H}}}_{2}}{\kern 1pt} O] + {{k}_{6}} + {{k}_{8}}[{{{\text{I}}}^{ - }}])}} \times $(11)
$\begin{gathered} W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}^{{\text{2}}} = {{k}_{4}}{{K}_{1}}[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH][{{{\text{I}}}_{2}}{\text{]}} + \\ + \;{{k}_{5}}{{K}_{1}}{{K}_{2}}[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH][{{{\text{I}}}_{2}}{\text{][}}{{{\text{H}}}^{{\text{ + }}}}{\text{]}} + {{k}_{7}}[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH][{{{\text{I}}}^{ \bullet }}] = \\ = {\text{2}}{{k}_{4}}{{K}_{1}}{{[{\text{FcC}}{{{\text{H}}}_{2}}OH]}_{0}}{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}_{0}}{\text{ + }} \\ {\text{ + }}\;\frac{{2{{k}_{5}}{{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}}_{0}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}}}{{1\, + \,{{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{I}}}_{{\text{2}}}}{\text{]}}}}_{{\text{0}}}}\, + \,\frac{{{{k}_{3}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}}}{{{{k}_{{ - 3}}}[{{{\text{H}}}_{2}}{\kern 1pt} O] + {{k}_{6}} + {{k}_{8}}[{{{\text{I}}}^{ - }}]}}}}. \\ \end{gathered} $Коэффициент “2” в уравнении (11) появляется за счет учета реакции FcCH2OH с атомом йода (схема 2 , реакция 7), концентрация которого принималась стационарной. Уравнения (10) и (11) свидетельствуют о том, что каждый из процессов протонирования и окисления МК оказывает существенное влияние на скорость протекания другого, что обусловлено их конкуренцией за кислоту при ее недостатке, притом, что I2 способен окислять FcCH2OH и без участия кислоты, хотя и с меньшей скоростью, и это служит подтверждением приведенных выше экспериментальных данных.
Общая скорость накопления катиона ферроцения будет равна
(12)
$ \times \;\frac{1}{{1 + {{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{I}}}_{{\text{2}}}}{\text{]}}}}_{{\text{0}}}} + \frac{{{{k}_{3}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}}}{{{{k}_{{ - 3}}}[{{{\text{H}}}_{2}}{\kern 1pt} O] + {{k}_{6}} + {{k}_{8}}{\text{[}}{{{\text{I}}}^{ - }}{\text{]}}}}}} + $(13)
$\begin{gathered} W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}^{{}} = \frac{{{{k}_{6}}{{k}_{3}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}}}{{({{k}_{{ - 3}}}[{{{\text{H}}}_{2}}{\kern 1pt} O] + {{k}_{6}} + {{k}_{8}}[{{{\text{I}}}^{ - }}])}}{\text{ + }} \\ + \;2{{k}_{5}}{{K}_{1}}{{K}_{2}}{{\left[ {{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH} \right]}_{0}}{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}_{0}}{{[{{{\text{H}}}^{{\text{ + }}}}]}_{0}}, \\ \end{gathered} $(14)
$W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}^{{}} = {\text{2}}{{k}_{4}}{{K}_{1}}{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}_{0}}{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}_{0}}$В этаноле и ацетонитриле $W_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}^{1} = 0$ и $~W_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}^{{}} = $ $~ = W_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}^{2},$ при этом в ацетонитриле скорость реакции будет описываться, как и в диоксане, уравнением (14), в этаноле – следующим уравнением:
(15)
$\begin{gathered} W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{ + }}}}^{{}} = {\text{2}}{{k}_{4}}{{K}_{1}}{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}_{0}}{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}_{0}} + \\ + \;\frac{{2{{k}_{5}}{{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}}_{0}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}}}{{1 + {{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{I}}}_{{\text{2}}}}{\text{]}}}}_{{\text{0}}}}}}. \\ \end{gathered} $Вариант 2
Для расчета скорости суммарного процесса используется то же самое уравнение (5). Выражения для стационарных концентраций FcC+H2 и ${{{\text{I}}}^{ \bullet }}$ остаются также неизменными. Текущая концентрация I2 находится из выражения:
(16)
$\begin{gathered} {{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}_{{\text{0}}}} = {\text{[}}{{{\text{I}}}_{2}}{\text{]}} + K{{K}_{1}} + K{{K}_{2}} + {\text{I}}_{3}^{ - } = \\ = {\text{[}}{{{\text{I}}}_{2}}{\text{]}} + {{K}_{1}}{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}_{0}}[{{{\text{I}}}_{2}}] + \\ + \;{{K}_{1}}{{K}_{2}}{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}_{0}}[{{{\text{I}}}_{2}}{\text{][}}{{{\text{H}}}^{{\text{ + }}}}{{{\text{]}}}_{0}} + {{K}_{9}}{\text{[}}{{{\text{I}}}_{2}}{\text{][}}{{{\text{I}}}^{ - }}{\text{],}} \\ \end{gathered} $(17)
${\text{[}}{{{\text{I}}}_{2}}{\text{]}} = \frac{{{{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}}_{{\text{0}}}}}}{{1 + {{K}_{1}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}} + {{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{H}}}^{{\text{ + }}}}]}}_{0}} + {{K}_{9}}{\text{[}}{{{\text{I}}}^{ - }}{\text{]}}}},$(18)
$W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}^{1} = \frac{{{{k}_{6}}{{k}_{3}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}}}{{{{k}_{{ - 3}}}[{{{\text{H}}}_{2}}{\kern 1pt} O] + {{k}_{6}} + {{k}_{8}}[{{{\text{I}}}^{ - }}]}},$(19)
$W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{ + }}}}^{2} = \frac{{{\text{2}}({{k}_{4}}{{K}_{1}} + {{k}_{5}}{{K}_{1}}{{K}_{2}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}){{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}}_{0}}}}{{1 + {{K}_{1}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}} + {{K}_{1}}{{K}_{2}}{{{[{\text{FcC}}{{{\text{H}}}_{2}}{\kern 1pt} OH]}}_{0}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}} + {{K}_{9}}[{{{\text{I}}}^{ - }}]}}.$Полученные уравнения показывают, что при достаточно больших концентрациях кислоты процессы окисления и протонирования МК протекают независимо друг от друга, если сравнивать эти уравнения с уравнениями (10) и (11), полученными в условиях, когда [MK]0 ≫ [HX]0.
В этаноле и ацетонитриле $W_{{{\text{F}}{{{\text{c}}}^{ + }}{{{\text{H}}}^{ + }}}}^{1} = 0$. Уравнение (19) справедливо для всех используемых растворителей. Логично, что аналогичное уравнение описывает скорость окисления ферроцена йодом в идентичных условиях. При больших концентрациях кислоты уравнение (19) преобразуется в уравнение:
(20)
$W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}^{{{\text{2}}{\text{.1}}}} = 2{{k}_{5}}{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}_{0}} = W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}{\text{max}}}}^{{{\text{2}}{\text{.1}}}}.$(21)
$W_{{{\text{F}}{{{\text{c}}}^{{\text{ + }}}}{{{\text{H}}}^{{\text{ + }}}}}}^{{{\text{2}}{\text{.2}}}} = \frac{{{\text{2}}({{k}_{4}} + {{k}_{5}}{{K}_{2}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}){{{{\text{[}}{{{\text{I}}}_{2}}{\text{]}}}}_{0}}}}{{1 + {{K}_{2}}{{{[{{{\text{H}}}^{{\text{ + }}}}]}}_{0}}}},$В заключение подчеркнем, что полученные данные свидетельствуют о характерных особенностях окисления FcCH2OH йодом как в сравнении с окислением ферроцена этим же окислителем, так и в сравнении с его окислением п-хиноном, способным проявлять свойства окислителя только в присутствии сильных кислот. Этот вывод можно распространить и на окисление ферроцена с другими функциональными группами, протонирование которых также приводит к образованию ферроценилкарбениевых ионов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Fomin V., Shirokov A., Kochetkova K. Oxidation of Derivants of Ferrocene by Molecular Oxygen and Peroxides. LAP LAMBERT Academic Publlishing RU, 2017. 361 p.
Фомин В.М., Галкина М.С., Ключевский К.В. и др. // Журн. общ. химии. 2018. Т. 88. Вып. 10. С. 1644 https://doi.org/10.1134/S0044460X18100104
Савицкий А.В., Сыркин Я.К. // Докл. АН СССР. 1958. Т. 120. № 1. С. 119.
Salman H.M.A., Mahmoud M.R., Abou-El-Wafa M.H.M. // Inorg. Chem. Comm. 2004. № 7. P. 1209. https://doi.org/10.1016/j.inoche.2004.07.023
Logan S.R., Welsh M.R. // Z. Phys. Chem. 1986. V. 148. № 2. P. 215. https://doi.org/10.1524/zpch.1986.148.2.215
Фомин В.М., Маркин А.В., Шуклина Н.Н. // Журн. физ. химии. 2022. Т. 96. № 1. С. 1. https://doi.org/10.31857/S0044453722010095
Rinehart K.L.Jr., Michejda C.J., Kittle P.A. // J. Am. Chem. Soc. 1959. V. 81. P. 3162. https://doi.org/10.1021/ja01521a082
Методы элементоорганической химии. Железоорганические соединения / Под ред. А.Н. Несмеянова, К.А. Кочеткова. М.: Наука, 1983. 544 с.
Фомин В.М., Широков А.Е. // Журн. общ. химии. 2009. Т. 89. Вып. 5. С. 1782; https://doi.org/10.1134/S1070363209050119
Фомин В.М., Кочеткова К.С., Ключевский К.В. // Там же 2018. Т. 88. Вып. 5. С. 805.
Фомин В.М., Шуклина Н.Н., Климова М.Н. // Журн. физ. химии. 2020. Т. 94. № 9. С. 1. https://doi.org/10.31857/S0044453720090071
Фомин В.М., Шуклина Н.Н. // Журн. общ. химии. 2021. Т. 91. № 7. С. 1078. https://doi.org/10.31857/S0044460X2107012X
Белл Р. Протон в химии. М.: Мир, 1977. С. 61.
Несмеянов А.Н., Кочеткова Н.С., Материкова Р.Б., Палицын Н.П. и др.// Журн. орган. химии. 1973. Т. 9. С. 378.
Check C.E., Faust T.O., Baily Y.M. // J. Phys. Chem. A. 2001. V. 105. № 34. P. 8111 (DOI: ) (all data).https://doi.org/10.1021/jp0119451
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


