Журнал физической химии, 2022, T. 96, № 8, стр. 1144-1149
Металл-органический каркас на основе γ-циклодекстрина как система доставки нифлумовой кислоты
Е. С. Делягина a, b, М. А. Агафонов a, А. А. Гарибян a, И. В. Терехова a, *
a Институт химии растворов им. Г.А. Крестова РАН
Иваново, Россия
b Ивановский государственный университет
Иваново, Россия
* E-mail: ivt@isc-ras.ru
Поступила в редакцию 30.12.2021
После доработки 24.01.2022
Принята к публикации 25.01.2022
- EDN: BWCHPU
- DOI: 10.31857/S0044453722080088
Аннотация
Металл-органический каркас, полученный на основе γ-циклодекстрина и катионов К+ методом диффузии паров антирастворителя, предложен как система доставки нифлумовой кислоты – нестероидного противовоспалительного соединения, имеющего ограниченную растворимость в водной среде. Рассмотрены способы загрузки нифлумовой кислоты в каркас, полученные композиты охарактеризованы с привлечением методов РФА, низкотемпературной сорбции/десорбции азота и ИК-спектроскопии. Рассмотрено влияние инкапсулирования в металл-органический каркас на кинетику высвобождения нифлумовой кислоты и ее мембранную проницаемость.
Металл-органические каркасы (MOFs) – кристаллические структуры, состоящие из органических лигандов, координированных ионами металлов [1], и представляющие собой большой класс перспективных гибридных материалов, которые имеют различные области применения [2]. В настоящее время получено множество различных металл-органических каркасов, но только некоторые из них могут быть использованы в качестве систем доставки лекарств. Для данного применения MOF должны обладать рядом свойств, таких как биосовместимость, высокая удельная поверхность и стабильность [3–5].
К числу таких соединений относятся металл-органические каркасы на основе циклических олигосахаридов природного происхождения – циклодекстринов (CD) [6–8]. Циклодекстрины, образующиеся путем ферментативного расщепления крахмала, состоят из остатков D-глюкопиранозы, связанных α(l–4)-гликозидной связью таким образом, что молекула напоминает форму полого усеченного конуса. Циклодекстрины полностью биосовместимы и могут быть использованы в качестве систем доставки лекарств [9, 10]. Полученные относительно недавно металл-органические каркасы на основе циклодекстринов (CD-MOF) обладают развитой удельной поверхностью, которая определяется наличием пор разного диаметра, благодаря чему они способны не только адсорбировать молекулы лекарственных соединений, но и влиять на их физико-химические свойства [11–14]. Например, известно включение в CD-MOF нестероидных противовоспалительных средств (НПВС) – лекарственных препаратов, которые обладают обезболивающим, жаропонижающим и противовоспалительным действием и широко используются в лечении самых разных заболеваний. НПВС плохо растворяются в водных средах и занимают одно из ведущих мест по количеству и тяжести побочных эффектов. В связи с этим, поиск эффективных систем доставки НПВС является одной из актуальных задач, для решения которой могут быть предложены CD-MOF. Как известно из литературы, в CD-MOF могут быть загружены ибупрофен [15, 16], фенбуфен [17], диклофенак [18]. На примере ибупрофена показано, что молекулы лекарства сначала заполняют узкие цилиндрические поры (0.78 нм) каркаса, а затем поры большого размера (1.7 нм) [15]. В работе [16] отмечено “взрывное” высвобождение ибупрофена, загруженного в γCD-MOF, а именно 70% лекарства высвобождается за 30 мин.
Нифлумовая кислота (NIF), относящаяся к группе НПВС, применяется для снятия боли при ревматоидном артрите, а также в лечении многих других воспалительных заболеваний. Она плохо растворима в водной среде (10–5–10–4 М [19]), что побуждает к поиску эффективных солюбилизаторов и носителей. В литературе в качестве систем доставки NIF применяются коллагеновые матриксы [20], наноэмульсии на основе твинов [21], микросферы с содержанием полиэтиленгликолей [22]. CD-MOF могут быть альтернативными биосовместимыми носителями. В связи с этим, цель данной работы заключалась в изучении процесса иммобилизаци нифлумовой кислоты в металл-органический каркас на основе γ-циклодекстрина (γCD-MOF) и последующем выявлении влияния γCD-MOF на фармакологически значимые свойства этого лекарственного соединения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
γCD-MOF был получен методом диффузии паров антирастворителя. Водный раствор γ-циклодекстрина и КОН, взятых в мольном соотношении 1:8, был помещен в кристаллизатор, заполненный антирастворителем (алифатическим спиртом), в котором циклодекстрин не растворяется [6]. Выпавший в осадок γCD-MOF промывался спиртом и активировался вакуумной сушкой (80°С, 24 ч). γCD-MOF был загружен нифлумовой кислотой методами сорбции из раствора (γCD-MOF/NIF-1) и соосаждения (γCD-MOF/NIF-2). Определенное спектроскопическим методом (Shimadzu UV-1800) содержание лекарственного соединения в полученных композитах γCD-MOF/NIF-1 и γCD-MOF/NIF-2 составило 1.4 мас. %, и 3.3 мас. % соответственно.
Изучение адсорбции NIF на γCD-MOF проводилось в среде этанола при 25°С. Количество адсорбированной нифлумовой кислоты (Qe) рассчитывали по формуле:
где С0 – начальная концентрация раствора NIF (мг/мл); Сe – концентрация NIF в момент равновесия (мг/мл); V – объем раствора NIF (мл); gγCD-MOF – количество γCD-MOF (г).Исследование методом рентгенофазового анализа проводилось на дифрактометре D8 Advance фирмы Bruker AXS с использованием медного излучателя (CuKα, λ = 1.5418 Å, напряжение 40 кВ, сила тока 40 мА). Изотермы адсорбции-десорбции азота были получены на автоматическом анализаторе удельной поверхности и размера пор Quantachrome (NOVA Series 1200e). ИК-спектры регистрировались на ИК-фурье-спектрометре VERTEX 80v (Bruker).
Высвобождение NIF, находящейся в чистом виде, в составе композита γCD-MOF/NIF и физической смеси с γ-циклодекстрином, было исследовано при 37°С с применением стандартизированного фармакопейного тестера растворения Labindia по известной методике “вращающаяся корзинка” (USP1) [23]. Профили высвобождения представляют собой зависимости ω = f(t), где ω – количество NIF, перешедшее в среду растворения (мас. %); t – время (мин). Концентрация NIF определялась спектрофотометрически (Shimadzu UV-1800).
Исследование мембранной проницаемости NIF проводилось с помощью диффузионной ячейки Франца в фосфатном буферном растворе (рН 7.4) при 37°С. В донорную камеру загружался раствор NIF или композита γCD-MOF/NIF, в акцепторную – буферный раствор. Между двумя камерами помещалась целлюлозная мембрана (MWCO 12 кДа). Отбор проб проводился из акцепторной камеры с временным интервалом 30 мин, причем отобранный объем пробы компенсировался чистым буферным раствором. Концентрация NIF в акцепторной камере определялась спектрофотометрически (Shimadzu UV‑1800). На основе полученных результатов строились зависимости количества NIF, перешедшего через мембрану, от времени, тангенс угла наклона которых представляет собой коэффициент массопереноса (J).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нифлумовая кислота была загружена в γCD‑MOF методами сорбции из спиртового раствора и соосаждения. Полученные композиты γCD-MOF/NIF-1 и γCD-MOF/NIF-2 были охарактеризованы с привлечением различных методов физико-химического анализа. На рис. 1 представлены дифрактограммы γCD-MOF, γCD‑MOF/NIF-1 и γCD-MOF/NIF-2. Как видно, основные рефлексы γCD-MOF сохраняются на дифрактограммах обоих композитов, при этом отсутствуют рефлексы NIF, наиболее выраженные при 21.5° и 26° [24]. Данные РФА свидетельствуют о том, что NIF в составе γCD-MOF/NIF не образует отдельной фазы и не вызывает изменений в кристаллической структуре носителя.
Исходный γCD-MOF имеет развитую удельную поверхность, значение которой по методу БЭТ составило 872 м2/г. Включение NIF в γCD-MOF приводит к понижению удельной поверхности до 751 м2/г (для γCD-MOF/NIF-1) и 192 м2/г (для γCD-MOF/NIF-2), что коррелирует с содержанием лекарственного соединения в композитах. Как было определено в работе [6], γCD-MOF имеет поры разного диаметра – малые (0.78 нм) и большие (1.7 нм). Размеры молекулы NIF (1.0 × 0.69 нм), приближенно рассчитанные в программе Gaussian 09, соответствуют размерам пор каркаса, т.е. лекарственное соединение может включаться в них. Однако удельная поверхность обоих композитов не уменьшается до нуля, что указывает на существование вакантных пор, не занятых NIF (рис. 2). Предположительно, при загрузке соосаждением NIF способна занимать внутренние поры γCD-MOF, что сказывается на существенном различии в удельной поверхности образцов, загруженных разными способами.
Для более детального изучения адсорбции NIF на γCD-MOF была получена изотерма адсорбции (рис. 3), представляющая зависимость между количеством адсорбированных частиц на единицу массы адсорбента и равновесной концентрацией адсорбата в растворе. Для выявления механизма адсорбции NIF на γCD-MOF, изотерма адсорбции была описана с помощью математических моделей Ленгмюра, Фрейндлиха и Темкина. Исходя из полученных расчетов, сорбция NIF на γCD-MOF лучше описывается моделью Фрейндлиха (R2 > 0.98), которая предполагает многослойную адсорбцию на неоднородных поверхностях. По мере увеличения концентрации адсорбата его содержание на поверхности адсорбента также увеличивается и, соответственно, энергия сорбции экспоненциально уменьшается [25].
Рис. 3.
Изотерма адсорбции NIF на γCD-MOF в среде этанола при 25°С (а) и зависимость, построенная по модели Дубинина–Радушкевича (б).

Для установления природы адсорбции использовалась модель Дубинина–Радушкевича [26]:
где KDR– постоянная изотермы Дубинина–Радушкевича (моль2/Дж2); ε – потенциал Поляни (Дж/моль), который можно рассчитать по уравнению: где R – газовая постоянная; Т – температура; ce – равновесная концентрация NIF. Зависимость $\ln {{Q}_{e}}$ от ε2 показана на рис. 3.Свободная энергия сорбции NIF на γCD-MOF может быть рассчитана из соотношения:
Свободная энергия адсорбции E обычно используется для выявления типа адсорбции: для химической адсорбции E = 8–16 кДж/моль, для физической адсорбции E < 8 кДж/моль [27]. Полученная энергия адсорбции составила 4.4 кДж/моль, что позволяет предположить, что поглощение NIF на γCD-MOF является физической сорбцией.Для изучения взаимодействий между NIF и γCD-MOF были сняты ИК-спектры рассматриваемых образцов (рис. 4). ИК-спектры композитов γCD-MOF/NIF-1 и γCD-MOF/NIF-2 демонстрируют сохранение всех полос, характерных для исходных γCD-MOF и NIF. Кроме того, ИК-спектры композитов и физической смеси совпадают. Полученные результаты указывают на физическую адсорбцию NIF на γCD-MOF, т.е. удерживание NIF в γCD-MOF происходит за счет вандерваальсовых взаимодействий.
Интересно было проследить влияние γCD-MOF на фармакологически значимые свойства NIF. С этой целью процессы растворения NIF и композита γCD-MOF/NIF-2 (как наиболее эффективно загруженного) были изучены на тестере растворимости. Для сравнения была рассмотрена физическая смесь NIF с γ-циклодекстрином (γ-CD + NIF). В качестве сред растворения были использованы буферные растворы, моделирующие среду желудка (рН 1.6) и кишечника (рН 6.8) и позволяющие максимально приблизить результаты исследований in vitro к прогнозируемому поведению препаратов in vivo. Профили высвобождения изображены на рис. 5.
Как видно из рис. 5, в солянокислом буфере (рН 1.6) в течение 1 ч высвобождается 14% чистой NIF, а в течение 6 часов – 40%. В фосфатном буферном растворе (рН 6.8) растворимость NIF несколько выше, и в течение 1 часа высвобождается 40% кислоты, тогда как полное высвобождение было достигнуто за 8 ч. Полученные результаты свидетельствуют о том, что скорость высвобождения NIF зависит от кислотности среды. Указанный процесс медленнее протекает в кислой среде. Возможно, это связано с разным ионным состоянием NIF в зависимости от рН среды. При значениях рН, соответствующих кислотности желудка, преобладает катионная форма нифлумовой кислоты, тогда как анионная форма присутствует при рН > 5 [28, 29]. Таким образом, переход анионных форм NIF в раствор является более благоприятным.
Как следует из рис. 5, скорость высвобождения NIF из композитов γCD-MOF/NIF-2 значительно увеличивается как в кислой, так и в щелочной средах. Полное высвобождение NIF наблюдается уже через 20 мин. Увеличение скорости высвобождения из композитов можно объяснить тем, что NIF включается в каркас и находится в его порах в молекулярном виде. При контакте с растворителем происходит разрушение структуры металл-органического каркаса, и NIF сразу переходит в раствор как в чистом виде, так и в составе комплексов включения с γ-циклодекстрином. Однако роль комплексообразования не первостепенная, что подтверждается поведением физической смеси (γ-CD + NIF). Кинетика процессов растворения чистой NIF и физической смеси (γ-CD + NIF) близка (рис. 5).
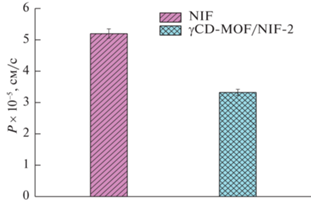
Мембранная проницаемость – второе по значимости свойство, которое определяет биодоступность лекарственного препарата. Поэтому, интересно проследить, как будет влиять γ-циклодекстрин на мембранную проницаемость NIF, которая высвобождается из композита. На рис. 6 приведены значения коэффициентов мембранной проницаемости кислоты (Р) через модельную целлофановую мембрану (MWCO 12 кДа), рассчитанные по выражению:
где с0 – исходная концентрация NIF в донорной камере.Сравнительный анализ значений Р (рис. 6) показывает уменьшение проницаемости в 1.5 раза в случае композита. Данный факт можно объяснить комплексообразованием NIF с γ-циклодекстрином. Уменьшение P в этом случае вызвано понижением коэффициента диффузии нифлумовой кислоты за счет увеличения размера ее частиц при образовании комплексов включения с циклодекстрином.
Для выявления влияния комплексообразования с циклодекстрином на проницаемость NIF через мембрану нами дополнительно была снята зависимость Р от концентрации γ-циклодекстрина (рис. 7). Как видно из рис. 7, увеличение концентрации γ-циклодекстрина в растворе ведет к плавному снижению проницаемости нифлумовой кислоты с постепенным выходом на плато. Данный эффект связан, прежде всего, с наличием взаимодействия между лекарством и циклодекстрином. Взаимодействие нифлумовой кислоты с циклодекстрином ведет к уменьшению доли свободных молекул лекарства в растворе, что вызывает ослабление концентрационного градиента и уменьшение коэффициентов проницаемости. Не исключается прохождение образующихся комплексов через используемую мембрану, однако со скоростью меньшей, чем у самой кислоты.
Рис. 7.
Зависимость коэффициента проницаемости нифлумовой кислоты от концентрации γ-циклодекстрина (рН 7.4, 37°С).

В заключение, включение нифлумовой кислоты в металл-органический каркас на основе γ‑циклодекстрина методом соосаждения является более эффективным по сравнению с сорбцией из раствора. Нифлумовая кислота, иммобилизованная в каркас, проявляет улучшенные показатели растворимости за счет нахождения в носителе на молекулярном уровне, т.е. при разрушении каркаса она переходит в раствор в виде отдельных молекул и комплексов включения с γ-циклодекстрином. При растворении γCD-MOF/NIF в одной среде происходит разрушение композитов, и кислота высвобождается в раствор в виде комплекса включения с циклодекстрином. Вследствие комплексообразования происходит контролируемое концентрацией циклодекстрина понижение коэффициента проницаемости кислоты через модельную целлюлозную мембрану. Обнаруженное снижение мембранной проницаемости не является критическим и не должно сильно отразиться на биодоступности препарата.
Исследование выполнено в рамках поддержанного федеральным государственным бюджетным образовательным учреждением высшего образования “Ивановский государственный университет” гранта № 60-21Г. Эксперименты РФА, низкотемпературная адсорбция/десорбция азота, ИК-спектроскопия выполнены на оборудовании ЦКП “Верхневолжский региональный центр физико-химических исследований” при ИХР РАН.
Список литературы
Симагина А.А., Полынский М.В., Виноградов А.В. и др. // Успехи химии. 2018. Т. 87. № 9. С. 831. https://doi.org/10.1070/RCR4797
Бутова В.В., Солдатов М.А., Гуда А.А. и др. // Успехи химии. 2016. Т. 85. № 3. С. 280. https://doi.org/10.1070/RCR4554
Li H., Eddaoudi N., O’Keefi M. et al. // Nature. 1999. V. 402. P. 276. https://doi.org/10.1038/46248
Forgan R.S., Smaldone R.A., Gassensmith J.J. et al. // Am. Chem. Soc. 2012. V. 134. P. 406. https://doi.org/10.1021/ja208224f
He S., Wu L., Li X. et al. // Acta Pharm. Sin. B. 2021. V. 11. P. 2362. https://doi.org/10.1016/j.apsb.2021.03.019
Smaldone R.A., Forgan R.S., Furukawa H. et al. // Angew. Chem. Int. Ed. 2010. V. 49. P. 8630. https://doi.org/10.1002/anie.201002343
Roy I., Limketkai B., Botros Y.Y. et al. // Acc. Chem. Res. 2020. P. 105. https://doi.org/10.1021/acs.accounts.9b00537
Rajkumara T., Kukkara D., Kima K.-H. et al. // J. Ind. Eng. Chem. 2019. V. 72. P. 50. https://doi.org/10.1016/j.jiec.2018.12.048
Kumar A., Kumar D., Gautam M. et al. // Lett. Drug. Des. Discov. 2013. V. 10. № 9. P. 853. https://doi.org/10.2174/15701808113109990016
Gidwani B., Vyas A. // Biomed. Res. Int. 2015. P. 198268. https://doi.org/10.1155/2015/198268
Moussa Z., Hmadeh M., Abiad M.G. et al. // Food Chem. 2016. V. 212. P. 485. https://doi.org/10.1016/j.foodchem.2016.06.013
Zhang G., Meng F., Guo Z. et al. // J. Microencapsul. 2018. V. 35. № 3. P. 249. https://doi.org/10.1080/02652048.2018.1462417
Ke F., Zhang M., Qin N. et al. // J. Mater. Sci. 2019. V. 54. P. 10420. https://doi.org/10.1007/s10853-019-03604-7
Roy I., Stoddart J.F. // Acc. Chem. Res. 2021. V. 54. P. 1440. https://doi.org/10.1021/acs.accounts.0c00695
Bernini M.C., Fairen-Jimenez D., Pasinetti M. et al. // J. Mater. Chem. B. 2014. V. 2. P. 766. https://doi.org/10.1039/C3TB21328E
Li H., Lv N., Li X. et al. // Nanoscale. 2017. V. 9. P. 7454. https://doi.org/10.1039/C6NR07593B
Liu B., He Y., Han L. et al. // Cryst. Growth Des. 2017. V. 17. P. 1654. https://doi.org/10.1021/acs.cgd.6b01658
Abuçafya M.P., Caetanoa B.L., Chiari-Andréoa B.G. et al. // Eur. J. Pharm. Biopharm. 2018. V. 127. P. 112. https://doi.org/10.1016/j.ejpb.2018.02.009
Pobudkowska A., Domańska U. // Chem. Ind. Chem. Eng. Q. 2014. V. 20. № 1. P. 115. https://doi.org/10.2298/CICEQ120531116P
Barbaresso R.C., Rău I., Zgârian R.G. et al. // Chimie. 2014. V. 17. № 1. P. 12. https://doi.org/10.1016/j.crci.2013.07.007
Thapa R., Sai K., Saha D. et al. // J. Mol. Liq. 2021. V. 334. P. 115998. https://doi.org/10.1016/j.molliq.2021.115998
Bédouet L., Moine L., Servais E. et al. // Int. J. Pharm. 2016. V. 511. № 1. P. 253. https://doi.org/10.1016/j.ijpharm.2016.06.128
Fagerberg J.H., Tsinman O., Sun N. et al. // Mol. Pharm. 2010. V. 7. № 5. P. 1419. https://doi.org/10.1021/mp100049m
Zapała L., Kosińska-Pezda M., Byczyński Ł. et al. // Thermochim. Acta. 2021. V. 696. P. 178814. https://doi.org/10.1016/j.tca.2020.178814
Vijayakumar G., Tamilarasan R., Dharmendirakumar M. // J. Mater. Environ. Sci. 2012. V. 3. P. 157.
Nguyen C., Do D.D. //Carbon. 2001. V. 39. P. 1327. https://doi.org/10.1016/S0008-6223(00)00265-7
Fu J., Zhu J., Wang Z. et al. // J. Colloid Interface Sci. 2019. V. 542. P. 123. https://doi.org/10.1016/j.jcis.2019.01.131
Iervolino M., Quaglia F., Miro A. et al. // J. Drug. Del. Sci. Tech. 2004. V. 14. № 1. P. 93. https://doi.org/10.1016/S1773-2247(04)50011-4
Takács-Novák K., Avdeef A., Box K.J. et al. // J. Pharm. Biomed. Anal. 1994. V. 12. P. 1369.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии