Журнал физической химии, 2023, T. 97, № 1, стр. 55-65
Взаимодействие ионов платиновых и переходных металлов с 2(4)-аминопиридинами в водных растворах в условиях, приближенных к процессам их экстракционного выделения и разделения
Л. С. Агеева a, *, Н. А. Борщ a, Н. В. Кувардин a, И. В. Егельский a
a Юго-Западный государственный университет
Курск, Россия
* E-mail: millfi@yandex.ru
Поступила в редакцию 21.05.2022
После доработки 20.06.2022
Принята к публикации 22.06.2022
- EDN: BARECH
- DOI: 10.31857/S0044453723010028
Аннотация
Методами кондуктометрии, спектрофотометрии и ИК-спектроскопии исследовано взаимодействие Pd(II), Pt(II), Pt (IV) и сопутствующих ионов Ni(II), Co(II), Fe(II, III), Cu(II) с 2(4)-аминопиридинами (2(4)-АП) в водных растворах, приближенных к условиям их экстракционного выделения и разделения. Показано, что ионы платиновых металлов образуют устойчивые нейтральные и катионные комплексы как с 2-АП, так и с 4-АП, которые могут быть выделены из водных растворов. Тенденция к образованию катионных комплексов снижается в ряду Pd(II) > Pt(II) > Pt(IV) и 4-АП > > 2-АП. Ионы 3d-элементов, кроме Cu(II), в этих условиях устойчивых комплексов не образуют. Cu(II) образуют комплексы с 2(4)-АП, которые подвержены гидролизу при выделении из водных растворов. Обсуждается специфика 2(4)-АП при взаимодействии с ионами металлов. Предлагается использовать аналоги 2(4)-АП с длинным углеводородным радикалом для экстракционного концентрирования платиновых металлов из сложных по составу растворов гидрометаллургии.
Ароматические амины представляют собой перспективные экстрагенты для концентрирования и разделения платиновых металлов [1]. Так, 2-октиламинопиридин (2-ОАП) предлагали для выделения и разделения платиновых (Pd(II), Rh(III), Ir(III) и Ru(III) [2–7], соответственно, и других редких элементов (Th(IV), Tl(III), Ga(III), In(III), La(III), Sm(III), Zr(IV), Mo(VI), Cr(VI), V(V), Bi(III), Pb(II), Hg(II) [8–20], соответственно). 4-Октиламинопиридин (4-ОАП) показал себя более эффективным экстрагентом, чем 2-ОАП для выделения иридия [21], его распределение в системе вода (HCl) – хлороформ исследовано в работе [22], работы по экстракции других металлов не найдены. Для разработки научной базы химии экстракции платиновых металлов важны дальнейшие исследования алкиламинопиридинов. В частности, представляют интерес 4-алкиламинопиридины и их производные, так как они обладают значительно более высокой основностью гетероциклического атома азота по сравнению с 2-алкиламинопиридинами.
2(4)-ОАП используют для экстракции ионов металлов из водных растворов. Экстракции предшествует образование координационно-сольватированного или внешнесферного комплекса металла с амином в водной фазе. Так как ароматические экстрагенты, как правило, содержат в своем составе длинный углеводородный радикал, то константа распределения амина в двухфазной системе органический растворитель–вода лежит в пределах 104–106. Следовательно, концентрация амина в водной фазе, как правило, не превышает порядок 10–4 М. Поэтому для исследования процессов взаимодействия ионов металлов с 2(4)‑ОАП в водном растворе, приближенных к условиям экстракции, можно использовать реагенты с одинаковым донорным фрагментом, но без углеводородного радикала, например, растворимые в воде 2(4)-аминопиридины (2(4)-АП).
Так как на практике приходится выделять платиновые металлы из растворов, содержащих многократно превышающие количества цветных металлов и железа, то необходимы исследования специфики взаимодействия 2(4)-АП с ионами платиновых металлов, с одной стороны, и ионами 3d-элементов – с другой, что и является целью настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и оборудование. 2(4)-Аминопиридины (Acros Organics, 99.5% основного вещества); хлорид никеля: NiCl2⋅6H2O, “ч.д.a.”; хлорид меди: CuCl2⋅2H2O, “ч.д.a.”; хлорид кобальта: CoCl2⋅6H2O, “ч.д.a.”; хлорид марганца: MnCl2⋅2H2O, “ч.д.a.”; хлорид палладия: PdCl2, “ч.д.а.”; хлорид железа (ΙΙ): FeCl2⋅4H2O, “ч.д.a.”; хлорид железа(III): FeCl3⋅6H2O, “ч.д.a.”; аммиак водный: NH3, “ч.д.а.” (25%); HCl и HNO3, “ч.д.а.”; гидразин солянокислый: N2H4⋅2HCl, “ч.д.а.”; вода бидистиллированная (0.5 мСм/см).
Раствор гексахлорплатината водорода Н2[PtCl6] с концентрацией 5 × 10–2 М получали растворением навески Pt (99.99%) массой 0.2530 г в царской водке [23].
Раствор тетрахлорплатината водорода H2[PtCl4] с концентрацией 5 × 10–2 М получали растворением навески (99.99%) Pt массой 0.2530 г в царской водке. Затем полученный гексаплатинат водорода восстанавливали до тетраплатината водорода солянокислым гидразином [23].
Для кондуктометрических измерений использовали “Анион 4100”, спектрофотометрических – UV-1800 (Shimadzu). ИК-спектры регистрировали на ИК-фурье-спектрометре IS 10 Nicolet c приставкой СМАРТ. Для выделения комплексов разбавленные растворы концентрировали на ротационном испарителе BUCHI Rotavapor R-215.
Методика эксперимента. Для кондуктометрических измерений и сканирования электронных спектров готовили 5 × 10–2 М исходные растворы солей Mn(II), Fe(II, III), Co(II), Ni(II), Cu(II), Pd(II), Pt(II, IV) и 0.1 М растворы 2(4)-аминопиридина в бидистиллированной воде, из которых разбавлением получали рабочие растворы хлоридов металлов с концентрацией 1 × 10–4 М.
Использовали кондуктометрию при 20 ± 2°С как физико-химический метод исследования взаимодействия ионов металлов с реагентами в разбавленных водных растворах, так как он не требует дорогостоящего оборудования, обладает высокой чувствительностью (10–4–10–5 М) и позволяет определять состав образующихся соединений по изломам на кондуктометрической кривой, построенной в координатах χ = f(CL/CMe), где χ – удельная электропроводность; CL и CMe – молярная концентрация амина и иона металла, соответственно [24].
Кроме того, определение удельной электропроводности двух серий разбавленных растворов (χ), содержащих только катион металла и катион металла с амином в мольном соотношении, соответствующем координационному числу металла, позволяет установить число ионов, на которые диссоциирует координационное соединение (тип электролита), следовательно, сделать предположение о вероятном составе внутренней и внешней координационной сферы. Для этого рассчитывали предельную молярную проводимость (λ) по формуле λ = 1000χ/СМе и экстраполировали функции λ = λо – а√СМе на “нулевую” концентрацию [25]. Сравнением найденного значения предельной молярной электрической проводимости λо (См см2/моль) с указанным ниже оценивали тип электролита (25°С):
Очевидно также, что при образовании комплекса амина с катионом металла определяемая λо должна быть или сопоставима с таковой для раствора иона металла в отсутствие амина, или снижаться в случае образования нейтрального комплекса. Правомерность такого подхода показана на примере исследования взаимодействия Cu(II) с аммиаком [26].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Процессы ступенчатого комплексообразования катионов металлов с 2(4)-аминопиридином могут протекать по уравнениям:
Как видно из уравнений, образование комплексов не приводит к увеличению числа заряженных частиц, следовательно, как минимум, это не должно сопровождаться увеличением предельной молярной электропроводности. Если же металл входит в ацидную часть комплекса, содержащую противоионы во внутренней координационной сфере, то возможно, как резкое падение, так и рост электропроводности в случае образования, соответственно, нейтрального или катионного комплекса с высвобождением заряженных противоионов, что характерно для галогенидных комплексов платиновых металлов. Поэтому, оценка предельной молярной электропроводности раствора соли металла в присутствии и отсутствие амина в этом случае позволяет предположить химизм процесса комплексообразования.
На рис. 1 приведены результаты исследования взаимодействия Pd(II) с 2-(4-АП) с использованием вышеперечисленных методик и УФ-спектроскопии. В присутствии 2-АП график линейной функции λ = f(√С) располагается ниже аналогичного графика для K2[PdCl4], а в присутствии 4-АП – выше (рис. 1а). На графиках функции χ = = f(CAm/CPd) в обоих случаях наблюдается излом при 2; в случае 4-АП еще и при 4 (рис. 1б).
Рис. 1.
Результаты исследования взаимодействия K2[PdCl4] c 2(4)-АП в водном растворе: a) определение молярной электропроводности: 1 – K2[PdCl4], 2 – K2[PdCl4] с добавкой 2-АП; 3 – K2[PdCl4] с добавкой 4-АП; б) определение удельной электропроводности в зависимости от мольного соотношения металл/амин: 1 – K2[PdCl4] с добавкой 2-АП, 2 – K2[PdCl4] с добавкой 4-АП; УФ-спектры: в) с добавкой 2-АП, г) с добавкой 4-АП: 1 – K2[PdCl4] (1 × 10–4 M), 2 – амин (1 × 10–4 M), 3 – CAm/CPd = 2; 4 – CAm/CPd = 5.
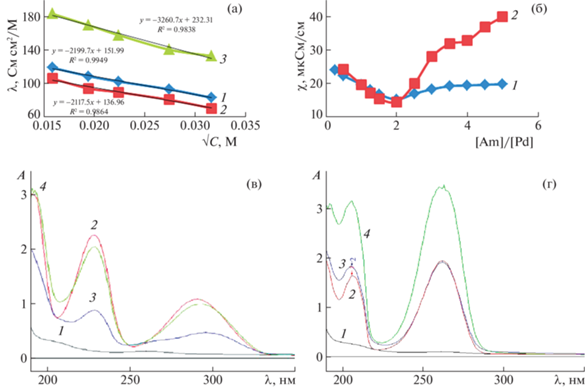
В УФ-области (рис. 1в и г) видны две полосы поглощения свободных 2-АП и 4-АП, обусловленные π → π*-переходами, при 241 и 296, 229 и 265 нм, соответственно. При взаимодействии Pd(II) с 2-АП наблюдается батохромный сдвиг длинноволновой полосы и резкое снижение интенсивности полос как при соотношении Am/Pd, равном 2, так и при соотношении, равном 5, если принять за единицу отсчета интенсивность полос свободного амина при концентрации 1 × 10–4 М. Снижение интенсивности полос, но в меньшей степени и без батохромного сдвига длинноволновой полосы, наблюдается и для 4-АП.
В случае K2[PtCl4] (рис. 2) картина меняется: графики функции λ = f(√С) как для 2-АП, так и 4‑АП располагаются ниже графика раствора без амина, причем в случае 4-АП удельная электропроводность не зависит от концентрации комплекса (рис. 2а). На графиках функции χ = f(CAm/CPt) как для 2-АП, так и 4-АП наблюдается излом при 2, более выраженный в случае 4-АП (рис. 2б). Все это свидетельствует об образовании преимущественно нейтрального комплекса.
Рис. 2.
Результаты исследования взаимодействия K2[PtCl4] c 2(4)-АП в водном растворе: a) определение молярной электропроводности: 1 – K2[PtCl4], 2 – K2[PtCl4] с добавкой 2-АП; 3 – K2[PtCl4] с добавкой 4-АП; б) определение удельной электропроводности в зависимости от мольного соотношения металл/амин: 1 – K2[PtCl4] с добавкой 2-АП, 2 – K2[PtCl4] с добавкой 4-АП; УФ-спектры: в) с добавкой 2-АП, г) с добавкой 4-АП: 1 – K2[PtCl4] (1 × 10–4 M), 2 – амин (2-АП – 7 × 10–5, 4-АП – 8 × 10–5 M), 3 – CAm/CPt = 2, 4 – CAm/CPt = 5.

В УФ-области (рис. 2в и г) тетрахлорплатинат калия имеет полосу поглощения вблизи 203.4 нм. При взаимодействии с 2-АП эта полоса претерпевает гипсохромный сдвиг с одновременным снижением интенсивности. Одновременно снижается интенсивность полос амина, а длинноволновая полоса претерпевает батохромный сдвиг. В случае 4-АП сдвиг полос отсутствует, интенсивность полос амина снижается.
При переходе к гексахлорплатинату калия (рис. 3) в УФ-спектрах с 2-АП (рис. 3в) и 4-АП (рис. 3г) при соотношении Am/Pt = 2 наблюдаемая тенденция с изменением положения полос поглощения пиридинового кольца сохраняется: резкое падение интенсивности и батохромный сдвиг длинноволновой полосы в случае 2-АП. Напротив, в УФ-спектре с 4-АП отсутствует батохромный сдвиг и падение интенсивности длинноволновой полосы.
Рис. 3.
Результаты исследования взаимодействия K2[PtCl6] c 2(4)-АП в водном растворе: a) определение молярной электропроводности: 1 – K2[PtCl6], 2 – K2[PtCl6] с добавкой 2-АП; 3 – K2[PtCl6] с добавкой 4-АП; б) определение удельной электропроводности в зависимости от мольного соотношения металл/амин: 1 – K2[PtCl6] с добавкой 2-АП, 2 – K2[PtCl6] с добавкой 4-АП; УФ-спектры: в) с добавкой 2-АП, г) с добавкой 4-АП: 1 – K2[PtCl6] (1 × 10–4 M), 2 – амин (1 × 10–4 M), 3 – CAm/CPt = 2; 4 – CAm/CPt = 5.

Что касается функций χ = f(CAm/CPt), то излом, как и для Pt(II), наблюдается при соотношении CAm/CPt = 2, как в случае 2-АП, так и в случае 4‑АП (рис. 3б). Графики функций λ = f(√С) в присутствии амина лежат значительно ниже соответствующего графика для гексахлорплатината.
Анализируя полученные результаты, можно сделать вывод, что при взаимодействии амин входит во внутреннюю координационную сферу Pd и Pt, так как происходит глубокая перестройка энергетических уровней пиридинового ядра, что находит отражение в УФ-спектрах. Амин координируется к металлу гетероциклическим азотом, причем возможно ступенчатое комплексообразование с вхождением до четырех молекул амина. Конкретный состав комплекса определяется активностью платинового металла, с одной стороны, и положением аминогруппы в пиридиновом кольце – с другой.
Так, Pd(II), как наиболее активный, образует с 4-АП, как нейтральный, так и катионный комплекс, о чем свидетельствуют изломы на кривой χ = f(CAm/CPt) (рис. 1б) и расположение прямой λ = λо– а√С (рис. 1а) значительно выше таковой при отсутствии амина (возрастает число заряженных частиц при высвобождении Cl- из внутренней координационной сферы). При этом доминирует катионный комплекс. В случае 2-АП преобладает нейтральный комплекс, поэтому прямая λ = λо– а√С располагается ниже остальных (рис. 1а).
Pt(II) проявляет меньшую активность в сравнении с Pd(II). Если принять во внимание расположение графиков функций χ = f(CAm/CPt) и λ = = λо ‒ а√С на рис. 2а и б, то можно сделать вывод, что в случае 4-АП доминирует нейтральный комплекс, хотя возможно образование заряженных комплексов в небольших количествах, тогда как с 2-АП, скорее всего, образуется только нейтральный комплекс.
С увеличением степени окисления платины до (IV) тенденция образования только нейтрального комплекса еще более выражена, как для 2-АП, так и 4-АП, что находит отражение в расположении графиков функций χ = f(CAm/CPt) и λ = λо– ‒ а√С на рис. 3а и б.
Из сопутствующих элементов особый интерес представляет Ni(II), изовалентный и изоэлектронный Pd(II) и Pt(II). Как следует из результатов кондуктометрии и спектрофотометрии (рис. 4), NiCl2 с 2(4)-АП в этих условиях комплексов не образует: в УФ-спектрах (рис. 4в и г) добавка амина не приводит к снижению интенсивности полос, напротив, интенсивность растет пропорционально концентрации добавляемого амина. Кроме того, на кривых χ = f(CAm/CNi) отсутствуют изломы (рис. 4б), а прямые λ = λо– а√С с добавкой амина располагаются выше таковой для NiCl2. При этом предельная молярная электропроводность λо для растворов с амином незначительно отличается от таковой для раствора NiCl2, что позволяет отнести эти растворы к электролиту типа 1 : 2.
Рис. 4.
Результаты исследования взаимодействия NiCl2 c 2(4)-АП в водном растворе: a) определение молярной электропроводности: 1 – NiCl2, 2 – NiCl2 с добавкой 2-АП; 3 – NiCl2 с добавкой 4-АП; б) определение удельной электропроводности в зависимости от мольного соотношения металл/амин: 1 – NiCl2 с добавкой 2-АП, 2 – NiCl2 с добавкой 4-АП; УФ-спектры: в) с добавкой 2-АП, г) с добавкой 4-АП: 1 – NiCl2 (1 × 10–4 M), 2–2-АП (4 × 10–5); 4-АП (1 × × 10‒4 M), 3 – CAm/CNi = 2; 4 – CAm/CNi = 5.

Аналогичные результаты получены и для других сопутствующих металлов: Mn(II), Co(II), Fe(II, III). Ниже приведены результаты определения предельной молярной электропроводности растворов хлоридов этих элементов с добавкой амина и без (табл. 1), которые свидетельствуют об отсутствии заметного взаимодействия этих солей с 2(4)-АП.
Таблица 1.
Предельная молярная электропроводность (λо, См см2/M) при 20 ± 2°С растворов хлоридов металлов (n = 2, 3), сопутствующих платиновым, в отсутствие и в присутствии 2(4)-АП
| Ме (n) | МеCln | МеCln + + 2-АП | МеCln + + 4-АП | Тип электро-лита |
|---|---|---|---|---|
| Mn(II) | 251 | 270 | 290 | 1 : 2 |
| Со(II) | 273 | 292 | 314 | 1 : 2 |
| Ni(II) | 286 | 304 | 311 | 1 : 2 |
| Fe(II) | 328 | 344 | 343 | 1 : 2 |
| Fe(III) | 386 | 391 | 408 | 1 : 3 |
| Cu(II) | 284 | 270 | 267 | 1 : 2 |
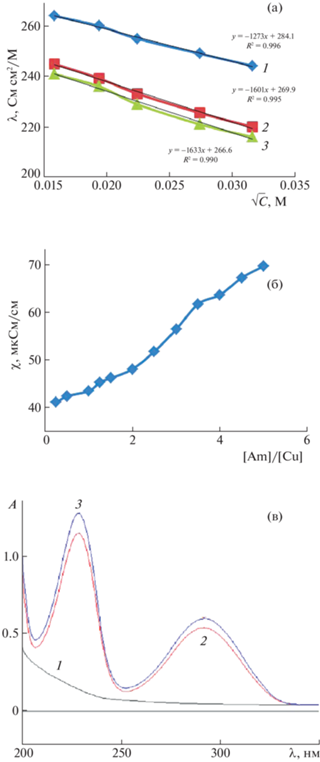
В этом ряду Cu(II) занимает особое место (рис. 5). Прямые λ = λо – а√С в присутствии 2(4)-АП располагаются на графике (рис. 5а) заметно ниже таковой для CuCl2. На кривой χ = f(C4-АП/ CCu) присутствуют слабовыраженные изломы при 2 и 4. В УФ-спектре CuCl2 с добавкой 2-АП, как и в случае Pd(II), Pt(II), наблюдается снижение интенсивности полос поглощения амина. В то же время тип электролита соответствует 1 : 2. Следовательно, возможно образование катионных комплексов, когда хлорид-ион, в отличие от платиновых металлов, не входит во внутреннюю координационную сферу.
Рис. 5.
Результаты исследования взаимодействия CuCl2 c 2(4)-АП в водном растворе: a) определение молярной электропроводности: 1 – CuCl2, 2 – CuCl2 с добавкой 2-АП; 3 – CuCl2 с добавкой 4-АП; б) определение удельной электропроводности в зависимости от мольного соотношения Cu/4-АП; в) УФ-спектр: 1 – CuCl2 (1 × 10–4 M), 2 – 2-АП (1 × 10–4 M), 3 – C2-АП/CCu = 2.
Сделанные выводы по данным кондуктометрии и спектрофотометрии подтверждаются также результатами ИК-спектроскопического исследования комплексов, выделяемых в небольших количествах из водных растворов после концентрирования в роторном испарителе. Получено два комплекса палладия с 4-АП (1 – нерастворимый при концентрации ≳10–3 М и 2 – растворимый при концентрации ≲10–3 М), по одному комплексу Pd(II), Pt(II, IV) c 2-АП и Pt(II, IV) с 4-АП. Выделить комплексы сопутствующих металлов не удалось: образующиеся продукты представляли собой гидроокиси с очень низким содержанием органического компонента. В случае Cu(II) удалось выделить продукт с заметным содержанием органического компонента [26]. В спектре наблюдается ряд частот, которые присутствуют в спектре 4-АП, взятого в качестве эталона, однако соотношение полос поглощения в области “скелетных” колебаний (1700–1000 см–1) сильно искажено. Скорее всего, в процессе выделения протекают процессы гидролиза комплексов, образующихся в разбавленном водном растворе.
В качестве примера на рис. 6 и 7 приведены ИК-спектры некоторых из выделенных комплексов Pd и Pt, а в табл. 2 и 3 отнесение некоторых частот.
Таблица 2.
Отнесение некоторых частот (см–1) в ИК-спектрах комплексов палладия и платины с 2-АП
| Фрагмент молекулы |
Тип ко-лебания | 2-АП | Pd(II) | Pt(II) | Pt(IV) |
|---|---|---|---|---|---|
| Аминогруппа | νs, νas |
3444 3299 |
3444 3346 |
3420 3326 |
3395 3320 |
| δплоск | 1489 | 1517 | 1517 | 1530 | |
| δнеплоск | 764 | 828 | 842 | 998 | |
| Пиридиновое кольцо |
νСН | 3165 3073 |
3220 | 3095 | 3217 |
| νСN | 1624 | 1629 | 1603 | 1651 | |
| νСC | 1279 | 1205 | 1249 | 1199 | |
| δCCH | 1141 | 1036 | 1153 | 998 |
Таблица 3.
Отнесение некоторых частот (см–1) в ИК-спектрах комплексов палладия и платины с 4-АП
| Фрагмент молекулы |
Тип ко-лебания | 4-АП | Pd(II) | Pt(II) | Pt(IV) | |
|---|---|---|---|---|---|---|
| 1 | 2 | |||||
| Аминогруппа | νs, νas |
3232 3140 |
3420 3324 |
3390 3324 |
3394 3321 |
3343 3324 |
| δплоск | 1356 | 1486 | 1589 | 1530 | 1529 | |
| δнеплоск | 810 | 842 | 994 | 998 | 999 | |
| Пиридиновое кольцо |
νСН | 2926 2859 |
3094 | 3215 3139 |
3217 | 3220 |
| νСN | 1603 | 1627 | 1649 | 1651 | 1651 | |
| νСC | 1217 | 1256 | 1198 | 1199 | 1199 | |
| δCCH | 985 | 1110 | 1104 | 999 | 1098 | |
В комплексах с 2-АП повышается νas аминогруппы в ряду Pt (IV) ≥ Pt(II) ≥ Pd(II), а также δпл и δнепл на 20–30 см–1. В пиридиновом кольце повышается νСН на 20–50 см–1, а νСN, νСC, δCCH не претерпевают значительных изменений. Напротив, в комплексах с 4-АП все частоты аминогруппы резко повышаются на 80–200 см–1, повышаются также и все частоты пиридинового кольца. Это свидетельствует о том, что распределение электронной плотности в комплексе зависит от положения аминогруппы в пиридиновом кольце. Возможно, в случае комплексов с 4-АП доминирует дативное взаимодействия металл-лиганд.
В литературе описаны комплексы Ni(II), Со(II), Сu(II), Zn(II) и Сd(II) с 2-АП (L) состава MeL2Cl2, которые синтезировали смешением этанольных растворов солей соответствующих металлов с 2-АП (Ме/L = 1 : 2). Комплексы выделены в твердом состоянии в виде кристаллов или мелкокристаллических порошков [27, 28]. Сравнением частот валентных колебаний NH свободных молекул 2-АП (3030–3470 см–1) с частотами валентных колебаний координированных лигандов (3025–3490 см–1) показало, что они не только не понижаются, а наоборот, даже повышаются. Частоты колебаний гетероцикла около 800–865, 1000–1080, 1180–1240, 1560–1600 см–1 также несколько повышаются. Сделан вывод, что 2-АП координируется металлом по атому азота гетероцикла.
Известны также комплексы Ni(II), Pd(II) и Pt(II) с 2-октиламинопиридином (2-ОАП) [29]. Комплексы палладия и платины хорошо растворимы в хлороформе, значительно хуже в дихлорэтане и ацетоне, практически не растворимы в спирте, четыреххлористом углероде и бензоле. Напротив, комплекс никеля хорошо растворим в бензоле и четыреххлористом углероде; при растворении в спирте и ацетоне, а также в других координационно-активных растворителях он разрушается. Синтезированные соединения исследованы с помощью электронной, ИК, ПМР и рентгеноэлектронной спектроскопии. Предложена структура комплексов с внутримолекулярной водородной связью.
Аналогичную структуру можно предположить и для выделенных комплексов Pd(II) и Pt(II) с 2-АП, что, возможно, объясняет значительно меньший сдвиг валентных частот аминогруппы в сравнении с аналогичными комплексами с 4-АП (рис. 8).
Результаты исследования взаимодействия ионов металлов с 2(4)-АП в условиях, приближенных к процессам экстракции, позволяют обсудить специфику такого типа лигандов. Все исследованные ионы металлов можно выстроить в следующий ряд по увеличению “мягкости” акцептора (табл. 4):
Таблица 4.
Параметры мягкости по Клопману ($Е_{n}^{*}$) и нормальные окислительно-восстановительные потенциалы ($Е_{r}^{*}$) некоторых катионов металлов [30, 31]
| Me(q) | ${{I}_{q}}_{{ + 1}}$, эВ | Iq, эВ | R0, Å | $Е_{n}^{*}$, эВ | $Е_{r}^{*}$, В |
|---|---|---|---|---|---|
| Hg(II) | 10.43 | 18.75 | 1.05 | –4.40 | +0.85 |
| Pt(II) | 8.96 | 18.54 | 0.90 | –2.80 | +1.20 |
| Pd(II) | 8.33 | 19.42 | 0.79 | –2.40 | +0.99 |
| Cu(II) | 7.72 | 20.29 | 0.68 | –1.80 (–1.60) | +0.34 |
| Pb(II) | 7.42 | 15.03 | 1.17 | –1.25 | –0.13 |
| Sn(II) | 7.33 | 14.60 | 1.02 | –0.30 (–1.15) | –0.14 |
| Cd(II) | 8.99 | 16.90 | 0.92 | –1.60 (–1.15) | –0.40 |
| Ni(II) | 7.63 | 18.15 | 0.74 | –0.70 | –0.23 |
| Zn(II) | 9.39 | 17.96 | 0.70 | –0.60 | –0.80 |
| Co(II) | 7.86 | 17.05 | 0.78 | –0.40 | –0.28 |
| Fe(II) | 7.90 | 16.18 | 0.80 | –0.10 | –0.44 |
| Mn(II) | 7.43 | 15.64 | 0.80 | +0.20 | –1.19 |
Примечание: в скобках приведены значения параметра мягкости катионов, скорректированные по окислительно-восстановительному потенциалу, которые лучше отвечают их химическому поведению [31].
Как следует из экспериментальных данных, в этом ряду увеличивается способность к образованию координационно-сольватированных комплексов с 2(4)-АП, что можно объяснить специфичностью ароматических аминов к мягким ионам металлов даже при экстракции из кислых растворов. Это обусловлено природой атома азота в ароматических аминах. Из анализа литературных данных следует, что свободная пара электронов на гетероциклическом атоме азота у 2(4)‑аминопиридинов имеет более выраженный π-характер за счет делокализации электронной плотности по ароматическому кольцу с одновременной подкачкой электронной плотности с аминного азота на гетероциклический азот.
Именно поэтому 2(4)-АП образуют прочные координационные связи с ионами платиновых металлов, имеющими соответствующие по энергетике акцепторные орбитали, и менее прочные комплексы с Ni(II) и другими 3d-элементами.
Все это указывает на “мягкую” природу 2(4)‑АП как лиганда. Если воспользоваться классификацией Пирсона, то свободный амин следует отнести к “мягким” основаниям, протонированный – к “мягким” кислотам. К мягким и промежуточным основаниям относятся и другие ароматические амины, в то время как алифатические амины – “жесткие” основания. Фактором, ответственным за “мягкое” или “жесткое” поведение амина, следует считать энергетическое и пространственное расположение верхней донорной орбитали атома азота. Энергетику взаимодействия металл-амин и реализующийся в итоге химизм комплексообразования в водной фазе в зависимости от природы амина, металла и кислотности раствора можно рассмотреть с позиции квантовой теории возмущенных молекулярных орбиталей (ВМО) [30, 32].
Предпочтительное образование ассоциата или координационно-сольватированного соединения зависит от результата конкурентного процесса взаимодействия амина и протона, с одной стороны, и иона металла – с другой. Количественная сторона этого процесса в первом приближении выражается основным уравнением теории ВМО [30]. В зависимости от относительного вклада кулоновской или ковалентной составляющей в энергию взаимодействия металл–азот образуется ионный ассоциат или координационно-сольватированное соединение.
Координация амина металлом в присутствии протона возможна только в том случае, если вклад ковалентной составляющей значительно больше, чем кулоновской. Вклад ковалентной составляющей тем больше, чем выше энергия донорной и чем ниже энергия акцепторной орбитали амина и иона металла, соответственно. Эти энергетические параметры взаимодействующих орбиталей в рамках ВМО характеризуются орбитальной электроотрицательностью донора и акцептора по Клопману [30]. Кроме того, ковалентная составляющая повышается с протяженностью донорной орбитали амина.
Если речь идет о природе амина, то координироваться металлом в присутствии протона способны только амины с низкой орбитальной электроотрицательностью неподеленной пары электронов (ОЭНПЭ), которая зависит от валентного состояния атома азота в молекуле амина. ОЭНПЭ азота уменьшается с увеличением ρ- и π-характера неподеленной пары электронов, то есть с уменьшением энергии донорной орбитали и с увеличением ее заселенности [30, 31]. Следовательно, ОЭНПЭ азота уменьшается при переходе от алифатических аминов к анилинам и далее к гетероароматическим аминам. В этом же ряду возрастает “мягкость” аминов и их способность взаимодействовать с ионами платиновых металлов с образованием координационно-сольватированных соединений.
В свою очередь, взаимодействовать с образованием координационно-сольватированных соединений в кислых растворах способны только ионы металлов с высокой орбитальной электроотрицательностью по Клопману [30]. Так, большинство ионов цветных металлов в водном растворе имеют низкую орбитальную электроотрицательность и не образуют в присутствии протона координационно-сольватированных соединений. Напротив, ионы платиновых металлов в водных растворах обладают высокой орбитальной электроотрицательностью, поэтому могут взаимодействовать с ароматическими аминами в кислых растворах с образованием координационно-сольватированных соединений.
Таким образом, специфика взаимодействия ионов платиновых металлов с 2(4)-АП в условиях их экстракционного выделения из водных растворов, содержащих сопутствующие ионы цветных металлов и железа, состоит в том, что эти ароматические амины образуют прочные координационно-сольватированные комплексы только с ионами платиновых металлов. Это позволяет использовать их аналоги с длинным углеводородным радикалом для экстракционного концентрирования платиновых металлов из сложных по составу растворов гидрометаллургии [33, 34].
Авторы заявляют, что у них нет конфликта интересов. Работа выполнена при поддержке Министерства образования и науки Российской Федерации № 0851-2020-0035.
Список литературы
Борщ Н.А. / Теория и практика экстракционных методов. Отв. ред. Алимарин И.П., Багреев В.В. М.: Наука, 1985. С. 111.
Suryavanshi V.J., Anuse M.A., Pawar R.R., Mulik G.N. // Analyt. Methods. 2015. V. 7. № 6. P. 2497. https://doi.org/10.1039/C4AY03045A
Борщ Н.А., Петрухин О.М., Соколов А.Б. и др. // Журн. неорган. химии. 1981. Т. 26. № 3. С. 734.
Борщ Н.А., Петрухин О.М. // Журн. аналит. химии. 1978. Т. 33. № 11. С. 2181.
Suryavanshi S.J., Patil M.M., Kokare A.N. et al. // J. Chinese Chem. Soc. 2016. V. 63. № 8. P. 694.https://doi.org/10.1002/jccs.201500541
Suryavanshi V.J., Patil M.M., Zanje S.B. et al. // Separat. Sci. and Technology. 2016. V. 51. № 10. P. 1690.https://doi.org/10.1080/01496395.2016.1177076
Suryavanshi V.J., Patil M.M., Mulik G.N. et al. // Rus. J. Inorg. Chem. 2017. V. 62. № 2. P. 257. https://doi.org/10.1134/S003602361702019X
Kore G.D., Patil S.A., Anuse M.A. et al. // J. Radioanalyt. and Nucl. Chem. 2016. V. 310. № 1. P. 329. https://doi.org/10.1007/s10967-016-4857-7
Sandip V.M., Prakash P.W., Anuse M.A. // J. Serb. Chem. Soc. 2008. V. 73. № 4. P. 435. https://doi.org/102298/JSC0804435M
Sandip V.M., Prakash P.W., Anuse M.A. // Ibid. 2010. V. 75. № 8. P. 1099. https://doi.org/10.2298/JSC090630072M
Mahamuni S.V., Kolekar S.S., Wadgaonkar P.P. et al. // J. Iran. Chem. Soc. 2009. V. 6. № 1. P. 200.https://doi.org/10.1007/BF03246521
Mandhare A.M., Anuse M.A., Kolekar S.S. // Ind. J. Chem. Technology. 2011. V. 18. № 6. P. 475.
Mandhare A.M., Han S.H., Anuse M.A. et al. // Arab. J. Chem. 2015. V. 8. № 4. P. 456.https://doi.org/10.1016/j.arabjc.2011.01.026
Noronha L.E., Kamble G.S., Kolekar S.S. et al. // Ind. J. Chem. Technology. 2013. V. 20. № 7. P. 252.
Noronha L.E., Kamble G.S., Kolekar S.S. et al. // Inter. J. Chem. Scince Technology. 2013. V. 3. № 1. P. 15–24.
Mane C.P., Mahamuni S.V., Kolekar S.S. et al. // Arab. J. Chem. 2016. V. 9. № 2. P. 1420.https://doi.org/10.1016/j.arabjc.2012.03.021
Noronha L.E., Kamble G.S., Kolekar S.S. et al. // Int. J. Analyt. and Bioanalyt. Chem. 2013. V. 3. № 1. P. 27.
Mane C.P., Anuse M.A. // J. Chinese Chem. Soc. 2008. V. 55. P. 807.https://doi.org/10.1002/jccs.200800121
Mane C.P., Anuse M.A. // J. Hazard Mater. 2008. V. 152. № 3. P. 1146.https://doi.org/10.1016/j.jhazmat.2007.07.119
Rajehdre V., Kolekar S.S., Anuse M.A. // J. Saudi Chem. Soc. 2015. V. 19. № 1. P. 46.https://doi.org/10.1016/j.jscs.2011.12.016
Серегина И.Ф., Петрухин О.М., Формановский А.А. и др. // Докл. АН СССР. 1984. Т. 275. № 2. С. 385.
Борщ Н.А., Агеева Л.С., Фролова А.Ю. // Журн. физ. химии. 2019. Т. 93. № 5. С. 661. https://doi.org/10.1134/S0036024419050066
Синтез комплексных соединений металлов платиновой группы: справочник / под общ. ред. И.И. Черняева. М.: Наука, 1964. С. 339.
Демидова Е.Н., Драчев А.И., Борщ Н.А. // Координац. химия. 2008. Т. 34. № 10. С. 797. https://doi.org/10.1134/S1070328408100151
Худякова Т.А. Теория и практика кондуктометрического и хронокондуктометрического анализа. М.: Химия, 1976.
Евстратикова И.А., Фалалеева В.Н. Естественнонаучные, инженерные и экономические исследования в технике, промышленности, медицине и сельском хозяйстве. Материалы I Молодежной научно-практической конференции с международным участием. Белгород: ИД Белгород НИУ БелГУ, 2017. С. 498.
Цинцадзе Г.В., Харитонов Ю.Я., Джашиашвили Т.К. и др. // Координац. химия. 1982. № 8. С. 1493.
Цинцадзе Г.В., Харитонов Ю.Я., Марченкова Т.Г. и др. // Там же. 1987. № 2. С. 215.
Борщ Н.А., Петрухин О.М., Золотов Ю.А. и др. // Там же. 1981. Т. 7. № 8. С. 1242.
Klopman G.J. Am. Chem. Soc. // 1968. V. 90. P. 223.
Борщ Н.А. // Дис. канд. хим. наук. М.: ГЕОХИ АН СССР, 1978. С. 184.
Клопман Г.Н. Реакционная способность и пути реакций. М.: Мир, 1977. 384 с.
Борщ Н.А., Петрухин О.М. Журн. аналит. химии. 1978. Т. 33. № 9. С. 1805.
Борщ Н.А., Петрухин О.М. Авт. свид. SU 687073 A1, 25.09.1979. Заявка № 2502576 от 04.07.1977.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии





