Физика и химия стекла, 2020, T. 46, № 1, стр. 74-81
Синтез и исследование цеолитов Beta с иерархической структурой пор
Е. Ю. Бразовская 1, *, О. Ю. Голубева 1
1 Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
* E-mail: Brazovskaya.ics@gmail.com
Поступила в редакцию 21.03.19
После доработки 16.08.19
Принята к публикации 08.10.19
Аннотация
В гидротермальных условиях синтезированы цеолиты Beta с иерархической системой пор с использованием двух структурно-направляющих агентов: гидроксида тетраэтиламмония и катионного полимера полидиалилдиметиламмония хлорида. Получены цеолиты со средним размером пор 1.2–7.2 нм путем варьирования условий синтеза. Обнаружена зависимость сорбционной емкости образцов (на примере тиамина гидрохлорида) от свойств поверхности цеолитов, а именно от концентрации Льюисовских кислотных центров (ЛКЦ) с pKa 14.2. Зависимости сорбционной способности образцов от их пористо-текстурных характеристик обнаружено не было.
ВВЕДЕНИЕ
Цеолиты широко используют в качестве ионообменников, в процессах разделения и адсорбции, селективных гетерогенных катализаторов в нефтехимической и тонкой химической промышленности, а также в медицине в качестве носителей для доставки лекарственных веществ [1–3].
Широкий спектр применений, упомянутый выше, связан с их превосходной стабильностью, однородной кристаллической структурой, большой площадью поверхности, ионообменными свойствами, селективностью и силой кислотных центров [4].
Поры диаметром менее 2 нм, присутствующие в цеолитах, ограничивают доступ к активным центрам, расположенным внутри цеолитных зерен и вызывают диффузионные ограничения. Микропоры ограничивают применение цеолитов в реакциях с участием крупных молекул, размеры которых схожи или больше размеров пор цеолитов.
Одним из возможных способов преодоления этого недостатка у цеолитов, с сохранением их химических свойств, является получение цеолитов с иерархической структурой пор, которые при этом сохранят основные свойства и характеристики микропористых образцов. Иерархических цеолиты – это цеолиты, которые помимо микропор содержат дополнительные поры большего размера (мезопоры)11. К настоящему моменту времени было предпринято много усилий для разработки стратегий синтеза иерархических цеолитов [5–12]. Создание дополнительной мезопористости в цеолитах для повышения их эффективности может быть достигнуто различными подходами. Некоторые из наиболее часто применяемых: десиликация или деалюминация, синтез с двумя темплатами, жесткие темплатные методы, перекристаллизация аморфных материалов, сборка цеолитных нанокристаллов и расслаивание слоистых цеолитов [4, 12].
В качестве объекта исследования был выбран цеолит Beta – запатентованный материал компании Mobil, впервые синтезированный в 1967 г. Надлингером, Керром и Росински, который является одним из наиболее широкопористых цеолитов. Его структура состоит из двух полиморфных форм, имеющих трехмерную систему взаимосвязанных 12-членных кольцевых каналов.
В данном исследовании для синтеза иерархических цеолитов Beta выбран прямой синтез с использованием двух структурообразующих агентов. Это простой, одностадийный процесс получения иерархических цеолитов, исключающий необходимость постсинтетической модификации. Впервые этот метод упоминается в [13], где было показано, что катионный полимер полидиалилдиметиламмония хлорид (PDDAC) в присутствии гидроксида тетраэтиламмония (TEAOH), позволяет синтезировать мезопористый цеолит Beta [14]. Исследовано влияние условий синтеза цеолитов Beta на пористо-текстурные характеристики, а также влияние свойств поверхности на сорбционные свойства образцов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества и реагенты. Для синтеза цеолита использовали реактивы высокой чистоты (Sigma-Aldrich): гидроксид калия (45 мас. % водный раствор), гидроксид натрия (50 мас. % водный раствор), натрий едкий (98 мас. % в чешуйках) гидроксид алюминия, силикатный золь (LUDOX HS-40, 40 мас. %), тетраэтиламмония гидроксид (35 мас. % водный раствор), алюминат натрия (Al2O3 50–51 мас. %, Na2O 40–45 мас. %, Fe2O3 0.05 мас. %) и полидиаллилдиметиламмония хлорид (20 мас. %, M = 100 000–200 000).
Все реагенты использовали без дополнительной очистки. Для проведения экспериментов применяли деионизированную воду с удельной проводимостью не более 0.2 мкСм/см, прошедшую обработку в системе “Водолей” (НПП Химэлектроника).
Синтез мезопористых цеолитов Beta. Для синтеза мезопористого цеолита Beta использовали две методики гидротермального синтеза.
В первом случае (состав I) синтез цеолита Beta проводили с использованием методики, описанной в [15]. К исходному гелю состава 97Na2O · 1.0K2O · 12.5(ТЕА)2O · 1.0Al2O3 × × 50SiO2 · 750H2O добавляли 1 г PDDAC. Кристаллизация полученных гелей осуществляли в стальных автоклавах объемом 30 мл (коэффициент заполнения 0.7) при температуре 140°С в течение 48 ч.
Во втором случае (состав II) синтез проводили с использованием методики, описанной в [16]. Готовили гель состава 2.2Na2O · Al2O3 · 40SiO2 · 4.6(TEA)2O · 444H2O. Алюминат и гидроксид натрия растворяли в деионизированной воде и перемешивали при температуре 25°С в течение 40 мин. Раствор нагревали в конвекционной печи до 70–90°С в течение 50 мин. После того как раствор охладили до комнатной температуры к нему добавили TEAOH, PDDAС, диоксид кремния, перемешивали до однородности, после чего осуществляли кристаллизацию полученных гелей в стальных автоклавах объемом 30 мл (коэффициент заполнения 0.7) при температуре 150°С в течение 312 ч. К готовому гелю добавляли определенное количество PDDAC (см. табл. 1).
Таблица 1.
Условия синтеза образцов
| Образец | Si/Al | PDDAC, г | TEAOH, г | Условия гидротермального синтеза | Старение |
|---|---|---|---|---|---|
| 1.97Na2O · 1.00K2O · 12.5(TEA)2O · Al2O3 · 50SiO2 · 750H2O | |||||
| 1 | 44 | 0 | 25.6 | 96 ч, 140°С | 2 ч |
| 2 | 24 | 1 | 24.6 | 96 ч, 140°С | 2 ч |
| 2.2Na2O · Al2O3 · 40SiO2 · 4.6(TEA)2O · 444H2O | |||||
| 3 | 44 | 0 | 12.6 | 312 ч, 150°С | Нет |
| 4 | 29 | 1 | 11.6 | 312 ч, 150°С | Нет |
| 5 | 31 | 6.4 | 6.4 | 312 ч, 150°С | Нет |
| 1.1Na2O · Al2O3 · 40SiO2 · 4.6(TEA)2O · 444H2O | |||||
| 6 | 26 | 6.4 | 6.4 | 312 ч, 150°С | Нет |
С целью удаления остатков органических и полимерных молекул цеолиты подвергали ступенчатой термообработке при 350 и 500°С с выдержкой в течение 4 ч на каждой ступени и скоростью нагрева 2°С/мин.
Получение H-формы. Перед проведением исследований образцы декатионировали путем обработки в 0.5 М растворе соляной кислоты в течении 10 мин. Образцы промывали дистиллированной водой и сушили при 120°С в течение 8 ч.
Метод обмена щелочного катиона, компенсирующего отрицательный заряд каркаса цеолита на протон для получения H-формы позволяет увеличить пористое пространство и, соответственно, сорбционную емкость цеолитов за счет того, что размер протона на 5 порядков меньше размера любого щелочного катиона. Цеолиты в водородной форме обладают высокой каталитической активностью и способностью к обмену водорода на другие катионы.
Методы исследования. Рентгенофазовый анализ синтезированных образцов проводили с использованием порошкового дифрактометра D8-Advance (Bruker), CuKα-излучение, в диапазоне 2θ = 5°–70°.
Химический анализ образцов на содержание Si и Al выполнен методом комплексометрического титрования. Содержание щелочных катионов определяли методом пламенной фотометрии, используя атомно-адсорбционный спектрофотометр серии iCE3000.
Количественный анализ распределения кислотно-основных центров на поверхности исследуемых образцов проводили спектрофотометрическим методом с использованием адсорбции индикаторов из водных сред [17, 18].
Измерение сорбционной емкости синтезированных образцов проводили сорбционно-фильтрационным методом по отношению к тиамину гидрохлориду (витамин B1). Перед проведением процесса сорбции образцы в H-форме были высушены при 100°С в течении 8 ч, с целью удаления молекулярной воды из пор композита. 100 мг образца добавляли к 20 мл водного раствора тиамина гидрохлорида и перемешивали в течении 4 ч при температуре 50°С. Далее суспензию фильтровали и определяли концентрацию тиамина в фильтрате с использованием спектроскопии поглощения в УФ области спектра (спектрофотометр LEKI SS2109UV) по величине оптической плотности при длине волны 242 нм. Количество адсорбированного тиамина рассчитывали по формуле:
где C0 и Ct – концентрации тиамина в растворе в начальной точке t = 0 и в момент t, V – объем раствора, m – масса адсорбента. Измерения проводили в кювете с длиной оптического пути 5 мм [19].Для измерения пористо-текстурных характеристик синтезированных образцов применяли метод капиллярной конденсации азота с использованием анализатора Quantachrome NOVA 1200e [20]. Для расчета объема микропор образцов, в которых присутствуют как микро-, так и мезопоры использован t – метод Хэлси (Vt). Диаметр пор для цеолитов с иерархической структурой пор определяли по методу Баррета–Джойнера–Халенды (БДХ) (DBJH) для определения мезопор. Метод БДХ не применим для исследования микропористых структур, метод Дубинина–Астахова (DDA) использовали для определения микропор.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтезированные цеолиты Beta, отличаются составом, содержанием органического и полимерного катионов (TEAOH и PDDAC), а также условиями гидротермального синтеза (температура и время) (табл. 1). В таблице приведены значения силикатного модуля для образцов, полученных методом энерго-дисперсионного анализа. По результатам анализа можно сделать вывод, что добавление PDDAC к исходному гелю приводит к значительному снижению содержания атомов алюминия и кремния в структуре цеолитов.
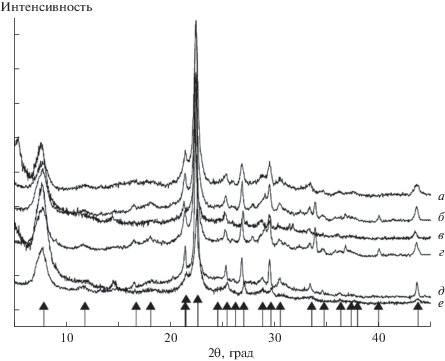
На рис. 1 представлены рентгенограммы синтезированных образцов, которые показывают, что полученные цеолиты со структурой Beta [21] являются однофазными.
Рис. 1.
Рентгеновские дифрактограммы синтезированных образцов: 1 (а), 2 (б), 3 (в), 4 (г), 5 (д), 6 (е). ▲ – штрих-диаграмма стандарта Beta.
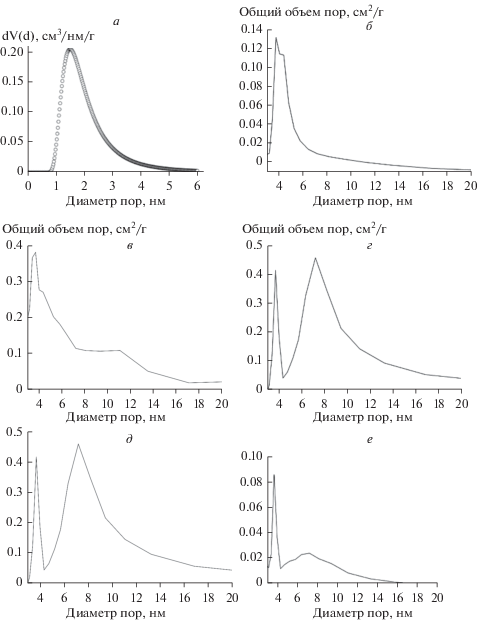
На рис. 2, а–е изображены изотермы низкотемпературной адсорбции-десорбции азота. Изотерма а на рис. 2, соответствует микропористому цеолиту Beta и относится к I типу по классификации ИЮПАК. Изотермы б–е на рис. 2, относятся к IV типу. Наличие петли гистерезиса говорит о присутствии мезопор в структуре цеолитов. В табл. 2 приведены значения объема и диаметра пор для декатионированных образцов. Средний диаметр пор для образцов 1–6 составляет 1.20–7.27 нм.
Рис. 2.
Изотермы адсорбции–десорбции азота образцов: 1 (а), 2 (б), 3 (в), 4 (г), 5 (д), 6 (е). ⚪ – адсорбция, □ – десорбция.
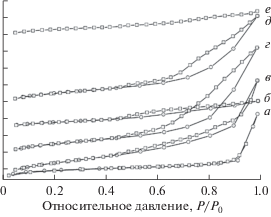
Таблица 2.
Пористо-текстурные и сорбционные характеристики цеолитов Beta
| Образец | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Vt, см3/г | 0.164 | 0.113 | 0.159 | 0.039 | 0.070 | 0.293 |
| DBJH, нм | – | 3.80 | 3.77 | 6.53 | 7.27 | 3.76 |
| DDA, нм | 1.20 | 1.70 | 1.96 | 2.12 | 2.06 | 1.34 |
| Сорбционная емкость, мг/г | 170 | 46 | 90 | 46 | 90 | 120 |
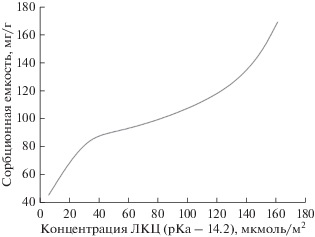
На рис. 3 представлен спектр распределения кислотно-основных свойств на поверхности синтезированных образцов. Поверхность цеолитов содержит многочисленные центры различной природы: Льюисовские кислотные центры (ЛКЦ), образованные атомами Al, Si, Льюисовские основные центры (ЛОЦ), соответствующие атомам кислорода и Бренстедовские кислотные центры (БКЦ), которые характерны для гидроксильных групп. В табл. 3 приведены значения по количественному содержанию активных центров на поверхности.
Таблица 3.
Кислотно-основные центры на поверхности цеолитов Beta
| Образец | Q, мкмоль/г | ||||
|---|---|---|---|---|---|
| ЛКЦ, pKa | БКЦ, pKa | ЛОЦ, pKa | |||
| 14.2 | 5 | 2.5 | –0.9 | –4.4 | |
| 1 | 161 | 27 | 54 | 18 | 17 |
| 2 | 6 | 8 | 37 | 13 | 91 |
| 3 | 54 | 80 | 56 | 12 | 37 |
| 4 | 6 | 38 | 82 | 23 | 32 |
| 5 | 32 | 14 | 77 | 21 | 57 |
| 6 | 136 | 5 | 126 | 19 | 55 |
Анализ пористо-текстурных, сорбционных и поверхностных свойств цеолитов выявил зависимость сорбционных характеристик от концентрации ЛКЦ с pKa 14.2 на поверхности цеолитов Beta (рис. 4). Образцы 2, 4, 3, 5, 6, 1 с концентрацией ЛКЦ – 6, 6, 32, 54, 120, 171 мкмоль/г имеют следующие значения сорбционной емкости по тиамину: 46, 46, 90, 90, 120, 170 мг/г (рис. 4). Образцы 1 и 6 обладают близкими значениями сорбционной емкости (рис. 5) и концентрацией ЛКЦ. Это говорит о том, что синтезированный цеолит Beta с иерархической структурой пор (образец 6) обладает свойствами и характеристиками микропористого цеолита Beta, при этом обладает дополнительной мезопористостью, что расширяет область его применения.
ЗАКЛЮЧЕНИЕ
Гидротермальный синтез с использованием двух структуро-направляющих агентов: катионного полимера полидиалилдиметиламмония хлорида и гидроксида тетраэтиламмония, в качестве структуро-направляющего агента, позволяет получить цеолиты Beta с иерархической структурой пор, размер которых составляет 1.2–7.2 нм в зависимости от условий синтеза. Добавление в исходный гель PDDAC перед кристаллизацией цеолита Beta приводит к уменьшению силикатного модуля по сравнению с аналогичным цеолитом Beta, полученного без добавления PDDAC. Сорбционная емкость по тиамину гидрохлориду цеолитов Beta возрастает по мере увеличения концентрации Льюисовских кислотных центров с pKa 14.2 на поверхности цеолитов Beta. Проведенные исследования позволяют считать данные материалы перспективными для адсорбционных и каталитических процессов с участием как небольших, так и крупных молекул.
Список литературы
Golubeva O.Y., Brazovskaia E.Y., Alikina Y.A., D’yachenko S.V, Zhernovoi A.I. Synthesis and Study of Nanocomposites Based on Beta Zeolite and Magnetite for Targeted Drug Delivery // Glass Phys. Chem. 2019. V. 45. № 1. P. 66–73.
Golubeva O.Y., Brazovskaya E.Y., Ul’yanova N.Y., Morozova Y.A. Development of Approaches for Designing and Preparing Magnetic Nanocomposites Based on Zeolite Beta and Magnetite Nanoparticles under Hydrothermal Conditions // Glass Phys. Chem. 2018. T. 44. № 2. P. 108–114.
Stefan Grund, Tristan Doussineau, Dagmar Fischer, Gerhard J. Mohr Mitoxantrone-loaded zeolite beta nanoparticles: Preparation, physico-chemical characterization and biological evaluation // J. Colloid Interface Sci. 2012. V. 365. № 1. P. 33–40.
Fernandez S., Ostraat M. L., Lawrence J. A., Zhang K. AC SC. Tailoring the Hierarchical Architecture of Beta Zeolites using Base Leaching and Pore-Directing Agents // Microp. Mesop. Mater. 2018. V. 263. P. 201–209.
Rutkowska M., Duda M., Macina D., Górecka S., Dębek R., Moreno J. M., Chmielarz L. Mesoporous Beta zeolite functionalisation with FexCry oligocations; catalytic activity in the NH3 SCO process // Microp. Mesop. Mater. 2019. V. 278. P. 1–13.
Xu L., Wu P. Diversity of layered zeolites: from synthesis to structural modifications // New J. Chem. 2016. V. 40. № 5. P. 3968–3981.
Diaz U., Corma A. Layered zeolitic materials: an approach to designing versatile functional solids // Dalton Trans. 2014. V. 43. № 27. P. 10292–10316.
Millini R., Bellussi G. Hybrid organic–inorganic zeolites: status and perspectives // Catal. Sci. Technol. 2016. V. 6. № 8. P. 2502–2527.
Roth W.J., Gil B., Makowski W., Marszalek B., Eliasova P. Layer like porous materials with hierarchical structure // Chem. Soc. Rev. 2016. V. 45. № 12. P. 3400–3438.
Beaumont M., Kondor A., Plappert S., Mitterer C., Opietnik M., Potthast A., Rosenau T. Surface properties and porosity of highly porous, nanostructured cellulose II particles // Cellulose. 2016. V. 24. № 1. P. 435–440.
Garcı J., Thommes M. Recent advances in the textural characterization of hierarchically structured nanoporous materials // Chem. Soc. Rev. 2017. V. 46. P. 389–414.
Serrano D.P., Escola J.M., Pizarro P. Synthesis strategies in the search for hierarchical zeolites // Chem. Soc. Rev. 2013. V. 42. № 9. P. 4004–4035.
Xiao F.-S., Wang L., Yin C., Lin K., Di Y., Li J., Tatsumi T. Catalytic Properties of Hierarchical Mesoporous Zeolites Templated with a Mixture of Small Organic Ammonium Salts and Mesoscale Cationic Polymers // Angew. Chem. 2006. V. 45. № 19. P. 3090–3093.
Moller K., Yilmaz B., Müller U., Bein T. Hierarchical Zeolite Beta via Nanoparticle Assembly with a Cationic Polymer // Chem. Mater. 2011. V. 23. № 9. P. 4301–4310.
Golubeva O.Yu., Ulyanova N.Yu., Yakovlev A.V. Synthesis of zeolite with paulingite structure // Glass Phys. Chem. 2015. V. 41. № 4. P. 413–416.
Tamer Nadir Hakan. Synthesis and characterization of zeolite Beta. Thesis for the degree of Master of Science in Chemical Engineering. Ankara. 2006. P. 80.
Zakharova N.V., Sychev M.M., Korsakov V.G. Myakin S.V. Evolution of donor-acceptor centers // Kondens. Sredy Mezhfaz. Granitsy. 2011. V. 13. № 1. P. 56–62.
Сычев М. М., Минакова Т.С., Слижов Ю.Г., Шилова О.А. Кислотно-Основные характеристики поверхности твердых тел и управление свойствами материалов и композитов. СПб.: Химиздат, 2016. 276 с.
Golubeva O.Yu., Pavlova S.V. Adsorption of thiamine hydrochloride (vitamin b1) by synthetic layered silicates with a montmorillonite structure // Glass Phys. Chem. 2014. V. 40. № 3. P. 375–379.
Peter Klobes, Klaus Meyer, Ronald G. Munro. Measurement of surface area and porosity by method of nitrogen capillary condensation. Methodical Guide. 2006. 89 p.
Treacy M.M.J., Higgins J.B. Collection of Simulated XRD Powder Patterns for Zeolites. Fifth Edition. Amsterdam: Elsevier, 2001. 586 p.
Дополнительные материалы отсутствуют.
Инструменты
Физика и химия стекла