Физика и химия стекла, 2020, T. 46, № 3, стр. 270-280
Адсорбция ионов железа(III) на пористых стеклах с различной структурой порового пространства
А. С. Кузнецова 1, 2, *, Л. Э. Ермакова 1, Т. В. Антропова 2, А. В. Волкова 1, Л. Н. Куриленко 2
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
2 Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
* E-mail: a_kuznetsova95@mail.ru
Поступила в редакцию 23.12.2019
После доработки 16.01.2020
Принята к публикации 05.02.2020
Аннотация
Исследована адсорбция ионов железа из растворов хлорида железа(III) с концентрацией 10–4–10–3 М при рН 3 на микро- и макропористых стеклах, а также на термообработанных при 750°С микропористых стеклах, полученных из двухфазного натриевоборосиликатного стекла. Установлено, что величины адсорбции при постоянной концентрации раствора хлорида железа являются функцией структурных параметров ПС. Показано, что изотермы адсорбции Фрейндлиха и Ленгмюра могут быть использованы для анализа экспериментальных данных, найдены константы этих изотерм. В исследованных системах адсорбция преимущественно происходит по монослойному механизму.
ВВЕДЕНИЕ
Решение проблем очистки сточных вод от загрязнений, в том числе соединениями металлов, и создание производств замкнутого цикла являются в настоящее время одними из наиболее важных экологических задач. Среди широко используемых и экономически оправданных методов удаления ионов тяжелых металлов из промышленных стоков выделяется простой в использовании адсорбционный метод. В связи с этим, высоки требования к адсорбентам, использующимся в реальных технологических процессах – это большая сорбционная емкость, невысокая стоимость, экологическая безопасность. К таким адсорбентам относятся или природные материалы (глины, апатит [1]), или материалы, которые можно получить из широко распространенных в природе соединений. Примером таких адсорбентов являются пористые стекла, обладающие широким спектром возможностей их использования, в том числе и в качестве адсорбентов [2], уникальные свойства которых обусловлены разветвленной системой пор нанометрового размера, параметры которых можно регулировать разными способами [3–5]. Отработка методов очистки жидких сред от ионов железа является весьма актуальной как в связи с тем, что соединения железа, как правило, являются одним из компонентов сточных вод, так и в связи с тем, что очень мала предельно допустимая концентрация ионов железа в воде 5.35 × 10–6 М. Проведенные нами предварительные исследования [6] показали, что в области исходных концентраций растворов хлорида железа С0 < 8 × 10–4 М даже при малом времени контакта адсорбента с раствором (30 мин) степени извлечения железа из раствора хлорида достаточно высоки и достигают 0.86 в самом разбавленном растворе. Представляло интерес как расширить круг исследуемых пористых стеклянных адсорбентов, так и изменить условия проведения адсорбционных измерений. Поэтому целью данной работы являлось исследование адсорбционных свойств пористых стекол с различной структурой порового пространства (микро- и макропористые) в растворах хлорида железа(III) в области концентраций С0 10–4–10–3 М при времени контакта адсорбента с растворов составлявшим 1 сут.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования были выбраны пористые стекла, полученные из двухфазного натриевоборосиликатного стекла марки 8В-НТ состава (мол. %): 6.73Na2O · 18.28B2O3 · 74.93SiO2 · 0.06Al2O3 [7]. Исходное стекло было сварено при температуре 1550°С в заводских условиях. Для формирования двухкаркасной структуры стекло было подвергнуто термической обработке при 550°С в течение 144 ч. В лабораторных условиях заводское стекло гомогенизировали, превращая его в однофазное при 800–815°С, и снова подвергали стандартной термообработке для достижения фазового равновесия [8]. Плотность двухфазного стекла, определенная методом гидростатического взвешивания в воде при 20°С, составила 2.256 г/см3.
Исследование структуры аналогичного двухфазного стекла методом просвечивающей электронной микроскопии (ПЭМ) показало, что в результате тепловой обработки формируется двухкаркасная структура [9]. Микропористые [10] стекла были получены из образцов толщиной 0.1 см путем выщелачивания в 3 М растворе азотной кислоты при кипячении в течение 6 ч. Выбранное время выщелачивания примерно в два раза превышает время смыкания прорабатываемых слоев [9]. Полученные образцы промывали в дистиллированной воде при комнатной температуре в течение 4–5 сут, затем сушили при 120°С в течение 1 ч (пористое стекло 8В-НТ МИП). Микропористые образцы в течение часа были подвергнуты дополнительной термообработке при 750°С (пористое стекло 8В-НТ-750 МИП). Часть полученных образцов 8В-НТ МИП была использована для получения макропористых стекол [10] путем обработки 0.5 М раствором КОН при 20°С в течение 4 ч с последующей отмывкой в дистиллированной воде при комнатной температуре в течение 1 сут и высушиванием на воздухе при 120°С в течение 1 ч (пористое стекло 8В-НТ МАП).
Для пластин микро- и макропористых стекол весовым методом [8] была определена объемная пористость W. Исследования адсорбционных свойств ПС проводили на порошках пористых стекол, полученных с помощью перетирания пластин в агатовой ступке. Примеры СЭМ изображений полученных частиц приведены на рис. 1, 2. Величины удельных поверхностей S0 полученных порошков ПС были измерены методом БЭТ по тепловой десорбции азота с хроматографической регистрацией. Из значений S0 были оценены величины средних радиусов пор в предположении о том, что для частиц ПС микронного и более размера, что соответствует условиям проведения эксперимента, подавляющий вклад в величину удельной поверхности вносят поровые каналы [8]:
(2)
${{r}_{{{{S}_{{\text{0}}}}}}} = \frac{{2W}}{{\left( {1 - W} \right){{{\rho }}_{{{\text{ст}}}}}{{S}_{0}}}}.$Рис. 1.
СЭМ изображения частиц микропористого стекла 8В-НТ МИП (3М НNO3): изображение пробы суспензии (а), изображение субмикронных частиц (б).

Рис. 2.
СЭМ-изображения частиц макропористого стекла 8В-НТ МАП (3М НNO3 + 0.5М KOH): изображение пробы суспензии (а), изображение субмикронных частиц (б).

Для исследования адсорбции ионов железа были приготовлены растворы хлорида железа(III) различной концентрации (C) в интервале 10–4–10–3 М. Для поддержания постоянного состава гидролизованных форм ионов железа в исходных растворах хлорида железа [11] исследования адсорбционных характеристик ПС проводили при фиксированном значении рН 3.0 ± 0.1, которое создавали с помощью 0.1 М раствора соляной кислоты.
Для определения величин адсорбции Fe(III) навески ПС (m, табл. 1) помещали в 40 мл раствора (V) заданной концентрации. Полученные дисперсии перемешивали в течение нескольких часов. Навеску подбирали таким образом, чтобы суммарная поверхность адсорбента в пробе была примерно одинаковой для всех исследованных ПС (в нашем случае эта величина составляла 8–9 м2). Адсорбент из проб удаляли через 24 ч путем центрифугирования (ELMI CM-50 centrifuge). Концентрации железа(III) в растворах до (С0) и после адсорбции (С) были определены в ИХС РАН методом атомно-абсорбционной спектроскопии при помощи спектрометра “AA Spectrometer iCE 3000” фирмы Thermo scintific и в Ресурсном центре СПбГУ “Методы анализа состава вещества” с помощью спектрометра Shimadzu_AA-7000. Величины адсорбции рассчитывали как по отношению к массе адсорбента (x/m, моль/г), так и на единицу площади поверхности адсорбента (моль/см2):
Таблица 1.
Структурные параметры пористых стекол и величины навесок ПС при проведении адсорбционных измерений
| Пористое стекло | W | S0, м2/г | ${{r}_{{{{{\text{S}}}_{{\text{0}}}}}}}$, нм | m, мг |
|---|---|---|---|---|
| 8В-НТ МИП (3М НNO3) | 0.24 | 219 | 1.3 | 40 |
| 8В-НТ-750 МИП (3М НNO3) | 0.16 | 57 | 3.1 | 160 |
| 8В-НТ МАП (3М НNO3 + 0.5М KOH) | 0.58 | 100 | 12.7 | 80 |
Из экспериментальных данных были рассчитаны величины степени эффективности адсорбции ионов железа пористыми частицами:
Кроме измерений концентраций железа в жидкой фазе, для образцов ПС 8В-НТ-750 МИП (3М НNO3) и 8В-НТ МАП (3М НNO3 + 0.5М KOH) было определено содержание железа в самих пористых частицах после контакта с растворами хлорида железа. Отцентрифугированные порошки ПС были промыты по 2 раза 10 мл бидистиллированной воды на воронке Бюхнера и высушены в сушильном шкафу при температуре 120°С в течение 1 ч. Измерения содержания железа в порошках ПС были выполнены в ИХС РАН.
Содержание железа в исходном стекле 8В-НТ по данным рентгенофлуоресцентного анализа (Energy Dispersive X-Ray Fluorescence Spectrometer Shimadzu EDX-800P, Ресурсный центр СПбГУ “Методы анализа состава вещества”) составляло 0.15 мг в 1 г пористого стекла. Это, в пересчете на количество молей железа в 1 г стекла (p0), соответствует величине p0 = 2.69 × 10–6 моль/г.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Найденные значения структурных параметров исследованных образцов пористых стекол приведены в табл. 1. Видно, что наименьшие значения объемной пористости и удельной поверхности наблюдаются для микропористого стекла 8В-НТ-750 МИП (3М НNO3). По-видимому, термообработка ПС при 750°С приводит к исчезновению наиболее тонких пор и к уплотнению структуры вторичного кремнезема в поровом пространстве. В свою очередь, это вызывает рост размеров поровых каналов – величины средних радиусов пор для 8В-НТ-750 МИП (3М НNO3) почти в 2.5 раза превышают таковые для микропористых стекол 8В-НТ МИП (3М НNO3), полученных по стандартной методике. Соотношение структурных характеристик микро- и макропористых стекол 8В-НТ согласуется с ранее полученными для аналогичных образцов результатами [8].
Зависимости степени эффективности извлечения ионов железа пористыми частицами исследованных ПС представлены на рис. 3. В исследованном интервале концентраций степень эффективности не превышает 0.5 и уменьшается по мере увеличения исходной концентрации раствора FeCl3 для всех ПС. Видно также, что при C0 = const значения α растут с увеличением среднего радиуса пор.
Рис. 3.
Зависимости степени эффективности извлечения ионов железа от исходной концентрации растворов FeCl3: 8В-НТ МИП (3М НNO3) (1), 8В-НТ-750 МИП (3М НNO3) (2), 8В-НТ МАП (3М НNO3 + + 0.5М KOH) (3).

Изотермы адсорбции ионов железа(III) на пористых стеклах приведены на рис. 4, 5.
Рис. 4.
Зависимости адсорбции ионов железа в расчете на единицу массы адсорбента от равновесной концентрации растворов FeCl3: 8В-НТ МИП (3М НNO3) (1), 8В-НТ-750 МИП (3М НNO3) (2), 8В-НТ МАП (3М НNO3 + 0.5М KOH) (3).

Рис. 5.
Зависимости адсорбции ионов железа в расчете на единицу поверхности адсорбента от равновесной концентрации растворов FeCl3: 1 – 8В-НТ МИП (3М НNO3), 2 – 8В-НТ-750 МИП (3М НNO3), 3 – 8В-НТ МАП (3М НNO3 + 0.5М KOH).
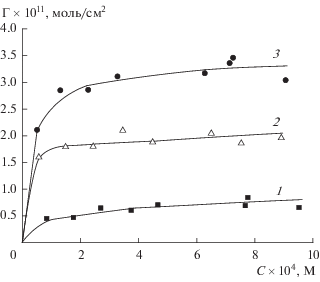
Анализ экспериментальных данных показал, что значения x/m при одинаковой равновесной концентрации С располагаются в соответствии с объемными пористостями ПС – с ростом значений W возрастают и величины x/m, относящиеся к единице массы адсорбента. В исследованном концентрационном интервале для термообработанных МИП стекол адсорбция незначительно возрастает с ростом равновесной концентрации (рис. 4), тогда как для не подвергавшихся термообработке МИП и МАП стекол наблюдается заметный рост значений x/m – в 1.9 и 1.6 раза для 8В-НТ МИП (3М НNO3) и 8В-НТ МАП (3М НNO3 + 0.5М KOH) соответственно. Величины адсорбции Γ, рассчитанные на единицу поверхности адсорбента (рис. 5), располагаются в соответствии размерами поровых каналов ПС – чем больше величина среднего радиуса пор ${{r}_{{{{{\text{S}}}_{{\text{0}}}}}}}{\text{,}}$ тем больше величина Γ. Наблюдаемая закономерность связана с влиянием двух факторов. Во-первых, с возрастанием размеров поровых каналов облегчается доступ одноименно заряженных ионов железа к поверхности пор, и, во-вторых, при увеличении размера пор растет и отрицательный поверхностный заряд ПС [12], что также вызывает рост адсорбции противоионов железа.
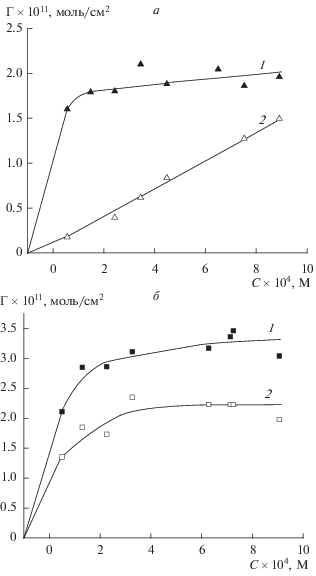
Результаты определения содержания железа в пористом стекле (p, моль/г сухого ПС) после отмывки частиц, находившихся в адсорбционном равновесии с растворами хлорида железа, были использованы для расчета количества молей железа, оставшегося на поверхности ПС в предположении, что все оставшееся после отмывки железо равномерно распределено как по внешней поверхности частицы, так и по поверхности поровых каналов. С учетом содержания железа в исходном стекле 8В-НТ, найдем величины ${{(p - {{p}_{0}})} \mathord{\left/ {\vphantom {{(p - {{p}_{0}})} {{{S}_{0}}}}} \right. \kern-0em} {{{S}_{0}}}},$ которые будут иметь размерность адсорбции Γ. Найденные таким образом величины являются аналогом необратимой адсорбции. Сопоставление полученных результатов с равновесными значениями адсорбции железа, найденными обычным методом, представлено на рис. 6. Видно (рис. 6а), что для микропористого стекла 8В-НТ-750 МИП (3М НNO3) большая часть адсорбированного железа смывается – от 90% в самом разбавленном растворе до 75% в самом концентрированном. По-видимому, в этом случае значительная часть адсорбированного железа находится на внешней поверхности частиц, поскольку дебаевский радиус ионной атмосферы в исследованном диапазоне составов жидкой фазы составляет 7.6–3.5 нм и проникновение ионов железа в поровое пространство (${{r}_{{{{{\text{S}}}_{{\text{0}}}}}}}$ = 3.1 нм) действительно затруднено. Для макропористого стекла 8В-НТ МАП (3М НNO3 + 0.5М KOH) (рис. 6б) количество смытого железа составляет 33–36% от равновесной величины Γ, что свидетельствует о том, что преимущественное количество адсорбированных ионов железа находится в поровом пространстве. Полученные результаты подтверждают выводы, сделанные при анализе зависимостей Γ–C.
Рис. 6.
Зависимости адсорбции ионов железа в расчете на единицу поверхности адсорбента от равновесной концентрации растворов FeCl3. 8В-НТ-750 МИП (3М НNO3), равновесные значения (1); 8В-НТ-750 МИП (3М НNO3) (2), после отмывки поверхности (а); 8В-НТ МАП (3М НNO3 + 0.5М KOH), равновесные значения (1), 8В-НТ МАП (3М НNO3 + 0.5М KOH), после отмывки поверхности (2) (б).
Полученные экспериментальные данные были также проанализированы в рамках классических представлений об адсорбции на твердых адсорбентах – изотерм Фрейндлиха и Ленгмюра [13].
Уравнение Фрейндлиха имеет вид:
(5)
$\frac{x}{m} = K{{C}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} n}} \right. \kern-0em} n}}}},$В нашем случае при расчетах величины С и x/m брали в миллимолях на литр и миллимолях на грамм соответственно.
Для нахождения величин предельной адсорбции ${{\Gamma }_{\infty }}$ и констант адсорбционного равновесия k в рамках теории адсорбции Ленгмюра используют линеаризованный вид изотермы адсорбции:
(9)
$\frac{C}{{\Gamma }} = \frac{{\text{1}}}{{{{{\Gamma }}_{\infty }}k}} + \frac{{\text{1}}}{{{{{\Gamma }}_{\infty }}}}C.$Линеаризованные экспериментальные зависимости в координатах Фрейндлиха и Ленгмюра приведены на рис. 7, 8. Найденные константы изотерм адсорбции приведены в табл. 2. Анализ полученных результатов показывает, что в исследованном концентрационном интервале для всех ПС экспериментальные результаты достаточно хорошо описываются как в рамках эмпирической изотермы Фрейндлиха, так и в рамках теории монослойной адсорбции Ленгмюра. Сопоставление найденных из экспериментальных данных констант, входящих в уравнения Фрейндлиха и Ленгмюра, показывает, что все они изменяются в соответствии с изменениями в структуре порового пространства ПС и в согласии с закономерностями изменений самих величин адсорбции. Адсорбция железа на ПС происходит преимущественно с образованием монослоя адсорбата, подтверждается найденными величинами предельной адсорбции ${{\Gamma }_{\infty }},$ которые возрастают с увеличением размеров поровых каналов, оставаясь при этом на 1–2 порядка меньше, чем максимально возможные значения величин адсорбции противоионов на кремнеземной поверхности (7.6–10 × 10−10 моль/см2), которые определяются количеством силанольных групп (4.6–6 групп на 1 нм2) [14–17].
Рис. 7.
Линеаризованные изотермы Фрейндлиха: 8В-НТ МИП (3М НNO3) (1), 8В-НТ-750 МИП (3М НNO3) (2), 8В-НТ МАП (3М НNO3 + 0.5М KOH) (3).

Рис. 8.
Линеаризованные изотермы Ленгмюра: 8В-НТ МИП (3М НNO3) (1), 8В-НТ-750 МИП (3М НNO3) (2), 8В-НТ МАП (3М НNO3 + 0.5М KOH) (3).

Таблица 2.
Константы изотерм Фрейндлиха и Ленгмюра для исследованных пористых стекол
| Пористое стекло | K, ${\text{мол}}{{{\text{ь}}}^{{(1 - 1/n)}}}{{{\text{л}}}^{{1/n}}}{{{\text{г}}}^{{ - 1}}}$ |
1/n | k, л/моль | Γ∞, моль/см2 |
|---|---|---|---|---|
| 8В-НТ МИП (3М НNO3) | 1.6 × 10–5 | 0.22 | 1.6 × 104 | 7.7 × 10–12 |
| 8В-НТ-750 МИП (3М НNO3) | 1.1 × 10–5 | 0.07 | 7.6 × 104 | 2.0 × 10–11 |
| 8В-НТ МАП (3М НNO3 + 0.5М KOH) | 3.5 × 10–5 | 0.14 | 4.5 × 104 | 3.3 × 10–11 |
ЗАКЛЮЧЕНИЕ
Проведено исследование структурных и адсорбционных свойств микро- и макропористых стекол, изготовленных из натриевоборосиликатного стекла 8В-НТ. Установлено, что термообработка микропористого стекла при 750°С приводит к уменьшению объемной пористости и удельной поверхности образца, а также к росту среднего радиуса пор от 1.3 (микропористое стекло, не подвергавшееся термообработке) до 3.1 нм вследствие исчезновения наиболее тонких пор. Измерения адсорбции ионов железа на порошках микро- и макропористых стекол из растворов FeCl3 с исходной концентрацией 1–10 × 10–4 М при постоянном значении рН = 3.0 ± 0.1 показали, что величины адсорбции, при прочих равных условиях, определяются структурными параметрами ПС – объемной пористостью и размерами поровых каналов. Анализ полученных результатов в рамках представлений Фрейндлиха и Ленгмюра показал, что оба типа изотерм удовлетворительно описывают экспериментальные данные и что адсорбция преимущественно является монослойной, о чем свидетельствуют найденные величины ленгмюровской предельной адсорбции.
Работа выполнена при финансовой поддержке РФФИ, гранты 17-03-01011а (в части изучения микро- и макропористых стекол) и 18-03-01206а (в части изучения характеристик термообработанного микропористого стекла). Образцы двухфазных и пористых стекол изготовлены в ИХС РАН в рамках госзадания (тема № 0097-2019-0015). Авторы благодарят И.Н. Анфимову за помощь в получении образцов двухфазных и микропористых стекол.
Исследования проведены с использованием оборудования ресурсных центров Научного парка СПбГУ “Нанотехнологии” и “Методы анализа состава вещества”, “Криогенный отдел”, а также Центра коллективного пользования ИХС РАН “Исследование наночастиц, наноструктур, нанокомпозитов”.
Список литературы
Gongming Qian, Maolin Li, Fei Wang, Xinggang Liu. Removal of Fe3+ from Aqueous Solution by Natural Apatite // J. Surface Eng. Materials and Advanced Technology. 2014. V. 4. P. 14–20.
Enke D., Janowski F., Schwieger W. Porous glasses in the 21st century – a short review // Microporous and Mesoporous Materials. 2003. V. 60. P. 19–30.
Крейсберг В.А., Антропова Т.В., Калинина С.В. Формирование микро- и мезопористой подструктур в процессе выщелачивания двухфазного щелочно-боросиликатного стекла // Физ. и хим. стекла. 2014. Т. 40. № 3. С. 508–513.
Крейсберг В.А., Ракчеев В.П., Антропова Т.В. Соотношение микро– и мезопористой подструктур при удалении коллоидного кремнезема из пористых стекол в процессе щелочной обработки // Коллоид. журн. 2014. Т. 76. № 2. С. 179–188.
Kreisberg V.A., Antropova T.V. Changing the relation between micro–and mesoporosity in porous glasses: The effect of different factors // Microporous and Mesoporous Materials. 2014. V. 190. № 1. P. 128–138.
Кузнецова А.С., Волкова А.В., Ермакова Л.Э., Антропова Т.В. Адсорбция ионов железа(III) на макропористом стекле // Физ. и хим. стекла. 2018. Т. 44. № 1. С. 61–69.
Antropova T., Girsova M., Anfimova I., Drozdova I., Polyakova I., Vedishcheva N. Structure and spectral properties of the photochromic quartz–like glasses activated by silver halides // J. Non-Crystalline Solids. 2014. V. 401. P. 139–141.
Ермакова Л.Э., Антропова Т.В., Волкова А.В., Кузнецова А.С., Гринкевич Е.А., Анфимова И.Н. Структурные параметры мембран из пористого стекла в растворах электролитов, содержащих однозарядные (Na+, K+) и трехзарядные (Fe3+) катионы // Физ. и хим. стекла. 2018. Т. 44. № 4. С. 346–360.
Антропова Т.В., Калинина С.В., Костырева Т.Г., Дроздова И.А., Анфимова И.Н. Особенности процесса получения и структура пористых мембран на основе двухфазных фтор- и фосфорсодержащих натриевоборосиликатных стекол // Физ. и хим. стекла. 2015. Т. 41. № 1. С. 25–41.
Жданов С.П. Пористые стекла и их структура // Wiss.Ztschr. Friedrich–Schiller–Univ., Jena, Math.–Naturwiss. Reihe. 1987. Bd. 36. H. 5/6. S. 817–830.
Пыхтеев О.Ю., Ефимов А.А., Москвин Л.Н. Гидролиз аквакомплексов железа(III) // Журн. прикл. химии. 1999. Т. 72. № 1. С. 11–19.
Волкова А.В., Ермакова Л.Э., Антропова Т.В., Сидорова М.П. Адсорбция потенциалопределяющих ионов на пористых стеклах различного состава // Коллоид. журн. 2010. Т. 72. С. 8–16.
Lyklema J. Fundamentals of interface and colloid science. Vol. II. Solid – liquid interfaces. N San Diego: Academic Press, 2001.
Armistead C.G., Tyler A.J.M., Hambleton F.H., Mitchell S.A., Hockey J.A. The Surface Hydroxylation of Silica // J. Phys. Chem. 1969. V. 73. № 11. P. 3947–3953.
Drzymala J., Leckie J.O., Laskowski J. Surface dissociation constants for solid–aqueous solution systems // Colloid Polymer Sci. 1979. V. 257. № 7. P. 768–772.
Hiemstra T., De Wit J.C.M., van Riemsdijk W.H. Multisite proton adsorption modeling at the solid/solution interface of (hydr)oxides: a new approach. II. Application to various important (hydr)oxides // J. Colloid Interface Sci. 1989. V. 133. № 1. P. 105–117.
Zhuravlev L.T. The surface chemistry of amorphous silica. Zhuravlev model // Colloids and Surfaces A: Physicochem. Eng. Aspects. 2000. V. 173. P. 1–38.
Дополнительные материалы отсутствуют.
Инструменты
Физика и химия стекла


