Физика и химия стекла, 2021, T. 47, № 3, стр. 306-319
Расчет вязкости и теплопроводности стекол на основе системы SiO2–Al2O3–R2O, где R – Na и K c добавками CaO, MgO, FeO при высокой температуре
1 Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский проспект, 4, Россия
2 ООО “ОгнеупорТрейдГрупп”
125028 Москва, ул. Сурикова, 24, Россия
* E-mail: svildanov@mail.ru
Поступила в редакцию 13.11.2020
После доработки 21.12.2020
Принята к публикации 05.02.2021
Аннотация
Рассчитана вязкость и теплопроводность многокомпонентных стеклообразующих оксидных смесей SiO2–MgO–CaO–Al2O3–FeO–K2O–Na2O на основе диоксида кремния. Построены политермы вязкости в температурном интервале 1798–1973 К. Теплопроводность рассчитана при температуре 1823 К. Показано, что вязкость оксидных растворов удовлетворительно описывается соотношением, учитывающим вязкость соответствующих двухкомпонентных систем SiO2–МеxOy. Расчетные формулы для вязкости и теплопроводности получены на основе предположения о наличии в жидкой оксидной фазе только простых катионов металлов и анионов кислорода.
ВВЕДЕНИЕ
В настоящее время все большее распространение, в частности, в металлургии, приобретают неорганические материалы на основе природных кремнеземсодержащих пород, например, перлитов с добавками зол от сжигания энергетических углей; такие смеси будем называть стеклообразующей оксидной смесью [1–3]. Подобные материалы являются основой так называемых теплоизолирующих смесей [4–8]. Результатом действия таких смесей является сохранение физического тепла жидкого металла, находящегося в различных футерованных емкостях, защита его от вторичного окисления кислородом воздуха и ассимиляция нежелательных неметаллических включений в жидком металле. Указанные смеси подают непосредственно на поверхность металлического расплава в порошкообразном состоянии. В процессе взаимодействия с металлическим расплавом неорганические ингредиенты смесей плавятся, образуя оксидные растворы. В твердой фазе такие оксидные растворы будем называть стеклообразующими оксидными растворами, а в жидкой фазе – стеклообразующими расплавами. При этом образуется в общем случае слоевая структура, состоящая из стеклообразующего расплава, двухфазной области и стеклообразующей оксидной смеси. Каждая из образованных фаз выполняет определенную функцию. Стеклообразующий расплав в большей степени выполняет функцию защиты жидкого металла от воздействия окислительной газовой фазы и поглощения неметаллических включений, в меньшей степени выполняет функцию теплоизолятора. Твердая фаза выполняет функцию эффективного теплоизолятора, уменьшающего скорость охлаждения жидкого металла. Важнейшими свойствами таких материалов в жидкой и твердой фазах являются вязкость и теплопроводность. Эти свойства системы SiO2–Al2O3–R2O c добавками СaO, MgO, FeO исследованы недостаточно [9–11].
ВЯЗКОСТЬ
Химический состав (массовая доля, %) стеклообразующих оксидных растворов приведен в табл. 1. Составы выбраны таким образом, что в них увеличивается суммарная концентрация ингредиентов, снижающих вязкость, или, что то же самое, – снижается концентрация SiO2. Диапазон концентраций ингредиентов соответствует данным результатов химического анализа проб, отобранных из промежуточного ковша в зависимости от времени (от момента отбора в начале разливки (состав 1) до завершающего момента разливки (состав 3)).
Таблица 1.
Химический состав стекол, мас. %, по синтезу
| Номер состава | SiO2 | MgO | CaO | Al2O3 | FeO | K2O | Na2O |
|---|---|---|---|---|---|---|---|
| 1 | 77.1 | 0.9 | 0.9 | 13.7 | 0.8 | 3.8 | 2.1 |
| 2 | 75.9 | 1.0 | 1.2 | 14.0 | 1.1 | 3.7 | 2.5 |
| 3 | 74.2 | 1.1 | 1.1 | 15.8 | 1.2 | 3.7 | 2.4 |
Как видно из данных табл. 1, все оксидные растворы представляют собой стеклообразные материалы (стекла). Исследованию вязкости стекол посвящено значительное количество работ. В их числе работы, в которых исследована вязкость чистого диоксида кремния, например, [12–14] и работы, в которых исследована вязкость стекол на основе диоксида кремния [15–18]. Анализ работ показывает, что вязкость стеклообразующих оксидных растворов указанного химического состава в высокотемпературном диапазоне исследована недостаточно [11, 19, 20]. Нами предпринята попытка теоретического расчета вязкости, основанного на экспериментальных данных по вязкости соответствующих двухкомпонентных систем SiO2–MexOy.
Предположим, что вязкость оксидного раствора как функция его химического состава и температуры η(Х, Т) представима в виде произведения двух функций: η(Х) – вязкости, зависящей только от химического состава и η(Т) – вязкости, зависящей только от температуры [21]. Функционально такую зависимость будем искать в виде:
где: $\eta \left( Х \right)$ компонента вязкости, зависящая от состава; $\eta \left( Т \right)$ компонента вязкости, зависящая от температуры.Охарактеризуем химический состав изучаемых оксидных растворов ионной долей соответствующих катионов, поскольку данная система является раствором с общим анионом. Под ионной долей ${{x}_{i}}~$ подразумеваем отношение числа ионов данного сорта ${{n}_{i}}$ к общему числу ионов $\sum\nolimits_{i = 0}^k {{{n}_{i}}} $ того же знака. При таком выражении концентрации, ионная доля анионов кислорода тождественно равна 1.
Зависимость вязкости $\eta \left( Х \right)$ будем искать в виде полинома:
где: ${{a}_{0}}$, …, ${{a}_{n}}$ действительные числа, ${{a}_{0}} \ne 0$; n – целое число.Для вязкости ${{\eta }_{2}}(X)$ 2-х компонентного оксидного раствора и вязкости ${{\eta }_{3}}(X)$ 3-х компонентного оксидного раствора предложенные расчетные формулы принимают вид:
(4)
${{\eta }_{2}}(X) = {{a}_{0}}x_{1}^{2}{{\eta }_{{{\text{11}}\,\,{\text{чист}}{\text{.}}}}} + {{a}_{1}}{{x}_{1}}{{x}_{2}}{{\eta }_{{{\text{12\;изб}}{\text{.}}}}} + {{a}_{2}}{{x}_{1}}{{x}_{2}}{{\eta }_{{{\text{21\;изб}}{\text{.}}}}} + {{a}_{3}}x_{2}^{2}{{\eta }_{{{\text{22\;чист}}{\text{.}}}}},$(5)
$\begin{gathered} {{\eta }_{3}}(X) = {{a}_{0}}x_{1}^{2}{{\eta }_{{{\text{11}}\,\,{\text{чист}}{\text{.}}}}} + {{a}_{1}}{{x}_{1}}{{x}_{2}}{{\eta }_{{{\text{12\;изб}}{\text{.}}}}} + {{a}_{2}}{{x}_{1}}{{x}_{2}}{{\eta }_{{{\text{13\;изб}}{\text{.}}}}} + {{a}_{3}}{{x}_{2}}{{x}_{2}}{{\eta }_{{{\text{21\;изб}}{\text{.}}}}} + {{a}_{4}}x_{2}^{2}{{\eta }_{{{\text{22\;чист}}{\text{.}}}}} + \\ + \,\,{{a}_{5}}{{x}_{2}}{{x}_{3}}{{\eta }_{{{\text{23\;изб}}{\text{.}}}}} + \,\,{{a}_{6}}{{x}_{3}}{{x}_{2}}{{\eta }_{{{\text{31\;изб}}{\text{.}}}}} + {{a}_{7}}{{x}_{3}}{{x}_{2}}{{\eta }_{{{\text{32\;изб}}{\text{.}}}}} + {{a}_{8}}x_{3}^{2}{{\eta }_{{{\text{233\;чист}}{\text{.}}}}} \\ \end{gathered} $Учитывая, что ${{x}_{1}}$ + ${{x}_{2}}$ + ${{x}_{3}}$ = 1, полагая ${{{{\eta }}}_{{ij~{\text{изб}}.}}}$ = ($({{{{\eta }}}_{{ii{\text{\;чист}}.}}} - {{{{\eta }}}_{{ij{\text{\;эксп}}.}}})$, ${{x}_{i}}{{x}_{j}}{{\eta }_{{ij~{\text{изб}}.}}}$ = = ${{x}_{j}}{{x}_{i}}{{\eta }_{{ji~{\text{изб}}.}}}$ полагая далее ${{\eta }_{{22}}} \ll 1$, ${{\eta }_{{33}}} \ll 1$, ${{x}_{2}}{{x}_{3}}~ \ll 1$, после некоторых преобразований приходим к соотношению:
(6)
${{\eta }_{3}}(X) = {{a}_{1}}{{x}_{1}}{{\eta }_{{{\text{11\;чист}}{\text{.}}}}} - \Theta [{{x}_{1}}{{x}_{{2~}}}({{\eta }_{{{\text{11\;чист}}{\text{.}}}}} - {{\eta }_{{{\text{12}}\,\,{\text{эксп}}{\text{.}}}}}) + {{x}_{1}}{{x}_{3}}({{\eta }_{{{\text{11\;чист}}{\text{.}}}}} - {{\eta }_{{{\text{13}}\,\,{\text{эксп}}{\text{.}}}}})].$Применяя данный результат к стеклообразующему расплаву, содержащему k катионов, получим выражение для вязкости как функции состава в виде многочлена первой степени вида:
(7)
$\begin{gathered} {{\eta }_{k}}(X) = {{a}_{{00}}}{{x}_{1}}{{\eta }_{{11}}} + \ldots + {{a}_{{kk}}}{{x}_{k}}{{\eta }_{{kk}}} - {{\Theta }_{1}}[{{x}_{1}}{{x}_{{2~}}}({{\eta }_{{{\text{11}}}}} - {{\eta }_{{{\text{12}}\,\,{\text{эксп}}{\text{.}}}}}) + \ldots + {{x}_{1}}{{x}_{k}}({{\eta }_{{{\text{11}}}}} - {{\eta }_{{{\text{1}}k\,\,{\text{эксп}}{\text{.}}}}}) + \\ + \,\,{{x}_{1}}{{x}_{3}}({{\eta }_{{{\text{22}}}}} - {{\eta }_{{{\text{23}}\,\,{\text{эксп}}{\text{.}}}}}) + \ldots + {{x}_{2}}{{x}_{k}}({{\eta }_{{{\text{22}}}}} - {{\eta }_{{{\text{2}}k\,\,{\text{эксп}}{\text{.}}}}}) + {{x}_{{k - 1}}}{{x}_{k}}({{\eta }_{{\left( {k - 1} \right)\left( {k - 1} \right)}}} - {{{{\eta }}}_{{\left( {k - 1} \right)k\,\,{\text{эксп}}.}}}], \\ \end{gathered} $Так как все вязкости чистых оксидов ${{\eta }_{{\left( {k - 1} \right)\left( {k - 1} \right)}}}$ < 1, k > 2, для изучаемого 7-ми компонентного оксидного раствора расчетная формула принимает вид:
(8)
$\begin{gathered} {{\eta }_{7}}(X) = {{x}_{1}}{{\eta }_{{11}}} - {{\Theta }_{1}}[{{x}_{1}}{{x}_{2}}({{\eta }_{{11}}} - {{\eta }_{{{\text{12}}\,{\text{эксп}}{\text{.}}}}}) + {{x}_{1}}{{x}_{3}}({{{{\eta }}}_{{11}}} - ~{{\eta }_{{{\text{13}}\,{\text{эксп}}{\text{.}}}}}) + {{x}_{1}}{{x}_{4}}({{\eta }_{{11}}} - {{\eta }_{{{\text{14}}\,{\text{эксп}}{\text{.}}}}}) + \\ + \,\,{{x}_{1}}{{x}_{5}}({{\eta }_{{11}}} - {{\eta }_{{{\text{15}}\,{\text{эксп}}{\text{.}}}}}) + {{x}_{1}}{{x}_{6}}({{\eta }_{{11}}} - {{\eta }_{{{\text{16}}\,{\text{эксп}}{\text{.}}}}}) + {{x}_{1}}{{x}_{7}}({{\eta }_{{11}}} - {{\eta }_{{{\text{17}}\,{\text{эксп}}{\text{.}}}}})], \\ \end{gathered} $Вязкость как функция температуры для большинства простых жидкостей и ряда сложных жидких растворов удовлетворительно описывается соотношением вида:
где ${{A}_{{ij}}}$ – коэффициент, имеющий размерность вязкости, в общем случае зависящий от состава ионного раствора; ${{W}_{{ij}}}$ некоторая суммарная энергия активации для растворов, зависящая от состава ионного раствора; k – константа Больцмана; T – абсолютная температура.Физический смысл энергии ${{W}_{{ij}}}$ (i = 1, … , k; j = 1, … , k – 1) для жидкого раствора, согласно [21], состоит в том, что эта суммарная энергия активации. Часть этой энергии необходима для образования свободного объема в жидкости, например, дырки некоторых минимальных размеров. Другая часть энергии обеспечивает перемещение в нее структурных единиц раствора – катионов. Эта энергия также зависит от температуры раствора и концентрации участвующих в тепловом движении частиц раствора – ионов ${{W}_{{ij}}}$ = f(T, ${{x}_{1}},$ …, ${{x}_{k}}$). Ее зависимость от концентрации многокомпонентных оксидных растворов носит, по-видимому, сложный нелинейный характер. Ниже будет показано, что для двухкомпонентных растворов эта зависимость может быть описана линейной функцией ${{W}_{{ij}}}$ = m${{x}_{i}}$ + b, где: ${{x}_{i}}$ – ионная доля, например, второго катиона двухкомпонентной системы, m, b – постоянные. Что касается зависимости энергии ${{W}_{{ij}}}$ от температуры, отметим следующее. Исследуемый температурный интервал составляет 125°С и относится к высокотемпературной области, где оксидный раствор находится в жидкой фазе. Учитывая эти условия, будем считать энергию не зависящей от температуры.
Комбинируя соотношения (8) и (9), будем иметь:
(10)
$\begin{gathered} {{\eta }_{7}}(X,T) = {{x}_{1}}{{A}_{{11}}}{{e}^{{\frac{{{{W}_{{11}}}}}{{kT}}}}} - {{\Theta }_{1}}[{{x}_{1}}{{x}_{2}}\left( {{{A}_{{11}}}{{e}^{{\frac{{{{W}_{{11}}}}}{{kT}}}}} - {{A}_{{12~{\text{эксп}}{\text{.}}}}}{{e}^{{\frac{{{{W}_{{{\text{12\;эксп}}{\text{.}}}}}}}{{kT}}}}}} \right)~ + \ldots + \\ + \,\,{{x}_{1}}{{x}_{7}}\left( {{{A}_{{11}}}{{e}^{{\frac{{{{W}_{{11}}}}}{{kT}}}}} - {{A}_{{{\text{17\;эксп}}{\text{.}}}}}{{e}^{{\frac{{{{W}_{{{\text{17\;эксп}}{\text{.}}}}}}}{{kT}}}}}} \right). \\ \end{gathered} $Регрессионный анализ экспериментальных данных вязкости двухкомпонентных оксидных систем как функции химического состава [22–26] позволил установить соответствующие зависимости энергий активации и предэкспоненциальных множителей от концентрации второго компонента. Полученные зависимости представлены в табл. 2.
Таблица 2.
Результаты регрессионного анализа
| Система SiO2–MexOy |
Вид функции | Уравнение регрессии | Выборочный коэфф. Корр. R | Дисперсия Sx |
Дисперсия Sy |
||||
|---|---|---|---|---|---|---|---|---|---|
| ${{A}_{{1i}}}$ | W1i | ${{A}_{{1i}}}$ | W1i | ${{A}_{{1i}}}$ | W1i | xi | ${{A}_{{1i}}}$ | W1i | |
| SiO2–MgO | y = b${{x}^{a}}$ | y = ax + b | ln(${{A}_{{12}}}$) = 21.53${{x}_{2}}$ – 15.81 | ${{W}_{{12}}}$ = –205522${{x}_{2}}$ + + 126 306 | 0.98 | –0.99 | 0.18 | ln (${{A}_{{12}}}$) 3.87 | 36 121 |
| SiO2–CaO | ln y = 1/(ax + b) | y = 1/(ax + b) | 1/ln(${{A}_{{13}}}$) = –0.067${{x}_{3}}$ – 0.067 | 1/ ${{W}_{{13}}}$ = 0.0000035${{x}_{{3~}}}$ + + 0.0000078 | –0.96 | 0.99 | 0.22 | ln (${{A}_{{13}}}$) 0.02 | 39 128 |
| SiO2–Al2O3 | y = ax + b | y = ax + b | ${{A}_{{14}}}$ = –3.27 × 10–7${{x}_{4}}$ + + 1.35 × 10–8 | ${{W}_{{14}}}$ = –143 073${{x}_{4}}$ + + 126 235 | –0.76 | –0.99 | 0.07 | 3.1 × 10–8 | 42 797 |
| SiO2–FeO | y = b${{x}^{a}}$ | y = ax + b | ln (${{A}_{{15}}}$) = 20.30${{x}_{5}}$ – 15.47 | ${{W}_{{15}}}$ = –185 041${{x}_{5}}$ + + 124 289 | 0.97 | –0.98 | 0.27 | ln (${{A}_{{15}}}$) 5.66 | 50 982 |
| SiO2–K2O | ln y = 1/(ax + b) | y = 1/(ax + b) | 1/ln(${{A}_{{16}}}$) = = –0.476${{x}_{6}}$ – 0.097 | 1/${{W}_{{16}}}$ = 0.000058${{x}_{6}}$ + + 0.000008 | –0.87 | 0.94 | 0.10 | 1/ln(${{A}_{{16}}}$) 0.06 | 1/${{W}_{{16}}}$ 6.4 × 10–6 |
| SiO2–Na2O | ln y = 1/(ax + b) | y = 1/(ax + b) | 1/ln(${{A}_{{17}}}$) = = –0.442 ${{x}_{7}}$ – 0.06 | 1/ ${{W}_{{17}}}$ = 0.000061 ${{x}_{7}}$ + + 0.000008 | –0.99 | 0.99 | 0.14 | 1/ln(${{A}_{{17}}}$) 0.06 | 1/${{W}_{{17}}}$ 8 × 10–6 |
В окончательном виде для одного моля расчетная формула принимает вид:
(11)
$\begin{gathered} {{\eta }_{7}}(X,T) = x_{1}^{{}}{{A}_{{11}}}{{e}^{{\frac{{{{W}_{{11}}}}}{{RT}}}}} - {{\Theta }_{1}}[{{x}_{1}}{{x}_{2}}\left( {{{A}_{{11}}}{{e}^{{\frac{{{{W}_{{11}}}}}{{RT}}}}} - A{{{\left( {{{x}_{2}}} \right)}}_{{{\text{12\;эксп}}{\text{.}}}}}{{e}^{{\frac{{W{{{\left( {{{x}_{2}}} \right)}}_{{{\text{12\;эксп}}{\text{.}}}}}}}{{RT}}}}}} \right) + \\ + \ldots + \,\,{{x}_{1}}{{x}_{7}}\left( {{{A}_{{11}}}{{e}^{{\frac{{{{W}_{{11}}}}}{{RT}}}}} - A{{{\left( {{{x}_{7}}} \right)}}_{{{\text{17\;эксп}}{\text{.}}}}}{{e}^{{\frac{{W{{{\left( {{{x}_{7}}} \right)}}_{{{\text{17\;эксп}}{\text{.}}}}}}}{{RT}}}}}} \right). \\ \end{gathered} $Необходимо заметить, что коэффициент Θ1 не является строгой константой. Его значения в зависимости от температуры изменяются приблизительно линейно от значения, равного 3.85 при 1798 К, до 3.90 при 1973 К.
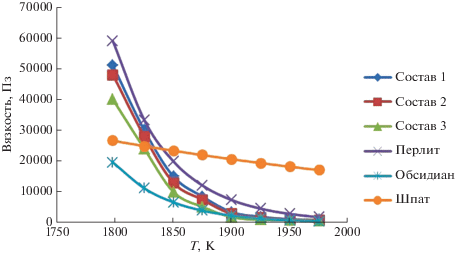
Расчетные политермы вязкости исследуемых стеклообразующих расплавов и сравнительные политермы вязкости близких по химическому составу стеклообразующих расплавов перлита, обсидиана и полевого шпата, рассчитанные экстраполяцией на изучаемый температурный диапазон, показаны на рис. 1.
Как видно из рис. 1, исследуемые стеклообразующие расплавы являются сильновязкими жидкостями. При температуре 1798 К вязкость составляет более 50 000 Пз. Увеличение температуры приводит к значительному снижению вязкости, и при температуре 1975 К значение вязкости становится равным приблизительно 1000 Пз.
Из наиболее близких по ингредиентному содержанию и концентрации составов, вязкость которых была исследована экспериментально, можно отметить работы [20, 27, 28]. В указанных работах экспериментальные значения вязкости ограничены сравнительно невысокими температурами. В работе [20] исследование вязкости обсидиана ограничено значениями температуры – до 1100°С (1373 К). В работе [27] исследование вязкости закарпатского перлита ограничено значениями температуры – до 1327°С (1600 К). В работе [28] исследование вязкости расплава полевого шпата ограничено значениями температуры – до 1375°С (1648 К). Сравнение оказывается возможным только при выполнении экстраполяции экспериментальных данных на изучаемый нами температурный интервал. Вязкость обсидиана состава SiO2 – 76.12, TiO2 – 0.11, Al2O3 – 13.37, Fe2O3 – 0.36, FeO – 0.38, MnO – 0.07, MgO – 0.06, CaO – 0.64, K2O – 4.83, Na2O – 4.06, H2O – 0.1 в исследуемом интервале температур описывается линейной функцией вида: lg η = –0.009T + 20.475. Экстраполяция значений вязкости на изучаемый нами интервал дает для граничных температур величины 19 600 Пз (1798 К) и 500 Пз (1975 К). Для закарпатского перлита состава SiO2 – 74.48, TiO2 – 0.17, Al2O3 – 14.02, Fe2O3 – 0.71, FeO – 0.36, CaO – 1.35, MgO – 0.36, (Na2O + K2O) – 5.64 автор [27] приводит уравнение зависимости вязкости (Пз) перлита от температуры: lg η = A + + B/T, где: А = –11.99, В = 30 125. Значения вязкости, рассчитанные по указанной формуле для температур 1798 и 1975 К составляют 58 000 Пз и 1900 Пз соответственно, что находится в удовлетворительном согласии с нашими расчетными данными. Вязкость полевого шпата состава Na2O – 5.6, K2O – 4.4, CaO – 0.8, MgO – 0.2, Fe2O3 – 0.06, Al2O3 – 14.0, SiO2 – 73.7 в диапазоне температур 1275°С (1548 К)–1375°C (1648 К) описывается функцией вида η = A${{B}^{T}}$, где: А = 2 400 000, В = 0.9975, Т – температура, К. Экстраполированные значения вязкости в граничных точках исследуемого нами диапазона температур равны 27 000 Пз (1798 К) и 17 000 Пз (1975 К). В этом случае, удовлетворительное совпадение расчетных и экспериментальных значений вязкости имеет место только в интервале температур 1800–1850 К.
ТЕПЛОПРОВОДНОСТЬ
Пакетированную по 10 кг в пакете порошкообразную теплоизолирующую оксидную смесь подают на открытую поверхность жидкого металла в промежуточном ковше. При этом смесь “растекается” по поверхности металлического расплава, образуя равномерный слой. Толщина слоя составляет приблизительно 10 см. По истечении времени на границе раздела фаз “металлический расплав–оксидная смесь” происходит плавление смеси. Рассмотрим следующую модель, включающую последовательность образования слоев над металлическим расплавом в процессе подачи оксидной смеси. Первый слой – стеклообразующий расплав – образуется при плавлении смеси и расположен над металлическим расплавом. Над ним располагается двухфазный слой, состоящий из стеклообразующего расплава и не растворившихся компонентов смеси. Третий слой представляет собой исходную стеклообразующую смесь (рис. 2).
Рис. 2.
Последовательность образования слоев над металлическим расплавом в процессе подачи стеклообразующей оксидной смеси.

Рассчитаем теплопроводность каждого слоя ${{\lambda }_{i}}$ суммарную эффективную теплопроводность ${{\lambda }_{{{\text{эф}}{\text{.}}}}}$ Вт/м К. Расчет выполнен для состава № 1.
Можем записать:
(12)
${{\lambda }_{{{\text{эф}}{\text{.}}}}} = {{\lambda }_{1}} + {{\lambda }_{2}} + {{\lambda }_{3}},$Согласно [29], рассматривая оксидный раствор как катионно-анионную смесь катионов кремния, алюминия, магния, кальция и натрия и т.д. и анионов кислорода, теплопроводность жидкого оксидного раствора можно вычислить по приближенному соотношению:
где ${{\lambda }_{{{\text{ж}}.\,\,i}}}$ – теплопроводность i-го компонента жидкого оксидного раствора в форме чистого оксида; ${{x}_{i}}$ – ионная доля i-го катиона в оксидном растворе.В табл. 3 приведены экстраполированные значения теплопроводности чистых оксидов, составляющих жидкий оксидный раствор, взятых из [30–34], и ионные доли соответствующих катионов оксидного раствора. Экстраполяция выполнена при температуре 1823 К. Ввиду отсутствия надежных экспериментальных данных по температурным зависимостям теплопроводности оксидов Na2O и K2O их значения теплопроводности в расчетах не учитывали.
Таблица 3.
Теплопроводность оксидов при температуре 1823 К и ионные доли катионов в оксидном растворе
| ${{\lambda }_{{{\text{ж}}{\text{.1}}}}}$ SiO2 |
${{\lambda }_{{{\text{ж}}{\text{.2}}}}}$ MgO |
${{\lambda }_{{{\text{ж}}{\text{.3}}}}}$ CaO |
${{\lambda }_{{{\text{ж}}{\text{.4}}}}}$ Al2O3 |
${{\lambda }_{{{\text{ж}}{\text{.5}}}}}$ FeO |
${{x}_{1}}$ | ${{x}_{5}}$ | ${{x}_{3}}$ | ${{x}_{4}}$ | ${{x}_{5}}$ |
|---|---|---|---|---|---|---|---|---|---|
| 4.5 | 7.0 | 6.5 | 4.2 | 4.0 | 0.803 | 0.014 | 0.009 | 0.168 | 0.008 |
Теплопроводность жидкого оксидного раствора выразится:
(14)
${{\lambda }_{1}} = \lambda _{{{\text{ж}}{\text{.1}}}}^{{{{x}_{1}}}}\lambda _{{{\text{ж}}{\text{.2}}}}^{{{{x}_{2}}}}\lambda _{{{\text{ж}}{\text{.3}}}}^{{{{x}_{3}}}}\lambda _{{{\text{ж}}{\text{.4}}}}^{{{{x}_{4}}}}\lambda _{{{\text{ж}}{\text{.5}}}}^{{{{x}_{5}}}}.$Значение теплопроводности будет равно
Оксидная смесь является порошкообразным пористым материалом, а температура применения смеси весьма значительна. Составляющая суммы ${{\lambda }_{3}}~$, в свою очередь, есть сумма теплопроводностей:
(15)
${{\lambda }_{3}} = \lambda {\text{*}}\,\,{\text{ + }}\,\,{{\lambda }_{{{\text{конв}}{\text{.}}}}}.$Согласно [33], для многокомпонентных огнеупорных систем, в которых теплопроводности отдельных составляющих отличаются не более, чем в 10 раз, λ* можно представить в виде произведения:
(16)
$\lambda {\text{*}}\,\,{\text{ = }}\,\,\prod\limits_{i = 1}^k {\lambda _{i}^{{{{\nu }_{i}}}}} ,$Для составов, приведенных в табл. 1, примем, что весь Al2O3 присутствует в смеси в виде муллита Al6Si2O13; СаО в виде CaSiO3; MgO в виде MgSiO3; FeO в виде фаялита Fe2SiO4; газовая фаза в виде воздуха. Остальная стекловидная фаза – SiO2. В расчетах не учитывали концентрацию оксидов натрия и калия. Для этого состава соотношение (16) выразится:
(17)
$\lambda {\text{*}}\,\,{\text{ = }}\,\,\lambda _{{{\text{ф}}1}}^{{{{\nu }_{ы}}}}\lambda _{{{\text{ф}}2}}^{{{{\nu }_{2}}}}\lambda _{{{\text{ф}}3}}^{{{{\nu }_{3}}}}\lambda _{{{\text{ф4}}}}^{{{{\nu }_{4}}}}\lambda _{{{\text{ф5}}}}^{{{{\nu }_{5}}}}\lambda _{{{\text{ф6}}{\text{.}}}}^{{{{\nu }_{6}}}}$Таблица 4.
Теплопроводность фаз и их объемная доля при температуре 1823 К
| ${{\lambda }_{{{\text{ф1}}}}}$ | ${{\lambda }_{{{\text{ф2}}}}}$ | ${{\lambda }_{{{\text{ф3}}}}}$ | ${{\lambda }_{{{\text{ф4}}}}}$ | ${{\lambda }_{{{\text{ф5}}}}}$ | ${{\lambda }_{{{\text{ф6}}}}}$ | ν1 | ν2 | ν3 | ν4 | ν5 | ν6 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4.50 | 6.90 | 8.10 | 8.30 | 8.60 | 0.10 | 0.47 | 0.09 | 0.02 | 0.01 | 0.01 | 0.40 |
В табл. 4 приведены расчетные значения теплопроводности фаз и их объемные доли.
Расчет $\lambda {\text{*\;}}$ и Т = 1823 К дает величину
Для проведения оценки величины ${{\lambda }_{{{\text{конв}}{\text{.}}}}}$ комплексной смеси нам понадобится анализ критериальных уравнений. Согласно [33, 35], в слое пористого материала, к которым относится смесь, расположенного горизонтально к источнику тепла (жидкий металлический расплав), естественная конвекция может развиться при значении критерия Релея Ra > ${\text{R}}{{{\text{a}}}_{{{\text{кр}}{\text{.}}}}}$ = 40. Оценку этой величины для нашего случая дает соотношение
где: Ra* – модифицированный критерий Релея; Gr = $\frac{{g\beta \Delta T{{\delta }^{3}}}}{{{{\nu }^{2}}}}$ критерий Грасгоффа; Pr* = $\frac{\nu }{{a{\text{*}}}}$ модифицированный критерий Прандтля; Da = $\frac{K}{{{{\delta }^{2}}}}$ критерий Дарси; $a{\text{*}} = \frac{{\lambda {\text{*}}}}{{{{C}_{{p~{{\rho }_{{{\text{каж}}{\text{.}}}}}}}}}};$ ${{с}_{p}}$ – теплоемкость; ${{{{\rho }}}_{{{\text{каж}}{\text{.}}}}}$ = $\frac{{MP}}{{RT}}$ – кажущаяся плотность газа; β = 1/Т; g = = 9.8 м/с2; К – газопроницаемость; ν – кинематическая вязкость воздуха; δ – толщина слоя смеси; М – молекулярная масса воздуха.Для дальнейшего расчета примем $\lambda {\text{*}}$ = 1.05 Вт/м К; газопроницаемость слоя К = = 10–6 м2; М = 0.029 кг; R = 8.31 × 103 Дж/кмоль К; P = 105 Па; кинематическая вязкость воздуха при 1823 К ν = 11.8 × 10–6 м2/с; кажущаяся плотность воздуха при 1823 К ${{\rho }_{{{\text{каж}}{\text{.}}}}}$ = 0.191 кг/м3; δ = 0.1 м; значение модифицированного критерия Nu* при 40 < Ra* < < 400, равно Nu* = 0.4$\sqrt {{\text{Ra*}}} $ – 1.5. Конвективная теплопроводность выразится ${{\lambda }_{{{\text{конв}}{\text{.}}}}}$ = = $\lambda {\text{*Nu*}}$ [33, 36]. Результаты расчета сведены в табл. 5. Значение ${{\lambda }_{3}}$ будет равно: ${{\lambda }_{3}}$ = = 1.05 + 2.94 = 3.99 Вт/м К. Теплопроводность двухфазной области ${{\lambda }_{2}}$ можно вычислить следующим образом. Пусть φ – объемная доля жидкой фазы в двухфазной области и (1 – φ) – объемная доля твердой фазы в двухфазной области, тогда теплопроводность ${{\lambda }_{2}}$ выразится:
Таблица 5.
Результаты расчета параметров критериальных уравнений и значение конвективной составляющей теплопроводности
| Gr | Da | Pr* | Ra* | Nu* | λконв. |
|---|---|---|---|---|---|
| 6.3 × 107 | 10–4 | 18.1 × 10–3 | 114.30 | 2.80 | 2.94 |
Значение теплопроводности двухфазной области для величины φ, равной, например, 0.5, будет равно: ${{\lambda }_{2}}$ = 4.51 × 0.5 + 3.99 × 0.5 = 4.26 Вт/м К.
Когда зная теплопроводность оксидного раствора ${{\lambda }_{1}}$, теплопроводность двухфазной области ${{\lambda }_{2}}$ – теплопроводность твердой пористой части смеси ${{\lambda }_{3}}$, можно рассчитать распределение температур по слоям, образованным смесью.
Тепловой поток от поверхности металлического расплава выразится:
(20)
$~q = \frac{{{{T}_{M}} - \,\,~{{T}_{{{\text{o}}{\text{.c}}{\text{.}}}}}}}{{\frac{{{{\delta }_{1}}}}{{{{\lambda }_{1}}}}~\,\, + \,\,~\frac{{{{\delta }_{2}}}}{{{{\lambda }_{2}}}}~\,\, + \,\,\frac{{{{\delta }_{3}}}}{{{{\lambda }_{3}}}}\,\,~ + \,\,~\frac{1}{\alpha }~~~}},$Теплоотдачу излучением определим по соотношению
(22)
${{\alpha }_{{{\text{изл}}{\text{.\;}}}}} = 5.7\varepsilon \frac{{{{{\left( {\frac{{{{T}_{{{\text{п}}{\text{.с}}{\text{.}}}}} + 273}}{{100}}} \right)}}^{4}} - \,\,~{{{\left( {\frac{{{{T}_{{{\text{o}}{\text{.c}}{\text{.\;}}}}} + 273}}{{100}}} \right)}}^{4}}~}}{{{{T}_{{{\text{п}}{\text{.с}}{\text{.}}}}} - \,\,~{{T}_{{{\text{о}}{\text{.с}}{\text{.}}}}}}},$Теплоотдача излучением составит: ${{\alpha }_{{{\text{изл}}{\text{.\;}}}}}$ = 5.7 × 0.9((600 + 273)/100)4 – ((20 + + 273)/100)4)/(250 – 20) = 50.7 Вт/(м2 К).
Теплоотдача конвекцией выразится:
(23)
${{\alpha }_{{{\text{кон}}{\text{.}}}}} = {\text{A}}\sqrt[4]{{{{T}_{{{\text{п}}{\text{.с}}{\text{.}}}}} - ~\,\,{{T}_{{{\text{о}}{\text{.с}}{\text{.}}}}}}},$Теплоотдача конвекцией составит: ${{\alpha }_{{{\text{кон}}{\text{.}}}}}$ = 2.6$\sqrt[4]{{600 - 20}}$ = 12.8 Вт/(м2 К).
Коэффициент теплоотдачи твердого пористого слоя в окружающую среду равен
α = 50.7 + 12.8 = 63.5 Вт/(м2 К).
Тепловой поток будет равен
Распределение температур по слоям найдем по соотношению
(24)
${{T}_{{{\text{нар}}{\text{.}}\,\,{\text{пов}}{\text{.}}}}} = {{T}_{{{\text{вн}}{\text{.}}\,\,{\text{пов}}{\text{.}}}}} - q\frac{{{{\delta }_{i}}}}{{{{\lambda }_{i}}}},$Температура ${{T}_{1}}$ оксидного раствора на границе с двухфазной областью
${{T}_{1}}$ = 1550 – 38 250(0.05/4.51) = 1129°С.
Температура ${{T}_{2}}$ двухфазной области на границе с твердым пористым слоем
${{T}_{2}}$ = 1129 – 38 250(0.02/4.26) = 937°С.
Температура ${{T}_{3}}$вердой пористой части на границе с воздушной средой:
${{T}_{3}}$ = 937 – 38 25(0.03/3.99) = 631°С.
Таким образом, мы получили удовлетворительную сходимость между измеренной температурой поверхности твердого пористого слоя и расчетной температурой.
На рис. 3 показано распределение температуры по слоям. Как видно из рис. 3 все три слоя смеси обладают эффективной теплоизолирующей способностью.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для расчета вязкости были выбраны три состава оксидных растворов, в которых суммарное количество оксидов за исключением диоксида кремния возрастает, или, что то же самое, уменьшается содержание диоксида кремния. Видно, что уменьшение концентрации диоксида кремния приводит к снижению вязкости во всем температурном диапазоне исследования.
Обоснованность представления вязкости оксидного раствора как произведения двух функций, одна из которых зависит только от химического состава, а другая только от температуры, обусловлена следующим. Для температурной зависимости вязкости чистого оксида кремния мы пренебрегли температурной зависимостью энергии активации и предэкспоненциального множителя в соотношении $\eta (T) = {{A}_{{ij}}}{{e}^{{\frac{{{{W}_{{ij}}}}}{{kT}}}}}$. Очевидно, что от химического состава это выражение для чистого оксида кремния не зависит. С другой стороны, для двухкомпонентных оксидных растворов мы также приняли независящими от температуры значения энергий активации и предэкспоненциальных множителей. Пренебречь концентрационной зависимостью энергии активации и предэкспоненциального множителя уже нельзя. В конечном выражении для вязкости многокомпонентного оксидного раствора содержатся произведения экспонент и концентраций. Для концентрационных зависимостей ${{A}_{{1j}}}$ и ${{W}_{{1j}}}$ найдены наилучшие приближения, которые использованы в расчетной формуле (11). Фигурирующий там же коэффициент Θ1 рассчитан по вероятностной модели, предложенной в [21]. Полученное соотношение для расчета вязкости дает удовлетворительное совпадение расчетных и экспериментальных значений вязкости многокомпонентного оксидного раствора, сходного по химическому составу с исследуемыми растворами.
Слоевое расположение оксидной смеси на поверхности жидкого металла подтверждается прямыми наблюдениями и экспериментами, проведенными путем намораживания оксидной смеси, расположенной на поверхности жидкого металла, на стальной прут. После подачи смеси на поверхность металлического расплава в промежуточном ковше и формирования слоя смеси толщиной 10 см проводили выдержку длительностью 30 мин. Такая длительность выдержки соответствует середине периода разливки металла. В смесь вертикально вводили металлический прут на глубину более 10 см. При извлечении металлического прута на его поверхности четко прослеживаются границы затвердевших фаз, толщину которых измеряют. Измеренная толщина соответствует в точности толщинам образующихся слоев смеси при ее подаче на поверхность металлического расплава и плавлении в течение указанного промежутка времени. Первая фаза – затвердевший металл, вторая – твердая однородная стеклообразная фаза, соответствующая толщине жидкого стеклообразующего расплава, образованного смесью, третья – неоднородная двухфазная область. Толщина стеклообразного слоя – 50 мм, толщина двухфазной области 20 мм. Толщину верхней сыпучей пористой смеси определяли визуально, значение толщины составило приблизительно 30 мм.
При расчете эффективной теплопроводности ${{\lambda }_{{{\text{эф}}{\text{.}}}}}$ наиболее сложной оказалась оценка теплопроводности жидкого оксидного раствора, ввиду отсутствия надежных экспериментальных данных. Для такой оценки приняли допущение, что в жидком оксидном растворе существуют только катионы и анион кислорода, что позволило рассчитать соответствующие ионные доли i-го катиона. Теплопроводность твердой пористой оксидной смеси ${{\lambda }_{3}}$ и ее конвективной составляющей ${{\lambda }_{{{\text{конв}}{\text{.}}}}}$ в грубом приближении, по-видимому, может быть оценена только с привлечением критериальных уравнений. Такой подход, несмотря на невысокую точность, оправдан отсутствием надежных экспериментальных данных, в частности по газопроницаемости слоя.
В дальнейшем, при расчете теплового потока и конечного распределения температуры по слоям показано, что оксидные смеси обладают низкой теплопроводностью в твердой фазе и более высокой теплопроводностью в жидкой фазе, остающейся, однако на уровне 4.51 Вт/м К при 1823 К. Для слоя оксидной смеси толщиной 100 мм, включающего и жидкую оксидную фазу и твердую оксидную фазу суммарная теплопроводность при 1823 К, составляет $~{{\lambda }_{{{\text{эф}}{\text{.}}}}} = {{\lambda }_{1}} + {{\lambda }_{2}} + \lambda {\text{*}} + {{\lambda }_{{{\text{конв}}{\text{.}}}}}$ = 4.51 + 4.26 + 1.05 + + 2.94 = 12.76 Вт/м К. Сравним результаты расчета эффективной теплопроводности оксидной смеси с теплопроводностью, полученной при прямых измерениях температуры поверхности стеклообразующей смеси, находящейся на зеркале металлического расплава. Теплоемкость смеси ввиду отсутствия надежных экспериментальных данных приняли равной теплоемкости соответствующей алюмо-силикатной композиции 1.280 кДж/кг К [33]. Плотность для трехкомпонентного расплава SiO2–Al2O3–CaO взята из [37]. Для слоевой структуры расчетная формула примет вид: ${{\lambda }_{{{\text{эф}}{\text{.}}}}}$ = = a(T)C(T${{\rho }_{{{\text{каж}}{\text{.}}}}}$), где: a(T) = $\frac{{b{{R}^{2}}}}{{\Delta T}}$ – температуропроводность, b – скорость нагрева поверхности оксидной смеси, ∆Т – разность температур между температурой жидкого металл 1823 К и экспериментальным значением температуры на поверхности оксидной смеси, C(T) = 1.056 + 0.000125T – теплоемкость, ${{\rho }_{{{\text{каж}}{\text{.}}}}}$ – кажущаяся общая плотность слоев оксидной смеси, принятая равной 2500 кг/м3. Данные для расчета таковы. За период времени, равный 30 мин, поверхность смеси нагревается от температуры окружающей среды до значения 600°С (873 К). Скорость нагревания 0.33°C в с. Толщина слоя смеси 0.1 м. Расчет дает: ${{\lambda }_{{{\text{эф}}{\text{.}}}}}$ = $\frac{{0.33 \times 0.01}}{{950}} \times 1280 \times 2500$ = 11.12 Вт/м К. Расчетная величина эффективной теплопроводности оксидной смеси находится в удовлетворительном согласии с величиной теплопроводности, полученной при измерениях температуры поверхности стеклообразующей оксидной смеси, находящейся на поверхности металлического расплава в промежуточном ковше при непрерывной разливке стали.
ЗАКЛЮЧЕНИЕ
Расчетная формула для вязкости получена при допущении, что в жидком оксидном растворе существуют только свободные элементарные ионы. Наличие сложных анионов, ассоциированных тетраэдров ${\text{SiO}}_{4}^{{4 - }}$ и т.д., не предполагается. По уровню вязкости исследуемый состав относится к сильновязким жидкостям – силикатным стеклам. Предложенная модель теплопроводности применима для стационарного случая, при котором отсутствует турбулентное перемешивание слоев. При расчете теплопроводности жидкого оксидного раствора по предложенной эмпирической формуле также принято допущение о существовании в жидком оксидном растворе только элементарных катионов. Тепловой расчет выполнен в приближении последовательно расположенных не взаимно проникающих горизонтальных слоев. Смесь сохраняет высокую теплоизолирующую способность при значительной температуре – 1823 К.
Список литературы
Топтыгин А.М., Полозов Е.Г., Айзин Ю.М. Совершенствование защитных шлакообразующих смесей для промежуточного ковша МНЛЗ // Сталь. 2007. № 3. С. 20–24.
Капитанов В.А., Куклев А.В., Полозов Е.Г. Исследование теплоизоляционных свойств шлаковых смесей для промежуточного ковша // Сталь. 2009. № 1. С. 28–31.
Вильданов С.К. Разработка и внедрение теплоизолирующих и шлакообразующих материалов серии “Изотерм-1600” // Сталь. 2018. № 9. С. 17–22.
Фукс Э., Савицки Й., Генералов А.В. Применение теплоизоляционных и экзотермических материалов фирмы “Foseco Steel” в ОАО “МЗ Камасталь” // Сталь. 2006. № 11. С. 46–51.
Шабловский В.А., Климов Ю.В., Онищенко Н.Ф. Специализированные смеси для сифонной разливки стали // Сталь. 2009. № 6. С. 21–24.
Вильданов С.К., Лиходиевский А.В., Пыриков А.Н. Разработка и внедрение энергосберегающих материалов для разливки стали // Новые огнеупоры. 2011. № 8. С. 3–6.
Ахметов А.Б. Разработка и освоение новых теплоизолирующих смесей для разливки стали // Сталь. 2008. № 8. С. 29–31.
Бабина И.А., Бабин А.О. Исследование свойств оксидных расплавов в модельном эксперименте // Расплавы. 2019. № 2. С. 133–141.
Воларович М.П., Леонтьева А.А. Исследование вязкости обсидианов в связи с вопросом генезиса пемзы // ДАН СССР. 1937. Т. 17. № 8. С. 419–421.
Брянцев Б.А., Хан Б.Х. Исследование некоторых физико-химических свойств петрургических расплавов // Проблемы каменного литья. 1968. № 2. С. 152–159.
Леонтьева А.А. Измерения вязкости обсидианов и водородсодержащих стекол // Изв. АН СССР. Сер. Геол. Наук. 1940. № 2. С. 44–54.
Филипович В.Н. Вакансионно-диффузионная теория вязкости стекол и ее применение к кварцевому стеклу // Физика и химия стекла. 1975. Т. 1. № 3. С. 256–264.
Маковецкий А.А., Замятин А.А., Иванов Г.А. Методика оценки вязкости расплава кварцевого стекла по кинетике схлопывания капилляра // Физика и химия стекла. 2014. Т. 40. № 5. С. 696–702.
Леко В.К. Вязкость кварцевых стекол // Физика и химия стекла. 1979. Т. 5. № 3. С. 258–278.
Гусакова Н.К., Леко В.К., Мещерякова Е.В. Исследование вязкости различных кварцевых стекол в широком диапазоне температур // Неорганические материалы. 1974. Т. Х. № 2. С. 338–340.
Леко В.К. Совместное влияние примесей оксидов щелочных металлов и алюминия на вязкость стеклообразного кремнезема // Физика и химия стекла. 1980. Т. 6. № 5. С. 553–557.
Мазурин О.В., Клюев В.П., Леко В.К. Исследование температурной зависимости вязкости оконного и кварцевых стекол в интервале 1013–1016 пуаз при равномерном охлаждении // Физика и химия стекла. 1975. Т. 1. № 4. С. 371–373.
Сандитов Д.С., Мункуева С.Б. Температурная зависимость вязкого течения стеклообразующих расплавов в широком интервале температур // Физика и химия стекла. 2016. Т. 42. № 2. С. 191–199.
Кани К. Исследование вязкости стекла из базальта при высоких температурах // Физико-химическая минералогия и петрология. 1936. Вып. 1. С. 65–68.
Леонтьева А.А. Исследование физических свойств обсидианов в связи с вопросом пемзообразования // АН СССР Труды института геологических наук, петрогр. Сер. 1938. Вып. 5. № 4. С. 35–40.
Вильданов С.К. Расчет вязкости многокомпонентных оксидных растворов на основе SiO2 с использованием данных по вязкости двухкомпонентных систем SiO2–МеxOy в интервале концентраций SiO2 от 65 до 75% // Расплавы. 2020. № 4. С. 375–392.
Bockris J. OʼM., Mackenzie J.D., Kitchener J.A. Viscous flow in silica and binary liquid silicates // Trans. Faraday Soc. 1955. V. 51. P. 1734–1748.
Асланова М.С., Чернов В.А., Кулаков Л.Ф. Исследование вязкости и кристаллизационных свойств кварцевого стекла с легирующими добавками окиси алюминия // Стекло и керамика. 1974. № 6. С. 19–21.
Hofmaier G., Urbian G. The viscosity of pure silica // Sci. Ceram. 1968. V. 4. P. 25–32.
Bacon J.F., Kasapis A., Wholley J. Viscosity and density of molten silica and high silica content glasses // Phys. Chem. Glasses. 1960. V. 1. № 3. P. 90–98.
Bruckner R. Properties and structure of vitreous silica // J. Non-Cristalline Solids. 1970. V. 5. № 2–3. P. 123–216.
Варужанян А.А. Исследование вязкости кислых вулканических водосодержащих стекол в интервале температур размягчения под давлением водяных паров // Закономерности формирования и размещения месторождений вулканического стекла. М.: Наука. 1969. С. 160–169.
Безбородов М.А. Вязкость силикатных стекол. Минск.: Наука и техника, 1975. 352 с.
Вильданов С.К., Рогалева Л.В., Пыриков А.Н. О некоторых критериях эффективности комплексных теплоизолирующих и шлакообразующих смесей // Новые огнеупоры. 2020. № 5. С. 16–22.
Сергеев О.А., Шашков А.Г., Уманский А.С. Теплофизические свойства кварцевого стекла // Инж.-физ. журн. 1982. Т. 43. № 6. С. 960–970.
Лисовский С.А. Теплопроводность твердого и жидкого оксида алюминия при высокой температуре // Очерки по физико-химии и материаловедению. М.: СП Интермет инжиниринг, 1998. С. 174–193.
Мазурин О.В., Стрельцина М.В., Швайко-Швайковская Т.П. Свойства стекол и стеклообразующих расплавов. Справочник. Т. IV. Ч. 1. Л.: Наука, 1980. 461 с.
Литовский Е.Я., Пучкелевич Н.А. Теплофизические свойства огнеупоров. М.: Металлургия, 1982. 150 с.
Физико-химические свойства окислов. Справочник. под ред. Самсонова Г.В. М.: Металлургия, 1969. 455 с.
Дульнев Г.Н., Заричняк Ю.П. Теплопроводность смесей и композиционных материалов. Л.: Энергия, 1974. 264 с.
Дульнев Г.Н., Новиков В.В. Процессы переноса в неоднородных средах. Л.: Энергоатомиздат, 1991. 247 с.
Атлас шлаков. М.: Металлургия, 1985. 207 с.
Дополнительные материалы отсутствуют.
Инструменты
Физика и химия стекла