Физика плазмы, 2022, T. 48, № 2, стр. 152-162
Влияние электрического поля на скорость образования положительных гидратированных ионов в плазме с парами воды
А. А. Пономарев a, b, Н. Л. Александров c, *
a Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
b ГНЦ “Центр Келдыша”
Москва, Россия
c Московский физико-технический институт
Долгопрудный, Московская обл., Россия
* E-mail: nick_aleksandrov@mail.ru
Поступила в редакцию 23.08.2021
После доработки 04.09.2021
Принята к публикации 15.09.2021
- EDN: LTOYQH
- DOI: 10.31857/S0367292122020123
Аннотация
Выполнено моделирование методом Монте-Карло свойств гидратированных ионов Н3О+(Н2О)n в чистых О2 и N2, а также в воздухе для различных внешних электрических полей. Определена средняя энергия ионов в этих газах в зависимости от приведенного электрического поля. На основе полученных результатов проведен анализ имеющихся в литературе данных по зависимости констант скорости образования гидратированных ионов от приведенного электрического поля в пределе низких давлений. Показано, что эти константы скорости гораздо слабее зависят от нагрева ионов электрическим полем, чем от одновременного нагрева ионов и нейтральных частиц в термодинамически равновесных условиях. Полученные данные использованы для определения констант скорости образования гидратированных ионов в плазме воздуха в широких диапазонах давления газа и приведенного электрического поля.
1. ВВЕДЕНИЕ
Неравновесная разрядная плазма в газовых смесях с парами воды генерируется при развитии разрядов около поверхности воды (газовые разряды с жидкими электродами, в газовых пузырях и пене), а также в условиях атмосферы. Также плазма такого типа встречается при реализации плазменных методов очистки воздуха от вредных примесей, в плазменной медицине, стимулированном плазмой горении и некоторых других приложениях [1–6]. В связи с этим в последнее время с помощью численного моделирования изучаются кинетические свойства разрядной плазмы в Н2О-содержащих газовых смесях. Моделирование кинетики заряженных частиц выполнено для плазмы в парах воды [7–9], во влажном воздухе (см., например, [10–12]), в дымовых газах (например, [13]), в смесях He:H2O [14], He:O2 с малой добавкой влажного воздуха [15], Ar:H2O [16, 17] и смеси Ar с влажным воздухом [18].
Входными параметрами для моделирования свойств неравновесной плазмы являются константы скорости элементарных процессов, прежде всего – процессов рождения и гибели электронов и ионов. Одним из главных каналов гибели заряженных частиц в молекулярной плазме является диссоциативная рекомбинация электронов с положительными молекулярными ионами. Скорость этого процесса существенно зависит от сорта положительных ионов; в частности, она возрастает примерно на порядок величины, когда простые молекулярные ионы превращаются в кластерные [19, 20]. В плазме газовых смесей с парами воды могут образовываться положительные кластерные водяные (гидратированные) ионы H3O+(H2O)n [11, 13, 14, 18, 21, 22]. Коэффициенты рекомбинации с электронами для этих ионов аномально велики [19, 20]. Например, эти коэффициенты равны ≈(0.5 + 2n) × 10–6 см3/с для данных ионов при n = 1–4 [23]. Образование ионов H3O+(H2O)n существенно сказывается на времени жизни плазмы и других плазменных характеристиках. Процессы кластеризации ионов являются трехтельными, а их константы скорости зависят от многих параметров, в том числе от концентрации и сорта нейтральных частиц, а также температуры газа и ионов.
Из-за большого постоянного дипольного момента молекулы Н2О гидратированные ионы по своим свойствам существенно отличаются от кластерных ионов, образуемых при присоединении других молекул. Число молекул Н2О в гидратированных ионах, образованных в слабоионизованной неравновесной плазме в газах при нормальных условиях, может достигать 7 [10]. Скорости образования и диссоциации гидратированных ионов H3O+(H2O)n, находящихся в термодинамическом равновесии с нейтральным газом, аномально чувствительны к температуре газа T: они меняются как T–k, где значение k для некоторых ионов может достигать 14–16 [10]. Это значит, что увеличение T всего лишь на 20% приводит к уменьшению скорости образования и диссоциации таких ионов более чем на порядок величины.
При наложении достаточно сильного электрического поля происходит нагрев ионов, и их эффективная температура Ti, определяемая как две трети средней энергии ионов Ei, “отрывается” от температуры газа T. Такие условия для положительных гидратированных ионов реализуются при разрядах в парах воды [7], влажном воздухе [10–12] и других газовых смесях с парами воды, в частности, в топливо-кислородных смесях при заметном окислении топлива [24, 25]. Очевидно, нагрев ионов в электрическом поле должен приводить к уменьшению констант скорости образования и диссоциации ионов H3O+(H2O)n. В [10] было предложено учитывать данный эффект по аналогии со случаем нагрева газа, когда константы скорости зависели от температуры T степенным образом. При этом показатель степени брался тем же, но вместо температуры в [10] предложено использовать эффективную температуру реакции Teff = 2Ecm/3kB, где Ecm – средняя кинетическая энергия относительного движения частиц при столкновении исходного иона и молекулы, kB постоянная Больцмана. Выражение для Ecm имеет вид [10, 26]
(1)
${{E}_{{cm}}} = \frac{M}{{m + M}}\left( {{{E}_{i}}--\frac{{3{{k}_{B}}T}}{2}} \right) + \frac{{3{{k}_{B}}T}}{2},$Предложенный в [10] подход для описания влияния нагрева ионов в электрическом поле на скорости образования и разрушения ионов H3O+(H2O)n является оценочным. Этот подход ранее не проверялся при сравнении расчета с экспериментом, хотя измерения константы скорости образования ионов H3O+(H2O)2 и H3O+(H2O)3 в молекулярном кислороде в зависимости от приведенного электрического поля E/N (N – концентрация нейтральных частиц) в литературе имеются [28]. В данной работе сделана попытка восполнить этот пробел, для чего было необходимо с максимальной точностью определить среднюю энергию ионов в электрическом поле для условий эксперимента. В связи с этим в данной работе энергия ионов в электрическом поле не определяется приближенным методом Ванье, как предложено это делать в [10], а находится из численного моделирования методом Монте-Карло на основе имеющихся данных по сечениям рассеяния ионов H3O+(H2O) и H3O+(H2O)2 на молекулах О2. Приводится обсуждение полученных результатов и причин их сильного отличия от результатов [10]. Результаты обобщаются на практически важный случай плазмы в воздухе при различных давлениях газа.
2. МОДЕЛИРОВАНИЕ НАГРЕВА ИОНОВ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ МЕТОДОМ МОНТЕ-КАРЛО
С помощью метода Монте Карло моделировались свойства ионов H3O+, H3O+(H2O) и H3O+(H2O)2 в чистых О2, N2 и воздухе в постоянном однородном электрическом поле. Учитывались только взаимодействия ионов с молекулами, а ион-ионным взаимодействием пренебрегалось в предположении о малой степени ионизации.
Используемый в данной работе вариант метода Монте Карло подробно описан в [9, 29]. Все ионы создавались в начале координат. Начальная скорость разыгрывалась стохастически в соответствии с максвелловской функцией распределения при температуре газа T. Вектор начальной скорости иона был изотропно распределен по полупространству в направлении электрического поля. Время до следующего столкновения находилось с помощью метода “нулевых” столкновений (см., например, [30, 31]) из соотношения
где η – случайная величина, равномерно распределенная на отрезке от 0 до 1, а νmax – частота ион-молекулярных столкновений, которая полагалась постоянной и была равна максимальному значению реальной частоты столкновений νtot(gi) для всех возможных относительных скоростей столкновения gi. Здесь ${{\nu }_{{tot}}} = \sum\nolimits_i {{{N}_{i}}} {{g}_{i}}{{\sigma }_{i}}$ – полная частота столкновений иона с нейтральными молекулами, Ni и σi – плотность частиц сорта i и полное сечение рассеяния иона на них, соответственно, ${{g}_{i}} = \left| {{\mathbf{V}}--{{{\mathbf{V}}}_{i}}} \right|$ – скорость иона относительно молекулы и V – скорость иона в неподвижной лабораторной системе координат. Скорость молекул Vi определялась случайным образом в предположении, что они имеют изотропное максвелловское распределение по скоростям с температурой газа T.Вероятность реального столкновения иона с молекулой равна p = νtot/νmax, а вероятность “нулевого” столкновения равна 1 – p. В случае “нулевого” столкновения ничего с ионом не происходило, и он продолжал свое движение. В случае реального столкновения разыгрывался его тип. Он находился в предположении о том, что вероятность j-го процесса в столкновении между ионом и молекулой i-го сорта равна ${{N}_{i}}{{g}_{i}}{{\sigma }_{{ij}}}({{g}_{i}}){\text{/}}{{\nu }_{{tot}}}$, где σij – сечение соответствующего процесса. Уравнения для определения скорости иона после столкновения приведены, например, в [30, 32]. Генератор случайных чисел был взят из [33]. Скорость иона после столкновения вычислялась в предположении, что рассеяние является изотропным в системе центра инерции.
Метод счета, используемый в данной работе, проверялся в [34] при сравнении результатов расчета ионных коэффициентов переноса в сильном электрическом поле с аналитическими решениями для модельных условий. Использовались модель постоянной частоты упругих столкновений ионов с нейтральными частицами в отсутствии неупругих процессов (максвелловская модель), а также модель, в которой все ионные столкновения приводят к резонансной перезарядке.
Для рассеяния ионов H3O+, H3O+(H2O) и H3O+(H2O)2 на молекулах О2 и N2 брался набор сечений [35], включающий сечения упругого взаимодействия и сечения диссоциации ионов. С использованием этих сечений в [35] было получено хорошее согласие между вычисленными и измеренными значениями подвижности ионов в чистом N2 в широком (1–103 Тд) диапазоне приведенных электрических полей. Что касается сечений рассеяния ионов на О2, то они вычислялись в [35] в рамках того же подхода, что и для N2, и тестировались на измеренных подвижностях ионов в чистом кислороде, которые имеются для данных ионов только для слабых электрических полей.
Предварительные расчеты показали, что средние характеристики ионов (скорость дрейфа и средняя энергия) в О2 и N2 выходят на постоянные значения, соответствующие заданным значениям приведенного электрического поля E/N, после примерно 10 соударений ионов с молекулами. Движение каждого иона моделировалось либо в течение определенного количества физического времени (так, чтобы ион испытал не менее 200 соударений), либо до соударения, в котором произошла диссоциация иона, т. е. он физически перестал существовать. Ввиду того, что релаксация ионов в расчете происходила достаточно быстро, а средняя энергия ионов определялась по промежутку физического времени, когда ионы находились в равновесии с полем, то способ выбора модуля и направления начальной скорости ионов никак не влиял на результаты расчета. Количество моделируемых ионов выбиралось таким образом, чтобы относительная погрешность расчетного метода определения средних координат и скоростей ионов не превышала 2%. Таким образом, количество моделируемых ионов составляло от 2500 до 10000. Оценки показывают, что в этом случае погрешность расчета средней энергии ионов также составляла 2%.
3. РЕЗУЛЬТАТЫ РАСЧЕТА СРЕДНЕЙ ЭНЕРГИИ ИОНОВ
Одной из целей исследования было определить зависимость констант скорости процессов образования гидратированных ионов
(4)
${{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}\left( {{{{\text{H}}}_{2}}{\text{O}}} \right) + {{{\text{H}}}_{2}}{\text{O}} + {\text{M}} \to {{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)}_{2}} + {\text{M}},$(5)
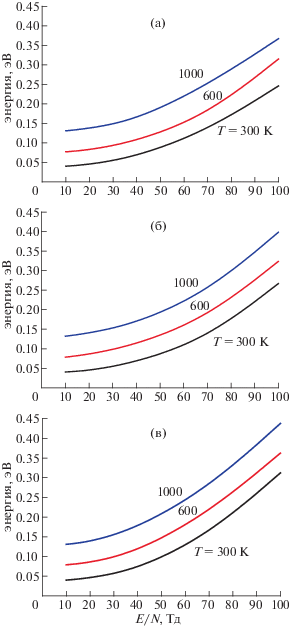
${{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)}_{2}} + {{{\text{H}}}_{2}}{\text{O}} + {\text{M}} \to {{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)}_{3}} + {\text{M}}$На рис. 1 приведены результаты расчета средней энергии ионов в чистых О2, N2 и воздухе в зависимости от приведенного электрического поля E/N, выраженного в Тд (1 Тд = 10–17 В · см2), при Т = 300 К. Ионы нагреваются гораздо сильнее (в достаточно сильном электрическом поле примерно в два раза больше) в кислороде по сравнению со случаем азота. Это связано в основном с тем, что сечения упругого рассеяния (это основной канал рассеяния) ионов на молекулах О2 меньше, чем на молекулах N2 [35]. В результате, как следует и из расчетов [35], подвижность рассматриваемых ионов в кислороде гораздо больше их подвижности в азоте. Значения средней энергии в воздухе близки к значениям в азоте, но несколько превышают их из-за влияния рассеяния ионов на молекулах О2.
Рис. 1.
Зависимость средней энергии ионов H3O+ (а), H3O+(H2O) (б) и H3O+(H2O)2 (в) в N2, О2 и воздухе от приведенного электрического поля при Т = 300 К.

Представляет интерес сравнить результаты проведенного расчета средней энергии ионов в электрическом поле с данными, получающимися по формуле Ванье (уравнение (2)). Это сравнение для энергии рассматриваемых ионов в молекулярном кислороде приведено на рис. 2, где в уравнение (2) подставлялись значения скорости дрейфа ионов, вычисленные методом Монте-Карло. Видно, что различие между этими данными относительно невелико – на уровне 30% для достаточно больших полей. Но оно оказывается важным в случае резкой зависимости констант скорости процессов (4) и (5) от Teff. Например, согласно [10], константа скорости процесса (5) зависит от температуры ионов степенным образом с показателем степени 8.1. Это значит, что изменение эффективной температуры ионов на 30% должно приводить к изменению константы скорости в 8 раз.
Рис. 2.
Зависимость средней энергии гидратированных ионов в О2 от приведенного электрического поля. Расчеты по формуле Ванье (символы) и методом Монте-Карло (кривые).

Во многих случаях температура газа, в котором создается плазма, заметно больше 300 К. Это происходит, например, при генерации плазмы в дымовых газах [13], при стимулированном плазмой воспламенении [2–4] и во время развития достаточно мощных разрядов, в частности, при стримерно-лидерном переходе и развитии лидерного разряда в воздухе [21, 22]. В связи с этим в данной работе было выполнено моделирование свойств ионов H3O+, H3O+(H2O) и H3O+(H2O)2 и в нагретом воздухе под действием электрического поля. Результаты расчета средней энергии для этих ионов в зависимости от электрического поля приведены на рис. 3 при температурах Т = 300, 600 и 1000 К. Нагрев газа приводит к росту средней энергии ионов, поскольку электрическое поле определяет прежде всего нагрев ионов относительно средней энергии нейтральных молекул. Но нагрев газа не сводится к простому росту средней энергии ионов в заданном электрическом поле на величину, равную увеличению средней кинетической энергии молекул. Это связано с нелинейностью задачи, в которой частота столкновений ионов с молекулами зависит от энергии относительного движения частиц, определяемой как приведенным электрическим полем E/N, так и температурой Т.
Рис. 3.
Зависимость средней энергии ионов H3O+ (а), H3O+(H2O) (б) и H3O+(H2O)2 (в) в воздухе от приведенного электрического поля при различных температурах газа.
На рисунке 4 приведено рассчитанное методом Монте-Карло энергетическое распределение ионов H3O+(H2O) в О2 при E/N = 34 Тд и Т = = 300 К. Средняя энергия ионов при этом была примерно равна 0.07 эВ. Распределения для ионов H3O+ и H3O+(H2O)2 в данных условиях близки к распределению, представленному на рис. 4. Для сравнения на рисунке приведена максвелловская функция распределения с той же средней энергией. Из расчетов видно, что энергетические распределения ионов отличаются от равновесных только при энергиях, существенно (на порядок величины) превышающих средние значения. При таких энергиях значения функций падают на 3 порядка величины относительно их максимальных значений. Из резких убывающих температурных зависимостей констант скорости гидратации ионов следует, что в этих процессах основную роль играют низкоэнергичные ионы. Поэтому здесь приближенно можно считать, что участвующие в процессах гидратации ионы описываются равновесными энергетическими распределениями с эффективными температурами, равными двум третям от значений средней энергии ионов.
4. КОНСТАНТЫ СКОРОСТИ ОБРАЗОВАНИЯ ГИДРАТИРОВАННЫХ ИОНОВ В ПРЕДЕЛЕ НИЗКИХ ДАВЛЕНИЙ
Полученные результаты расчета средней энергии ионов H3O+(H2O) и H3O+(H2O)2 в О2 были использованы для обработки экспериментальных данных [28] по константам скорости процессов (4) и (5) при различных электрических полях. Эти измерения были выполнены при комнатной температуре газа в диапазоне давлений 1–2 Торр, который соответствует пределу низких давлений для тройных реакций. В [28] эти данные приведены в зависимости от приведенного электрического поля E/N. В настоящей работе результаты расчета средней энергии ионов в О2 в зависимости от E/N были использованы для определения эффективной температуры реакции Teff по формуле (1) и зависимости констант скорости процессов (4) и (5) от Teff. Экспериментальные точки [28] по константам скорости процессов (4) и (5) в зависимости от Teff приведены на рис. 5 в двойном логарифмическом масштабе, в котором степенная зависимость дает прямую линию. Там же представлены линии, соответствующие расчету на основе подхода [10] с нормировкой на экспериментальные точки в пределе малых электрических полей, а также прямые, аппроксимирующие степенным образом зависимости измеренных констант скорости от Teff.
Рис. 5.
Константы скорости конверсии ионов Н3О+(Н2О) в Н3О+(Н2О)2 (процесс (4)) (а) и Н3О+(Н2О)2 в Н3О+(Н2О)3 (процесс (5)) (б) в зависимости от эффективной температуры реакции в чистом кислороде. Точки – эксперимент [28] в диапазоне давлений 1–2 Торр, кривые – аппроксимации на основе настоящего расчета и расчетов по методике [10].

Из рис. 5 следует, что подход [10] не позволяет описать полученные в эксперименте [28] зависимости констант скорости процессов (4) и (5) от эффективной температуры и электрического поля даже на качественном уровне. Реальное уменьшение констант скорости с ростом E/N оказывается гораздо меньше и, как следует из аппроксимационных линий, константы скорости в пределах разброса (±100%) экспериментальных точек для процессов (4) и (5) можно аппроксимировать, соответственно, формулами
(6)
${{k}_{4}} = 3 \times {{10}^{{ - 27}}}{{({{T}_{{eff}}}{\text{/}}300)}^{{ - 2.2}}}\;{\text{с}}{{{\text{м}}}^{6}}{\text{/с}}$(7)
${{k}_{5}} = 1.5 \times {{10}^{{ - 27}}}{{({{T}_{{eff}}}{\text{/}}300)}^{{ - 3}}}{\text{ с}}{{{\text{м}}}^{6}}{\text{/с}},$Объяснить получаемое несоответствие между неравновесным (E > 0) и равновесным (E = 0) случаями можно на основе механизма рассматриваемых процессов. Реакция
(8)
${{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{({{{\text{H}}}_{2}}{\text{O}})}_{n}} + {{{\text{H}}}_{2}}{\text{O}} + {\text{M}} \to {{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{({{{\text{H}}}_{2}}{\text{O}})}_{n}}_{{ + 1}} + {\text{M}},$(9)
${{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{({{{\text{H}}}_{2}}{\text{O}})}_{n}} + {{{\text{H}}}_{2}}{\text{O}} \to {{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}({{{\text{H}}}_{2}}{\text{O}})_{{n + 1}}^{*}$(10)
${{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}({{{\text{H}}}_{2}}{\text{O}})_{{n + 1}}^{*} \to {{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{({{{\text{H}}}_{2}}{\text{O}})}_{n}} + {{{\text{H}}}_{2}}{\text{O}}$(11)
${{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)_{{n + 1}}^{*} + {\text{M}} \to {{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}{{\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)}_{n}}_{{ + 1}} + {\text{M}}.$Константа скорости процесса стабилизации равна kq. В пределе низких давлений, когда большинство нестабильных ионов самопроизвольно распадается, и только их малая доля стабилизируется в столкновениях, константа скорости процесса (8) имеет вид [36]
Для описания констант скорости ka и kq в случае отсутствия у молекул постоянного дипольного момента обычно используется модель поляризационного взаимодействия заряда иона с наведенным диполем молекулы, что дает в результате так называемое ланжевеновское сечение захвата и константы скорости, не зависящие от температуры. В случае дипольных молекул зависимость от температуры Т появляется, но она слабая: в этом случае константа скорости падает с ростом Т как ${{Т}^{{ - 0.5}}}$. Наблюдаемая же сильная степенная зависимость констант скорости процессов (8) от Т в термодинамически равновесных условиях при нагреве газа в основном связана с зависимостью времени жизни нестабильного ионного комплекса τ от Т. Ее можно записать в виде [36]
где s – эффективное число “незамороженных” колебательных степеней свободы нестабильного ион-молекулярного комплекса, а r – эффективное число его внутренних вращательных степеней свободы. При нагреве газа в режиме термодинамического равновесия у такой сложной системы, как ${{{\text{H}}}_{3}}{{{\text{O}}}^{ + }}({{{\text{H}}}_{2}}{\text{O}})_{{n + 1}}^{*}$, возбуждается много внутренних степеней свободы комплекса, и показатели степени в температурных зависимостях времени жизни комплекса и константы скорости процесса (8) по модулю оказываются велики, порядка 10, что и наблюдается в эксперименте [10, 37]. При нагреве же ионов в электрическом поле оказываются с повышенной эффективной температурой прежде всего поступательные степени свободы, а внутренние колебательные степени свободы остаются в значительной степени замороженными. Именно поэтому время жизни нестабильного комплекса и константа скорости процесса (8) менее чувствительны к изменению эффективной температуры Teff.5. РАСЧЕТ КОНСТАНТ СКОРОСТИ ДЛЯ ПРОМЕЖУТОЧНЫХ И ВЫСОКИХ ДАВЛЕНИЙ
Выше рассматривались константы скорости конверсии гидратированных ионов в пределе малых давлений, когда скорость процесса пропорциональна квадрату концентрации нейтральных частиц. При повышении давления в тройных процессах вероятностью процесса столкновительной стабилизации комплекса по сравнению с автораспадом нельзя пренебрегать, и зависимость скорости от концентрации нейтральных частиц уменьшается. В пределе больших давлений преобладает именно стабилизация комплекса над его автораспадом. В этом случае скорость тройного процесса зависит от концентрации нейтральных частиц линейно, подобно парным процессам, а константа скорости такого квазипарного процесса равна ka [10, 12, 36]. Процедура нахождения константы скорости рассматриваемого процесса в промежуточной области давлений описана, например в [10, 12].
В данной работе на основе этой процедуры и вычисленных констант скорости для низких давлений был проведен расчет констант скорости конверсии гидратированных ионов (процессы (4) и (5)) в воздухе в зависимости от его давления и эффективной температуры реакции Teff, определяемой внешним электрическим полем. Расчеты сделаны для температуры газа 300 К и разных значениях приведенного электрического поля E/N. При этом, по аналогии с [10], полагалось, что константы скорости процессов (4) и (5) в пределе низких давлений одни и те же при M = O2 и M = N2. На рис. 6 представлены зависимости от давления для этих констант скорости, умноженных на концентрацию третьего тела [M], при разных значениях Teff, от 300 К (отсутствие электрического поля) до 1500 К, что для воздуха соответствует E/N ≈ 110 Тд. Там же для сравнения приведены линии, соответствующие k(p → 0)[M] (предел низких давлений) и kq (предел высоких давлений). На рисунке четко прослеживается переход от предела низких давлений, когда кривые линейно растут с давлением к пределу высоких давлений, когда кривые выходят на асимптотику горизонтальных прямых. Даже в случае атмосферного давления и слабого нагрева ионов для констант скорости не наступает предела высоких давлений. С ростом же E/N (и Teff) и уменьшением давления отличие констант скорости от величин, соответствующих пределу высоких давлений, становится все более заметным. При этом становятся все более важными полученные в данной работе аппроксимации констант скорости (4) и (5) для предела низких давлений.
Рис. 6.
Константы скорости конверсии ионов Н3О+(Н2О) в Н3О+(Н2О)2 (процесс (4)) (а) и Н3О+(Н2О)2 в Н3О+(Н2О)3 (процесс (5)) (б) в зависимости от давления газа в воздухе при различных эффективных температурах реакций Teff. Штриховые линии – расчет k4[M] и k5[M] во всем диапазоне давлений, пунктирные – k4(p → 0)[M] и k5(p → 0)[M], сплошные – kq. Вертикальная линия соответствует 1 атм.

На рис. 7 приведена зависимость констант скорости указанных процессов от Teff при различных давлениях воздуха в двойном логарифмическом масштабе. Поскольку в пределах низких и высоких давлений константы скорости данных процессов зависят от Teff степенным образом, то в этих пределах на рисунках должны получаться отрезки прямых линий. Наблюдаемые на рис. 7 отклонения от такого поведения связаны именно с переходом от предела низких давлений к пределу высоких давлений. При этом с ростом давления зависимость констант скорости от Teff становится более пологой.
Рис. 7.
Константы скорости конверсии ионов Н3О+(Н2О) в Н3О+(Н2О)2 (процесс (4)) (а) и Н3О+(Н2О)2 в Н3О+(Н2О)3 (процесс (5)) (б) в зависимости от эффективной температуры реакции в воздухе при различных давлениях газа.

Выше показано, что константы скорости реакций образования гидратированных ионов гораздо слабее зависят от нагрева ионов электрическим полем, чем от одновременного нагрева ионов и нейтральных частиц в условиях термодинамического равновесия. Следует ожидать аналогичного эффекта и для обратных процессов, в которых происходит разрушение гидратированных ионов в парных столкновениях с молекулами. В [10] константы скорости обратных процессов находились в зависимости от температуры при нагреве газа на основе принципа детального равновесия. Этот принцип справедлив в условиях термодинамического равновесия и не может быть применен в рассматриваемом выше случае, когда электрическое поле греет ионы, оставляя холодными нейтральные молекулы. Его применение также усложняется из-за того, что изучаемые в работе процессы идут через несколько стадий, в каждой из которых может оказаться важным заселение разных степеней свободы молекул и ионов. Поэтому вычислить константы скорости разрушения гидратированных ионов по аналогии с [10] не представляется возможным.
Основные различия в зависимости констант скорости образования гидратированных ионов от температуры газа Т в случае термодинамического равновесия и от Teff в случае только нагрева ионов электрическим полем состоят главным образом в том, что в первом случае возбуждаются также и колебательные степени свободы молекул, а во втором – нет. Поэтому можно ожидать, что в неравновесных условиях при наличии только колебательного возбуждения молекул зависимость констант скорости от колебательной температуры ${{T}_{v}}$ также будет степенной, а показатель степени можно оценить из разности показателя степени в первом случае и показателя степени во втором случае. Отсюда получаем, что зависимость констант скорости для реакций (4) и (5) от ${{T}_{v}}$ будет типа $T_{v}^{{ - k}}$, где k ~ 5.
Полученные данные позволяют оценивать влияние образования положительных гидратированных ионов на свойства плазмы для конкретных случаев при численном моделировании плазмы с парами воды. Рассмотрим в качестве примера стримерный разряд положительной и отрицательной полярности в длинных воздушных промежутках атмосферного давления в зависимости от влажности воздуха. Этот разряд имеет много важных применений и реализуется в естественных условиях. Поэтому большое число работ посвящено его численному моделированию (см., например, [21, 38]). В этом разряде развивается плазменный филаментированный канал, в головке которого в повышенном локальном электрическом поле происходит основная ионизация, а высокая проводимость стримерного канала позволяет сообщать головке стримера высокий потенциал электрода, от которого стартовал стример. Газ в канале обычно холодный, и плазма в нем находится в стадии распада. Поэтому в достаточно длинном канале за счет распада плазмы (сначала благодаря электрон-ионной диссоциативной рекомбинации, а потом и тройному прилипанию электронов к молекулам О2) происходит уменьшение проводимости плазмы и снижение потенциала головки. Все это приводит к уменьшению электрического поля в головке стримера, снижению скорости его распространения и изменению остальных его характеристик. Скорость диссоциативной рекомбинации электронов с ионами сильно зависит от состава ионов. При распаде длинного стримерного канала в сухом воздухе при нормальных условиях доминируют кластерные ионы ${\text{O}}_{4}^{ + }$ [39]. Во влажном воздухе в рассматриваемых условиях преобладают гидратированные ионы Н3О+(Н2О)n, скорость рекомбинации которых значительно больше, чем ионов ${\text{O}}_{4}^{ + }$. В связи с этим скорость распада плазмы зависит от скорости образования гидратированных ионов, и этот процесс надо учитывать при моделировании стримеров во влажном воздухе [39, 40]. В частности, благодаря данному процессу при увеличении влажности возрастает среднее электрическое поле в канале стримера и снижается предельная длина, на которую может распространяться стример при заданном напряжении на электроде [40].
Среднее электрическое поле в канале стримера при нормальных условиях в сухом воздухе E ≈ 5 кВ/см (20 Тд) при положительной полярности разряда и ≈10 кВ/см (40 Тд) при отрицательной [21]. Согласно расчетам данной работы, при E/N = 20 и 40 Тд эффективная температура Teff для рассматриваемых ионов увеличивается, соответственно, на 20 и на 100 К. Как следует из данных на рис. 7, рост Teff на 100 К приводит к уменьшению констант скорости гидратации ионов примерно на 30% для атмосферного давления. Эффект становится гораздо более выраженным при уменьшении давления газа, когда происходит переход от предела больших давлений к давлениям меньшим. Отсюда можно сделать вывод о том, что нагрев водяных ионов в электрическом поле в канале стримера относительно слабо сказывается на скорости гидратации ионов при атмосферном давлении. В этих условиях независимо от полярности стримерного разряда допустимо выполнять его моделирование без учета влияния нагрева ионов в электрическом поле на скорость их гидратации. Однако этот эффект необходимо учитывать при моделировании стримерных разрядов во влажном воздухе пониженного давления, где влияние влажности существенно сказывается на характеристиках длинного (~10 см) стримерного разряда [41].
Другим примером, где может быть важной гидратация ионов во внешнем электрическом поле, служит наносекундный импульсно-периодический разряд в топливно-кислородных и топливо-воздушных смесях. В [42] предложено для изучения стимулированного плазмой окисления топливно-кислородных и топливо-воздушных смесей использовать гибридный разряд, в котором основная ионизация происходит под действием повторяющихся наносекундных импульсов, а между импульсами поддерживается относительно слабое электрическое поле. Распад плазмы, образованной в наносекундных импульсах, определяется в основном диссоциативной электрон-ионной рекомбинацией [24, 25]. После достаточно большого числа импульсов происходит окисление топлива с образованием в газовой среде паров воды. Последнее приводит к гидратации положительных ионов и ускорению распада плазмы после наносекундных импульсов [24, 25], который происходит в электрическом поле. В этих условиях при достаточно сильном электрическом поле между импульсами также необходимо учитывать замедление гидратации положительных ионов при их нагреве в электрическом поле. Если это поле достаточно велико, то в режиме промежуточных давлений эффект нагрева ионов существенен даже при атмосферном давлении.
6. ЗАКЛЮЧЕНИЕ
С помощью моделирования методом Монте-Карло изучено поведение ионов Н3О+, Н3О+(Н2О) и Н3О+(Н2О)2 в чистых молекулярных кислороде и азоте, а также в воздухе в широком диапазоне приведенных электрических полей E/N. На основе самосогласованного набора сечений рассеяния ионов на молекулах вычислена средняя энергия ионов в этих газах и показано, что нагрев ионов в электрическом поле больше в кислороде по сравнению с воздухом и азотом. Это связано прежде всего с меньшими сечениями упругого рассеяния ионов на молекулах О2 по сравнению с сечениями рассеяния на молекулах N2.
Полученные результаты использованы для анализа имеющихся в литературе данных по зависимости констант скорости образования гидратированных ионов Н3О+(Н2О)2 и Н3О+(Н2О)3 от приведенного электрического поля в молекулярном кислороде при давлениях 1–2 Торр и комнатной температуре газа. Сделан вывод о том, что, как и в случае термодинамически равновесного нагретого газа при Е = 0, зависимость констант скорости от эффективной температуры реакции Teff можно аппроксимировать степенными функциями. Но показатели степени здесь оказываются в диапазоне 2.2–3, что существенно меньше величин, предложенных для описания температурных зависимостей констант скорости в отсутствие электрического поля. Дано объяснение этому эффекту на основе механизма процесса рассматриваемых тройных процессов, идущих через образование нестабильного промежуточного комплекса. В случае нагрева ионов только внешним электрическим полем возбуждается меньшее число внутренних степеней свободы нестабильного комплекса, что приводит к менее резкой зависимости времени жизни комплекса, а значит и констант скорости, от температуры Teff по сравнению со случаем нагрева всего газа в отсутствие электрического поля.
На основе полученных зависимостей проведен расчет констант скорости образования гидратированных ионов Н3О+(Н2О)2 и Н3О+(Н2О)3 в плазме воздуха в широких диапазонах давления газа и приведенного электрического поля. Показано, что с ростом давления существенно снижается зависимость констант скорости рассматриваемых процессов от Teff, а значит и от электрического поля. Это происходит из-за перехода от режима низких давлений в тройных процессах гидратации ионов к режиму высоких давлений. Однако даже при атмосферном давлении предел высоких давлений не наступает в случае констант скорости для рассматриваемых процессов.
Список литературы
Fridman A. Plasma chemistry. Cambridge: Cambridge University Press, 2008.
Starikovskiy A., Aleksandrov N. // Progr. Energy Comb. Sci. 2013. V. 39. P. 61.
Starikovskaia S.M. // J. Phys. D: Appl. Phys. 2014. V. 47. P. 353001.
Ju Y., Sun W. // Progr. Energy Comb. Sci. 2015. V. 48. P. 21.
Kong M.G., Kroesen G., Morfill G., Nosenko T., Shimi-zu T., van Dijk J., Zimmermann J.L. // New J. Phys. 2009. V. 11. P. 115012.
Bruggeman P.J., Ribežl E., Maslani A., Degroote J., Malesevic A., Rego R., Vierendeels J., Leys C. // Plasma Sources Sci. Technol. 2016. V. 25. P. 053002.
Avtaeva S.V., General A.A., Kel’man V.A. // J. Phys. D: Appl. Phys. 2010. V. 43. P. 315201.
Ponomarev A.A., Aleksandrov N.L. // J. Phys. Conf. Ser. 2017. V. 927. P. 012044.
Пономарев А.А., Александров Н.Л. // Физика плазмы. 2018. Т. 44. С. 839.
Sieck L.W., Herron J.T., Green D.S. // Plasma Chem. Plasma Proc. 2000. V. 20. P. 235.
Soloshenko I.A., Tsiolko V.V., Pogulay S.S., Kalyuzh-naya A.G., Bazhenov V.Yu., Shchedrin A.I. // Plasma Sources Sci. Technol. 2009. V. 18. 045019.
Филиппов А.В., Дербенев И.Н., Дятко Н.А., Кур-кин С.А., Лопанцева Г.Б., Паль А.Ф., Старостин А.Н. // ЖЭТФ. 2017. Т. 152. С. 293.
Gallimberti I. // Pure Appl. Chem. 1988. V. 60. P. 663.
Liu D.X., Bruggeman P., Iza F., Rong M.Z., Kong M.G. // Plasma Sources Sci. Technol. 2010. V.19. P. 025018.
Murakami T., Niemi K., Gans T., O’Connell D., Gra-ham W.G. // Plasma Sources Sci. Technol. 2013. V. 22. P. 015003.
Tavant A., Lieberman M.A. // J. Phys. D: Appl. Phys. 2016. V. 49. P. 465201.
Liu D., Sun B., Iza F., Xu D., Wang X., Rong M., Kong M.G. // Plasma Sources Sci. Technol. 2017. V. 26. P. 045009.
Van Gaens W., Bogaerts A. // J. Phys. D: Appl. Phys. 2013. V. 46. P. 275201.
Florescu-Mitchell A.I. and Mitchell J.B.A. // Phys. Rep. 2006. V. 430. P. 277.
Larsson M., Orel A.E. Dissociative recombination of molecular ions. Cambridge: Cambridge University Press, 2008.
Базелян Э.М., Райзер Ю.П. Искровой разряд. Долгопрудный: Изд-во МФТИ, 1997.
Базелян Э.М., Райзер Ю.П. Физика молнии и молниезащиты. М.: Физматлит, 2001.
Johnsen R. // J. Chem. Phys. 1993. V. 98. P. 5390.
Popov M.A., Kochetov I.V., Starikovskiy A.Y., Aleksandrov N.L. // J. Phys. D: Appl. Phys. 2021. V. 54. P. 335201.
Popov M.A., Kochetov I.V., Starikovskiy A.Y., Aleksandrov N.L. // Combust. Flame. 2021. V. 233. P. 111611.
Ellis H.W., Thackston M.G., McDaniel E.W., Ma-son E.A. // Atomic Data and Nuclear Data Tables. 1984. V. 31. P. 113.
Wannier G.H. // Bell Syst. Tech. J. 1953. V. 32. 170.
Young C.E., Falconer W.E. // J. Chem. Phys. 1972. V. 57. P. 918.
Ponomarev A.A., Aleksandrov N.L. // Plasma Sources Sci. Technol. 2015. V. 24. P. 035001.
Longo S. // Plasma Sources Sci. Technol. 2006. V. 15. P. S181.
Lin S.L., Bardsley J.N. // J. Chem. Phys. 1977. V. 66. P. 435.
Panarese A., Longo S. // Astrophys. J. 2012. V. 749. P. 23.
Brown F.B. // Trans. Am. Nucl. Soc. 1994. V. 71. P. 202.
Ponomarev A.A., Aleksandrov N.L. // Plasma Sources Sci. Technol. 2017. V. 26. P. 044003.
Bekstein A., Benhenni M., Yousfi M. // Eur. Phys. J. D. 2011. V. 61. P. 153.
Смирнов Б.М. Комплексные ионы. М.: Наука, 1983.
Lau Y.K., Ikuta S., Kebarle P. // J. Am. Chem. Soc. 1982. V. 104. P. 1462.
Nijdam S., Teunissen J., Ebert U. // Plasma Sources Sci. Technol. 2020. V. 29. P. 103001.
Aleksandrov N.L., Bazelyan E.M. // Plasma Sources Sci. Technol. 1999. V. 8. P. 285.
Александров Н.Л., Базелян Э.М., Новицкий Д.А. // Письма в ЖТФ. 1998. Т. 24. С. 86.
Phelps C.T., Griffiths R.F. // J. Appl. Phys. 1976. V. 47. P. 2929.
Mao X., Chen Q., Rousso A.C., Chen T.Y., Ju Y. // Combust. Flame. 2019. V. 206. P. 522.
Дополнительные материалы отсутствуют.



