Физиология растений, 2019, T. 66, № 1, стр. 13-25
Роль сахарозосинтазы в акцепторных органах древесных растений
Ю. Л. Мощенская a, Н. А. Галибина a, Л. Л. Новицкая a, К. М. Никерова a
a Институт леса – обособленное подразделение Федерального государственного бюджетного учреждения науки “Карельский научный центр Российской академии наук”
Петрозаводск, Россия
Поступила в редакцию 20.11.2017
После доработки 12.01.2018
Принята к публикации 22.01.2018
Аннотация
Фермент сахарозосинтаза (К.Ф. 2.4.1.13) (СС) определяет включение сахарозы в метаболизм клеток камбиальной зоны древесных растений, влияя тем самым на строение и качество древесины. За последнее время накоплен большой объем данных о роли СС в формировании компонентов клеточной стенки и синтезе запасных метаболитов. Однако большинство работ проводится на травянистых растениях. В обзоре рассмотрены возможные механизмы регуляции активности фермента, представлен изоферментный состав и профиль экспрессии генов, кодирующих СС, у древесных растений. Проанализированы имеющиеся в литературе данные о возможной роли СС в разгрузке флоэмы, синтезе компонентов клеточных стенок ксилемы и участии в накоплении крахмала у древесных растений при разных сценариях ксилогенеза.
ВВЕДЕНИЕ
В акцепторных тканях растений расщепление сахарозы происходит за счет деятельности двух ферментов – инвертазы и сахарозосинтазы (СС). Инвертаза (КФ 3.2.1.26) – гидролаза, которая катализирует реакцию гидролиза сахарозы до глюкозы и фруктозы (сахароза + Н2О → глюкоза + + фруктоза) (рис. 1). Гексозы, образующиеся в ходе инвертазного расщепления сахарозы, могут расходоваться на дыхание, синтез крахмала и компонентов клеточных стенок (целлюлоза, гемицеллюлозы, лигнин и др.), а также выступать в роли сигнальных молекул [1]. Инвертаза играет важную роль в поддержании градиента концентрации сахарозы между донорными и акцепторными тканями [1, 2].
Рис. 1.
Пути метаболизации сахарозы и основные пути распределения углерода в акцепторных тканях древесных растений. СС – сахарозосинтаза, Инв – инвертаза, ГК – гексокиназа, ФК – фруктокиназа, ФГМ – фосфоглюкомутаза, ФГИ – фосфоглюкоизомераза, Г-6-Ф – глюкозо-6-фосфат, Ф-6-Ф – фруктозо-6-фосфат, Г-1-Ф – глюкозо-1-фосфат, АДФ – аденозиндифосфат, АТФ – аденозинтрифосфат, УДФ – уридиндифосфат, PPi – пирофосфат.
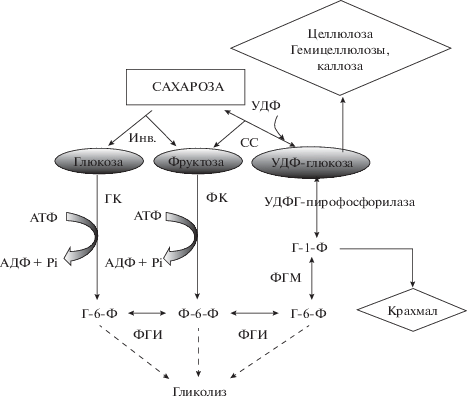
Сахарозосинтаза (К.Ф. 2.4.1.13) представляет собой гликозилтрансферазу: в присутствии уридиндифосфата (УДФ) она обратимо расщепляет сахарозу на уридиндифосфатглюкозу (УДФГ) и фруктозу (сахароза + УДФ ↔ УДФ-глюкоза + + фруктоза) (рис. 1). Несмотря на двойную направленность сахарозосинтазной реакции, в акцепторных тканях СС функционирует, в основном, в направлении распада сахарозы, в связи с высоким запросом на углерод, необходимый для биосинтетических и дыхательных процессов [3]. В клетке СС может находиться в свободном или связанном с мембранами состоянии [1, 3, 4]. Считается, что свободная форма СС поддерживает пул гексозофосфатов, необходимый для дыхания растительных клеток [1, 3–5]. Связанная с цитоплазматической мембраной форма СС входит в состав целлюлозосинтазного комплекса, поставляя УДФ-глюкозу, образующуюся в ходе расщепления сахарозы, непосредственно на синтез целлюлозы [1, 6–15]
Древесные растения являются основными продуцентами в наземных экосистемах, а древесина представляет собой важный возобновляемый источник органического углерода. Ксилогенез – процесс формирования древесины, играет ключевую роль в повышении продуктивности лесов. Образование древесины происходит в результате активности латеральной меристемы – камбия. В период активного камбиального роста камбиальная зона и дифференцирующаяся ксилема становятся основными акцепторами фотоассимилятов у древесного растения. В ходе ксилогенеза СС активно включается в метаболизм клеток на этапе отложения вторичной клеточной стенки [12, 16–19], регулируя количество УДФ-глюкозы, идущей на синтез микрофибрилл целлюлозы. Данная стадия является наиболее важной, поскольку клеточные стенки составляют основную часть древесной биомассы [20]. Несмотря на то, что у древесных растений в период камбиального роста основная функция СС в тканях ствола – участие в синтезе компонентов клеточных стенок ксилемы, УДФ-глюкоза, образующаяся при расщеплении сахарозы СС, может расходоваться также на биосинтез каллозы [6, 9, 13] и крахмала [14, 15]. Исходя из полученных данных, можно сделать вывод, что включение СС в биосинтез компонентов клеточных стенок и/или крахмала в большей степени определяется типом ткани.
В клетках как травянистых, так и древесных растений, образуются множественные изоформы СС, которые отличаются по субстратной специфичности, удельной активности, оптимуму рН. До конца не изученным остается механизм, определяющий локализацию СС в клетке, связывание ее с актином плазматической мембраны или свободное нахождение в цитоплазме. На основе данных, полученных в ходе экспериментов in vitro, было высказано предположение, что локализация СС зависит от статуса фосфорилирования фермента, от рН клеточной среды [3, 10, 21, 22]. Экспрессия генов, кодирующих изоформы СС, является ткане- и органоспецифичной [9, 23], зависит от стадии развития растения и факторов внешней среды [24]. Как правило, на фоне индукции экспрессии одного изофермента, одна или несколько других изоформ репрессируются [25].
В настоящей работе обобщена информация об особенностях функционирования СС и роли фермента в распределении углерода в акцепторных органах древесных растений при разных сценариях ксилогенеза.
РЕГУЛЯЦИЯ И СУБКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ САХАРОЗОСИНТАЗЫ
Различные внешние факторы (анаэробные условия, значение pH среды, температура, уровень влажности почвы, почвенное плодородие и др.) оказывают влияние на активность СС. Регуляция активности СС может осуществляться, как за счет изменения уровня экспрессии кодирующих ее генов, так и на посттрансляционном уровне [1, 22, 26].
СС относится к ферментам, деятельность которых жестко обусловлена статусом углеводного обмена растения, в частности, метаболизма сахарозы. Экспрессия кодирующих СС генов, в значительной степени, зависит от содержания сахаров в тканях растения, при этом изоформы фермента по-разному реагируют на изменение содержания углеводов в клетке [26]. Активность СС возрастает при увеличении концентрации сахарозы в условиях глюкозного голодания клетки и снижается при повышенном содержании глюкозы [22].
Регуляция активности СС на посттрансляционном уровне осуществляется посредством ее фосфорилирования. На листьях кукурузы (Zea mays L.) было показано, что фосфорилирование СС in vitro селективно активирует реакцию расщепления сахарозы посредством увеличения сродства фермента к субстрату. Так, Km для УДФ снижается в 5 раз, а для сахарозы – в 2.5 раза. При этом статус фосфорилирования не влияет на синтетическую активность СС [27].
СС имеет два сайта фосфорилирования – Ser15 (S15) и Ser170 (S170). Устойчивая активная форма СС – это сахарозосинтаза, активированная фосфорилированием по сайту S15 [27, 28]. Фосфорилирование СС по этому сайту осуществляется за счет активности кальций-зависимой протеиновой киназы (CDPK) [28–30]. Показано, что фосфорилирование СС за счет CDPK приводило к увеличению активности фермента в направлении распада сахарозы как в реакции с УДФ, так и с АДФ [31]. Поддержание устойчивой формы СС происходит за счет блокировки второго сайта фосфорилирования (S170) белком ENOD 40 (early nodulin) [29, 32–34]. Отсутствие связывания с защитным белком приводит к фосфорилированию фермента посредством CDPK по S170 сайту. S170-фосфорилированная СС образует конъюгаты с убиквитином и в дальнейшем подвергается убиквитин-опосредованной протеасомной деградации [29] (рис. 2).
Рис. 2.
Модель регуляции сахарозосинтазы (СС) на посттранскрипционном уровне. Активация СС фосфорилированием по сайту Ser15 (S15) происходит за счет кальций-зависимой протеиновой киназы (CDPK) и SnRK1 (SNF1-related protein kinase-1) протеиновой киназы. CPDK-катализируемое фосфорилирование СС по сайту Ser170 (S170) приводит к убиквитин-опосредованной протеасомной деградации СС. Поддержание устойчивой формы СС происходит за счет блокировки второго сайта фосфорилирования (S170) белком ENOD 40 (early nodulin).
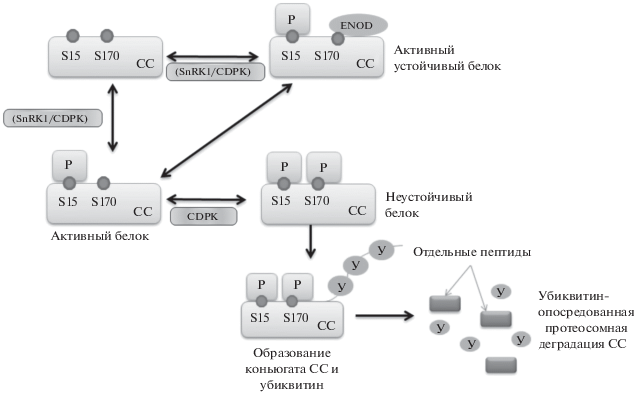
В фосфорилировании СС по сайту S15 может участвовать SnRK1 (SNF1-related protein kinase-1) [29, 35, 36]. SnRK1 относится к SNF1 (sucrose non-fermenting-1) протеиновым киназам, предпочтительно активирующимся в стрессовых условиях, при которых снижается уровень глюкозы и аденозинтрифосфатов и повышается концентрация АМФ [37]. Основная стратегия механизмов, регулируемых этими киназами, направлена на снижение уровня биосинтетических процессов и активацию альтернативных катаболических путей [37]. Следует отметить, что SnRK1 катализирует фосфорилирование СС только по сайту S15 и не участвует в фосфорилировании S170 [1] (рис. 2). Растительные SnRK1, помимо влияния на СС, могут также фосфорилировать сахарозофосфатсинтазу и нитратредуктазу, ингибируя тем самым синтез сахарозы, восстановление неорганического азота и включение его в органические соединения. Регуляция активности СС через SnRK1 осуществляется не только на посттрансляционном уровне, но и на уровне транскрипции. SnRK1 может активировать гены СС и ферментов глиоксилатного цикла, репрессированные глюкозой [37].
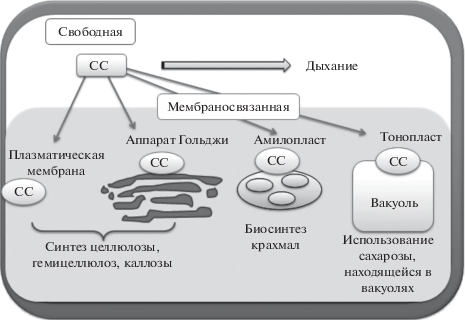
СС в клетке находится в свободном или связанном состоянии, при этом субклеточная локализация фермента влияет на то, как углерод распределяется между конкурирующими путями [1, 3, 4, 38, 39]. Несмотря на то, что СС – растворимый белок, имеется большое количество данных, свидетельствующих о способности данного фермента ассоциироваться с мембранами [3, 13, 29, 38, 40]. СС обычно представлена в виде тетрамерного белка, но может образовывать димеры и, при некоторых условиях, мономеры [38, 39]. Считается, что именно тетрамерная структура СС представляет собой активный фермент, способный связываться с мембранами [41–48].
Одним из основных факторов, влияющих на олигомеризацию CC, является концентрация сахарозы, которая действует как метаболический сигнал, приводящий к формированию тетрамерной формы фермента [29, 38]. Показано, что сахароза оказывает существенное влияние на связывание СС с мембранами in vitro [29], а снижение концентрации сахарозы in vivo приводит к уменьшению связи СС с микросомальными мембранами [38]. Участие сахарозы в регуляции образования тетрамерной формы СС является важным фактором, определяющим клеточную локализацию фермента.
Связыванию СС с мембраной способствует также фосфорилирование фермента (по сайту S15), при этом поддержание тетрамерной структуры СС происходит даже в отсутствие дисахарида [29, 38, 40, 49].
Образованию тетрамера СС в отсутствие сахарозы способствуют низкие значения pH (6.0), тогда как высокий уровень pH (8.5) вызывает образование смеси форм от мономеров до тетрамеров [29, 38]. Способность СС образовывать различные олигомерные структуры в зависимости от рН важна для механизмов, регулирующих каталитическую активность, а также активности мембранного связывания. Исходя из того, что оптимум pH для СС в направлении распада составляет 6−8.5, а в направлении синтеза – 8.5−9.5 [50], можно предположить, что кислые микродомены в окрестности плазматической мембраны повышают активность мембранносвязанной СС в направлении расщепления сахарозы [38].
Имеется большое количество данных, свидетельствующих о способности СС связываться с F‑актином in vitro и возможности ассоциации фермента с актиновым цитоскелетом in vivo [21, 22, 51, 52]. На связывание белка с F-актином влияют факторы, которые способствуют олигомеризации СС, контролируя тем самым внутриклеточную локализацию СС in vivo и включение ее в различные метаболические пути [38].
Мембраносвязанная СС может быть ассоциирована как с плазматической мембраной клетки, так и мембранами различных ее компартментов (аппарата Гольджи, амилопластов, вакуолей) [1]. Продукты расщепления сахарозы, ассоциированной с клеточной стенкой и аппаратом Гольджи, расходуются на биосинтез целлюлозы и каллозы, связанные с мембраной амилопласта – на синтез крахмала [1]; возможная роль СС, локализованной на тонопласте, – использование сахарозы, находящейся в вакуолях [53] (рис. 3). Считается, что продукты распада сахарозы, образующиеся в ходе деятельности свободной СС, расходуются на процессы дыхания и общего метаболизма клетки (рис. 3) [1, 3–5, 54, 55]. У древесных растений в развивающейся ксилеме (главном акцепторе ассимилятов в период камбиального роста) наиболее значимую роль будут иметь изоформы СС, участвующие в синтезе компонентов клеточной стенки, а при альтернативных сценариях ксилогенеза – в синтезе крахмала.
ИЗОФЕРМЕНТНЫЙ СОСТАВ И ПРОФИЛЬ ЭКСПРЕССИИ ГЕНОВ САХАРОЗОСИНТАЗЫ У ДРЕВЕСНЫХ РАСТЕНИЙ
У большинства растений присутствует несколько изоформ СС, кодируемых мультигенным семейством и отличающихся по своим биологическим функциям и кинетическим характеристикам. Гены, кодирующие изоформы СС, различаются по нуклеотидной последовательности и профилям экспрессии [13, 23, 56, 57].
Наиболее изучены изоформы СС у травянистых растений [13, 56, 58]. Исследования функции генов СС проведены, в основном, на модельном растении Arabidopsis, у которого выделено 6 изоформ СС (Sus1-6), объединенных в 3 пары на основании филогенетического анализа [59, 60]. В большей степени изучены изоформы фермента, кодируемые генами Sus1 и Sus2, участвующие в синтезе крахмала в запасающих тканях [43, 61]. Участие СС в синтезе целлюлозы на примере травянистых растений обсуждается в обзоре Haigler с соавторами [58]. У трансгенных растений с пониженной активностью СС наблюдается снижение целлюлозы в клеточной стенке, по сравнению с растениями дикого типа.
Работ, посвященных изучению изоформ СС у древесных растений, очень мало, в основном, такие исследования проводятся на растениях рода Populus. Результаты структурного анализа показали наличие у растений тополя семи генов, кодирующих разные изоформы СС, которые располагаются в 4 (из 19) хромосомах [57]. Высокая идентичность по аминокислотной (АК) последовательности у изоформ и нуклеотидной последовательности кодирующих их генов, найдена между Sus1 и Sus2, Sus4 и Sus5, Sus6 и Sus7. Ген Sus3 выделяют в отдельную группу. Показано, что изоформы СС тополя SS1 и SS2 на 80.9–85.7% идентичны данным изоформам картофеля, томата, Arabidopsis по АК последовательности, и, в меньшей степени, изоформам однодольных (пшеница, кукуруза) – на 74.1–80.0% [57]. В базе данных национального центра биотехнологической информации США (National Center for Biotechnological Information, NCBI) имеется информация по 3 генам (Sus1, Sus2, Sus3), кодирующим СС для видов рода Betula – B. luminifera, B. platyphylla. В 2017 году был секвенирован геном березы повислой, и проведен геномный анализ популяций B. pendula, а также семи других представителей семейства Betulaceae [62].
В исследованиях по изучению экспрессии генов сахарозосинтазного семейства показано, что изменение уровня экспрессии генов СС влияет на содержание целлюлозы в ксилеме древесных растений в большей степени, чем травянистых [11, 12], а также определяет свойства древесины [11, 12, 16, 63–65].
Экспрессия генов, кодирующих СС, ткане- и органоспецифична и зависит от стадии развития растения. Изучение активности СС в тканях ствола 8-летних и 40-летних растений березы повислой на разных этапах вегетационного периода показало, что наибольшая активность фермента (мкмоль распавшейся сахарозы на мг белка) наблюдалась в камбиальном регионе в период активного формирования вторичной клеточной стенки. Из этого следует, что в стволе березы работа фермента связана с деятельностью камбия, а значит, формированием проводящих тканей – ксилемы и флоэмы [18, 66]. В работах по изучению СС на сеянцах P. tremula × tremuloides [65] и P. trichocarpa [15, 57] выявлены различия в распределении уровня экспрессии генов, кодирующих разные изоформы СС в органах и тканях, и показано, что как в зрелой, так и в дифференцирующейся ксилеме наиболее высокие значения экспрессии характерны для генов Sus1, Sus2 [15, 57] и Sus3 (в паренхимных клетках лучей) [57]. Наиболее высокий коэффициент корреляции между активностью СС и экспрессией генов в развивающейся древесине характерен для Sus1 и Sus2 [19, 67]. Вероятно, основная роль генов Sus1 и Sus2 состоит в регуляции поставки углерода для синтеза компонентов клеточной стенки. Для гена Sus3 показан широкий диапазон экспрессии во всех органах и тканях древесных растений, из чего следует, что он относится к группе генов общего метаболизма. Sus3 практически не экспрессируется в формирующихся клетках ксилемы [15]. Как на травянистых, так и на древесных растениях было показано, что изоформа фермента SS1, кодируемая геном Sus1, имеет наибольшее сродство к УДФ, по сравнению с SS2 и SS3 [60, 68]. Интересными на наш взгляд являются данные по активности СС и уровню экспрессии кодирующих ее генов в камбиальном регионе двух форм березы повислой с разными сценариями ксилогенеза – обычной березы повислой (B. pendula var. pendula) (норма) и карельской березы (B. pendula var. carelica) (аномальный ксилогенез) [18, 19]. Было показано, что формирование узорчатой древесины у карельской березы сопровождается снижением активности СС и изменением соотношения уровня транскрипции генов Sus1, Sus2, Sus3 в камбиальном регионе [18, 19]. Так, основную роль в поддержании высокой активности СС у B. pendula var. pendula играла высокая экспрессия гена Sus1, в то время как у B. pendula var. carelica заметное участие в этом принимали также гены Sus2 и Sus3 [19]. Ген Sus2 может участвовать в синтезе целлюлозы при низком уровне транскрипции Sus1 или пониженной активности SuSy1, в частности, при избыточном накоплении в тканях фруктозы, высокие концентрации которой сильно ингибируют или инактивируют SuSy1 [52]. В норме у древесных растений ген Sus3 практически не экcпрессируется в формирующихся клетках древесины, уровень его транскриптов повышается в зрелом листе. Как правило, ген Sus3 имеет широкий диапазон транскрипции в органах и тканях и рассматривается как ген общего метаболизма [15, 57]. Отличительная особенность карельской березы – это увеличение в составе древесины числа паренхимных клеток [69, 70]. Усиление паренхиматизации ксилемы у узорчатых растений может быть причиной изменения состава изоформ. Паренхимные клетки древесины накапливают большое количество запасных компонентов (крахмал, танины), и толщина их клеточных стенок меньше, чем у элементов водопроводящей и механической систем древесины [69, 70].
РОЛЬ САХАРОЗОСИНТАЗЫ В РАЗГРУЗКЕ ФЛОЭМЫ
Разгрузка флоэмы играет ключевую роль в распределении фотоассимилятов на дыхание и биосинтетические процессы в акцепторных органах древесных растений [71]. В период камбиального роста основным акцептором, потребляющим синтезирующуюся в донорных органах сахарозу, является ксилема, что объясняет большую ее массовую и объемную долю, по сравнению с флоэмой [72]. Расходование сахарозы на синтез компонентов клеточных стенок ксилемы способствует оттоку дисахарида и поддержанию градиента концентрации между ксилемой и флоэмой.
Высокая активность СС при формировании ксилемы является одним из основных факторов, создающих ее акцепторную силу. Исследования, проведенные на травянистых растениях (Arabidopsis thaliana, Nicotiana tabacum), показали, что сверхэкспрессия генов, кодирующих СС (AtSySy1-6), приводит к повышению активности фермента в направлении распада сахарозы во всех органах трансгенных растений, по сравнению с диким типом. При этом у трансгенных растений наблюдали возрастание количества сахарозы и общего содержания растворимых сахаров, как предполагают авторы, за счет увеличения интенсивности фотосинтеза [73]. На растениях тополя (Populus × × сanadensis Moench ‘robusta’) [74] и на разновозрастных растениях березы повислой (B. pendula var. pendula) [18] было показано, что в течение вегетации максимальные значения активности СС наблюдаются в период камбиального роста. При этом активность фермента коррелирует с содержанием целлюлозы в дифференцирующейся ксилеме [19]. Поддержание устойчивой активной формы СС в местах быстрой разгрузки флоэмы происходит за счет блокировки второго сайта фосфорилирования (S170) белком ENOD40, для которого в тканях с высокой акцепторной силой повышается уровень экспрессии кодирующих его генов [32, 75, 76].
Снижение активности CC при аномальном ксилогенезе B. pendula var. carelica, приводит к сильному ослаблению потока сахарозы из флоэмы в ксилему, то есть оказывает негативное влияние на разгрузку флоэмы [66]. Разгрузка флоэмы – процесс исключительно важный для поддержания нормального функционирования всего растительного организма [77, 78]. Ослабление запроса на сахарозу со стороны ксилемы у карельской березы должно компенсироваться другими механизмами поддержания градиента концентрации дисахарида между донорными (мезофилл листа) и акцепторными (ткани ствола) тканями древесного растения. У узорчатых деревьев карельской березы ослабление активности СС в ксилеме происходит на фоне многократного увеличения активности апопластной инвертазы во флоэме [79]. Интенсивное инвертазное расщепление сахарозы в данном случае рассматривается как эффективный механизм утилизации избытка дисахарида во флоэме.
УЧАСТИЕ САХАРОЗОСИНТАЗЫ В ФОРМИРОВАНИИ КЛЕТОЧНЫХ СТЕНОК КСИЛЕМЫ
Образование ксилемы (ксилогенез) у древесных растений происходит поэтапно и включает деление камбиальных инициалей и ксилемных производных камбия, их рост и дифференциацию, отложение вторичной клеточной стенки, лигнификацию клеточных оболочек и программированную клеточную смерть [72, 80–82].
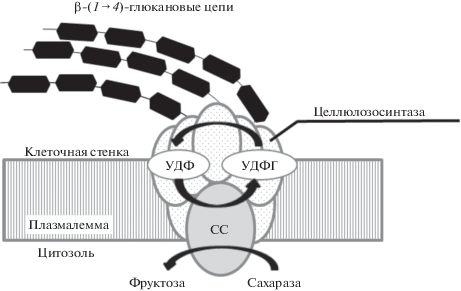
В ходе ксилогенеза активное включение сахарозосинтазы в метаболизм клеток происходит на стадии отложения вторичной клеточной стенки, данный этап является очень важным, поскольку именно вторичные клеточные стенки имеют наибольшую массовую долю в древесине [20]. Участие СС в формировании клеточной стенки обеспечивается за счет образования комплексов из ее мембраносвязанной формы с целлюлозосинтазой [1, 6, 9]. Такая ассоциация дает возможность прямого поступления УДФ-глюкозы, образующейся в ходе сахарозосинтазного расщепления сахарозы, к месту синтеза клеточной стенки. УДФ-глюкоза служит субстратом для синтеза β‑(1 → 4)-глюкановых цепей целлюлозы [6, 11, 12, 83] (рис. 4).
Рис. 4.
Схематическое изображение целлюлозосинтазного комплекса. Сахарозосинтаза, связанная с плазматической мембраной клетки, входит в состав целлюлозосинтазного комплекса. Образующаяся УДФ-глюкоза поступает напрямую к месту синтеза β-(1→4)-глюкановых цепей целлюлозы.
В последнее время появляется все больше работ, в которых участие СС в синтезе целлюлозы демонстрируется с помощью данных молекулярно-генетического анализа. Среди древесных растений такие исследования активно ведутся на тополе. На трансгенных растениях тополя показано, что высокий уровень экспрессии генов сахарозосинтазного семейства коррелирует с активным утолщением вторичных клеточных стенок ксилемы и приводит к увеличению прочности древесины [12, 16, 63, 65]. На взрослых деревьях тополя (Populus tremula) [64], сеянцах его гибридных линий P. alba × P. gradidentata [17], P. deltoides × P. trichocarpa [84], P. tremula × P. tremuloides [68], а также на взрослых растениях двух форм березы повислой (B. pendula var. pendula и var. carelica) [19] выявлена корреляция между уровнем экспрессии генов, кодирующих СС, и количеством содержащейся в древесине целлюлозы. Участие СС в образовании древесины показано на гибридных линиях тополя P. alba × gradidentata [12], P. deltoids × trichocarpa [84] и P. tremula × tremuloides [67]. Выявлено влияние СС на содержание целлюлозы, гемицеллюлоз, лигнина на единицу объема древесины. Снижение экспрессии генов, кодирующих СС, приводит к изменению хемотипа клеточной стенки (в частности, в составе лигнина происходит увеличение соотношения сирингильные/гваяцильные единицы) [67].
Наиболее высокая экспрессия в ксилеме древесных растений установлена для гена Sus1. Известно, что гены Sus1 и Sus2 кодируют изоформы сахарозосинтазы SS1 и SS2, которые у древесных растений имеют перекрывающиеся биологические функции, основной из которых является поставка углерода к месту синтеза клеточных стенок ксилемы [15]. Снижение уровня транскрипции Sus1, Sus2 и на этом фоне активности СС при аномальном ксилогенезе у B. pendula var. carelica сопровождается понижением в формирующейся ксилеме содержания целлюлозы [19].
УЧАСТИЕ САХАРОЗОСИНТАЗЫ В СИНТЕЗЕ КАЛЛОЗЫ
Помимо синтеза целлюлозы, СС принимает участие в синтезе другого полисахарида – каллозы (β-(1 → 3)-глюкана) [1, 85]. На трансгенных растениях A. thaliana (L.) Heynh., у которых отсутствовали 2 изоформы СС, функционирующие во флоэме (SS5 и SS6), было показано снижение объема каллозы в ситовидных элементах [56]. Синтез каллозы происходит при участии мультиэнзимного комплекса, связанного с плазматической мембраной. Субстратом для синтеза каллозы, также, как и целлюлозы, служит УДФ-глюкоза – продукт сахарозосинтазного расщепления сахарозы. В состав каллозосинтазного комплекса входят каллозосинтаза (CalS), УДФ-глюкозотрансфераза (UGT1), белок Rop1, СС и аннексин [53, 86, 87] (рис. 5). UGT1, Rop1 и СС не имеют трансмембранных доменов, составляя часть каллозосинтазного комплекса. Они или непосредственно взаимодействуют с белком CalS, или связываются с мембраной после некоторой посттрансляционной модификации [53]. Функция UGT заключается в передаче УДФ-глюкозы из сахарозосинтазной субъединицы в CalS, Rop1 выступает в качестве молекулярного переключателя, контролирующего активность CalS. Возможное расположение этих двух белков в центральном гидрофильном домене пептида CalS может создать канал для переноса УДФ-глюкозы. Подобная ассоциация белков в каллозосинтазном комплексе обеспечивает быстрый поток субстрата для синтеза значительных количеств каллозы, необходимых для заполнения большого объема растущей клеточной пластинки, менее чем за 60 мин [53].
Рис. 5.
Схематическое изображение каллозосинтазного комплекса на плазмалемме (по [53] с изменениями). CalS – каллозосинтаза, UGT – УДФ-глюкозотрансфераза, Rop – белок Rop1, СС – сахарозосинтаза.
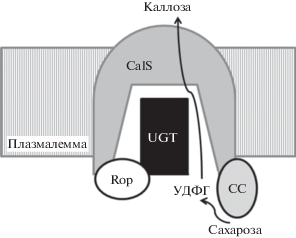
Во флоэме каллозные отложения свойственны, главным образом, ситовидным элементам, что отличает их от прочих клеток проводящих тканей. Каллоза откладывается на поверхности ситовидных пластинок ситовидных трубок, концентрируясь в области соединяющих трубки пор [78]. Широко распространено мнение, что быстрое отложение каллозы обеспечивает механизм регуляции межклеточного потока, а каллозные пробки играют роль выключателей межклеточных контактов на тех участках пути, где возникает неисправность, что сохраняет работоспособность остальной части проводящей системы [88–90]. Отложение каллозы происходит в ходе нормального онтогенеза структурных элементов тканей, а также стимулируется воздействием различных факторов окружающей среды [86, 89–94].
Наиболее быстрым способом утилизации избытка сахарозы в растениях является синтез крахмала, однако в ситовидных элементах проводящей флоэмы запасание крахмала не происходит, а образование β-(1 → 3)-глюкана и синтез каллозы является наиболее эффективным способом поддержания концентрационного градиента сахарозы. В этой связи, интересными являются данные, полученные на двух формах березы повислой (обычной и карельской березе) в опытах по внесению в почву нитратного азота [95]. Было показано, что экзогенный нитрат приводит к усилению синтеза сахарозы в листьях и ее оттока к потребляющим органам. У обычной березы увеличение концентрации сахарозы в акцепторных тканях ствола приводило к возрастанию активности СС в ксилеме, усилению использования дисахарида в этой ткани и сопровождалось увеличением прироста древесины. Стимуляция процессов образования древесины у березы приводила к снижению активности СС во флоэме [95] и снижению содержания в проводящей флоэме каллозы (наши неопубликованные данные). У деревьев карельской березы, характеризующихся аномальным ксилогенезом, напротив, внесение нитратного азота в почву приводило к снижению активности СС в ксилеме и увеличению использования сахарозы во флоэме, о чем свидетельствует увеличение здесь активности СС, а также апопластной инвертазы [95]. Возрастание метаболизации сахарозы во флоэме у карельской березы сопровождалось увеличением отложения каллозы в проводящей флоэме (наши неопубликованные данные).
РОЛЬ САХАРОЗОСИНТАЗЫ В БИОСИНТЕЗЕ КРАХМАЛА
В литературе имеются многочисленные данные об участие СС в биосинтезе крахмала [23, 61, 96]. Схематическое изображение возможных путей биосинтеза крахмала представлено на рисунке 6. УДФ-глюкоза, образованная при расщеплении сахарозы СС, переводится в глюкозо-1-фосфат (Г‑1-Ф) в реакции, катализируемой УДФГ-пирофосфорилазой. Из Г-1-Ф образуется (1) глюкозо-6-фосфат (Г-6-Ф) под действием фосфоглюкомутазы (этот путь, в большей степени, встречается у двудольных растений) или (2) АДФ-глюкоза в реакции, катализируемой АДФГ-пирофосфорилазой (этот путь протекает при развитии семян однодольных растений). Г-6-Ф и АДФ-глюкоза, в свою очередь, транспортируются в амилопласты. АДФ-глюкоза непосредственно используется на синтез крахмала в реакции, катализируемой крахмалсинтазой, а Г-6-Ф преобразуется в Г-1-Ф и переводится в АДФ-глюкозу при участии АДФГ-пирофосфорилазы (рис. 6). Путь образования крахмала из УДФ-глюкозы считается приоритетным в акцепторных тканях растений [61, 97, 98], и УДФ является преимущественным субстратом для сахарозосинтазной реакции [61, 99]. Показано, что АДФ также может вступать в катализируемую СС реакцию. В результате такой реакции образуется АДФ-глюкоза, транспортируемая к месту синтеза крахмала в амилопласты [61, 99, 100] (рис. 6).
Рис. 6.
Участие сахарозосинтазы в синтезе крахмала. ГК – гексокиназа, ФГМ – фосфоглюкомутаза, ФГИ – фосфоглюкоизомераза, Ф-6-Ф – фруктозо-6-фосфат, Г-6-Ф – глюкозо-6-фосфат, Г-1-Ф – глюкозо-1-фосфат, АДФ – аденозиндифосфат, АТФ–аденозинтрифосфат, УДФ – уридиндифосфат, УТФ – уридинтрифосфат, PPi – пирофосфат.
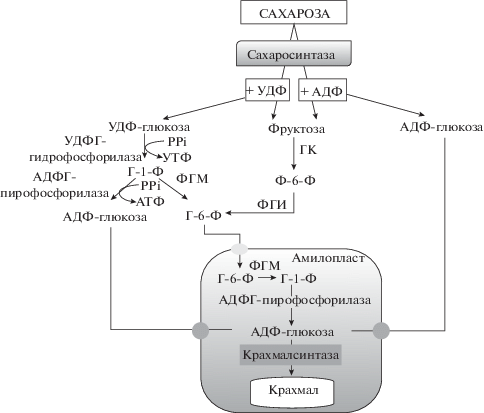
Работы, выполненные на травянистых растениях, показывают корреляцию активности СС с накоплением крахмала в запасающих тканях и органах [14, 43]. У древесных растений основная функция СС в тканях ствола в период камбиального роста – участие в синтезе компонентов клеточных стенок ксилемы. На разновозрастных деревьях березы повислой показано, что в этот период на фоне высокой активности СС запасание крахмала происходит слабо [18], а продукты метаболизации сахарозы расходуются преимущественно на синтез целлюлозы [19]. В условиях временного торможения камбиальной деятельности погодными условиями происходило снижение активности СС в ксилеме. При этом возрастала утилизация сахарозы во флоэме, и на фоне повышения активности СС происходило значительное накопление крахмала в проводящей флоэме [18]. У растений карельской березы в местах формирования аномалий содержание крахмала было намного выше, и при этом наблюдается корреляция активности СС с накоплением крахмала, как во флоэме, так и в ксилеме, что, вероятно, связано с увеличением числа паренхимных клеток в составе узорчатой древесины [18, 19]. Таким образом, в тканях ствола древесных растений в период камбиального роста СС может принимать участие в синтезе крахмала (1) во флоэме при появлении избыточных количеств сахарозы в проводящей флоэме и (2) в ксилеме при дифференцировке камбиальных производных в паренхимные клетки (живые клетки лучевой и аксиальной паренхимы) вместо прозенхимных клеток (сосуды, волокна).
В заключение следует отметить, что спектр функций, выполняемых СС в растениях, очень широк. Очевидно, что в акцепторных тканях древесных растений физиологически наиболее значимым является участие данного фермента в синтезе компонентов клеточных стенок сосудов и волокон, составляющих основную часть древесной биомассы. На разных видах древесных растений показано, что СС обеспечивает приоритетный путь метаболизации сахарозы в ходе ксилогенеза. Регуляция активности СС, в значительной степени, осуществляется на уровне транскрипции, и уровень экспрессии кодирующих ее генов неодинаков в ксилеме древесных растений, различающихся по структурному составу древесины. В свою очередь, изоферментный состав СС и уровень транскрипции генов, кодирующих определенные изоформы, очень сильно варьирует в зависимости от условий внешней среды, стадии онтогенеза и типа растительной ткани. При воздействии определенных факторов и в зависимости от условий клеточной среды СС, помимо ее участия в формировании вторичных клеточных стенок, может включаться также в биосинтез крахмала и каллозы. Продукты сахарозосинтазного расщепления сахарозы могут расходоваться в процессах дыхания и общем метаболизме клетки. Данные о деятельности СС в акцепторных органах древесных растений могут быть использованы для изучения продуктивности и поиска путей управления ксилогенезом.
Работа выполнена при финансовой поддержке грантов Российского фонда фундаментальных исследований № 16-04-100639_ р_а и № 16-04-01191_а, средств федерального бюджета на выполнение государственного задания ИЛ КарНЦ РАН.
Список литературы
Koch K.E. Sucrose metabolism: regulatory mechanisms and pivotal roles in sugar sensing and plant development // Curr. Opin. Plant Biol. 2004. V. 7. P. 235–246.
Greenshields D.L., Wang F., Wei Y., Selvaraj G. Activity and gene expression of acid invertases in einkorn wheat (Triticum monococcum) infected with powdery mildew // Can. J. Plant Pathol. 2004. V. 26. P. 506−513.
Winter H., Huber J.L., Huber S.C. Membrane association of sucrose synthase: changes during the gravi response and possible control by protein phosphorylation // FEBS Lett. 1997. V. 420. P. 151–155.
Komina O., Zhou Y., Sarath G., Chollet R. In vivo and in vitro phosphorylation of membrane and soluble forms of soybean nodule sucrose synthase // Plant Physiol. 2002. V. 129. P. 1664–1673.
Rees A.P., Wilson P.M., Wright B.W. The ability of Sordaria fimicola to take up and metabolize glucose and sucrose // J. Gen. Microbiol. 1984. V. 130. P. 3235–3238.
Amor Y., Haigler C.H., Johnson S., Wainscott M., Delmer D.P. A membrane-associated form of sucrose synthase and its potential role in synthesis of cellulose and callose in plants // Proc. Natl. Acad. Sci. USA. 1995. V. 92. P. 53–57.
Delmer D.P., Amor Y. Cellulose biosynthesis // The Plant Cell. 1995. V. 7. P. 987–1000.
Carlson S.J., Chourey P.S., Chourey P.S. Evidence for plasma membrane-associated forms of sucrose synthase in maize // Mol. Gen. Genet. 1996. V. 252. P. 303−310.
Sturm A., Tang G.Q. The sucrose-cleaving enzymes of plants are crucial for development, growth and carbon partitioning // Trends Plant Sci. 1999. V. 4. P. 401–407.
Barratt D.H.P., Barber L., Kruger N.J., Smith A.M., Wang T.L., Martin C. Multiple, Distinct isoforms of sucrose synthase in pea // Plant Physiol. 2001. V. 127. P. 655−664.
Coleman H.D. Up-regulation of sucrose synthase and UDP-glucose pyrophosphorylase impacts plant growth and metabolism // Plant Biotechnol. 2006. V. 4. P. 87–101.
Coleman H.D., Yan J., Mansfield S.D. Sucrose synthase affects carbon partitioning to increase cellulose production and altered cell wall ultrastructure // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 13118–13123.
Ruan Y.L., Llewellyn D.J., Furbank R.T. Suppression of sucrose synthase gene expression represses cotton fiber cell initiation, elongation, and seed development // Plant Cell. 2003. V. 15. P. 952–964.
Baroja-Fernandez E., Munoz F.J., Li J., Bahaji A., A-lmagro G., Montero M., Etxeberria E., Hidalgo M., Sesma M.T., Pozueta-Romero J. Sucrose synthase activity in the sus1/sus2/sus3/sus4 Arabidopsis mutant is sufficient to support normal cellulose and starch production // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 321–326.
Geisler-Lee J., Geisler M., Coutinho P.M., Segerman B., Nishikubo N. Poplar carbohydrate-active enzymes. Gene identification and expression analyses // Plant Physiol. 2006. V. 140. P. 946–962.
Hauch S., Magel E. Extractable activities and protein content of sucrose-phosphate synthase, sucrose synthase and neutral invertase in trunk tissues of Robinia pseudoacacia L. are related to cambial wood production and heartwood formation // Planta. 1998. V. 207. P. 266–274.
Hertzberg M., Aspeborg H., Schrader J., Andersson A., Erlandsson R., Blomqvist K., Bhalerao R., Uhlen M., Teeri M., Lundeberg J., Sundberg R., Nilsson P., Sandberg G. A transcriptional roadmap to wood formation // Proc. Natl. Acad. Sci. USA. 2001. V. 98. P. 14732–14737.
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. Активность сахарозосинтазы в тканях ствола карельской березы в период камбиального роста // Физиология растений. 2015. Т. 62. P. 410–419.
Мощенская Ю.Л., Галибина Н.А., Топчиева Л.В., Новицкая Л.Л. Экспрессия генов, кодирующих изоформы сахарозосинтазы, в ходе аномального ксилогенеза карельской березы // Физиология растений. 2017. Т. 64. С. 301–310.
Dinwoodie J.M. Timber—a review of the structure-mechanical property relationship // J. Microscopie. 1975. V. 104. P. 3–32.
Winter H., Huber J.L., Huber S.C. Identification of sucrose synthase as an actin-binding protein // FEBS Lett. 1998. V. 430. P. 205−208.
Winter H., Huber S.C. Regulation of sucrose metabolism in higher plants: localization and regulation of activity of key enzymes // Crit. Rev. Plant Sci. 2000. V. 19. P. 31–67.
Kladnik A., Chamusco K., Chourey P.S., Dermastia M. In situ detection of programmed cell death in the maize caryopsis // Period. Biol. 2005. V. 107. P. 11–16.
Ашмарин И.П. Молекулярная биология. Л.: Издательство ЛГУ, 1977. 220 с.
Xu J., Pemberton G.H., Almira E.C., McCarty D.R., Koch K.E. The Ivr1 gene for invertase from maize // Plant Physiol. 1995. V. 108. P. 1293–1294.
Koch K.E. Carbohydrate-modulated gene expression in plants // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1996. V. 47. P. 509–540.
Huber S.C., Huber J.L., Laio P.C., Gage D.A., McMichael R.W.Jr., Chourey P.S., Hannah L.C., Koch K.E. Phosphorylation of serine-15 of maize leaf sucrose synthase // Plant Physiol. 1996. V. 112. P. 793–802.
Zhang X.Q., Lund A.A., Sarath G., Cerny R.L., Roberts D.M., Chollet R. Soybean nodule sucrose synthase (nodulin-100): further analysis of its phosphorylation using recombinant and authentic root-nodule enzymes // Arch. Biochem. Biophys. 1999. V. 371. P. 70–82.
Hardin S.C., Duncan K.A., Huber S.C. Determination of structural requirements and probable regulatory effectors for membrane association of maize sucrose synthase1 // Plant Physiol. 2006. V. 141. P. 1106–1119.
Cheng S.H., Willmann M.R., Chen H.C., Sheen J. Calcium signaling through protein kinases. The Arabidopsis calcium-dependent protein kinase gene family // Plant Physiol. 2002. V. 129. P. 469–485.
Takeda H., Niikura M., Narumi A., Aoki H., Sasaki T., Shimada H. Phosphorylation of rice sucrose synthase isoforms promotes the activity of sucrose degradation // Plant Biotechnol. 2017. V. 34. P. 107–113.
Kouchi H., Takane K., So R.B., Ladha J.K., Reddy P.M. Rice ENOD40: isolation and expression analysis in rice and transgenic soybean root nodules // Plant J. 1999. V. 18. P. 121–129.
Rohrig H., John M., Schmidt J. Modification of soybean sucrose synthase by S-thiolation with ENOD40 peptide A // Biochem. Bioph. Res. Co. 2004. V. 325. P. 864–870.
Rohrig H., Schmidt J., Miklashevichs E., Schell J., John M. Soybean ENOD40 encodes two peptides that bind to sucrose synthase // Proc. Natl. Acad. Sci. USA. 2002. V. 99. P. 1915–1920.
Purcell P.C., Smith A.M., Halford N.G. Antisense expression of a sucrose non-fermenting-1-related protein kinase sequence in potato results in decreased expression of sucrose synthase in tubers and loss of sucrose-inducibility of sucrose synthase transcripts in leaves // Plant J. 1998. V. 14. P. 195–202.
Chikano H., Ogawa M., Ikeda Y., Koizumi N., Kusano T., Sano H. Two novel genes encoding SNF-1 related protein kinases from Arabidopsis thaliana: differential accumulation of AtSR1 and AtSR2 transcripts in response to cytokinins and sugars, and phosphorylation of sucrose synthase by AtSR2 // Mol. Gen. Genet. 2001. V. 264. P. 674–681.
Джамеев В.Ю. Внутриклеточный сигналинг у растений: учебное пособие. Х.: АССА, 2015. 224 с.
Duncan K.A., Huber S.C. Sucrose synthase oligomerization and F-actin association are regulated by sucrose concentration and phosphorylation // Plant Cell Physiol. 2007. V. 48. P. 1612–1623
Winter H., Huber S.C. Sucrose metabolism and the actin cytoskeleton: SuSy as actin-binding protein // A-ctin: a dynamic framework for multiple plant cell functions. Developments in plant and soil sciences / Eds. Staiger C.J., Baluška F., Volkmann D., Barlow P.W. Dordrecht: Springer, 2013. P. 119–128.
Hardin S.C., Winter H., Huber S.C. Phosphorylation of the amino terminus of maize sucrose synthase in relation to membrane association and enzyme activity // Plant Physiol. 2004. V. 134. P. 1427–1438.
Su J.C., Preiss J. Sucrose synthase from corn kernels // Seikagaku. 1977. V. 49. P. 6.
Chourey P.S. Genetic control of sucrose synthetase in maize endosperm // Mol. Gen. Genet. 1981. V. 184. P. 372−376.
Echt C.S., Chourey P.S. A Comparison of two sucrose synthetase isozymes from normal and shrunken-1 maize // Plant Physiol. 1985. V. 79. P. 530–536.
Chourey P.S., Latham M., Still P.E. Expression of two sucrose synthase genes in endosperm and seedling cells of maize: evidence of tissue-specific polymerization of protomers // Mol. Gen. Genet. 1986. V. 203. P. 251–255.
McElfresh K.C., Chourey P.S. Anaerobiosis induces transcription but not translation of sucrose synthase in maize // Plant Physiol. 1988. V.87. P. 542–546.
Koch K.E., Nolte K.D., Duke E.R., McCarty D.R., Avigne W.T. Sugar levels modulate differential expression of maize sucrose synthase genes // Plant Cell. 1992. V. 4. P. 59–69.
Chourey P.S., Taliercio E.W. Epistatic interaction and functional compensation between the two tissue- and cell-specific sucrose synthase genes in maize // Proc. Natl. Acad. Sci. USA. 1994. V. 91. P. 7917–7921.
Hardin S.C., Huber S.C. Proteasome activity and the post-translational control of sucrose synthase stability in maize leaves // Plant Physiol. Biochemistry. 2004. V. 42. P. 197–208.
Duncan K.A., Hardin S.C., Huber S.C. The Three maize sucrose synthase isoforms differ in distribution, localization, and phosphorylation // Plant Cell Physiol. 2006. V. 47. P. 959–971.
Morell M., Copeland L. Sucrose synthase of soybean nodules // Plant Physiol. 1985. V. 78. P. 149–154.
Azama K., Abe S., Sugimoto H., Davies E. Lysine-containing proteins in maize endosperm: a major contribution from cytoskeleton-associated carbohydrate-metabolizing enzymes // Planta. 2003. V. 217. P. 628−638.
Matic S., Akerlund H.-E., Everitt E., Widell S. Sucrose synthase isoforms in cultured tobacco cells // Plant Physiol. Biochem. 2004. V. 42. P. 299–306.
Hong Z., Zhang Z., Olson J.M., Verma D.P. A novel UDP-glucose transferase is part of the callose synthase complex and interacts with phragmoplastin at the forming cell plate // Plant Cell. 2001. V. 13. P. 769−779.
Copeland L. Enzymes of sucrose metabolism // Methods Plant Biochem. 1990. V. 3. P. 73–85.
Quick W.P., Schaffer A.A. Sucrose metabolism in sources and sinks // Photoassimilate distribution in plants and crops: source-sink relationships / Eds. Zamski E., Schaffer, A.A. New York: Marcel Dekker, 1996. P. 115–156.
Barratt D.H., Derbyshire P., Findlay K., Pike M., Wellner N., Lunn J., Feil R., Simpson C., Maule A.J., Smith A.M. Normal growth of Arabidopsis requires cytosolic invertase but not sucrose synthase // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 13124–13129.
Zhang D., Xu B., Yang X., Zhang Z., Li B. The sucrose synthase gene family in Populus: structure, expression, and evolution // Tree Genet. Genome. 2011. V. 7. P. 443–456.
Haigler C.H, Ivanova-Datcheva M., Hogan P.S., Salnikov V.V., Hwang S., Martin L.K., Delmer D.P. Carbon partitioning to cellulose synthesis // Plant Mol. Biol. 2001. V. 47. P. 29–51.
Baud S., Vaultier M.-N., Rochat C. Structure and expression profile of the sucrose synthase // J. Exp. Bot. 2004. V. 55. P. 397–409.
Bieniawska Z., Barratt D.H., Garlick A.P., Thole V., Kruger N.J., Martin C., Zrenner R. Analysis of the sucrose synthase gene family in Arabidopsis // Plant J. 2007. V. 49. P. 810–828.
Baroja-Fernández E., Muñoz F.J., Saikusa T., Rodríguez-López M., Akazawa T., Pozueta-Romero J. Sucrose synthase catalyzes the de novo production of ADP-glucose linked to starch biosynthesis in heterotrophic tissues of plants // Plant Cell Physiol. 2003. V. 44. P. 500–509.
Salojärvi J. et al. Genome sequencing and population genomic analyses provide insights into the adaptive landscape of silver birch // Nat. Genet. 2017. V. 49. P. 904–912.
Salnikov V.V., Grimson M.J., Delmer D.P., Haigler C.H. Sucrose synthase localizes to cellulose synthesis sites in tracheary elements // Phytochemistry. 2001. V. 57. P. 823–833.
Andersson-Gunneras S., Mellerowicz E.J., Love J., Segerman B., Ohmiya Y., Coutinho P.M., Nilsson P., Henrissat B., Moritz T., Sundberg B. Biosynthesis of cellulose-enriched tension wood in Populus: global analysis of transcripts and metabolites identifies biochemical and developmental regulators in secondary wall biosynthesis // Plant J. 2006. V. 45. P. 144–165.
Nilsson R., Bernfur K., Gustavsson N., Bygdell J., Wingsle G., Larsson C. Proteomics of plasma membranes from poplar trees reveals tissue distribution of transporters, receptors, and proteins in cell wall formation // Mol. Cell. Proteomics. 2010. V. 9. P. 368–387.
Мощенская Ю.Л. Активность сахарозосинтазы в ходе ксилогенеза двух форм Betula pendula Roth, отличающихся по текстуре древесины: Автореф. дисс. канд. биол. наук. СПб: БИН РАН, 2017. 24 с.
Gerber L., Zhang B., Roach M., Rende U., Gorzsas A., Kumar M., Burgert I., Niittylla T., Sundberg B. Deficient sucrose synthase activity in developing wood does not specifically affect cellulose biosynthesis, but causes an overall decrease in cell wall polymers // New Phytol. 2014. V. 203. P. 1220–1230.
Tanase K., Yamaki S. Purification and characterization of two sucrose synthase isoforms from Japanese pear fruit // Plant Cell Physiol. 2000. V. 41. P. 408−414.
Любавская А.Я. Карельская береза. Москва: Лесная промышленность, 1978. 158 с.
Новицкая Л.Л. Карельская береза: механизмы роста и развития структурных аномалий. Петрозаводск: Verso, 2008. 144 с.
Chen Ch., Yuan Yu., Zhang Ch., Li H., Ma F., Li M. Sucrose phloem unloading follows an apoplstic pathway with high sucrose synthase in Actinidia fruit // Plant Sci. 2017. V. 255. P. 40−50.
Plomion C., Leprovost G., Stokes A. Wood Formation in Trees // Plant Physiol. December 2001. V. 127. P. 1513–1523.
Nguyen Q.A., Luan S., Wi S.G., Bae H., Lee D.-S., Bae H.-J. Pronounced phenotypic changes in transgenic tobacco plants overexpressing sucrose synthase may reveal a novel sugar signaling pathway // Front. Plant Sci. 2016. V. 6. P. 1–15.
Shrader S., Sauter J.J. Seasonal changes of sucrose-phosphate synthase and sucrose synthase activities in poplar wood (Populus × canadensis Moench “robusta”) and their possible role in carbohydrate metabolism // J. Plant Physiol. 2002. V. 159. P. 833−843.
Hardin S.C., Tang G-Q., Scholz A., Holtgraewe D., Winter H., Huber S.C. Phosphorylation of sucrose synthase at serine 170: occurrence and possible role as a signal for proteolysis // Plant J. 2003. V. 35. P. 588–603.
Varkonyi-Gasic E., White D.W. The white clover enod40 gene family. Expression patterns of two types of genes indicate a role in vascular function // Plant Physiol. 2002. V. 129. P. 1107–1118.
Гамалей Ю.В. Транспортная система сосудистых растений. С.-Пб.: Изд-во Санкт-Петербургского государственного университета, 2004. 422 с.
Курсанов А.Л. Транспорт ассимилятов в растениях. Москва: Наука, 1976. 647 с.
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. Активность инвертазы в тканях ствола карельской березы // Физиология растений. 2015. Т. 62. С. 804–813.
Savidge R.A. Biochemistry of seasonal cambial growth and wood formation - an overview of the challenges // In: Cell and molecular biology of wood formation. E-xperimental biology reviews / Ed. by Savidge R.A. Oxford: BIOS Scientific Publishers, 2000. P. 1–30.
Du J., Groover A. Transcriptional regulation of secondary growth and wood formation // JIPB. 2010. V. 52. P. 17–27.
Ye Z.H., Zhong R. Molecular control of wood formation in trees // J. Exp. Bot. 2015. V. 66. P. 4119–4131.
Ruan Y.-L. Sucrose metabolism: gateway to diverse carbon use and sugar signaling // Annu. Rev. Plant B-iol. 2014. V. 65. P. 33–67.
Song D.L., Shen J.H., Li L.G. Characterization of cellulose synthase complexes in Populus xylem differentiation // New Phytol. 2010. V. 187. P. 777–790.
Pirselova B., Mistrikova V., Libantova J., Moravcikova J., Matusikova I. Study on metal-triggered callose deposition in roots of maize and soybean // Biologia. 2012. V. 67. P. 698−705.
Pirselova B., Matusikova I. Callose: the plant cell wall polysacchride with multiple biological functions // Acta Physiol. Plant. 2013. V. 35. P. 635–644.
Chen X.Y., Kim J.Y. Callose synthesis in higher plant // Plant. Signal. Behav. 2009. V. 4. P. 489−492.
Botha C.E.J., Cross R.H.M. Towards reconciliation of structure with function in plasmodesmata – Who is the gatekeeper? // Micron. 2000. V. 31. P. 713–721.
Iglesias V.A., Meins F. Movement of plant viruses is delayed in a beta-1,3-glucanase-deficient mutant showing a reduced plasmodesmatal size exclusion limit and enhanced callose deposition // Plant J. 2000. V. 21. P. 157–166.
Simpson C., Thomas C., Findlay K., Bayer E., Maule A.J. An Arabidopsis GPI-anchor plasmodesmal neck protein with callose binding activity and potential to regulate cell-to-cell trafficking // Plant Cell. 2009. V. 21. P. 581–594.
McNairn R.B. Phloem translocation and heat-induced callose formation in field-grown Cossypium hirsutum L. // Plant Physiol. 1972. V. 50. P. 366–370.
Hughes J.E., Gunning B.E.S. Glutaraldehyde-induced deposition of callose // Can. J. Bot. 1980. V. 58. P. 250–258.
Sivaguru M., Fujiwara T., Samaj J., Baluska F., Yang Z., Osawa H., Maeda T., Mori T., Volkmann D., Matsumoto H. Aluminum-induced 1 → 3-beta-D-glucan inhibits cell-to-cell trafficking of molecules through plasmodesmata. A new mechanism of aluminum toxicity in plants // Plant Physiol. 2000. V. 124. P. 991–1006.
Maeda H., Song W., Sage T.L., Dellapenna D. Tocopherols play a crucial role in low-temperature adaptation and phloem loading in Arabidopsis // Plant Cell. 2006. V. 18. P. 2710–2732.
Галибина Н.А., Новицкая Л.Л., Никерова К.М. Избыток экзогенных нитратов подавляет формирование аномальной древесины у карельской березы // Онтогенез. 2016. Т. 47. № 2. С. 83–91.
Patrick J.W., Botha F.C., Birch R.G. Metabolic engineering of sugars and simple sugar derivatives in plants // Plant Biotechnol. J. 2013. V. 11. P. 142–156.
Tauberger E., Fernie A.R., Emmermann M., Renz A., Kossmann J., Willmitzer L., Trethewey R.N. Antisense inhibition of plastidial phosphoglucomutase provides compelling evidence that potato tuber amyloplasts import carbon from the cytosol in the form of glucose-6-phosphate // Plant J. 2000. V. 23. P. 43–53.
Tiessen A., Hendriks J.H.M., Stitt M., Branscheid A., Gibon Y., Farre E.M., Geigenberger P. Starch synthesis in potato tubers is regulated by post-translational redox modification of ADP-glucose pyrophosphorylase: a novel regulatory mechanism linking starch synthesis to the sucrose supply // Plant Cell. 2002. V. 14. P. 2191–2213.
Pozueta-Romero J., Perata P., Akazawa T. Sucrose-starch conversion in heterotrophic tissues of plants // Crit. Rev. Plant Sci. 1999. V. 18. P. 489−525.
Shannon J.C., Pien F.-M., Cao P., Liu K.-C. Brittle-1, an adenylatetranslocator, facilitates transfer of extraplastidial ADP-glucose into amyloplasts of maize endosperms // Plant Physiol. 1998. V. 117. P. 1235–1252.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений