Физиология растений, 2019, T. 66, № 1, стр. 26-34
Влияние донора сероводорода на состояние антиоксидантной системы и устойчивость растений пшеницы к почвенной засухе
Ю. Е. Колупаев a, Е. Н. Фирсова a, Т. О. Ястреб a, Н. И. Рябчун b, В. В. Кириченко a, b
a Харьковский национальный аграрный университет им. В.В. Докучаева
Харьков, Украина
b Институт растениеводства им. В.Я. Юрьева Национальной академии аграрных наук Украины
Харьков, Украина
Поступила в редакцию 27.12.2017
После доработки 28.01.2018
Принята к публикации 02.02.2018
Аннотация
Исследовали влияние обработки растений донором сероводорода гидросульфидом натрия (NaHS) на состояние антиоксидантной и осмопротекторной систем молодых растений озимой пшеницы (Triticum aestivum L.) сорта Досконала в условиях почвенной засухи (постепенное снижение влажности почвы до 25–30% от ПВ). Опрыскивание растений растворами NaHS (0.1–0.5 мМ) заметно смягчало ростингибирующее действие засухи и способствовало сохранению пула хлорофиллов. Положительное влияние гидросульфида натрия на растения устранялось их обработкой скавенджером сероводорода гидроксиламином. Предобработка растений NaHS предотвращала вызываемое засухой повышение в листьях содержания пероксида водорода и продукта пероксидного окисления липидов малонового диальдегида. Обработка растений раствором гидросульфида натрия перед засухой способствовала повышению активности супероксиддисмутазы (СОД) и предотвращала вызываемое стрессом снижение активности каталазы и гваяколпероксидазы в листьях. Также под влиянием донора сероводорода в листьях растений пшеницы при засухе повышалось содержание пролина и существенно возрастало количество антоцианов и флавоноидов, поглощающих в УФ. Сделано заключение о значительном вкладе СОД и флавоноидных соединений в защитное действие донора сероводорода на растения в условиях засухи.
ВВЕДЕНИЕ
В последние годы интенсивно исследуется физиологическая роль так называемых газотрансмиттеров – газообразных сигнальных молекул, которые могут восприниматься клетками, а также участвовать в передаче сигналов из окружающей среды у разных групп организмов – бактерий, грибов, млекопитающих и растений [1]. Среди них особый интерес вызывает сероводород, который рассматривается как сигнальная молекула, реализующая физиологические эффекты во взаимодействии с монооксидом азота (NO), монооксидом углерода (CO) и активными формами кислорода (АФК) [1, 2]. К настоящему времени получены сведения об изменении содержания эндогенного сероводорода в клетках растений при действии стрессоров различной природы, в частности, засухи, экстремальных температур, засоления, тяжелых металлов [2–4]. В исследованиях, выполненных с использованием растений различной таксономической принадлежности, показаны эффекты индуцирования их устойчивости к стресс-факторам действием доноров сероводорода [2].
Установлена и природа отдельных защитных реакций, развивающихся с участием сероводорода, у растений разных видов. Так, показано усиление экспрессии генов и повышение активности антиоксидантных ферментов под влиянием донора H2S [4]. Зарегистрированы и эффекты индуцирования донорами сероводорода накопления в растительных клетках низкомолекулярных защитных соединений, в частности, сахаров [5] и пролина [2].
Вследствие глобальных климатических изменений отмечается увеличение частоты и продолжительности засух [6]. Одним из последствий влияния засухи на растения является нарушение функционирования фотосинтетического аппарата. Ограничение поступления углекислого газа из-за закрывания устьиц приводит к эффекту перевосстановленности электрон-транспортной цепи хлоропластов и продуцированию АФК [6]. Так, в клетках листьев пшеницы при засухе утечка электронов от ферредоксина к молекулярному кислороду в реакции Mehler может увеличиваться на 50%. Также в условиях засухи усиливается образование АФК в других клеточных компартментах, в особенности в митохондриях [7]. В связи с этим экзогенные воздействия, индуцирующие антиоксидантную систему, рассматриваются в качестве приемов, эффективно повышающих засухоустойчивость растений [6].
Под влиянием гидросульфида натрия зарегистрировано повышение активности супероксиддисмутазы (СОД) у молодых растений пшеницы при осмотическом стрессе, вызываемом ПЭГ 6000 [8]. Обработка проростков риса донором сероводорода вызывала повышение активности СОД, каталазы и различных пероксидаз в условиях модельного водного стресса [9].
Как известно, накопление осмолитов, в первую очередь пролина, способствует удержанию в клетках воды и смягчает негативное действие водного дефицита на растения. Также пролин в настоящее время рассматривается в качестве одного из мощных антиоксидантов [10]. Однако сведения о влиянии доноров сероводорода на его содержание весьма неоднозначные. Так, в работе Tian с соавт. [11] показано увеличение содержания пролина у растений проса под влиянием гидросульфида натрия, а также его сочетания со стрессовым действием ионов кадмия. Этот эффект сопровождался усилением экспрессии гена Δ1-пирролин-5-карбоксилатредуктазы и снижением экспрессии гена пролиндегидрогеназы. Похожие эффекты зарегистрированы на этиолированных проростках кукурузы, авторы рассматривают накопление пролина как одну из причин повышения их теплоустойчивости [12]. В то же время показано снижение под влиянием предобработки донором сероводорода содержания пролина у растений огурца в условиях солевого стресса [13]. Уменьшение количества пролина в условиях засухи под влиянием экзогенного H2S выявлено и у проростков шпината [14].
К важным низкомолекулярным антиоксидантам относятся флавоноиды [15]. Особо следует отметить высокую антиоксидантную активность антоцианов, в т. ч. их бесцветных таутомеров, которые способны эффективно деактивировать супероксидные анион-радикалы [16]. Однако влияние сероводорода на их содержание почти не изучено. Недавно выявлено некоторое увеличение содержания бесцветных флавоноидов (поглощающих УФ) и антоцианов у растений ячменя при индуцировании их устойчивости к действию УФ-B обработкой донором сероводорода [17].
В целом механизмы протекторного действия доноров сероводорода при водном стрессе изучены далеко не полностью. Несмотря на многочисленные сведения о положительном влиянии экзогенного сероводорода на устойчивость растений к стрессорам различной природы, пока очень мало работ, в которых бы его эффекты исследовались в условиях, приближенных к естественным. В частности, его протекторное действие при осмотическом стрессе изучалось в основном в экспериментах с использованием ПЭГ, чаще на этиолированных проростках. Известно, что эффекты засухи на модельных системах и интактных растениях могут существенно отличаться, поскольку реакция растительного организма на недостаток влаги реализуется в результате взаимодействия различных органов и систем [6].
В связи с изложенным, целью работы было выяснение вклада компонентов ферментативной антиоксидантной системы и низкомолекулярных протекторов (пролина и флавоноидных соединений) в индуцируемое донором сероводорода развитие устойчивости растений пшеницы к почвенной засухе.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследований использовали растения озимой мягкой пшеницы (Triticum aestivum L.) сорта Досконала, которые выращивали в пластиковых контейнерах (почва чернозем типичный тяжелосуглинистый). Влажность субстрата – 70% от ПВ, освещение – 7 клк, фотопериод – 14 ч, температура 22/18°С (день/ночь). Перед созданием условий засухи растения в возрасте 7 суток опрыскивали растворами NaHS в концентрациях 0.1, 0.3, 0.5 и 1 мМ, контроль – опрыскивание дистиллированной водой. В отдельной серии опытов исследовали эффекты гидросульфида натрия в сочетании со скавенджером сероводорода гидроксиламином (ГА). В этом случае растения соответствующих вариантов опрыскивали 0.3 мМ гидросульфидом натрия, 0.5 мМ солянокислым ГА, либо их смесью.
Засуху создавали в течение шести суток, начиная с 8 дня выращивания растений, уменьшением нормы полива с постепенным снижением влажности почвы до 25–30% от ПВ.
На 3 и 6 сутки засухи в первых листьях определяли активность антиоксидантных ферментов, содержание пролина и флавоноидов. В конце эксперимента (на 6 сутки засухи) определяли содержание пероксида водорода, малонового диальдегида (МДА) и фотосинтетических пигментов в листьях. Также оценивали вызываемое засухой ингибирование роста растений по формуле:
Фотосинтетические пигменты экстрагировали из листьев этанолом и определяли их содержание спектрофотометрическим методом [18]. Содержание пигментов выражали в мг/г сухой массы листьев.
Пероксид водорода экстрагировали из листьев, растертых на льду, 5% ТХУ, затем пробы центрифугировали на центрифуге MPW350R (Польша) при 8000 g в течение 10 мин при 4°С и в супернатанте определяли его содержание ферротиоцианатным методом с использованием соли Мора и тиоцианата аммония [19].
Для определения продуктов пероксидного окисления липидов (ПОЛ), реагирующих с 2‑тиобарбитуровой кислотой (преимущественно МДА), растительный материал гомогенизировали в реакционной среде, содержащей 0.25% 2-тиобарбитуровую кислоту в 10% ТХУ, гомогенат помещали в кипящую водяную баню на 30 мин. Затем пробы резко охлаждали и центрифугировали 15 мин при 10 000 g. Оптическую плотность супернатанта определяли при длинах волн 532 нм (максимум светопоглощения МДА) и 600 нм (для поправки на неспецифическое светопоглощение) [20].
Активность антиоксидантных ферментов – цитозольной супероксиддисмутазы (СОД, КФ 1.15.1.1), каталазы (КАТ, КФ 1.11.1.6) и гваяколпероксидазы (ГПО, КФ 1.11.1.7) – определяли по методикам, описанным ранее [21]. Навески из средних частей первых листьев гомогенизировали на холоде в 0.15 М K,Na-фосфатном буфере (pH 7.6) с добавлением ЭДТА (0.1 мМ) и дитиотрейтола (1 мМ). Для анализа использовали супернатант после центрифугирования гомогената при 8000 g в течение 10 мин при температуре не выше 4°С. Активность СОД определяли, используя метод, основанный на способности фермента конкурировать с нитросиним тетразолием за супероксидные анионы, образующиеся вследствие аэробного взаимодействия НАД · H и феназинметосульфата. Активность КАТ оценивали по количеству пероксида водорода, разложившегося за единицу времени. Активность ГПО анализировали, используя в качестве донора водорода гваякол, а в качестве субстрата – пероксид водорода. Активность СОД и ГПО выражали в усл. ед./(г сухой массы × мин), активность КАТ – в ммоль H2O2/(г сухой массы × × мин).
Содержание пролина в листьях определяли с использованием нингидринового реактива, как описано ранее [21] и выражали в мкмоль/г сухой массы.
Для определения содержания флавоноидов, которые имеют максимум поглощения в УФ-B области, и антоцианов навески листьев гомогенизировали в 1% растворе HCl в метаноле [22]. После центрифугирования гомогената при 8000 g в течение 15 мин определяли оптическую плотность супернатанта при 300, 530 и 657 нм [22, 23] на спектрофотометре СФ 46 (“ЛОМО”, Россия). При расчете содержания антоцианов учитывали величину неспецифического поглощения при 657 нм [23]. Содержание флавоноидов и антоцианов выражали в условных единицах как величины A300/г сухой массы и (A530 – 0.25A657)/г сухой массы, соответственно.
Эксперименты повторяли независимо трижды при трехкратной биологической повторности в каждом из них. Приведены средние величины и их стандартные ошибки. Кроме оговоренных случаев обсуждаются различия, достоверные при P ≤ 0.05.
РЕЗУЛЬТАТЫ
Влияние донора сероводорода на рост растений пшеницы и содержание фотосинтетических пигментов в листьях
После 6-дневного действия засухи отмечалось существенное ингибирование роста надземной части растений пшеницы (рис. 1а). Опрыскивание растений донором сероводорода NaHS в концентрациях диапазона 0.1–0.5 мМ перед засухой заметно смягчало ее ростингибирующее действие. Наиболее значительный стресс-протекторный эффект проявлялся при обработке растений 0.3 мМ раствором гидросульфида натрия.
Рис. 1.
Модуляция ростингибирующего действия засухи донором сероводорода: а – концентрационная зависимость протекторного эффекта NaHS; б – нивелирование протекторного эффекта NaHS действием ГА: 1 – засуха; 2 – засуха + + NaHS (0.3 мМ); 3 – засуха + ГА (0.5 мМ); 4 – засуха + NaHS (0.3 мМ) + ГА (0.5 мМ). Одинаковыми латинскими буквами отмечены величины, различия между которыми недостоверны при P ≤ 0.05.
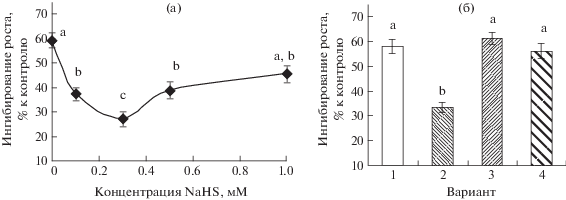
Опрыскивание растений скавенджером сероводорода ГА само по себе не оказывало существенного влияния на их рост в условиях засухи. Однако при совместной обработке ГА и NaHS положительное влияние последнего не проявлялось (рис. 1б).
При отсутствии засухи донор сероводорода в концентрациях 0.1–0.5 мМ оказывал незначительное (в пределах 8–10%) ростстимулирующее действие на растения (результаты не приводятся).
Обработка гидросульфидом натрия в условиях нормального водообеспечения растений не оказывала влияния на содержание хлорофиллов и каротиноидов в листьях (таблица 1). Под влиянием 6-дневной засухи отмечалось снижение количества фотосинтетических пигментов. При этом обработка растений донором сероводорода способствовала сохранению пула хлорофиллов и каротиноидов при действии засухи. В присутствии ГА, который сам по себе не влиял на содержание фотосинтетических пигментов, положительное влияние донора H2S на их количество в листьях при засухе не проявлялось (таблица).
Таблица 1.
Содержание фотосинтетических пигментов в листьях 13-дневных растений пшеницы (мг/г сухой массы)
| Вариант | Хлорофилл а | Хлорофилл b | Хлорофиллы a + b |
Каротиноиды |
|---|---|---|---|---|
| Нормальный полив | ||||
| Контроль | 8.04 ± 0.08a | 3.14 ± 0.06a | 11.18 ± 0.10a | 1.88 ± 0.04a |
| NaHS (0.3 мМ) | 8.01 ± 0.09a | 3.04 ± 0.07a | 11.05 ± 0.11a | 1.97 ± 0.05a |
| ГА (0.5 мМ) | 7.99 ± 0.11a | 3.12 ± 0.09a | 11.11 ± 0.14a | 1.86 ± 0.06a |
| NaHS (0.3 мМ) + ГА (0.5 мМ) | 8.07 ± 0.09a | 3.18 ± 0.07a | 11.25 ± 0.11a | 1.92 ± 0.03a |
| Засуха | ||||
| Контроль | 6.30 ± 0.10c | 2.53 ± 0.07b | 8.83 ± 0.12c | 1.60 ± 0.02b |
| NaHS (0.3 мМ) | 6.83 ± 0.07b | 2.95 ± 0.05a | 9.78 ± 0.09b | 1.77 ± 0.03a |
| ГА (0.5 мМ) | 6.26 ± 0.09c | 2.49 ± 0.07b | 8.75 ± 0.11c | 1.55 ± 0.04b |
| NaHS (0.3 мМ) + ГА (0.5 мМ) | 6.36 ± 0.12c | 2.37 ± 0.06b | 8.73 ± 0.13c | 1.55 ± 0.04b |
Нивелирование гидроксиламином положительного влияния NaHS на рост надземной части растений и содержание фотосинтетических пигментов в листьях в условиях засухи позволяет рассматривать стресс-протекторный эффект гидросульфида натрия именно как донора сероводорода, а не как соли. В последующих экспериментах изучали его влияние в концентрациях, смягчающих ростингибирующий эффект засухи (0.1 и 0.3 мМ), на показатели окислительного стресса и функционирования антиоксидантной системы растений.
Проявление эффекта окислительного стресса у растений пшеницы в условиях засухи и действия донора сероводорода
К известным эффектам окислительного стресса относится накопление в клетках АФК, в частности пероксида водорода [7] и продукта ПОЛ МДА [20]. В условиях нормального увлажнения под влиянием обработки донором сероводорода содержание H2O2 в листьях не изменялось (рис. 2а). На 6 день засухи его количество возрастало более чем в 1.5 раза. Предобработка растений NaHS практически полностью нивелировала этот эффект.
Рис. 2.
Содержание пероксида водорода (а) и МДА (б) в листьях 13-дневных растений пшеницы при действии засухи и донора сероводорода. 1 – контроль; 2 – NaHS (0.1 мМ); 3 – NaHS (0.3 мМ); 4 – засуха; 5 – засуха + NaHS (0.1 мМ); 6 – засуха + NaHS (0.3 мМ). Одинаковыми латинскими буквами отмечены величины, различия между которыми недостоверны при P ≤ 0.05.

При обработке донором сероводорода в обычных условиях содержание МДА не изменялось (рис. 2б). Под влиянием засухи количество конечного продукта ПОЛ в листьях возрастало на 42%. Предварительная обработка растений раствором гидросульфида натрия в обеих исследуемых концентрациях предотвращала накопление МДА. Таким образом, донор сероводорода предотвращал вызываемый засухой эффект окислительного стресса, что проявлялось в сохранении стабильного содержания пероксида водорода и МДА в тканях листьев.
Активность антиоксидантных ферментов в листьях при действии засухи и донора сероводорода
В условиях нормального увлажнения обработка растений 0.1 и особенно 0.3 мМ NaHS вызывала повышение активности СОД в листьях у 10 и 13-дневных растений (рис. 3а). Засуха не вызывала достоверных изменений активности фермента. В условиях засухи (как на третий, так и на шестой день) отмечалось существенное повышение активности СОД в листьях растений, обработанных донором сероводорода.
Рис. 3.
Активность СОД (а), КАТ (б) и ГПО (в) в листьях пшеницы при действии засухи и донора сероводорода. Варианты: 1 – контроль; 2 – NaHS (0.1 мМ); 3 – NaHS (0.3 мМ); 4 – засуха; 5 – засуха + NaHS (0.1 мМ); 6 – засуха + NaHS (0.3 мМ). Одинаковыми латинскими буквами отмечены величины, различия между которыми недостоверны при P ≤ 0.05.

В отсутствие засухи обработка растений NaHS не оказывала влияния на активность КАТ в листьях (рис. 3б). Под влиянием засухи происходило снижение активности фермента. Обработка донором сероводорода способствовала сохранению активности КАТ на уровне, близком к контролю, особенно заметно этот эффект проявлялся на 3 сутки засухи.
У контрольных растений на 13 день роста отмечалось некоторое повышение активности ГПО в листьях (рис. 3в). Обработка донором сероводорода в концентрации 0.1 мМ вызывала тенденцию к незначительному снижению активности фермента, однако этот эффект не был достоверным при P ≤ 0.05. Под влиянием обработки 0.3 мМ NaHS в обычных условиях отмечалось некоторое повышение активности ГПО у 10-дневных растений с последующим снижением у 13-дневных. Засуха вызывала заметное снижение активности фермента. При этом донор сероводорода, особенно в концентрации 0.1 мМ, способствовал сохранению активности ГПО в условиях засухи (рис. 3в).
Содержание пролина и флавоноидных соединений в листьях при недостаточном увлажнении и обработке донором сероводорода
После обработки растений 0.1 мМ раствором гидросульфида натрия содержание пролина в листьях не изменялось, в то же время на 3 день после воздействия 0.3 мМ NaHS отмечалось небольшое, но достоверное его увеличение (рис. 4а). Под влиянием засухи происходило почти 1.5-кратное повышение содержания пролина в листьях. При этом обработка растений 0.1 и особенно 0.3 мМ раствором гидросульфида натрия способствовала дополнительному увеличению количества пролина в листьях (рис. 4а).
Рис. 4.
Содержание пролина (а), антоцианов (б) и флавоноидов (в) в листьях пшеницы при действии засухи и донора сероводорода. Варианты: 1 – контроль; 2 – NaHS (0.1 мМ); 3 – NaHS (0.3 мМ); 4 – засуха; 5 – засуха + NaHS (0.1 мМ); 6 – засуха + NaHS (0.3 мМ). Одинаковыми латинскими буквами отмечены величины, различия между которыми недостоверны при P ≤ 0.05.

Обработка растений 0.1 мМ раствором донора сероводорода вызывала повышение содержания антоцианов в листьях более чем на 30%, а под влиянием 0.3 мМ NaHS оно увеличивалось приблизительно в два раза (рис. 4б). В условиях засухи содержание антоцианов в листьях существенно не изменялось, однако у растений, обработанных донором сероводорода, оно было намного выше.
Содержание флавоноидов, поглощающих в области УФ-В, при обработке NaHS в условиях нормального увлажнения существенно не изменялось (рис. 4в). Засуха вызывала тенденцию к небольшому его снижению, однако этот эффект не был достоверным при P ≤ 0.05. В то же время у растений, обработанных донором сероводорода, в условиях засухи содержание флавоноидов было более высоким.
ОБСУЖДЕНИЕ
Обработка растений пшеницы донором сероводорода гидросульфидом натрия повышала их устойчивость к почвенной засухе, что выражалось в уменьшении ее ростингибирующего действия на растения (рис. 1), сохранении у обработанных растений пула фотосинтетических пигментов (таблица) и предотвращении развития признаков окислительных повреждений, определяемых по увеличению содержания в тканях листьев пероксида водорода и продукта ПОЛ МДА (рис. 2). Следует отметить, что положительное влияние донора сероводорода на засухоустойчивость растений NaHS практически не проявлялось при одновременной их обработке скавенджером сероводорода гидроксиламином (рис. 1б, таблица). Это свидетельствует о специфичности действия гидросульфида натрия именно как донора сероводорода.
Одной из составляющих позитивного действия донора сероводорода на растения в стрессовых условиях, по-видимому, является активация антиоксидантной системы. Так, обработка растений NaHS даже в отсутствие стресса вызывала существенное повышение активности СОД (рис. 3а). В условиях засухи активность СОД у растений опытного варианта существенно превышала значения соответствующего контроля. Как известно, СОД является единственным ферментативным антиоксидантом, устраняющим радикальные АФК. Элиминируя супероксидные радикалы, этот фермент опосредованно уменьшает вероятность образования гидроксильных радикалов, синглетного кислорода, пероксинитрита и других АФК, которые в силу высокой реакционной способности не могут быть удалены белковыми катализаторами [24], в связи с чем повышение ее активности имеет особое значение для устойчивости растений к действию стрессоров. Увеличение активности СОД у молодых растений пшеницы и риса, обработанных донором сероводорода, недавно было выявлено в условиях осмотического стресса, вызываемого ПЭГ 6000 [8, 9]. Участие сероводорода в регуляции экспрессии генов, контролирующих редокс-гомеостаз, в том числе СОД, показано молекулярно-генетическими методами в работе Li с соавт. [25].
Продуктом реакции превращения супероксидного анион-радикала с помощью СОД является пероксид водорода. КАТ, локализованная в пероксисомах, и различные пероксидазы, обезвреживающие H2O2, функционируют в кооперации с СОД [24]. В наших экспериментах засуха вызывала снижение активности КАТ в листьях с одновременным повышением содержания пероксида водорода и МДА (рис. 2, 3б). В литературе сообщается как о повышении, так и о снижении активности КАТ у растений различных видов в условиях засухи [6]. Возможно, что в условиях наших экспериментов засуха ускоряла старение первого листа, что сопровождалось эффектами повышения содержания пероксида водорода и снижения активности ферментов, его обезвреживающих.
Обработка растений донором сероводорода предотвращала вызываемое засухой снижение активности КАТ и ГПО (рис. 3б, 3в). Примечательно, что под влиянием осмотического стресса, создаваемого в водной культуре пшеницы добавлением ПЭГ, происходило повышение активности КАТ в листьях и корнях и активности пероксидазы только в корнях, при этом обработка растений NaHS лишь на отдельных стадиях экспериментов вызывала тенденцию к незначительному повышению активности этих ферментов в органах растений [8]. Подобные различия в реакции на засуху и обработку донором сероводорода могут быть связаны с тем, что в указанной работе для анализов использовали активно растущие вторые листья. Кроме того, возможны отличия влияния осмотического стресса, вызываемого в водной культуре, и засухи в почвенной культуре в условиях наших экспериментов. С другой стороны, у растений огурца при солевом стрессе обработка донором сероводорода вызывала повышение активности СОД, КАТ, ГПО и аскорбатпероксидазы [13]. Стабилизация активности этих ферментов под влиянием обработки NaHS отмечена у растений ячменя при стрессовом воздействии на них УФ-B [17]. Таким образом, в целом полученные нами результаты согласуются с данными ряда других работ, свидетельствующих о повышении под влиянием экзогенного сероводорода активности антиоксидантных ферментов у растений разных видов при действии стрессоров различной природы.
Механизмы влияния H2S на активность антиоксидантных ферментов растений, по-видимому, могут быть различными и весьма сложными. Вполне вероятно, что такие эффекты происходят с участием других сигнальных посредников. Так, индуцированное донором сероводорода повышение активности антиоксидантных ферментов в листьях ячменя устранялось скавенджером пероксида водорода диметилтиомочевиной и ингибитором НАДФH-оксидазы дифенилениодониумом, что указывает на роль АФК в реализации эффектов экзогенного сероводорода [17]. В свою очередь вызываемое сероводородом образование АФК и последующее повышение активности антиоксидантных ферментов могут быть кальцийзависимыми процессами. Так, индуцирование донором сероводорода гидросульфидом натрия развития теплоустойчивости отрезков колеоптилей пшеницы сопровождалось усилением генерации АФК. При этом хелатор внеклеточного кальция ЭГТА и ингибитор НАДФН-оксидазы имидазол снимали вызываемые обработкой NaHS эффекты усиления генерации АФК, увеличения активности СОД, КАТ и ГПО, а также повышения теплоустойчивости клеток [26]. Имеются сведения и о нивелировании антагонистами кальция вызываемого сероводородом развития теплоустойчивости клеток суспензионной культуры табака [27]. С другой стороны, возможно, что некоторые физиологические эффекты H2S обусловлены его способностью прямо влиять на состояние тиольных групп белков. Показано, что сероводород может взаимодействовать с сульфеновой кислотой – продуктом окисления тиольных групп – с образованием персульфидов, которые могут быть восстановлены с участием тиоредоксиновой системы [28]. Не исключено, что таким образом H2S может участвовать в восстановлении структуры определенных белков, в том числе антиоксидантных ферментов.
Помимо положительного влияния на активность антиоксидантных ферментов в наших экспериментах донор сероводорода способствовал накоплению пролина в листьях в условиях засухи (рис. 4а). Как уже отмечалось, в литературе имеются сведения как о повышении под влиянием экзогенного сероводорода содержания пролина [11, 12], так и о его снижении [13, 14]. Такие различия могут быть связаны с видовыми особенностями растений, неодинаковым их состоянием в момент воздействия стрессора и (или) экзогенного сероводорода. Наконец, неоднозначность влияния сероводорода на содержание пролина может быть обусловлена сложным функциональным взаимодействием этого низкомолекулярного протектора с другими компонентами антиоксидантной системы [21, 29].
В условиях наших экспериментов донор сероводорода оказывал существенное влияние на содержание антоцианов (рис. 4б) и менее заметное на количество бесцветных флавоноидов, поглощающих в области УФ-B (рис. 4в). Эффект индуцирования накопления флавоноидных соединений в листьях злаков при совместном действии экзогенного сероводорода и стрессоров пока изучен очень слабо. В доступной литературе нам удалось найти лишь данные о повышении под влиянием обработки NaHS содержания антоцианов в листьях ячменя при действии УФ-В [17]. Возможно, у растений пшеницы индуцирование сероводородом усиленного синтеза антоцианов и других флавоноидов является важной составляющей предотвращения окислительного стресса. Показано, что эффективность взаимодействия флавоноидных соединений с АФК приблизительно в четыре раза выше, чем у аскорбиновой кислоты и α-токоферола [15]. Однако флавоноиды накапливаются в основном в вакуолях, в связи с чем в литературе дискутируется вопрос о том, насколько велик их вклад в работу антиоксидантной системы растительных клеток. В то же время флавоноидные соединения выявлены и в других компартментах, в том числе в хлоропластах и ядре [15]. С другой стороны, и флавоноиды, локализованные в вакуоли, способны участвовать в детоксикации пероксида водорода, который может транспортироваться в этот компартмент [30]. В условиях водного стресса накопление флавоноидов в тканях также может быть важной составляющей осморегуляции [15]. Заметим, что механизмы участия сероводорода в регуляции синтеза флавоноидов пока практически не изучены, по-видимому, ввиду большого количества ферментов, а также регуляторных белков, задействованных в этом процессе [15].
В целом, в условиях наших экспериментов обработка растений пшеницы донором сероводорода перед засухой оказывала влияние на различные компоненты антиоксидантной системы, особенно заметное на активность СОД и содержание флавоноидных соединений, в первую очередь, антоцианов. В то же время в условиях засухи у растений, обработанных NaHS, отмечались более высокие значения активности ферментов, утилизирующих пероксид водорода, – каталазы и гваяколпероксидазы, и содержания пролина (рис. 3б, 3в, 4а), у которого сочетаются функции осмо- и мембранопротектора, а также низкомолекулярного шаперона и антиоксиданта [10]. Об эффективном функционировании различных звеньев антиоксидантной системы растений, обработанных донором сероводорода, свидетельствует отсутствие в условиях засухи существенного повышения содержания в тканях пероксида водорода и МДА (рис. 2).
Таким образом, в настоящей работе показано индуцирование NaHS засухоустойчивости растений в условиях, близких к естественным, что позволяет рассматривать доноры сероводорода как индукторы стресс-резистентности, перспективные для практического применения.
Список литературы
Zhang H. Hydrogen sulfide in plant biology // Signaling and Communication in Plants. Gasotransmitters in Plants / Eds. Lamattina L., Garcia-Mata C. Switzerland: Springer International Publishing. 2016. P. 23–51. doi 10.1007/978-3-319-40713-5_2
Lisjak M., Teklic T., Wilson I.D., Whiteman M., Hancock J.T. Hydrogen sulfide: environmental factor or signalling molecule? // Plant Cell Environ. 2013. V. 36. P. 1607–1616.
Jin Z.P., Shen J.J., Qiao Z.J., Yang G.D., Wang R., Pei Y.X. Hydrogen sulfide improves drought resistance in Arabidopsis thaliana // Biochem. Biophys. Res. Commun. 2011. V. 414. P. 481–486.
Lai D.W., Mao Y., Zhou H., Li F., Wu M., Zhang J., He Z., Cui W., Xie Y. Endogenous hydrogen sulfide enhances salt tolerance by coupling the reestablishment of redox homeostasis and preventing salt-induced K+ loss in seedlings of Medicago sativa // Plant Sci. 2014. V. 225. P. 117–129.
Shi H., Ye T., Chan Z. Exogenous application of hydrogen sulfide donor sodium hydrosulfide enhanced multiple abiotic stress tolerance in bermudagrass (Cynodon dactylon (L.). Pers.) // Plant Physiol. Biochem. 2013. V. 71. P. 226–234.
De Carvalho M.H.C. Drought stress and reactive oxygen species. Production, scavenging and signaling // Plant Signal. Behav. 2008. V. 3. P. 156–165.
Gautam V., Kaur R., Kohli S.K., Verma V., Kaur P., Singh R., Saini P., Arora S., Thukral A.K., Karpets Y.V., Kolupaev Y.E., Bhardwaj R. ROS compartmentalization in plant cells under abiotic stress condition // Reactive oxygen species and antioxidant systems in plants: role and regulation under abiotic stress / Eds. Khan M.I.R., Khan N.A. Springer Nature Singapore Pte Ltd., 2017. P. 89–114. doi 10.1007/978-981-10-5254-5_4
Ma D., Ding H., Wang C., Qin H., Han Q., Hou J., Lu H., Xie Y., Guo T. Alleviation of drought stress by hydrogen sulfide is partially related to the abscisic acid signaling pathway in wheat // PLoS One. 2016. V. 11. e0163082.
Liu J., Zhang H., Yin Y., Chen H. Effects of exogenous hydrogen sulfide on antioxidant metabolism of rice seed germinated under drought stress // J. Southern Agricult. 2017. V. 48. P. 31–37.
Liang X., Zhang L., Natarajan S.K., Becker D.F. Proline mechanisms of stress survival // Antioxid. Redox Signal. 2013. V. 19. P. 998–1011.
Tian B., Qiao Z., Zhang L., Li H., Pei Y. Hydrogen sulfide and proline cooperate to alleviate cadmium stress in foxtail millet seedlings // Plant Physiol. Biochem. 2016. V. 109. P. 293–299.
Li Z.-G., Ding X.-J., Du P.-F. Hydrogen sulfide donor sodium hydrosulfide-improved heat tolerance in maize and involvement of proline // J. Plant Physiol. 2013. V. 170. P. 741–747.
Yu L., Zhang C., Shang H., Wang X., Wei M., Yang F., Shi Q. Exogenous hydrogen sulfide enhanced antioxidant capacity, amylase activities and salt tolerance of cucumber hypocotyls and radicles // J. Integr. Agricult. 2013. V. 12. P. 445–456.
Chen J., Shang Y.T., Wang W.H. Chen X.Y., He E.M., Zheng H.L., Shangguan Z. Hydrogen sulfide-mediated polyamines and sugar changes are involved in hydrogen sulfide-induced drought tolerance in Spinacia oleracea seedlings // Front. Plant Sci. 2016. V. 7: 1173. doi 10.3389/fpls.2016.01173
Khlestkina E.K. The adaptive role of flavonoids: e-mphasis on cereals // Cereal Res. Commun. 2013. V. 41. P. 185–198.
Neill S.O., Gould K.S. Anthocyanins in leaves: light attenuators or antioxidants? // Functional Plant Biol. 2003. V. 30. P. 865–873.
Li Q., Wang Z., Zhao Y., Zhang X., Zhang S., Bo L., Wang Y., Ding Y., An L. Putrescine protects hulless barley from damage due to UV-B stress via H2S- and H2O2-mediated signaling pathways // Plant Cell Rep. 2016. V. 35. P. 1155–1168.
Шлык А.А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. С. 154–170.
Sagisaka S. The occurrence of peroxide in a perennial plant, Populus gelrica // Plant Physiol. 1976. V. 57. P. 308–309.
Фазлиева Э.Р., Киселева И.С., Жуйкова Т.В. Антиоксидантная активность листьев Melilotusalbus и Trifolium medium из техногенно нарушенных местообитаний Среднего Урала при действии меди // Физиология растений. 2012. Т. 59. С. 369–375.
Колупаев Ю.Е., Рябчун Н.И., Вайнер А.А., Ястреб Т.О., Обозный А.И. Активность антиоксидантных ферментов и содержание осмолитов в проростках озимых злаков при закаливании и криострессе // Ф-изиология растений. 2015. Т. 62. С. 533–541.
Nogues S., Baker N.R. Effects of drought on photosynthesis in Mediterranean plants grown under UV-B radiation // J. Exp. Bot. 2000. V. 51. P. 1309–1317.
Pietrini F., Massacci A. Leaf anthocyanin content changes in Zea mays L. grown at low temperature: Significance for the relationship between the quantum yield of PS II and the apparent quantum yield of CO2 assimilation // Photosynthesis Res. 1998. V. 58. P. 213–219.
Jaleel C.A., Riadh K., Gopi R. Manivannan P., Jallali I., Al-Juburi H.J., Xing Z.C., Hong-Bo S., Panneerselvam R. Antioxidant defense responses: physiological plasticity in higher plants under abiotic constraints // Acta Physiol. Plant. 2009. V. 31. P. 427–436.
Li H., Li M., Wei X., Zhang X., Xue R., Zhao Y., Zhao H. Transcriptome analysis of drought-responsive genes regulated by hydrogen sulfide in wheat (Triticum aestivum L.) leaves // Mol. Genet. Genomics. 2017. doi 10.1007/s00438-017-1330-4
Колупаев Ю.Е., Фирсова Е.Н., Ястреб Т.О., Луговая А.А. Участие ионов кальция и активных форм кислорода в индуцировании антиоксидантных ферментов и теплоустойчивости растительных клеток донором сероводорода // Прикл. биохимия и микробиол. 2017. Т. 53. С. 502–509.
Li Z.G., Gong M., Xie H., Yang L., Li J. Hydrogen sulfide donor sodium hydrosulfide-induced heat tolerance in tobacco (Nicotiana tabacum L.) suspension cultured cells and involvement of Ca2+ and calmodulin // Plant Sci. 2012. V. 185–186. P. 185–189.
Filipovic M.R., Jovanovic V.M. More than just an intermediate: hydrogen sulfide signalling in plants // J. Exp. Bot. 2017. V. 68. P. 4733–4736.
Радюкина Н.Л., Шашукова А.В., Макарова С.С., Кузнецов Вл.В. Экзогенный пролин модифицирует дифференциальную экспрессию генов супероксиддисмутазы в растениях шалфея при UV-B облучении // Физиология растений. 2011. Т. 58. С. 49–57.
Gould K.S., Lister C. Flavonoid functions in plants / Flavonoids: Chemistry, Biochemistry, and Applications / Eds. Andersen O.M., Markham K.R. Boca Raton, London, New York: CRC, Taylor and Francis Group, 2006. P. 397–442.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


