Физиология растений, 2019, T. 66, № 1, стр. 58-65
Влияние локального повреждения на транспирацию листьев гороха посевного при различной влажности воздуха
Л. М. Юдина a, О. Н. Шерстнева a, С. А. Мысягин a, В. А. Воденеев a, В. С. Сухов a
a Национальный исследовательский Нижегородский государственный университет
им. Н.И. Лобачевского
Нижний Новгород, Россия
Поступила в редакцию 01.11.2017
После доработки 27.12.2017
Принята к публикации 14.02.2018
Аннотация
Локальные повреждения вызывают в интактных частях растений широкий спектр функциональных ответов, включая развитие изменений транспирации и ассимиляции СО2, которые могут быть связаны с распространением вариабельного потенциала (ВП). Проведен анализ влияния локального ожога, приводящего к генерации ВП, на транспирацию и ассимиляцию СО2 в условиях различной влажности воздуха у гороха посевного. Показано, что ВП вызывал многофазные изменения интенсивности транспирации и ассимиляции СО2 в интактном листе гороха, включая быстрое снижение параметров, медленное их повышение и длительное уменьшение транспирации и ассимиляции. При анализе влияния влажности воздуха на эти процессы выявлено, что быстрое и длительное снижение транспирации существенно уменьшалось в условиях высокой влажности, а медленное возрастание транспирации от влажности практически не зависело. Зависимость вызванных ВП ответов ассимиляции СО2 от влажности воздуха имела близкий характер. Дополнительно проведенный корреляционный анализ амплитуд вызванных ВП изменений транспирации и ассимиляции СО2 показал, что длительное закрытие устьиц может быть механизмом долговременного снижения ассимиляции интактных листьев после действия локального ожога. В целом установлено, что вызванный ВП транспирационный ответ является сложной комбинацией активации и угнетения транспирации, при этом вклад различных компонент зависит от влажности воздуха.
ВВЕДЕНИЕ
Засуха является одним из самых распространенных лимитирующих факторов для выживания растений в природных условиях. В первую очередь она влияет на водный обмен, активность которого может зависеть как от водного потенциала почвы [1, 2], так и от влажности воздуха [1, 3, 4]. Низкий уровень влажности почвы и воздуха в большинстве случаев приводит к уменьшению размеров устьичной щели [5] и снижению таких ключевых показателей водного обмена растений, как проводимость устьиц для воды и транспирация [2, 4]. Помимо типичных изменений этих показателей, в ряде случаев могут наблюдаться “парадоксальные” ответы [3]. В частности, при быстром снижении влажности воздуха у Xanthium strumarium и Vicia faba происходило быстрое (порядка 10 минут) переходное увеличение проводимости устьиц для воды, сменяющееся более медленным снижением и выходом на стационарный уровень [3], однако механизмы подобных ответов остаются невыясненными.
Для эффективной регуляции жизнедеятельности растения используют дальние сигналы различной природы. Такие сигналы возникают в зоне действия неблагоприятных факторов и распространяются в интактные части растительного организма, где индуцируют многообразные физиологические ответы, включая усиление генной экспрессии, продукцию фитогормонов, активацию дыхания, изменения активности транспирации, фотосинтеза и др. [6–8]. Локальные стимулы способны индуцировать у растений генерацию и распространение электрических сигналов, включая вызванный повреждающими воздействиями (ожог, нагрев, раздавливание) уникальный электрический сигнал растений – вариабельный потенциал (ВП) [6, 9, 10]. ВП существенно влияет на физиологическое состояние растений и, в частности, вызывает сложные изменения транспирации интактных листьев [11–18], которые в некоторых случаях могут иметь многофазный характер [13]. Согласно нашим предыдущим результатам [13], такие ответы могут быть связаны с изменениями активности Н+-АТФазы плазматической мембраны в ходе генерации ВП; с другой стороны, определенный вклад в изменения транспирации могут вносить и вызванные локальными повреждениями гидропассивные изменения открытости устьиц [14].
Итоговой функцией электрических сигналов, по-видимому, является повышение устойчивости фотосинтетического аппарата [19–21] и растения в целом [13, 22] к неблагоприятным абиотическим факторам, в первую очередь, к высоким и низким температурам. Механизмы такого повышения имеют комплексный характер [20]: в случае увеличения теплоустойчивости они включают в себя (i) повышение устойчивости фотосистемы I, которое связано с ВП-индуцированным снижением поглощения CO2 в ходе темновой стадии фотосинтеза [19], и (ii) стимуляцию теплового повреждения фотосистемы II, обусловленного ВП-индуцированным снижением транспирации во время действия повышенной температуры и усилением нагрева листа [13]. Следует отметить, что стимуляция повреждения фотосистемы II также может иметь защитный характер, поскольку способствует снижению теплового повреждения фотосистемы I путем уменьшения на нее потока электронов [20, 21]. Кроме того, вызванное ВП снижение транспирации при нагреве, возможно, приводит к увеличению теплоустойчивости растения в целом вследствие уменьшения потерь воды растительным организмом [14].
Положительное влияние на теплоустойчивость растения может потенциально оказывать как усиление транспирации, которое приводит к снижению нагрева листа, так и ее уменьшение, способствующее снижению потери воды растением и замедляющее потерю тургора. С этой точки зрения логично ожидать, что в условиях низкой влажности воздуха и высокого уровня транспирации ключевую роль для выживания при повышении температуры играет снижение водной потери, т.е. закрытие устьиц; и наоборот, в условиях высокой влажности и относительно низкого исходного уровня транспирации возрастание водопотери при повышении температуры будет не столь велико, а значит, более важным окажется снижение температуры листа, т.е. открытие устьиц. На основании этого весьма вероятной представляется зависимость направленности вызванных ВП изменений транспирации от влажности воздуха.
У травянистых растений при высокой влажности воздуха (75% и более) после локального ожога и распространения ВП происходит лишь усиление транспирации интактных листьев [10]. В условиях умеренной влажности воздуха (более 50, но менее 75%) после ожога наблюдается преимущественно сложная реакция, включающая как активацию транспирации, так и снижение ее активности [13, 23, 24]. В условиях низкой влажности воздуха (50% и ниже) в интактных листьях после распространения ВП могут наблюдаться либо такие же сложные изменения транспирации (активация, затем снижение) [15, 16], либо только снижение [12, 17, 18]. Вопрос о механизмах этих изменений остается в настоящее время нерешенным. В первую очередь, среди возможных механизмов снижения транспирации под влиянием ВП следует отметить инактивацию H+-АТФазы плазматической мембраны, которая играет ключевую роль в развитии ВП [25]. Известно, что активность H+-АТФазы прямо связана с открытостью устьиц [26], а роль ВП-индуцированного снижения ее активности в уменьшении транспирации подтверждается результатами ингибиторного анализа [13]. В свою очередь, вероятным следствием такой инактивации является активация потенциал-зависимых outward калиевых каналов плазматической мембраны и выход ионов калия [25]. Согласно литературным данным [27], активация калиевых каналов и выход калия сопровождаются потерей тургора замыкающими клетками устьиц, что также может приводить к их закрытию. В качестве вероятного механизма индуцированной ВП активации транспирации рассматривают гидропассивное открытие устьиц [10, 16], обусловленное потерей тургора у окружающих устьица эпидермальных клеток; при этом такая потеря тургора также может быть связана со снижением активности H+-АТФазы и активацией калиевых каналов. Таким образом, данные литературы показывают, что вызванные ВП изменения транспирации могут зависеть от влажности воздуха, окружающего лист. Нельзя исключать также, что различия в вызванных ВП транспирационных ответах приведут к различиям в ответах фотосинтетической ассимиляции СО2, так как именно через устьица преимущественно осуществляется поступление углекислого газа в лист.
Цель работы – исследование влияния локальных ожогов и связанных с ними ВП на транспирацию и фотосинтез листьев гороха посевного в условиях различной влажности воздуха.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования были использованы 2–3-недельные растения гороха посевного (Pisum sativum L.) сорта “Альбумен”. Растения культивировали гидропонным способом на 50% среде Хоглэнда–Арнона в климатической камере Binder KBW 240 (Германия) при 16-часовом световом периоде и температуре 24°С.
Электрические сигналы регистрировали с помощью стандартной электрофизиологической установки, включающей Ag/AgCl макроэлектроды ЭВЛ-1М3 (Гомельский завод измерительных приборов, Беларусь), высокоомный усилитель ИПЛ-113 (“СЕМИКО”, Россия) и персональный компьютер. Электрический сигнал индуцировали классическим повреждающим раздражением – ожогом открытым пламенем [13] кончика первого зрелого листа растения (1 см2) в течение 3 с (рис. 1). Время адаптации растения до нанесения раздражения составляло не менее 1.5 часов. Измерительные электроды располагались на стебле рядом со вторым зрелым листом растения (Эст) и на исследуемом втором листе (Эл) на расстоянии 5–7 см от зоны локального раздражения; электрод сравнения (Эср) находился в растворе, омывающем корни. Контакт измерительных электродов осуществлялся с помощью электропроводящего геля “Униагель” (“Гельтек-Медика”, Россия).
Рис. 1.
Схема нанесения ожога, расположения электродов и зоны регистрации фотосинтетической ассимиляции СО2 и транспирации у проростка гороха посевного. Эст, Эл – измерительные электроды, расположенные на стебле и листе, Эср – электрод сравнения.

Параметры газообмена и водного обмена растения регистрировались с помощью системы, включающей инфракрасный газоанализатоp GFS-3000 и измерительную головку Dual-PAM gas-exchange Cuvette 3010-Dual (“Heinz Walz GmbH”, Геpмания). Данный комплекс позволял осуществлять измерение параметров ассимиляции и транспирации на участке нестимулируемого листа гороха (1.3 cм2). Исследования проводились в условиях освещения листа (актиничный свет 460 нм, интенсивность 239 мкмоль/(м2 с)), которое обеспечивалось РАМ-флуориметром Dual-PAM-100, также подключенным к измерительной головке системы. В кювете с исследуемым листом растения поддерживалась постоянная температура (23°С) и концентрация СО2 (360 ppm).
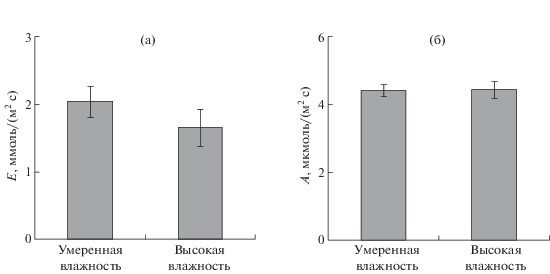
Влажность в кювете регистрировалась с помощью газоанализатора и варьировала в пределах 13 000–25 000 ppm. Для оценки особенностей ответов газообмена и водного обмена при разных концентрациях Н2О в воздухе растения были объединены в группы, охватывающие два диапазона влажностей: умеренную (от 13 000 до 19 000 ppm, 45–67%) и высокую (от 19 000 до 25 000 ppm, 67–89%). В условиях умеренной и высокой влажности окружающего лист воздуха, анализ средних начальных уровней транспирации (рис. 2а) и фотосинтетической ассимиляции СО2 (рис. 2б) показал лишь тенденцию к снижению транспирации при высокой влажности; отличий начального уровня ассимиляции при различной влажности зарегистрировано не было.
Рис. 2.
Средние начальные уровни транспирации (а) и фотосинтетической ассимиляции СО2 (б) листьев гороха посевного в условиях умеренной (13 000–19 000 ppm, n = 10) и высокой (19 000–25 000 ppm, n = 11) влажности, окружающего лист воздуха.
Биологическая повторность экспериментов составляла не менее 10 (n). В работе представлены примеры записей, средние значения и их стандартные отклонения, а также значения коэффициентов линейной корреляции между вызванными вариабельными потенциалами изменений транспирации и ассимиляции СО2 на различных фазах развития ответов.
РЕЗУЛЬТАТЫ
На первом этапе исследования было показано, что локальный ожог листа гороха приводит к генерации и распространению по растению электрического сигнала в виде вариабельного потенциала (рис. 3а). Амплитуда электрической реакции, развивающейся в нераздраженном листе растения на расстоянии 7–10 см от зоны повреждения, составляла 52 ± 5 мВ. После ожога и распространения ВП в исследуемой зоне возникали также изменения активности транспирации и ассимиляции СО2 (рис. 3б). Изменения транспирации и ассимиляции имели 3-фазный характер (быстрое снижение Е0-Е1, медленное возрастание Е1-Е2, длительное снижение Е2-Е3). В случае ассимиляции СО2 наблюдалось ее выраженное снижение А0-А1, затем повышение до уровня А2 и снижение к А3. Отметим, что длительность первых двух фаз составляла в среднем около 6–7 мин, а через 15–30 мин начиналась вторая фаза снижения ассимиляции.
Рис. 3.
Примеры вызванного локальным ожогом вариабельного потенциала во втором зрелом листе гороха посевного – серая линия и в стебле у основания этого листа – черная линия (а), и изменений фотосинтетической ассимиляции СО2 (А – серая линия) и транспирации (Е – черная линия) при абсолютной влажности около 19000 ppm (66% относительной влажности) (б). Стрелкой обозначен момент ожога первого зрелого листа. А и Е с индексами обозначают нулевой уровень и последующие экстремумы кривых ассимиляции и транспирации, соответственно.

На следующем этапе был проведен анализ влияния влажности воздуха на вызванные ВП транспирационные и фотосинтетические ответы. Было показано, что ответы транспирации существенно зависели от влажности окружающего лист воздуха. Так, при умеренной влажности происходило сильное снижение транспирации с уровня Е0 до Е1, затем ее небольшое возрастание до Е2, которое сменялось еще более выраженным медленным снижением до уровня Е3 (рис. 4а). При высокой влажности воздуха наблюдалась иная картина: незначительное снижение транспирации с Е0 до Е1 сменялось существенным повышением до уровня Е2, на завершающем этапе реакции происходило снижение транспирации до уровня Е3, который был лишь немного ниже начального Е0 (рис. 4б). В случае ассимиляции явные различия между вызванной ВП быстрой инактивацией фотосинтеза при разной влажности отсутствовали, однако длительное снижение ассимиляции СО2 было намного более выраженным при умеренной влажности воздуха (рис. 4).
Рис. 4.
Примеры вызванных локальным ожогом и связанным с ним вариабельным потенциалом изменений фотосинтетической ассимиляции СО2 (А – серая линия) и транспирации (Е – черная линия) листьев гороха посевного при абсолютной влажности 16 000 ppm (а) и 20 000 ppm (б). Стрелкой обозначен момент ожога первого зрелого листа. А и Е с индексами обозначают нулевой уровень и последующие экстремумы кривых ассимиляции и транспирации, соответственно. В качестве умеренной принималась влажность в диапазоне от 13 000 до 19 000 ppm (n = 10), в качестве высокой – от 19 000 до 25 000 ppm (n = 11).

Анализ средних значений изменения транспирации при ВП показал, что при умеренной влажности значения таких показателей, как Е1-Е0 и Е3-Е0 были достоверно выше, чем при высокой влажности (таблица). Также при высокой влажности наблюдалось возрастание ответа параметра Е2-Е0 по сравнению с нулевым уровнем, т.е. ВП в этих условиях и в этом временном диапазоне вызывал активацию транспирации по сравнению с начальным уровнем. Важно также отметить, что влажность воздуха практически не влияла на величину возрастания от Е1 к Е2. Последнее позволяет предположить, что возрастание транспирации от Е1 к Е2 представляет собой не просто снижение подавления транспирации, а именно ее активацию, которая имеет свои собственные механизмы. Анализ средних значений изменения ассимиляции СО2 при ВП показал достоверно большие величины параметров А2-А0 и А3-А0 при умеренной влажности воздуха. Для разности экстремумов А1-А0 наблюдалась лишь слабая тенденция к снижению при высокой влажности воздуха. Как и в случае транспирационных ответов, влажность воздуха не влияла на изменения А2-А1 (таблица 1).
Таблица 1.
Величины вызванных вариабельными потенциалами изменений транспирации и ассимиляции СО2 листьев гороха посевного
| Фаза ответа | Умеренная влажность | Высокая влажность |
|---|---|---|
| E1-E0, ммоль/(м2 с) | –0.717 ± 0.235* | –0.170 ± 0.055 |
| E2-E0, ммоль/(м2 с) | –0.095 ± 0.320 | 0.294 ± 0.115 |
| E3-E0, ммоль/(м2 с) | –1.553 ± 0.228* | –0.403 ± 0.153 |
| E2-E3, ммоль/(м2 с) | 0.575 ± 0.168 | 0.400 ± 0.103 |
| А1-А0, мкмоль/(м2 с) | –2.592 ± 0.253 | –2.092 ± 0.252 |
| А2-А0, мкмоль/(м2 с) | –1.195 ± 0.128* | –0.717 ± 0.126 |
| А3-А0, мкмоль/(м2 с) | –2.310 ± 0.310* | –1.275 ± 0.240 |
| А2-А3, мкмоль/(м2 с) | 1.623 ± 0.271 | 1.375 ± 0.284 |
Примечание. Е1-Е0, А1-А0 – от начального уровня до первого экстремума; Е2-Е0, А2-А0 – от начального уровня до второго экстремума; Е3-Е0, А3-А0 – от начального уровня до третьего экстремума; Е2-Е1, А2-А1 – от первого до второго экстремума в условиях умеренной (13000 – 19000 ppm, n = 10) и высокой (19 000–25 000 ppm, n = 11) влажности окружающего лист воздуха. Расположение экстремумов показано на рисунках 2 и 3. * – отличия от варианта с высокой влажностью статистически значимы (p < 0.05).
Проведение корреляционного анализа между вызванными вариабельным потенциалом изменениями транспирации и ассимиляции СО2 на различных фазах развития ответов показало умеренную достоверную корреляцию между А2-А0 и Е2-Е0 (R = 0.53) и высокую достоверную корреляцию между А3-А0 и Е3-Е0 (R = 0.81) (рис. 5). Такой результат показывает, что изменения устьичной проводимости, вероятно, лежащие в основе вызванных ВП изменений транспирации, слабо влияют на быструю компоненту фотосинтетического ответа, однако могут вносить существенный вклад в длительное ингибирование фотосинтеза.
Рис. 5.
Величины коэффициентов линейной корреляции (R) между вызванными вариабельными потенциалами изменениями транспирации и ассимиляции СО2 листьев гороха посевного на различных фазах развития ответов. Белым цветом обозначена корреляция фаз А1-А0 и Е1-Е0 (◻), светло-серым цветом – корреляция А2-А0 и Е2-Е0 (◼), темно-серым – А3-А0 и Е3-Е0 (◼), черным – А2-А1 и Е2-Е1 (◼). Коэффициенты корреляции рассчитаны по всему исследованному диапазону влажностей (n = 21). * – коэффициент корреляции является статистически значимым (p < 0.05).

ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о наличии связи индуцированных вариабельным потенциалом изменений транспирации с уровнем влажности воздуха, что согласуется с обобщенными литературными данными, представленными во Введении [10, 12, 13, 15–18, 23, 24]. Интерпретация полученных результатов требует обращения к механизму генерации вариабельного потенциала в клетках высших растений [9, 25]. Генерация ВП связана со входом в клетку ионов Ca2+, увеличение концентрации которого вызывает активацию анионных каналов и инактивацию протонной АТФазы, что ведет к развитию деполяризации. Формирование реполяризации вызвано выходом из клетки ионов K+ и реактивацией протонного насоса [25]. Как было отмечено выше, в целом можно выделить следующие стадии индуцированного ВП транспирационного ответа: кратковременная инактивация, переходная активация и длительная инактивация. Выраженность каждой из стадий ответа потенциально может варьировать при различной влажности воздуха, что обуславливает различия в итоговой (суммарной) динамике транспирации.
Известно, что закрытие устьиц обусловлено инактивацией K+inward-каналов, активацией K+outward-каналов, а также анионных каналов и снижением активности Н+-АТФазы [25, 26], что приводит к уменьшению концентрации осмотически активных ионов и падению тургора. Генерация ВП связана с инактивацией H+-АТФазы плазматической мембраны, которая приводит к активации ионных каналов и возникновению масштабных потоков K+ и Cl- из клетки [25]. На основании этого можно предполагать ключевую роль снижения активности H+-АТФазы и последующей активации ионных каналов в развитии кратковременной инактивации транспирации. Проведенный ранее ингибиторный анализ [13], который показал ключевую роль инактивации H+-АТФазы в развитии изменений транспирации при ВП, подтверждает это предположение. Дополнительным аргументом в пользу приведенного механизма является также близкое время (первые 3–5 минут после нанесения локального ожога) развития кратковременной инактивации транспирации и быстрой начальной деполяризации в ходе ВП, которая в значительной степени связана с активацией ионных каналов [25].
Аналогичные ионные механизмы могут обуславливать и длительную инактивацию транспирации; в то же время такая инактивация может быть связана не только непосредственно с распространением ВП, но и с вызванным вариабельным потенциалом длительным повышением содержания стрессовых фитогормонов (прежде всего, абсцизовой кислоты) [8], которые регулируют активность анионных и калиевых каналов, а также Н+-АТФазы, снижая тем самым устьичную проводимость [28]. Литературные данные [17, 18] подтверждают это предположение, показывая, что ВП увеличивает содержание абсцизовой кислоты в растении, при этом снижение ассимиляции СО2 и транспирации после вариабельного потенциала на длительных временных интервалах (десятки минут) связано, по-видимому, с таким повышением.
Можно предположить, что сходные изменения ионного транспорта и снижение тургора, происходящие не в устьичных, а в эпидермальных клетках, также обеспечивают активацию транспирации, имеющую место после кратковременной инактивации. Известно, что активация транспирации может быть вызвана снижением тургора в соседних с замыкающими эпидермальных клетках – так называемый эффект Иванова [27]. Такое снижение тургора эпидермальных клеток может быть также связано с распространением вариабельного потенциала и возникновением трансмембранных ионных потоков. Различия в динамике изменения тургора устьичных и эпидермальных клеток могут обуславливать наблюдаемые многофазные изменения транспирации, развивающиеся после локального повреждения. В свою очередь, тип транспирационного ответа при отличающейся влажности воздуха может зависеть от различного влияния содержания воды в воздухе на вызванные ВП ответы замыкающих клеток устьиц и клеток эпидермиса; однако механизмы такого влияния требуют будущих исследований. Изменение активности ассимиляции, как показано выше, также проявляет зависимость от уровня влажности воздуха, при этом увеличение влажности ведет к понижению ответа ассимиляции CO2. Наличие такой зависимости может объясняться существованием двух путей регуляции интенсивности ассимиляции. Первый из них связан с возрастанием внеклеточного pH, имеющего место при генерации ВП, приводящее к снижению поступления СО2 в клетку и уменьшению активности темновой стадии фотосинтеза [8]. Определенный вклад в спад ассимиляции СО2 может вносить и понижение внутриклеточного рН, которое приводит к закислению стромы хлоропластов [20], тем самым, вероятно, снижая активность ферментов цикла Кальвина.
Другим путем ВП-индуцированного уменьшения поступления CO2 в клетки мезофилла является, по-видимому, снижение устьичной проводимости; вероятно, именно этот путь в значительной степени отвечает за длительную инактивацию фотосинтеза (десятки минут), так как на этом временном интервале между изменениями транспирации и ассимиляции СО2 наблюдается высокая корреляция. При этом, если первый из отмеченных механизмов ведет к снижению интенсивности ассимиляции независимо от влажности воздуха, то изменение устьичной проводимости, как было отмечено выше, может иметь различную направленность, соответственно внося вклад в активацию или инактивацию ассимиляции. Однако, в отличие от транспирации, ответы ассимиляции изменяются только по амплитуде, сохраняя свою направленность (снижение активности) (рис. 5). Это может говорить о том, что первый из указанных механизмов вносит больший вклад в регуляцию ассимиляции при распространении ВП.
ЗАКЛЮЧЕНИЕ
Ранее нами было показано, что распространяющиеся вариабельные потенциалы [13, 19, 21] участвуют в повышении теплоустойчивости фотосинтетического аппарата и растения в целом, т.е. являются одним из механизмов адаптации растения к действию температурного фактора [8]. Обнаруженная в настоящей работе зависимость параметров вызванного ВП функционального ответа от влажности может быть значимой для “выбора стратегии” такой адаптации в условиях комбинированного действия повышенной температуры и различного уровня влажности. В частности, в условиях повышенной влажности фактор потери влаги для растения не столь критичен, в связи с чем целесообразным является снижение температуры путем повышения транспирации. В условиях умеренной и низкой влажности определяющим для выживания будет снижение транспирации для обеспечения приемлемого для жизни уровня содержания воды.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (Государственное задание № 6.3199.2017/4.6) и Российского фонда фундаментальных исследований (проект № 16-34-00972 мол_а).
Список литературы
Perrone I., Pagliarani C., Lovisolo C., Chitarra W., R-oman F., Schubert A. Recovery from water stress af-fects grape leaf petiole transcriptome // Planta. 2012. V. 235(6). P. 1383–1396.
Karuppanapandian T., Geilfus C.M., Mühling K.H., Novák O., Gloser V. Early changes of the pH of the apoplast are different in leaves, stem and roots of Vicia faba L. under declining water availability // Plant Sci. 2017. V. 255. P. 51–58.
Mott K. Leaf hydraulic conductivity and stomatal responses to humidity in amphistomatous leaves // Plant Cell Environ. 2007. V. 30. V. 1444–1449.
Kuwagata T., Ishikawa-Sakurai J., Hayashi H., Nagasuga K., Fukushi K., Ahamed A., Takasugi K., Katsuhara M., Murai-Hatano M. Influence of low air humidity and low root temperature on water uptake, growth and aquaporin expression in rice plants // Plant Cell Physiol. 2012. V. 53(8). P. 1418–1431.
Bi H., Kovalchuk N., Langridge P., Tricker P.J., Lopato S., Borisjuk N. The impact of drought on wheat leaf cuticle properties // BMC Plant Biol. 2017. V. 17(1). Article 85.
Fromm J., Lautner S. Electrical signals and their physiological significance in plants // Plant Cell Environ. 2007. V. 30. P. 249–257.
Gallé A., Lautner S., Flexas J., Fromm J. Environmental stimuli and physiological responses: The current view on electrical signalling // Environmental and Experimental Botany. 2015. V. 114. P. 15–21.
Sukhov V. Electrical signals as mechanism of photosynthesis regulation in plants // Photosynthesis Research. 2016. V. 130(1–3). P. 373–387.
Vodeneev V.A., Katicheva L.A., Sukhov V.S. Electrical signals in higher plants: Mechanisms of generation and propagation // Biophysics. 2016. V. 61. P. 505–512.
Lautner S., Stummer M., Matyssek R., Fromm J., Grams T.E.E. Involvement of respiratory processes in the transient knockout of net CO2 uptake in Mimosa pudica upon heat stimulation // Plant Cell Environ. 2014. V. 37. P. 254–260.
Grams T.E.E., Lautner S., Felle H.H., Matyssek R., Fromm J. Heatinduced electrical signals affect cytoplasmic and apoplastic pH as well as photosynthesis during propagation through the maize leaf // Plant Cell Environ. 2009. V. 32. P. 319–326.
Sukhov V., Orlova L., Mysyagin S., Sinitsina J., Vodeneev V. Analysis of the photosynthetic response induced by variation potential in geranium // Planta. 2012. V. 235. P. 703–712.
Sukhov V., Surova L., Sherstneva O., Bushueva A., Vodeneev V. Variation potential induces decreased PSI damage and increased PSII damage under high external temperatures in pea // Funct. Plant Biol. 2015. V. 42. P. 727–736.
Grams T.E.E., Koziolek C., Lautner S., Matyssek R., Fromm J. Distinct roles of electric and hydraulic signals on the reaction of leaf gas exchange upon re-irrigation in Zea mays L. // Plant Cell Environ. 2007. V. 30. P. 79–84.
Galle A., Lautner S., Flexas J., Ribas-Carbo M., Hanson D., Roesgen J., Fromm J. Photosynthetic responses of soybean (Glycine max L.) to heat-induced electrical signalling are predominantly governed by modifications of mesophyll conductance for CO2 // Plant Cell Environ. 2013. V. 36. P. 542–552.
Kaiser H., Grams T.E.E. Rapid hydro-passive opening and subsequent active stomatal closure follow heat-induced electrical signals in Mimosa pudica // Journal of Experimental Botany. 2006. V. 57. P. 2087–2092.
Hlavackova V., Krchnak P., Naus J., Novak O., Spundova M., Strnad M. Electrical and chemical signals involved in short-term systemic photosynthetic responses of tobacco plants to local burning // Planta. 2006. V. 225. P. 235–244.
Hlavinka J., Nozkova-Hlavackova V., Flokova K., Novak O., Naus J. Jasmonic acid accumulation and systemic photosynthetic and electrical changes in locally burned wild type tomato, ABA-deficient sitiens mutants and sitiens pre-treated by ABA // Plant Physiol. Biochem. 2012. V. 54. P. 89–96.
Sukhov V., Surova L., Sherstneva O., Vodeneev V. Influence of variation potential on resistance of the photosynthetic machinery to heating in pea // Physiologia Plantarum. 2014. V. 152. P. 773–783.
Sukhov V., Surova L., Morozova E., Sherstneva O., Vodeneev V. Changes in H+-ATP synthase activity, proton electrochemical gradient, and pH in pea chloroplast can be connected with variation potential // Frontiers in Plant Science. 2016. V. 7. Article 1092.
Surova L., Sherstneva O., Vodeneev V., Sukhov V. Variation potential propagation decreases heat-related damage of pea photosystem I by two different pathways // Plant Signaling & Behavior. 2016. V. 11(3). Article e1145334.
Ретивин В.Г., Опритов В.А., Федулина С.Б. Предадаптация тканей стебля Cucurbita pepo к повреждающему действию низких температур индуцированная потенциалом действия // Физиология растений. 1997. Т. 44. С. 499–510.
Koziolek C., Grams T.E.E., Schreiber U., Matyssek R., Fromm J. Transient knockout of photosynthesis mediated by electrical signals // New Phytologist. 2004. V. 161. P. 715–722.
Grams T.E.E., Lautner S., Felle H.H., Matyssek R., Fromm J. Heatinduced electrical signals affect cytoplasmic and apoplastic pH as well as photosynthesis during propagation through the maize leaf // Plant Cell Environ. 2009. V. 32. P. 319–326
Vodeneev V., Akinchits E., Sukhov V. Variation potential in higher plants: Mechanisms of generation and propagation // Plant Signaling & Behavior. 2015. V. 10(9). Article e1057365.
Wang Y., Noguchi K., Ono N., Inoue S., Terashima I., Kinoshita T. Overexpression of plasma membrane H+-ATPase in guard cells promotes light-induced stomatal opening and enhances plant growth // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 533–538.
Kollist H., Nuhkat M., Rob M., Roelfsema G. Closing gaps: linking elements that control stomatal movement // New Phytologist. 2014. V. 203. P. 44–62.
Aliniaeifard S., van Meeteren U. Can prolonged exposure to low VPD disturb the ABA signalling in stomatal guard cells? // J. Exp. Bot. 2013. V. 64. P. 3551–3566.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


