Физиология растений, 2019, T. 66, № 2, стр. 83-103
Пептидные гормоны растений
М. С. Ганчева a, Ю. В. Маловичко a, Л. О. Полюшкевич a, И. Е. Додуева a, Л. А. Лутова a
a Санкт-Петербургский государственный университет,
кафедра генетики биотехнологии
Санкт-Петербург, Россия
Поступила в редакцию 26.02.2018
После доработки 04.04.2018
Принята к публикации 16.05.2018
Аннотация
В дополнение к классическим фитогормонам, таким как ауксин, цитокинин, этилен, гиббереллин и абсцизовая кислота, пептидные гормоны растений также вовлечены в различные аспекты роста и развития. Эта группа фитогормонов представлена короткими пептидами, которые являются, как правило, лигандами для рецепторных киназ, инициирующих сигнальный каскад, который регулирует развитие растения в ответ на стимулы из внешней или внутренней среды. В обзоре рассматриваются известные к настоящему времени семейства пептидных фитогормонов, их строение, особенности синтеза, рецепторы и роль в развитии растений.
ВВЕДЕНИЕ
Гормоны белковой и пептидной природы, представляющие собой цепи АК разной длины, широко представлены в животном и растительном царствах. Первый пептидный гормон, инсулин, был выявлен у животных в 1921 году. У растений, в связи с ранним открытием гормонов непептидной природы (ауксинов, цитокининов и т.д.), пептидные гормоны долго оставались в тени. Тем не менее, в 1991 г. был выявлен первый сигнальный пептид у растений – системин томатов, вовлеченный в защитные реакции [1]. Открытие этого пептида вдохновило биологов растений на поиск других пептидных сигналов. В 1996 г. идентифицированы фитосульфокины (PSK), которые вовлечены в регуляцию делений клеток; PSK были первыми выявленными сигнальными пептидами с посттрансляционной модификацией у растений [2]. В 1999 г. было предположено, что белок CLAVATA3 является секретируемым и, взаимодействуя со своим рецептором, регулирует размер пула стволовых клеток в апикальной меристеме побега [3]. Поиск системин-подобных пептидов у других видов растений привел к обнаружению в 2001 году у табака семейства пептидов HypSys, которые относятся к защитным сигнальным пептидам растений [1]. В 2006 году был обнаружен TDIF (Tracheary Element Differentiation Inhibitory Factor), пептид, регулирующий развитие проводящей системы и, как впоследствии оказалось, относящийся к большому и на данный момент наиболее изученному семейству сигнальных пептидов CLE (CLAVATA3/EMBRYO SURROUNDING REGION-RELATED) [4].
Гены, кодирующие пептидные фитогормоны разных групп, выявлены у всех изученных растений, а также за пределами растительного царства – у некоторых паразитов растений. Как правило, пептидные фитогормоны транслируются в виде относительно длинного (сотни АК) белка-предшественника; созревание сигнальных пептидов обычно включает в себя протеолитический процессинг белков-предшественников (в результате которого от пептида остается только основной функциональный домен (или домены) длиной в несколько десятков АК) и модификации определенных АК в составе пептида [5]. Затем, как правило, имеет место транспорт зрелого сигнального пептида в апопласт, где он взаимодействует со своими рецепторами [5]. Белок-предшественник в большинстве случаев состоит из N-концевой сигнальной последовательности, направляющей пептид на секреторный путь, вариабельного участка и наиболее функционально значимого С-концевого домена, соответствующего последовательности зрелого пептида (иногда таких доменов может быть несколько) [5].
Все сигнальные пептиды можно подразделить на 3 группы: две группы секретируемых пептидов (их особенностью является N-концевая сигнальная последовательность, определяющая транспортировку за пределы клетки) и одна группа несекретируемых пептидов, без сигнальной последовательности. К секретируемым относятся группы посттрансляционно модифицируемых пептидов (9 идентифицированных семейств) и цистеин-богатых пептидов (13 идентифицированных семейств). Посттрансляционно модифицируемые пептиды (ПТМП) в зрелом состоянии имеют небольшие размеры (менее 20 АК) и после трансляции подвергаются протеолитическому процессингу и модификациям аминокислот, которые изменяет конформацию пептидов и приводят к изменению их активности. К группе цистеин-богатых пептидов (ЦБП) относятся более крупные (до 160 АК) белки, которые заряжены положительно и, как правило, содержат от 4 до 16 остатков цистеина, образующих дисульфидные мостики, важные для формирования трехмерной структуры пептида. Предполагается, что секретируемые пептиды могут как пассивно диффундировать во внеклеточном пространстве, так и транспортироваться по проводящим тканям. Несекретируемые сигнальные пептиды (НСП), лишенные N-концевой сигнальной последовательности, также в некоторых случаях доставляются во внеклеточное пространство, где они действуют как межклеточный сигнал.
Общепринятым является утверждение, что пептидами называют вещества, молекулы которых содержат менее 50 аминокислот. В таком случае, некоторые гормоны некорректно называть пептидными, а нужно называть белковыми (например, многие ЦБП, по сути, являются белками). Однако в литературе, посвященной пептидным гормоном, чтобы, вероятно, не дробить семейство и не создавать путаницы в определениях, все гормоны пептидной и белковой природы называют пептидными. Так поступим и мы.
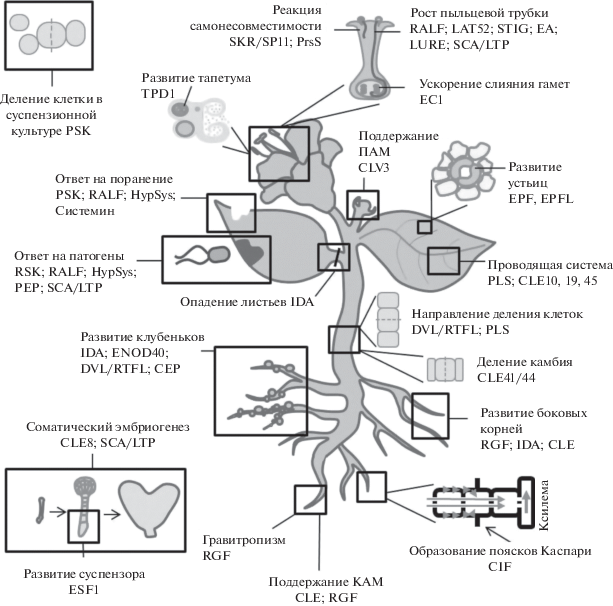
Как будет видно, пептидные фитогормоны весьма разнообразны по своим функциям (рис. 1). В целом можно сказать, что ПТМП регулируют разнообразные онтогенетические процессы, большая часть ЦБП участвует в регуляции самонесовместимости, а большая часть НСП – в растительно-микробных взаимодействиях.
Количество групп пептидных фитогормонов постоянно растет, так как почти каждый год открывают новые семейства. Например, у Arabidopsis thaliana обнаружено более 30 000 открытых рамок считывания, кодирующих еще не изученные пептиды длиной от 25 до 250 аминокислот [6], подавляющее большинство из которых до сих пор не охарактеризованы. В этом обзоре мы постараемся охватить все изученные на сегодняшний день семейства пептидных фитогормонов.
ПОСТТРАНСЛЯЦИОННО МОДИФИЦИРУЕМЫЕ ПЕПТИДЫ (ПТМП)
Общей характеристикой ПТМП является то, что их молекулы состоят из 5–20 АК, не содержат большого количества цистеиновых остатков, содержат модификации на пролиновых и/или тирозиновых остатках, и образуются из более крупного предшественника. Функции ПТМП в развитии растений крайне разнообразны. К ПТМП относятся семейства пептидов CLAVATA3/EMBRYO SURROUNDING REGION-RELATED (CLE), ROOT GROWTH FACTOR /GOLVEN/CLE-LIKE (RGF/GLV/CLEL), PLANT PEPTIDES CONTAINING SULFATED TYROSINE (PSY), фитосульфокины (PSK), C-TERMINALLY ENCODED PEPTIDES (CEP), INFLORESCENCE DEFICIENT IN ABSCISSION (IDA), CASPARIAN STRIP INTEGRITY FACTORS (CIF), PAMP-INDUCED SECRETED PEPTIDES (PIP), HYDROXYPROLINE-RICH GLYCOPEPTIDE SYSTEMINS (HypSys).
Для созревания ПТМП первостепенное значение имеет протеолитический процессинг, в результате которого от длинного пептида-предшественника остается только короткий функциональный домен. Про механизмы протеолитического процессинга известно мало, тем не менее, были выявлены семейства ферментов, играющих первостепенную роль в процессинге и созревании разных групп ПТМП: так, для образования функционально активных пептидов IDA необходимы ферменты группы субтилизин-подобных протеиназ (Subtilisin-Like Proteinases, SBT) [7], а для процессинга пептида CLE19 из семейства CLE – карбоксипептидаза SOL1 (SUPPRESSOR OF LLP1) [8]. Мутанты с потерей функции генов соответствующих ферментов часто имеют дефекты развития, сходные с таковыми у мутантов с потерей функции определенных генов ПТМП [5].
Помимо протеолитического процессинга, для созревания ПТМП важны посттрансляционные модификации АК, такие как сульфатирование тирозина и гидроксилирование пролина с последующим арабинозилированием гидроксипролина. Подобные модификации необходимы для поддержания стабильности пептидов, а также для их взаимодействия с рецепторами [9]. Гидроксилирование пролина в составе ПТМП катализирует фермент пролил-4-гидролаза (PROLYL-4-HYDROXYLASE, P4H), мембранный белок, локализованный в ЭПС и аппарате Гольджи [10]. Гидроксилирование пролина имеет первостепенную важность для активности некоторых ПТМП: так, было показано, что остаток гидроксипролина формирует водородные связи между пептидом IDA и его рецептором [11]. С другой стороны, у пептидов CLE само по себе гидроксилирование пролина не столь важно для активности, но необходимо для дальнейшей модификации гидроксипролина – арабинозилирование [4]. Арабинозилирование гидроксипролина катализирует гидроксипролин-О-арабинозилтрансфераза (HYDROXYPROLINE O-ARABINOSYL TRANSFERASE) – фермент, локализованный в аппарате Гольджи. Помимо CLЕ, арабинозилированию гидроксипролина подвергаются также пептиды PSY1 [12]. Сульфатирование тирозина опосредовано тирозилпротеинсульфотранесферазой (TYROSYLPROTEIN SYLFOTRANSFERASE, TPST) – находящимся в аппарате Гольджи ферментом, который катализирует перенос сульфата на фенольную группу тирозина. Сульфатирование тирозина имеет место при созревании пептидов PSK, PSY1 и RGF и в дальнейшем важно для их взаимодействия с рецепторами [13]. У A. thaliana найден лишь один ген, кодирующий TPST, экспрессия которого наблюдается во всем растении с максимумом экспрессии в апикальной меристеме корня; мутант tpst-1 характеризуется серьезными дефектами в развитии: у него уменьшена меристема корня и отсутствует координация между делением клеток и их растяжением. К полному восстановлению нормального фенотипа у мутанта tpst-1 приводит обработка ПТМП PSK, PSY1 и RGF1, что свидетельствует о роли сульфатирования тирозина в их созревании [14].
Рецепторами для ПТМП являются серин-треониновые рецепторные протеинкиназы с экстраклеточным доменом, содержащие лейцин-богатые повторы (LRR-RLK, Leucine-Rich Repeats containing Receptor-Like Kinase): рецепторы CLE, IDA, CEP, RGF, PIP, PEP и CIF относятся к LRR-RLK подкласса XI, рецептор PSK – PSKR – к LRR-RLK подкласса X, рецептор пептидов HypSys неизвестен [15]. Внеклеточные домены LRR-RLK содержат лейцин-богатые повторы (LRR), которые формируют спираль, необходимую для формирования поверхности для взаимодействия с пептидом-лигандом.
В ряде случаев показано, что в связывании ПТМП с их рецепторами участвуют белки-корецепторы, также относящиеся к LRR-RLK и играющие роль в регуляции специфичности рецепции и/или дальнейшей передаче сигнала, при этом пептидный лиганд действует как молекулярный клей для стабилизации взаимодействия между рецептором и корецептором [15, 16]. Зачастую в качестве рецепторов и корецепторов при связывании ПТМП выступают “дефектные” LRR-RLK, лишенные лиганд-связывающего либо киназного домена [17].
CLAVATA3/EMBRYO SURROUNDING REGION-RELATED (CLE)
Наиболее изученными пептидными фитогормонами являются пептиды CLE. Гены, кодирующие пептиды CLE и их рецепторы, были найдены у различных растений, включая однодольные, двудольные, мхи и водоросли [18]. Функциональной частью пептида CLE является CLE-домен, расположенный вблизи C-конца полнодлинновых пептидов-предшественников. Сразу после трансляции пептиды CLE претерпевают протеолитический процессинг, в результате которого от пептида-предшественника остается только CLE-домен; таким образом, зрелый пептид CLE состоит из 12–13 АК и содержит от 1 до 3 высоко консервативных остатков пролина. Первый выявленный представитель семейства CLE, CLAVATA3 (CLV3), был идентифицирован как ключевой регулятор активности апикальной меристемы побега; его функция заключается в подавлении экспрессии гена WUSCHEL (WUS), кодирующего гомеодоменсодержащий ТФ – регулятор организующего центра меристемы [19]. Ген CLV3 экспрессируется в периферических слоях клеток центральной зоны апикальной меристемы побега и связывается с тремя рецепторами: CLV1 (CLAVATA1), CLV2 (CLAVATA2) (которая для связывания CLV3 образует комплекс с рецепторной киназой SUPPRESSOR OF LLP1-2 (SOL2)/CORYNE (CRN)) и RECEPTOR-LIKE PROTEIN KINASE 2 (RPK2)/TOADSTOOL2 (TOAD2); эти три рецепторных комплекса могут функционировать независимо друг от друга. Помимо этого, предполагается, что в рецепции CLV3 также участвуют LRR-RLK BARELY ANY MERISTEM (BAM1 и BAM2) [17]. Рецепторы, связывая пептиды CLE, запускают практически неизученный сигнальный путь, приводящий к репрессии транскрипции гена WUS; к числу выявленных компонентов этого пути относятся малая ГТФаза ROP, МАР-киназный каскад, а также протеинфосфатазы семейства 2С POLTERGEIST (POL) и POLTERGEIST-LIKE1 (PLL1) [15]. В свою очередь, ТФ WUS мигрирует из организующего центра и присоединяется к промотору гена CLV3 для его активации [17].
В апикальной меристеме корня функцию, гомологичную CLV3, выполняет пептид CLE40, необходимый для ограничения зоны экспрессии гена WOX5 – ортолога гена WUS [20]. Пептид CLE40 синтезируется в клетках колумеллы, рецепцию CLE40 осуществляют рецепторные киназы CLV1 и ACR4 (ARABIDOPSIS CRINKLY 4), образуя гомо- и гетеродимеры. Как и ТФ WUS, ТФ WOX5 может перемещаться из организующего центра меристемы корня в прилежащие стволовые клетки, репрессируя транскрипцию генов, отвечающих за дифференцировку клеток [21], но прямой регуляции экспрессии гена CLE40 с помощью ТФ WOX5 не выявлено.
Экспрессирующиеся во флоэме гены CLE41 и CLE44 кодируют белки TDIF, которые стимулируют пролиферацию клеток камбия и ингибируют дифференцировку ксилемы [4]. Из флоэмы пептиды CLE41 и CLE44 попадают в апопласт, где связываются с рецепторами TDIF RECEPTOR/PHLOEM INTERCALATED WITH XYLEM (TDR/PXY) на плазматической мембране клеток прокамбия и камбия; индуцируемый ими сигнальный каскад приводит к активации экспрессии еще одного представителя семейства генов WOX – WOX4, который функционирует как позитивный регулятор пролиферации клеток камбия [22].
Помимо TDIF, в регуляции развития проводящей системы растений участвует пептид CLE10, который может являться негативным регулятором развития сосудов, благодаря ингибированию экспрессии генов ARR типа А, ARR5 и ARR6, кодирующих репрессоры передачи сигнала цитокининов [23]. Цитокинины стимулируют пролиферацию клеток камбия и подавляют дифференцировку клеток ксилемы; считается, что CLE10, усиливая цитокининовый сигналинг, негативно регулирует формирование сосудов. Пептид CLE19, напротив, считается стимулятором развития ксилемы: сверхэкспрессия гена CLE19 стимулирует дифференцировку сосудов, что приводит к образованию ксилемных “островков”, не связанных с проводящей системой растения, в органах цветка Arabidopsis и капусты [24], а также резко повышает количество элементов ксилемы – сосудов и одревесневшей ксилемной паренхимы – в запасающем корне редиса [25].
В развитии другой проводящей ткани, флоэмы, участвует пептид CLE45, негативно регулирующий формирование протофлоэмы в меристеме корня A. thaliana. В рецепции CLE45 принимают участие LRR-RLK BAM3 и STERILITY-REGULATING KINASE MEMBER1 (SKM1). Мишенью действия CLE45 являются локализованные в плазматической мембране белки BREVIS RADIX (BRX) и OCTOPUS (OPS), которые участвуют в регуляции развития протофлоэмы [17].
Помимо регуляции гистогенеза в постэмбриональном периоде, некоторые пептиды CLE также вовлечены в регуляцию эмбриогенеза: так, пептид CLE8 является регулятором ранних этапов эмбриогенеза и развития семян [17]. Мишенью CLE8 является ген WOX8, регулирующий идентичность базального домена зародыша; рецептор CLE8 неизвестен, но синтетический пептид CLE8 может связываться с рецепторной киназой BAM1 [26].
У бобовых некоторые пептиды CLE (MtCLE13 Medicago truncatula, PsCLE13 Pisum sativum, CLE ROOT SIGNAL1 и 2 (CLE-RS1 и CLE-RS2) Lotus japonicus), являются компонентами системы авторегуляции клубенькообразования и подавляют образование избыточного количества клубеньков [17]. Пептиды CLE этой группы по ксилеме поднимаются в листья, где взаимодействуют со своим рецептором – CLV1-подобной рецепторной киназой MtSUNN M. truncatula/PsSYM29 Pisum sativum/LjHAR1 L. japonicus/GmNARK Glicine max – и запускают неизвестный вторичный сигнал, предположительно идущий из стебля в корень и подавляющий развитие клубеньков. Мишенью действия этой системы является ген WOX5, который помимо апикальной меристемы корня экспрессируется также в меристемах клубеньков [27].
Помимо количества клубеньков, CLE-пептиды могут также регулировать количество закладывающихся боковых корней: так, у A. thaliana экспрессия генов CLE1, -3, -4, и -7 индуцируется нехваткой азота в корнях, а их сверхэкспрессия подавляет рост примордиев боковых корней, что предотвращает разрастание корневой системы в неблагоприятных условиях. Рецептором этих CLE-пептидов выступает CLV1 [28].
Наконец, пептиды CLE важны для регуляции взаимодействия с патогенами – в особенности с теми, которые вызывают у растений пролиферацию клеток и изменение программы их дифференцировки, формирование новых органов и аномальных разрастаний. Например, активация экспрессии некоторых генов CLE имеет место при развитии опухолей, индуцированных Agrobacterium tumefaciens; в опытах по совместному заражению растений ризобиями и агробактериями получены данные, свидетельствующие о том, что для регуляции взаимодействия с агробактериями растение использует те же компоненты системы авторегуляции клубенькообразования – пептиды CLE, их рецепторы и гены WOX – что контролируют развитие клубеньков [29]. Удивительно, но некоторые паразитические нематоды также секретируют CLE-подобные пептиды, которые необходимы для успешного заражения растения. Так, в геноме нематоды Heterodera glycines, индуцирующей развитие галлов на корнях растений, присутствуют гены HgCLE1/2B10/Hg-SYV46 и HgCLE2/4G12, кодирующие пептиды CLE и экспрессирующиеся в клетках глоточных желез. Интересно, что сверхэкспрессия “нематодных” генов CLE, – например, HgCLE1, восстанавливает нормальный фенотип у мутанта clv3 [30], что свидетельствует о сходстве функций пептидов CLE у нематод и растений. На поверхности растительных клеток пептиды CLE, секретируемые нематодами, связываются с рецепторным комплексом CLV2/CRN [31].
ROOT GROWTH FACTOR/GOLVEN/CLE-LIKE (RGF/GLV/CLEL)
Пептиды RGF/GLV/CLEL имеют длину 13–18 АК и содержат гидроксилированный пролин и сульфатированный тирозин. Эти пептиды были впервые обнаружены у A. thaliana и в дальнейшем выявлены у других растений [14, 32]. У A. thaliana семейство пептидов RGF/GLV/CLEL включает в себя 11 членов. Зрелые пептиды RGF образуются путем протеолитического процессинга из пептида-предшественника длиной 86–163 АК и соответствуют последовательности консервативного GLV-домена. Пептид-предшественник подвергается сульфатированию по консервативным остаткам тирозина, эту реакцию катализирует фермент TPST [12].
Функции пептидов RGF частично перекрываются: мутации по одному гену RGF не вызывают каких-либо изменений, но у тройных мутантов rgf1rgf2rgf3 происходит укорочение корня из-за уменьшения количества клеток в его апикальной меристеме [33]. Известно, что пептид RGF1 участвует в поддержании недифференцированного статуса клеток покоящегося центра в апикальной меристеме корня и координации делений стволовых клеток колумеллы. Экзогенная обработка RGF1 вызывает увеличение меристемы корня и уровней экспрессии генов PLT1 и PLT2, кодирующих ТФ PLETHORA, градиент которых контролирует судьбу стволовых клеток корня [14]. Еще одна функция пептидов RGF связана с контролем полярного транспорта ауксина и гравитропизма корня: сверхэкспрессия генов GLV3, GLV6, и GLV9 приводит к росту волнистых корней (в связи с чем семейство получило свое название “GOLVEN”, что означает “волны” на голландском языке) [33]. Обработка корней пептидом RGF3 вызывает быстрое накопление белка PIN2 – одного из регуляторов полярного транспорта ауксина, в плазматической мембране и везикулах эпидермальных клеток кончика корня [33]. Регулируя полярный транспорт ауксина, пептиды RGF/GLV/CLEL могут участвовать в контроле и других ауксин-зависимых процессов, таких как рост корневых волосков и развитие боковых корней.
Недавно у A. thaliana были обнаружены рецепторы пептидов RGF – они получили название RGF RECEPTORs – RGFR1, RGFR2 и RGFR3. Тройные мутации по генам RGFR приводят к нечувствительности к обработке пептидами RGF и укорочению корня [34].
ФИТОСУЛЬФОКИНЫ (PSK)
Фитосульфокины были выявлены при поиске фактора, регулирующего пролиферацию клеток в суспензионной культуре растительных клеток. Известно, что для пролиферации клеток растений в суспензионной культуре необходимо достижение минимальной плотности клеток, при этом начала пролиферации клеток можно добиться, добавляя среду с более старой суспензионной культуры к более молодой, что предполагает наличие химического регулятора пролиферации. В 1996 г. из суспензионной культуры мезофилла Asparagus officinalis были выделены два очень коротких (всего 4–5 АК) пептида, в состав которых входил сульфатированный тирозин: дисульфатированный пентапепид, названный PSK-α (YIYTH) и тетрапепид PSK-β, образованный из PSK-α в результате удаления С‑концевого остатка глутамина [2, 35]. Эти пептиды были названы фитосульфокинами – обычно этот термин применяют к PSK-α, тогда как PSK-β считают биологически неактивным продуктом деградации PSK-α [35]. Добавление PSK в среду вызывает деление клеток даже у культур низкой плотности. Однако без ауксина и цитокинина PSK не могут стимулировать деления клеток [36], таким образом, PSK является сигналом кворума, который позволяет клеткам в культуре делиться при наличии, во-первых, определенной плотности клеток и, во-вторых, стимуляторов деления клеток – ауксинов и цитокининов.
In planta PSK обнаруживаются в местах активного деления клеток, способствуя органогенезу (образованию листьев, боковых корней и т.д.). Показано, что добавление в культуральную среду PSK в концентрации 1 нМ ускоряет рост корня у проростков A. thaliana, а сверхэкспрессия одного из генов, кодирующих PSK, – AtPSK4 – приводит к удлинению корней и формированию более крупных листьев. Помимо этого, при сверхэкспрессии AtPSK4 происходит повышение уровня экспрессии генов, кодирующих экспансины – ферменты, которые вовлечены в “разрыхление” клеточной стенки [37].
Как и все ПТМП, PSK образуются из белковых предшественников, состоящих из 80–120 АК и содержащих N-терминальную сигнальную последовательность, которая направляет белок на секреторный путь [35]. Гомологи PSK обнаружены у многих двудольных и однодольных; так, у A. thaliana 5 генов кодируют предшественники PSK-α (AtPSK1-5) [38]. Пептид-предшественник подвергается сульфатированию по консервативным остаткам тирозина, эту реакцию катализирует фермент TPST; затем сульфатированный предшественник PSK подвергается протеолитическому процессингу в апопласте с помощью субтилазы (сериновой протеазы) AtSBT1.1 [39]. Рецепторы PSK – рецепторные протеинкиназы PHYTOSULFOKINE RECEPTORs (PSKR) были впервые найдены у моркови (DcPSKR1) [36], а впоследствии у A. thaliana (AtPSKR1 и AtPSKR2) [12]. Интересно, что рецепторы PSK являются уникальными LRR-RLK, обладающими гуанилатциклазной активностью наряду с протеинкиназной, а также свойствами кальмодулин-связывающих белков: в киназном домене AtPSKR1 присутствуют гуанилат-циклазный каталитический центр и сайт связывания кальмодулина, которые важны для передачи сигнала PSK [40]. Для связывания PSK с рецептором необходимы кислые условия, при рН 5.0 связывание идет в 3 раза лучше, чем при рН 6.0, что говорит о том, что закисление клеточной стенки может стимулировать связывание PSK с рецептором и таким образом усиливать передачу сигнала от PSK [41].
PLANT PEPTIDES CONTAINING SULFATED TYROSINE1 (PSY1)
PSY1 – 18 АК гликопептид, содержащий 1 сульфатированный тирозин и два гидроксилированных пролина, функционально сходный с PSK. Как и в случае PSK, обработка PSY1 стимулирует деление клеток в суспензионной культуре, а также рост клеток растяжением в корне и стебле. В геноме A. thaliana имеются два гена, кодирующие пептиды-предшественники PSY1, они экспрессируются во всем растении с максимумами экспрессии в апикальной меристеме побега и зоне элонгации корня [12]. Пептиды-предшественники PSY1 подвергаются сульфатированию тирозина с помощью фермента TPST и протеолитическому процессингу, в результате которого от предшественника остается 18 АК последовательность, соответствующая PSY1-домену.
Рецептор PSY1 – рецепторная киназа PSY1R (PSY1 RECEPTOR) – при связывании лиганда образует гетеродимер с корецептором SERK1 (SOMATIC EMBRYOGENESIS RECEPTOR KINASE1). Мишенью ее действия является мембранная H+-АТФаза AHA2: фосфорилируя и активируя AHA2, киназа PSY1R способствует закислению межклеточного пространства и повышению лабильности клеточной стенки, что способствует росту клеток растяжением [42].
Помимо роста и деления клеток, функционально близкие пептиды PSK и PSY1 участвуют также в регуляции взаимодействия растений с патогенами. Так, было показано, что экспрессия генов PSKR1, PSK1, 2, 4 и PSY1 индуцируется при заражении Pseudomonas syringae pv. tomato. Активация рецепторов PSKR1 и PSY1R ведет к супрессии сигналинга салициловой кислоты (реакция на биотрофных патогенов) и усиливают сигналинг жасмоновой кислоты и, следовательно, усиливает защиту от некротрофных патогенов и ответ на поранение [43].
C-TERMINALLY ENCODED PEPTIDES (СЕР)
У Arabidopsis семейство пептидов CEP было идентифицировано in silico при скрининге белкового семейства, содержащего короткий консервативный домен около С-конца, – т.е. структуры, часто встречающейся у сигнальных пептидов группы ПТМП. Зрелые пептиды СЕР состоят из 15 АК и содержат 2–4 консервативных остатка гидроксилированного пролина. Выяснилось, что гены CEP присутствуют только у семенных растений, у которых хорошо развита корневая система, и отсутствуют у мхов и водорослей [44]. В геноме A. thaliana выявлены 15 генов CEP, экспрессия семи из них повышается примерно в 10 раз при голодании по азоту [45]. Эти гены экспрессируются в стеле боковых корней, затем их белковые продукты попадают в сосуды ксилемы и переносятся в листья. Там они взаимодействуют со своими рецепторами – LRR-RLK СЕРR1 и СЕРR2, индуцируя активацию неизвестного сигнального пути, мишенью которого являются гены, кодирующие несекретируемые пептиды длиной 99 и 102 АК, названные CEP DOWNSTREAM 1 и 2 (CEPD1, 2). Эти пептиды транспортируются по флоэме от листьев обратно в корни и регулируют экспрессию генов нитратных транспортеров, таких как NRT2.1, для компенсации локального азотного голодания [46]. Интересно, что индукция экспрессии NRT2.1 наблюдается только в тех корнях, которые находятся в наиболее богатых по азоту условиях, хотя пептиды CEPD присутствуют во всей корневой системе [46].
Согласно имеющимся данным, функции пептидов СЕР связаны с регуляцией роста стебля и корня, а также развития боковых корней и клубеньков и ответа на абиотический стресс, в особенности – на дефицит азота. Так, у A. thaliana сверхэкспрессия CEP1 тормозит рост корня, особенно в условиях низкого содержания азота и высокого содержания СО2. Другой способ преодоления азотного голодания, доступный только бобовым растениям, – увеличение количества симбиотических клубеньков. Например, у M. truncatula сверхэкспрессия CEP1 и обработка синтетическим 15-аминокислотным пептидом CEP1 вызывает снижение количества боковых корней и увеличение количества клубеньков [47]. Ортолог гена CEPR1 у M. truncatula получил название COMPACT ROOT ARCHITECTURE 2 (CRA2), мутанты по этому гену образуют мало клубеньков [48]. Еще один интересный эффект, который вызывает сверхэкспрессия гена CEP1 или обработка экзогенным CEP1 пептидом, – формирование так называемых сайтов ССР (Circumferential Cell Proliferations) – вздутий на корне, расположенных с определенной периодичностью и возникающих за счет активной пролиферации клеток периферических тканей корня – эпидермы и коры. В ССР сайтах увеличено число слоев клеток коры, а также повышена плотность корневых волосков; в то же время, боковые корни, закладывающиеся в пределах ССР сайтов, останавливаются в развитии и не формируют проводящей системы – таким образом, значение таких сайтов для выживания растений в условиях азотного голодания непонятно [47].
Интересно, что паразитические галлообразующие нематоды, для которых ранее была обнаружена способность к синтезу и секреции пептидов CLE, секретируют еще и пептиды, по последовательности сходные с CEP, которые также могут играть роль в аномальном разрастании тканей корня при формировании сайтов кормления нематод [49].
INFLORESCENCE DEFICIENT IN ABSCISSION (IDA)
В отличие от животных, растения постоянно образуют новые органы, такие как листья, цветки, боковые корни, – таким образом, большое значение приобретает способность к отделению (“сбрасыванию”) органов, которые уже выполнили свою функцию, а также стареющих или поврежденных органов; кроме того, опадение плодов имеет большое значение для распространения семян. Для облегчения этого процесса в органах, подлежащих сбрасыванию (черешках листьев, цветков, плодов) формируется отделительный слой, состоящий из мелких тонкостенных изодиаметрических клеток с плотной цитоплазмой. Процессы, ведущие к опадению органов растения, вызывают повышение концентрации ферментов, осуществляющих гидролиз полисахаридов клеточной стенки в отделительном слое – целлюлаз, полигалактуроназ, экспансинов и т.д. После отделения органа, дистальная часть соединительного слоя формирует лигнифицированный защитный слой, предотвращающий проникновение патогенов.
При старении листьев и цветков, а также созревании плодов, в ответ на уменьшение уровня ауксина и увеличения уровня этилена в клетках отделительного слоя начинается экспрессия генов, кодирующих пептиды INFLORESCENCE DEFICIENT IN ABSCISSION (IDA). Помимо гена IDA в геноме A. thaliana выявлено 8 генов IDA-LIKE (IDL); их продуктами являются пептиды длиной 70–80 АК, которые после трансляции подвергаются протеолитическому процессингу [50]. Функциональной частью пептида IDA является 20 АК домен на С-конце, названный EPIP (Е-xtended PIP) и сходный по последовательности с одним из доменов пептидов PIP (см. ниже). Было показано, что экзогенный EPIP восстанавливает фенотип мутанта ida [51].
Пептиды IDА взаимодействуют с рецепторными киназами HAE (HAESA) и HSL2 (HAESA-Like2) на поверхности клеток отделительного слоя. У мутантов ida и двойных мутантов по рецепторам HAE и HSL2 не опадают лепестки [51]. В связывании пептидов IDА участвует также корецептор SERK1, взаимодействующий с HAE [16]. При связывании IDA с рецепторами происходит запуск MAP киназного каскада (MITOGEN-ACTIVATED PROTEIN KINASE) включающего в себя киназы группы MAPK MPK3 и MPK6 и MAPKK MKK4 и MKK5; активация этого сигнального каскада стимулирует экспрессию генов, кодирующих ферменты-“разрыхлители” клеточной стенки [52]. Кроме того, в число генов-мишеней пептидов IDА входят некоторые гены, кодирующие ТФ семейства KNOX (KNOTTED-RELATED HOMEOBOX) – KNAT1 (KNOTTED-LIKE FROM ARABIDOPSIS THALIANA1), KNAT2 и KNAT6. По литературным данным, помимо функций в развитии меристемы побега и листьев, эти гены также играют роль в формировании отделительного слоя, при этом KNAT1 ограничивает экспрессию генов KNAT2 и KNAT6, которые необходимы для формирования отделительного слоя [53].
Еще одна функция пептидов IDA – регуляция роста боковых корней. У мутантов ida, hae, hsl2 и hae/hsl2 происходит снижение количества боковых корней за счет того, что их примордии не могут преодолеть кору, эндодермальные и эпидермальные клеточные слои [54]. В корне, так же, как и в отделительном слое, пептиды IDA активируют экспрессию генов, играющих роль в перестройке клеточной стенки, что позволяет примордию бокового корня проникнуть через слои клеток эндодермы и коры; экспрессия IDA в эндодермальных клетках стимулируется ауксином, поступающим из примордия [54].
Помимо этого, изменение свойств клеточной стенки может влиять на устойчивость растений к заражению фитопатогенами, – следовательно, пептиды IDA могут играть роль также в растительно-микробных взаимодействиях. Так, экспрессия гена IDA-like 6 (IDL6) значительно повышается в листьях A. thaliana при заражении P. syringae pv. tomato [55]. Показано, что IDL6 активирует экспрессию гена ADPG2, кодирующего полигалактуроназу, что ведет к снижению содержания пектина и прочности листа, делая его менее устойчивым к заражению бактерией [55].
PAMP-INDUCED SECRETED PEPTIDES (PIP)
Семейство PIP включает 11 пептидов, имеющих высокое сходство с IDA и CEP. Однако если IDA и CEP вовлечены в процессы развития растений, то PIP участвуют исключительно в ответе на широкий круг патогенов [50]. У растений иммунный ответ инициируется на поверхности плазмалеммы и начинается с рецепторов (главным образом – рецепторных протеинкиназ LRR-RLK), связывающих элиситоры – молекулы, продуцируемые патогеном – Pathogen-Associated Molecular Patterns (PAMP) – например, флагеллин бактерий и хитин грибов, или возникающие при повреждении растительной клетки – Damage Associated Molecular Patterns (DAMP) – например, олигогалактурониды и некоторые пептиды, в том числе сигнальные. Среди генов, экспрессия которых быстро активируется при восприятии PAMP, и были выявлены гены, кодирующие секретируемые пептиды PIP.
Ортологи генов PIP выявлены у многих двудольных и однодольных растений, таких как соя, виноград, кукуруза и рис. У A. thaliana экспрессия гена PIP1 повышается при заражении бактериями P. syringae или грибами F. oxysporum f. sp. conglutinans, а также при обработке фитогормоном, вовлеченным в иммунные реакции у растения – салициловой кислотой и ее метиловым эфиром [56]. Пептиды-предшественники, названные prePIP, состоят из 50–80 АК и включают в себя несколько консервативных 13–14 АК С-концевых доменов SGPS (названы по наиболее консервативному 4 АК мотиву), сходных с доменом EPIP пептидов IDA [56]. Рецептором PIP является киназа RLK7 (Receptor-Like Kinase 7).
Пептиды PIP действуют как компоненты системного иммунного ответа растений: экспрессия генов группы PIP активируется при связывании PAMP флагеллина с рецепторной киназой FLS2 (Flagellin-Sensitive 2) и пептида PEP (см. ниже), функционирующего в качестве DAMP, с рецепторными киназами PEPR (PEP RECEPTOR). Связывание PIP с рецепторной киназой RLK7 запускает активацию MAP-киназного каскада, продукцию активных форм кислорода, отложение каллозы и экспрессию ряда генов-регуляторов иммунного ответа. Экспрессия гена PIP1 наблюдается в проводящих тканях, что позволяет предположить, что PIP1 является мобильным сигналом, вовлеченным в системный иммунный ответ [56].
CASPARIAN STRIP INTEGRITY FACTOR (CIF)
Эндодерма, формируя пояски Каспари, образует диффузионный барьер между корнями и почвой. Пояски Каспари представляют собой одревесневшие участки радиальных стенок клеток эндодермы, окружающие клетки в виде пояса и включающие в себя много гидрофобных полимеров лигнина – таким образом, клетки эндодермы, смыкаясь в области поясков Каспари, окружают стелу водонепроницаемым кольцом. Совсем недавно было показано, что образование поясков Каспари у A. thaliana опосредуют сигнальные пептиды CIF1 и CIF2, образующиеся в стеле корня, и специфично связывающиеся с рецепторными киназами GASSHO1/SHENGEN3 (GSO1/SGN3) и GSO2/SGN2, локализованными в эндодерме [57, 58]. В рецепции пептидов CIF также участвует цитоплазматическая киназа SGN1 – предполагаемый корецептор GSO1 и GSO2 [57]. Экспрессия генов CIF наблюдается во флоэме и прилегающих к ней клетках перицикла, продуктами этих генов являются пептиды-предшественники длиной около 80 АК, содержащие высоко консервативный С‑концевой домен, которые затем подвергаются протеолитическому процессингу и пост-трансляционной модификации, – в итоге зрелые CIF представляют собой 21 АК пептиды, соответствующие С-концевому домену предшественников и содержащие сульфатированные остатки тирозина.
Экспрессия генов CIF меняется в зависимости от условий произрастания растения: в частности от рН среды и концентрации солей железа; в свою очередь, мутанты cif1-1cif2-1 демонстрируют резко сниженную устойчивость к солям железа [58]. Это означает, что образование поясков Каспари – не пассивный процесс, связанный с развитием корня, а является активной стратегией борьбы с неблагоприятными условиям среды.
HYDROXYPROLINE-RICH GLYCOPEPTIDE SYSTEMINS (HypSys)
Гидроксипролинсистемины относятся к защитным сигнальным пептидам растений; они не гомологичны системинам (см. ниже), но обладают сходной с ними биологической активностью и одинаковым размером молекулы, за что и получили свое название. На сегодняшний день разные HypSys-пептиды выделены из табака, петуньи, томата, паслена и батата. Наиболее изученными являются пептиды NtHypSysI и NtHypSysII табака, которые состоят из 18 АК. Исходным пептидом для них служит общий предшественник из 165 АК, на N-терминальном конце которого имеется сигнальная последовательность. Последовательности NtHypSysI и NtHypSysII располагаются на разных концах пептида-предшественника: около N-терминального конца – NtHypSysI, около C-терминального конца – NtHypSysII [59]. Помимо протеолитического процессинга, пептиды HypSys подвергаются посттрансляционному гидроксилированию пролина и дальнейшему арабинозилированию. Процессы посттрансляционной модификации необходимы для активации пептида: синтетические NtHypSysI и NtHypSysII, не подвергшиеся арабинозилированию, проявляют сниженную биологическую активность. О рецепторах пептидов HypSys в настоящее время ничего не известно.
Экспрессия генов, кодирующих HypSys, увеличивается у Nicotiana tabacum при поедании растения насекомыми: личинками Manduca sexta и имаго Bemisia tabaci [59]. Кроме того, экcпериментально показано, что транскрипты HypSys также накапливаются у табака, петуньи, томата, паслена и батата при механических повреждениях или обработке метилжасмонатом [59]. Подобное накопление транскриптов в ответ на поедание или поранение свидетельствует о роли HypSys как участника защитных реакций растений. Действительно, сверхэкспрессия NtHypSys в трансгенных растениях увеличивает количество ингибиторов протеазы и полифенолоксидазы у N. tabacum, следствием чего является проявление повышенной защиты от поедающих растение личинок.
Недавно было показано, что системин и HypSys томата действуют скоординировано в ответе на поедание травоядными животными, стимулируя синтез жасмоновой кислоты [59].
ЦИСТЕИН-БОГАТЫЕ ПЕПТИДЫ
Цистеин-богатые пептиды (ЦБП) – обширная группа растительных пептидов, отличительными особенностями которой являются размер (до 160 аминокислотных остатков) и C-терминальный домен, содержащий 2–16 остатков цистеина, необходимых для формирования пространственной структуры молекулы. Как и ПТМП, пептиды ЦБП в ходе своего созревания подвергаются посттрансляционному протеолитическому процессингу, в результате от них остается только C-концевой домен, консервативные остатки цистеина в составе которого могут образовывать между собой дисульфидные мостики. ЦБП выполняют разнообразные функции, такие как рост клеток растяжением, дифференцировка специфических типов клеток, взаимодействие с симбиотическими и патогенными микроорганизмами; кроме того, значительная часть ЦБП участвует в регуляции процессов оплодотворения и эмбрионального развития [60, 61]. Неудивительно, что у некоторых видов растений на долю генов, кодирующих ЦБП, приходится до 2% от числа всех белок-кодирующих генов. К группе ЦБП относятся пептиды RAPID ALKALINIZATION FACTOR (RALF), EPIDERMAL PATTERNING FACTOR (EPF и EPF-LIKE), S-LOCUS CYS-RICH/S-LOCUS PROTEIN 11 (SCR/SP11), PAPAVER RHOEAS PISTIL S-DETERMINANT (PrsS), LYCOPERSICON ANTHER-SPECIFIC PROTEIN 52 (LAT52) и STIGMA-SPECIFIC PROTEIN 1 (STIG1), EGG APPARATUS (EA), LURE, SMALL CYSTEIN ADHESION/LIPID TRANSFER PROTEIN (SCA/ LTP), TAPETUM DETERMINANT1 (TPD1), EGG CELL1 (EC1) и EMBRYO SURROUNDING FACTOR1 (ESF1).
Как и ПТМП, ЦБП секретируются в апопласт, где связываются на поверхности клеток с рецепторными киназами семейства LRR RLK. В качестве корецепторов для рецепторов ЦБП, как и в случае рецепторов ПТМ пептидов, зачастую выступают рецепторные киназы SERK, которые могут взаимодействовать с рецепторами пептидов EPF и TPD1 [16]. Мишенями действия ЦБП являются разнообразные гены, регулирующие ионный транспорт, дифференцировку клеток и ответ на стресс.
Помимо сигнальных пептидов, к группе ЦБП относятся дефензины – антимикробные пептиды, имеющиеся как у растений, так и у животных [62], поэтому сигнальные ЦБП часто называют дефензин-подобными пептидами.
RAPID ALKALINIZATION FACTOR (RALF)
Пептиды RAPID ALKALINIZATION FACTOR (RALF) были впервые выделены из клеток листа табака, а в дальнейшем было доказано их наличие и у других растений. Пептиды RALF подавляют растяжение клеток при развитии растения, но впервые были обнаружены как факторы, резко повышающие рН среды при их добавлении в культуру клеток табака. В геноме A. thaliana выявлено 34 гена, кодирующие пептиды RALF [63]. Пептиды RALF синтезируются из 115 АК предшественника, который содержит N-концевую сигнальную последовательность и консервативный С-концевой функциональный домен длиной 48–50 АК. После протеолитического процессинга и секреции зрелые пептиды RALF связываются на поверхности клеток с рецепторной киназой FERONIA (FER). Недавно было показано, что рецептор-подобная киназа RIPK (RPM1-INDUCED PROTEIN KINASE) взаимодействует с FER для связывания RALF; кроме того, в рецепции RALF в качестве корецептора может принимать участие рецептор-подобная киназа ВАК1, участвующая также в рецепции брассиностероидов, пептидов РЕР и некоторых РАМР [64]. К компонентам сигналинга, которые активируются при рецепции RALF, относятся Ca2+ сигналинг и МАР-киназный каскад, конечной мишенью сигналинга, по-видимому, является H+-АТФаза 2 (H+-ATPase 2, AHA2), активность которой негативно регулируют RALF пептиды [65].
Именно с подавлением активности AHA связана способность RALF повышать рН среды. Благодаря этой способности пептиды RALF являются негативными регуляторами роста клеток растяжением и антагонистами ауксина и пептидов PSY в этом процессе: ауксин и PSY повышают лабильность клеточной стенки за счет закисления межклеточного пространства, активируя мембранные H+-АТФазы (“кислый рост”), пептиды RALF действуют наоборот. Показано, что обработка растений A. thaliana пептидами RALF вызывает снижение скорости удлинения корней, мутанты с потерей функции их рецептора FER характеризуются более длинными корнями, чем у дикого типа. Один из пептидов RALF – RALF-Like34 у арабидопсиса – играет центральную роль в инициации бокового корня из перицикла [66]. Другая известная функция RALF связана с развитием пыльцы: например, ген AtRALF4 экспрессируется в пыльниках и ингибирует созревание пыльцы; у томатов обработка пыльцы пептидом SlPRALF ингибирует удлинение пыльцевой трубки, но только до достижения ею определенной длины (40–60 мкм) [66]. Помимо растений, RALF-подобные пептиды найдены у грибов Fusarium oxysporum: предполагается, что они могут использоваться грибом для манипулирования процессами развития растения-хозяина [67].
EPIDERMAL PATTERNING FACTOR (EPF и EPF-LIKE)
Семейство EPF включает в себя 11 ЦБП: EPF1, EPF2 и EPFL1-9; все представители этого семейства пептидов, а особенно EPF1, EPF2, EPF-LIKE6 (EPFL6)/CHALLAH(CHAL) и EPFL9/STOMAGEN, вовлечены в дифференцировку замыкающих клеток устьиц [68]. Дифференцировка замыкающих клеток устьиц – сложный многоэтапный процесс, разные стадии которого регулируются разными пептидными сигналами и несколькими группами ТФ. На развивающихся листьях A. thaliana показано, что слой протодермальных клеток листового примордия содержит популяцию клеток-предшественниц замыкающих клеток, способных к асимметричным делениям и называемых материнскими клетками меристемоидов (meristemoid mother cells (MMCs)). В результате первого асимметричного деления такие клетки дают начало двум морфологически различающимся дочерним клеткам – клетка меньшего размера называется меристемоидом и в дальнейшем дает начало замыкающим клеткам, клетка большего размера дает начало околоустьичным клеткам. Меристемоид обычно претерпевает еще одно или несколько асимметричных делений, в каждом из которых предшественником замыкающих клеток устьиц является меньшая из дочерних клеток. В конечном итоге, последний в линии потомков меристемоида претерпевает симметричное деление и дает две замыкающие клетки, которые, созревая, приобретают характерную форму за счет неравномерного утолщения клеточных стенок. Межклетный матрикс между ними набухает и растворяется, образуя устьичную щель.
Все этапы дифференцировки замыкающих клеток регулируются ТФ SPEECHLESS (SPCH), MUTE, и FAMA, которые относятся к семейству Basic Helix-loop-Helix (bHLH). От активности ТФ SPCH зависит самый первый этап развития устьиц и эпидермы в целом – дифференцировка протодермальных клеток. ТФ MUTE ограничивает число ассиметричных делений меристемоида и стимулирует его переход к последнему этапу, за которым следует симметричное деление. ТФ FAMA работает на последнем этапе формирования устьиц: роль его заключается в контроле симметричного деления позднего меристемоида и установления идентичности замыкающих клеток. Еще два ТФ bHLH – SCREAM/ICE1 (SCRM) и SCRM2 – также влияют на развитие устьиц, формируя гетеродимеры с SPCH, MUTE или FAMA [69].
Разные пептиды EPF также регулируют разные стадии дифференцировки замыкающих клеток устьиц. Так, ген EPF2 экспрессируется на раннем этапе формирования устьиц – в протодермальных клетках MMC, дающих начало меристемоидам; затем его экспрессия продолжается в ранних меристемоидах. Функцией пептида EPF2 является подавления дифференцировки околоустьичных клеток по пути замыкающих клеток. Ген EPF1 работает на более поздних этапах – он экспрессируется в поздних меристемоидах и регулирует ориентацию их делений, а также определяет расстояние между устьицами [69]. Обработка растений экзогенными пептидами EPF1 и EPF2 вызывает дефекты развития устьиц (полное их отсутствие при обработке EPF2 и неспособность поздних меристемоидов к асимметричным делениям при обработке EPF1), что свидетельствует об их роли как негативных регуляторов дифференцировки замыкающих клеток. Еще один негативный регулятор развития устьиц – EPFL6/ СHAL – секретируется клетками, окружающими проводящий пучок, перемещаясь оттуда в эпидермис; его функцией является подавление развития протодермальных клеток по устьичному пути [70]. Ген EPFL9/STOMAGEN, напротив, является позитивным регулятором развития устьиц. Он экспрессируется в клетках мезофилла листа, его белковый продукт диффундирует в эпидермис и позитивно регулирует развитие устьиц [68].
Продуктами генов EPF являются пептиды-предшественники длиной 102 АК, содержащие N-концевую сигнальную последовательность из 31 АК и С-концевой функциональный домен из 45 АК. Зрелые пептиды EPF состоят только из С‑концевого домена, содержащего 6–8 остатков цистеина в строго определенных позициях, между которыми формируются 3–4 дисульфидных мостика. Экспериментально доказано, что образующийся после дисульфидных связей “выступ” молекулы пептида (так называемая вариабельная петля) важна для связывания пептидов EPF с их рецепторами [71].
Рецепторами пептидов EPF1 и EPF2 являются LRR-киназы ERECTA (ER) и ERECTA-LIKE (ERL), образующие гетеродимер с киназой TOO MANY MOUTHS (TMM), лишенной киназного домена. Показано, что в клетках мезофилла пептид EPFL9/STOMAGEN конкурирует с EPF1 и EPF2 за связывание с рецептором ER/ТММ, – таким образом осуществляется антагонизм между позитивным и негативными регуляторами развития устьиц [69]. Интересно, что киназа ER может функционировать как рецептор для EPF1, EPF2 и EPFL9 только в комплексе с TMM; напротив, рецепция EPFL4 и EPFL6 осуществляется рецепторной киназой ER независимо от ТММ. Таким образом, ТММ влияет на выбор лиганда ER, и эта особенность рецепторов, вкупе с тканеспецифичностью экспрессии гена ER обеспечивает механизм тканеспецифичного функционирования пептидов EPF и их рецепторов [72].
Известно, что связывание EPF с их рецепторами активирует МАР-киназный каскад, компонентами которого являются МАРККК YODA, МАРКК МКК4/5/7/9 и МАРК МРК3/6; в то же время, известно, что стабильность ТФ SPCH регулируется фосфорилированием и зависит от MАР-киназного каскада [73]. Мишенями действия пептидов EPF, по-видимому, являются ТФ семейства bHLH, регулирующие развитие устьиц – SPCH, MUTE и FAMA.
TAPETUM DETERMINANT1 (TPD1)
Следующие несколько групп ЦБП, выявленных у разных видов растений, участвуют в регуляции оплодотворения и предшествующих ему процессов – развития пыльцы (пептид TPD1), реакции самонесовместимости (пептиды SCR/SP11 и PrsS), роста пыльцевой трубки (LAT52, STIG, EA, LURE и SCA/LTР), контакта спермия с яйцеклеткой (ЕС1).
Так, пептид TPD1, впервые идентифицированный у A. thaliana, необходим для специализации клеток тапетума – ткани, выстилающей пыльник и необходимой для нормального созревания пыльцы. В пыльниках мутанта tpd1 отсутствует слой клеток тапетума, а предшественники клеток тапетума развиваются в микроспороциты, что приводит к мужской стерильности растений; напротив, сверхэкспрессия TPD1 усиливает пролиферацию клеток тапетума пыльника и задерживает разрушение тапетума в процессе созревания пыльцы: микроспоры у таких растений не отделяются от тапетума, что также вызывает мужскую стерильность [74]. Ген TPD1 экспрессируется клетками-предшественницами микроспороцитов и кодирует белок из 176 АК, имеющий N-концевую сигнальную последовательность и С-концевой функциональный домен. В результате протеолитического процессинга от пептида-предшественника остается только 100 АК С-концевой домен, содержащий 6 консервативных остатков цистеина, которые образуют дисульфидные мостики [75].
Рецептором пептида TPD1 является LRR-RK EXCESS MICROSPOROCYTES1 (EMS1)/EXTRA SPOROGENOUS CELLS (EXS), которая для взаимодействия с лигандом образует комплекс с корецепторами – киназами SERK1 и SERK2 [76]. Связывание TPD1 с рецептором запускает периклинальные деления клеток тапетума и экспрессию А9 – маркерного гена клеток тапетума [75].
S-LOCUS CYS-RICH/S-LOCUS PROTEIN 11 (SCR/SP11)
Пептиды SCR/SP11 и PrsS (см. ниже) участвуют в контроле реакции самонесовместимости – комплекса мер, которые принимает растение для недопущения самоопыления. Реакция самонесовместимости имеет место в пестике между тканями рыльца и пыльцевыми зернами и проявляется при наличии одинаковых аллелей локуса S; гаметофитная самонесовместимость зависит от генотипа пыльцевого зерна, спорофитная – от генотипа ткани мужского спорофита, в котором образовалась пыльца.
У представителей семейства Brassicaceae локус S, ответственный за реакции самонесовместимости, включает в себя два гена, один из которых кодирует ЦБП SCR/SP11, другой – рецепторную киназу SRK (S-locus receptor kinase). Зрелая форма пептида SCR/SP11 имеет массу 6 кДа и длину около 50 АК, включая 8 остатков цистеина, образующих 4 дисульфидных мостика [61]. Пространственная структура пептида включает в себя 3 β‑слоя и 1 α-спираль; соединяющая эти две структуры петля содержит вариабельный домен, определяющий самонесовместимость для данного гаплотипа. Ген SCR/SP11 экспрессируется в тапетуме и созревающем пыльцевом зерне. Продукт гена накапливается в оболочке пыльцевого зерна и выступает в качестве лиганда для гомодимеров киназы SRK, экспонируемых на мембранах клеток рыльца пестика [61]. Кроме того, локус S может кодировать также секретируемые гликопротеины SLG (S-LOCUS GLYCOPROTEINS), схожие по структуре с внеклеточным доменом SRK и способные регулировать его активность [60]. Связавшийся с лигандом димер SRK активируется за счет автофосфорилирования и вместе с другой RLK, MLPK (M-LOCUS PROTEIN KINASE), участвует в фосфорилировании убиквитин-лигазы ARC1 (ARM REPEAT CONTAINING). ARC1 участвует в убиквитинировании Exo70A1 (EXOCYST SUBUNIT EXO70 FAMILY PROTEIN A1), мембранного белка клеток рыльца, с последующей его деградацией в протеасоме, что приводит к нарушению гидратации и роста пыльцевой трубки [61].
PAPAVER RHOEAS PISTIL S-DETERMINANT (PrsS)
У представителей семейства Papaveraceae, напротив, растворимый фактор самонесовместимости секретируется клетками рыльца материнского растения [77]. Это гликопротеины массой приблизительно 17 кДа, получившие название PrsS, содержащие 4 остатка цистеина; эксперименты по экспрессии гена PrsS в клетках E. coli показали, что гликозилирование не требуется для выполнения белком своей функции [60]. Рецептором PrsS со стороны пыльцевого зерна является рецепторная киназа PrpS (Papaver rhoeas pollen S-determinant) [77]. Кроме того, показано, что с PrpS также связывается протеогликан SBP (S protein binding protein), однако опыты над трансгенными растениями Arabidopsis показывают, что взаимодействия PrsS-PrpS достаточно для индукции реакции самонесовместимости [78].
LYCOPERSICON ANTHER-SPECIFIC PROTEIN 52 (LAT52) и STIGMA-SPECIFIC PROTEIN 1 (STIG1)
Скорость роста пыльцевой трубки является одним из определяющих факторов продуктивности цветковых растений. Рост пыльцевой трубки стимулируется как аутокринными сигналами самого пыльцевого зерна, так и сигналами, секретируемыми тканями пестика. Роль ЦБП, секретируемых пыльцевыми зернами и тканями пестика, в росте пыльцевой трубки была впервые выявлена у томата (Solanum lycopersicum): у этого растения стимулирующим сигналом со стороны пыльцевого зерна является ЦБП LAT52, а со стороны тканей пестика – ЦБП STIG1 [79].
В качестве рецептора LAT52 выступает одна из LRR-RLK, присутствующих на поверхности пыльцевых зерен, а именно PRK2 (Pollen Receptor Kinase 2) [79]; связывание LAT52 с PRK2 приводит к активации роста пыльцевой трубки. Показано также, что пептид LAT52 может существовать в двух формах, причем более короткая, секретируемая после прорастания пыльцевого зерна, не может выступать в качестве лиганда для PRK2.
Другим лигандом PRK2 является секретируемый клетками рыльца пептид STIG1 [79]. Зрелая форма STIG1 имеет массу 7 кДа и содержит 14 остатков цистеина, образующих дисульфидные мостики. В отличие от пептида LAT52, участвующего в прорастании пыльцевой трубки, STIG1 связывается с PRK2 на этапе ее элонгации. Пептид STIG1 присутствует в экссудате рыльца пестика и аккумулируется на поверхности прорастающей пыльцевой трубки, где и связывается с рецептором. Недавно было показано, что для связывания с PRK2 важен сайт с 80 по 83 АК в составе пептида STIG1, тогда как АК 88–115 связывают фосфатидилинозитол-3-фосфат (PI(3)P), причем для STIG1-зависимого стимулирования роста пыльцевой трубки важно как его взаимодействие с рецептором, так и связывание PI(3)P [80].
EGG APPARATUS1 (EA) и EA-подобные пептиды
Пептид EA1, выделенный впервые у кукурузы, является аттрактантом пыльцевой трубки и определяет направление ее роста после достижения семязачатка [81]. Ген EA1 экспрессируется в яйцеклетке и синергидах, и первичным продуктом его экспрессии является пептид-предшественник длиной 94 АК, который подвергается процессингу с образованием зрелого 49 АК пептида. В составе пептида-предшественника выделяют N-терминальный сигнальный домен, консервативный EA-бокс длиной 27–29 аминокислотных остатков и C-терминальный аланин-богатый домен. На основании наличия EA-бокса выделяют три семейства EA-подобных пептидов, а именно EAL (включает EA1 и EAL1-2 (EA1-like кукурузы), EAG (EA1-box glycine-rich) и EAC (EA1-box containing). Пептиды первого семейства встречаются только у злаков и обладают функцией, сходной с EA1, тогда как пептиды из двух последних семейств широко представлены среди однодольных и двудольных растений, и функции их неизвестны [82]. Пептид EA1 секретируется в апопласт и накапливается в стенках клеток нуцеллуса; после взаимодействия с еще неизвестным рецептором, EA1 поглощается пыльцевой трубкой и деградирует [82].
LURE
У двудольных сходной с EA функцией обладают пептиды LURE (LURE1 и LURE2), которые были первоначально обнаружены у декоративного растения Torenia fournieri [83]. Впоследствии пять гомологов LURE1, AtLURE1.1-1.5, были обнаружены у A. thaliana [84]. Зрелые пептиды LURE имеют длину 62–70 АК, включая 6 остатков цистеина; они синтезируются синергидами и участвуют в направлении роста пыльцевой трубки после достижения ею микропиле семязачатка. Недавно было показано, что рецептором AtLURE является LRR-киназа AtPRK6 (Pollen Receptor Kinase 6) [84]. AtPRK6, в свою очередь, может взаимодействовать с фактором обмена нуклеотидов ROP GEF12 (ROP GTP exchange factor) и рецептор-подобными цитоплазматическими киназами LIP1/2 (LOST IN POLLEN TUBE GUIDANCE), заякоренными на внутренней стороне мембраны пыльцевой трубки [84]. Предполагается, что LIP1/2 выступают в качестве корецепторов для AtPRK6; тем не менее, конкретный сигнальный путь, запускаемый в пыльцевой трубке пептидами LURE, остается неизвестным.
STIGMA/STYLE CYSTEIN-RICH ADHESIN/ LIPID TRANSFER PROTEINS (SCA/LTP)
Пептиды SCA/LTP позитивно регулируют рост пыльцевой трубки за счет стимуляции адгезии трубки к тканям материнского спорофита. Первым выявленным пептидом этой группы является STIGMA/STYLE CYSTEIN-RICH ADHESIN (SCA), который синтезируется клетками пестика лилейных растений [85]. Пептид SCA имеет массу 9–10 кДа и включает 8 остатков цистеина; предполагается, что наличие в составе молекулы этого пептида большого количества положительно заряженных АК приводит к формированию суммарного положительного заряда и, как следствие, позволяет SCA взаимодействовать с пектинами клеточных стенок. Сходные функции выполняет LIPID TRANSFER PROTEIN 5 (LTP5), ортолог SCA у A. thaliana [85].
В дальнейшем SCA-подобные пептиды были выявлены у разных видов растений. Так, в геноме A. thaliana присутствуют 6 генов LTP, причем только некоторые из них экспрессируются в тканях пестика – т.е. функции пептидов этого семейства, вероятно, гораздо шире, чем контроль роста пыльцевой трубки [85]. Зрелый пептид LTP состоит из 4 α-спиралей, стабилизируемых в пространстве за счет 4 дисульфидных связей; третичная структура LTP включает гидрофобный карман, позволяющий этим пептидам взаимодействовать с молекулами фосфолипидов и жирных кислот. Функции большинства LTP до конца не выяснены, однако их список на данный момент включает в себя регуляцию растительно-микробных взаимодействий, синтез кутина, участие в соматическом эмбриогенезе, регуляцию роста пыльцевой трубки, устойчивость к абиотическим стрессам [86]. Рецепторы и сигнальный путь пептидов SCA/ LTP в настоящий момент неизвестны.
EGG CELL1 (EC1)
Пептиды, кодируемые генами EC1, принадлежат к крупной, но плохо изученной группе цистенин-богатых пептидов ECA1 (EARLY CULTURE ABUNSANT 1), которые секретируются яйцеклеткой для активации спермиев, тем самым ускоряя слияние гамет. Впервые гены EC1 (EGG CELL 1) были найдены у пшеницы, затем EC1-подобные гены обнаружили у A. thaliana [87]. EC1-подобные гены найдены только у цветковых растений и экспрессируются только в тканях женского гаметофита. Все пептиды EC1 имеют в составе молекул два консервативных коротких мотива, а также 6 остатков цистеина, которые образуют внутримолекулярные дисульфидные мостики.
До оплодотворения пептиды EC1 накапливаются в везикулах яйцеклетки; когда спермии достигают женского гаметофита, содержимое везикул экзоцитируется. В ответ на выделившиеся пептиды EC1 у спермиев происходит перераспределение мембран-связанного белка HAP2/GCS1 (HAPLESS 2/GENERATIVE CELL SPECIFIC 1) на поверхности клетки, благодаря чему происходит слияние гамет [87]. Гомологи HAP2 имеются у всех растений, включая зеленые водоросли, и выполняют они функции “катализаторов” слияния гамет: например, HAP2-дефицитные спермии A. thaliana неспособны к слиянию с яйцеклетками, и то же самое свойственно HAP2-дефицитным гаметам Chlamydomonas. Механизмы возможного взаимодействия EC1 и HAP2, а также индуцируемые ими механизмы слияния гамет неизвестны. Предполагается, что мишенью действия HAP2 может быть родственный ему белок GAMETE EXPRESSED 2 (GEX2) – спермий-специфичный белок с одним трансмембранным и двумя филамин-подобными доменами, сходный с белком IZUMO1, необходимым для стабилизации взаимодействия гамет млекопитающих [88].
EMBRYO SURROUNDING FACTOR1 (ESF1)
Еще один ЦБП, специфично накапливающийся в клетках женского гаметофита, – ESF1. Зрелый пептид ESF1 состоит из 68 АК и в наномолярных концентрациях способен вызывать удлинение клеток суспензора. Пептид ESF1 у A. thaliana кодируют три гена – ESF1.1, 1.2., 1.3, экспрессия которых сосредоточена только в центральной клетке, а после оплодотворения в ее потомках – клетках эндосперма, окружающих зародыш. Мутации по одному из генов ESF1 не дают видимого эффекта, но РНК-интерференция всех трех генов ESF1 у A. thaliana вызывает существенные дефекты в морфологии зародышей, при этом изменяется характер экспрессии гомеобокс-содержащего гена WOX8, вовлеченного в установление апикально-базальной оси зародыша, а также снижется уровень экспрессии гена PIN1, кодирующего транспортер ауксина. Эти результаты позволили предположить, что ESF1 являются регуляторами развития суспензора и распределения ауксина на ранних стадиях развития эмбриона [89].
Предполагаемым рецептором ESF1 является RLK SHORT SUSPENSOR (SSP) [89], мишенью которой в свою очередь является MAPKK-киназа YODA, необходимая для становления апикально-базальной полярности эмбриона и развития суспензора [90].
НЕСЕКРЕТИРУЕМЫЕ СИГНАЛЬНЫЕ ПЕПТИДЫ
Группа несекретируемых сигнальных пептидов (НСП) объединяет семейства пептидных гормонов, молекулы которых не содержат N-концевой секреторной последовательности, в связи с чем эти пептиды выполняют свои функции либо оставаясь внутри клетки, либо попадая в апопласт иным путем, например, при разрушении клетки. Как и прочие сигнальные пептиды растений, НСП транслируются в виде длинных предшественников, протеолитический процессинг которых является ключевым моментом в образовании функционально активных зрелых пептидов. Для ряда НСП с внеклеточным действием идентифицированы рецепторы – они также относятся к группе серин-треониновых протеинкиназ LRR-RLK. К группе НСП относится системин – первый из идентифицированных сигнальных пептидов растений, а также пептиды PLANT ELICITOR PEPTIDES (PEP), EARLY NODULIN 40 (ENOD40), DEVIL/ROTUNDIFOLIA (DVL/RTFL) и POLARIS (PLS). Представители группы НСП играют роль по большей части во взаимодействии растений с патогенами и симбионтами.
СИСТЕМИН
Системин – пептид с защитными функциями, выделенный из листьев томата в 1991 году [1], был первым обнаруженным сигнальным пептидом растений. Системин состоит из 18 аминокислотных остатков и участвует в активации и усилении защитной реакции растений в ответ на поедание фитофагами. Просистемин – предшественник системина – состоит из 200 АК и не имеет N-терминальной сигнальной последовательности. С помощью иммуноцитохимического анализа было показано, что просистемин образуется и компартментализуется в цитозоле паренхимных клеток флоэмы, однако детали синтеза системина и его транспорт в межклеточное пространство практически не изучены. Экспрессия гена просистемина индуцируется любыми механическими повреждениями тканей растения, в частности – повреждением насекомыми-фитофагами. Экзогенный системин в чрезвычайно низкой концентрации (40 фмолей) индуцирует у томатов экспрессию генов, кодирующих ингибиторы сериновых протеаз: считается, что эти ингибиторы являются индуцибельными защитными соединениями, препятствующими легкой усвояемости белков насекомыми. Эксперименты с 14C-меченным системином показали, что при поранении системин попадает в проводящую систему и переносится в другие части растения для индукции защитной реакции. Также известно, что системин стимулирует выброс летучих веществ, которые привлекают насекомых, паразитирующих на атакующих растение фитофагах [91]. Таким образом, системин участвует не только в прямом, но и в косвенном механизме регуляции защитного ответа растения на внешние раздражители.
Белок весом 160 кДа, специфично связывающийся с системином, был выделен из мембран клеток Solanum peruvianum и получил название SR-160 (SYSTEMIN CELL SURFACE RECEPTOR). В дальнейшем с помощью масс-спектрометрического анализа этот белок был идентифицирован как LRR RLK, гомолог рецептора брассиностероидов BRI1. После связывания системина с рецептором активируется фосфолипаза, высвобождающая из фосфолипидов клеточной мембраны линоленовую кислоту, которая является предшественником в биосинтезе одного из основных “защитных” гормонов растений – жасмоновой кислоты. Конъюгаты жасмоновой кислоты с изолейцином активируют защитные гены, включая ген просистемина: считается, что именно с этим связано накопление мРНК системина по всему растению при поранении одного листа [92].
PLANT ELICITOR PEPTIDES (PEP)
Белок PEP1 был обнаружен как внеклеточный 23 АК пептид с защитными функциями, образующийся в результате процессинга 92 АК пептида-предшественника. У A. thaliana обнаружено 8 генов, кодирующих предшественник PEP1, в дальнейшем эти гены были найдены у многих покрытосеменных растений. Так как у пептида-предшественника PEP1 отсутствует сигнальная последовательность на N-конце, предполагается, что зрелый PEP1 попадает во внеклеточное пространство при разрушении клетки в результате поранения или при атаке патогенов, т.е. пептид PEP1 функционирует как DAMP.
Две LRR-RK, PEPR1 и PEPR2, являются рецепторами для PEP1 и гомологичных ему пептидов у A. thaliana [93]. В качестве корецептора, взаимодействующего с PEPR1 и PEPR2, выступает киназа ВАК1/SERK3, лишенная лиганд-связывающего домена; следующим звеном в пути передачи сигнала является цитоплазматическая киназа BIK1 (BOTRYTIS-INDUCED KINASE 1) – регулятор иммунного ответа растений [56]. При взаимодействии PEP с рецепторами происходит активация системного иммунитета и усиливается устойчивость растения к разнообразным патогенам. Одним из компонентов иммунного ответа, индуцированного при связывании PEP с его рецепторами, является синтез сигнального пептида PIP, относящегося к группе ПТМ (см. выше). Кроме того, PEP1 у A. thaliana активирует экспрессию гена дефензина PDF1.2 и повышает уровень продукции перекиси водорода, что также необходимо для развития иммунного ответа [56].
EARLY NODULIN 40 (ENOD40)
Образование клубеньков у бобовых растений связано с дедифференцировкой клеток коры корня, вызванной действием ризобиальных клубеньковых факторов (Nod-факторов). Последние индуцируют в тканях растений экспрессию генов нодулинов, одним из которых является ENOD40. Ген ENOD40 экспрессируется перицикле корня, а после инфицирования ризобиями – в клетках примордия клубенька и периферических клетках сосудистых пучков. Ген ENOD40 является мишенью ТФ NODULE NUMBER CONTROL1 (NNC1), негативно регулирующего клубенькообразование [94]. Интересно, что последовательность ENOD40 имеет два сайта инициации трансляции, в результате чего с него могут транслироваться высоко консервативный 12–13 АК пептид А и 4–30 АК пептид В [95]. У обоих пептидов нет сигнальной последовательности, поэтому предполагается, что они функционируют внутри клеток и не подвергаются процессингу. Однако, благодаря небольшому размеру пептиды ENOD40, возможно, способны перемещаться из клетки в клетку по симпласту. Основной функцией ENOD40 является инициация деления клеток коры корня во время начального этапа образования клубеньков. Также для обоих пептидов было показано взаимодействие с сахарозосинтазой, поэтому предполагается, что они способствуют поступлению сахарозы в клетки коры корня и таким образом способствуют их делению.
DEVIL/ROTUNDIFOLIA4-LIKE (DVL/RTFL)
Пептиды DVL/RTFL, встречающиеся у всех наземных растений, изучены довольно слабо, их изучение началось с получения доминантного мутанта Arabidopsis devil1-1 dominant (dvl1-1D), для которого было характерно укорочение розеточных листьев, органов цветка и стручков. У A. thaliana обнаружено 22 гена DVL/RTFL, функции их перекрываются, поэтому мутанты по отдельным генам фенотипически сходны, что усложняет их изучение; в то же время, сверхэкспрессия генов DVL/RTFL приводит к сходному эффекту, напоминающему фенотип мутанта dvl1-1D [96]. Данные, полученные при более подробном анализе эффекта сверхэкспрессии гена ROT4 на развитие вегетативных и генеративных органов растений A. thaliana, позволили предположить, что функции этого гена связаны с регуляцией направления деления клеток вдоль вертикальной оси растения [97]. Также, было показано, что гомолог DVL/RTFL у M. truncatula (MtDVL1) вовлечен в клубенькообразование: MtDVL1 экспрессируется на ранних стадиях развития клубенька, а его сверхэкспрессия приводит к уменьшению количества клубеньков и к дефектам в их развитии [97].
Размер пептидов DVL/RTFL варьирует от 40 до 144 АК, но все они сходны по консервативному домену на С-конце длиной 30 АК. На примере пептида ROT4 показано, что представители этого семейства сигнальных пептидов не подвергаются протеолитическому процессингу и не являются мобильными белками, накапливаясь на плазмалемме клеток, в которых синтезировались [98].
POLARIS (PLS)
POLARIS (PLS) – выявленный у A. thaliana НСП длиной 36 АК, который синтезируется в виде предшественника длиной около 100 АК и затем подвергается протеолитическому процессингу. Для мутанта pls характерны короткие и широкие листья с малым количеством сосудов, укороченные корни, а также сниженный ответ на экзогенные ауксин и цитокинин; таким образом, считается, что пептид PLS необходим для координации роста растений вдоль вертикальной оси, а также для формирования сосудистой системы листа. У мутанта pls снижены уровни экспрессии генов PIN1 и PIN2, кодирующих белки полярного транспорта ауксина [99]. Поскольку регуляция экспрессии генов PIN является одним из наиболее важных механизмов антагонистических взаимодействий цитокинина и ауксина в контроле онтогенетических процессов, считается, что пептид PLS необходим для поддержания баланса ауксина и цитокинина, тем более что у мутанта pls снижен уровень биосинтеза ауксина и повышен уровень цитокинина. Также мутант pls демонстрирует сверхчувствительность к этилену и конститутивный тройной ответ проростков даже в отсутствии этилена, тогда как сверхэкспрессия гена PLS восстанавливает нормальный фенотип у мутанта с конститутивным ответом на этилен ctr1 (CONSTITUTIVE TRIPLE RESPONSE 1), – таким образом, пептид PLS считается негативным регулятором ответа на этилен и, более того, экспрессия гена PLS негативно регулируется этиленом [100]. Итак, пептид PLS необходим для координации роста растений и участвует в этом процессе наряду с цитокинином, ауксином и этиленом, поддерживая их гомеостаз в тканях растения. Рецепторы и система передачи сигнала PLS, а также механизмы его действия в контроле гомеостаза фитогормонов неизвестны.
ЗАКЛЮЧЕНИЕ
Пептидные фитогормоны регулируют развитие растений начиная с ранних этапов эмбриогенеза и заканчивая различными аспектами постэмбрионального развития, а также участвуют в ростовых реакциях на факторы внешней и внутренней среды, действуя при этом как локально, так и системно. В этом обзоре мы постарались учесть все функционально охарактеризованные классы пептидных фитогормонов, однако, не ограничиваясь наиболее изученными. Несмотря на большое разнообразие, пептидные фитогормоны обладают рядом общих свойств: так, для получения функционально активных пептидов характерно “созревание” белка-предшественника; все пептидные фитогормоны функционируют вне клетки, связываясь с рецепторами на плазмалемме, при этом все идентифицированные рецепторы и корецепторы этих пептидов относятся к рецепторным киназам с лейцин-богатыми повторами, LRR-RLK [15, 16].
Количество обнаруженных классов пептидных фитогормонов постоянно растет: вероятно, большинство сигнальных пептидов растений еще только предстоит охарактеризовать. Интересно, что в ходе изучения пептидных фитогормонов способность к их синтезу и секреции была выявлена не только у разных групп растений начиная с водорослей, но и у некоторых групп фитопатогенов: так, паразитические галловые нематоды синтезируют свои собственные пептиды CLE и CEP, взаимодействующие с растительными рецепторами соответствующих пептидов и оказывающие влияние на развитие корня растения-хозяина [30, 49], способностью к синтезу пептидов RALF обладают некоторые паразитические грибы [67]. Наличие генов, кодирующих пептидные фитогормоны, в геномах паразитов, может свидетельствовать о крайне “далеко зашедшей” коэволюции паразита и хозяина либо о горизонтальном переносе генов.
Большинство пептидных фитогормонов было изначально идентифицировано исходя из их функциональных характеристик (например, при изучении мутантов с нарушением определенной программы развития), а затем охарактеризовано химически. К настоящему времени для большого количества пептидных фитогормонов идентифицированы рецепторы – LRR-RLK и мишени, которыми могут быть очень разнообразные белки: ТФ разных групп [17, 20, 22, 72], мембранные транспортеры ионов [46, 66], убиквитин-лигазы [61] и т.д. В последние годы для некоторых пептидных фитогормонов были проанализированы кристаллические структуры комплексов, образуемых пептидами с лиганд-связывающими доменами рецепторов [15]; для ряда пептидных фитогормонов (в частности, для представителей семейства CLE) была изучена роль отдельных аминокислот в функционировании пептида и связывании его с рецептором: для этого, как правило, использовали синтетические пептиды с замещением аминокислотных остатков на аланин и другие аминокислоты. В целом, это направление исследований наглядно продемонстрировало получение оптимальных пар “лиганд-рецептор” в ходе молекулярной эволюции: вероятно, благодаря давлению отбора семейства пептидных гормонов, каждое из которых, как правило, включает в себя несколько представителей, демонстрируют довольно малое количество вариаций в последовательности зрелого пептидного лиганда [5].
Помимо изучения механизмов взаимодействия пептидных фитогормонов с их рецепторами, исследования в области пептидных регуляторов роста растений направлены на поиск нижележащих компонентов сигнальных каскадов, активируемых в растительной клетке при взаимодействии сигнальных пептидов с LRR-RLK. Несмотря на длительный поиск, были получены лишь единичные данные о белках, действующих в передаче сигнала пептидных фитогормонов ниже их рецепторов: так, в передаче сигнала пептидов CLE, очевидно, действуют протеинфосфатазы POL/PLL [15]; связывание пептидов CEP с их рецепторами вызывает синтез коротких мобильных пептидов CEPD [46]; активация MAP-киназного каскада отмечена при рецепции пептидов CLE, IDA, RALF, EPF и ESF [15, 52, 66, 73, 90]. Тем не менее, точных данных обо всех компонентах сигнальных каскадов, запускаемых пептидными фитогормонами, и последовательности действия этих компонентов, получено не было.
Перспективным направление исследований также является изучение взаимодействия пептидных фитогормонов с другими гормонами растений, в частности с цитокининами и ауксинами. Был получен ряд данных, свидетельствующих о наличии таких взаимодействий: например, пептиды RGF регулируют полярный транспорт ауксина в корне [33]; пептиды PSK стимулируют деление клеток только в присутствии ауксина и цитокинина [36]; уровни экспрессии некоторых генов CLE могут регулироваться цитокинином и ауксином [25], тогда как сами пептиды CLE (СLE10) могут ингибировать экспрессию генов ARR5 и ARR6, активируя передачу сигнала цитокининов [23].
Еще одно направление изучения пептидных фитогормонов связано с их значимостью для развития хозяйственно ценных признаков у растений, что в перспективе предполагает использование пептидных регуляторов роста в биотехнологии. В частности, пептиды из семейств CLE и CEP являются системными регуляторами развития корневой системы в зависимости от доступности основных источников азота – нитратов, предотвращая разрастание корневой системы в неблагоприятных условиях и регулируя количество клубеньков у бобовых растений [17, 28, 45]. Интересно, что при этом пептиды CLE и CEP используются растением в качестве сигналов “дальнего действия”, которые транспортируются по ксилеме от места своего синтеза в корне к рецепторам, работающим в листьях [27, 46]. Вероятно, затем имеет место флоэмный транспорт нижележащих компонентов CLE- и CEP-опосредованных сигнальных каскадов обратно в корень и регуляция экспрессии “корневых” генов-мишеней, что важно для координации развития надземной и подземной частей растения в зависимости от источников питания. Еще один пример хозяйственно ценных признаков, регулируемых пептидными фитогормонами – признаки, связанные с вторичным утолщением корня и стебля, – такие как запасающие корни и стебли корнеплодных культур, а также стволы древесных растений; имеются данные о роли пептидов CLE в развитии таких признаков [25].
Итак, изучение пептидных фитогормонов является активно развивающимся направлением современной физиологии и генетики развития растений, весьма перспективным в плане получения фундаментальных знаний и практического применения в биотехнологии.
Исследования поддержаны грантами Российского научного фонда 16-16-1001, Российского фонда фундаментальных исследований 18-04-01017, Российского фонда фундаментальных исследований 15-29-02737, Российского фонда фундаментальных исследований 18-34-00020.
Список литературы
Pearce G., Strydom D., Johnson S., Ryan C.A. A polypeptide from tomato leaves induces wound-inducible proteinase inhibitor proteins // Science. 1991. V. 253. P. 895–897.
Matsubayashi Y., Sakagami Y. Phytosulfokine, sulfated peptides that induce the proliferation of single mesophyll cells of Asparagus officinalis L // Proc. Natl. Acad. Sci. USA. 1996. V. 93. P. 7623–7627.
Fletcher J.C., Brand U., Running M.P., Simon R., Meyerowitz E.M. Signaling of cell fate decisions by CLAVATA3 in Arabidopsis shoot meristems // Science. 1999. V. 283. P. 1911–1914.
Ito Y., Nakanomyo I., Motose H., Iwamoto K., Sawa S., Dohmae N., Fukuda H. Dodeca-CLE peptides as suppressors of plant stem cell differentiation // Science. 2006. V. 313. P. 842–845.
Matsubayashi Y. Posttranslationally modified small-peptide signals in plants // Annu. Rev. Plant Biol. 2014. V. 65. P. 385–413.
Lease K.A., Walker J.C. The Arabidopsis unannotated secreted peptide database, a resource for plant peptidomics // Plant Physiol. 2006. V. 142. P. 831–838.
Schardon K., Hohl M., Graff L., Pfannstiel J., Schulze W., Stintzi A., Schaller A. Precursor processing for plant peptide hormone maturation by subtilisin-like serine proteinases // Science. 2016. V. 354. P. 1594–1597.
Tamaki T., Betsuyaku S., Fujiwara M., Fukao Y., Fukuda H., Sawa S. SUPPRESSOR OF LLP1 1-mediated C-terminal processing is critical for CLE19 peptide activity // Plant J. 2013. V. 76. P. 970–981.
Okamoto S., Shinohara H., Mori T., Matsubayashi Y., Kawaguchi M. Root-derived CLE glycopeptides control nodulation by direct binding to HAR1 receptor kinase // Nat. Commun. 2013. V. 4. P. 2191.
Gorres K.L., Raines R.T. Prolyl 4-hydroxylase // Crit. Rev. Biochem. Mol. Biol. 2010. V. 45. P. 106–124.
Santiago J., Brandt B., Wildhagen M., Hohmann U., Hothorn L.A., Butenko M.A., Hothorn M. Mechanistic insight into a peptide hormone signaling complex mediating floral organ abscission // Elife. 2016. V. 5. e15075.
Amano Y., Tsubouchi H., Shinohara H., Ogawa M., Matsubayashi Y. Tyrosine-sulfated glycopeptide involved in cellular proliferation and expansion in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 18333–18338.
Song W., Liu L., Wang J., Wu Z., Zhang H., Tang J., Lin G., Wang Y., Wen X., Li W., Han Z., Guo H., Chai J. Signature motif-guided identification of receptors for peptide hormones essential for root meristem growth // Cell Res. 2016. V. 26. P. 674–685.
Matsuzaki Y., Ogawa-Ohnishi M., Mori A., Matsubayashi Y. Secreted peptide signals required for maintenance of root stem cell niche in Arabidopsis // Science. 2010. V. 329. P. 1065–1067.
Hirakawa Y., Torii K.U., Uchida N. Mechanisms and strategies shaping plant peptide hormones // Plant Cell Physiol. 2017. V. 58. P. 1313–1318.
Ma X., Xu G., He P., Shan L. SERKing coreceptors for receptors // Trends Plant Sci. 2016. V. 21. P. 1017–1033.
Yamaguchi Y.L., Ishida T., Sawa S. CLE peptides and their signaling pathways in plant development // J. Exp. Bot. 2016. V. 67. P. 4813–4826.
Kucukoglu M., Nilsson O. CLE peptide signaling in plants – the power of moving around // Physiol. Plantarum. 2015. V. 155. P. 74–87.
Schoof H., Lenhard M., Haecker A., Mayer K.F., J-ürgens G., Laux T. The stem cell population of Ar-abidopsis shoot meristems in maintained by a regulatory loop between the CLAVATA and WUSCHEL genes // Cell. 2000. V. 100. P. 635–644.
Stahl Y., Wink R.H., Ingram G.C., Simon R. A signaling module controlling the stem cell niche in Arabidopsis root meristems // Curr. Biol. 2009. V. 19. P. 909–914.
Pi L., Aichinger E., van der Graaff E., Llavata-Peris C.I., Weijers D., Hennig L., Groot E., Laux T. Organizer-derived WOX5 signal maintains root columella stem cells through chromatin-mediated repression of CDF4 expression // Dev. Cell. 2015. V. 33. P. 576–588.
Kondo Y., Fukuda H. The TDIF signaling network // Curr. Opin. Plant Biol. 2015. V. 28. P. 106–110.
Kondo Y., Hirakawa Y., Kieber J.J., Fukuda H. CLE peptides can negatively regulate protoxylem vessel formation via cytokinin signaling // Plant Cell Physiol. 2011. V. 52. P. 37–48.
Fiers M., Hause G., Boutilier K., Casamitjana-Martinez E., Weijers D., Offringa R., van der Geest L., van Lookeren Campagne M., Liu C.-M. Mis-expression of the CLV3/ESR-like gene CLE19 in Arabidopsis leads to a consumption of root meristem // Gene. 2004. V. 327. P. 37–49.
Gancheva M.S., Dodueva I.E., Lebedeva M.A., Tvorogova V.E., Tkachenko A.A., Lutova L.A. Identification, expression, and functional analysis of CLE genes in radish (Raphanus sativus L.) storage root // BMC Plant Biol. 2016. V. 16. Suppl. 1. P. 7.
Shinohara H., Moriyama Y., Ohyama K., Matsubayashi Y. Biochemical mapping of a ligand-binding domain within Arabidopsis BAM1 reveals diversified ligand recognition mechanisms of plant LRR-RKs // Plant J. 2012. V. 70. P. 845–854.
Osipova M.A., Mortier V., Demchenko K.N., Tsyganov V.E., Tikhonovich I.A., Lutova L.A., Dolgikh E.A., Goormachtig S. Wuschel-related homeobox5 gene expression and interaction of CLE peptides with components of the systemic control add two pieces to the puzzle of autoregulation of nodulation // Plant Physiol. 2012. V. 158. P. 1329–1341.
Araya T., Miyamoto M., Wibowo J., Suzuki A., Kojima S., Tsuchiya Y.N., Sawa S., Fukuda H., von Wirén N., Takahashi H. CLE-CLAVATA1 peptide-receptor signaling module regulates the expansion of plant root systems in a nitrogen-dependent manner // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 2029–2034.
Samorodova A.P., Tvorogova V.E., Tkachenko A.A., P-otsenkovskaya E.A., Lebedeva M.A., Tikhonovich I.A., Lutova L.A. Agrobacterial tumors interfere with nodulation and demonstrate the expression of nodulation-induced CLE genes in pea // J. Plant Physiol. 2017. V. 221. P. 94–100.
Wang X., Mitchum M.G., Gao B., Li C., Diab H., Baum T.J., Hussey R.S., Davis E.L. A parasitism gene from a plant-parasitic nematode with function similar to CLAVATA3/ESR (CLE) of Arabidopsis thaliana // Mol. Plant Pathol. 2005. V. 6. P. 187–191.
Replogle A., Wang J., Paolillo V., Smeda J., Kinoshita A., Durbak A., Tax F.E., Wang X., Sawa S., Mitchum M.G. Synergistic interaction of CLAVATA1, CLAVATA2, and RECEPTOR-LIKE PROTEIN KINASE 2 in cyst nematode parasitism of Arabidopsis // Mol. Plant M-icrobe Interact. 2013. V. 26. P. 87–96.
Meng L., Buchanan B.B., Feldman L.J., Luan S. CLE-like (CLEL) peptides control the pattern of root growth and lateral root development in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 1760–1765.
Whitford R., Fernandez A., Tejos R., Pérez A.C., Kleine-Vehn J., Vanneste S., Drozdzecki A., Leitner J., Abas L., Aerts M., Hoogewijs K, Baster P, De Groodt R, Lin YC, Storme V., Van de Peer Y., Beeckman T., Madder A., Devreese B., Luschnig C., Friml J., Hilson P. GOLVEN secretory peptides regulate auxin carrier turnover during plant gravitropic responses // Developmental Cell. 2012. V. 22. P. 678–685.
Shinohara H., Mori A., Yasue N., Sumida K., Matsubayashi Y. Identification of three LRR-RKs involved in perception of root meristem growth factor in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 3897–3902.
Yang H., Matsubayashi Y., Nakamura K., Sakagami Y. Oryza sativa PSK gene encodes a precursor of phytosulfokine-alpha, a sulfated peptide growth factor found in plants // Proc. Natl. Acad. Sci. USA. 1999. V. 96. P. 13560–13565.
Matsubayashi Y., Morita A., Matsunaga E., Furuya A., Hanai N., Sakagami Y. Physiological relationships between auxin, cytokinin, and a peptide growth factor, phytosulfokine-α, in stimulation of asparagus cell proliferation // Planta. 1999. V. 207. P. 559–565.
Yu L., Liu Y., Liu Y., Li Q., Tang G., Luo L. Overexpression of phytosulfokine-α induces male sterility and cell growth by regulating cell wall development in Arabidopsis // Plant Cell Rep. 2016. V. 35. P. 2503–2512.
Matsubayashi Y., Ogawa M., Kihara H., Niwa M., Sakagami Y. Disruption and overexpression of Arabidopsis phytosulfokine receptor gene affects cellular longevity and potential for growth // Plant Physiol. 2006. V. 142. P. 45–53.
Srivastava R., Liu J.-X., Howell S.H. Proteolytic processing of a precursor protein for a growth-promoting peptide by a subtilisin serine protease in Arabidopsis // Plant J. 2008. V. 56. P. 219–227.
Sauter M. Phytosulfokine peptide signalling // J. Exp. Bot. 2015. V. 66. P. 5161–5169.
Wang J., Li H., Han Z., Zhang H., Wang T., Lin G., Chang J., Yang W., Chai J. Allosteric receptor activation by the plant peptide hormone phytosulfokine // Nature. 2015. V. 525. P. 265–268.
Oehlenschlæger C.B., Gersby L.B.A., Ahsan N., Pedersen J.T., Kristensen A., Solakova T.V., Thelen J.J., Fuglsang A.T. Activation of the LRR receptor-like kinase PSY1R requires transphosphorylation of residues in the activation loop // Front. Plant Sci. 2017. V. 8. P. 2005.
Mosher S., Kemmerling B. PSKR1 and PSY1R-mediated regulation of plant defense responses // Plant Signal Behav. 2013. V. 8: e24119. doi 10.4161/psb.24119
Roberts I., Smith S., De Rybel B., Van Den Broeke J., Smet W., De Cokere S., Mispelaere M., De Smet I., Beeckman T. The CEP family in land plants: evolutionary analyses, expression studies, and role in Arabidopsis shoot development // J. Exp. Bot. 2013. V. 64. P. 5371–5381.
Tabata R., Sumida K., Yoshii T., Ohyama K., Shinohara H., Matsubayashi Y. Perception of root-derived peptides by shoot LRR-RKs mediates systemic N-demand signaling // Science. 2014. V. 346. P. 343–346.
Ohkubo Y., Tanaka M., Tabata R., Ogawa-Ohnishi M., Matsubayashi Y. Shoot-to-root mobile polypeptides involved in systemic regulation of nitrogen acquisition // Nat. Plants. 2017. V. 3. P. 17029.
Imin N., Mohd-Radzman N.A., Ogilvie H.A., Djordjevic M.A. The peptide-encoding CEP1 gene modulates lateral root and nodule numbers in Medicago truncatula // J. Exp. Bot. 2013. V. 64. P. 5395–5409.
Huault E., Laffont C., Wen J., Mysore K.S., Ratet P., Duc G., Frugier F. Local and systemic regulation of plant root system architecture and symbiotic nodulation by a receptor-like kinase // PLOS Genetics. 2014. V. 10: e1004891.
Bobay B.G., DiGennaro P., Scholl E., Imin N., Djordjevic M.A., Mck Bird D. Solution NMR studies of the plant peptide hormone CEP inform function // FEBS Letters. 2013. V. 587. P. 3979–3985.
Vie A.K., Najafi J., Liu B., Winge P., Butenko M.A., Hornslien K.S., Kumpf R., Aalen R.B., Bones A.M., Brembu T. The IDA/IDA-LIKE and PIP/PIP-LIKE gene families in Arabidopsis: phylogenetic relationship, expression patterns, and transcriptional effect of the PIPL3 peptide // J. Exp. Bot. 2015. V. 66. P. 5351–5365.
Stenvik G.-E., Tandstad N.M., Guo Y., Shi C.-L., Kristiansen W., Holmgren A., Clark S.E., Aalen R.B., Butenko M.A. The EPIP peptide of INFLORESCENCE DEFICIENT IN ABSCISSION is sufficient to induce abscission in arabidopsis through the receptor-like kinases HAESA and HAESA-LIKE2 // Plant Cell. 2008. V. 20. P. 1805–1817.
Cho S.K., Larue C.T., Chevalier D., Wang H., Jinn T.-L., Zhang S., Walker J.C. Regulation of floral organ abscission in Arabidopsis thaliana // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 15629–15634.
Butenko M.A., Shi C.-L., Aalen R.B. KNAT1, KNAT2 and KNAT6 act downstream in the IDA-HAE/HSL2 signaling pathway to regulate floral organ abscission // Plant Signal. Behav. 2012. V. 7. P. 135–138.
Kumpf R.P., Shi C.-L., Larrieu A., Stø I.M., Butenko M.A., Péret B., Riiser E.S., Bennett M.J., Aalen R.B. Floral organ abscission peptide IDA and its HAE/HSL2 receptors control cell separation during lateral root emergence // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 5235–5240.
Wang X., Hou S., Wu Q., Lin M., Acharya B.R., Wu D., Zhang W. IDL6-HAE/HSL2 impacts pectin degradation and resistance to Pseudomonas syringae pv. tomato DC3000 in Arabidopsis leaves // Plant J. 2017. V. 89. P. 250–263.
Hou S., Wang X., Chen D., Yang X., Wang M., Turrà D., Di Pietro A., Zhang W. The secreted peptide PIP1 amplifies immunity through receptor-like kinase 7 // PLoS Pathog. 2014. V. 10. № 9. https://www.ncbi.nlm.nih.gov/ pmc/articles/PMC4154866/. (Accessed November 17, 2017).
Doblas V.G., Smakowska-Luzan E., Fujita S., Alassimone J., Barberon M., Madalinski M., Belkhadir Y., Geldner N. Root diffusion barrier control by a vasculature-derived peptide binding to the SGN3 receptor // Science. 2017. V. 355. P. 280–284.
Nakayama T., Shinohara H., Tanaka M., Baba K., Ogawa-Ohnishi M., Matsubayashi Y. A peptide hormone required for Casparian strip diffusion barrier formation in Arabidopsis roots // Science. 2017. V. 355. P. 284–286.
Pearce G. Systemin, hydroxyproline-rich systemin and the induction of protease inhibitors // Current Protein & Peptide Science. 2011. V. 12. P. 399–408.
Higashiyama T. Peptide signaling in pollen-pistil interactions // Plant Cell Physiol. 2010. V. 51. P. 177–189.
Qu L.-J., Li L., Lan Z., Dresselhaus T. Peptide signalling during the pollen tube journey and double fertilization // J. Exp. Bot. 2015. V. 66. P. 5139–5150.
Stotz H.U., Thomson J.G., Wang Y. Plant defensins: defense, development and application // Plant Signal Behav. 2009. V. 4. P. 1010–1012.
Olsen A.N., Mundy J., Skriver K. Peptomics, identification of novel cationic Arabidopsis peptides with conserved sequence motifs // In Silico Biol. (Gedrukt). 2002. V. 2. P. 441–451.
Dressano K., Ceciliato P.H.O., Silva A.L., Guerrero-Abad J.C., Bergonci T., Ortiz-Morea F.A., Bürger M., Silva-Filho M.C., Moura D.S. BAK1 is involved in A-tRALF1-induced inhibition of root cell expansion // PLoS Genet. 2017. V. 13: e1007053.
Murphy E., De Smet I. Understanding the RALF family: a tale of many species // Trends Plant Sci. 2014. V. 19. P. 664–671.
Murphy E., Vu L.D., Van den Broeck L., Lin Z., Ramakrishna P., van de Cotte B., Gaudinier A., Goh T., Slane D., Beeckman T., Inzé D., Brady S.M., Fukaki H., De Smet. RALFL34 regulates formative cell divisions in Arabidopsis pericycle during lateral root initiation // J. Exp. Bot. 2016. V. 67. P. 4863-4875.
Thynne E., Saur I.M.L., Simbaqueba J., Ogilvie H.A., Gonzalez-Cendales Y., Mead O., Taranto A., Catanzariti A.-M., McDonald M.C., Schwessinger B., Jones D.A., Rathjen J.P., Solomon P.S. Fungal phytopathogens encode functional homologues of plant rapid alkalinization factor (RALF) peptides // Mol. Plant Pathol. 2017. V. 18. P. 811–824.
Sugano S.S., Shimada T., Imai Y., Okawa K., Tamai A., Mori M., Hara-Nishimura I. Stomagen positively regulates stomatal density in Arabidopsis // Nature. 2010. V. 463. P. 241–244.
Shimada T., Sugano S.S., Hara-Nishimura I. Positive and negative peptide signals control stomatal density // Cell. Mol. Life Sci. 2011. V. 68. P. 2081–2088.
Murphy E., Smith S., De Smet I. Small signaling peptides in Arabidopsis development: how cells communicate over a short distance // Plant Cell. 2012. V. 24. P. 3198–3217.
Kondo T., Kajita R., Miyazaki A., Hokoyama M., Nakamura-Miura T., Mizuno S., Masuda Y., Irie K., Tanaka Y., Takada S., Kakimoto T., Sakagami Y. Stomatal density is controlled by a mesophyll-derived signaling molecule // Plant Cell Physiol. 2010. V. 51. P. 1–8.
Lin G., Zhang L., Han Z., Yang X., Liu W., Li E., Chang J., Qi Y., Shpak E.D., Chai J. A receptor-like protein acts as a specificity switch for the regulation of stomatal development // Genes Dev. 2017. V. 31. P. 927–938.
Jewaria P.K., Hara T., Tanaka H., Kondo T., Betsuyaku S., Sawa S., Sakagami Y., Aimoto S., Kakimoto T. Differential effects of the peptides Stomagen, EPF1 and EPF2 on activation of MAP kinase MPK6 and the SPCH protein level // Plant Cell Physiol. 2013. V. 54. P. 1253–1262.
Yang S.-L., Jiang L., Puah C.S., Xie L.-F., Zhang X.-Q., Chen L.-Q., Yang W.-C., Ye D. Overexpression of T-APETUM DETERMINANT1 alters the cell fates in the Arabidopsis carpel and tapetum via genetic interaction with excess microsporocytes1/extra sporogenous cells // Plant Physiol. 2005. V. 139. P. 186–191.
Huang J., Zhang T., Linstroth L., Tillman Z., Otegui M.S., Owen H.A., Zhao D. Control of anther cell differentiation by the small protein ligand TPD1 and its receptor EMS1 in Arabidopsis // PLoS Genet. 2016. V. 12: e1006147.
Li Z., Wang Y., Huang J., Ahsan N., Biener G., Paprocki J., Thelen J.J., Raicu V., Zhao D. Two SERK receptor-like kinases interact with EMS1 to control anther cell fate determination // Plant Physiol. 2017. V. 173. P. 326–337.
Wheeler M.J., de Graaf B.H.J., Hadjiosif N., Perry R.M., Poulter N.S., Osman K., Vatovec S., Harper A., Franklin F.C.H., Franklin-Tong V.E. Identification of the pollen self-incompatibility determinant in Papaver rhoeas // Nature. 2009. V. 459. P. 992–995.
Lin Z., Eaves D.J., Sanchez-Moran E., Franklin F.C.H., Franklin-Tong V.E. The Papaver rhoeas S determinants confer self-incompatibility to Arabidopsis thaliana in planta // Science. 2015. V. 350. P. 684–687.
Tang W., Kelley D., Ezcurra I., Cotter R., McCormick S. LeSTIG1, an extracellular binding partner for the pollen receptor kinases LePRK1 and LePRK2, promotes pollen tube growth in vitro // Plant J. 2004. V. 39. P. 343–353.
Huang W.-J., Liu H.-K., McCormick S., Tang W.-H. Tomato pistil factor STIG1 promotes in vivo pollen tube growth by binding to phosphatidylinositol 3-phosphate and the extracellular domain of the pollen receptor kinase LePRK2 // Plant Cell. 2014. V. 26. P. 2505–2523.
Márton M.L., Cordts S., Broadhvest J., Dresselhaus T. Micropylar pollen tube guidance by egg apparatus 1 of maize // Science. 2005. V. 307. P. 573–576.
Uebler S., Márton M.L., Dresselhaus T. Classification of EA1-box proteins and new insights into their role during reproduction in grasses // Plant Reprod. 2015. V. 28. P. 183–197.
Okuda S., Tsutsui H., Shiina K., Sprunck S., Takeuchi H., Yui R., Kasahara R.D., Hamamura Y., Mizukami A., Susaki D., Kawano N., Sakakibara T., Namiki S., Itoh K., Otsuka K., Matsuzaki M., Nozaki H., Kuroiwa T., Nakano A., Kanaoka M.M., Dresselhaus T., Sasaki N., Higashiyama T. Defensin-like polypeptide LUREs are pollen tube attractants secreted from synergid cell // Nature. 2009. V. 458. P. 357–361.
Takeuchi H., Higashiyama T. Tip-localized receptors control pollen tube growth and LURE sensing in Ar-abidopsis // Nature. 2016. V. 531. P. 245–248.
Chae K., Lord E.M. Pollen tube growth and guidance: roles of small, secreted proteins // Ann. Bot. 2011. V. 108. P. 627–636.
Tousheh M., Miroliaei M., Asghar Rastegari A., Ghaedi K., Esmaeili A., Matkowski A. Computational evaluation on the binding affinity of non-specific lipid-transfer protein-2 with fatty acids // Comput. Biol. Med. 2013. V. 43. P. 1732–1738.
Sprunck S., Rademacher S., Vogler F., Gheyselinck J., Grossniklaus U., Dresselhaus T. Egg cell-secreted EC1 triggers sperm cell activation during double fertilization // Science. 2012. V. 338. P. 1093–1097.
Mori T., Igawa T. Gamete attachment process revealed in flowering plant fertilization // Plant Signal Behav. 2014. V. 9: e977715.
Costa L.M., Marshall E., Tesfaye M., Silverstein K.A.T., Mori M., Umetsu Y., Otterbach S.L., Papareddy R., Dickinson H.G., Boutiller K., VandenBosch K.A., Ohki S., Gutierrez-Marcos J.F. Central cell-derived peptides regulate early embryo patterning in flowering plants // Science. 2014. V. 344. P. 168–172.
Musielak T.J., Bayer M. YODA signalling in the early Arabidopsis embryo // Biochem. Soc. Trans. 2014. V. 42. P. 408–412.
Corrado G., Sasso R., Pasquariello M., Iodice L., Carretta A., Cascone P., Ariati L., Digilio M.C., Guerrieri E., Rao R. Systemin regulates both systemic and volatile signaling in tomato plants // J. Chem. Ecol. 2007. V. 33. P. 669–681.
Li C., Liu G., Xu C., Lee G.I., Bauer P., Ling H.-Q., Ganal M.W., Howe G.A. The tomato suppressor of prosystemin-mediated responses2 gene encodes a fatty acid desaturase required for the biosynthesis of jasmonic acid and the production of a systemic wound signal for defense gene expression // Plant Cell. 2003. V. 15. P. 1646–1661.
Yamaguchi Y., Huffaker A., Bryan A.C., Tax F.E., Ryan C.A. PEPR2 is a second receptor for the Pep1 and Pep2 peptides and contributes to defense responses in Arabidopsis // Plant Cell. 2010. V. 22. P. 508–522.
Wang Y., Wang L., Zou Y., Chen L., Cai Z., Zhang S., Zhao F., Tian Y., Jiang Q., Ferguson B.J., Gresshoff P.M., Li X. Soybean miR172c targets the repressive AP2 transcription factor NNC1 to activate ENOD40 expression and regulate nodule initiation // Plant Cell. 2014. V. 26. P. 4782–4801.
Batut J., Mergaert P., Masson-Boivin C. Peptide signalling in the rhizobium-legume symbiosis // Curr. Opin. Microbiol. 2011. V. 14. P. 181–187.
Wen J., Lease K.A., Walker J.C. DVL, a novel class of small polypeptides: overexpression alters Arabidopsis development // Plant J. 2004. V. 37. P. 668–677.
Ikeuchi M., Yamaguchi T., Kazama T., Ito T., Horiguchi G., Tsukaya H. ROTUNDIFOLIA4 regulates cell proliferation along the body axis in Arabidopsis shoot // Plant Cell Physiol. 2011. V. 52. P. 59–69.
Valdivia E.R., Chevalier D., Sampedro J., Taylor I., Niederhuth C.E., Walker J.C. DVL genes play a role in the coordination of socket cell recruitment and differentiation // J. Exp. Bot. 2012. V. 63. P. 1405–1412.
Liu J., Mehdi S., Topping J., Friml J., Lindsey K. Interaction of PLS and PIN and hormonal crosstalk in Arabido-psis root development // Front Plant Sci. 2013. V. 4. P. 75.
Chilley P.M., Casson S.A., Tarkowski P., Hawkins N., Wang K.L.-C., Hussey P.J., Beale M., Ecker J.R., Sandberg G.K., Lindsey K. The POLARIS peptide of Arabidopsis regulates auxin transport and root growth via effects on ethylene signaling // Plant Cell. 2006. V. 18. P. 3058–3072.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений