Физиология растений, 2019, T. 66, № 2, стр. 104-111
Генерация перекиси водорода и транскрипционная регуляция экспрессии антиоксидантных ферментов Chlamydomonas reinhardtii в условиях гипотермии
Ж. М. Залуцкая a, У. С. Скрябина a, Е. В. Ермилова a
a Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
Поступила в редакцию 31.01.2018
После доработки 22.03.2018
Принята к публикации 26.04.2018
Аннотация
В работе показана генерация перекиси водорода в клетках Chlamydomonas reinhardtii в условиях гипотермии. Анализ у клеток C. reinhardtii транскрипции генов, кодирующих ферменты, вовлеченные в детоксикацию перекиси водорода: аскорбатпероксидазы (APX1, APX2 и APX3), каталазы (CAT1 и CAT2) и глутатионпероксидазы (GPX1, GPX3, GPX4 и GPX5) показал, что действие низкой температуры (7°С) приводит к снижению транскрипции генов, кодирующих каталазы и аскорбатпероксидазы. Вместе с тем, в этих условиях выявлена индукция трех GPX-генов – GPX1, GPX3 и GPX5. Максимальное увеличение уровней транскрипции (в 50 раз) зафиксировано для GPX3, на основании чего ген, кодирующий глутатионпероксидазу 3, предложен в качестве потенциального маркера ответа C. reinhardtii ни гипотермию. Кроме того, установлено, что при действии низкой температуры перекись водорода вовлечена в регуляцию индукции гена GPX3.
ВВЕДЕНИЕ
Одноклеточные фотосинтезирующие эукариоты, возможности которых для применения стратегий адаптации более ограничены, чем у высших растений, поскольку непосредственное окружение микроорганизмов влияет на их гомеостаз, должны “подстраивать” свое клеточное содержимое (состав и структуру биополимеров, пути метаболизма и т.д.) к внешним условиям. В отличие от цианобактерий [1–3] и некоторых высших растений [4, 5], молекулярные компоненты путей адаптации которых к действию стрессоров изучаются на протяжении длительного времени и поняты во многих деталях, анализ механизмов регуляции стрессовых ответов фотосинтезирующих эукариотических микроорганизмов начат сравнительно недавно, и в литературе практически не обсуждаются молекулярные механизмы адаптации к действию низких температур. Основными последствиями действия гипотермии на клетку являются снижение текучести мембран и стабилизация вторичных структур РНК и ДНК, что, в свою очередь, сказывается на процессах трансляции, транскрипции и репликации. Одноклеточная зеленая водоросль Chlamydomonas reinhardtii Dang., оптимальная температура роста которой составляет 20−22°С, полностью сохраняет жизнеспособность при снижении температуры культивирования до 5−7°С [6].
При действии низких температур в клетках различных организмов происходит генерация перекиси водорода, оказывающей повреждающее действие на различные компоненты клеток [7]. В этих условиях фотосинтезирующие организмы, включая микроорганизмы, способны синтезировать/активировать ферменты, которые необходимы для детоксикации перекиси водорода. В клетках C. reinhardtii, как и у многих организмов, в защиту от токсичного действия перекиси водорода вовлечены аскорбатпероксидазы, а также независимые от аскорбата каталазы и глутатионпероксидазы [8]. Анализ генома C. reinhardtii выявил наличие трех генов АРХ, кодирующих аскорбатпероксидазы, двух генов CAT, кодирующих каталазы, и четырех генов GPX, кодирующих глутатионпероксидазы [9, 10]. Транскрипция генов GPX, CAT и APX регулируется у C. reinhardtii при действии различных стрессовых условий. Так, транскрипция GPX1 индуцируется при дефиците серы [11], уровни мРНК GPX3 и GPX4 возрастают в ответ на удаление из среды марганца [12], а GPX5 – при отсутствии меди [13] и в ответ на образование синглетного кислорода [14, 15]. Кроме того, происходит увеличение транскрипции генов CAT1 и CAT2 при действии на клетки кадмия и антрацена [16], а также при солевом стрессе [17]. В ответ на действие экзогенной перекиси водорода транскрипция генов GPX5 и АРХ возрастает [18, 19], тогда как уровни мРНК CAT1 и CAT2 снижаются [8, 20]. Регуляция транскрипции генов из семейств APX, CAT и GPX в клетках водоросли C. reinhardtii в условиях низких температур ранее не анализировалась.
Цель работы – выявление возможной генерации перекиси водорода клетками C. reinhardtii в условиях гипотермии, а также в изучении экспрессии генов, кодирующих аскорбатпероксидазы, каталазы и глутатионпероксидазы, при низкотемпературном воздействии.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В экспериментах был использован штамм Chlamydomonas reinhardtii cw15−325 (cw15mt+arg7-8nit1+nit2+), любезно предоставленный профессором М. Шрода (Технический Университет г. Кайзерслаутерна, Германия).
Условия культивирования. Культуры C. reinhardtii выращивали в среде ТАР [21] при постоянном освещении (освещенность 2 тыс. люкс) и температуре 22°С в течение 72 ч. В экспериментах клетки инкубировали при 7°С, поскольку ранее было установлено, что эта температура блокирует деление клеток С. reinhardtii, но при этом не влияет на их жизнеспособность [6]. Для экспериментов по гипотермии клетки переносили в инкубатор Innova®42 (“New Brunswick Scientific”, Германия) и выдерживали при 7°С. Через 1, 2, 3, 6, 8, 16, 24, 42, 48, 54 и 72 ч в зависимости от эксперимента (см. рис. 1−4) из клеток выделяли РНК и оценивали генерацию перекиси водорода. Анализ жизнеспособности проводили с использованием красителя Evans Blue, как описано ранее [6, 22]. 400 клеток из каждой пробы были оценены в трех биологических повторах. Аскорбат (“Вектон”, Россия) вносили в суспензию C. reinhardtii в концентрации 20 мМ, которая эффективно снижала образование клетками перекиси водорода в условиях гипотермии.
Рис. 1.
Действие гипотермии на формирование перекиси водорода клетками C. reinhardtii. (а) − Детекция формирования Н2О2 клетками C. reinhardtii методом конфокальной микроскопии с использованием флуоресцентного красителя H2DCF-DA. Верхний ряд – микрофотографии клеток, выращенных при 22°С; нижний ряд – микрофотографии клеток, инкубированных при 7°С в течение 24 ч. Слева приведены микрофотографии популяций клеток (масштаб − 100 мкм), справа – отдельных клеток (масштаб – 10 мкм). Свечение при 7°С в присутствии H2DCF-DA свидетельствует о присутствии Н2О2, свечение в отсутствие красителя соответствует автофлуоресценции хлорофилла. (б) − Количественное определение содержания Н2О2 в клетках в условиях низкотемпературного воздействия (7°C 24 ч) с использованием микропланшетного ридера CLARIOstar (BMG) и флуоресцентного красителя H2DCF-DA.

Выделение РНК и синтез одноцепочечной кДНК. Для выделения РНК 10 мл суспензии клеток C. reinhardtii (1–2 × 106 клеток/мл) осаждали центрифугированием (5000 g, 2 мин) и далее обрабатывали тризолом (“Invitrogen”, США) как описано ранее [23]. Для синтеза кДНК пробы РНК обрабатывали ДНКазой 1 (“Thermo Scientific”, США). Реакционную смесь объемом 10 мкл, содержащую 1 мкг РНК, 1 мкл 10× реакционного буфера, 1 е.а. ДНКазы, инкубировали при 37°С в течение 15 мин. ДНКазу инактивировали внесением 2.5 мМ ЭДТА и прогреванием при температуре 65°С в течение 10 мин. Синтез одноцепочечной кДНК из тотальной РНК проводили с использованием набора Revert Aid H minus First Strand cDNA Synthesis Kit (“Thermo Scientific”, США) как описано фирмой-производителем. Проводили спектрофотометрическое измерение концентрации кДНК на спектрофотометре SmartSpec Plus Spectrophotometer (“BioRad”, США).
Проведение ПЦР в режиме реального времени. Полимеразную цепную реакцию (ПЦР) в реальном времени проводили на амплификаторе CFX96™ Real-Time System (“Bio-Rad”, США) c использованием интеркалирующего красителя SYBRGreen I (“Invitrogen”, США), как описано ранее [24]. На основе последовательностей генов, приведенных в базе данных Phytozome 12, Chlamydomonas reinhardtii v5.5 (https://phytozome.jgi.doe.gov/pz/ portal.html#!info?alias=Org_Creinhardtii), нами были подобраны праймеры (программа OligoPerfect™ Designer) (табл. 1). В качестве референс-гена для оценки экспрессии использовали ген RACK1 C. reinhardtii, кодирующий β-субъединицу G-белка [6]. Для оценки относительных уровней экспрессии анализируемых генов использовали метод ΔΔCt [25], согласно которому уровень экспрессии анализируемого гена (гена интереса) оценивался как 2–∆∆Сt, где
(1)
$\Delta \Delta {\text{С t}} = \Delta {\text{С t}}\,{\text{п р о б ы }}--\Delta {\text{С t}}\,{\text{к о н т р о л я }},$(2)
$\Delta {\text{С t}}\,{\text{п р о б ы }} = {\text{С t}}\,{\text{г е н а }}\,\,{\text{и н т е р е с а }}\,\,{\text{п р о б ы }}--{\text{С t}}\,{\text{р е ф е р е н с }} - {\text{г е н а }}\,\,{\text{п р о б ы }},$(3)
$\Delta {\text{С t}}\,{\text{к о н т р о л я }} = {\text{С t}}\,{\text{г е н а }}\,\,{\text{и н т е р е с а }}\,\,{\text{к о н т р о л я }}--{\text{С t}}\,{\text{р е ф е р е н с }} - {\text{г е н а }}\,\,{\text{к о н т р о л я }}.$Таблица 1.
Последовательности праймеров для проведения количественной ПЦР
| Ген/идентификационный номер (v.5.5)* | Праймер | Последовательность (5'–3') |
|---|---|---|
| GPX1/Cre02.g078300 | GPX1 прямой | AGCCCCGTGTACAACTTCCT |
| GPX1 обратный | AAAGTTCCAGCCGATGTCC | |
| GPX3/Cre03.g197750 | GPX3 прямой | AAGTCCAACTACGGCGTGAC |
| GPX3 обратный | AGACCACCCTTCTGGGTCTT | |
| GPX4/Cre10.g440850 | GPX4 прямой | TACAAGGGCCTGACCAAGAC |
| GPX4 обратный | CGCGCTTTAGGAACTGGTAG | |
| GPX5/Cre10.g458450 | GPX5 прямой | GCTAGCAAGTGCGGCTTTAC |
| GPX5 обратный | GTACTTGAACACGGGGTTGG | |
| CAT1/Cre09.g417150 | CAT1 прямой | GATGGTATGGCCTGGTGCTG |
| CAT1 обратный | CAATCGGATGGGCTCCCTAA | |
| CAT2/Cre01.g045700 | CAT2 прямой | CTCAGACCTGGCGATCAAGT |
| CAT2 обратный | TGCAGGAAAGCTGTGTTGTC | |
| APX1/Cre02.g087700 | APX1 прямой | TCAAGGAGATCAAGGCCAAG |
| APX1 обратный | GCCGCTCAGTCCAGAGTAAC | |
| APX2/Cre06.g285150 | APX2 прямой | AGCCCTGGAACAACACAAAG |
| APX2 обратный | GAGAAGTCGCGGAAGAACAG | |
| APX3/Cre09.g401886 | APX3 прямой | CAGGAGCTGCTCAACAACAA |
| APX3 обратный | GGCGTACTGGGTCACGTACT | |
| RACK1/Cre06.g278222 | RACK1 прямой | CTTCTCGCCCATGACCAC |
| RACK1 обратный | CCCACCAGGTTGTTCTTCAG |
Примечание. * Названия генов и их идентификационные номера приведены в соответствии с базой данных Phytozome 12, Chlamydomonas reinhardtii v5.5 (https://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_Creinhardtii).
Для статистической обработки использовали данные, полученные в трех независимых экспериментах и трех технических повторах в каждом эксперименте. Средние значения, стандартное отклонение и достоверность различий вычисляли с использованием программы Microsoft Excel. Предполагаемая локализация ферментов, кодируемых анализируемыми в работе генами, уточнялась с помощью программ ChloroP 1.1 и Target P1.1 (http://www.cbs.dtu.dk/services/ChloroP/ и http:// www.cbs.dtu.dk/services/TargetP/).
Анализ генерации перекиси водорода с помощью конфокальной микроскопии. Внутриклеточную перекись водорода визуализировали с использованием флуоресцентного красителя 2',7'-дихлорофлуоресцеин диацетата (H2DCF-DA, Sigma-Aldrich) [26]. К 0.7 мл культуры C. reinhardtii (1–2 × 106 клеток/мл) добавляли H2DCF-DA до конечной концентрации 20 мкМ; через 15 мин инкубирования c дихлорофлуоресцеином клетки дважды отмывали от красителя средой ТАР и ресуспендировали в среде ТАР. Для получения изображений использовали конфокальный микроскоп Leica TCS-SP5 (“Leica-Microsystems”, Германия) с масляным иммерсионным объективом HC PL APO 63×. Возбуждение осуществляли с помощью аргонового лазера (длина волны 488 нм). Флуоресценцию дихлорофлуоресцеина регистрировали в интервале 500–544 нм, автофлуоресценцию хлорофилла в интервале 600–680 нм. Изображения получали и обрабатывали с помощью программы LAS AF Light (“Leica-Microsystems”, Германия).
Количественное определение уровней внутриклеточной перекиси водорода. Флуоресценцию дихлорофлуоресцеина количественно измеряли на мультимодальном микропланшетном ридере CLARIOstar (“BMG Labtech”, Германия). Длины волн возбуждения и излучения составляли 483 ± 14 и 530 ± 30 нм соответственно. Клетки подготавливали для анализа как описано выше для конфокальной микроскопии. Для каждого варианта были сделаны три технических повтора (200 мкл суспензии на лунку планшета (“Greiner Bio-One”, США). Значение автофлуоресценции вычитали из полученного значения флуоресценции клеток, зарегистрированной после их инкубации с H2DCF-DA. Интенсивность флуоресценции выражали как относительные единицы флуоресценции на 106 клеток. Для статистической обработки использовали данные, полученные в трех независимых экспериментах.
РЕЗУЛЬТАТЫ
Образование перекиси водорода клетками C. reinhardtii в условиях действия низкой температуры
Известно, что действие низкой температуры приводит к формированию внутриклеточных активных форм кислорода и, прежде всего, перекиси водорода (Н2О2) у различных организмов [7]. Нами было проверено действие гипотермии на генерацию Н2О2 клетками C. reinhardtii. Как видно из рис. 1а, в клетках C. reinhardtii, выращенных при 22°С, было выявлено слабое свечение в цитозоле после инкубации с красителем H2DCF-DA, специфически взаимодействующим с Н2О2. После инкубации при 7°С в течение 24 ч была зафиксирована генерация внутриклеточной Н2О2, что регистрировали как свечение зеленого цвета в цитозоле клеток.
Полученные с помощью конфокальной микроскопии данные подтверждаются также результатами анализа, проведенного на мультимодальном микропланшетном ридере CLARIOstar (рис. 1б). Действие низкой температуры приводило к возрастанию флуоресценции, которая отражает внутриклеточные уровни Н2О2: через 16 ч наблюдалось увеличение флуоресценции примерно в 2.5 раза и вплоть до 42 ч происходило ее дальнейшее увеличение (в 4 раза через 42 ч). Однако к 54 ч уровни флуоресценции снижались до значений, в 2 раза превышающих исходные значения. Последнее обстоятельство позволяет предположить эффективную работу клеточных систем по детоксикации Н2О2.
Действие низкой температуры на транскрипцию АРХ-генов
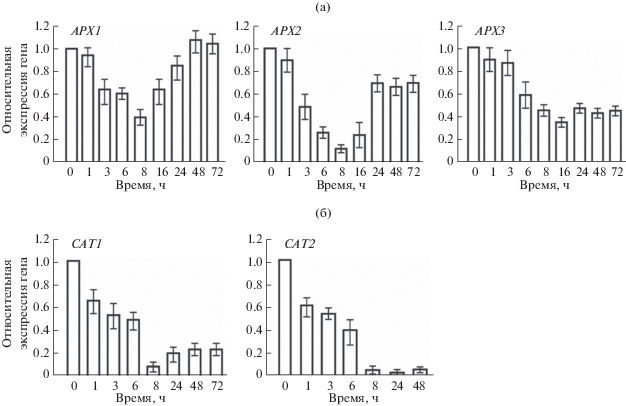
Среди антиоксидантных систем растительных клеток аскорбатпероксидазы представляют собой ключевые ферменты, с помощью которых в тканях растений эффективно удаляется перекись водорода. Представители этого семейства ферментов функционируют также в клетках C. reinhardtii [8]. Нас интересовало, экспрессируются ли в клетках водоросли в условиях гипотермии гены, кодирующие аскорбатпероксидазы? Для ответа на этот вопрос была проанализирована транскрипция генов, кодирующих три аскорбатпероксидазы C. reinhardtii (рис. 2а). Анализ действия низкой температуры на транскрипцию генов, кодирующих аскорбатпероксидазы хлоропласта (APX1 и APX2) и митохондрий (APX3), показал, что APX-гены не только не индуцировались при 7°С, но демонстрировали значительное снижение уровней транскриптов (рис. 2а). Уровень относительной экспрессии одного из APX-генов (APX1) через 24 ч действия гипотермии достигал значений, близких к контролю при комнатной температуре. Однако дальнейшего возрастания транскрипции APX1 не происходило.
Рис. 2.
Уровни относительной экспрессии APX-генов (а) и САТ-генов (б) C. reinhardtii при 7°C. Относительные уровни экспрессии нормализованы по отношению к экспрессии референс-гена RACK1 и рассчитаны по методу ΔΔCt [25].
Действие низкой температуры на транскрипцию САТ-генов
В клетках C. reinhardtii, как и у многих организмов, в защиту от токсичного действия перекиси водорода вовлечены еще две группы ферментов, которые не контролируются аскорбатом: каталазы и глутатионпероксидазы [8]. Анализ транскрипции двух САТ-генов, кодирующих каталазы C. reinhardtii в условиях гипотермии, показал, что происходило снижение экспрессии гена CAT1, кодирующего монофункциональную каталазу, локализованную предположительно в митохондриях или пероксисомах, и гена CAT2, кодирующего каталазу цитозоля (рис. 2б). Минимальные уровни мРНК CAT1 и CAT2 отмечены уже через 8 ч после начала низкотемпературного воздействия.
Действие низкой температуры на транскрипцию GPX-генов
Для выяснения того, контролируется ли синтез глутатионпероксидаз C. reinhardtii холодом на транскрипционном уровне, была проанализирована экспрессия четырех GPX-генов (рис. 3). Данные количественной ПЦР свидетельствуют о том, что уровни мРНК двух генов − GPX1 и GPX5 − возрастали уже через 3 ч культивирования при 7°С и достигали максимальных значений через 6 и 8 ч соответственно. Максимальные уровни транскрипции генов GPX1 превышали исходные значения в 4 раза, а GPX5 − в 6 раз. Через 16 ч уровни мРНК обоих генов снижались до значений, близких к контрольному уровню.
Рис. 3.
Уровни относительной экспрессии GPX-генов C. reinhardtii при 7°C. Относительные уровни экспрессии нормализованы по отношению к экспрессии референс-гена RACK1 и рассчитаны по методу ΔΔCt [25].

Наибольший уровень относительной экспрессии был зафиксирован для гена GPX3 (рис. 3). Уровни транскрипта увеличивались приблизительно в 48 раз через 16 ч низкотемпературного воздействия. Однако через 24 ч инкубации при 7°С уровень транскрипции GPX3 уменьшался приблизительно в 3 раза. При воздействии гипотермии не наблюдалось возрастания уровней относительной экспрессии гена GPX4.
Действие аскорбата на транскрипцию GPX-генов в условиях гипотермии
Известно, что формируемая в клетках растений перекись вовлечена в качестве сигнальной молекулы в контроль различных процессов [20, 27]. Для проверки того, контролирует ли индукцию трех GPX-генов Н2О2, формирующаяся при действии низкой температуры, к клеткам до температурной обработки был добавлен аскорбат (рис. 4) – антиоксидант, экзогенное использование которого позволяет анализировать экспрессию и функционирование антиоксидантных ферментов у растений [28]. По нашим данным, при добавлении к клеткам аскорбата в условиях гипотермии происходило значительное снижение уровней формирования перекиси водорода (рис. 4а). Примечательно, что уже через 6 ч после внесения аскорбата происходил блок индукции GPX3 холодом (рис. 4б). Наблюдаемый нами эффект позволяет предположить, что Н2О2 является индуктором транскрипции GPX3-гена в условиях гипотермии. Для двух других генов, и GPX1 и GPX5, достоверного действия аскорбата не выявлено (данные не показаны).
Рис. 4.
Действие аскорбата на уровни формирования перекиси (а) и экспрессию GPX3-гена (б) C. reinhardtii при 7°C. Количественное определение содержания перекиси водорода в клетках в условиях гипотермии выполнено с использованием микропланшетного ридера CLARIOstar (BMG) и флуоресцентного красителя H2DCF-DA. (а) – Серым цветом обозначена флуоресценция при при 7°C в среде ТАР, черным цветом – в среде ТАР, содержащей аскорбат. Относительные уровни экспрессии нормализованы по отношению к экспрессии референс-гена RACK1 и рассчитаны по методу ΔΔCt [25]. (б) – Черным цветом обозначены уровни экспрессии в ТАР с аскорбатом при 22°C, серым цветом – уровни экспрессии в ТАР с аскорбатом при 7°C и белым цветом – уровни экспрессии в ТАР при 7°C.

ОБСУЖДЕНИЕ
Антиоксидантные ферменты, аскорбатпероксидазы, каталазы и глутатионпероксидазы, играют одну из ключевых ролей в утилизации клетками C. reinhardtii перекиси водорода, которая может формироваться при различных стрессовых воздействиях, например, фотоокислительном стрессе, воздействии экзогенной перекиси или действии фенольных гербицидов [8, 10, 12, 19]. Однако формирование Н2О2 и ее возможная роль в контроле синтеза указанных ферментов при действии гипотермии ранее у C. reinhardtii не изучалась. На примере высших растений показано, что при снижении температуры в клетках формируются активные формы кислорода и прежде всего – перекись водорода [29]. По нашим данным, клетки водоросли C. reinhardtii также формируют Н2О2 в условиях гипотермии (рис. 1). Низкая температура, при которой прекращается деление клеток C. reinhardtii (7°С) [6], вызывает снижение транскрипции генов, кодирующих каталазы и аскорбатпероксидазы C. reinhardtii (рис. 2). Примечательно, что снижение транскрипции указанных генов зафиксировано также при действии на клетки экзогенной перекиси водорода [8]. Последнее обстоятельство предполагает возможное ингибиторное действие формируемой при гипотермии Н2О2 на экспрессию генов CAT и APX. Вместе с тем, в этих условиях зафиксирована индукция трех GPX-генов, GPX1, GPX3 и GPX5 (рис. 3), которые кодируют глутатионпероксидазы. Указанные ферменты функционируют в разных компартментах клетки: в хлоропласте, митохондриях и цитозоле, соответственно [10]. Увеличение уровней транскриптов до 50 раз зафиксировано для GPX3, на основании чего ген, кодирующий глутатионпероксидазу 3, может быть использован в качестве потенциального маркера ответа C. reinhardtii на гипотермию. Следует отметить, что проанализированные САТ- и АРХ-гены кодируют ферменты, которые, как и глутатионпероксидазы, локализованы в различных компартментах клетки: АРХ1 и АРХ2 − в хлоропласте, САТ1 и АРХ3 - в митохондриях, а САТ2 и АРХ3 – в цитозоле [8, 9]. Полученные данные позволяют нам высказать предположение, что из трех проанализированных классов антиоксидантных ферментов в условиях гипотермии одноклеточная водоросль использует глутатионпероксидазы, которые функционируют в разных компартментах клетки.
Сопоставление динамик формирования перекиси (рис. 1) и увеличения транскрипции GPX-генов (рис. 3) при действии низкой температуры позволило предположить, что Н2О2 может быть вовлечена в регуляцию индукции указанных генов в условиях гипотермии. Внесение в среду аскорбата приводило к блокированию генерации перекиси водорода (рис. 4а). Однако ингибирование индукции в этих условиях было зафиксировано только для локализованного в хромосоме 3 GPX3-гена [10] (рис. 4б), что свидетельствует в пользу высказанной гипотезы. Эффективность использования подобного контроля, по-видимому, может быть связана с тем, что индуцированные при участии перекиси водорода глутатионпероксидазы далее могут использоваться клеткой для детоксикации этой активной формы кислорода. Два других гена, GPX1 и GPX5, которые, как было ранее установлено [9], локализованы в других хромосомах (2 и 10, соответственно). У C. reinhardtii гены, продукты которых ассоциированы с определенными биологическими функциями, могут быть организованы в регуляторные кластеры, локализованные на одной хромосоме, как, например, гены, вовлеченные в ассимиляцию нитрата [30], или гены, ассоциированные с механизмом концентрирования углерода [9]. Транскрипционный контроль таких генов осуществляется с помощью одних и тех же регуляторов и сигнальных молекул. Тот факт, что три GPX-гена расположены на разных хромосомах, дополнительно свидетельствует о том, что в контроле их транскрипции при гипотермии могут быть задействованы различные механизмы, которые еще предстоит установить.
Таким образом, на основании проведенных исследований мы пришли к заключению, что из трех классов антиоксидантных систем против действия Н2О2C. reinhardtii в условиях гипотермии индуцирует только гены глутатионпероксидаз и, по-видимому, использует для защиты разных компартментов клетки в условиях холода ферменты одного класса.
Работа выполнена при финансовой поддержке гранта Российского научного фонда № 16-14-10004. Конфокальная микроскопия проведена в Центре коллективного пользования ”Хромас” Санкт-Петербургского государственного университета.
Список литературы
Castielli O., De la Cerda B., Navarro J.A., Hervás M., De la Rosa M.A. Proteomic analyses of the response of cyanobacteria to different stress conditions // FEBS Lett. 2009. V. 583. P. 1753–1758.
Los D.A., Zorina A., Sinetova M., Kryazhov S., Mironov K., Zinchenko V.V. Stress sensors and signal transducers in cyanobacteria // Sensors. 2010. V. 10. P. 2386−2415.
Sinetova M.A., Los D.A. New insights in cyanobacterial cold stress responses: Genes, sensors, and molecular triggers // Biochim. Biophys. Acta. 2016. V. 1860. P. 2391−2403.
Shulaev V., Cortes D., Miller G., Mittler R. Metabolomics for plant stress response // Physiol. Plant. 2008. V. 132. P. 199−208.
Miura K., Furumoto T. Cold signaling and cold response in plants // Int. J. Mol. Sci. 2013. V. 14. P. 5312–5337.
Maikova A., Zalutskaya Zh., Lapina T., Ermilova E. The HSP70 chaperone machines of Chlamydomonas are induced by cold stress // J. Plant Physiol. 2016. V. 204. P. 85–91.
Ермилова Е.В. Молекулярные аспекты адаптации прокариот: монография. 2-е изд., Санкт-Петербург: Химиздат, 2012. 342 с.
Blaby I.K., Blaby-Haas C.E., Perez-Perez M.E., Schmollinger S., Fitz-Gibbon S., Lemaire S.D., Merchant S.S. Genome-wide analysis on Chlamydomonas reinhardtii reveals the impact of hydrogen peroxide on protein stress responses and overlap with other stress transcriptomes // Plant J. 2015. V. 84. P. 974–988.
Merchant S.S., Prochnik S.E., Vallon O., Harris E.H., Karpowicz S.J., Witman G.B., Terry A., Salamov A., Fritz-Laylin L.K., Maréchal-Drouard L., Marshall W.F., Qu L.H., Nelson D.R., Sanderfoot A.A., Spalding M.H., Kapitonov V.V., Ren Q., Ferris P., Lindquist E., Shapiro H., Lucas S.M., Grimwood J., Schmutz J., Cardol P., Cerutti H., Chanfreau G., Chen C.L., Cognat V., Croft M.T., Dent R., Dutcher S., Fernández E., Fukuzawa H., González-Ballester D., González-Halphen D., Hallmann A., Hanikenne M., Hippler M., Inwood W., Jabbari K., Kalanon M., Kuras R., Lefebvre P.A., Lemaire S.D., Lobanov A.V., Lohr M., Manuell A., Meier I., Mets L., Mittag M., Mittelmeier T., Moroney J.V., Moseley J., Napoli C., Nedelcu A.M., Niyogi K., Novoselov S.V., Paulsen I.T., Pazour G., Purton S., Ral J.P., Riaño-Pachón D.M., Riekhof W., Rymarquis L., Schroda M., Stern D., Umen J., Willows R., Wilson N., Zimmer S.L., Allmer J., Balk J., Bisova K., Chen C.J., Elias M., Gendler K., Hauser C., Lamb M.R., Ledford H., Long J.C., Minagawa J., Page M.D., Pan J., Pootakham W., Roje S., Rose A., Stahlberg E., Terauchi A.M., Yang P., Ball S., Bowler C., Dieckmann C.L., Gladyshev V.N., Green P., Jorgensen R., Mayfield S., Mueller-Roeber B., Rajamani S., Sayre R.T., Brokstein P., Dubchak I., Goodstein D., Hornick L., Huang Y.W., Jhaveri J., Luo Y., Martínez D., Ngau W.C., Otillar B., Poliakov A., Porter A., Szajkowski L., Werner G., Zhou K., Grigoriev I.V., Rokhsar D.S., Grossman A.R. The Chlamydomonas genome reveals the evolution of key animal and plant functions // Science. 2007. V. 318. P. 245−250.
Dayer R., Fischer B., Eggen R.I.L., Lemaire S.D. The peroxiredoxin and glutathione peroxidase families in Chlamydomonas reinhardtii // Genetics. 2008. V. 179. P. 41–57.
Zhang Z., Shrager J., Jain M., Chang C.W., Vallon O. Insights into the survival of Chlamydomonas reinhardtii during sulfur starvation based on microarray analysis of gene e-xpression // Eukaryot. Cell. 2004. V. 3. P. 1331–1348.
Allen M.D., Kropat J., Tottey S., Del Campo J.A., Merchant S.S. Manganese deficiency in Chlamydomonas results in loss of photosystem II and MnSOD function, sensitivity to peroxides, and secondary phosphorus and iron deficiency // Plant Physiol. 2007.V. 143. P. 263–277.
Jamers A., Van der Ven K., Moens L., Robbens J., Potters G., Guisez Y., Blust R., De Coen W. Effect of copper exposure on gene expression profiles in Chlamydomonas reinhardtii based on microarray analysis // Aquat. Toxicol. 2006. V. 80. P. 249–260.
Ledford H.K. Chinand B.L., Niyogi K.K. Acclimation to singlet oxygen stress in Chlamydomonas reinhardtii // Eukaryot. Cell. 2007. V. 6. P. 919–930.
Fischer B.B., Eggen R.I., Trebst A., Krieger-Liszkay A. The glutathione peroxidase homologous gene Gpxh in Chlamydomonas reinhardtii is upregulated by singlet oxygen produced in photosystem II // Planta. 2006. V. 223. P. 583–590.
Aksmann A., Pokora W., Bascik-Remisiewicz A., Dettlaff-Pokora A., Wielgomas B., Dziadziuszko M., Tukaj Z. Time-dependent changes in antioxidative enzyme expression and photosynthetic activity of Chlamydomonas reinhardtii cells under acute exposure to cadmium and anthracene // Ecotoxicol. Environ. Saf. 2014. V. 110. P. 31–40.
Vega J.M., Garbayo I., Domínguez M.J., Vigara J. Effect of abiotic stress on photosynthesis and respiration in Chlamydomonas reinhardtii: Induction of oxidative stress // Enzyme Microb. Technol. 2006. V. 40. P. 163–167.
Leisinger Ur., Rüfenacht K., Fischer B., Pesaro M., Spengler A., Zehnder Al.J.B., Eggen R.I.L. The glutathione peroxidase homologous gene from Chlamydomonas r-einhardtii is transcriptionally up-regulated by singlet oxygen // Plant Mol. Biol. 2001. V. 46. P. 395–408.
Michelet L., Roach T., Fischer B.B., Bedhomme M., Lemaire S.D., Krieger-Liszkay A. Down-regulation of catalase activity allows transient accumulation of a hydrogen peroxide signal in Chlamydomonas reinhardtii // Plant Cell Environ. 2013. V. 36. P. 1204–1213.
Shao N., Beck C.F., Lemaire S.D., Krieger-Liszkay A. Photosynthetic electron flow affects H2O2 signaling by inactivation of catalase in Chlamydomonas reinhardtii // Planta. 2008. V. 228. P. 1055–1066.
Harris E.H. The Chlamydomonas sourcebook: a comprehensive guide to biology and laboratory use. San Diego, CA: Academic Press., 1989.
Crutchfield A.L.M., Diller K.R., Brand J.J. Cryopreservation of Chlamydomonas reinhardtii (Chlorophyta) // Eur. J. Phycol. 1999. V. 34. P. 43–52.
Ermilova E.V., Zalutskaya Zh.M., Nikitin M.M., Lapina T.V., Fernández E. Regulation by light of ammonium transport systems in Chlamydomonas reinhardtii // Plant Cell Environ. 2010. V. 33. P. 1049−1056.
Zalutskaya Zh., Lapina T., Ermilova E. The Chlamydomonas reinhardtii alternative oxidase 1 is regulated by heat stress // Plant Physiol. Biochem. 2015. V. 97. P. 229−234.
Livak K.J., Schmittgen, T.D. Analysis of relative gene -expression data using real-time quantitative PCR and the 2-ΔΔCT method // Methods. 2001. V. 25. P. 402–408.
Zhu H., Bannenberg G.L., Moldéus P., Shertzer H.G. Oxidation pathways for the intracellular probe 2',7'-dichlorofluorescein // Arch. Toxicol. 1994. V. 68. P. 582−587.
Stone J.R., Yang S. Hydrogen peroxide: a signaling messenger // Antioxid. Redox Signal. 2006. V. 8. P. 243–270.
Horling F., Lamkemeyer P., König J., Finkemeier I., Kandlbinder A., Baier M., Dietz K.-J. Divergent light-, ascorbate-, and oxidative stress-dependent regulation of expression of the peroxiredoxin gene family in Arabidopsis // Plant Physiol. 2003. V. 131. P. 317–325.
Scandalios J.G. Oxidative stress: Molecular perception and transduction of signals triggering antioxidant gene defenses // Braz. J. Med. Biol. Res. 2005. V. 38. P. 995−1014.
Quesada A., Galván A., Schnell R., Lefebvre P.A., Fernández E. Five nitrate assimilation related loci are clustered in Chlamydomonas reinhardtii // Mol. Gen. Genet. 1993. V. 240. P. 387−394.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


