Физиология растений, 2019, T. 66, № 2, стр. 151-155
Сравнительный анализ влияния L-гистидина на поступление никеля в побеги различных видов рода Alyssum
И. В. Серегин a, А. Д. Кожевникова a, Х. Схат b
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений им. К. А. Тимирязева Российской академии наук
Москва, Россия
b Свободный Университет
Амстердам, Нидерланды
Поступила в редакцию 20.04.2018
После доработки 09.06.2018
Принята к публикации 13.06.2018
Аннотация
В работе изучено влияние свободного L-гистидина на поступление никеля (Ni) в побеги гипераккумуляторов Alyssum murale, A. fallacinum, A. corsicum, A. tenium, A. lesbiacum, A. bertolonii, A. pintodasilvae, A. obovatum, а также близкородственного негипераккумулятора Aurinia saxatilis (ранее Alyssum saxatile). Содержание Ni в ксилемном соке растений определяли с помощью графитной и пламенной атомно-абсорбционной спектрофотометрии. Наибольшая концентрация Ni в ксилемном соке растений без предобработки L-гистидином или L-аланином была обнаружена у A. murale и A. corsicum. Установлено увеличение поступления Ni в сосуды ксилемы после предобработки L-гистидином только у двух видов гипераккумуляторов из рода Alyssum (A. pintodasilvae и A. obovatum), а также у негипераккумулятора A. saxatilis. Отсутствие увеличения содержания Ni в ксилемном соке у всех изученных видов после предобработки L-аланином свидетельствует о том, что наблюдаемый эффект специфичен для гистидина, а не является общим свойством аминокислот. Таким образом, вклад гистидина в избирательное накопление Ni в побегах может существенно различаться даже у близкородственных видов, принадлежащих к одному роду, что, по-видимому, может быть связано как с различным эндогенным уровнем гистидина в корнях, так и с особенностями транспорта и распределения металла у разных видов.
ВВЕДЕНИЕ
Одной из ключевых задач современной экологической физиологии растений является изучение механизмов, определяющих избирательное накопление металлов у двух контрастных групп растений: исключателей, у которых металлы накапливаются главным образом в корневой системе, и аккумуляторов, у которых они накапливаются преимущественно в надземных органах [1]. Среди аккумуляторов выделяют особую группу растений гипераккумуляторов. К ним относят виды, содержание цинка (Zn) и марганца (Mn) у которых превышает 1%; никеля (Ni), кобальта (Co), меди (Cu) и селена (Se) – 0.1%, а кадмия (Сd) и мышьяка (As) – 0.01% от сухой массы побегов [2]. Всего в настоящее время известно около 500 видов гипераккумуляторов, большинство из которых относится к гипераккумуляторам Ni [2–4]. Среди них около 50 видов относятся к роду Alyssum [5], что позволяет рассматривать его представителей в качестве идеальной системы для изучения феномена гипераккумуляции [6]. Способность к гипераккумуляции Ni в трибе Alysseae возникала в процессе эволюции неоднократно [6], в результате чего на территории России, стран Средиземноморья, Армении и Ирака в настоящее время произрастают виды рода Alyssum, способные накапливать в побегах от 1280 до 29400 мг Ni/кг сухой массы [2].
Гипераккумуляторы обладают высокой устойчивостью к одному или нескольким металлам и металлоидам. Способность к гипераккумуляции определяется высокой эффективностью механизмов детоксикации и транспорта металлов из корней в побеги, существенной составляющей которых является связывание металлов с хелаторами, обладающими к ним высоким сродством [4].
Наряду с глутатионом, фитохелатинами, металлотионеинами, органическими кислотами и никотианамином, к важнейшим хелаторам относится свободный гистидин [7, 8], который у Noccaea caerulescens (ранее Thlaspi caerulescens) вовлечен в механизм гипераккумуляции Ni и Zn [9, 10], но не Cd [11]. Анализ литературных источников выявил существование определенных противоречий в данных, полученных разными авторами. Так, у гипераккумулятора Alyssum lesbiacum добавление в среду L-гистидина не влияло на поступление Ni в ксилему [12], тогда как у различных экотипов гипераккумулятора N. сaerulescens в большинстве случаев наблюдалась стимуляция загрузки Ni и Zn в сосуды ксилемы [9, 10]. У исключателей эффект обработки гистидином тоже был различным. Предобработка растений L-гистидином вызывала увеличение содержания Ni в ксилемном соке Alyssum montanum [13] и Brassica juncea [12], тогда как у Тhlaspi arvense увеличения содержания как Ni, так и Zn в пасоке не наблюдалось [9, 10]. Возникает закономерный вопрос, являются ли полученные различия во влиянии экзогенного L-гистидина на поступление металлов результатом методических различий в проведении эксперимента или вклад гистидина в избирательное накопление Ni в побегах действительно может различаться даже у близкородственных видов исключателей или гипераккумуляторов. Содержание металлов в тканях и органах растений в значительной степени зависит от концентрации солей металлов, времени инкубации, условий выращивания растений [7]. Поэтому корректное сравнение данных разных авторов во многих случаях становится затруднительным. Однако решение поставленного нами вопроса кажется принципиально важным для дальнейшего изучения механизмов избирательного накопления металлов у растений, так как впервые позволит понять, насколько универсален механизм с участием гистидина и какой вклад вносит гистидин в феномен гипераккумуляции у разных видов растений. Учитывая высокую способность различных видов рода Alyssum накапливать Ni, целью работы было сравнительное изучение влияния свободного L-гистидина на поступление Ni в побеги ряда видов этого рода. Для корректного сравнения полученных в настоящей работе результатов с данными, полученными нами ранее для разных экотипов гипераккумулятора N. сaerulescens, эксперименты проводились в тех же самых условиях [9] и при одинаковой концентрации соли Ni в растворе (250 мкМ).
МАТЕРИАЛЫ И МЕТОДЫ
Выращивание растений. Семена гипераккумуляторов Ni Alyssum murale Waldst. & Kit., A. fallacinum Hausskn., A. corsicum Duby, A. tenium Halácsy, A. lesbiacum (Candargy) Rech.f., A. bertolonii Desv., A. pintodasilvae Dudley (syn. A. serpyllipholium Desf. subsp. lusitanicum Dudley & Pinto da Silva), A. obovatum (C.A. Mey.) Turcz., произрастающих на богатых Ni серпентиновых почвах, а также семена близкородственного негипераккумулятора Aurinia saxatilis (L.) Desv. (ранее Alyssum saxatile L.) проращивали в чашках Петри на смоченной водопроводной водой фильтровальной бумаге в течение двух недель при температуре 20ºС в темном термостате. Проростки пересаживали в вегетационные сосуды объемом 1 л (по 4 проростка на сосуд) на 0.5 N раствора Хогланда и выращивали в течение 8 недель в климатической камере (20/15°C день/ночь, 14-часовой световой день). В качестве среды Хогланда использовали следующие концентрации солей: KNO3 (3 мМ); Ca(NO3)2 (2 мМ); NH4HPO4 (1 мМ); MgSO4 (0.5 мМ); KCl (1 мкМ); H3BO3 (25 мкМ); ZnSO4 (2 мкМ); MnSO4 (2 мкМ); CuSO4 (0.1 мкМ); (NH4)6Mo7O24 (0.1 мкМ); Fe(Na)ЕДТА (20 мкМ). Среду доводили до рН 5.25 с помощью MES (2 мМ)/КОН, что позволило предотвратить связывание Ni и Zn c ЭДТА [14]. Питательную среду сменяли еженедельно.
Определение содержания никеля в пасоке. Перед сбором ксилемного сока 8-недельные растения инкубировали в течение 4 часов на 1 мМ растворах L-гистидина или L-аланина (рН 5.5, MES/KOH). В качестве контроля служили растения без предобработки. После предобработки корни отмывали дистиллированной водой, а побеги отрезали, после чего корневые системы инкубировали на 0.5 N раствора Хогланда в присутствии 250 мкМ NiSO4. Концентрация соли Ni была подобрана в предварительных экспериментах и не оказывала токсического действия на растения при краткосрочной инкубации. Ксилемный сок собирали в течение ночи через силиконовые трубки в микропробирки типа Эппендорф объемом 2 мл. Образцы хранили при –20°С до дальнейшего анализа, который проводили методами графитной и пламенной атомно-абсорбционной спектрофотометрии по стандартной методике [9].
Статистическая обработка данных. Эксперименты были проведены в трех независимых повторностях. Каждая повторность включала 4 растения на вариант. Количественный анализ содержания Ni в пасоке проведен в трех независимых аналитических повторностях. Полученные данные обработаны с помощью однофакторного дисперсионного анализа и представлены как средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
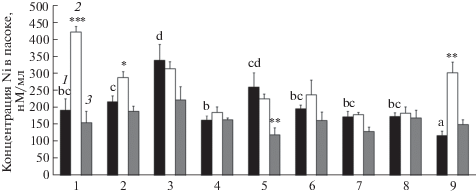
Наибольшая концентрация Ni в ксилемном соке растений без предобработки наблюдалась у A. murale и A. corsicum. У остальных гипераккумуляторов содержание металла было ниже и различия между видами были незначительными. Наименьшая концентрация Ni в ксилемном соке была выявлена у негипераккумулятора A. saxatilis.
Ранее нами было показано, что экзогенный L-гистидин поглощается корневыми системами как исключателей, так и гипераккумуляторов [9]. Анализ влияния L-гистидина на содержание Ni в ксилемном соке у разных видов рода Alyssum четко показал, что увеличение поступления Ni в сосуды ксилемы наблюдается только у двух видов гипераккумуляторов: A. pintodasilvae и A. obovatum. У остальных гипераккумуляторов содержание Ni в пасоке после предобработки L-гистидином существенно не изменялось (рис. 1). Отсутствие влияния L-гистидина на поступление Ni в ксилему гипераккумулятора A. lesbiacum показано также в работе Kerkeb и Krämer [12]. Предобработка растений L-гистидином вызывала увеличение содержания Ni в ксилемном соке негипераккумулятора A. saxatilis (рис. 1), а также у исключателей Alyssum montanum [13] и Brassica juncea [12], тогда как у исключателя Тhlaspi arvense увеличения содержания Ni в пасоке не наблюдалось [9]. Выявленные различия по влиянию предобработки L-гистидином на содержание Ni в ксилемном соке разных видов могут быть связаны с разным конститутивным уровнем гистидина в корнях этих видов. Решение этого вопроса требует дальнейшего изучения.
Рис. 1.
Влияние предобработки L-гистидином или L-аланином на содержание Ni в ксилемном соке разных видов рода A-lyssum: (1) – A. obovatum, (2) – A. pintodasilvae, (3) – A. murale, (4) – A. fallacinum, (5) – A. corsicum, (6) – A. tenium, (7) – A. lesbiacum, (8) – A. bertolonii, (9) – Aurinia saxatilis (ранее Alyssum saxatile). 1 – растения без предобработки аминокислотами, 2 – растения, предобработанные раствором L-гистидина, 3 – растения, предобработанные раствором L-аланина. Статистически достоверные различия между содержанием Ni в ксилемном соке у предобработанных и контрольных растений показаны звездочками: *р < 0.05; **р < 0.01; ***р < 0.001. Достоверно различающиеся между собой значения концентраций Ni в ксилемном соке непредобработанных растений разных видов обозначены разными буквами.
Увеличение содержания Ni и Zn в ксилемном соке после предобработки экзогенным L-гистидином наблюдалось нами ранее у четырех экотипов гипераккумулятора Nоссаеа caerulescens: La Calamine (LC, Бельгия), Saint Félix de Palliéres (SF, Франция); Monte Prinzera (MP, Италия) и Lellingen (LE, Люксембург) [9, 10]. В случае Zn была обнаружена более значительная стимуляция его загрузки в ксилему, чем в случае Ni, что может быть связано с перераспределением и мобилизацией для загрузки в ксилему Zn, накопленного в корнях до предобработки гистидином, так как Zn присутствует в растворе Хогланда [9, 10]. При низкой концентрации Ni в среде (25 мкМ), предобработка гистидином не влияла на содержание Ni в ксилемном соке у экотипа LC, для которого характерно наименьшее накопление металла в побегах, тогда как наибольший эффект даже при низкой концентрации Ni наблюдался у экотипа MP, эволюция которого проходила на серпентиновых почвах, богатых Ni. При более высокой концентрации Ni (250 мкМ) эффект гистидина отчетливо наблюдался у всех изученных экотипов N. caerulescens [9]. При инкубации выделенных из корней тонопластных везикул в среде, содержащей комплекс Ni или Zn с гистидином, поступление металлов в везикулы было значительно менее интенсивным у гипераккумулятора N. caerulescens по сравнению с исключателем T. arvense [9, 10]. Прямой количественный анализ показал, что содержание Zn в вакуолях клеток исключателя Т. arvense в 2.4 раза выше, чем у гипераккумулятора N. caerulescens. Кроме того, скорость транспорта Zn из вакуоли была примерно в 2 раза выше у N. caerulescens по сравнению с Т. arvense [15]. Учитывая высокий эндогенный уровень гистидина в корнях и более низкое содержание металлов в вакуолях клеток коры у гипераккумуляторов по сравнению с исключателями, можно предположить, что связывание металлов с гистидином ограничивает поступление металлов в вакуоли клеток коры корня, облегчая их поступление в ксилему у гипераккумуляторов, тогда как у исключателей Ni и Zn накапливаются в клетках коры [9, 10, 12, 13, 16–18]. Однако, как показывают результаты нашей работы, вклад гистидина в избирательное накопление Ni в побегах даже у близкородственных видов, принадлежащих к одному роду, может существенно различаться.
Комплексы металла с гистидином могут быть формой, в которой происходит их загрузка в ксилему [19], однако прямые доказательства этого факта в настоящее время отсутствуют. В загрузке Zn в ксилему участвует АТФаза P-типа НМА4, локализованная на плазмалемме, высокий уровень экспрессии генов которой достигается за счет увеличения числа их копий у гипераккумуляторов [4, 20, 21]. Так, например, высокий уровень транскрипции гена HMA4 у гипераккумулятора Zn Arabidopsis halleri является результатом присутствия у него трех копий гена AhHMA4 под одним промотором, тогда как у исключателя A. thaliana есть только одна копия гена AtHMA4 [21]. Уровень экспрессии гена NcHMA4 у N. caerulescens был даже выше уровня экспрессии AhHMA4 у A. halleri как в корнях, так и в побегах [22]. Механизм загрузки Ni или его комплексов в сосуды ксилемы остается в настоящее время неизученным. Возможно, эффективность его функционирования может различаться не только у гипераккумуляторов и исключателей, но и у разных представителей одной группы растений.
Поступив в сосуды ксилемы, комплексы гистидина с металлом, вероятно, частично разрушаются, так как их стабильность при рН ксилемного сока (≈ 5.5–6.2) ниже, чем при рН цитоплазмы (≈ 7.2–7.5) за счет протонирования азота имидазольной группы гистидина [23, 24]. Помимо гистидина [13], дальний транспорт Ni по сосудам ксилемы осуществляется в составе комплексов с органическими кислотами [25], никотианамином [26, 27], а также в ионной форме [28].
После предобработки аланином, который имеет в 5 раз более низкую стабильность комплексов с Ni по сравнению с гистидином [29], у большинства изученных нами видов содержание Ni в ксилемном соке не изменялось. Снижение содержания Ni наблюдалось только у A. corsicum (рис. 1). Аналогичное отсутствие увеличения содержания Ni и Zn в ксилемном соке N. caerulescens после предобработки аланином [9, 10] свидетельствует о том, что наблюдаемый эффект специфичен для гистидина, а не является общим свойством аминокислот.
Таким образом, существующие в литературе противоречивые данные по влиянию экзогенного L-гистидина на поступление Ni в побеги у разных видов не являются следствием различий в методике постановки экспериментов. Вклад гистидина в избирательное накопление Ni в побегах может существенно различаться даже у близкородственных видов, принадлежащих к одному роду, что, по-видимому, может быть связано как с различным эндогенным уровнем гистидина в корнях, так и с особенностями транспорта металла у разных видов.
Авторы выражают глубокую благодарность профессору A.J.М. Baker (Мельбурн, Австралия) за любезно предоставленные семена растений A-lyssum murale, A. fallacinum, A. corsicum, A. tenium, A. lesbiacum, A. bertolonii, A. pintodasilvae и Aurinia saxatilis, М.Н. Катаевой (БИН РАН, Санкт-Петербург) за любезно предоставленные семена растений A. obovatum, а также профессору В.Б. Иванову (ИФР РАН, Москва) за критическое обсуждение полученных результатов.
Работа выполнена при частичной финансовой поддержке проекта Российского фонда фундаментальных исследований № 15-04-02236, а также Международной научной программы LOCOMET.
Список литературы
Brooks R.R., Lee J., Reeves R.D., Jaffré T. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants // J. Geochem. Explor. 1977. V. 7. P. 49–57.
Reeves R.D., Baker A.J.M. Metal-accumulating plants // Phytoremediation of toxic metals using plants to clean up the environment / Eds. Raskin I., Ensley B.D. John Wiley & Sons, Inc. 2000. P. 193–229.
Verbruggen N., Hermans C., Schat H. Molecular mechanisms of metal hyperaccumulation in plants // New Phytol. 2009. V. 181. P. 759–776.
Krämer U. Metal hyperaccumulation in plants // Annu. Rev. Plant Biol. 2010. V. 61. P. 517–534.
Koch M., Al-Shehbaz I.A. Phylogeny of Brassica and wild relatives // Biology and breeding of crucifers / Eds. Gupta S.K. Boca Raton: Taylor and Francis Group, 2009. P. 1–19.
Cecchi L., Gabbrielli R., Arnetoli M., Gonnelli C., Hasko A., Selvi F. Evolutionary lineages of nickel hyperaccumulation and systematics in European Alysseae (Brassicaceae): evidence from nrDNA sequence data // Ann. Bot. 2010. V. 106. P. 751–767.
Серегин И.В., Кожевникова А.Д. Физиологическая роль никеля и его токсическое действие на высшие растения // Физиология растений. 2006. Т. 53. С. 285–308.
Leitenmaier B., Küpper H. Compartmentation and complexation of metals in hyperaccumulator plants // Front. Plant Sci. 2013. V. 4. P. 1–13.
Richau K.H., Kozhevnikova A.D., Seregin I.V., Vooijs R., Koevoets P.L.M., Smith J.A.C., Ivanov V.B., Schat H. Chelation by histidine inhibits the vacuolar sequestration of nickel in roots of the hyperaccumulator, Thlaspi caerulescens // New Phytol. 2009. V. 183. P. 106–116.
Kozhevnikova A.D., Seregin I.V., Erlikh N.T., Shevyreva T.A., Andreev I.M., Verweij R., Schat H. Histidine-mediated xylem loading of zinc is a species-wide character in Noccaea caerulescens // New Phytol. 2014. V. 203. P. 508–519.
Kozhevnikova A.D., Seregin I.V., Verweij R., Schat H. Histidine promotes the loading of nickel and zinc, but not of cadmium, into the xylem in Noccaea caerulescens // Plant Signal. Behav. 2014. V. 9: e29580. URL: http:// www.tandfonline.com/doi/full/10.4161/psb.29580.
Kerkeb L., Krämer U. The role of free histidine in xylem loading of nickel in Alyssum lesbiacum and Brassica juncea // Plant Physiol. 2003. V. 131. P. 716–724.
Krämer U., Cotter-Howells J.D., Charnock J.M., Baker A.J.M., Smith A.C. Free histidine as a metal chelator in plants that accumulate nickel // Nature. 1996. V. 379. P. 635–638.
Assunção A.G.L., Bookum W.M., Nelissen H.J.M., Vooijs R., Schat H., Ernst W.H.O. Differential metal-specific tolerance and accumulation patterns among Thlaspi caerulescens populations originating from different soil types // New Phytol. 2003. V. 159. P. 411–419.
Lasat M.M., Baker A.J.M., Kochian L.V. Altered Zn compartmentation in the root symplasm and stimulated Zn absorption into the leaf as mechanisms involved in Zn hyperaccumulation in Thlaspi caerulescens // Plant Physiol. 1998. V. 118. P. 875–883.
Ingle R.A., Mugford S.T., Rees J.D., Campbell M.M., Smith J.A.C. Constitutively high expression of the histidine biosynthetic pathway contributes to nickel tolerance in hyperaccumulator plants // Plant Cell. 2005. V. 17. P. 2089–2106.
Серегин И.В., Кожевникова А.Д. Роль тканей корня и побега в транспорте и накоплении кадмия, свинца, никеля и стронция // Физиология растений. 2008. Т. 55. С. 3–26.
Бакланов И.А., Серегин И.В., Иванов В.Б. Гистохимический анализ распределения никеля в гипераккумуляторе и исключателе из рода Alyssum L. // Доклады Академии наук. 2009. Т. 429. С. 698–700.
Haydon M.J., Cobbett C.S. Transporters of ligands for essential metal ions in plants // New Phytol. 2007. V. 174. P. 499–506.
Hussain D., Haydon M.J., Wang Y., Wong E., Sherson S.M., Young J., Camakaris J., Harper J.F., Cobbett C.S. P-type ATPase heavy metal transporters with roles in essential zinc homeostasis in Arabidopsis // Plant Cell. 2004. V. 16. P. 1327–1339.
Hanikenne M., Talke I.N., Haydon M.J., Lanz C., Nolte A., Motte P., Kroymann J., Weigel D., Krämer U. Evolution of metal hyperaccumulation required cis-regulatory changes and triplication of HMA4 // Nature. 2008. V. 453. P. 391–395.
Bernard C., Roosens N., Czernic P., Lebrun M., Verbruggen N. A novel CPx-ATPase from the cadmium hyperaccumulator Thlaspi caerulescens // FEBS Lett. 2004. V. 569. P. 140–148.
Salt D.E., Prince R.C., Baker A.J., Raskin I., Pickering I.J. Zinc ligands in the metal hyperaccumulator Thlaspi caerulescens as determined using X-ray absorption spectroscopy // Environ. Sci. Technol. 1999. V. 33. 713–717.
Monsant A.C., Kappen P., Wang Y., Pigram P.J., Baker A.J., Tang C. In vivo speciation of zinc in Noccaea caerulescens in response to nitrogen form and zinc exposure // Plant Soil. 2011. V. 348. 167–183.
Kersten W.J., Brooks R.R., Reeves R.D., Jaffre T. Nature of nickel complexes in Psychotria douarrei and other nickel-accumulating plants // Phytochemistry. 1980. V. 19. P. 1963–1965.
Vacchina V., Mari S., Czernic P., Marquès L., Pianelli K., Schaumlöffel D., Lebrun M., Łobiński R. Speciation of nickel in a hyperaccumulating plant by high-performance liquid chromatography-inductively coupled plasma mass spectroscopy and electrospray MS/MS assisted by cloning using yeast complementation // Anal. Chem. 2003. V. 75. P. 2740–2745.
Kim S., Takahashi M., Higuchi K., Tsunoda K., Nakanishi H., Yoshimura E., Mori S., Nishizawa N.K. Increased nicotianamine biosynthesis confers enhanced tolerance of high levels of metals, in particular nickel, to plants // Plant Cell Physiol. 2005. V. 46. P. 1809–1818.
Sagner S., Kneer R., Wanner G., Cosson J.-P., Deus-Neumann B., Zenk M.H. Hyperaccumulation, complexation and distribution of nickel in Sebertia acuminata // Phytochemistry. 1998. V. 47. P. 339–343.
Dawson R.M.C., Elliott D.C., Elliott W.H., Jones K.M. Data for biochemical research. Oxford: Clarendon Press, 1986. 580 p.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


