Физиология растений, 2019, T. 66, № 3, стр. 198-206
Фотосинтетические пигменты в растениях природной флоры таежной зоны европейского северо-востока России
О. В. Дымова a, Т. К. Головко a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
Поступила в редакцию 03.04.2018
После доработки 22.05.2018
Принята к публикации 23.05.2018
Аннотация
Исследовали содержание и качественный состав фонда фотосинтетических пигментов 160 видов растений природной флоры таежной зоны европейского северо-востока России. Показана зависимость содержания и соотношения хлорофиллов и каротиноидов от вида, жизненной формы, принадлежности к географической и эколого-ценотической группам. В целом флора наземных растений таежной зоны характеризуется сравнительно низким накоплением хлорофиллов, 2−6 мг/г сухой массы. Листья травянистых видов содержат в 1.5 раза больше хлорофилла по сравнению с древесными формами. На долю антенных (светособирающих) хлорофиллов приходится 55−65% фонда зеленых пигментов. Величина соотношения хлорофиллы/каротиноиды у растений Приполярного Урала, среди которых высока доля арктических и аркто-альпийских видов, равнялась 3, у растений среднего течения р. Вычегда, где преобладают бореальные виды, была на 35% больше. На фоне значительных межвидовых различий в накоплении фотосинтетических пигментов прослеживается увеличение относительного содержания каротиноидов в ряду бореальные – гипоарктические – арктические и аркто-альпийские виды, что указывает на повышение защитной роли каротиноидов с продвижением на север.
ВВЕДЕНИЕ
Глобальная фотосинтетическая система Земли обеспечивает введение в биосферные процессы солнечной энергии и составляет основу первичной биопродуктивности природных экосистем и фитоценозов, создаваемых человеком. Наша планета буквально покрыта оболочкой универсального оптического фотосенсибилизатора – хлорофилла, встроенного в сопрягающие мембраны растительных клеток. Ежегодно на планете трижды обновляется 300 млн т хлорофилла, синтезируется около 100 млн т каротиноидов. Хлорофиллы и каротиноиды ответственны за поглощение, передачу и преобразование световой энергии в фотосинтезе. Фотосинтетические пигменты занимают важное место в проблеме изучения фотосинтеза на всех уровнях его организации: от молекулярного до экосистемного и биосферного.
В настоящее время в связи с тенденциями глобального изменения климата и обострением проблем региональной экологии все большее внимание уделяется вопросам сохранения флористического богатства, и фитофизиологии предстоит внести свой вклад в изучение его разнообразия [1]. Всю свою научную жизнь А.Т. Мокроносов не только проявлял большой интерес, но и вместе с учениками непосредственно участвовал в изучении функционирования фотосинтеза растений в разных биомах.
А.Т. Мокроносов [2, 3] предложил рассматривать структурно-функциональную организацию ФСА на органоидном (хлоропласт) и тканево-органном (лист) уровнях, ввел понятие “мезоструктура” и разработал систему показателей для ее анализа. Исследования на многих видах растений позволили определить наиболее часто встречающиеся значения и пределы варьирования некоторых важных показателей (число хлоропластов в клетке и на единицу площади листа, объем единичного хлоропласта и всех хлоропластов клетки, отношение общей поверхности хлоропластов к площади листа) [3]. Установлено, что в одном хлоропласте светолюбивых видов содержится (1–2) × × 109 молекул хлорофилла, а тенелюбивых – в 5 раз больше. По данным R.E. Glick и A. Melis [4, 5] минимальное число хлорофиллов, необходимое для обеспечения эффективной работы ФСА, составляет 132 молекулы Хл на две фотосистемы. Показатели мезоструктуры значительно изменяются в онтогенезе листа, зависят от физиологического состояния и экологических условий произрастания растений.
Количественные и качественные изменения пигментного комплекса являются чувствительным показателем физиологического состояния растений и активности их фотосинтетического аппарата. Сведения о пигментном фонде растительного покрова необходимы для оценки стока углерода и продуктивности крупных биомов [6, 7]. Однако, несмотря на востребованность, данные о пигментной системе растений разных ботанико-географических зон и таксонов немногочисленны и противоречивы [8–18].
Целью данной работы было изучить содержание и соотношение фотосинтетических пигментов (хлорофиллов и каротиноидов) в листьях растений таежной зоны европейского северо-востока России, выявить таксономическую вариабельность и установить закономерности изменения в зависимости от жизненной формы, принадлежности к широтной и эколого-ценотической группе.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования охватывают длительный период (2002−2015 гг.). Сбор материала проводили в конце июня – первой половине июля во время экспедиционных выездов в географически удаленные точки на территории Республики Коми: Приполярный Урал в район верхнего течения р. Кожим (65°22′ с.ш., 60°46′ в.д.), Южный Тиман (62°45′ с.ш., 55°49′ в.д.), в районы, расположенные в бассейне среднего течения р. Вычегда (61°54′ с.ш., 50°16′ в.д.). Флора и растительность этих территорий подробно охарактеризована в ряде исследований [19–21]. Основные черты флоры европейского Северо-Востока сложились в плейстоцене. В настоящее время она представляет собой комплекс различных по происхождению и времени проникновения на данную территорию флористических элементов. Основу флоры составляют бореальные леса, число видов сосудистых растений − более 1200. Уровень видового богатства снижается в направлении с юга на север [20].
Приполярный Урал (подзона крайне северной тайги) отличается наиболее суровым климатом и коротким вегетационным периодом (табл. 1). Район Южного Тимана и бассейн среднего течения р. Вычегда относятся к подзоне средней тайги. Климат характеризуется как умеренно континентальный со сравнительно длинной, холодной, многоснежной зимой и умеренно теплым коротким летом.
Таблица 1.
Климатическая характеристика районов исследований*
| Показатели | Приполярный Урал 65°22′ с.ш. 60°46′ в.д. |
Южный Тиман 62°45′ с.ш. 55°49′ в.д. |
Бассейн течения р. Вычегда 61°54′ с.ш. 50°16′ в.д. |
|---|---|---|---|
| Среднегодовая температура, °С | –4.8 | –1.5 | +1 |
| Средняя температура июля, °С | +13 | +15 | +17 |
| Сумма температур выше +5°С | 1070 | 1550 | 1800 |
| Продолжительность вегетационного периода (выше +5°С), сутки | 105–110 | 133 | 150 |
| Продолжительность периода активного роста (выше +10°С), сутки | 60–70 | 89 | 100–110 |
| Сумма осадков за вегетационный период, мм | 310–350 | 315–365 | 320–365 |
Примечание. * Таблица составлена по материалам Козубов Г.М. с соавт. [19].
Всего исследован 121 вид (12–15% флоры надземных растений): на Приполярном Урале – 46, на Южном Тимане – 47, в среднем течении р. Вычегда – 48. Большинство из них относится к травам и принадлежит бореальной группе. Растения классифицировали по принадлежности к жизненной форме [22] и широтной группе [23]. Исследованные растения относятся к 46 семействам. К семействам с наибольшим числом изученных видов относятся Rosaceae (16 видов), Asteraceae (15 видов), Fabaceae (11 видов), Ericaceae (10 видов), Orchidaceae (9 видов). В 14 семействах изучено по 2−3 вида. Изученное нами число видов представляет собой репрезентативную выборку, т.е. соответствует характеристикам генеральной совокупности в целом.
Определения пигментов в листьях представителей гидрофильной флоры водоемов, расположенных в радиусе 10−150 км от г. Сыктывкара, были проведены в 2010–2016 гг. Исследованиями были охвачены высшие растения (44 вида из 27 семейств), входящие в обводненную зону, зону уреза воды (береговая линия) и переувлажненных берегов. Экологическая классификация гидрофитов дана по В.Г. Папченкову [24].
Сбор образцов, завершивших рост функционально активных листьев для определения содержания пигментов, осуществляли в 5-кратной биологической повторности, каждая включала смешанную пробу с 10–15 типичных растений. Свежесобранные образцы фиксировали в парах кипящего ацетона и содержали в темноте в холодильнике. Образцы листьев водных и прибрежно-водных макрофитов фиксировали жидким азотом и хранили в морозильной камере при температуре –76°С.
Концентрацию пигментов определяли в ацетоновой вытяжке спектрофотометрически на приборе UV-1700 (“Shimadzu”, Япония) при длинах волн 662 и 644 нм для хлорофилла a и b соответственно. Определение каротиноидов проводили при 470 нм с поправками [25, 26 ] . Долю хлорофиллов в светособирающем комплексе (ССК) рассчитывали по формуле: [(Хл b + 1.2 Хл b)/(Хл a + Хл b)], исходя из того, что весь Хл b находится в ССК ФС II, а соотношение Хл a/Хл b в этом комплексе равно примерно 1.2 [13, 27]. Содержание пигментов выражали в расчете на единицу сухой массы (мг/г).
Статистическая обработка данных проведена с помощью программы Statistica 10 (“Statsoft Inc.”, США). В качестве меры среднего использовали среднеарифметическое значение и/или медиану. Для оценки вариации использовали стандартное отклонение, дисперсию, доверительный интервал. Данные обрабатывали с использованием корреляционного анализа, описательной статистики, однофакторного и двухфакторного дисперсионного анализа (ANOVA) по месту произрастания (Приполярный Урал, Южный Тиман, бассейн среднего течения р. Вычегда), таксономическому положению (вид), жизненной форме (травы, древесные), географическому положению (широтная группа). Статистическую значимость различий между независимыми выборками оценивали с помощью теста Дункана. Р-величину рассчитывали при заданном уровне значимости α = 0.05. В таблицах и на рисунках, если не указано иное, приведены средние величины со стандартной ошибкой.
РЕЗУЛЬТАТЫ
Содержание хлорофиллов
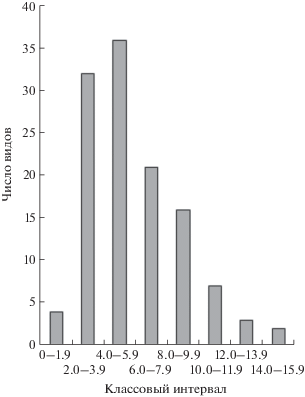
Анализ данных выявил, что концентрация зеленых пигментов в листьях исследованных видов наземных растений таежной зоны варьирует в широком диапазоне, 1–17 мг/г. Распределение видов по содержанию хлорофиллов имеет левосторонний характер (рис. 1). Большая часть видов (57%) характеризуется сравнительно низким накоплением Хл, от 2 до 6 мг/г. У 30% видов величина этого показателя находилась в пределах 6−10 мг/г. Доля видов с очень низким (<1.9 мг/г) и высоким (12−17 мг/г) содержанием Хл составляла менее 10% всей выборки.
Рис. 1.
Распределение видов растений таежной зоны по содержанию хлорофиллов (мг/г сухой массы) (n = = 121). Значения концентраций хлорофиллов разделены по классам. Для одноименных видов использованы усредненные данные. Тест Шапиро-Уилк показал распределение, отличное от нормального (уровень значимости p < 0.0001).
Среди изученных растений превалировали травы (свыше 65%). У травянистых видов наиболее высоким содержанием пигментов характеризовались более эволюционно продвинутые цветковые растения. Наименьшим содержанием пигментов отличались плауны. Промежуточную позицию занимали папоротники.
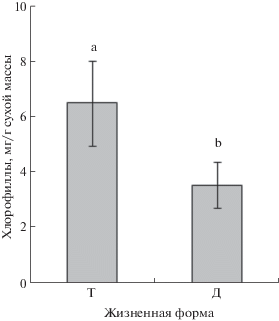
Как и следовало ожидать, фонд пигментов в листьях травянистых растений был существенно больше по сравнению с древесными (рис. 2). В среднем фонд Хл в листьях травянистых видов в 1.5 раза больше, чем в листьях представителей древесной жизненной формы.
Рис. 2.
Содержание хлорофиллов в листьях растений таежной зоны: Т – травы (цветковые и споровые) (n = = 105), Д – древесные (деревья, кустарники, кустарнички) (n = 30). Латинские буквы обозначают значимость различий показателей по группам (тест Дункана, α = 0.05). F – значение критерия Фишера при однофакторном дисперсионном анализе (F = 28.2, p < < 0.0001).
В общем фонде хлорофилла превалирует Хл а. У большинства изученных видов наземных растений величина соотношения Хл a/b находится в пределах 2.0–3.5. Известно, что часть Хл а и весь Хл b локализован в антенных комплексах фотосистем. Это означает, что значительная доля зеленых пигментов принадлежит светособирающим комплексам (ССК). На долю ССК приходится в среднем 55–65% всего фонда хлорофилла листьев. В то же время, нами обнаружено небольшое число видов (7), у которых величина Хл a/b составляла 3.6–4.0, а доля Хл в ССК была меньше 50%.
Определения пигментов в листьях 10 видов высших водных и 34 видов прибрежно-водных и заходящих в воду береговых растений показали, что содержание зеленых пигментов у них варьировало от 3.4 до 13.1 мг/г. У подавляющего числа видов (71%) концентрация Хл в листьях составляла 6–10 мг/г, у 20% видов – 4–6 мг/г. Значительное накопление зеленых пигментов (свыше 10 мг/г) отмечено у 9% видов (рис. 3). У большинства изученных гидрофитов величина соотношения Хл a/b варьировала в пределах 2.4−2.8, а доля Хл в ССК превышала 55% от общего фонда зеленых пигментов.
Содержание каротиноидов
Каротиноиды являются обязательным компонентом пигментной системы листьев растений и выполняют ряд важных функций. Являясь дополнительными пигментами в процессе поглощения световой энергии, они играют важную роль в защите ФСА.
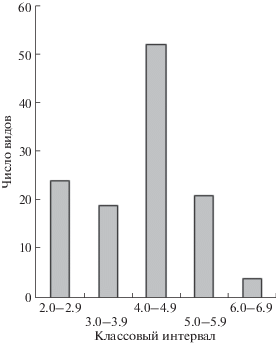
Количество каротиноидов в листьях наземных растений варьировало в широких пределах, 0.2–5.1 мг/г, и тесно коррелировало с содержанием хлорофилла (r = 0.77) (рис. 4а). У большинства исследованных видов величина соотношения Хл/Кар составляла 4–5 (рис. 5). Виды с высоким соотношением Хл/Кар (>5) составляли менее 20% всей выборки. Доля видов со сравнительно низким соотношением Хл/Кар (2.0–3.9), а, следовательно, высоким относительным содержанием каротиноидов составляла 35%.
Рис. 4.
Связь между содержанием хлорофиллов и каротиноидов в листьях растений таежной зоны европейского Северо-Востока: (а) – наземные виды, произрастающие на Приполярном Урале, Южном Тимане, бассейне среднего течения р. Вычегда (n = 121); (б) – водные и прибрежно-водные виды (n = 44). Уровень значимости p < 0.0001.
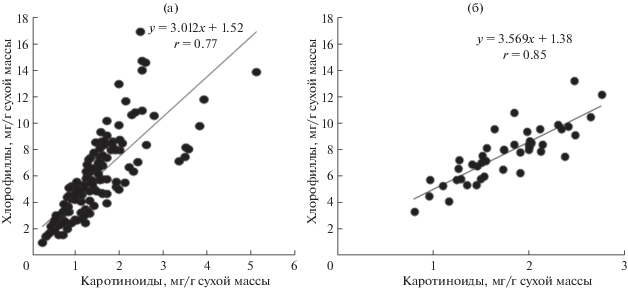
Рис. 5.
Распределение видов растений таежной зоны по соотношению хлорофиллы/каротиноиды (n = = 121). Величины соотношения Хл/Кар разделены по классам. Для одноименных видов использованы усредненные данные. Тест Шапиро-Уилк показал распределение, отличное от нормального (уровень значимости p < 0.03).
Как и у наземных растений, у водных макрофитов имела место положительная статистически значимая корреляция между содержанием Хл и Кар (рис. 4б). У 55% исследованных видов величина соотношения Хл/Кар составляла 4–5, у 18% – больше 5, у остальных – меньше 4.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о высокой вариабельности фонда фотосинтетических пигментов в растениях таежной зоны, что в значительной степени обусловлено их таксономической принадлежностью. Значение фактора “вид” подтверждается данными дисперсионного анализа (табл. 2). В данном контексте видоспецифичность отражает генотипически обусловленную совокупность признаков, включая морфофизиологические и биохимические свойства растительного организма. Так, например, нами выявлено, что среди всех исследованных видов наиболее богаты хлорофиллом были представители рода A-stragalus (A. norvegicus Grauer и A. frigidus (L.) A. Gray) и Hedisarum arcticum B. Fedtsh., обитающие на Приполярном Урале [14]. Для этих видов, относящихся к семейству Fabaceae, характерно высокое содержание азота и повышенный уровень метаболической активности [28]. Дисперсионный анализ подтвердил также ожидаемые различия между травянистыми и древесными растениями в содержании пигментов (рис. 2). Среди древесных листья вечнозеленых хвойных деревьев (Picea obovata Ledeb., Pinus sibirica Du Tour, Abies sibirica Ledeb.) и кустарничков (Diapensia lapponica L., Vaccinium uliginosum L., Empetrum hermaphroditum (Lange), Phyllodoce caerulea (L.) Bab) содержали в 2–3 раза меньше пигментов, чем листья листопадных древесных видов (Salix reticulate L., Betula nana L.), у которых концентрация достигала 5–6 мг/г сухой массы. По-видимому, в этом случае, наряду с отличиями в жизненной стратегии и метаболической активности, значение имеет соотношение тканей в листе. У вечнозеленых листьев (хвои) сильнее развиты механические ткани, клеточные оболочки, кутикула [29]. По содержанию хлорофиллов и каротиноидов исследованные нами вечнозеленые растения не отличались существенно от одноименных и близкородственных видов лесного и горно-тундрового пояса Хибин [10].
Таблица 2.
Результаты однофакторного дисперсионного анализа по влиянию факторов на содержание хлорофиллов, каротиноидов и их соотношение в листьях 121 вида растений таежной зоны
| Фактор | F | p | Значимость |
|---|---|---|---|
| Хлорофиллы | |||
| Район | 2.46 | 0.089 | н.з. |
| Вид | 2.40 | 0.007 | ** |
| Семейство | 5.12 | 0.000 | *** |
| Жизненная форма | 20.2 | 0.000 | *** |
| Широтная группа | 2.13 | 0.099 | н.з. |
| Ценотическая группа | 0.77 | 0.545 | н.з. |
| Каротиноиды | |||
| Район | 0.85 | 0.431 | н.з. |
| Вид | 2.90 | 0.002 | ** |
| Семейство | 2.96 | 0.000 | *** |
| Жизненная форма | 14.74 | 0.000 | *** |
| Широтная группа | 0.84 | 0.474 | н.з. |
| Ценотическая группа | 4.57 | 0.002 | ** |
| Хлорофиллы/Каротиноиды | |||
| Район (Урал, Тиман, Вычегда) | 21.73 | 0.000 | *** |
| Вид | 1.69 | 0.065 | н.з. |
| Семейство | 1.80 | 0.009 | * |
| Жизненная форма | 0.66 | 0.416 | н.з. |
| Широтная группа | 3.42 | 0.017 | * |
| Ценотическая группа | 4.34 | 0.002 | ** |
Несмотря на значительную дифференциацию видов по содержанию фотосинтетических пигментов, в целом растительность таежной зоны характеризуется весьма умеренным их накоплением. Статистический анализ показал (табл. 3), что средние значения содержания хлорофиллов в растениях из географически удаленных районов таежной зоны составляли 5–7 мг/г сухой массы. В этом отношении она мало отличается от растительности арктических тундр [12, 18], степей Забайкалья и Южного Урала [11, 17], пойменных лугов и остепненных пустынь Монголии [16].
Таблица 3.
Содержание фотосинтетических пигментов в листьях наземных растений из трех географически удаленных районов таежной зоны на европейском Северо-Востоке (n = 121)
| Статистические показатели | Приполярный Урал | Южный Тиман | Бассейн р. Вычегда |
|---|---|---|---|
| n | 45 | 47 | 48 |
| Хлорофиллы (a + b), мг/г сухой массы | |||
| Среднее, X | 5.10 | 5.90 | 6.55 |
| Стандартное отклонение, SD | 2.66 | 2.83 | 3.59 |
| Минимум, Min | 1.00 | 1.47 | 1.73 |
| Медиана, Med | 4.95 | 5.65 | 5.36 |
| Максимум, Max | 13.90 | 14.05 | 16.97 |
| Доверительный интервал, CI | 0.38 | 0.40 | 0.52 |
| P-величина | 0.068 | ||
| Каротиноиды, мг/г сухой массы | |||
| Среднее, Х | 1.55 | 1.41 | 1.36 |
| Стандартное отклонение, SD | 0.97 | 0.77 | 0.64 |
| Минимум | 0.23 | 0.31 | 0.39 |
| Медиана | 1.30 | 1.28 | 1.33 |
| Максимум | 5.10 | 3.54 | 2.77 |
| Доверительный интервал, CI | 0.14 | 0.11 | 0.09 |
| P-величина | 0.525 | ||
| Хлорофиллы/Каротиноиды | |||
| Среднее, Х | 3.4 | 4.4 | 4.8 |
| Стандартное отклонение, SD | 0.9 | 0.9 | 1.0 |
| Минимум | 2.1 | 2.1 | 2.6 |
| Медиана | 3.1 | 4.6 | 4.8 |
| Максимум | 5.7 | 5.7 | 6.9 |
| Доверительный интервал, CI | 0.14 | 0.13 | 0.15 |
| P-величина | 0.00001 | ||
Как и в случае с хлорофиллами, выявлена статистически значимая зависимость содержания каротиноидов от таксономического положения (табл. 2). Несмотря на значительную видовую вариабельность по содержанию каротиноидов, средние значения находились в пределах 1.3–1.5 мг/г (табл. 3).
По содержанию каротиноидов изученные нами растения таежной зоны более сходны с арктическими, чем со степными растениями. Так, для сравнения, содержание каротиноидов в листьях степных и лесостепных растений Поволжья составляло 0.5–0.9 мг/г [30], растений пустынь Гоби и Каракумы 0.9–1.1 мг/г [12], растений Западного Шпицбергена – 1.1−1.6 мг/г [18], а в высокогорьях Памира достигало 2.6 мг/г [12].
Мы проанализировали содержание и соотношение пигментов в растениях трех географически удаленных точек и в зависимости от их принадлежности к широтной группе. Не выявили статистически значимых различий между средними значениями, характеризующими содержание хлорофиллов и каротиноидов в листьях растений Приполярного Урала, Южного Тимана и бассейна р. Вычегда (табл. 3). Тем не менее, четко прослеживается тенденция уменьшения содержания хлорофилла и увеличения количества каротиноидов при продвижении на север. В результате снижается величина соотношения Хл/Кар (рис. 6).
Рис. 6.
Содержание хлорофиллов (а) и величина соотношения хлорофиллы/каротиноиды (б) в листьях растений таежной зоны (n = 121), представляющих разные географические элементы: А + АА – арктический и аркто-альпийский, ГИП – гипоарктический, Б – бореальный. Латинские буквы обозначают значимость различий показателей по группам (тест Дункана, α = 0.05). F – значение критерия Фишера при однофакторном дисперсионном анализе (F = 3.93, p < 0.02 для (а); F = 4.68, p < 0.01 для (б)).

Следует отметить, что среди растений Приполярного Урала высока доля видов арктической и аркто-альпийской группы, полностью отсутствующих в бассейне р. Вычегда. Сопоставление растений по принадлежности к широтной группе выявило, что арктические и аркто-альпийские виды не различались значимо по содержанию Хл (рис. 6а). Вместе с тем, у бореальных видов достоверно больше (на 20%), чем у арктических и аркто-альпийских величина соотношения Хл/Кар (рис. 6б). Следовательно, арктические и аркто-альпийские виды характеризуются повышенным относительным содержанием каротиноидов. Другими словами, в пигментном комплексе арктических и аркто-альпийских видов выше доля каротиноидов по отношению к хлорофиллу. Каротиноиды – соединения липидной природы с ненасыщенными двойными связями, увеличивают гибкость мембран хлоропластов, что важно для функционирования ФСА в условиях пониженных температур. Кроме того, каротиноиды могут функционировать как дополнительные светосборщики в период “белых ночей”. Как известно, в спектре рассеянной радиации увеличивается процентное содержание сине-фиолетовых лучей, поглощаемых каротиноидами.
В некоторых работах [12, 13] приведены значения соотношения Хл/Кар для растений разных регионов. По величине этого показателя растения Приполярного Урала (3.4) ближе всего к высокогорным растениям Восточного Памира, растения Южного Тимана (4.4) – к арктическим растениям Таймыра, а виды, произрастающие в бассейне среднего течения р. Вычегда (4.8) – к бореальным видам умеренной зоны. Снижение относительного содержания хлорофиллов с продвижением в высокие широты [12, 13] коррелирует с изменением хлорофильного индекса (ХИ, показатель проективного запаса Хл в растительном покрове). На территории Северной Евразии его величина уменьшается от 35–40 кг/га в средней и южной тайге до 3–4 кг/га в тундре [6, 7]. По-видимому, снижение продуктивности и ХИ обусловлено торможением ростовых процессов пониженными температурами и дефицитом азота в почве [9, с. 134−136].
Высшие водные и прибрежно-водные растения значимо не отличались от наземных цветковых трав, произрастающих в бассейне р. Вычегда, по величине соотношения хлорофиллы/каротиноиды и содержанию хлорофиллов. Исходя из того, что на долю антенных хлорофиллов приходилось в среднем 55% фонда зеленых пигментов, можно говорить о том, что повышенное относительное содержание Хл b обеспечивает эффективный светосбор погруженных листьев в толще воды.
Сопоставление наземных растений, относящихся к разным эколого-ценотическим группам показало, что лесные, луговые, скальные виды не отличались значимо по содержанию зеленых пигментов (табл. 2). Содержание каротиноидов и соотношение хлорофиллы/каротиноиды достоверно зависело от фактора “ценотическая группа”.
ЗАКЛЮЧЕНИЕ
Нами получены и проанализированы данные о фонде фотосинтетических пигментов листьев 121 вида наземных и 44 видов гидрофильной флоры таежной зоны европейского северо-востока России. Показано, что содержание хлорофиллов варьировало в широких пределах, от 1 до 17 мг/г сухой массы, у большей части наземных растений было сравнительно низким и составляло 2−6 мг/г сухой массы. Травянистые растения накапливали в 1.5 раза больше хлорофилла, чем древесные. Существенная часть зеленых пигментов (55−65%) принадлежит ССК фотосистем, что свойственно представителям флоры бореальной зоны. Судя по величине Хл/Кар, относительное содержание каротиноидов возрастало в ряду бореальные – гипоарктические – аркто-альпийские виды. Это указывает на повышение роли каротиноидов с продвижением на север.
Таким образом, нами установлены различия в содержании и соотношении фотосинтетических пигментов в листьях растений бореальной зоны, обусловленные видовыми особенностями, жизненной формой и принадлежностью к широтной группе. Это не исключает влияния на пигментный комплекс растений интенсивности и спектрального состава лучистой энергии, теплового и водного режима, условий воздушного и почвенного питания в конкретных местообитаниях. В целом для растений природной флоры бореальной зоны характерно невысокое содержание хлорофиллов, соотношение Хл a/b находится в пределах 2.0–3.5. Результаты работы дополняют характеристику флористического разнообразия таежной зоны, могут быть использованы как базовые при прогнозировании продуктивности, оценки стока углерода, верификации спектральных характеристик растительного покрова, полученных методами дистанционного зондирования.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственных заданий Института биологии Коми научного центра Уральского отделения Российской академии наук (регистрационный номер АААА-А17-117033010038-7) и программы Уральского отделения Российской академии наук (регистрационный номер АААА-А18-118012290132-0).
Список литературы
Мокроносов А.Т. Физиология растений на рубеже XXI века // Физиология растений. 2000. Т. 47. С. 341–342.
Мокроносов А.Т. Мезоструктура и функциональная активность фотосинтетического аппарата // Мезоструктура и функциональная активность фотосинтетического аппарата / Под ред. Мокроносова А.Т., Борзенковой Р.А., Цельникер Ю.Л., Некрасовой Г.Ф. Свердловск: Уральский ун-т, 1978. С. 5–31.
Мокроносов А.Т. Онтогенетический аспект фотосинтеза. М.: Наука, 1981. 196 с.
Glick R.E. Minimum photosynthetic unit size in system-I and system-II of barley chloroplasts // Biochim. Biophys. Acta. 1988. V. 934. P. 151–155.
Melis A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency // Plant Sci. 2009. V. 177. P. 272−280.
Воронин П.Ю., Ефимцев Е.И., Васильев А.А., Ватковский О.С., Мокроносов А.Т. Проективное содержание хлорофилла и биоразнообразие растительности основных ботанико-географических зон России // Физиология растений. 1995. Т. 42. С. 295−302.
Воронин П.Ю. Континентальный растительный покров как глобальный фактор фотосинтетического стока атмосферного углерода и эмиссии органического углерода при аридизации климата Северной Евразии // Фотосинтез: физиология, онтогенез, экология / Под ред. Роньжиной Е.С. Калининград: Изд-во ФГОУ ВПО “КГТУ”, 2009. С. 52−125.
Любименко В.Н. Избранные труды. Работы по фотосинтезу и пигментам растений / В. Н. Любименко. Киев: Академия наук Украинской ССР, 1963. Т. 2. 681 с.
Larcher W. Physiological plant ecology. Ecophysiology and stress physiology of functional groups. Fourth Edition. Springer-Verlag: Berlin, Heidelberg, New-York, 2003. 513 p.
Лукьянова Л.М., Локтева Т.Н., Булычева Т.М. Газообмен и пигментная система растений Кольской Субарктики (Хибинский горный массив) / Под ред. Вознесенского В.Л. Апатиты: Кольский филиал АН СССР, 1986. 128 с.
Буинова М.Г. Пигменты растений Западного Забайкалья // Ботанический журнал. 1987. Т. 72. № 8. С. 1089–1097.
Попова И.А., Маслова Т.Г., Попова О.Ф. Особенности пигментного аппарата растений разных ботанико-географических зон // Эколого-физиологические исследования фотосинтеза и дыхания растений / Под ред. Семихатовой О.А. Л.: Наука, 1989. С. 115–130.
Maslova T.G., Popova I.A. Adaptive properties of the pigment systems // Photosynthetica. 1993. V. 29. P. 195–203.
Головко Т.К., Дымова О.В., Табаленкова Г.Н. Пигментный аппарат растений Приполярного Урала // Ботанический журнал. 2007. Т. 92. № 11. С. 1732−1741.
Головко Т.К., Далькэ И.В., Дымова О.В., Захожий И.Г., Табаленкова Г.Н. Пигментный комплекс растений природной флоры европейского северо-востока // Известия Коми научного центра УрО РАН. 2010. № 1. С. 39–46.
Слемнев Н.Н., Шереметьев С.Н., Маслова Т.Г., Цоож Ш., Алтанцоож А. Разнообразие фотосинтетического аппарата растений Монголии: анализ биологических, экологических и эволюционных рядов // Ботанический журнал. 2012. Т. 97. № 11. С. 1377−1396.
Иванов Л.А., Иванова Л.А., Ронжина Д.А., Юдина П.К. Изменение содержания хлорофиллов и каротиноидов в листьях степных растений вдоль широтного градиента на Южном Урале // Физиология растений. 2013. Т. 60. С. 856−864.
Марковская Е.Ф., Шмакова Н.Ю. Растения и лишайники Западного Шпицбергена: экология, физиология. Петрозаводск: изд-во ПетрГУ, 2017. 270 с.
Козубов Г.М., Мартыненко В.А., Дёгтева С.В., Галенко Э.П., Забоева И.В. Лесорастительное районирование Республики Коми // Леса Республики Коми / Под ред. Козубова Г.М., Таскаева А.И. М.: издательско-продюсерский центр “Дизайн. Информация. Картография”, 1999. С. 257–288.
Биологическое разнообразие Республики Коми / Под ред. Пономарева В.И., Татаринова А.Г. Сыктывкар: Институт биологии Коми НЦ УрО РАН, 2012. 264 с.
Флоры, лихено- и микобиоты особо охраняемых ландшафтов бассейнов рек Косью и Большая Сыня (Приполярный Урал, национальный парк “Югыд ва”) / Под ред. Дегтевой С.В. М.: Товарищество научных изданий КМК, 2016. 483 с.
Серебряков И.Г. Жизненные формы высших растений и их изучение // Полевая геоботаника. М., Л.: Наука, 1964. Т. 3. С. 146–205.
Флора европейского Северо-Востока. Т. 3. Л.: Наука, 1976. С. 104–150.
Папченков В.Г. О классификации макрофитов водоемов и водной растительности // Экология. 1985. № 6. С. 8–13.
Маслова Т.Г., Попова И.А., Попова О.Ф. Критическая оценка спектрофотометрического метода количественного определения каротиноидов // Физиология растений. 1986. Т. 33. С. 615–619.
Методика измерений массовой доли пигментов спектрофотометрическим методом (фиксация и экстракция диметилкетоном). Растительные материалы: свидетельство об аттестации методики измерений / Е.В. Ванчикова, Б.М. Кондратенок, И.Г. Захожий, О.А. Кузиванова; Федеральное государственное бюджетное учреждение науки Институт биологии Коми научного центра Уральского отделения Российской академии наук. № 88-17641-077-2014, дата выдачи свидетельства 02.10.2014, ФР.1.31.2014.19218. Сыктывкар, 2014. 23 с.
Lichtenthaler H.K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes // Methods in Enzymology / Ed. Colowick S.P., Kaplan N.O. San Diego: Academic Press, 1987. P. 350–382.
Головко Т.К., Далькэ И.В., Табаленкова Г.Н., Гармаш Е.В. Дыхание растений Приполярного Урала // Ботанический журнал. 2009. Т. 94. № 8. С. 1216−1226.
Горышина Т.К. Фотосинтетический аппарат растений и условия среды. Л.: изд-во Ленинградского университета, 1989. 204 с.
Иванов Л.А., Ронжина Д.А., Иванова Л.А. Изменение листовых параметров как показатель смены функциональных типов степных растений вдоль градиента аридности // Физиология растений. 2008. Т. 55. С. 332−339.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



