Физиология растений, 2019, T. 66, № 3, стр. 230-240
Влияние водного фактора на реакцию растений Cucumis sativus L. на кратковременное ежесуточное понижение температуры
Т. Г. Шибаева a, Е. Г. Шерудило a, Е. Н. Икконен a, А. Ф. Титов a
a Институт биологии Карельского научного центра Российской академии наук,
Федеральный исследовательский центр “Карельский научный центр РАН”
Петрозаводск, Россия
Поступила в редакцию 29.12.2017
После доработки 28.05.2018
Принята к публикации 16.07.2018
Аннотация
Изучали влияние относительной влажности воздуха (ОВВ) и режима полива на реакцию растений Cucumis sativus L. на ежесуточное кратковременное (2 ч) понижение температуры до 10°С (ДРОП-воздействия). Растения выращивали при условно высокой (80%) или низкой (30%) ОВВ в условиях нормального полива или в режиме искусственно создаваемой “периодической засухи”. Показано, что ОВВ и режим полива оказывают сильное количественное и качественное влияние на реакцию растений на ДРОП-воздействия. В условиях высокой ОВВ ДРОП-воздействия оказывали значительный морфогенетический эффект, увеличивая биомассу и компактность растений. В условиях низкой ОВВ эффекты ДРОП-воздействий на компактность растений нивелировались из-за сильного морфогенетического эффекта самой ОВВ и значительного снижения биомассы растений в результате ДРОП-воздействий при “засухе”. Режим полива по-разному влиял на эффект ДРОП-воздействий в зависимости от ОВВ. При высокой ОВВ ДРОП-воздействия в сочетании с “засухой” приводили к увеличению компактности растений, а также их устойчивости к действию низкой температуры. Кроме того, эти растения становились более устойчивыми к водному стрессу, индуцированному низкой температурой (4°С). При низкой ОВВ увеличения компактности растений под влиянием ДРОП-воздействий не происходило.
ВВЕДЕНИЕ
Температура является одним из ведущих факторов внешней среды, который оказывает глубокое и всестороннее влияние на жизнедеятельность растений. Поэтому ее роль в жизни растений изучают многие годы, и за это время опубликовано огромное количество работ, посвященных различным аспектам реакции растительного организма на действие этого фактора, среди которых важное место занимают публикации о влиянии на растения низких положительных и отрицательных температур. В фокусе этих работ обычно находятся вопросы холодовой адаптации и/или холодового повреждения растений. Причем и в том, и в другом случае, как правило, изучаются эффекты постоянного (круглосуточного) действия низкой температуры на растения. Между тем, рост растений в естественных условиях даже в теплое время (в период активной вегетации) происходит на фоне постоянных флуктуаций температуры в суточном цикле, причем очень часто с выходом за пределы оптимума. Более того, при относительно высоких значениях среднесуточной температуры довольно часто наблюдаются резкие понижения температуры в ночное время или в предутренние часы. В этом случае воздействие низких температур на растения оказывается непродолжительным (от 1 до нескольких часов) и ежесуточно сменяется достаточно продолжительным периодом действия оптимальных температур, поэтому последствия непродолжительного холодового воздействия не всегда очевидны и в силу этого долго не привлекали внимания исследователей. Вместе с тем известно, что кратковременные ежесуточно повторяющиеся воздействия низких положительных (субповреждающих) температур способны оказывать на растения хорошо выраженный морфогенетический эффект, который, прежде всего, проявляется в торможении линейного роста надземных органов растений [1–3]. Эти наблюдения и соответствующие эксперименты привели к разработке агротехнического приема, который получил название “temperature drop” (в Европе) и “temperature dip” или “cool morning pulse” (в США). Ежесуточное кратковременное понижение температуры − ДРОП-воздействия (от англ. drop – падение, понижение) − применяются для получения компактной, более жизнеспособной рассады овощных культур и клумбовых растений и при выращивании цветочных растений в тепличных условиях. С этой целью обычно снижают температуру на 5−15°С на 2−3 ч в конце ночи. Во многих случаях это позволяет полностью или частично отказаться от использования химических регуляторов роста (ретардантов). Однако, несмотря на широкое применение, данный агротехнический прием изучали главным образом в плане подбора параметров ДРОП-воздействий (выбор значения используемой температуры, продолжительности ее действия и времени понижения температуры в суточном цикле), позволяющих получить наилучшие в практическом плане результаты [3–6]. Влияние внутренних и внешних факторов на реакцию растений на ДРОП-воздействия изучено очень слабо, хотя такого рода информация крайне важна и в теоретическом, и в практическом плане. Ранее нами был показан н-еодинаковый отклик зрелых (завершивших активный рост) и растущих листьев на ДРОП-воздействия и то, что индукция вызванных ими защитно-приспособительных реакций зависит от возраста листа [7, 8]. В ряде работ [4, 9–11] показано влияние светового фактора на реакцию растений на ДРОП-воздействия. В частности, отмечено, что эффекты ДРОП-воздействий на растения, прежде всего, различаются в зависимости от того, осуществляются они на свету или в темноте. На свету ДРОП-воздействия вызывают у растений более ощутимые изменения в фотосинтетическом аппарате, приводящие в итоге к снижению скорости накопления биомассы. Важную роль в реакции растений на ДРОП-воздействия могут играть и световые условия (интенсивность освещения), в которых выращивают растения, а также их светотребовательность [9]. Кроме того, эксперименты, проведенные с 20 различными видами и сортами растений, отчетливо показали, что эффективность ДРОП-воздействий может зависеть и от фотопериода [12]. В отличие от света, влияние водного фактора (относительной влажности воздуха и/или содержания воды в корнеобитаемой среде) на реакцию растений на ДРОП-воздействия пока не изучалось, хотя хорошо известно, что влажность воздуха и водообеспеченность растений существенным образом влияют на их рост и морфогенез, а прием “периодической засухи” и создание нелетального водного дефицита тоже используют в растениеводстве с целью торможения роста растений как альтернативу применения ретардантов [1, 13].
Исходя из изложенного выше цель данной работы заключалась в изучении влияния относительной влажности воздуха и обеспеченности растений водой (создаваемой определенным режимом полива) на реакцию растений огурца на ДРОП-воздействия.
МАТЕРИАЛЫ И МЕТОДЫ
Растения огурца (Cucumis sativus L., гибрид Зозуля F1) выращивали в камере искусственного климата (“Vötsch”, Германия) методом песчаной проливной культуры при поливе питательным раствором (в мг/л: 226 N, 55 P, 370 K, 180 Ca, 40 Mg, 45 S, 17 Na, 52 Cl, 2.5 Fe, 0.6 Mn, 0.35 B; 0.3 Zn, 0.15 Cu и 0.05 Mo; рН 6.2−6.4), температуре воздуха 23°С, ФАР 150 мкмоль/(м2 с), фотопериоде 12 ч. Все опыты проводили при низкой (30 ± 5%) или высокой (80 ± 5%) относительной влажности воздуха (ОВВ).
Начиная с 6 суток от замачивания семян, когда развернулись семядольные листья, применяли разные режимы полива − ежедневный полив (вариант “полив”) или полив после высыхания субстрата (1 раз в 2–3 дня), создавая тем самым условия так называемой “периодической засухи” (вариант “засуха”).
Начиная с 14 суток от замачивания семян, когда первый настоящий лист находился в фазе активного роста, достигнув половины окончательного размера, растения в течение 6 суток подвергали действию температуры 10°С в течение 2 ч (плюс 30 мин на снижение и 30 мин на повышение температуры) в конце ночного периода (вариант ДРОП). Температуру снижали и повышали со скоростью 0.4°С/мин. Контролем служили растения, не подвергавшиеся низкотемпературным воздействиям.
По окончании ДРОП-воздействий часть растений всех вариантов (контроль и ДРОП) подвергали холодовому тестированию в темноте в течение 1 суток при температуре 4°С и влажности воздуха 90–100%. После этого их помещали на восстановление на 1 сутки в условия температуры 23°С.
Все измерения проводили через сутки после завершения ДРОП-воздействий или через сутки после завершения ходового тестирования.
Определяли высоту растений, длину черешков листьев, площадь листовой поверхности, число листьев (достигших длины 10 мм и более) и сухую биомассу частей растений (листья, стебли, корни). Компактность растений (мг/см) рассчитывали как отношение сухой массы растения к его высоте. Общее содержание хлорофиллов a и b определяли с помощью измерителя уровня хлорофилла SPAD 502 Plus (“Konica Minolta”, Osaka, Япония). Для измерения флуоресценции хлорофилла использовали анализатор фотосинтеза с импульсно-модулированным освещением (MINI-PAM, “Walz”, Германия). Определяли потенциальный квантовый выход фотохимической активности ФС II (Fv/Fm) после 20-минутной темновой адаптации листьев. Величину относительного содержания воды (ОСВ) рассчитывали как процент содержания воды в опытной растительной ткани от ее содержания в той же ткани в состоянии полного насыщения.
Газообмен листьев, транспирацию, устьичную проводимость и отношение содержания СО2 в межклеточном пространстве к его содержанию в окружающем воздухе измеряли на первом листе с использованием портативной фотосинтетической системы HCM-1000 (“Walz”) при температуре листа 23°С и при 1000 мкмоль/(м2 с) ФАР. Влажность воздуха на входе в листовую камеру-прищепку составляла 62–65%. Все измерения газообмена начинали не ранее чем через 2 ч после наступления светового периода. Темновое дыхание измеряли при 0 мкмоль/(м2 с) ФАР у растений, адаптированных к темноте в течение 30 минут.
Об устойчивости листьев к низким температурам судили по холодоустойчивости клеток листа (ЛТ50), а о холодоустойчивости растений и устойчивости к водному стрессу − по относительному выходу электролитов (ОВЭ) из тканей листа и интенсивности перекисного окисления липидов (ПОЛ) по содержанию малонового диальдегида (МДА).
Холодоустойчивость клеток листа оценивали по температуре (ЛТ50), вызывающей гибель 50% палисадных клеток листовых высечек после их промораживания в течение 5 минут в термоэлектрическом микрохолодильнике ТЖР-02/-20 (“Интерм”, Россия) при последовательном снижении тестирующей температуры с шагом 0.4°С [14]. Жизнеспособность клеток определяли с помощью светового микроскопа Микмед-2 (“ЛОМО”, Россия) по коагуляции цитоплазмы и деструкции хлоропластов.
Относительный выход электролитов (ОВЭ) из тканей листа определяли кондуктометрически с использованием кондуктометра Эксперт-002 с датчиком для микрообъемов УЭП-П-С (“Эконикс-Эксперт”, Россия).
Содержание МДА определяли по методике Heath и Packer [15]. Листья (0.1 г) растирали в 2 мл 20% трихлоруксусной кислоты (ТХУ). Гомогенат центрифугировали при 15000 g в течение 10 мин; 1 мл надосадочной жидкости смешивали с 1 мл 20% ТХУ, содержавшей 0.5% тиобарбитуровой кислоты. Смесь нагревали в течение 30 минут при 95ºС и затем центрифугировали 5 минут при 10 000 g. Концентрацию МДА определяли спектрофотометрически, измеряя оптическую плотность при 532 нм и неспецифичное поглощение при 600 нм. Для расчета содержания МДА использовали коэффициент экстинкции, равный 155 мМ–1 см–1. Концентрацию МДА выражали в мкмоль/г сухой массы листьев.
Каждый опыт повторяли дважды. На рисунках представлены средние значения (n ≥ 6) и их стандартные ошибки. Достоверность различий между средними значениями устанавливалась с помощью дисперсионного анализа с использованием программного обеспечения Statistica (v. 8.0.550.0, “StatSoft, Inc.”). Разницу между средними значениями считали значимой при P < 0.05.
РЕЗУЛЬТАТЫ
Влияние ОВВ и режима полива на рост и развитие растений
Результаты опытов показали, что при высокой ОВВ (80%) и нормальном поливе наблюдался ожидаемый морфогенетический эффект ДРОП-воздействий – уменьшение высоты растений на 10% и суммарной длины черешков листьев на 8% по сравнению с контролем (рис. 1a, б, табл. 1). При этом не происходило уменьшения количества и площади листьев, а накопление биомассы превышало контроль на 12% (рис. 1в–1д, табл. 1). При той же ОВВ, но в условиях “засухи” морфогенетический эффект ДРОП-воздействий был более выражен, чем в условиях нормального полива − наблюдалось уменьшение высоты растений на 15% и суммарной длины черешков листьев на 22% по сравнению с контролем (рис. 1а, б, табл. 1). ДРОП-воздействия в условиях “засухи” также не снижали площадь листьев, увеличивая биомассу растений на 9% (рис. 1в, д), но тормозили скорость появления листьев (рис. 1г, табл. 1). Очевидно, что больший морфогенетический эффект вызван суммированием эффектов ДРОП-воздействия и “засухи”, так как растения с поливом в режиме “засуха”, не подвергавшиеся действию холода, имели меньшую высоту (на 3%), суммарную длину черешков (на 10%), площадь листьев (на 23%) и сухой вес растения (на 13%) по сравнению с растениями, обеспеченными нормальным поливом (рис. 1а–1в, 1д). ДРОП-воздействия, особенно в сочетании с “засухой”, увеличивали долю биомассы корней в общей биомассе растения за счет снижения долей биомассы стеблей и листьев (рис. 2).
Рис. 1.
Высота растения (а), длина черешков листьев (б), площадь (в) и количество (г) листьев, сухая масса (д) и компактность (е) контрольных (1) растений и подвергавшихся ДРОП-воздействиям (2) в условиях нормального полива (Полив) или периодической засухи (Засуха) при относительной влажности воздуха 80 или 30%. Разные буквы указывают на достоверность различий средних значений при уровне значимости Р < 0.05.
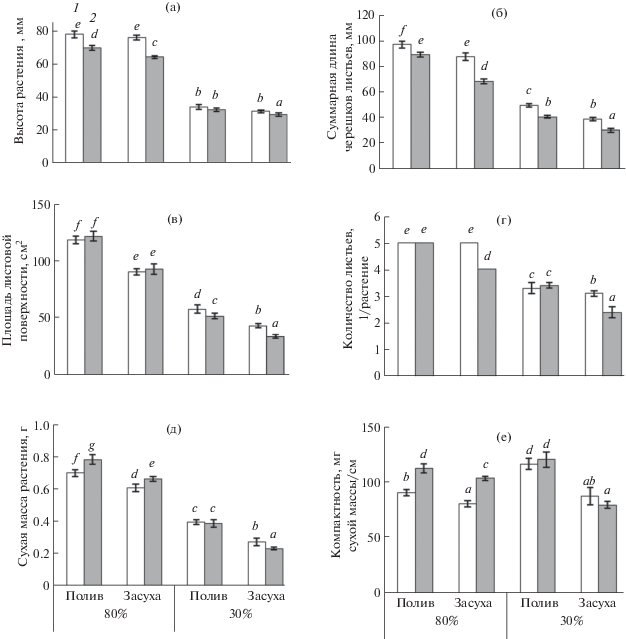
Рис. 2.
Распределение сухого вещества между органами (1 – листья, 2 – стебли, 3 – корни) у контрольных (К) растений и подвергавшихся ДРОП-воздействиям (ДРОП) в условиях нормального полива (Полив) или периодической засухи (Засуха) при относительной влажности воздуха 80 или 30%.

В условиях низкой ОВВ (30%) биометрические параметры контрольных растений (высота растений, длина черешков, площадь листьев и сухая масса растений) были снижены примерно в два раза, а количество листьев – на треть. ДРОП-воздействия дополнительно уменьшили высоту растений на 5–6% и суммарную длину черешков − на 18–22% (рис. 1а, б, табл. 1). При этом в условиях “засухи” произошло как снижение количества листьев (на 23%), так и уменьшение площади листьев на 10–21% в условиях разного полива (рис. 1в, г, табл. 1) по сравнению с контролем. В условиях нормального полива сухая масса растений была одинаковой в вариантах ДРОП и контроль, но в условиях “периодической засухи” действие ДРОП снижало сухую массу растений на 15% (рис. 1д, табл. 1).
Влияние на водный режим растений
Независимо от ОВВ, ОСВ было несколько выше у растений в условиях “периодической засухи” (рис. 3б). При этом варианты ДРОП и контроль достоверно не различались (рис. 3б, табл. 1). Значения устьичной проводимости и транспирации листьев снижались по мере возрастания дефицита воды, т.е. были ниже у растений, выращиваемых при низкой ОВВ и в условиях “засухи” (рис. 4а, б). У растений, подвергавшихся ДРОП-воздействиям, устьичная проводимость и транспирация не отличались от контрольных (кроме варианта “засухи” при высокой ОВВ, где значения были ниже контрольных) (рис. 4а, б, табл. 1).
Рис. 3.
Относительное содержание хлорофилла (а), относительное содержание воды (ОСВ) (б) и холодоустойчивость листьев (в) контрольных (1) растений и подвергавшихся ДРОП-воздействиям (2) в условиях нормального полива (Полив) или периодической засухи (Засуха) при относительной влажности воздуха 80 или 30%. Разные буквы указывают на достоверность различий средних значений при уровне значимости Р < 0.05.

Рис. 4.
Транспирация (а), устьичная проводимость (б), видимый фотосинтез (в) и темновое дыхание (г) контрольных (1) растений и подвергавшихся ДРОП-воздействиям (2) в условиях нормального полива (Полив) или периодической засухи (Засуха) при относительной влажности воздуха 80 или 30%. Разные буквы указывают на достоверность различий средних значений при уровне значимости Р < 0.05.

Влияние на фотосинтетический аппарат и газообмен
Низкая ОВВ привела к увеличению относительного содержания хлорофилла в листьях контрольных растений, вероятно, в результате увеличения толщины листа (рис. 3а). В условиях высокой ОВВ ДРОП-воздействия несколько повышали содержание хлорофилла относительно контроля, независимо от условий полива, тогда как при низкой ОВВ этот показатель не отличался от контрольных растений (рис. 3а). Значения максимального квантового выхода фотохимической активности ФС II (Fv/Fm) были высокими (выше 0.8) во всех вариантах опыта, свидетельствуя об отсутствии повреждений комплексов ФС II (данные не приведены).
Условия полива и ОВВ не оказали значимого влияния на видимый фотосинтез у контрольных растений (рис. 4в), но ДРОП-воздействия вызывали повышение скорости фотосинтеза в условиях высокой ОВВ (на 15% при нормальном поливе и на 7% при “периодической засухе”). При низкой ОВВ растения варианта ДРОП не отличались от контрольных при обоих вариантах полива (рис. 4в, табл. 1).
Дыхание контрольных растений снижалось по мере возрастания дефицита воды − было ниже в условиях низкой ОВВ и в условиях “засухи” (рис. 4г). Дыхание растений, подвергавшихся ДРОП-воздействиям, не отличалось достоверно от дыхания контрольных растений (рис. 4г, табл.).
Влияние на холодоустойчивость
Оценка холодоустойчивости клеток листьев по температуре (ЛТ50) при краткосрочном промораживании показала бóльшую устойчивость листьев у растений, подвергавшихся ДРОП-воздействиям, по сравнению с контрольными растениями, причем устойчивость листьев была выше и различия более явно выраженными у растений, выросших при низкой ОВВ (рис. 3в, табл. 1).
Анализ растений до холодового тестирования показал, что содержание МДА, свидетельствующее об интенсивности перекисного окисления липидов, у контрольных растений было одинаковым в условиях разной ОВВ и полива (рис. 5а). ДРОП-воздействия немного снижали содержание МДА. Значения ОВЭ не различались достоверно между контрольными растениями и растениями в вариантах ДРОП (рис. 5в).
Рис. 5.
Содержание МДА (а, б) и относительный выход электролитов (в, г) до холодового тестирования (а, в) и после него (б, г) у контрольных (1) растений и подвергавшихся ДРОП-воздействиям (2) в условиях нормального полива (Полив) или периодической засухи (Засуха) при относительной влажности воздуха 80 или 30%. Разные буквы указывают на достоверность различий средних значений при уровне значимости Р < 0.05.

Холодовое тестирование (4°С в течение 24 ч) показало, что растения всех вариантов, выросшие в условиях низкой ОВВ, были более устойчивы к действию низкой температуры (по значениям ОВЭ и содержанию МДА) по сравнению с растениями, выросшими в условиях высокой ОВВ (рис. 5б, г). ДРОП-воздействия привели к дополнительному повышению устойчивости, при этом самая высокая устойчивость отмечена при ДРОП-воздействиях в условиях “засухи” (рис. 5б, г, табл. 1). Визуально наблюдаемые холодовые повреждения (некроз листьев) были более выраженными у контрольных растений, выросших в условиях высокой ОВВ при нормальном поливе (рис. 6). Менее поврежденными были растения, выросшие в условиях низкой ОВВ и “засухи”.
ОБСУЖДЕНИЕ
Результаты проведенных исследований показали, что водный фактор, а именно ОВВ и обеспеченность растений водой, создаваемая за счет определенного режима полива значительным образом изменяют реакцию растений на ДРОП-воздействия по многим параметрам, причем не только количественно, но и качественно. При высокой ОВВ наблюдается типичный морфогенетический эффект ДРОП-воздействий, когда при уменьшении линейных размеров надземных органов, но несколько большем накоплении сухой биомассы, увеличивается (на 25–28%) компактность растения (т.е. отношение сухой массы растения к его высоте). Причиной большего накопления сухой биомассы растений под влиянием ДРОП-воздействий является более высокая скорость фотосинтеза без увеличения потерь на дыхание по сравнению с контрольными растениями, что мы уже отмечали ранее [7]. В условиях низкой ОВВ морфогенетический эффект ДРОП-воздействий сохраняется, но помимо уменьшения высоты растений и длины черешков листьев наблюдалось и уменьшение площади листьев. В результате этого снижалась сухая биомасса, что нивелировало эффект ДРОП-воздействий на компактность растений. Растения имели меньшие линейные размеры, но не были более компактными по сравнению с контролем. Однако следует отметить, что низкая ОВВ сама по себе приводила к уменьшению биометрических показателей растений вдвое и увеличению компактности на 30%.
Режим полива с созданием условий периодической засухи (вариант “засуха”) усиливал эффекты ДРОП-воздействий на растения, что проявлялось в еще большем уменьшении линейных размеров и повышении компактности. Однако это происходило только в условиях высокой ОВВ, а при низкой ОВВ режим “засухи” вызывал увеличение скорости транспирации и дыхания, что приводило к меньшему накоплению биомассы и уменьшению компактности растений.
Оценка холодоустойчивости растений показала, что ДРОП-воздействия повышают холодоустойчивость листьев, независимо от уровня ОВВ и условий полива. Рост холодоустойчивости листьев при ДРОП-воздействиях в условиях нормального водоснабжения мы неоднократно отмечали ранее [3, 6, 16–18]. Результаты холодового тестирования растений приводят к выводу о том, что все растения, выросшие в условиях низкой ОВВ, более холодоустойчивы по сравнению с растениями, выросшими при высокой ОВВ. Нужно отметить, что холодовой тест проводили для всех растений одинаково, при ОВВ 90–100%, поэтому известный факт, что помещение растений в условия 100% влажности воздуха способствует снижению повреждений растений от холода [19, 20] в данном случае не играл роли, и различия в реакции растений на холодовой тест были обусловлены различиями в условиях их выращивания до тестирования. Очень важно, что эффекты ДРОП-воздействий и “засухи” на холодоустойчивость растений частично суммировались, приводя к большей устойчивости растений при их совместном действии. Поскольку различий в устойчивости клеток листьев к краткосрочному промораживанию между вариантами опыта с ДРОП-воздействиями в условиях нормального полива и “засухи” при высокой ОВВ не наблюдалось, то вероятно, бóльшая холодоустойчивость растений в варианте одновременного действия ДРОП и “засухи” вызвана не их метаболическими или структурными особенностями, а их большей устойчивостью к водному стрессу, вызванному действием низкой температуры. Неоднократно показано, что охлаждение влияет на теплолюбивые растения косвенно, нарушая водный баланс растений и вызывая водный стресс [20, 21]. В этом случае первичной причиной холодовых повреждений у теплолюбивых видов является потеря тургора вследствие нарушения контроля за устьичной проводимостью и потерь воды в процессе транспирации при снижении способности корней компенсировать потери воды. После возвращения в нормальные условия на высохших листьях появляются некротические пятна, что мы и наблюдали в наших опытах в большей степени у контрольных растений, выросших в условиях высокой ОВВ при нормальном поливе. В определенных случаях низкая температура может блокировать устьица в открытом состоянии (феномен “locking open”) [21–23]. Ранее нами было зафиксировано “необычное” поведение устьиц у растений, подвергавшихся ДРОП-воздействиям [24], а именно увеличение устьичной проводимости при низких температурах, что, возможно, связано с изменением чувствительности замыкающих клеток устьиц к АБК [25]. Предполагается, что это явление распространено в природе и имеет адаптивный смысл [26], заключающийся в том, что в ранние утренние часы, когда температура и транспирация имеют низкие значения, АБК не ингибирует открытие устьиц. Это позволяет листьям активно фотосинтезировать в период, когда мала вероятность того, что открытые устьица подвергнут растение риску возникновения сильного водного стресса. Позже в течение дня, когда температура повышается и значительно возрастает интенсивность транспирации, тот же уровень АБК обеспечивает защиту растения, вызывая закрытие устьиц. Ранее также было показано, что закаливание растений с помощью засухи предотвращает холодовые повреждения у теплолюбивых растений [19, 27]. Совместное действие ДРОП и “засухи” проявлялось в большем снижении устьичной проводимости по сравнению с их раздельным действием в условиях высокой ОВВ. Поэтому устойчивость растений к низкой температуре в варианте с ДРОП-воздействиями и “засухой”, по-видимому, связана с усилением контроля за устьичной проводимостью в условиях стресса. Кроме того, полученные ранее и в настоящей работе данные позволяют предположить, что при ДРОП-воздействиях у теплолюбивых растений регуляция водного баланса может осуществляться с помощью альтернативного механизма, который заключается не в закрытии устьиц (что вызывает резкое снижение фотосинтеза и, как следствие, приводит к уменьшению продуктивности растений), а в обеспечении оводненности растений за счет увеличения притока воды из корней благодаря увеличению гидравлической проводимости. Известно, что растения с хорошо развитой корневой системой более устойчивы к засухе [28]. В наших опытах именно в варианте с ДРОП-воздействиями в условиях “засухи” наблюдалось в том числе и увеличение доли биомассы корней в общей биомассе растения.
Показатели фотосинтетической активности оказались менее других зависимыми от ОВВ и режима полива в исследуемом диапазоне условий. Однако то, что растения реагируют на водный стресс уменьшением размеров раньше, чем снижением фотосинтетической активности, неудивительно и отмечалось другими авторами [29]. В предыдущих наших работах при разных параметрах ДРОП-воздействий (интенсивность, длительность, сопутствующие световые условия) мы наблюдали как сохранение интенсивности фотосинтеза на уровне контрольных растений, так и его снижение (при ДРОП-воздействиях на свету), или даже небольшое повышение относительно контроля, особенно при низких температурах [7–9, 11, 24]. Вероятно, это связано с “необычным” поведением устьиц, проявляющемся в способности растений открывать их в условиях низких и высоких температур, что по сути означает расширение адаптивных возможностей растений под влиянием ДРОП-воздействий.
Таблица 1.
Влияние водного фактора на реакцию растений Cucumis sativus L. на ДРОП-воздействия (% от контроля)
| Показатель | Варианты опыта | |||
|---|---|---|---|---|
| ОВВ 80% | ОВВ 30% | |||
| полив | “засуха” | полив | “засуха” | |
| Рост и развитие растений | ||||
| Высота растения | 90* | 85* | 95 | 94 |
| Суммарная длина черешков листьев | 92* | 78* | 82* | 78* |
| Площадь листовой поверхности | 103 | 103 | 90* | 79* |
| Количество листьев | 100 | 80* | 103 | 77* |
| Сухая масса растения | 112* | 109* | 98 | 85* |
| Компактность | 124* | 128* | 103 | 91 |
| Водный режим | ||||
| ОСВ | 103 | 101 | 102 | 99 |
| Транспирация | 99 | 91 | 100 | 112 |
| Устьичная проводимость | 97 | 66* | 103 | 114 |
| Газообмен | ||||
| Видимый фотосинтез | 115* | 107* | 100 | 103 |
| Дыхание | 93 | 80 | 71 | 138 |
| Холодоустойчивость | ||||
| Холодоустойчивость листьев (ЛТ50) | 123* | 123* | 139* | 142* |
| Содержание МДА | 95 | 70* | 100 | 89* |
| ОВЭ | 102 | 37* | 65* | 85* |
Примечание. * − Значимые различия с контролем. Показатели контрольных растений (без низкотемпературных воздействий) приняты за 100%. Абсолютные значения показателей контрольных растений приведены на рисунке 1–5. Содержание МДА и ОВЭ приведены для листьев растений после холодового теста.
Считается, что дефицит воды оказывает значительное влияние на скорость накопления сухой массы, но меньшее − на скорость развития растений [30]. В нашей работе мы также наблюдали, что торможение линейного роста и накопления биомассы в условиях низкой ОВВ или в варианте “засуха” было более сильным, чем снижение скорости развития (оцениваемой по скорости появления листьев). ДРОП-воздействия приводили к замедлению скорости появления листьев по сравнению с контрольными растениями только в варианте “засуха”, не снижая скорости развития в условиях нормального полива.
Необходимо подчеркнуть, что, как показали результаты данной работы, хотя морфогенетический эффект таких агроприемов как ДРОП-воздействия и “периодическая засуха”, альтернативных применению ретардантов, сопоставим в плане влияния на линейные размеры растений, тем не менее увеличение компактности растений происходит только под влиянием ДРОП-воздействий. При “периодической засухе” растения становятся меньше, но не компактнее, из-за значительного снижения биомассы. Эти данные однозначно говорят о преимуществе агроприема ДРОП по сравнению с “периодической засухой”, когда они применяются для получения более компактных и устойчивых растений. Это важно иметь ввиду, так как современное растениеводство, ориентированное на снижение затрат на единицу получаемой продукции, требует поиска относительно недорогих и безопасных для окружающей среды способов управления высотой и компактностью растений. Кроме того, существуют строгие маркетинговые требования относительно размера рассады овощных культур и декоративных растений [13].
Таким образом, совокупность полученных данных однозначно говорит о значительной зависимости реакции растений на ДРОП-воздействия от обеспеченности растений водой. И ОВВ, и режим полива оказывают сильное и не только количественное, но и качественное влияние на ответную реакцию растений на ДРОП-воздействия. В условиях высокой ОВВ ДРОП-воздействия оказывают значительный морфогенетический эффект, не снижая или даже увеличивая биомассу растения, что приводит к увеличению компактности растений. В условиях низкой ОВВ эффекты ДРОП-воздействий на компактность растений нивелируются ввиду сильного морфогенетического эффекта самой ОВВ и значительного снижения биомассы растений в результате ДРОП-воздействий в условиях низкой водообеспеченности. Режим полива по-разному влияет на эффект ДРОП-воздействий на растения в зависимости от ОВВ. При высокой ОВВ ДРОП-воздействия в сочетании с “засухой” приводят к увеличению компактности растений, а также их устойчивости к действию низкой температуры и водному стрессу, индуцированному низкой температурой, а при низкой ОВВ увеличения компактности растений не происходит. Выявленные в данной работе закономерности помимо теоретического значения важны в практическом плане, т.к. их знание необходимо для более эффективного управления ростом растений и получения растений с заданными свойствами.
Работа выполнена с использованием оборудования Центра коллективного пользования Карельского научного центра Российской академии наук при финансовой поддержке из средств федерального бюджета на выполнение государственного задания КарНЦ РАН (№ 0221-2017-0051).
Список литературы
Hendriks L., Ueber E. Alternative methods of regulating the elongation growth of ornamental plants: a current assessment // Acta Hortic. 1995. V. 378. P. 159−167.
Myster J., Moe R. Effect of diurnal temperature alternations on plant morphology in some greenhouse crops: a mini review // Sci. Hortic. 1995. V. 62. P. 205−215.
Марковская Е.Ф., Сысоева М.И., Шерудило Е.Г. Кратковременная гипотермия и растение. Петрозаводск: Карельский научный центр РАН. 2013. 194 с.
Ueber E., Hendriks L. Effects of intensity, duration and timing of a temperature drop on the growth and flowering of Euphorbia pulcherrima Willd. ex Klotzsch. // A-cta Hortic. 1992. V. 327. P. 33−40.
Erwin J.E., Heins R.D. Thermomorphogenic responses in stem and leaf development // Hort. Sci. 1995. V. 30. P. 940−949.
Марковская Е.Ф., Сысоева М.И., Харькина Т.Г., Шерудило Е.Г. Влияние кратковременного снижения ночной температуры на рост и холодостойкость растений огурца // Физиология растений. 2000. Т. 47. С. 445−448.
Икконен Е.Н., Шибаева Т.Г., Титов А.Ф. Реакция фотосинтетического аппарата листа у Cucumis sativus L. на кратковременное ежесуточное понижение температуры // Физиология растений. 2015. Т. 62. С. 528−532.
Икконен Е.Н., Шибаева Т.Г., Титов А.Ф. Влияние кратковременных ежесуточных понижений температуры на соотношение дыхания и фотосинтеза у теплолюбивых растений // Физиология растений. 2018. Т. 65. С. 63−69.
Шибаева Т.Г., Икконен Е.Н., Шерудило Е.Г., Титов А.Ф. Особенности реакции различных по требовательности к свету гибридов Cucumis sativus L. на ежесуточные кратковременные показатели и урожайность // Труды Карельского научного центра РАН. Серия Экспериментальная биология. 2016. № 6. С. 56–64.
Stavang J.A., Junttila O., Moe R., Olsen J.E. Differential temperature regulation of GA metabolism in light and darkness in pea // J. Exp. Bot. 2007. V. 58. P. 3061−3069.
Ikkonen E.N., Shibaeva T.G., Titov A.F. The role of light in cucumber plant response to a diurnal short-term temperature drop // J. Stress Physiol. Biochem. 2017. V. 13. № 2. P. 35−44.
Moe R., Willumsen K., Ihlebekk I.H., Stupa A.I., Glomsrud N.M., Mortensen L.M. DIF and temperature drop responses in SDP and LDP, a comparison // Acta Hortic. 1995. V. 378. P. 27−33.
Carvalho S.M.P., van Noort F., Postma R., Heuvelink E. Possibilities for producing compact floricultural crops. Wageningen: Wageningen UR Greenhouse Horticulture, 2008. Report 173. 68 p.
Дроздов С.Н., Будыкина Н.П., Курец В.К., Балагурова Н.И. Определение устойчивости растений к заморозкам // Методы оценки устойчивости растений к неблагоприятным условиям среды. Л.: Колос, 1976. С. 222−228.
Heath R. L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. № 1. P. 189–198.
Sysoyeva M.I., Markovskaya E.F., Kharkina T.G. Optimal temperature drop for the growth and development of young cucumber plants // Plant Growth Regul. 1997. V. 6. P. 1−5.
Sysoyeva M.I., Kharkina T.G. A method for quantifying the effect of temperature treatments on plant quality // J. Agric. Sci. 2000. V. 134. P. 221−226.
Шибаева Т.Г., Шерудило Е.Г., Титов А.Ф. Реакция растений Cucumis sativus L. на длительное постоянное и кратковременные ежесуточные воздействия низких температур // Физиология растений. 2018. Т. 65. С. 143−152.
Wilson J.M. The mechanism of chill- and drought-hardening of Phaseolus vulgaris leaves // New Phytol. 1976. V. 76. P. 257−270.
Janowiak F. Effect of water saturated atmosphere on chilling injuries of maize seedlings (Zea mays L.) // Ac-ta Physiol. Plant. 1989. V. 11. P. 89−96.
Mustardy L.A., Thanh Tam Vu, Faludi-Daniel A. Stomatal response and photosynthetic capacity of maize leaves at low temperature. A study on varietal differences in chilling sensitivity // Physiol. Plant. 1982. V. 55. P. 31−34.
Markhart A.H., III. Chilling injury: a review of possible causes // Hort Sci. 1986. V. 21. P. 1329-1333.
McKersie B.D., Leshem Y.Y. Stress and stress coping in cultivated plants. Kluwer Ac. Publ. Dordrecht, Boston, London. 1994.
Икконен Е.Н., Шибаева Т.Г., Сысоева М.И., Шерудило Е.Г. Устьичная проводимость Cucumis sativus L. при длительном и кратковременном действии низких температур // Физиология растений. 2012. Т. 59. С. 716−720.
Guye M.G., Wilson J.M. The effects of chilling and chill-hardening temperatures on stomatal behaviour in a range of chill-sensitive species and cultivars // Plant Physiol. Biochem. 1987. V. 25. P. 717–721.
Honour S.J., Webb A.A.R., Mansfield T.A. The response of stomata to abscisic acid and temperature are interrelated // Proc. R. Soc. Lond. B. Biol. Sci. 1995. V. 259. P. 301–306.
Perez de Juan J., Javier J.J., Sanchez-Diaz M. Chilling of drought and non-hardened plants of different chilling-sensitive maize lines. Changes in water relations and ABA contents // Plant Sci. 1997. V. 122. P. 71−79.
Альтергот В.Ф., Мордкович С.С., Игнатьев JI.A. Принципы оценки засухо- и жароустойчивости растений // Методы оценки устойчивости растений к неблагоприятным условиям среды. Л: Колос, 1976. С. 6−17.
McCree K.J. Whole plant carbon balance during osmotic adjustment to drought and salinity stress // Austral. J. Plant Physiol. 1986. V. 13. P. 33−43.
Thorne G.N., Wood D.W. Effects of radiation and temperature on tiller survival, grain number and grain yield in winter wheat // Ann. Bot. 1987. V. 59. P. 413−426.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



