Физиология растений, 2019, T. 66, № 3, стр. 218-229
Дыхание и вовлечение альтернативного пути в связи с возрастом и фенологической стратегией листа
Е. В. Гармаш
Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
Поступила в редакцию 06.04.2018
После доработки 10.05.2018
Принята к публикации 24.05.2018
Аннотация
Изучена возрастная динамика дыхательной активности, соотношения дыхательных путей и влияния альтернативного пути (АП) на величину коэффициента YАТФ/глюкоза, отражающего энергетическую эффективность дыхания (ЭЭД) листа яровой пшеницы и озимой ржи, имеющих разную фенологическую стратегию. Дыхательная способность при 20°С листа пшеницы была выше, чем ржи, что обусловлено снижением уровня метаболизма ржи в осенний период вегетации. Дыхание снижалось с возрастом и относительной скоростью роста листа (ОСР). Дыхание молодого листа площадью 20–30% от конечной протекало в основном по цитохромному пути, что связано с энергетическими нуждами на синтез de novo. Увеличение с возрастом листа яровой пшеницы доли АП с 25 до 40% от общего дыхания указывает на то, что альтернативное дыхание относится к компоненте дыхания поддержания. Уменьшение вклада АП в зрелом листе ржи (с 35 до 15% от общего дыхания) было направлено на поддержание ЭЭД при адаптации растений к пониженным температурам. Обнаружено изменение направления градиента дыхания вдоль листа. Меристематически активная часть листа разного возраста характеризовалась наиболее высокой интенсивностью дыхания, долей АП (до 45% от общего дыхания) и скоростью теплопродукции, что указывает на участие альтернативного дыхания в диссипации энергии и регуляции энергетического баланса. В целом, величина YАТФ/глюкоза на уровне листа разного возраста пшеницы и ржи не менялась и была в среднем равна 20 моль АТФ/моль глюкозы, что на треть меньше теоретически возможной. Это можно расценивать как признак соответствия уровня метаболизма и его адаптации условиям среды.
ВВЕДЕНИЕ
Лист как главный орган фотосинтеза обеспечивает все части растения восстановленным углеродом, играет важную роль в энергопластическом обмене и продукционном процессе. В работах А.Т. Мокроносова [1–3] сформулирована концепция возрастной физиологии фотосинтеза, в основе которой лежат исследования структурных и функциональных характеристик фотосинтеза по мере роста листовой пластинки и разновозрастных участков листа. А.Т. Мокроносовым совместно с сотрудниками кафедры физиологии и биохимии растений Уральского университета исследовано множество процессов, вовлеченных в формирование и функционирование фотосинтетического аппарата в онтогенезе листа: хлоропластогенез, изменения мезоструктуры фотосинтетического аппарата, ассимиляция углерода, направленность фотосинтетического метаболизма, изменение состава продуктов первичного биосинтеза, транспорт ассимилятов, старение листа и хлоропласта, гормональная регуляция фотосинтеза. Эти комплексные многолетние исследования позволили заключить, что возрастные изменения фотосинтетической функции листа подчинены общим закономерностям функционирования целого растительного организма [3].
Важная роль в обеспечении роста растения энергией и метаболитами принадлежит дыханию. На это указывал и А.Т. Мокроносов [3], ссылаясь на работы О.А. Семихатовой [4]. В эти годы еще только менялись представления о тесной взаимосвязи фотосинтеза и дыхания, координации и регуляции этих процессов на уровне клетки, листа и целого растения [5]. Около 40% энергии, запасенной зелеными листьями в химических связях конечных продуктов фотосинтеза, извлекается в процессе дыхания и используется на рост и поддержание целостности клеточных структур и их функциональной активности [6, с. 130–138].
В онтогенезе листа хлоропластогенез, дифференцировка пластид и рост клеток мезофилла определяют его фотосинтетическую активность [2, 3]. Эти процессы являются энергозависимыми. Хотя хлоропласты могут генерировать АТФ в результате фотофосфорилирования, однако именно АТФ, образованный при дыхании, является основным источником энергии для биосинтетических процессов, включая синтез и деградацию белков фотосинтетического аппарата [7]. Это стало известно сравнительно недавно благодаря исследованиям транспортеров, участвующих в переносе АТФ дыхательного происхождения из цитоплазмы в хлоропласт. Ограничение импорта АТФ в хлоропласт ведет к фотоокислительным повреждениям клетки, нарушению гормонального сигналинга и некрозу (обзор работ в [7]).
Вопросы возрастного хода дыхания достаточно полно освещены в работах Т.К. Головко [6, c. 35–53]. Дыхание листа снижается с возрастом, что связано с уменьшением в нем доли меристематически активных тканей, снижением метаболической активности и завершением ростовых процессов. Вместе с тем, в электрон-транспортной цепи растительных митохондрий (мЭТЦ), дополнительно к основному транспорту электронов через цитохромоксидазу (ЦП), функционирует альтернативный путь (АП) через цианидустойчивую альтернативную оксидазу (АОX). ЦП является основным источником АТФ. Электронный транспорт по АП не связан с двумя пунктами генерации мембранного потенциала, поэтому является энергетически малоэффективным. Основная функция АП состоит в обеспечении поддержания редокс-баланса в мЭТЦ за счет более быстрого окисления НАД·Н и предотвращения избыточного образования АФК [8].
Проблема участия AП в регуляции энергетической эффективности дыхания (ЭЭД) и, в целом, энергетического обмена растения обсуждалась в работах О.А. Семихатовой [9]. С тех пор накоплен большой фактический материал по функционированию АП, но вопросы оценки и регуляции ЭЭД до сих пор остаются предметом исследований. С одной стороны, вовлечение АП снижает ЭЭД, с другой, является механизмом регуляции и стабилизации энергетического баланса клетки и целого растения [10, 11].
Представления о возрастных изменениях дыхательных путей окончательно не сформированы. Полагают, что возрастной ход дыхания листа определяется преимущественно снижением способности основного цитохромного пути (ЦП) и увеличением доли альтернативного пути (АП) [12, 13]. Вместе с тем, дыхание молодых листьев зимне-зеленых растений отличалось более высокой активностью и вовлечением АП по сравнению со зрелыми [14, 15]. Показаны также изменения активности митохондриальных оксидаз у завершившего рост зрелого листа [16]. Возможно, что противоречивость имеющихся в литературе данных связана с разной жизненной формой и стратегией развития растения.
Яровая пшеница и озимая рожь – две формы злаковых, имеющих разную продолжительность полного цикла развития. Яровая пшеница – однолетнее растение с полным циклом развития, в один вегетационный период. Онтогенез озимой ржи продолжается два вегетационных периода с перезимовкой, в процессе которой растения пребывают в состоянии покоя. Важным при выращивании яровой пшеницы, особенно в условиях короткого и прохладного вегетационного периода на Севере, является второй этап органогенеза, связанный с фенофазой третьего листа и кущением. В период кущения – выхода в трубку третий и четвертый лист пшеницы вносят значительный вклад в фотосинтетический потенциал главного побега [17]. Для растений озимой ржи осенний период вегетации заканчивается вторым этапом органогенеза, который соответствует фазе кущения. В этот период пониженных температур происходит интенсивное формирование вегетативной массы растения, закладка узлов с листовыми зачатками и междоузлий, накопление в вегетативных органах пластических веществ при подготовке (закалке) к перезимовке. Таким образом, в период активной вегетации лист яровой пшеницы и озимой ржи имеют разную фенологическую стратегию, характеризующую его сезонную динамику функционирования в соответствии с сезонным ритмом развития растения [18].
Цель работы – сравнить возрастную динамику дыхания листа с разной фенологической стратегией у растений яровой пшеницы (Triticum aestivum L., сорт Иргина) и озимой ржи (Secale cereale L., сорт Вятка 2), оценить вклад альтернативного пути в дыхание и энергетический баланс листа, рассмотреть физиологическую роль АП в разных частях листовой пластинки.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в 2007–2009 гг. Растения яровой пшеницы (Triticum aestivum L., сорт Иргина) и озимой ржи (Secale cereale, сорт Вятка-2) выращивали в полевых условиях на делянках площадью 6 м2 вблизи г. Сыктывкара (61°40′ с.ш.). Почва опытного участка типичная подзолистая, сформированная на покровных суглинках, средней степени окультуренности. Перед закладкой опытов в почву вносили минеральные удобрения из расчета N30P60K60 (кг д.в./га). Посев яровой пшеницы и озимой ржи производили вручную в начале июня и в конце первой декады августа соответственно.
Период активной вегетации от начала всходов у яровой пшеницы до фазы выхода в трубку составлял 20–25 дней, у озимой ржи осенний этап вегетации длился 50–60 дней. Все измерения на яровой пшенице выполнены в июне–начале июля, на озимой ржи – во второй половине сентября–начале октября. Все исследования у растений яровой пшеницы выполнены на третьем листе в фенофазу третьего листа и начала кущения, у озимой ржи – на третьем листе второго бокового побега в фенофазу кущения.
Рост листа оценивали по накоплению биомассы. Пробы (30 образцов) взвешивали и высушивали до воздушно-сухого состояния при 70°С. Площадь листа измеряли с момента появления его кончика из влагалища предыдущего листа с помощью метода отпечатков на бумаге. Относительную скорость роста листа (ОСР, г/(г сухой массы ч)) определяли классическим способом как разность натуральных логарифмов массы листа в разные периоды времени [19].
Для характеристики дыхательной способности, скорости теплопродукции и содержания белка использовали листья, достигшие площади 20–30% (молодые листья) и 70% от конечной (зрелые листья). Интенсивность темнового дыхания листа измеряли при 20°С манометрическим методом. Листья отбирали с 10–15 растений. Дыхание целого листа характеризовали по скорости поглощения О2 высечками из средней выборки целых листьев. Для измерения дыхания в разных частях листа брали высечки из трех зон листовой пластинки. Зона деления включала участок около 5 и 3 мм от основания молодого и зрелого листа соответственно [2, c. 28]. Следующая за ней зона растяжения содержала образцы высечек листа длиной 3 мм. Для изучения дыхания зоны дифференцированных клеток отбирали высечки средней части листа длиной 5–10 мм. Высечки помещали в манометрические сосудики по 250–300 мг свежего материала. Интенсивность дыхания выражали в мл О2/(г сухой массы ч).
Активность терминальных оксидаз определяли с помощью специфических ингибиторов: салицилгидроксамовой кислоты (СГК, “Lancaster”, США) и NaN3 (“ДиаэМ”, Украина) для АОХ и цитохромоксидазы соответственно. Концентрацию ингибитора и длительность инкубации подбирали экспериментально, используя метод “прямого титрования” с возрастающими концентрациями ингибитора до насыщения скорости поглощения О2 [20]. Образцы предварительно инкубировали 20 мин в растворах СГК (25 мМ, рН 6.5), NaN3 (5 мМ, рН 4.5), а также в смеси ингибиторов. Затем их помещали в манометрические сосудики, куда наливали по 2.5 мл раствора ингибитора. Контрольные пробы высечек из листа инкубировали в воде. Показания манометров регистрировали каждые 15 мин в течение 1 ч. Активность АП (Valt) находили как разность между дыханием контрольных и инкубированных в растворе SHAM образцов. Остаточное (немитохондриальное) дыхание (Vres) измеряли при совместном действии ингибиторов (СГК и NaN3). Активность ЦП (Vcyt) рассчитывали как разность между дыханием, устойчивым к действию 25 мМ SHAM, и остаточным поглощением О2.
Для оценки энергетической эффективности дыхания (ЭЭД) с учетом вовлечения АП применен коэффициент эффективности окисления глюкозы для образования АТФ – YАТФ/глюкоза [21]. В расчетах использовали скорость дыхания при среднесуточной температуре в период проведения исследований, которая во второй и третьей декаде июня и первой декаде июля за три года составляла около 20°С, во второй и третьей декаде сентября – около 10°С (по данным Агрометеорологического бюллетеня по Республике Коми, станция Сыктывкар). При переводе количества поглощенного О2 (мл) в эквиваленты дыхательного субстрата (мг глюкозы) использовали коэффициент, равный 1.34. Количество глюкозы выражали в молях на единицу массы и времени. Для определения количества образованного из глюкозы АТФ при дыхании по цитохромному пути использовали коэффициент 29 (образование 29 моль АТФ на 1 моль глюкозы), при дыхании по альтернативному пути – коэффициент 11 (11 моль АТФ на 1 моль глюкозы) [21].
Скорость теплопродукции (q) разных частей листа измеряли при 20°С с помощью изотермического микрокалориметра Биотест 2 (Россия).
Экстракцию растворимого белка проводили при температуре 4°С в среде, содержащей (мМ): Tрис-HCl – 100, pH 8.0, MgCl2 · 6H2O – 10, ЭДТА – 4, ДТТ – 5. Гомогенат центрифугировали 20 мин при 15000 g и 4°С. Концентрацию белка определяли по методу Брэдфорда [22].
На рисунках и в таблицах представлены средние арифметические величины со стандартной ошибкой, полученные за трехлетний (для яровой пшеницы) и двухлетний (для озимой ржи) периоды исследований. Все параметры даны в расчете на сухую массу. Данные после проверки на нормальность распределения проанализированы с помощью ANOVA с использованием параметрического критерия Дункана и непараметрического критерия Краскела-Уоллиса при уровне значимости p < 0.05 [23]. Для статистической обработки использовали программу Statistica 6.1 software (“StatSoft. Inc.”, США). Стандартные ошибки производных величин оценивали как относительные погрешности функций нескольких переменных.
РЕЗУЛЬТАТЫ
Рост листа
С момента появления кончика листа из влагалища предыдущего листа масса и площадь листа пшеницы и ржи увеличивались в соответствии с классической S-образной кривой роста (рис. 1a, 1б). Лист пшеницы и ржи после 5 суток от появления характеризовался высокой относительной скоростью роста (ОСР), равной около 0.5 и 0.6 г/(г сут) соответственно (рис. 1в). В ходе онтогенеза ОСР листа снижалась особенно заметно в течение первых 10 дней. Спустя 20 дней от появления ОСР листа не превышала 0.03–0.04 г/(г сут). Масса и площадь листа пшеницы была несколько выше, чем ржи. Лист ржи и пшеницы достигал 70% от конечной площади на 10 и 14 день от своего появления соответственно.
Рис. 1.
Онтогенетические изменения биомассы (а), площади (б) и относительной скорости роста листа (в) яровой пшеницы (1) и озимой ржи (2). W – биомасса, S – площадь листа, ОСР – относительная скорость роста. Представлены среднеарифметические величины и их стандартные ошибки, полученные в период проведения исследований из 2–3 независимых экспериментов. В каждом эксперименте n = 30. Разными латинскими буквами обозначена достоверность изменений биомассы и площади в онтогенезе листа и между видами растений. Для величины ОСР ошибки рассчитаны как относительные погрешности функций нескольких переменных. Согласно ANOVA, влияние фактора возраста листа на величину ОСР значимо, фактора вида растения – незначимо при p < 0.05.

Содержание и скорость накопления белка в листе
Содержание растворимого белка и скорость его накопления в расчете на единицу сухой массы были выше в листе пшеницы, чем ржи. Динамика увеличения содержания белка в листе в процессе его роста у обоих видов была схожей (рис. 2). Скорость накопления белка у молодого листа была выше, чем у зрелого. Молодой и зрелый лист пшеницы накапливал белок со скоростью около 13 и 8 мг/г сухой массы в сутки, ржи – 6 и 3 мг/г сухой массы в сутки соответственно.
Рис. 2.
Содержание растворимого белка и скорость его накопления (г белка/(г сухой массы сут)) в онтогенезе листа яровой пшеницы (а) и озимой ржи (б). Представлены среднеарифметические величины и их стандартные ошибки, полученные в период проведения исследований из двух-трех независимых экспериментов. В каждом эксперименте n = 3. Разными латинскими буквами обозначена достоверность изменений параметра в онтогенезе листа (ANOVA, тест Дункана, p < 0.05).

Дыхание и соотношение дыхательных путей в молодом и зрелом листе
Дыхательная способность растений ржи, измеренная при 20°С, была значительно ниже, чем растений пшеницы (рис. 3а). Возрастная динамика дыхательной активности листа пшеницы и ржи имела схожий характер. Скорость поглощения О2 в молодом листе, рассчитанная как на единицу сухой массы листа, так и на единицу количества растворимого белка, была выше, чем в зрелом (рис. 3а, 3б). Однако разница между значениями скорости поглощения О2, полученными для молодого и зрелого листа пшеницы, была более заметной, чем у ржи. Молодые листья пшеницы и ржи поглощали О2 в 1.7 и 1.4 раза активнее, чем зрелые.
Рис. 3.
Дыхание в расчете на единицу сухой массы листа (а) и единицу содержания растворимого белка (б), активности цитохромного (Vcyt), альтернативного (Valt) и остаточного дыхания (Vres) (в) и соотношение дыхательных путей (г) в молодом (1) и зрелом листе (2) яровой пшеницы и озимой ржи. Представлены среднеарифметические величины и их стандартные ошибки, полученные в период проведения исследований из двух-трех независимых экспериментов. В каждом эксперименте n = 6–8. Разными латинскими буквами обозначена достоверность изменений параметра в онтогенезе листа (ANOVA, тест Дункана, p < 0.05).

Изменения скорости поглощения О2 были связаны с модуляцией активности и ЦП (Vcyt) и АП (Valt) (рис. 3в). Самая высокая величина активности ЦП (Vcyt) обнаружена в молодом листе пшеницы. В зрелом листе пшеницы снижение дыхания было в основном связано со снижением Vcyt. Активность АП (Valt) имела схожие значения у листьев пшеницы разного возраста. В листьях разного возраста ржи, в отличие от пшеницы, снижение дыхания зрелого листа было связано с уменьшением Valt, тогда как величина Vcyt не зависела от возраста.
Анализ изменения соотношения дыхательных путей (рис. 3г) показал, что дыхание молодого листа пшеницы осуществлялось в основном по ЦП по сравнению со зрелым (рис. 3а). Доля АП и ЦП в дыхании молодого листа пшеницы составляла около 25 и 63% от общего дыхания соответственно. В дыхании зрелого листа пшеницы вклад АП возрастал до 40%, доля ЦП несколько уменьшалась – до 55% от общего дыхания. Доля АП в дыхании молодого листа ржи составляла в среднем 35%, а зрелого листа, в отличие от пшеницы, – снижалась и составляла около 15%, при этом доля дыхания по ЦП возрастала до 75% от общего дыхания. В присутствии смеси ингибиторов остаточное поглощение кислорода (Vres) листа обоих видов не превышало 10% от общего дыхания.
Дыхание и соотношение дыхательных путей в разных частях листовой пластинки
Наиболее интенсивно дышала базальная меристематически активная часть, менее интенсивно – дифференцированная часть молодого и зрелого листа обоих видов (рис. 4а, 4г). Изменения дыхания вдоль листа разного возраста пшеницы были в основном связаны с активностью нефосфорилирующих путей (рис. 4б). В зоне деления величины Valt и Vres были вдвое выше, чем в зонах растяжения и дифференцированных клеток. Активность ЦП в разных участках листа пшеницы изменялась, но не так заметно, как активность АП. Изменение дыхания вдоль листа ржи были также связаны с модуляцией Valt и Vres, которые снижались с возрастанием уровня дифференцировки ткани при относительно стабильных значениях Vcyt, за исключением зоны дифференцированных клеток зрелого листа (рис. 4д). В этой зоне отмечали усиление дыхания по ЦП и резкое снижение активности АП.
Рис. 4.
Дыхание (а, г), активности цитохромного (Vcyt), альтернативного (Valt) и остаточного дыхания (Vres) (б, д) и соотношение дыхательных путей (в, е) в разных зонах роста молодого и зрелого листа яровой пшеницы и озимой ржи. ж – зоны роста листа: I – деления, II – растяжения, III – дифференцированных клеток. Представлены среднеарифметические величины и их стандартные ошибки, полученные в период проведения исследований из двух-трех независимых экспериментов. В каждом эксперименте n = 6–8. Разными латинскими буквами обозначена достоверность изменений параметра в онтогенезе листа (ANOVA, тест Дункана, p < 0.05).
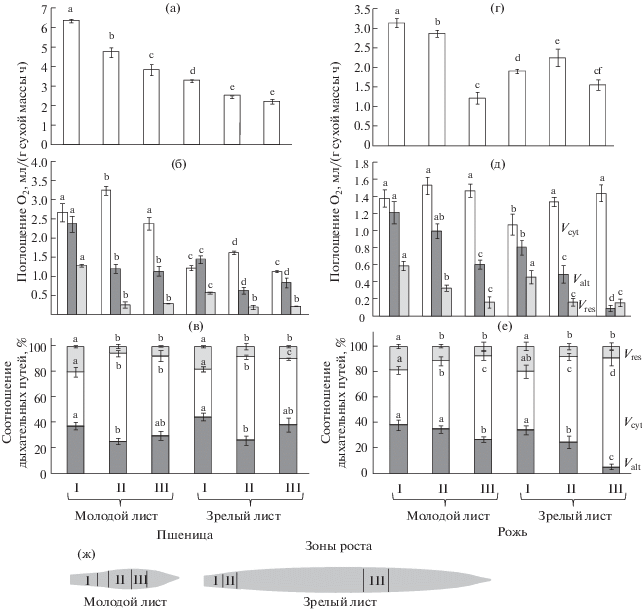
В меристематически активной зоне листа разного возраста обоих видов вклад АП и ЦП в дыхании был равнозначным и составлял в среднем 40%, при этом возрастала доля остаточного дыхания – до 20% от общего дыхания (рис. 4в, 4е). В дифференцированной части листа дыхание протекало в основном по ЦП, а в зрелом листе ржи доля ЦП достигала 85% от общего дыхания. Вклад АП в этой зоне зрелого листа ржи не превышал 5%, у других листьев варьировал в пределах 25–40% от общего дыхания.
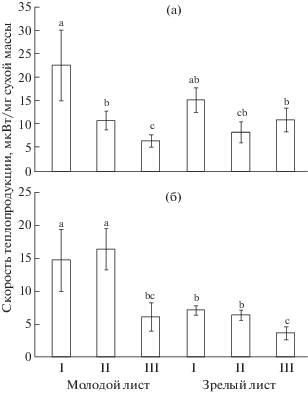
Скорость теплопродукции в разных частях молодого и зрелого листа
Базальная меристематически активная часть зрелого и особенно молодого листа пшеницы характеризовалась более высокой скоростью теплопродукции (q) по сравнению с другими частями (рис. 5). Величина q постепенно снижалась вдоль листа пшеницы по мере увеличения степени дифференцировки тканей. У молодого листа ржи величина q имела сравнительно высокие показатели в зоне деления и растяжения, снижаясь вдвое в зоне дифференцированных клеток. Зрелый лист ржи характеризовался самыми низкими показателями скорости теплопродукции, снижающимися вдоль листовой пластинки.
Рис. 5.
Скорость теплопродукции (q) в разных зонах роста молодого и зрелого листа яровой пшеницы (а) и озимой ржи (б). I – зона деления, II – зона растяжения, III – зона дифференцированных клеток. Разными латинскими буквами обозначена достоверность изменений параметра в онтогенезе листа (ANOVA, тест Краскела-Уоллиса, p < 0.05). Представлены среднеарифметические величины и их стандартные ошибки, полученные в период проведения исследований из 2–3 независимых экспериментов. В каждом эксперименте n = 6–8.
ОБСУЖДЕНИЕ
Развитие листа начинается с формирования листового примордия из апикальной меристемы побега, вслед за которым образуется ось листа и листовая пластинка. В среднем в течение первых 10 дней лист растет за счет деления и роста клеток, затем путем их растяжения без увеличения количества. Активный рост листа сопровождается накоплением хлорофилла, увеличением числа и размеров хлоропластов в клетке, усилением активности фотосинтетических ферментов. Наибольшая фотосинтетическая активность листа в расчете на единицу поверхности наблюдается при достижении им площади 40–60% от максимальной, затем интенсивность фотосинтеза снижается [3, с. 32]. К этому времени лист функционирует как донор ассимилятов. Одной из причин снижения фотосинтетической активности по мере созревания листа является превалирование процессов роста клеток над увеличением числа хлоропластов, хотя интенсивность фотосинтеза единичного хлоропласта и активность ферментов сохраняются на уровне достигнутых в период активного роста величин вплоть до завершения роста листа.
Известные нам количественные расчеты образования АТФ в процессе дыхания и, в целом, бюджета дыхательного АТФ были произведены без учета вовлечения АП [7, 24]. При этом не раз отмечалось, что дыхательные затраты, связанные с превращением ассимилированного при фотосинтезе углерода в структурную биомассу и ее поддержанием, зависят от вовлечения “холостых” дыхательных путей, снижающих энергетическую эффективность дыхания (ЭЭД) [8, 9, 21]. Поиск способов оценки ЭЭД привел к разработке различных показателей, имеющих определенные ограничения [6, с. 92–99; 9]. На разных уровнях организации – от клеточного до организменного целесообразно применение коэффициента эффективности окисления глюкозы для образования АТФ – YАТФ/глюкоза, позволяющего учесть в расчетах бюджета АТФ вовлечение нефосфорилирующих путей [21].
Лист пшеницы и ржи характеризовался наиболее высокой ОСР в период формирования площади, составляющей до 40% от конечной. Затем ОСР листа снижалась. Зрелый лист пшеницы имел более высокую биомассу, площадь и дыхательную способность, измеренную при 20°С, чем ржи (рис. 1, 3). Это свидетельствовало об общем торможении метаболизма озимой ржи в период подготовки к перезимовке.
В нормальных условиях активному росту соответствует интенсивное дыхание [6, с. 97]. Зрелый лист обоих видов дышал менее интенсивно, чем молодой (рис. 3а). Повышенная скорость дыхания молодых листьев связана, в первую очередь, с интенсификацией оборота белка [7, 24]. В листе самые активные процессы белкового синтеза протекают в хлоропластах, которые содержат более 50% белков клетки [7]. Содержание растворимого белка в молодом листе обоих видов было меньше, чем в зрелом. Однако скорость накопления, или точнее, оборота (синтеза и деградации) белка в период активного роста листа пшеницы и ржи выше, чем у завершившего рост листа (рис. 2). Полученные данные для листа пшеницы согласуются с теоретически рассчитанной величиной скорости оборота белка в биомассе с 10% его содержанием, которая в среднем составляет около 0.015 г/(г сут) [21]. Для листьев ржи скорость оборота белка ниже теоретической, что также указывает на более низкий уровень метаболизма растений в условиях пониженных температур. В целом, дыхание в пересчете на единицу белка в молодых листьях пшеницы и ржи было в 3.5 и 1.9 раз выше, чем в зрелых соответственно (рис. 3б).
В зрелом листе, активно функционирующем как донор ассимилятов, интенсивные процессы новообразования прекращаются, хотя содержание белка остается какое-то время постоянным вследствие процессов ресинтеза для замещения деградирующих структур. Так, в развивающемся и зрелом листе Arabidopsis thaliana процессы синтеза и деградации белка составляли 42 и 16% от общего бюджета АТФ соответственно [7]. При этом самая высокая цена энергетических расходов приходилась на синтез и поддержание протеома хлоропластов – ферментов цикла Кальвина и реакционных центров. Основную часть бюджета АТФ зрелого листа составляют процессы экспорта ассимилятов, включающие синтез транспортных форм сахаров и загрузку флоэмы. Известно, что дыхание, связанное с реализацией донорной функции листа, достигает 50% от общего дыхания [6, с. 124].
Поддержание относительно высокой дыхательной цены синтеза белка листа разного возраста ржи на уровне значений, полученных для листа пшеницы, скорее всего, обусловлено накоплением белков, выполняющих антифризную функцию. Показано, что холодовое закаливание проростков озимой пшеницы сопровождалось усиленным синтезом дегидринов – белков, участвующих в развитии морозоустойчивости растений [25, с. 13].
С возрастом листа пшеницы доля АП в дыхании увеличивалась от 25 до 40% (рис. 3г). Увеличение активности in vivo и доли АП от 25 до 32% от общего дыхания с возрастом листа Arabidopsis thaliana было также обнаружено c помощью метода изотопного фракционирования [12]. Следовательно, по мере снижения ОСР интенсивность дыхания падала за счет уменьшения активности цитохромного пути на фоне вовлечения АП. Это согласуется с представлением о том, что цитохромное дыхание является компонентой дыхания роста, тогда как альтернативное дыхание – скорее компонентой дыхания поддержания, чем роста [12, 26]. Полагают, что вовлечение АП усиливает потребление углерода для процессов дыхания поддержания, снижая риски возникновения окислительного стресса [12].
Количество окисляемой в процессе дыхания глюкозы и образуемого АТФ с учетом АП зависело от возраста листа (табл. 1). Полученные данные скорости образования АТФ находятся в диапазоне величин, рассчитанных с помощью коэффициента, связывающего скорость дыхательного поглощения кислорода с синтезом АТФ (1O2 – 4.5 ATФ) [7, 24]. Однако такие расчеты не позволяют учесть вклада АП. В нашем эксперименте количество окисляемой в процессе дыхания глюкозы и образуемого АТФ с учетом вклада АП в единице сухой массы молодого листа пшеницы были вдвое выше, чем зрелого. Напротив, в пересчете на массу целого листа энергетический выход дыхания зрелого листа был вдвое выше, чем молодого. Однако коэффициент эффективности окисления глюкозы для образования АТФ (YАТФ/глюкоза), отражающий ЭЭД, не изменялся с возрастом и составлял около 20 моль АТФ/моль глюкозы. Эта величина на треть меньше теоретически рассчитанной, составляющей 29 моль АТФ/моль глюкозы [21].
Доля АП в дыхании молодых листьев ржи составляла около 35% от общего дыхания (рис. 3г). Однако в отличие от пшеницы вклад АП в дыхание зрелого листа был на 20% ниже по сравнению с молодым. Поэтому абсолютные величины скорости образования АТФ с учетом АП в зрелых листьях озимой ржи, были немногим ниже (в 1.2 раза), чем в молодых (табл. 1). Это повлияло на количество образованного АТФ на уровне целого листа, которое в зрелом листе было в 3 раза выше, чем в молодом. В результате энергетический выход дыхания (YАТФ/глюкоза) в зрелом листе ржи имел небольшую тенденцию к увеличению.
Можно полагать, что усиление дыхания цитохромного типа в зрелых листьях ржи и снижение вклада АП было обусловлено необходимостью сохранения максимальной ЭЭД для реализации энергозависимых процессов адаптации к пониженным температурам. Подобная направленность изменения дыхания и соотношения дыхательных путей обнаружена нами в контролируемом эксперименте у холодостойкого сорта ячменя, выращиваемого при более низкой (но в пределах температурного оптимума роста) температуре [27]. Полученные данные согласуются с современными представлениями о том, что регуляция энергетического метаболизма клетки направлена на снижение вовлечения энергетически малоэффективного АП [13]. Однако вопрос участия АОХ в процессе адаптации растений к пониженным температурам до сих пор является предметом дискуссий. Существует ряд работ, свидетельствующих о вовлечении АП при низкотемпературном воздействии. В частности, индукция АП на первых этапах холодового закаливания проростков озимой пшеницы предотвращала развитие окислительного стресса, а при кратковременном влиянии отрицательных температур – способствовала термогенерации [25, c. 18–24].
В целом, величины YАТФ/глюкоза листа разного возраста пшеницы и ржи были примерно на одном уровне значений, что можно расценивать как признак соответствия уровня метаболизма и его адаптации условиям среды.
У злаков образование язычка (складка верхнего эпидермиса листа и внутреннего эпидермиса влагалища) начинается только после выхода кончика листа из влагалища предыдущего листа. После образования язычка на границе пластинки и влагалища листовая пластинка растет за счет интеркалярной (вставочной) меристемы, располагающейся в ее основании. Рост листовой пластинки продолжается до тех пор, пока верхушка влагалища с язычком не выйдут из трубки влагалища предыдущего листа. В результате роста за счет интеркалярной (вставочной) меристемы от основания листа к верхушке создается градиент клеток и тканей с возрастанием уровня дифференцировки. С возрастом листа зона деления укорачивается (рис. 4ж). Переход клеток к росту растяжением и дифференцировке сопровождается хлоропластогенезом и увеличением количества других компонентов [3]. А.Т. Мокроносов отмечал, что изучение фотосинтетической функции разновозрастных участков листа однодольных растений является одним из приемов, позволяющих получить более полные представления о возрастной физиологии фотосинтеза.
Мы изучили изменение соотношения дыхательных путей в трех частях молодого и зрелого листа растений. Дыхание разных частей и градиент дыхания вдоль листа изменялись с возрастом (рис. 4). Менее интенсивно дышала дифференцированная, функционально активная часть молодого и зрелого листа обоих видов. В этой зоне дыхание в основном протекало по ЦП и составляло в молодом листе пшеницы и листьях разного возраста ржи 65–75%, в зрелом листе пшеницы – до 55% от общего дыхания. Это отражает потребность клеток в энергии и интермедиатах для процессов биосинтеза и поддержания. Известно, что зона дифференцированных клеток листа однодольных характеризуется наиболее высокими показателями активности фотосинтетического аппарата – числом хлоропластов на единицу площади, содержанием белка фракции I (основной компонент белковой смеси, представляющей сумму водорастворимых белков) на единицу количества хлоропластов, удельной активностью РБФ-карбоксилазы и ее содержанием в хлоропласте, максимальной интенсивностью фотосинтеза [2, с. 28–30].
Зона деления листьев разного возраста пшеницы и молодого листа ржи отличалась наиболее интенсивным дыханием, которое в основном было связано с АП (45%) и немитохондриальным поглощением О2 (20%) (рис. 4). Дыхание в зоне деления зрелого листа ржи было несколько ниже, чем в зоне растяжения, но также характеризовалось увеличением доли АП и остаточного дыхания. Вовлечение нефосфорилирующих путей в зоне деления коррелировало с более высокой скоростью теплопродукции (рис. 5). Это косвенно может свидетельствовать о том, что АП как способ теплового рассеивания энергии участвует в регуляции баланса между углеводным метаболизмом и скоростью электронного транспорта [8]. На наш взгляд, активация альтернативного дыхания в меристематической ткани, обладающей повышенной аттрагирующей способностью [3, с. 42], направлена на обеспечение синтезов de novo за счет поддержания высокой скорости электронного транспорта в обход фосфат-акцепторного контроля. Это позволяет ЦТК функционировать и снабжать клетку метаболитами [8, 10]. Усиление тока электронов по АП и вклада остаточного дыхания можно также связать с их ролью в предотвращении окислительного стресса. Устойчивое к действию ингибиторов митохондриальных оксидаз остаточное дыхание включает реакции окисления молекулярным кислородом органических соединений с помощью различных оксидаз и других ферментов класса оксидоредуктаз в пероксисомах и на эндоплазматическом ретикулуме, участвуя в защите клетки от избытка кислорода и АФК [20, 28].
Таблица 1.
Показатели энергетической эффективности дыхания (ЭЭД) в листьях разного возраста растений
| Показатель | Яровая пшеница | Озимая рожь | ||
|---|---|---|---|---|
| молодой лист | зрелый лист | молодой лист | зрелый лист | |
| Дыхание, мг глюкозы/(г ч) | 6.02 ± 0.19а | 3.65 ± 0.11b | 3.84 ± 0.05b | 2.88 ± 0.10bc |
| Дыхание, мкмоль глюкозы/(г ч) | 33.5 ± 1.0а | 20.3 ± 0.6b | 21.3 ± 0.3b | 16.0 ± 0.6c |
| Дыхание с учетом АП, мкмоль АТФ /(г ч) | 723 ± 15 | 395 ± 4 | 211 ± 2 | 187 ± 4 |
| Дыхание целого листа с учетом АП, мкмоль АТФ/(г ч)* | 29.8 ± 1.0 | 69.8 ± 0.6 | 7.2 ± 0.2 | 22.8 ± 0.6 |
| ЭЭД (YАТФ/глюкоза), моль АТФ/моль глюкозы | 21.6 ± 3.2 | 19.5 ± 2.1 | 19.8 ± 2.1 | 23.4 ± 3.6 |
Примечание. В расчетах использовали скорость дыхания при среднесуточной температуре в период проведения исследований (“Материалы и методы”). * – в пересчете на целую массу листа, остальные параметры рассчитаны на единицу сухой массы листа. Представлены среднеарифметические величины и их стандартные ошибки, полученные в период проведения исследований из двух-трех независимых экспериментов (n = 6–8). Разные надстрочные символы обозначают достоверность изменений параметра в онтогенезе листа (ANOVA, тест Дункана, p < 0.05). Для величин дыхания в эквивалентах АТФ и YАТФ/глюкоза ошибки рассчитаны как относительные погрешности функций нескольких переменных. Согласно ANOVA, влияние фактора возраста листа на величину дыхания в эквивалентах АТФ значимо, на величину YАТФ/глюкоза – незначимо при p < 0.05.
А.Т. Мокроносов [2, c. 29, 3, с. 46–47] отмечал интересную, на наш взгляд, особенность фотосинтетического метаболизма углерода ювенильного листа и меристематически активной зоны листа, которая связана с преобладанием гетеротрофной фиксации СО2 (до 85%) при участии ФЕП-карбоксилазы. Причиной такого сдвига метаболизма является неполное развитие фотосинтетического аппарата и низкая активность РБФ-карбоксилазы в условиях интенсивной пролиферации клеток. Этот процесс сопровождается активным импортом ассимилятов, генерацией ФЕП и активацией дыхательных систем. Согласно современным исследованиям, существует метаболическая связь между активностью ФЕП-карбоксилазы и АОХ. В частности, коэкспрессия генов (SrPEPC и SrAOX) и активности ферментов обнаружена в процессе термогенеза цветков Symplocarpus renifolius [29]. Увеличение синтеза белка и активности ФЕП-карбоксилазы и АОХ выявлено в процессе экссудации карбоксилатов (цитрата, малата) кластерными корнями Hakea prostrata при дефиците фосфора [30]. Биохимическая основа этой связи состоит в поддержании высокой скорости ЦТК в обход фосфат-акцептороного контроля [30]. Возможно, этот механизм имел место и в меристематически активной зоне листа пшеницы и ржи. Этот вопрос требует специальных исследований.
В целом, коэффициент YАТФ/глюкоза в зоне деления был ниже, чем в других участках листа, но это не могло оказать существенного влияния на изменение ЭЭД целого листа разного возраста обоих видов, что связано с низкой долей базальной меристематически активной части (2–5%) в сухой массе листа (рис. 6).
Рис. 6.
Изменение коэффициента YАТФ/глюкоза (моль АТФ/моль глюкозы), отражающего энергетическую эффективность дыхания, в разных зонах роста молодого и зрелого листа яровой пшеницы (а) и озимой ржи (б). I – зона деления, II – зона растяжения, III – зона дифференцированных клеток. Для величины YАТФ/глюкоза ошибки рассчитаны как относительные погрешности функций нескольких переменных. Согласно ANOVA, влияние фактора зоны роста на величину YАТФ/глюкоза значимо при p < 0.05.

Таким образом, выявлены возрастные закономерности изменения дыхания и соотношения дыхательных путей листа двух видов, имеющих разные сезонные условия периода активной вегетации. Дыхательная способность листа яровой пшеницы была выше, чем озимой ржи, что обусловлено снижением уровня метаболизма ржи в осенний период. Более интенсивное дыхание молодого листа по сравнению со зрелым у обоих видов протекало в основном по цитохромному пути, что связано с энергетическими нуждами на синтез de novo. В зрелом листе вовлечение АП изменялось в зависимости от фенологической стратегии листа и целого растения. Увеличение доли АП с 25 до 40% от общего дыхания с возрастом листа яровой пшеницы происходило на фоне снижения относительной скорости роста и накопления белка. Ослабление дыхания альтернативного типа в зрелом листе ржи (до 15%) было направлено на поддержание ЭЭД при адаптации растений к пониженным температурам. Обнаружено изменение направления градиента дыхания вдоль листа. Меристематически активная часть листа характеризовалась наиболее высокой интенсивностью дыхания, долей АП (до 45% от общего дыхания) и скоростью теплопродукции, что указывает на участие альтернативного дыхания в диссипации энергии и регуляции энергетического баланса. В целом, вовлечение АП снижало величину коэффициента YАТФ/глюкоза, но не оказывало в период вегетативного роста растений существенного влияния на энергетический баланс на уровне ассимилирующего органа. Способность листа к изменению соотношения дыхательных путей и подчиненность выполняемых им функций в общей системе внутренних связей организма способствует эффективной реализации программы роста и развития.
Автор благодарна Т.К. Головко за ценные замечания и советы при подготовке статьи к публикации, Р.В. Малышеву за определения скорости теплопродукции листа.
Работа выполнена в рамках бюджетной темы НИР “Физиология и стресс-устойчивость фотосинтеза растений и пойкилогидрических фотоавтотрофов в условиях Севера”, номер ГР АААА-А17-117033010038-7.
Список литературы
Мокроносов А.Т. Мезоструктура и функциональная активность фотосинтетического аппарата // Мезоструктура и функциональная активность фотосинтетического аппарата / Под ред. Мокроносова А.Т., Борзенковой Р.А., Цельникер Ю.Л., Некрасовой Г.Ф. Свердловск: Уральск. ун-т. 1978. С. 5–31.
Мокороносов А.Т. Онтогенетический аспект фотосинтеза. М.: Наука, 1981. 196 с.
Мокроносов А.Т. Фотосинтетическая функция и целостность растительного организма. 42-е Тимирязевское чтение. М.: Наука, 1983. 64 с.
Семихатова О.А. Энергетические аспекты интеграции физиологических процессов в растениях // Физиология растений. 1980. Т. 27. С. 1005–1017.
Гармаш Е.В. Митохондриальное дыхание фотосинтезирующей клетки // Физиология растений. 2016. Т. 63. С. 17–30.
Головко Т.К. Дыхание растений (физиологические аспекты). СПб.: Наука, 1999. 204 с.
Li L., Nelson C.J., Trösch J., Castleden I., Huang S., Millar A.H. Protein degradation rate in Arabidopsis thaliana leaf growth and development // The Plant Cell. 2017. V. 29. P. 207–228.
Millenaar F.F., Lambers H. The alternative oxidase: In vivo regulation and function. Plant Biol. 2003. V. 5. C. 2–15.
Семихатова О.А. Энергетика дыхания в норме и при экологическом стрессе. 48-е Тимирязевское чтение. М.: Наука, 1990. 72 с.
Рахманкулова З.Ф. Уровни регуляции энергетического обмена в растениях // Вестник Башкирского университета. 2009. Т. 14. № 3(I). С. 1141–1154.
Noguchi K. Effects of light intensity and carbohydrate status on leaf and root respiration // Plant Respiration: From Cell to Ecosystem. Ch. 5 / Eds. Lambers H., Ribas-Carbo M. Dordrecht: Springer, 2005. P. 63−83.
Florez-Sarasa I.D., Bouma T.J., Medrano H., Azcon-B-ieto J., Ribas-Carbo M. Contribution of the cytochrome and alternative pathways to growth respiration and maintenance respiration in Arabidopsis thaliana // Physiol. Plant. 2007. V. 129. № 1. P. 143–151.
Priault P., Vidal G., De Paepe R., Ribas-Carbo M. Leaf age-related changes in respiratory pathways are dependent on complex I activity in Nicotiana sylvestris // Physiol. Plant. 2007. 129. № 1. P. 152–162.
Иванова Т.И., Кирпичникова О.В., Шерстнева О.А., Юдина О.С. Годичный цикл дыхания листьев вечнозеленых растений // Физиология растений. 1998. Т. 45. С. 906–913.
Головко Т.К., Пыстина Н.В. Альтернативный путь дыхания в листьях Rhodiola rosea L. и Ajuga reptans L.: возможная физиологическая роль // Физиология растений. 2001. Т. 48. С. 846–853.
Шугаев А.Г., Выскребенцева Э.И., Шугаева Н.А. Сезонные изменения активности митохондриальных оксидаз в высечках из взрослых листьев сахарной свеклы, определяемые с помощью традиционных методов ингибиторного анализа // Физиология растений. 1998. Т. 45. С. 670–678.
Тарчевский И.А. Метаболизм растений при стрессе (избранные труды). Казань: Фэн, 2001. 448 с.
Kikuzawa K. Leaf phenology as an optimal strategy for carbon gain in plants // Can. J. Bot. 1995. V. 73. P. 158–163.
Radford P.J. Growth analysis formulae – their use and abuse // Crop Science. 1967. V. 7. P. 171–175.
Møller I.M., Berczi A., Plas van der L.H.W., Lambers H. Measurement of the activity and capacity of the alternative pathway in intact plant tissue: identification of problems and possible solution // Physiol. Plant. 1988. V. 72. P. 642–649.
Amthor J.S. The McCree-de Wit-Penning de Vries-Thornley respiration paradigms: 30 years later // Ann. Bot. 2000. V. 86. P. 1–20.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. 72. P. 248–254.
Москалев А.А., Новаковский А.Б. Статистические методы в экологии с использованием R, Statistica, Excel и SPSS: учебное пособие. Сыктывкар: изд-во СыктГУ, 2014. 197 с.
Edwards J.M., Roberts T.H., Atwell B.J. Quantifying ATP turnover in anoxic coleoptiles of rice (Oryza sativa) demonstrates preferential allocation of energy to protein synthesis // J. Exp. Bot. 2012. V. 63. P. 4389–4402.
Грабельных О.И. Митохондриальные энергорассеивающие системы растений при действии низких температур. Автореф. дисс. докт. биол. наук. Иркутск: ФГБУН СИФИБР СО РАН, 2014. 47 с.
Гармаш Е.В., Малышев Р.В., Шелякин М.А., Головко Т.К. Активность дыхательных путей и фонд неструктурных углеводов в листе зеленеющих проростков яровой пшеницы // Физиология растений. 2014. Т. 56. С. 382–387.
Гармаш Е.В., Головко Т.К. Влияние скорости роста ячменя, выращиваемого при разных температуре и обеспеченности минеральным питанием, на активность альтернативного пути дыхания растений // Физиология и биохимия культурных растений. 2011. Т. 43. С. 113–121.
Шугаева Н.А., Выскребенцева Э.И., Орехова С.О., Шугаев А.Г. Влияние водного дефицита на дыхание проводящих пучков листового черешка сахарной свеклы // Физиология растений. 2007. Т. 54. С. 373–380.
Sayed M.A., Umekawa Y., Kikukatsu I. Metabolic interplay between cytosolic phosphoenolpyruvate carboxylase and mitochondrial alternative oxidase in thermogenic skunk cabbage, Symplocarpus renifolius // Plant Signaling & Behavior. 2016. V. 11. № 11: e1247138. http://dx.doi.org/https://doi.org/10.1080/15592324.2016.1247138.
Shane M.W., Cramer M.D., Funayama-Noguchi S., Cawthray G.R., Millar A.H., Day D.A., Lambers H. Developmental physiology of cluster-root carboxylate synthesis and exudation in Harsh Hakea. Expression of phosphoenolpyruvate carboxylase and the alternative oxidase // Plant Physiol. 2004. V. 135. P. 549–560.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


