Физиология растений, 2019, T. 66, № 4, стр. 256-265
В АБК- и стресс-индуцируемую экспрессию гена AT4G01870 Arabidopsis thaliana вовлекаются цис-элементы, ответственные за связывание АБК-зависимых транс-факторов
Н. В. Виноградов a, А. А. Андреева a, М. Н. Данилова a, А. С. Дорошенко a, Н. В. Кудрякова a, В. В. Кузнецов a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева РАН
Москва, Россия
Поступила в редакцию 10.04.2018
После доработки 17.05.2018
Принята к публикации 21.05.2018
Аннотация
Анализ in silico промоторной области гена At4g01870 Arabidopsis thaliana (L.) Heynh. показал наличие в его последовательности цис-элементов ABRE, W-box, RAV1-A, MYB и LFY. Эти регуляторные мотивы связывают транскрипционные факторы, которые вовлечены в ответы на действие абсцизовой кислоты (АБК) и стрессы. Получены стабильные трансгенные растения, несущие ген β-глюкуронидазы под контролем 5'-делеционных фрагментов промотора At4g01870. Согласно результатам гистохимического окрашивания трансформантов, экспрессия гена индуцировалась абиотическими стрессами и была наиболее ярко выражена в проводящих тканях корня, листьев и чашелистиков, а также в цветках. Изучение экспрессии гена At4g01870 методом полимеразной цепной реакции в режиме реального времени подтвердило, что содержание транскриптов гена возрастало после экспозиции растений на растворе NaCl или при температуре 37°С, а также после обработки АБК, однако гипотермия практически не изменяла уровень его транскриптов. Наряду с АБК, экспрессия гена At4g01870 индуцировалась индолилуксусной и салициловой кислотами и предшественником этилена 1-аминоциклопропан-1-карбоновой кислотой, но практически не регулировалась метилжасмонатом и подавлялась цитокинином. Известно, что TolB-подобный белок, кодируемый геном At4g01870, способен выполнять функцию своеобразной платформы, на базе которой происходит сборка белковых комплексов. Учитывая выявленные нами ранее АБК-связывающие свойства белка At4g01870, за которые отвечает его N-концевой фрагмент и присутствие в промоторе кодирующего его гена АБК-зависимых цис-элементов, можно предположить, что белок, кодируемый геном At4g01870, позволяет контролировать проведение гормональных сигналов в клетке, предоставляя структурную платформу для взаимодействия специфичных эффекторных белков, транс-факторов и ионных каналов.
ВВЕДЕНИЕ
Известно, что абсцизовая кислота (АБК) накапливается в растительных клетках под воздействием стрессовых условий, таких как засуха, засоление, аномальные температуры или действие патогенов [1]. При этом гормон индуцирует экспрессию многих АБК-зависимых генов. Канонический путь передачи сигнала АБК содержит несколько обязательных элементов. Он включает рецепторы PYR/PYL/RCAR, которые при связывании АБК приобретают способность взаимодействовать с протеинфосфатазами РР2С и ингибировать их активность [2]. Подавление РР2С разблокирует процесс автоактивации киназы SnRK2, которая в активном состоянии фосфорилирует транс-факторы, регулирующие транскрипцию АБК-зависимых генов [3]. В результате анализа промоторов таких генов было выяснено, что регуляция АБК экспрессии генов определяется наличием цис-элементов, ответственных за связывание АБК-зависимых транскрипционных факторов в промоторных зонах генов. Среди цис-элементов, вовлеченных в АБК- и стресс-регулируемую активацию генов, были установлены такие последовательности как ABRE (англ., ABA response element), MYB, W-box и другие [4–6]. АБК-регулируемые гены, имеющие в промоторных областях подобные мотивы, являются мишенями сигнальных сетей проведения сигнала АБК и представляют особый интерес для понимания молекулярных механизмов действия гормона.
Ранее среди АБК-связывающих белков нами было выявлено семейство АБК-активируемых белков, содержащих TolB-подобный бета-пропеллерный домен (построенный на базе PD40-повторов), и С-концевой домен, несущий гомологию с дипептидилпептидазой IV типа (DPP IV) [7]. По своей аминокислотной последовательности белки семейства оказались сходны с белком TolB бактерии Escherichia сoli, который является важным структурно-функциональным доменом бактериальной Tol-Pal системы, осуществляющей защиту клетки от проникновения пептидных токсинов – колицинов и поддержание водно-солевого обмена клетки бактерии [8]. Гены, гомологи этого семейства, были обнаружены в 46 растительных геномах, а кодируемые ими белки выявили высокую степень межвидового сходства, что говорит о консервативности функции данной группы белков [7]. У Arabidopsis thaliana, белки этого семейства кодируются тремя генами-гомологами, два из которых, At1g21670 и At1g21680, экспрессируются в листьях, а третий At4g01870 − преимущественно в корнях и цветках. Несмотря на сходство их нуклеотидных последовательностей, гены-гомологи обладают выраженной спецификой гормон-индуцируемой регуляции и находятся в геноме под разными промоторами, что, вероятно, и обуславливает их строго специфичное время и место экспрессии.
Согласно результатам, полученным с помощью методов аффинной хроматографии, а также прямой и конкурентной систем иммуноферментного анализа, экспрессированный в бактериальных клетках белок At4g01870 обратимо и специфически взаимодействует с АБК, причем за связывание с гормоном отвечает его N-концевая область [7, 9]. Наряду с АБК, в регуляции экспрессии At4g01870 могут принимать участие этилен, метилжасмонат, индолилуксусная и салициловая кислоты [10]. Эта отличительная особенность исследуемого гена открывает дополнительные возможности для выявления точек пересечения регуляторной сети АБК с сигнальными путями других гормонов и позволяет судить о сложном ансамбле взаимодействия различных гормональных систем, контролирующих экспрессию генов.
Цель работы – анализ промотора гена At4g01870 для последующей идентификации его возможных функций.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал, условия культивирования и обработки. Растения Arabidopsis thaliana, экотип Columbia 0, культивировали в почве или чашках Петри на агаризованной (0.5% агара) питательной среде Мурасиге и Скуга (МС) с половинной концентрацией минеральных солей при освещении 100 μE m–2 s–1, температуре 23°С и продолжительности светового периода 16 ч. В возрасте одной или двух недель, в зависимости от целей эксперимента, растения переносили на фильтровальную бумагу, смоченную жидкой средой МС, и инкубировали при повышенной (37°С) или пониженной температуре (4°С), а также на растворах гормонов или NaCl (200 мМ) в течение указанного при описании результатов периода времени. В работе использовали транс-зеатин и индолилуксусную кислоту (ИУК) в концентрации 5 × 10–6 М, АБК и метилжасмонат в концентрации 5 × 10–5 М, салициловую кислоту и предшественник этилена 1-аминоацилциклопропан-1-карбоксиловую кислоту (АЦК) в концентрации 10–5 М. Оптимальные концентрации фитогормонов определены в предварительных экспериментах. Для анализа гормон-зависимой экспрессии генов методом ПЦР в режиме реального времени после обратной транскрипции (ПЦР-РВ) фильтры с проростками на растворах гормонов в МС среде экспонировали на свету в течение 3 ч в соответствии с протоколом Kilian с соавт. [10]. Контрольные растения помещали на МС среду, содержавшую этиловый спирт в концентрации, использованной для приготовления растворов фитогормонов (0.1%). Для флуорометрического анализа активности β-глюкуронидазы листья 7-недельных почвенных растений (период естественного старения) опрыскивали растворами гормонов и через 24 ч фиксировали в жидком азоте.
Создание и гистохимический анализ трансгенных растений Arabidopsis, включающих химерную конструкцию PAt4g01870-GUS. 5'-делеционные фрагменты промоторной зоны гена At4g01870 –384 + + 15 (P384), –298 + 15 (P298) и –197 + 15 (P197) п.н., амплифицированные с помощью ПЦР, были проклонированы в плазмиду pCXGUS-P (Arabidopsis Biological Resource Center). Необходимые праймеры (таблица 1) подбирались с помощью программы VectorNTI Suite 9 (“Invitrogen”, США). Доказательство правильности полученных ампликонов и корректности их клонирования в плазмиду проведено с помощью секвенирования в ЗАО Евроген (Москва, Россия). Полученные векторные конструкции, содержащие 5'-делеционные фрагменты регуляторной зоны гена At4g01870, были использованы для создания трансгенных растений Arabidopsis методом агробактериальной трансформации цветоносов [11]. Трансгенные растения со встроенными генетическими конструкциями отбирали на селективной среде в присутствии антибиотика гигромицина в концентрации 25 мкг/мл. Наличие встроенных генетических конструкций доказано методом ПЦР, используя набор специальных праймеров.
Таблица 1.
Праймеры для амплификации фрагментов промоторной зоны гена At4g01870
| Обозначение праймера | Последовательность 5'–3' | Длина амплифицируемого фрагмента |
|---|---|---|
| At4g_pr0 | GCTTGATGTTGTATTCTTGTTGGT | 399 п.н. (–384 + 15) P384 |
| At4g_pr_S | TTTGCTTGTTAAGTCACAACTTCAT | 313 п.н. (–298 + 15) P298 |
| At4g_pr_S1 | ATGAATCTCTTCTGCGTCGATT | 212 п.н. (–197 + 15) P197 |
| At4g_pr_AS | TTTGGGAGTTTCCATTGTCG | Обратный праймер, использованный для всех трех реакций ПЦР |
Флуорометрический анализ активности фермента β-глюкуронидазы проводили согласно методике, предложенной Jefferson с соавт. [12].
Для гистохимического анализа GUS-активности в тканях трансгенных растений Arabidopsis применяли методику Vitha с соавт. [13].
Анализ экспрессии гена At4g01870 методом ПЦР-РВ. Суммарную РНК выделяли из проростков Arabidopsis, используя TRIzol® (“Invitrogen”, США) в соответствии с рекомендациями производителя (http://www.invitrogen.com/). Синтез кДНК и последующий ПЦР-РВ анализ проводили на амплификаторе LightCycler 96 (“Roche”, Швейцария) согласно методике, описанной ранее [14]. Эффективность гормональной обработки и влияния стрессоров оценивали, измеряя экспрессию стресс-индуцибельных генов и генов-маркеров действия гормонов. В работе для ПЦР-РВ анализа использовали следующие праймеры: для гена At4g01870 – F: CGGACTAAAGTCGGCGGTGTCT; R: CACGACCGTCCTATCATCACTCA; для гена-маркера действия АБК RAB18 – F: – TCGCATTCGGTCGTTGTATTGT; R: AGTAAACAACACACATCGCAGGA). Уровень экспрессии целевых генов был нормализован к уровню экспрессии гена полиубиквитина (UBQ10). Праймеры для гена UBQ10 – F: GCGTCTTCGTGGTGGTTTCTAA; R: GAAAGAGATAACAGGAACGGAAACA.
Эксперименты проводили в трех биологических повторностях. Достоверность различий между опытными и контрольными образцами оценивали с помощью критерия Стьюдента. На рисунках приведены средние значения и стандартные ошибки средних.
РЕЗУЛЬТАТЫ
Анализ in silico промоторной области гена At4g01870
С помощью программного онлайн ресурса AGRIS (http://agris-knowledgebase.org/AtcisDB/atcisview.html?id=At4g01870) [15] был проведен биоинформатический поиск предполагаемых регуляторных последовательностей для гена At4g01870 и составлена схема их расположения в промоторе (рис. 1). В последовательности промоторной зоны гена At4g01870 (384 п.н.), которая практически равна полному межгенному спейсеру между 3'‑концом гена At4g1880 и 5'-концом гена At4g01870 Arabidopsis, было выявлено 8 потенциальных регуляторных мотивов. При этом следует отметить, что могут быть и более удаленные от структурной зоны гена регуляторные элементы, способные влиять на его экспрессию.
Рис. 1.
Схема расположения предполагаемых цис-элементов в промоторе гена At4g01870. Для идентификации регуляторных элементов использовали программу AGRIS (http://agris-knowledgebase.org/AtcisDB/atcisview.html?id=At4g01870). “А” в сайте инициации трансляции ATG обозначается как +1. Первое основание в 5'-направлении перед ATG обозначается как –1.
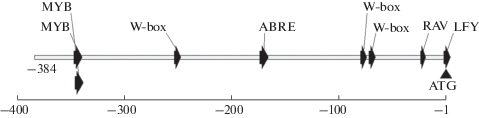
Среди обнаруженных цис-элементов присутствует АБК-зависимый элемент ABRE (A-like binding site element), имеющий консервативную последовательность TACGTGGA, с которой взаимодействуют транскрипционные факторы семейства AREB/ABF (от англ. ABRE-binding factors) [4]. Эти транс-факторы принадлежит к подсемейству bZIP белков, содержащих домены со структурой “основной лейциновой молнии” (bZIPs). Среди возможных функций выделяют их участие в ответе на дегидратацию, засоление и обработку АБК. Растения, оверэкспрессирующие эти факторы, проявляют повышенную устойчивость к засухе [16]. Кроме того, в ABRE-опосредованную транскрипцию вовлечен Ca2+, который является одним из важнейших вторичных мессенджеров в передаче различных эндогенных сигналов, например, сигнала АБК в устьичных клетках растений [17].
Промотор At4g01870 включает две последовательности (CACCAACC и ACCAACC), которые взаимодействуют с транскрипционными факторами MYB [5, 18]. Известно, что геном Arabidopsis содержит 126 R2R3-MYB генов, причем часть из них является медиаторами АБК-зависимой инициации экспрессии генов. Один из транс-факторов семейства MYB – MYB96 – индуцируется также ауксином и представляет общее звено или точку конвергенции сигнальных путей ауксина и абсцизовой кислоты. Следует отметить, что система осуществления ответа через факторы MYB/MYC функционирует медленнее, чем система bZIP-ABRE, что связано с необходимостью синтеза белков de novo [19].
В промоторе At4g01870 присутствуют три W-box элемента, включающие консервативную последовательность TTGACC (TTGAC(C/T)). W-box последовательности связываются транскрипционными факторами семейства WRKY, которое насчитывает у Arabidopsis 72 представителя [6]. Известно, что транс-факторы WRKY действуют в нисходящих участках цепей, по крайней мере, двух рецепторов АБК: цитоплазматической PYR/PYL/RCAR и локализованного в хлоропластах комплекса ABAR/GUN5/CHLH. Транс-факторы WRKY являются важными компонентами сигнальных сетей растений, координирующими экспрессию самых разнообразных генов. При этом они могут действовать в качестве как позитивных, так и негативных регуляторов [6].
В промоторной области гена At4g01870 была также выявлена регуляторная последовательность CCATTG, с которой взаимодействует транс-фактор LFY (или LEAFY, floral meristem identity), регулирующий транскрипцию ряда генов, ответственных за органогенез цветков Arabidopsis [20, 21]. Возможно, с LFY-зависимой индукцией гена At4g01870 связано его непосредственное участие в развитии цветковых структур при переходе к репродуктивной стадии: согласно данным исследования экспрессии этого гена методом ДНК-микрочипирования транскрипты гена накапливались преимущественно в цветках и корнях.
Еще один регуляторный цис-элемент, идентифицированный в промоторе At4g01870, RAV1-A (CAACA), связывается с транс-факторами подсемейства RAV (Related to ABI3/VP1), которое принадлежит к семейству AP2/ERF (APETALA2/Ethylene Responsive Factor). AtRAV1 экспрессируется преимущественно во время прорастания и на ранних стадиях роста и развития Arabidopsis и подавляется экзогенной АБК и брассиностероидами. Помимо этого, он способен индуцироваться поранением и пониженной температурой [22] и ингибироваться засолением и недостатком влаги [23]. Белок RAV1 содержит консервативный репрессорный домен RLFGV и способен действовать в качестве негативного регулятора развития растений [24] и позитивного регулятора процесса старения [25].
Таким образом, данные биоинформационного поиска подтверждают гормон- и стресс- регулируемую функцию цис-элементов промотора At4g01870 и позволяют предполагать участие гена в сигнальных процессах и ответах на воздействие факторов окружающей среды или определенных групп фитогормонов.
Гистохимический анализ экспрессии промотора гена At4g01870 в стрессовых условиях и при обработке гормонами
Для исследования регуляции экспрессии гена At4g01870 нами были созданы трансгенные линии Arabidopsis, несущие репортерный ген GUS под контролем 5’-делеционных фрагментов промотора At4g01870 –384 + 15 (Р384), –298 + 15 (Р298) и –197 + 15 (Р197) п.н. (рис. 2). Размер максимального фрагмента промотора практически совпадает с размером межгенного спейсера At4g1880 и At4g01870 генов. Фрагменты меньшей длины позволяли последовательно исключать часть цис-элементов, узнаваемых транс-факторами семейств MYB и WRKY.
Рис. 2.
Схематичное изображение 5'-делеционных фрагментов промотора гена At4g01870. “А” в сайте инициации трансляции ATG обозначается как +1. Первое основание в 5'-направлении перед ATG обозначается как –1.

Согласно полученным результатам, трансформанты с укороченными вариантами промоторов (Р298 и Р197), устойчивые к селективному антибиотику гигромицину, не обнаружили активности GUS как при гистохимическом окрашивании тканей, так и при измерении активности фермента флуоресцентным методом. Это позволяет предполагать, что делеция фрагмента промотора –384−298 п.н., включающего потенциальные два MYB цис-элемента и возможно другие, неидентифицированные регуляторные последовательности, приводила к потере активности промотора (рис. 1 и 2), что представляется исключительно интересным и требует дальнейшего детального изучения этого фрагмента.
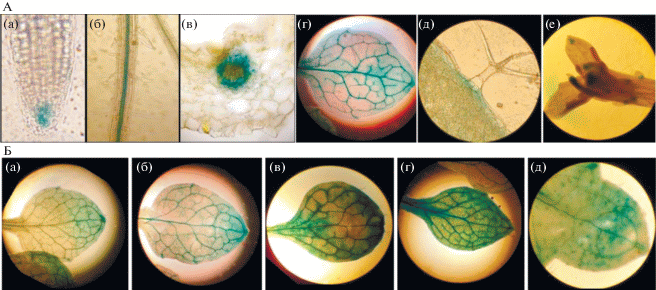
У растений, имеющих наибольший фрагмент промотора (Р384), активность β-глюкуронидазы была наиболее ярко выражена в проводящих тканях корня, листьев и чашелистиков, а также в цветке, кончике корня и области трихом (рис. 3А). Преимущественная экспрессия GUS гена под управлением промотора гена At4g01870 в проводящих тканях свидетельствует о тканеспецифичном характере экспрессии гена. Обработка двухнедельных растений цитокинином (транс-зеатином 5 × 10–6 М) в течение 5 ч не оказывала видимого влияния на интенсивность гистохимического окрашивания тканей листа (рис. 3Б-б), тогда как инкубация на растворе АБК (5 × 10–5 М) в течение 5 ч усиливала интенсивность окрашивания по сравнению с контрольным вариантом (рис. 3Б-в). При солевом стрессе (200 мМ NaCl, 5 ч), интенсивность окрашивания замыкающих клеток устьиц и оснований трихом по сравнению с контрольным вариантом не изменялась. Наиболее высокое содержание продукта At4g01870 было в проводящей системе корня и листа. Оно последовательно снижалось в центральной жилке, жилках второго и третьего порядка и мезофилле (данные не приводятся). При воздействии повышенной и пониженной температуры изменения в экспрессии GUS-конструкции носили разнонаправленный характер. При тепловом стрессе (37°С, 5 ч) интенсивность окрашивания возрастала, особенно в области устьиц и оснований трихом (рис. 3Б-г), тогда как холодовой стресс (4°С, 5 ч) снижал интенсивность окраски и усиливал ее неравномерность (рис. 3Б-д). Полученная картина распределения активности GUS свидетельствовала о тканеспецифичной регуляции экспрессии гена At4g01870 стрессорами различной природы.
Рис. 3.
Гистохимический анализ GUS активности. Экспрессия GUS активности обнаружена в 2-недельных А(а–д) и 5-недельных А(е) трансгенных растениях A. thaliana, инкубированных после выращивания и соответствующей обработки фитогормонами и стрессорами в растворе X-Gluc в течение ночи. Для трансформации растений использовалась конструкция, в которой GUS ген находился под контролем максимального фрагмента промотора (Р384) гена At4g01870. А. Локализация GUS активности в различных частях и органах трансгенных растений, выращенных в обычных условиях без воздействия каких-либо экзогенных факторов: а –кончик корня, б – корень, в – поперечный срез листа, г – лист, д – область трихом, е – цветок. Б. Представлен лист 2-недельных трансгенных растений A. thaliana, которые выращивались в контрольных условиях (а), были в течение 5 ч обработаны БАП (б) и АБК (в), подвергнуты воздействию температуры 37°С (г) и 4°С (д).
Измерения активности β-глюкуронидазы флюорометрическим методом у трансгенных растений A. thaliana, несущих максимальный по размеру делеционный фрагмент промотора (Р384 п.н.), в целом соответствовали данным калориметрического окрашивания. АБК, NaCl и гипертермия усиливали экспрессию GUS гена под управлением промотора At4g01870 (151.5 ± 14.1, 147.2 ± 0.7 и 168.5 ± 3.8%, соответственно, относительно контроля), цитокинин и гипотермия не оказывали достоверного воздействия (97 ± 1.2 и 112.2 ± 1.8%), по крайней мере, в пределах исследованного временного интервала.
Таким образом, результаты анализа экспрессии маркерного GUS-гена под контролем фрагмента промотора гена At4g01870 позволяют сделать вывод о возможном участии гена At4g01870 и его продукта в формировании устойчивости к неблагоприятным воздействиям среды при участии АБК.
Количественный анализ экспрессии гена At4g01870
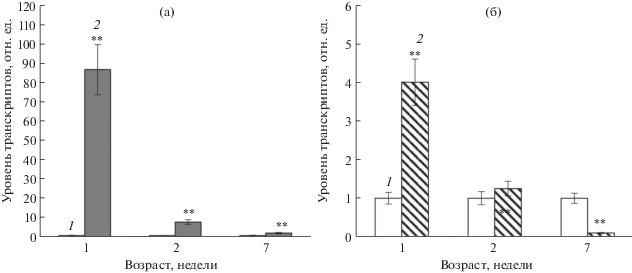
Результаты гистохимического исследования активности промотора гена At4g01870 были сопоставлены с данными анализа экспрессии этого гена методом ПЦР-РВ в растениях A. thaliana дикого типа. На всех изученных стадиях онтогенеза экзогенная АБК активировала накопление транскриптов гена RAB18 (Responsive to ABA), используемого в качестве маркера действия этого фитогормона (рис. 4а). Совершенно другой характер регуляции абсцизовой кислотой наблюдался для гена At4g01870. В 7-дневных проростках Col 0 АБК примерно в 4 раза активировала накопление мРНК этого гена, однако в 2-недельных растениях АБК не вызывала значимых изменений в его экспрессии, а в листьях 7-недельных растений, напротив, подавляла активность (рис. 4б). Таким образом, особенности регуляции экспрессии At4g01870 экзогенной АБК в процессе онтогенеза, положительной или отрицательной, вероятно, опосредованы действием онтогенетических регуляторных факторов.
Рис. 4.
Влияние АБК на относительное содержание транскриптов генов RAB18 (а) и At4g01870 (б) в 1-, 2- и 7-недельных растениях дикого типа A. thaliana. Растения были обработаны в течение 3 ч водой (1 – контроль) или раствором АБК (5 × 10–5 М) (2). Суммарную выделенную РНК анализировали методом ПЦР-РВ. В качестве референсного гена использовали UBQ10. Представлены средние значения трех независимых определений ± SE.
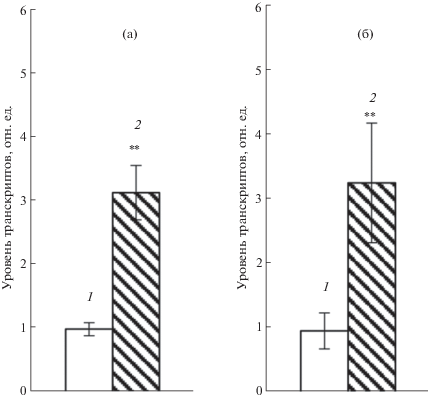
Участие АБК в формировании ответной реакции на стрессы позволяло предполагать стресс-зависимый характер экспрессии гена At4g01870. Действительно, содержание транскриптов гена после 3 часов экспозиции 2-недельных трансгенных растений при 37°С возрастало в надземной части растений (рис. 5а), а при инкубации на растворе NaCl (200 мМ) увеличивалось содержание транскриптов изучаемого гена только в корнях (рис. 5б). Однако гипотермия практически не изменяла уровень накопления транскриптов в течение этого временного периода, что соответствовало результатам анализа экспрессии конструкции РAt4g01870-GUS. Однако, стоит отметить, что реакция на засоление носила выраженный органо-специфичный характер и была ограничена корнями.
Рис. 5.
Эффект гипертермии в наземной части (а) и засоления в корне (б) на экспрессию гена At4g01870 в 2-недельных растениях дикого типа A. thaliana. Растения были выдержаны в течение 3 ч в обычных условиях (1 – контроль), в условиях повышенной температуры +37°С (а, 2) или на растворе NaCl (200 мМ) (б, 2). Выделенную РНК анализировали методом ПЦР-РВ. В качестве референсного гена использовали UBQ10. Представлены средние значения трех независимых определений ± SE.
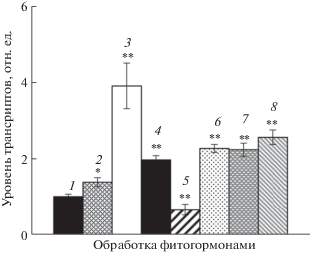
Перепрограммирование экспрессии генома и запуск каскада защитных механизмов при стрессах, как правило, связаны с участием комплекса гормональных систем. Поскольку некоторые цис-элементы промотора At4g01870 (MYB, WRKY), наряду с АБК, вовлечены в регуляцию ИУК, жасмоновой и салициловой кислотами, а также этиленом, мы оценили, как обработка этими гормонами изменяет экспрессию гена At4g01870 у растений дикого типа (рис. 6). После 3 ч экспозиции 7-дневных проростков на растворах ИУК (10–6 М), салициловой кислоты (10–5 М), и предшественника этилена АЦК (10–5 М), накопление транскриптов At4g01870 возрастало как минимум вдвое. Исключение составил метилжасмонат (5 × 10–5 М), реакция на который была выражена значительно слабее, а транс-зеатин (5 × 10–6 М) подавлял экспрессию данного гена. Аналогичные результаты, полученные с использованием технологии ДНК микрочипов, представлены в базе данных ресурса eFP Browser [10]. Они также были частично подтверждены флуорометрическим методом при измерении активности β-глюкуронидазы трансгенных растений A. thaliana, включающих конструкцию РAt4g01870-GUS (Р384). Через 24 ч инкубации трансформантов на растворах ИУК, салициловой кислоты и предшественника этилена АЦК активность фермента достоверно повышалась и составляла соответственно 145.7 ± 1.5, 155.5 ± 9.2 и 152 ± 2.0% от уровня контрольного образца. При этом метилжасмонат не оказывал значимого воздействия (107.8 ± 9.2%). Все это позволяет отнести изучаемый ген к участникам широкого спектра защитных реакций, в той или иной степени вовлеченных в гормональный сигналинг.
Рис. 6.
Гормональная регуляция экспрессии гена At4g01870 в 7-дневных проростках A. thaliana дикого типа. Растения были обработаны в течение 3 ч: 1 – водой, 2 – растворами метилжасмоната (5 × 10–5 М), 3 – АБК (5 × 10–5 М), 4 – АЦК (10–5 М), 5 – транс-зеатина (5 × 10–6 М), 6 – ИУК (10–6 М), 7 – брассинолида (5 × 10–7 М) и 8 – салициловой кислоты (5 × 10–5 М). Относительное содержание транскриптов гена At4g01870 анализировали методом ПЦР-РВ. В качестве референсного гена использовали UBQ10. Представлены средние значения трех независимых определений ± SE.
ОБСУЖДЕНИЕ
В результате проведенного нами in silico анализа промоторной области гена At4g01870 показано наличие в его последовательности цис-элементов, ответственных за связывание АБК-зависимых транскрипционных факторов. Среди них были выявлены такие АБК-зависимые мотивы как ABRE, W-box, RAV1-A, MYB и LFY.
Гены, имеющие в своих промоторных областях мотивы ABRE, являются основными мишенями транскрипционных факторов ABF/AREB [4], активируемых протеинкиназами SnRK2-типа и, следовательно, могут быть целевыми генами цепи трансдукции сигнала АБК, включающей рецепторы PYR/PYL/RCAR [2]. Факторы AREB/ABF принадлежат к подсемейству транс-факторов bZIP и относятся к группе А, насчитывающей в геноме Arabidopsis 9 гомологов. Показано, что некоторые из них индуцируются в ответ на дегидратацию, засоление и обработку АБК. Следовательно, наличие мотивов ABRE в промоторе At4g01870 позволяет предполагать участие продуктов этого гена в физиологических реакциях, связанных с обезвоживанием и засолением. Действительно, солевой стресс способствовал увеличению экспрессии гена, вслед за которой, согласно результатам вестерн-блот анализа, усиливалось накопление кодируемого им белка [9]. Стресс-зависимая активация накопления белка At4g01870 соответствовала функции TolB белка E. сoli, который необходим для поддержания водно-солевого баланса и целостности внешней мембраны. Известно, что помимо АБК в ABRE-опосредованную транскрипцию вовлечен Ca2+. Это означает, что в число мишеней At4g01870 могут попадать различные ионные каналы или белки, регулирующие их активность.
Подобно белку TolB E. сoli, At4g01870 может быть также связан с ответами на действие патогенов. Участие белков Arabidopsis, гомологов TolB, в реакциях детоксикации в ответ на обработку биопатогеном Pseudomonas было выявлено в протеомных исследованиях Mueller с соавт. [26]. Регуляция подобного ответа, возможно, является результатом специфичного действия не одного, а группы фитогормонов, находящихся в тесном взаимодействии друг с другом. С защитными механизмами, обеспечивающими устойчивость к патогенам, наряду с АБК могут быть связаны салициловая и жасмоновая кислоты и этилен. При этом характер взаимодействия АБК с этими фитогормонами может быть как синергичным, так и антагонистичным. Все эти фитогормоны, как было показано в нашей работе, регулировали экспрессию At4g01870, действуя, по всей видимости, через транс-факторы MYB или WRKY.
Функции At4g01870, опосредованные транс-факторами семейства WRKY, не ограничиваются участием в ответах на биотические стрессы. Известно, что один из членов семейства WRKY – WRKY39 – является положительным регулятором сигнальных путей салициловой кислоты и метилжасмоната, активируемых в ответ на тепловой стресс [6]. Возможно, индукция At4g01870 повышенными температурами, продемонстрированная в наших исследованиях, также носит гормон-зависимый характер, однако это предположение требует дополнительной экспериментальной проверки.
Помимо ответов на внешние сигналы, связанные с гормон-зависимыми реакциями, At4g01870, вероятно, принимает непосредственное участие в реализации онтогенетических программ. Согласно биоинформационным данным, накопление транскриптов At4g01870 достигает максимума на стадии ранних зеленых семядолей в процессе эмбриогенеза семян, а затем при их прорастании. На вегетативной стадии преимущественная экспрессия гена сосредоточена в проводящих тканях корня, листьев и чашелистиков, что соответствовало результатам проведенного нами гистохимического анализа трансформантов (рис. 3). При переходе к репродуктивной стадии мРНК и белок At4g01870 накапливались в соцветиях [9]. Молекулярный механизм этого процесса, по-видимому, определялся LFY-зависимой индукцией гена At4g01870, интегрированной в процесс морфогенеза цветковых структур.
Функции гена At4g01870 и кодируемого им белка, вероятно, сопряжены со сложными взаимодействиями различных стимуляторов и ингибиторов роста и переключением вектора гормональной регуляции с позитивного на негативный и наоборот. Так, на ювенильной стадии экспрессия гена At4g01870 в ответ на АБК усиливалась, а в старых листьях снижалась (рис. 4б). Наряду с подавлением синтеза эндогенной АБК по типу обратной связи или сдвигом гормонального баланса, специфичность ответа могла обеспечиваться связыванием с различными транскрипционными факторами, действующими в качестве активаторов или репрессоров экспрессии гена. Подобный механизм, в частности, характерен для семейства WRKY, представители которого могут действовать и как положительные, и как отрицательные регуляторы, причем иногда один и тот же белок WRKY способен выступать в обоих качествах в зависимости от конкретной реакции [6].
Специфичность ответа на АБК позволяет предполагать существование в растительной клетке не единственного линейного пути передачи сигнала этого гормона, а наличие целой регуляторной сети, которая способна формировать различные физиологические реакции [2]. В промоторе At4g01870 нами были выявлены три W-box связываемых транскрипционными факторами семейства WRKY. Эти транс-факторы способны действовать не только в нисходящих участках цепи рецептора PYR/PYL/RCAR, но и являются важными компонентами цепи трансдукции сигнала АБК GUN5-WRKY40-ABI5 [27]. При передаче сигнала АБК через эту цепь Н-субъединица Mg-хелатазы выступает в качестве антагониста транскрипционных репрессоров семейства WRKY и снимает ингибирование гена ABI5. Ранее нами было показано, что у мутантов abi5-1 и gun5-1 отсутствует выраженная АБК-зависимая регуляция экспрессии гена At4g01870 и его гомологов At1g21670 и At1g21680 [28]. Все эти результаты позволяют предполагать, что данные гены являются целевыми для цепи трансдукции сигнала АБК GUN5-WRKY40-ABI5. Заметим также, что помимо АБК, транскрипционный фактор ABI5 может функционировать в качестве интегратора сигналинга таких фитогормонов как ауксины, цитокинины, гиббереловая кислота и брассиностероиды, обеспечивая сбалансированную реакцию растений на абиотический стресс [29].
Таким образом, ген At4g01870 интегрирован в сложную сетевую систему ответов растения на АБК и другие фитогормоны. Известно, что продукт гена содержит в своей структуре консервативные WD40 повторы – участки последовательности из 40 аминокислот с высоким содержанием триптофана, пролина и аспартата, которые отвечают за определенную структурную организацию белка. При наличии не менее трех таких повторов молекула белка может иметь конформацию так называемого бета-пропеллерного домена. Такая структурная единица способна выполнять функцию своеобразной платформы, на базе которой происходит сборка белковых комплексов, участвующих в самых разнообразных процессах: переносе сигналов, сборке транскрипционного аппарата, синтезе и деградации белков и многих других. Учитывая АБК-связывающие свойства белка, за которые отвечают его N-концевой фрагмент и присутствие в промоторе кодирующего его гена цис-элементов, связывающих АБК-зависимые транс-факторы, можно предположить, что белок, кодируемый геном At4g01870, позволяет контролировать проведение гормонального сигнала в клетке, предоставляя структурную платформу для взаимодействия специфичных эффекторных белков, транс-факторов и ионных каналов.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 14-14-00584).
Список литературы
Vishwakarma K., Upadhyay N., Kumar N., Yadav G., Singh J., Mishra R.K., Kumar V., Verma R., Upadhyay R.G., Pandey M., Sharma S. Abscisic acid signaling and abiotic stress tolerance in plants: A review on current knowledge and future prospects // Front. Plant Sci. 2017. V. 8. Article 161.
Hubbard K.E., Nishimura N., Hitomi K., Getzoff E.D., Schroeder J.I. Early abscisic acid signal transduction mechanisms: newly discovered components and newly emerging questions // Genes Dev. 2010. V. 24. P. 1695–1708.
Fujii H., Chinnusamy V., Rodrigues A., Rubio S., Antoni R., Park S.Y., Cutler S.R., Sheen J., Rodriguez P.L., Zhu J.K. In vitro reconstitution of an abscisic signalling pathway // Nature. 2009. V. 462. P. 660−664.
Fujita Y., YoshidaT., Yamaquchi-Shinozaki K. Pivotal role of the AREB/ABF-SnRK2 pathway in ABRE-mediated transcription in response to osmotic stress in plants // Physiol. Plant. 2013. V. 147. P. 15−27.
Dubos C., Stracke R., Grotewold E., Weisshaar B., Martin C., Lepiniec L. MYB transcription factors in Arabidopsis // Trends Plant Sci. 2010. V. 15 P. 573−581.
Bakshi M., Oelmüller R. WRKY transcription factors: Jack of many trades in plants // Plant Signal. Behav. 2014. V. 9. P. e27700-1−18.
Demidenko A.V., Kudryakova N.V., Karavaiko N.N., Kazakov A.S., Cherepneva G.N., Shevchenko G.V., Permyakov S.E., Kulaeva O.N., Oelmüller R., Kusnetsov V.V. The ABA-binding protein AA1 of Lupinus luteus is involved in ABA-mediated responses // Физиология растений. 2015. Т. 62. С. 176−185.
Bonsor D.A., Hecht O., Vankemmelbeke M., Sharma A., Krachler A.M., Housden N.G., Lilly K.J., Moore G.R., Kleanthous C. Allosteric beta-propeller signaling in TolB and its manipulation by translocating colicins // EMBO J. 2009. V. 28. P. 2846−2857.
Барташевич Д.А., Каравайко Н.Н., Кузнецов В.В. Новый АБК-связывающий белок, кодируемый геном AT4G01870 A. thaliana, способен взаимодействовать с РНК in vitro // Доклады академии наук. 2014. Т. 457. С. 235–238.
Kilian J., Whitehead D., Horak J., Wanke D., Weinl S., Batistic O., D’Angelo C. Bornberg-Bauer E., Kudla J., Harter K. The AtGenExpress global stress expression data set: protocols, evaluation and model data analysis of UV-B light, drought and cold stress responses // Plant J. 2007. V. 50. P. 347–363.
Clough, S.J., Bent A.F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana // Plant J. 1988. V. 16. P. 735–743.
Jefferson R.A., Kavanagh T.A. Bevan M.V. GUS-fusions: glucuronidase as a sensitive and versalite gene fusion marker in higher plants // EMBO J. 1987. V. 6 P. 3901−3907.
Vitha S., Benes K., Phillips J.P., Gartland K.M.A. Histochemical GUS analysis // Methods Mol. Biol. 1995. V. 44. P. 185−193.
Данилова М.Н., Кудрякова Н.В., Воронин П.Ю., Оельмюллер Р., Кузнецов В.В., Кулаева О.Н. Мембранные рецепторы цитокинина и их регуляторная роль в реакции растений Arabidopsis thaliana на фотоокислительный стресс в условиях водного дефицита // Физиология растений. 2014. Т. 61. С. 466–475.
Yilmaz A., Mejia-Guerra M.K., Kurz K., Liang X., Welch L., Grotewold E. AGRIS: Arabidopsis Gene Regulatory Information Server, an update // Nucleic Acids Res. 2011. V. 39 (Database issue). P. 1118−1122.
Kim J.-B., Kang J.-Y., Kim S.Y. Over-expression of a transcription factor regulating ABA responsive gene expression confers multiple stress tolerance // Plant Biotech. J. 2004. V. 2. P. 459–466.
Tuteja N. Abscisic acid and abiotic stress // Plant Signal.Behav. 2007. V. 2. P. 135−138.
Roy S. Function of MYB domain transcription factors in abiotic stress and epigenetic control of stress response in plant genome // Plant Signal.Behav. 2016. V. 11. e1117723.
Shinozaki K., Yamaguchi-Shinozaki K. Molecular responses to dehydration and low temperature: Differences and cross-talk between two stress signaling pathways // Curr. Opin. Plant Biol. 2000. V. 3. P. 217–223.
Lamb R.S., Hill T.A., Tan Q.K.G., Irish V.F. Regulation of APETALA3 floral homeotic gene expression by meristem identity genes // Development. 2002. V. 129. P. 2079−2086.
Weigel D., Alvarez J., Smyth D.R., Yanofsky M.F., Meyerowitz E.M. LEAFY controls floral meristem identity in Arabidopsis // Cell. 1992. V. 69. P. 643−659.
Feng C.Z., Chen Y., Wang C., Kong Y.H., Wu W.H., Chen Y.F. Arabidopsis RAV1 transcription factor, phosphorylated by SnRK2 kinases, regulates the expression of ABI3, ABI4, and ABI5 during seed germination and early seedling development // Plant J. 2014. V. 80. P. 654–668.
Fu M., Kang H.K., Son S.H., Kim S.K., Nam K.H. A subset of Arabidopsis RAV transcription factors modulates drought and salt stress responses independent of ABA // Plant Cell Physiol. 2014. V. 55. P. 1892–1904.
Hu Y.X., Wang Y.H., Liu X.F., Li J.Y. Arabidopsis RAV1 is down-regulated by brassinosteroid and may act as a negative regulator during plant development // Cell Res. 2004. V. 14. P. 8–15.
Woo H.R., Kim J.H., Kim J., Kim J., Lee U., Song I.J., Kim J.H., Lee H.Y., Nam H.G., Lim P.O. The RAV1 transcription factor positively regulates leaf senescence in Arabidopsis // J. Exp. Bot. 2010. V. 61. P. 3947–3957.
Mueller S., Hilbert B., Dueckershoff K., Roitsch T., Markus Krischke M., Mueller M.J., Berger S. General detoxification and stress responses are mediated by oxidized lipids through TGA transcription factors in Arabidopsis // Plant Cell. 2008. V. 20. P. 68−85.
Shang Y., Yan L., Liu Z.Q., Cao Z., Mei C., Xin Q., Wu F.Q., Wang X.F., Du S.Y., Jiang T., Zhang X.F., Zhao R., Sun H.L., Liu R., Yu Y.T., Zhang D.P. The Mg-chelatase H subunit of Arabidopsis antagonizes a group of WRKY transcription repressors to relieve ABA-responsive genes of inhibition // Plant Cell. 2010. V. 22. P. 1909−1935.
Виноградов Н.В., Данилова М.В., Кудрякова Н.В., Кузнецов В.В., Кулаева О.Н. АБК-зависимая регуляция экспрессии генов-гомологов AA1 (abscisic acid activated 1) у мутантов A. thaliana с нарушениями синтеза или трансдукции сигнала АБК // Мат. междунар. науч. конф. “Физиология растений − теоретическая основа инновационных агро- и фитобиотехнологий”. 2014. Калининград. С. 33−35.
Skubacz A., Daszkowska-Golec A., Szarejko I. The role and regulation of ABI5 (ABA-insensitive 5) in plant development, abiotic stress responses and phytohormone crosstalk // Front. Plant Sci. 2016. V. 7. Article 1884.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


