Физиология растений, 2019, T. 66, № 4, стр. 266-276
Влияние ежесуточных кратковременных понижений температуры на теплолюбивые и холодостойкие растения
Т. Г. Шибаева a, Е. Н. Икконен a, Е. Г. Шерудило a, А. Ф. Титов a
a Институт биологии Карельского научного центра Российской академии наук,
Федеральный исследовательский центр “Карельский научный центр РАН”
Петрозаводск, Россия
Поступила в редакцию 08.06.2018
После доработки 14.08.2018
Принята к публикации 28.08.2018
Аннотация
В условиях контролируемой среды проведено изучение особенностей ответной реакции типичного холодостойкого вида (пшеница, Triticum aestivum L.) по различным физиолого-биохимическим показателям (рост листьев, биомасса растения, содержание хлорофилла, скорость фотосинтеза и транспирации, относительное содержание воды, относительный выход электролитов, интенсивность перекисного окисления липидов, холодоустойчивость клеток листа) на кратковременные ежесуточные понижения температуры (ДРОП-воздействия) на основе сопоставления с реакцией типичного теплолюбивого вида (огурец, Cucumis sativus L.), а также сравнение их реакции на длительное действие пониженных температур. С этой целью растения огурца и пшеницы подвергали: а) постоянному (круглосуточному) действию температуры 4°С (пшеница), 9°С (огурец) или 12°С (пшеница и огурец); б) действию этих же температур в течение 3 ч ежесуточно в конце ночного периода на протяжении 6 суток. Обнаружено, что, несмотря на значительные качественные и количественные различия в реакциях холодостойких и теплолюбивых растений на постоянное продолжительное действие и последействие пониженных температур, их реакции на ДРОП-воздействия в целом качественно схожи, а степень проявления зависит от степени понижения температуры. И у теплолюбивых, и у холодостойких видов ДРОП-воздействия оказывают тормозящее действие на линейный рост органов растений, вызывают целый спектр физиологических изменений, способствующих более полному проявлению их адаптивного потенциала, в частности, обеспечивая более высокую скорость фотосинтеза при низкой температуре по сравнению с растениями, не подвергавшимися низкотемпературным воздействиям, а также вызывают рост их холодоустойчивости.
ВВЕДЕНИЕ
Хорошо известно, что термоадаптивные возможности разных видов растений могут существенно различаться. В частности, по отношению к низким положительным температурам растения принято делить на теплолюбивые, которые повреждаются низкими положительными температурами, и холодостойкие, которые переносят эти температуры без повреждений, во многих случаях не снижая своей продуктивности. Отличительной особенностью теплолюбивых видов является то, что при снижении температуры до критического уровня (10−12°С) у них происходит нарушение водного режима, снижение скорости фотосинтеза, разрушение хлорофилла и другие изменения, а при длительном действии низкой температуры уменьшение интенсивности дыхания и, как следствие, снижение количества АТФ. Важное различие между этими двумя группами растений заключается еще и в том, что холодостойкие растения способны под влиянием закаливающих (субповреждающих) температур приобретать высокую устойчивость и могут благодаря этому без губительных для себя последствий переносить в дальнейшем действие гораздо более низких температур, чем в незакаленном состоянии, тогда как у теплолюбивых растений способность к закаливанию выражена слабо и носит ограниченный характер [1–4].
Необходимо сказать, что влияние продолжительного (сутки и более) воздействия пониженных температур сравнительно хорошо изучено как на холодостойких, так и на теплолюбивых растениях. Однако, в естественных условиях растения часто сталкиваются с ситуацией, когда температура понижается в суточном цикле всего на несколько часов, а затем повышается до оптимальных (или близким к ним) значений. С подобной ситуацией сталкиваются не только холодостойкие растения, произрастающие в условиях умеренного климата, но и теплолюбивые растения, выращиваемые в открытом грунте умеренной зоны. Причем в начале и в конце вегетационного сезона они могут испытывать кратковременный холодовой стресс многократно. Вместе с тем, хорошо известно, что физиологические нарушения, возникающие под влиянием низкой температуры (остановка движения цитоплазмы, фазовый переход липидов мембран и др.), могут быть обратимыми (reversed) или восстановимыми (repaired), если возврат температуры к норме происходит до того, как произойдут необратимые нарушения и/или повреждения [5]. Более того, показано, что даже непродолжительные периоды тепла в суточном цикле в весенний период на общем фоне пониженных температур позволяют теплолюбивым растениям избежать негативных последствий холода, что в итоге положительно сказывается на урожае [6].
Помимо ситуаций, наблюдаемых в естественных условиях и описанных выше, теплолюбивые растения могут испытывать кратковременное ежесуточное действие пониженных температур в теплицах, так как агротехнический прием под названием “temperature drop” (в Европе) и “temperature dip” или “cool morning pulse” (в США) широко применяют с целью управления ростом растений, как альтернативу использованию ретардантов [7–9]. Таким образом, и холодостойкие, и теплолюбивые растения, произрастающие или выращиваемые в районах с умеренным климатом, довольно часто оказываются в ситуации ежесуточно повторяющихся непродолжительных понижений температуры. Поэтому изучение влияния ДРОП-воздействий (от англ. drop – падение) на растения, помимо теоретического, представляет большой практический интерес.
Следует отметить, что особенностям ответных реакций теплолюбивых растений на ДРОП-воздействия посвящено немало работ, в т.ч. обзорных [7–18], тогда как данных о реакции холодостойких растений на подобный тип низкотемпературного воздействия в литературе крайне мало [10, 15, 17, 18] и поэтому остается открытым вопрос относительно способности холодостойких растений реагировать на кратковременные понижения температуры в суточном цикле аналогично тому, как реагируют теплолюбивые. На основе ранее полученных данных мы предположили, что характер реакции растений на ДРОП-воздействия не зависит от их принадлежности к группе теплолюбивых или холодостойких видов. Однако данное предположение основывалось на крайне ограниченном материале [15, 17, 18] и требовало проведения специального исследования.
Цель работы − изучение особенностей ответной реакции типичного холодостойкого вида (пшеница) на кратковременные ежесуточные понижения температуры (ДРОП-воздействия) на основе сопоставления с реакцией на данный тип температурного воздействия типичного теплолюбивого вида (огурец), а также сравнение реакции указанных видов растений на длительное действие пониженных температур.
МАТЕРИАЛЫ И МЕТОДЫ
Растения огурца (Cucumis sativus L., гибрид Зозуля F1) и пшеницы (Triticum aestivum L., сорт Московская 39) выращивали в камере искусственного климата (“Vötsch”, Германия) методом песчаной проливной культуры при поливе питательным раствором (рН 6.2–6.4) (огурец) и в рулонах фильтровальной бумаги на модифицированном (с добавлением микроэлементов) питательном растворе Кнопа (рН 6.2–6.4) (пшеница) при температуре воздуха 23°С, фотосинтетически активной радиации (ФАР) 200 мкмоль/(м2 с), фотопериоде 12 ч и влажности воздуха 70%.
Растения огурца в возрасте 14 суток и пшеницы в возрасте 6 суток (с момента замачивания семян), когда первый настоящий лист у растений огурца и первый лист у пшеницы находись в фазе активного роста, в течение 6 суток подвергали: а) постоянному (круглосуточному) действию температуры 4°С (пшеница), 9°С (огурец) или 12°С (пшеница и огурец) (варианты ПНТ 4, ПНТ 9 и ПНТ 12) или б) действию этих же температур в течение 3 ч ежесуточно в конце ночного периода (варианты ДРОП 4, ДРОП 9 и ДРОП 12). Контролем служили растения, не подвергавшиеся низкотемпературным воздействиям. Выбор температур определялся тем, что температура 12°С для обоих видов находится вблизи верхней границы зоны закаливания и, кроме того, для теплолюбивых видов является чуть выше критической, при которой происходит фазовый переход липидов мембран из жидкокристаллического в гель-состояния и другие изменения, приводящие к нарушению ионного гомеостаза и метаболическому дисбалансу. Температуры 9 и 4°С для огурца и пшеницы, соответственно, являются близкими к оптимальной с точки зрения закаливающего эффекта [3], которые можно рассматривать как изодозы. По окончании температурных обработок часть растений всех вариантов (ДРОП, ПНТ) переносили на 3 суток в оптимальные температурные условия (23°С). Часть растений огурца из всех вариантов опыта подвергали холодовому тестированию (ХТ) в темноте в течение 3 суток при температуре 8°С. После этого их помещали на восстановление на 2 суток в условия температуры 23°С.
В ходе опыта определяли площадь листьев и сухую биомассу растений. Общее содержание хлорофиллов a и b определяли с помощью измерителя уровня хлорофилла SPAD 502 Plus (“Konica Minolta”, Япония). Для измерений флуоресценции хлорофилла использовали анализатор фотосинтеза с импульсно-модулированным освещением (MINI-PAM, “Walz”, Германия). Определяли потенциальный квантовый выход фотохимической активности ФС II (Fv/Fm) после 20-минутной темновой адаптации листьев.
Видимый фотосинтез (An), устьичную проводимость (gs), транспирацию листьев (Tr) и отношение содержания СО2 в межклеточном пространстве (Ci) к содержанию СО2 в окружающем пространстве (Ca) измеряли с помощью портативной фотосинтетической системы HCM-1000 (“Walz”, Германия) при температуре листа 12 и 23°С и ФАР, равной 1000 мкмоль/(м2 с). Параметры газообмена определяли после полной стабилизации процесса.
Эффективность использования воды была рассчитана как отношение An к Tr. Величину относительного содержания воды (ОСВ) рассчитывали как процент содержания воды в опытной растительной ткани от ее содержания в той же ткани в состоянии полного насыщения.
Содержание продуктов, реагирующих с тиобарбитуровой кислотой (ТБК) (ТБК-РП), определяли по стандартной методике, основанной на образовании триметинового комплекса с максимумом поглощения 532 нм при взаимодействии данных соединений с ТБК [19].
Холодоустойчивость клеток листьев пшеницы оценивали по температуре (ЛТ50), вызывающей гибель 50% палисадных клеток листовых высечек после их промораживания в течение 5 мин в термоэлектрическом микрохолодильнике ТЖР-02/-20 (“Интерм”, Россия) при последовательном изменении тестирующих температур с шагом 0.4°С [20]. Жизнеспособность клеток определяли с помощью светового микроскопа Микмед-2 (“ЛОМО”, Россия) по коагуляции цитоплазмы и деструкции хлоропластов.
Относительный выход электролитов (ОВЭ) из тканей листа определяли кондуктометрически [21] с использованием кондуктометра Эксперт-002 с датчиком для микрообьемов УЭП-П-С (“Эконикс-Эксперт”, Россия).
Площадь листьев, содержание хлорофилла и Fv/Fm измеряли ежесуточно в течение 6 суток низкотемпературных воздействий и затем в течение 3 суток, когда растения находились при температуре 23°С. ОСВ, сухую массу растений, An, Tr, gs, Ci/Ca и ЭИВ измеряли через сутки после завершения ПНТ- и ДРОП-воздействий. Измерения ОВЭ и содержания ТБК-РП проводили до и после ХТ.
На рисунках представлены результаты в виде средних значений (6 и более биологических повторностей в каждом варианте) и их стандартных ошибок. Для данных, представленных в таблице 1 и на рис. 3, достоверность различий между средними значениями исследованных параметров определяли на основе дисперсионного анализа (LSD тест) с использованием программного обеспечения Statistica (v. 8.0.550.0, “StatSoft, Inc.”). Разницу между средними значениями считали значимой при P < 0.05.
РЕЗУЛЬТАТЫ
Анализ динамики роста растений огурца и пшеницы, подвергавшихся ДРОП-воздействиям или постоянному действию температуры 12 и 9°С (для огурца), 12 и 4°С (для пшеницы) в течение 6 суток, показал, что у огурца по скорости роста листьев варианты ДРОП 12 и ДРОП 9 не отличались от контроля, в варианте ПНТ 12 рост листьев был сильно заторможен (прирост площади за 6 суток опыта составил 18% по сравнению с контролем), а в варианте ПНТ 9 остановлен полностью (рис. 1а). У растений пшеницы рост листьев в вариантах ДРОП 12 и ДРОП 4 также не отличался достоверно от контроля, в варианте ПНТ 12 был явно ниже (прирост площади листьев составил 49% от контроля), а в варианте ПНТ 4 увеличения площади листьев почти не происходило (рис. 1б).
Рис. 1.
Площадь листьев (а, б), содержание хлорофилла (в, г), Fv/Fm (д, е) у растений огурца (а, в, д) и пшеницы (б, г, е), не подвергавшихся действию низких температур (контроль) и подвергавшихся 3-часовому ежесуточному понижению температуры до 12°С (ДРОП 12) или до 9°С (ДРОП 9) (огурец) и 4°С (ДРОП 4) (пшеница) или постоянному действию температуры 12°С (ПНТ 12) или 9°С (ПНТ 9) (огурец) и 4°С (ПНТ 4) (пшеница). Вертикальная пунктирная линия разделяет период с 1 по 6 сутки, когда растения подвергались низкотемпературным воздействиям, и последующий период, когда все растения находились при температуре 23°С. △ − контроль, ⚪ − ДРОП 12, ⚫ − ДРОП 9, ◆ − ДРОП 4, ◻ − ПНТ 12, ◼ − ПНТ 9, ◇ − ПНТ 4.

Содержание хлорофилла в листьях огурца увеличивалось по мере их роста. Через 6 суток опыта в вариантах ДРОП 12 и ДРОП 9 содержание хлорофилла у огурца было несколько ниже по сравнению с контрольными растениями (рис. 1в). В варианте ПНТ 12 накопление хлорофилла было сильно заторможено, а в варианте ПНТ 9 содержание хлорофилла уменьшалось в течение всех 6 суток опыта. У пшеницы накопление хлорофилла в варианте ДРОП 12 не отличалось достоверно от контроля, а в варианте ДРОП 4 было несколько ниже (рис. 1г). В обоих вариантах с ПНТ содержание хлорофилла снижалось в первые же сутки действия пониженной температуры и дальнейшего накопления хлорофилла не происходило. Более значительное снижение отмечено в варианте ПНТ 4.
Величина максимального квантового выхода фотохимической активности ФС II (Fv/Fm) у огурца в обоих вариантах ДРОП не отличалась от контроля, в варианте ПНТ 12 была несколько ниже, но не ниже 0.79 (рис. 1д). В варианте ПНТ 9 отмечено значительное уменьшение значений Fv/Fm (до 0.65) уже после первых суток действия пониженной температуры, которое продолжалось до пятых суток опыта, когда величина Fv/Fm достигала предельно низких значений 0.3, свидетельствующих о серьезных повреждениях в фотосинтетическом аппарате (ФСА). У пшеницы значения Fv/Fm в обоих вариантах с ДРОП-воздействиями и в варианте ПНТ 12 не отличались от контрольных (рис. 1е). В варианте ПНТ 4 происходило снижение этого показателя в первые трое суток действия пониженной температуры до 0.65 с последующим увеличением к 6 суткам до 0.77.
После завершения низкотемпературных воздействий (ДРОП и ПНТ) все растения были помещены на трое суток в условия температуры 23°С. У растений огурца в обоих вариантах с ДРОП-воздействиями сохранялась прежняя скорость роста листьев, в варианте ПНТ 12 происходило быстрое возобновление роста, а в варианте ПНТ 9 отмечено лишь очень слабое начало роста листьев (рис. 1а). У пшеницы в обоих вариантах с ДРОП-воздействиями также скорость роста была прежней, в варианте ПНТ 12 наблюдалось некоторое усиление роста, а в варианте ПНТ 4 происходило быстрое возобновление роста листьев (рис. 1б).
По содержанию хлорофилла листья огурца из вариантов ДРОП 12 и ДРОП 9 уже через сутки не отличались от контрольных (рис. 1в). В варианте ПНТ 12 содержание хлорофилла в листьях резко увеличивалось и уже через 3 суток почти достигало уровня контроля, а в варианте ПНТ 9 накопление хлорофилла было незначительным. У пшеницы содержание хлорофилла резко увеличивалось в вариантах ПНТ 12 и ПНТ 4 и через 3 суток при оптимальной температуре все варианты не отличались достоверно от контроля (рис. 1г).
Значения Fv/Fm у огурца в варианте ПНТ 12 возрастали и уже через сутки в оптимальных условиях достигали контрольных значений, но в варианте ПНТ 9 значения хотя и увеличивались, но даже за 3 суток не достигали уровня контроля (рис. 1д). У растений пшеницы, наоборот, значения Fv/Fm в варианте ПНТ 4 уже через 2 суток были сопоставимы с контролем (рис. 1е), свидетельствуя о восстановлении фотохимической активности ФС II.
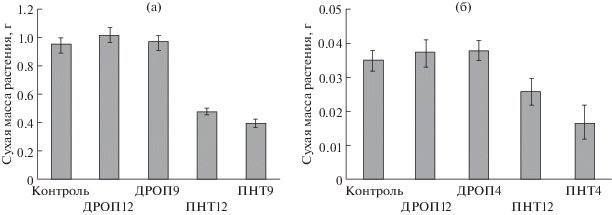
По окончанию низкотемпературных воздействий растения огурца и пшеницы в обоих вариантах с ДРОП-воздействиями не отличалась по биомассе от контрольных, в то время как биомасса растений в вариантах ПНТ 12, ПНТ 9 и ПНТ 4 была ниже, чем у контрольных растений на 25 и 50% у огурца и на 50 и 58% у пшеницы, соответственно (рис. 2а, 2б).
Рис. 2.
Сухая масса растений огурца (а) и пшеницы (б), не подвергавшихся действию низких температур (контроль) и подвергавшихся 3-часовому ежесуточному понижению температуры до 12°С (ДРОП 12) или до 9°С (ДРОП 9, огурец) и 4°С (ДРОП 4, пшеница) или постоянному действию температуры 12°С (ПНТ 12) или 9°С (ПНТ 9, огурец) и 4°С (ПНТ 4, пшеница).
Относительное содержание воды (ОСВ) в листьях огурца у растений из вариантов ДРОП не отличалось от контроля, а в вариантах ПНТ 12 и ПНТ 9 было ниже на 7 и 11% (таблица 1). У пшеницы снижение ОСВ (на 13%) отмечено только в варианте ПНТ 4.
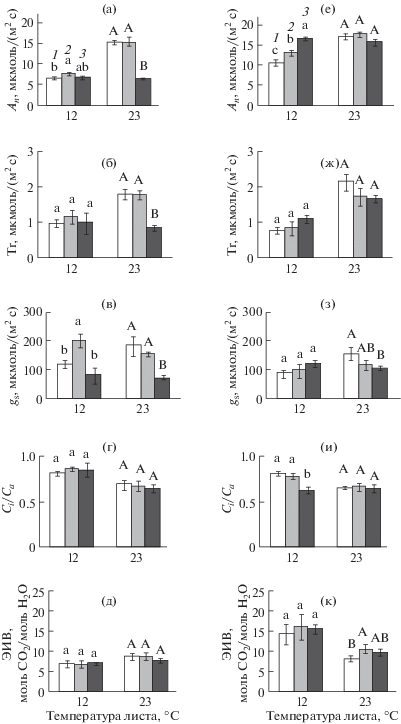
Рис. 3.
Видимый фотосинтез (An) (а, е), транспирация (Tr) (б, ж), устьичная проводимость (gs) (в, з), отношение содержания СО2 в межклеточном пространстве (Ci) к содержанию СО2 в окружающем пространстве (Ca) (г, и) и эффективность использования воды на фотосинтез (ЭИВ) (д, к) на уровне листа у растений огурца (а–д) и пшеницы (е–к), не подвергавшихся действию низких температур (1) и подвергавшихся 3-часовому ежесуточному понижению температуры (до 12°С огурец и до 4°С пшеница) (2) или постоянному действию низкой температуры (12°С огурец и 4°С пшеница) (3). Измерения выполнены при температуре листа 12 и 23°С. В пределах каждого параметра и каждого вида растений разные буквы указывают на достоверность различий средних значений при уровне значимости Р < 0.05.
Относительный выход электролитов (ОВЭ) у огурца достоверно отличался от контроля (на 13% выше) только в варианте ПНТ 9, а в вариантах с ДРОП-воздействиями отмечалась лишь тенденция снижения ОВЭ относительно контроля (таблица 1). У пшеницы также в вариантах ДРОП и ПНТ 12 значения ОВЭ были ниже контрольных, а в варианте ПНТ 4 превышали контроль. Содержание ТБК-РП и у огурца, и у пшеницы было ниже по сравнению с контролем в вариантах ДРОП и ПНТ 12, но значительно повышалось в вариантах ПНТ 9 (у огурца) и ПНТ 4 (у пшеницы) (таблица 1).
Таблица 1.
Относительное содержание воды (ОСВ), относительный выход электролитов (ОВЭ), содержание ТБК-РП (до и после холодового тестирования (ХТ)) у огурца и пшеницы, не подвергавшихся действию низких температур (контроль) и подвергавшихся 3-часовому ежесуточному понижению температуры до 12°С (ДРОП 12) или до 9°С (ДРОП 9, огурец) и 4°С (ДРОП 4, пшеница) или постоянному действию температуры 12°С (ПНТ 12) или 9°С (ПНТ 9, огурец) и 4°С (ПНТ 4, пшеница)
| Вариант опыта | ОСВ, % | ОВЭ, % до/после ХТ |
Содержание ТБК-РП, мМ/г сухого веса, до/после ХТ |
|---|---|---|---|
| Огурец | |||
| Контроль | 86.0б | 13.1а/14.3б | 126в/290в |
| ДРОП 12 | 85.6б | 12.6а/12.6а | 113б/242б |
| ДРОП 9 | 86.3б | 12.1а/12.9а | 117б/223б |
| ПНТ 12 | 78.5а | 12.3а/13.4а | 83а/161а |
| ПНТ 9 | 74.6a | 26.5б/38.6в | 188г/333г |
| Пшеница | |||
| Контроль | 96.2б | 6.1в | 154в |
| ДРОП 12 | 97.5б | 5.5б | 120a |
| ДРОП 4 | 98.1б | 5.2б | 141б |
| ПНТ 12 | 94.8б | 4.3a | 102a |
| ПНТ 4 | 83.6a | 8.1г | 189г |
У растений огурца после холодового тестирования (8°С в течение 4 суток, затем 23°С в течение 2 суток) ОВЭ в листьях растений в обоих вариантах ДРОП и ПНТ 12 был немного ниже, чем в контроле, а в варианте ПНТ 9 значительно (в 2.5 раза) превышал контроль (таблица 1). Содержание ТБК-РП в обоих вариантах ДРОП и ПНТ 12 было значительно ниже, чем у контрольных растений, а в варианте ПНТ 9 превосходило контрольные значения на 15%.
У растений пшеницы холодоустойчивость листьев (ЛТ50) повышалась под влиянием ДРОП 12 и ДРОП 4 на 2.5 и 3°С, а под влиянием ПНТ 12 и ПНТ 4 − на 2.3 и 1.9°С, соответственно.
Для анализа газообмена растений использовали растения огурца из вариантов ДРОП 12 и ПНТ 12 и растения пшеницы из вариантов ДРОП 4 и ПНТ 4, так как у теплолюбивого огурца при температуре 9°С в случае ее постоянного действия фотосинтетическая активность была крайне низкая (рис. 1д), а для холодостойкой озимой пшеницы температура 12°С, в случае ее непродолжительного действия, оказывала малозаметное влияние на фотосинтетическую активность и газообмен растений. При температуре измерения 23°С скорость видимого фотосинтеза (An) у обоих видов растений в вариантах ДРОП не отличалась достоверно от значений контрольных растений (рис. 3а, 3е). Под влиянием ДРОП-воздействий скорость видимого фотосинтеза при температуре измерения 12°С у обоих видов растений возрастала. Так, значения An у огурца и пшеницы в вариантах ДРОП были выше контрольных соответственно на 17 и 23% (рис. 3а, 3е). В варианте ПНТ величина An у пшеницы не отличалась от контрольного значения при температуре измерения 23°С и превышала таковое на 57% при температуре измерения 12°С (рис. 3е). В отличие от пшеницы, у растений огурца в варианте ПНТ значения An были ниже, чем в контроле, при обоих температурах измерения, но особенно существенно при 23°С (рис. 3а). Следует отметить, что у пшеницы и огурца в вариантах ПНТ скорости An при разных температурах измерения различались незначительно, что отражает снижение температурной зависимости процесса фотосинтеза растений, подвергавшихся данному типу низкотемпературного воздействия.
У пшеницы низкотемпературные воздействия обоих типов не влияли на потери воды вследствие транспирации (Tr) (рис. 3ж), а у растений огурца действие ПНТ в отличие от ДРОП снижало величину Tr относительно контроля на 47% при оптимальной температуре измерения (рис. 3б). ДРОП-воздействия повлияли на функционирование устьичного аппарата в большей степени у растений огурца, чем у пшеницы. Так, у растений огурца из варианта ДРОП отмечалось частичное раскрытие устьиц и повышение величины gs на 65% при температуре измерения 12°С (рис. 3в). У растений огурца из варианта ПНТ gs было ниже контрольных величин на 33 и 52% соответственно при 12 и 23°С. Оба низкотемпературных типа воздействий не влияли на содержание СО2 в межклеточном пространстве у растений огурца, но у озимой пшеницы при 12°С величина Ci/Ca снижалась в варианте ПНТ, возможно, в результате активного вовлечения СО2 в углеродный метаболизм (рис. 3г, 3и). Холодовые воздействия не сказывались на эффективности использования воды (ЭИВ) на фотосинтез в листьях огурца, но у растений пшеницы в варианте с ДРОП-воздействиями ее значения на 30% превышали контрольные в оптимальных температурных условиях (рис. 3д, 3к).
ОБСУЖДЕНИЕ
Результаты проведенных исследований показали, что в реакциях растений пшеницы и огурца на длительное постоянное действие пониженных температур (оцениваемым по показателям роста фотосинтетической активности и холодоустойчивости) существуют значительные различия, тогда как реакция на кратковременные ежесуточные понижения температуры (ДРОП-воздействия) сходна. Как и ожидалось, пониженная температура (9°С для огурца и 4°С для пшеницы) при ее постоянном действии тормозила рост растений и накопление хлорофилла. Но при этом в условиях оптимальной температуры после прекращения низкотемпературных воздействий у холодостойкой пшеницы наблюдалось быстрое возобновление роста и накопления хлорофилла, а у теплолюбивого огурца восстановление происходило очень медленно. В отличие от постоянного действия пониженной температуры, ДРОП-воздействия с использованием тех же температур у обоих видов не влияли или оказывали лишь незначительное влияние на рост листьев и содержание хлорофилла. Таким образом, несмотря на значительные количественные и качественные различия в реакции теплолюбивых и холодостойких растений на действие повреждающих и субповреждающих низких температур [22], можно полагать, что многие реакции на легкий (мягкий) холодовой стресс у них однотипны. Известно, например, что холодовой стресс (7°С) оказывает сходное влияние на ферменты биосинтеза хлорофилла у огурца и пшеницы [23]. У пшеницы в силу особенностей ее анатомии трудно проследить эффект ДРОП-воздействий на рост растений в высоту. Но у холодостойких растений капусты ДРОП-воздействия тормозили линейный рост органов растений (рост стебля, черешков и листьев) [15]. У теплолюбивых растений влияние ДРОП-воздействий на линейный рост органов растений проявляется еще сильнее, и он многократно подтвержден на разных культурах [7–10, 15–18].
В наших опытах при действии самой низкой (из изученных) постоянной температуры и у огурца (9°С), и у пшеницы (4°С) снижались значения потенциального квантового выхода фотохимической активности ФСII (Fv/Fm), что свидетельствует о нарушениях в ФСА. Из литературы известно, что при постоянном действии низких закаливающих температур фотоингибирование происходит как у теплолюбивых (огурец, томат, фасоль, кукуруза, просо, сорго, каянус, рис), так и у холодостойких (ячмень, бобы, горох, пшеница) растений, но у первых оно выражено значительно сильнее [24]. В наших опытах у холодостойкой пшеницы в условиях температуры 4°С отмечена довольно быстрая адаптация, и значения Fv/Fm возрастали при продолжающемся действии пониженной температуры, а затем в условиях нормальной температуры (23°С) быстро достигали уровня контрольных растений. У теплолюбивого огурца восстановления до уровня контроля во временных рамках эксперимента не происходило. В отличие от постоянного действия пониженной температуры, ДРОП-воздействия с применением тех же самых пониженных температур у обоих видов не вызывали снижения величины Fv/Fm. Помимо огурца и пшеницы это наблюдали и на других теплолюбивых и холодостойких растениях при ДРОП-воздействиях [15].
При постоянном действии пониженной температуры скорость фотосинтеза у огурца снижалась при всех температурах измерения, а растения пшеницы демонстрировали адаптацию ФСА к низкой температуре, что позволяло им иметь при температуре 12°С более высокую скорость фотосинтеза по сравнению с контролем. Эти результаты вполне ожидаемы, так как известно, что фотосинтез является одним из наиболее чувствительных к низкой температуре физиологических процессов [25], а снижение фотосинтетической активности − одна из ранних ответных реакций на холод у теплолюбивых растений [26]. При этом ДРОП-воздействия у обоих видов привели к увеличению скорости фотосинтеза при температуре измерения 12°С. Поддержание высокой скорости фотосинтеза при пониженных температурах обеспечивает растения ассимилятами, т.е. необходимым материалом для адаптивных изменений, способствующих сохранению функционально активного состояния растений в условиях действия холода. Полученные результаты свидетельствуют о том, что не только холодостойкая пшеница, но и теплолюбивый огурец способен адаптироваться к условиям холода под воздействием краткосрочных ежесуточных понижений температуры. Наши данные о реакции растений на ДРОП-воздействия согласуются с результатами, полученными на теплолюбивых культурах, когда при пониженных (но не экстремальных) ночных температурах происходит незначительное снижение скорости роста, но без снижения продуктивности [27].
Низкотемпературные воздействия обоих типов не влияли или оказывали очень незначительное влияние на скорость транспирации и устьичную проводимость у пшеницы, тогда как у огурца они снижались в случае постоянного действия пониженной температуры. Это согласуется с известным фактом, что пониженная температура снижает способность поглощать воду у теплолюбивых видов в большей степени, чем у холодостойких, ввиду большей вязкости и меньшей проницаемости мембран у первых [28]. У огурца ДРОП-воздействия приводили к увеличению устьичной проводимости при температуре измерения 12°С, что уже отмечалось нами ранее [11]. Это способствует расширению адаптивных возможностей растений, подвергнутых ДРОП-воздействиям, и обуславливает более высокую скорость фотосинтеза при пониженной температуре по сравнению с контролем и растениями в варианте ПНТ. У пшеницы отмечено повышение эффективности использования воды на фотосинтез, причем более ощутимое под влиянием ДРОП-воздействий. Это согласуется с мнением о том, что свойства, которые придают растениям холодостойкость, сходны с теми, которые приводят к более высокой эффективности использования воды на фотосинтез [29]. Повышение эффективности использовании воды является важным механизмом засухоустойчивости. В наших опытах растения пшеницы, судя по значениям ОСВ, оказались действительно более устойчивыми к водному стрессу, вызванному пониженной температурой, чем растения огурца, однако это касалось только вариантов опыта с постоянным действием пониженной температуры. При ДРОП-воздействиях с использованием тех же низких температур ОСВ оставалось неизменным у обоих видов растений.
В наших опытах по устойчивости растений к холоду мы судили по значениям ОВЭ, интенсивности ПОЛ, в том числе после холодового тестирования (у огурца) и по показателю холодоустойчивости листьев, измеренному с помощью ЛТ50 (у пшеницы). В вариантах ПНТ 9 у огурца и ПНТ 4 у пшеницы происходило увеличение значений ОВЭ и интенсивности ПОЛ, свидетельствуя, что у обоих видов, в том числе холодостойкой пшеницы, при постоянном действии низкой температуры развивается окислительный стресс и нарушается структурно-функциональная целостность мембран. Отметим, что увеличение содержания малонового диальдегида (МДА) уже в первые 2 ч действия холода (4°C) с последующим ростом в течение 3 суток наблюдалось даже у озимой пшеницы с. Мироновская 808, считающегося одним из наиболее морозоустойчивых сортов [30]. Очевидно, что в липидах мембран озимой пшеницы при действии температуры 4°С происходят серьезные изменения, когда растения без предварительной подготовки подвергаются действию холода. Реакция огурца и пшеницы на ДРОП-воздействия разной интенсивности была сходная − значения ОВЭ и интенсивности ПОЛ снижались, что еще раз указывает на способность растений, в том числе теплолюбивого огурца, адаптироваться к низкой температуре и на способность пшеницы повышать холодоустойчивость в результате кратковременных понижений температуры. Вероятно, это связано с тем, что когда кратковременные (3 ч) понижения температуры чередуются в суточном цикле с продолжительными (21 ч) периодами действия оптимальной температуры, то в течение теплых периодов происходит восстановление возможных отклонений и/или нарушений в ФСА, вызванных холодом, ввиду их обратимости. Кроме того, такие физиологические нарушения как фазовый переход липидов мембран, остановка движения цитоплазмы и другие также обратимы или восстановимы, если возврат температуры к норме происходит до того, как произойдут необратимые нарушения и/или повреждения [5]. Помимо огурца и пшеницы, отсутствие влияния ДРОП-воздействий на интенсивность ПОЛ мы наблюдали и у других теплолюбивых и холодостойких культур [15].
Если судить по приросту холодоустойчивости листьев у пшеницы, ДРОП-воздействия при использовании температуры 4°С были более эффективны, чем действие ПНТ 4. Вероятно, это также объясняется тем, что в ситуации, когда действие пониженной температуры не является постоянным, а чередуется с продолжительными теплыми периодами, растения могут восстановить возникшие нарушения и/или повреждения, метаболизировать и/или нейтрализовать появившиеся токсические продукты, не давая им накапливаться. Кроме того, в этом случае они располагают достаточным временем (более 20 ч) для пополнения энергетических и пластических ресурсов, необходимых для формирования повышенной устойчивости [16], в то время как при постоянном действии пониженной температуры происходит постепенное истощение энергетических и пластических ресурсов и, как следствие, процесс повышения устойчивости останавливается на более низком, чем в случае с ДРОП-воздействиями, уровне. Увеличение холодоустойчивости листьев в ответ на ДРОП-воздействия наблюдали также у теплолюбивых томата и сладкого перца и холодостойких гороха, картофеля, капусты, ячменя [10, 17, 18]. При этом при ДРОП-воздействиях, как неоднократно отмечалось и ранее [10, 16–18], не снижается биомасса растений по сравнению с контролем, тогда как при постоянном действии тех же температур происходит задержка роста и накопления биомассы. Такая специфика ДРОП-воздействий обусловлена, как мы предполагаем, тем, что охлаждение запускает в клетках и тканях надземных органов растений программу адаптационных изменений (сопряженную с торможением роста и развития), что приводит к повышению устойчивости растений, а благодаря чередованию в суточном цикле периодов охлаждения с гораздо более продолжительными периодами (более 20 ч) действия оптимальной для роста температуры, происходит репрограммирование и возобновление ростовой и онтогенетической программ. В результате этого под влиянием ДРОП-воздействий растения, не снижая скорости фотосинтеза, не только накапливают биомассу, но и приобретают при этом более высокую (по отношению к контролю) холодоустойчивость.
Таким образом, полученные результаты показали, что, несмотря на значительные качественные и количественные различия в реакциях холодостойких и теплолюбивых растений на постоянное продолжительное действие и последействие пониженных температур, их реакции на кратковременные ежесуточные понижения температуры (ДРОП-воздействия) в целом качественно схожи, а степень проявления зависит от степени понижения температуры. И у теплолюбивых, и у холодостойких видов ДРОП-воздействия вызывают торможение линейного роста органов растений, а также целый спектр других физиологических изменений, способствующих более полному проявлению адаптивного потенциала, что, в частности, обеспечивает более высокую скорость фотосинтеза при низкой температуре по сравнению с растениями, не подвергавшимися низкотемпературным воздействиям, а также рост их холодоустойчивости. Помимо этого, полученные данные позволяют думать, что постоянное продолжительное действие (несколько суток) холода на растения и ДРОП-воздействия следует рассматривать как два разных типа (вида) низкотемпературных воздействий, в адаптации к которым растения используют как общие, так и разные (специфические) защитно-приспособительные механизмы, набор и соотношение которых могут варьировать не только в зависимости от интенсивности и продолжительности низкотемпературного воздействия, но и от сопутствующих внешних условий (свет, влажность и т.д.).
Работа выполнена с использованием оборудования Центра коллективного пользования Карельского научного центра Российской академии наук и средств федерального бюджета на выполнение государственного задания (№ 0221-2017-0051).
Список литературы
Генкель П.А., Кушниренко С.В. Холодостойкость растений и термические способы ее повышения. М.: Наука, 1966. 224 с.
Graham D., Patterson B.D. Responses of plant to low, non-freezing temperatures: proteins, metabolism, and acclimation // Annu. Rev. Plant Physiol. 1982. V. 33. P. 347−480.
Титов A.Ф., Таланова В.В., Акимова Т.В., Топчиева Л.В. Устойчивость растений в начальный период действия неблагоприятных температур. М.: Наука, 2006. 143 с.
Попов В.Н., Антипина О.В., Трунова Т.И. Перекисное окисление липидов при низкотемпературной адаптации листьев и корней теплолюбивых растений табака // Физиология растений. 2010. Т. 57. С. 153−156.
Jones H.G. Plant and microclimate: a quantitative approach to environmental plant physiology // Cambridge University Press. 2014. 423 p.
Koscielniak J., Biesaga-Koscielniak J. The effect of short warm breaks during chilling on water status, intensity of photosynthesis of maize seedlings and final grain yield // J. Agron. Crop Sci. 2000. V. 184. P. 1−12.
Erwin J.E., Heins R.D. Thermomorphogenic responses in stem and leaf development // Hort. Sci. 1995. V. 30. P. 940−949.
Myster J., Moe R. Effect of diurnal temperature alternations on plant morphology in some greenhouse crops: a mini review // Sci. Hort. 1995. V. 62. P. 205–215.
Moe R., Heins R.D. Thermo- and photomorphogenesis in plants // Advances in floriculture research. Report no. 6. / Ed. Strømme E. Agricultural University of Norway: Spekter, Oslo, 2000. P. 52–64.
Марковская Е.Ф., Сысоева М.И., Шерудило Е.Г. Кратковременная гипотермия и растение. Петрозаводск: Карельский научный центр РАН, 2013. 194 с.
Икконен Е.Н., Шибаева Т.Г., Сысоева М.И., Шерудило Е.Г. Устьичная проводимость Cucumis sativus L. при длительном и кратковременном действии низких температур // Физиология растений. 2012. Т. 59. С. 716−720.
Икконен Е.Н., Шибаева Т.Г., Титов А.Ф. Реакция фотосинтетического аппарата листа у Cucumis sativus L. на кратковременное ежесуточное понижение температуры // Физиология растений. 2015. Т. 62. С. 528−532.
Икконен Е.Н., Шибаева Т.Г., Титов А.Ф. Влияние кратковременных ежесуточных понижений температуры на соотношение дыхания и фотосинтеза у теплолюбивых растений // Физиология растений. 2018. Т. 65. С. 63−69.
Ikkonen E.N., Shibaeva T.G., Titov A.F. The role of light in cucumber plant response to a diurnal short-term temperature drop // J. Stress Physiol. Biochem. 2017. V. 13. P. 35−44.
Шибаева Т.Г., Шерудило Е.Г., Титов А.Ф. Реакция теплолюбивых и холодостойких растений на ежесуточные кратковременные понижения температуры // Всерос. науч. конф. “Фундаментальные и прикладные проблемы современной экспериментальной биологии растений”. М.: ИФР РАН, 2015. С. 737−741.
Шибаева Т.Г., Шерудило Е.Г., Титов А.Ф. Реакция растений Cucumis sativus L. на длительное постоянное и кратковременные ежесуточные воздействия низких температур // Физиология растений. 2018. Т. 65. С. 143−152.
Sysoeva M.I., Sherudilo E.G., Markovskaya E.F. Obshatko L.A., Matveyeva E.M. Temperature drop as a tool for cold tolerance increment in plants // Plant Growth Regul. 2005. V. 46. P. 189−191.
Марковская Е.Ф., Сысоева М.И., Шерудило Е.Г. Феномен ежесуточного кратковременного влияния низких закаливающих температур на жизнедеятельность растения // Онтогенез. 2008. Т. 39. С. 323−332.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189–198.
Drozdov S.N., Titov A.F., Talanova V.V., Kritenko S.P., Sherudilo E.G., Akimova T.V. The effect of temperature on cold and heat resistance of growing plants. I. Chilling-sensitive species // J. Exp. Bot. 1984. V. 35. P. 1595−1602.
Гришенкова Н.Н., Лукаткин А.С. Определение устойчивости растительных тканей к абиотическим стрессам с использованием кондуктометрического метода // Поволжский экологический журнал. 2005. № 1. С. 3–11.
Saltveit M.E. Discovery of chilling injury // Discovery of plant biology / Eds. Kung S.D., Yang S.F. Singapore: Word Scientific Publishing Co., 2000. V. 3. P. 423–448.
Tewari A.K., Tripathy B.C. Temperature-stress-induced impairment of chlorophyll biosynthetic reactions in cucumber and wheat // Plant Physiol. 1998. V. 117. P. 851–858.
Hetherington S.E., He J., Smillie R.M. Photoinhibition at low temperature in chilling-sensitive and -resistant plants // Plant Physiol. 1989. V. 90. P. 1609−1615.
Креславский В.Д., Карпентиер Р., Климов В.В., Мурата Н., Аллахвердиев С.И. Молекулярные механизмы устойчивости фотосинтетического аппарата к стрессу // Биологические мембраны. 2007. Т. 24. С. 195–217.
Öquist G. Effects of low temperature on photosynthesis // Plant, Cell and Environ. 1983. V. 6. P. 281−300.
Franco T. Effects of stressful and unstressful low temperature on vegetable crops: morphological and physiological aspects // Acta Hortic. 1990. V. 287. P. 67−76.
Levitt J. Responses of plants to environmental stresses: chilling, freezing and high temperature stresses. Academic Press: New York, 1980. 497 p.
Gremer J.R., Kimball S., Angert A.L., Venable D.L., Huxman T.E. Variation in photosynthetic response to temperature in a guild of winter annual plants // Ecology. 2012. V. 93. P. 2693–2704.
Hou Y.-D., Guo Z.-F., Yi Y., Li H.-N., Li H.-G., Chen L.-J., Ma H., Zhang L., Lin J.-W., Zhang M. Effects of cold acclimation and exogenous phytohormone abscisic acid treatment on physiological indicators of winterness wheat // J. Plant Sci. 2010. V. 5. P. 125–136.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


