Физиология растений, 2019, T. 66, № 4, стр. 313-320
Донорно-акцепторные связи в растении картофеля
Т. К. Головко a, Г. Н. Табаленкова a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
Поступила в редакцию 06.04.2018
После доработки 28.05.2018
Принята к публикации 05.06.2018
Аннотация
С использованием метода меченых атомов исследовали закономерности функционирования донорно-акцепторной системы растений картофеля на северной границе возделывания. Метку вводили фотосинтетически, экспонируя отдельные листья или всю надземную часть в атмосфере с 14СО2 на разных этапах роста и развития растений. Показано, что величина оттока ассимилятов из листьев зависела от возраста листа, его положения на стебле и этапа онтогенеза растения. Молодые листья нижнего яруса рано становились донорами и экспортировали продукты текущего фотосинтеза в стебли и корни, обеспечивая собственный рост субстратами из материнского клубня. При этом в стеблях депонировалось в 2 раза больше 14С-ассимилятов, чем поступало в корни. Листья среднего яруса имели наибольшую площадь, поставляли 14С прямо в клубни и потребляли на собственные нужды до 40% ассимилированного углерода. В верхушечных листьях, появляющихся к концу вегетационного периода, локализовалось около 10% 14С-продуктов фотосинтеза, остальная часть экспортировалась непосредственно в клубни. Воздействие коротким днем стимулировало распределение углерода в клубни у вида картофеля с количественно-короткодневной реакцией клубнеобразования (Solanum andigenum), тогда как у сортового картофеля (Solanum tuberosum) с нейтральной реакцией сокращение суточной продолжительности фотосинтеза приводило к торможению накопления биомассы ботвы и клубней. В процессе клубнеобразования на дыхание использовалось 35% первоначально ассимилированного 14С, что свидетельствует о высокой эффективности запасания полимеров углерода в форме крахмала. В целом, полученные данные дополняют представления об организации и функционировании донорно-акцепторных связей и обеспечивают основу для разработки способов управления донорно-акцепторной системой картофеля в целях повышения продуктивности этой важнейшей сельскохозяйственной культуры.
ВВЕДЕНИЕ
Классические представления о донорно-акцепторной системе (ДАС) растений сложились в прошлом столетии как результат исследования взаимодействия органов, производящих и потребляющих ассимиляты [1, 2]. Однако одни и те же части растения, например, листья, могут одновременно образовывать и использовать ассимиляты, а корни и другие органы – импортировать и экспортировать продукты фотосинтеза [3]. Концепция донорно-акцепторных отношений (ДАО) во многом способствовала формированию представлений о растении как целостной системе. Особую роль в этом сыграли работы А.Т. Мокроносова [4, 5], рассматривавшего растение как систему доноров и акцепторов, взаимодействие которых осуществляется благодаря канализированным системам транспорта веществ и передачи сигналов. В процессе реализации морфогенетической программы роста и развития в растении возникают все новые донорные листья и сменяют друг друга акцепторы, что свидетельствует о динамичности донорно-акцепторных связей. Благодаря своей универсальности, донорно-акцепторная концепция логично вписалась в общую теорию продукционного процесса и стала ее неотъемлемой частью. Согласно А.Т. Мокроносову [4], фотосинтезу здесь отводится место важнейшей функции растительного организма, ему подчиненного и им управляемого.
Развитие представлений о ДАС способствовало разработке идеи оптимального морфофизиологического типа растения для создания высокопродуктивных посевов сельскохозяйственных культур [5]. По современным представлениям продукционный процесс является интегральной функцией растений, основу которой составляют фотосинтез, дыхание и рост. Важную роль в формировании продуктивности играют процессы распределения углерода между органами, которые контролируются системой прямых и обратных связей, образующих единую донорно-акцепторную систему растений. Основные регуляторные функции в ДАС отводятся фитогормонам, механизмам транспорта ассимилятов и аттрагирующему действию акцептора. А.Т. Мокроносов не исключал также способности донора влиять на загрузку, транспорт и распределение ассимилятов [4].
Реализация генетически запрограммированной программы роста и развития растений в значительной степени зависит от условий внешней среды. В этом отношении интерес представляет изучение ДАС культурных растений на северной границе возделывания, где их продуктивность ограничивается коротким периодом вегетации, недостатком тепла, перепадами температуры, низким естественным плодородием почв.
Цель работы – выявление закономерностей функционирования донорно-акцепторной системы картофеля при выращивании на европейском северо-востоке России.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проведены в подзоне средней тайги (61°67′ с.ш., 50°76′ в.д.). Климат района умеренно-континентальный с продолжительной холодной многоснежной зимой и умеренно-теплым летом [6]. Поздние весенние заморозки возможны вплоть до середины июня, а ранние осенние – нередки в начале августа. Сумма средних суточных температур выше 10°С варьирует в пределах 1000–1200°С. Средняя многолетняя температура самого теплого месяца июля равна 16.6°С. Обеспеченность растений влагой удовлетворительная, за вегетационный период выпадает в среднем 250 мм осадков. Характерной особенностью региона, расположенного в первой световой зоне, является длинный день. В июне продолжительность светового дня на широте г. Сыктывкара составляет 19 ч 30 мин.
В опытах использовали два вида картофеля: Solanum tuberosum L. (сорт Приекульский ранний и среднепоздний cорт Идеал) и S. andigenum Juz. et Buk. Растения выращивали на опытном участке с типичной подзолистой среднеокультуренной почвой. Высадку клубней проводили в первой декаде июня на площади питания 0.3 × 0.9 м. Всходы появлялись в конце июня, начало клубнеобразования отмечали во второй декаде июля. Рост растений характеризовали по накоплению биомассы и листовой поверхности. Площадь листа каждого яруса определяли методом отпечатков листовых пластинок на хлоркобальтовой бумаге.
Обработку растений 20% раствором суперфосфата с добавлением 0.05% 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) для ускорения старения и отмирания ботвы проводили в период интенсивного налива клубней, за месяц до уборки урожая. Воздействие коротким днем (11 ч) осуществляли в течение 20 сут после появления зачатков бутонов.
Лист определенного яруса растений сорта Приекульский ранний экспонировали в атмосфере с 14СО2 в течение 20 мин. Эксперименты с меткой проводили в первой половине дня при солнечной погоде, используя для этого полевой прибор, сходный с описанным в работе А.Т. Мокроносова [7]. Меченую углекислоту генерировали из Ва14СО3 при добавлении 0.1 н раствора HCl. Концентрация 14СО2 в газовой смеси составляла 1%, удельная радиоактивность 9.3 × 105 Бк/л. Распределение метки по органам растений изучали сразу, через сутки и спустя неделю после экспозиции в атмосфере с 14СО2 индивидуальных листьев главного побега (пятый, десятый и пятнадцатый лист, считая снизу).
Для изучения влияния короткого (11 ч) дня на распределение 14С индивидуальные растения нейтрального по клубнеобразованию картофеля сорта Идеал и количественно-короткодневного вида S. andigenum экспонировали в течение 30 мин под прозрачной камерой емкостью 0.15 м3, снабженной устройством для перемешивания воздуха. Начальная концентрация СО2 в камере составляла 0.09%, удельная радиоактивность около 9 × 104 Бк/л. Экспозицию проводили после 20-суточного воздействия на растения коротким днем. Распределение 14С изучали спустя 3 суток после экспозиции. Для анализа долговременной динамики убыли 14С растения картофеля сорта Идеал экспонировали под прозрачной камерой в атмосфере с 14СО2, как описано выше. Содержание и распределение метки в растениях изучали сразу, спустя 8, 15 и 30 суток после экспозиции. Растения выкапывали, расчленяли на части и взвешивали. Пробы фиксировали в сушильном шкафу при 105°С, затем досушивали при 70°С и измельчали. Удельную радиоактивность порошка определяли на альфа-бета радиометре УМФ-1500 Д в 5–6-кратной повторности. Стандартная ошибка для радиологического анализа составила 5–7%. Количество ассимилированного растением 14С оценивали по удельной радиоактивности органов с учетом их доли в биомассе растения. Распределение 14С по органам выражали в относительных единицах, % от всей содержащейся в растении метки. Биологическая повторность (индивидуальное растение) – 3–5-кратная. На графиках представлены средние величины со стандартной ошибкой.
РЕЗУЛЬТАТЫ
Донорная функция листьев в онтогенезе картофеля
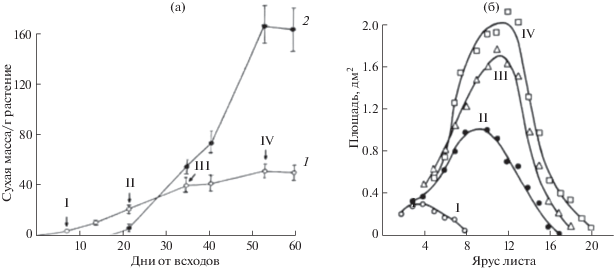
Картофель, формирующий специализированные органы запасания, служит удобным модельным объектом для изучения закономерностей использования ассимилятов на рост и обновление структур самого листа, оттока продуктов фотосинтеза из листа по мере становления его донорной функции и в зависимости от положения в донорно-акцепторной системе растения. Мы изучали поглощение и распределение 14С по органам картофеля сорта Приекульский ранний после экспозиции листьев в атмосфере с 14СО2 на разных этапах роста и развития растений: в периоды интенсивного формирования ботвы и клубнеобразования (рис. 1). К началу клубнеобразования сухая надземная биомасса растения не превышала 20 г, а к уборке клубней возрастала в 2.5 раза (рис. 1а). При этом ботва была зеленой, а отпад листьев незначительным. Соотношение сухих масс клубней и ботвы при уборке составило около 2.7. Следовательно, коэффициент хозяйственной продуктивности равнялся 0.8. Листья картофеля формировались довольно быстро. Через 3 недели от всходов на главном побеге уже появились верхушечные шестнадцатый и семнадцатый листья. Всего к уборке было сформировано 20 листьев. По площади листовой пластинки листья верхних и нижних ярусов существенно, в 3–5 раз, уступали листьям среднего яруса (с десятого по двенадцатый лист) (рис. 1б).
Рис. 1.
Динамика накопления биомассы (а) и площади листьев (б) растений картофеля сорта Приекульский ранний. 1 – надземная часть, 2 – клубни. Стрелками и римскими цифрами отмечены сроки экспонирования индивидуальных листьев разного яруса в атмосфере с 14СО2.
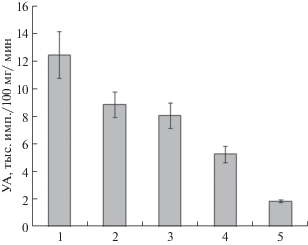
Сразу после фотосинтетического введения метки в растущий (площадь 30% от конечной) или функционально зрелый полностью завершивший рост пятый лист подавляющее количество 14С было обнаружено в листовой пластинке (рис. 2а). Такую же закономерность отмечали и при введении метки в другие (десятый и пятнадцатый) листья, независимо от их возраста и положения на стебле (рис. 2б, 2в). В течение первых суток после экспозиции отмечали быструю убыль 14С-ассимилятов из пятого листа. Через сутки в нем локализовалось 50% меченых продуктов, а через неделю – только 5% всего содержащегося в растении 14С. Картина не изменялась, когда метку вводили в завершивший рост лист.
Рис. 2.
Динамика распределения 14С в растении картофеля сорта Приекульский ранний после ассимиляции листа в атмосфере с 14СО2. а, a' – пятый лист; б, б' – десятый лист; в – пятнадцатый лист; а – фаза вегетативного роста, a', б – начало клубнеобразования, б', в – налив клубней; 1, 2, 3, 4 – экспонируемый лист, стебли, корни и клубни соответственно. Представлены усредненные данные, полученные на 3–4 растениях для каждой точки, всего в опыте использовано около 50 растений.
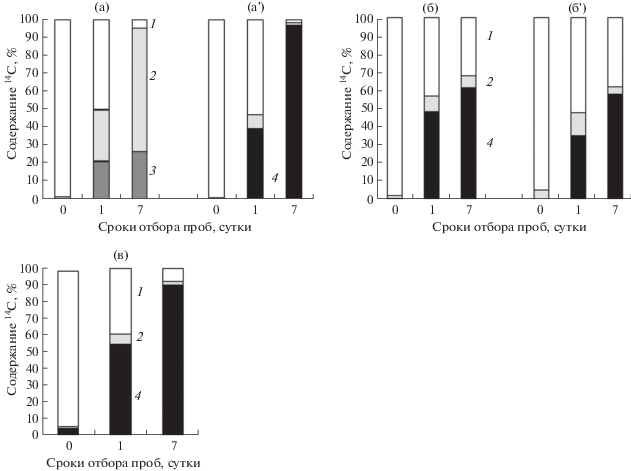
Листья среднего яруса характеризовались продолжительным ростом и имели наибольшую ассимилирующую поверхность. Площадь завершившего рост десятого листа достигала 0.02 м2, что в 3 раза больше площади зрелого пятого листа. Листья среднего яруса использовали значительную часть ассимилятов на собственные нужды. После экспозиции растущего или завершившего рост десятого листа в атмосфере с 14СО2 в нем локализовалось более 30% от общего количества обнаруживаемой в растении метки (рис. 2б, 2б').
Зрелые листья верхнего яруса, образующиеся в период интенсивного клубнеобразования, имеют сравнительно небольшую площадь, вдвое меньшую по сравнению с листьями среднего яруса. Спустя сутки после экспозиции пятнадцатого листа в атмосфере с 14СО2 в нем локализовалось 40% содержащейся в растении метки, а через неделю – менее 10% (рис. 2в).
Распределение ассимилятов по органам в онтогенезе растений картофеля
По мере последовательного формирования метамеров меняется роль отдельных ярусов листьев в обеспечении целого растения пластическими веществами. Одновременно происходит закономерная смена аттрагирующих центров, где ассимиляты интенсивно используются в ростовых процессах или запасаются. У молодых растений картофеля доминирующими акцепторами являлись стебли, корни и апикальные меристемы. Спустя сутки после введения метки в пятый лист почти половина содержащегося в растении 14С локализовалась в стеблях и корнях, и только 5% – в верхушке побега (рис. 2а). Через неделю на долю стеблей и корней приходилось свыше 90% 14С, причем его количество в стеблях было в 2.5 раза больше, чем в корнях.
С появлением у картофеля специализированных органов запасания основной поток ассимилятов из листьев всех ярусов ориентирован непосредственно в клубни. Значение стебля как органа временного депонирования ассимилятов падает. Практически весь ассимилированный листьями нижнего яруса 14С обнаруживается в столонах и клубнях (рис. 2а'). При экспозиции листьев среднего яруса (десятый лист) в атмосфере с 14СО2 в клубнях локализовалось около 60% всего содержащегося в растении 14С, значительное количество метки удерживается в экспонируемом листе (рис. 2б). Листья верхнего яруса (пятнадцатый лист) экспортируют в клубни подавляющую часть ассимилированного углерода, тогда как в экспонируемом листе локализуется менее 10% всей метки (рис. 2в).
Постфотосинтетическая динамика содержания и убыль ассимилированного углерода из растений
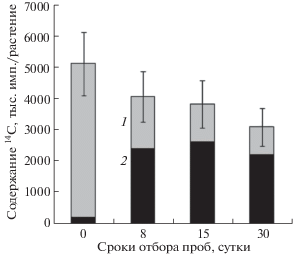
Чтобы получить представление о потере ассимилированного растением углерода при формировании урожая клубней надземную часть растений сорта Идеал экспонировали в атмосфере с 14СО2 в начале клубнеобразования. Сразу после экспозиции меченый углерод был обнаружен практически во всех частях картофельного растения (рис. 3). По удельной активности молодые клубни (вместе со столонами) были сопоставимы с листьями, что свидетельствует об интенсивном транспорте продуктов текущего фотосинтеза в запасающие органы. Наименьшую удельную активность имели корни, что указывает на их второстепенную роль в иерархии акцепторов в фазу клубнеобразования. За месяц после ассимиляции убыль метки из целых растений составила около 35% ее первоначального содержания (рис. 4). При этом в течение всего периода отмечали изменение соотношения количества 14С-продуктов фотосинтеза, локализованных в надземной части и клубнях. Величина этого соотношения снижалась в 30 раз, от 15 до 0.5, причем за первую неделю почти в 20 раз. Другими словами, на фоне потери трети ассимилированной метки, ее содержание в клубнях возрастало более чем на порядок, тогда как в надземной части уменьшалось в 4 раза.
Влияние короткого дня на распределение ассимилятов и накопление биомассы клубней
Среди видов, форм и сортов картофелей существует значительное разнообразие по фотопериодической реакции клубнеобразования. У растений нейтрального по клубнеобразованию картофеля S. tuberosum сорта Идеал при воздействии коротким днем в течение 20 суток после появления зачатков бутонов наблюдали выраженную тенденцию снижения накопления биомассы (рис. 5а). Укорочение фотопериода усиливало клубнеобразование S. andigenum на фоне торможения накопления биомассы надземной части. В результате доля клубней в биомассе целого растения количественно-короткодневного по клубнеобразованию вида на коротком дне увеличивалась в 3 раза. Тем не менее, растения S. andigenum существенно уступали сортовому картофелю по урожайности клубней.
Рис. 5.
Влияние продолжительности фотопериода на накопление сухой биомассы (а) и распределение 14С (б) в растениях картофеля Solanum tuberosum (сорт Идеал) и S. andigenum. ДД и КД – естественный (длинный) и короткий (11 ч) день; I и II – целое растение и клубни; 1, 2, 3, 4 – листья, стебли, корни, клубни, соответственно. Представлены усредненные данные, полученные на 4 растениях.
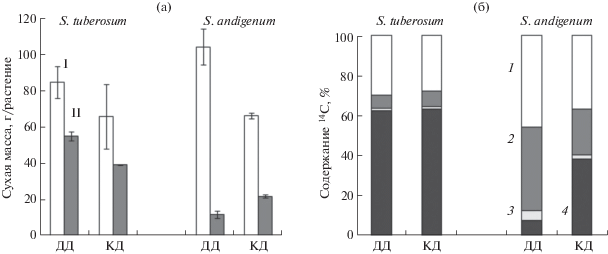
Укорочение фотопериода не оказало существенного влияния на распределение меченых продуктов фотосинтеза в растениях сортового картофеля (рис. 5б). Через трое суток после экспозиции растений в атмосфере с 14СО2 свыше 60% метки локализовалось в клубнях. В листьях было обнаружено около 30%, а в стеблях 7–8% всей содержащейся в растениях метки. В остальных частях растения (цветки, корни) метка присутствовала в следовых количествах. В отличие от S. tuberosum, у растений S. andigenum на естественном (длинном) дне больше метки оставалось в листьях и стеблях. Укорочение фотопериода усиливало распределение 14С в клубни S. andigenum. В них локализовалось в 5 раз больше меченых продуктов, чем на естественном дне.
Влияние химической обработки растений на отток ассимилятов в клубни
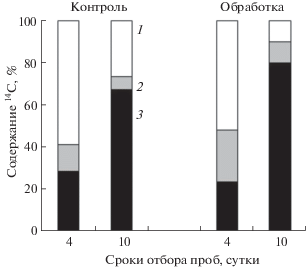
Известно, что старение листа – сложный процесс, сопровождаемый реутилизацией деградирующих структур. Стресс ускоряет старение. Мы исследовали влияние обработки ботвы картофеля сорта Приекульский ранний 20% раствором суперфосфата с добавкой 0.05% 2,4-Д. Такая обработка приводит к подсушиванию ботвы, ускоряет пожелтение и отмирание листьев. Полученные данные показали, что химическая обработка усиливала отток ассимилятов из листьев (рис. 6). Через 4 суток после обработки в экспонируемом в атмосфере с 14СО2 листе опытных растений локализовалось вдвое меньше меченого углерода по сравнению с контрольными растениями. Существенная часть углерода была депонирована в проводящей системе (черешке и стебле). Спустя 2 недели у опытных растений отмечали реутилизацию значительного количества 14С из листа и перемещение в клубни временно депонированного 14С из стебля и черешка. В итоге в клубнях локализовалось более 80% содержащегося в растении меченого углерода. У контрольных растений больше 14С оставалось в листе.
Рис. 6.
Влияние обработки растений картофеля сорта Приекульский ранний насыщенным раствором суперфосфата с добавлением 0.05% 2,4-Д на распределение 14С. 1, 2, 3 – экспонируемый лист с черешком, стебли, клубни, соответственно. Метку вводили фотосинтетически при экспозиции десятого листа в атмосфере с 14СО2. Представлены усредненные данные, полученные на 4 растениях для каждой точки и варианта опыта.
ОБСУЖДЕНИЕ
Картофель – культура, образующая специализированные органы запасания восстановленного углерода и послужившая модельным объектом в работах многих авторов, изучавших ДАС растений. Сформулированные А.Т. Мокроносовым [4, 5] основные положения концепции ДАО во многом явились результатом глубоких и целенаправленных исследований онтогенетических изменений мезоструктуры, фотосинтеза, фотосинтетического метаболизма углерода и донорной функции седьмого листа главного побега картофельного растения.
С помощью меченого углерода нами исследована роль различных ярусов листьев в формировании урожая клубней картофеля. Показано, что величина оттока ассимилятов из листьев определяется собственным возрастом листа, его положением на стебле и этапом онтогенеза растения. В этом отношении представляет интерес тот факт, что пятый лист в период собственного развития экспортировал подавляющую часть 14С-продуктов ассимиляции в другие органы. Интенсивный экспорт ассимилятов из листьев нижнего яруса начинался в молодом возрасте, когда их площадь составляла 30–35% от конечной. Мы полагаем, что в формирование листьев нижнего яруса существенный вклад вносит материнский клубень. В литературе имеются сведения об использовании пластических веществ материнского клубня в новообразовании метамеров надземного побега [8]. Самостоятельный интерес представляет вопрос о том, обмениваются ли листья ассимилятами с материнским клубнем. В наших опытах обратная связь между листьями, ассимилировавшими в атмосфере с 14СО2, и материнским клубнем не была выявлена. Таким образом, характерной чертой ДАС картофельного растения является то, что образующиеся в растущих листьях нижнего яруса ассимиляты экспортируются в другие органы, а необходимые для собственного роста и поддержания пластические вещества поступают из материнского клубня.
В отличие от нижних, листья среднего яруса характеризовались продолжительным ростом, имели наибольшую по сравнению с другими листьями площадь поверхности и потребляли больше ассимилятов на собственные нужды. Спустя неделю после фотосинтетического введения метки в десятом листе было обнаружено более 30% всего содержащегося в растении 14С.
В работе Р.А. Борзенковой [9] отмечено, что чем ближе к основанию стебля картофеля расположен лист, тем больше ассимилятов экспортировалось из него в подземную часть растения. Судя по нашим данным, экспорт 14С-продуктов фотосинтеза из всех листьев ориентирован базипетально. Спустя неделю после ассимиляции пятнадцатого листа в атмосфере с 14СО2 90% всего содержащегося в растении 14С находилось в клубнях. В этом отношении листья нижнего и верхнего ярусов были сходны.
По некоторым данным, примерно 30% убыли метки из листьев за первые сутки связано с дыханием [10, 11]. Мы установили величину потери метки из растения картофеля в процессе клубнеобразования. После ассимиляции всей надземной части в атмосфере с 14СО2 за первую неделю убыль метки составила около 10%, а за месяц – 35%. Поскольку заметного отмирания частей и органов растений за этот период не наблюдалось, то убыль 14С из растений можно отнести за счет использования 14С-ассимилятов в дыхании. Довольно низкие затраты на дыхание частично могут быть обусловлены реассимиляцией образующегося при дыхании надземных органов 14СО2. Известно, что в дыхании листьев используются преимущественно “свежие” ассимиляты. Однако основной причиной, по нашему мнению, является интенсивный отток 14С-продуктов фотосинтеза из листьев в стебли, а затем в клубни. В конечном итоге, в клубнях запасается 50–55% первоначально ассимилированного 14С. Клубень – видоизмененный побег, образующийся при разрастании субапикальной части столона [12]. Сухая масса клубней на 70–80% состоит из крахмала. Отложение в запас ассимилятов в виде крахмальных зерен осуществляется в паренхимных клетках клубня, которые в совокупности формируют запасающую ткань, составляющую почти всю массу клубня. Запасание полимеров углеводов, энергетическая стоимость биосинтеза которых вдвое ниже, чем белков, является высокоэффективным процессом. Ранее нами было показано, что высокая потенциальная продуктивность культур типа картофеля определяется сравнительно низкими дыхательными затратами на формирование специализированных органов запаса [13, 14].
А.Т. Мокроносов придавал большое значение способности растений к временному депонированию ассимилятов [4, 15]. Создание временных фондов способствует поддержанию сбалансированности ДАО, увеличивает “запрос” на ассимиляты и предотвращает репрессию фотосинтеза накоплением крахмала в хлоропласте. Демпфирование системы ДАО повышает ее надежность и обеспечивает возможность частичного разобщения и автономизации фотосинтеза и эпигенеза (роста и развития). До начала клубнеобразования основным местом временного депонирования ассимилированного углерода у картофельного растения служат стебли. В них может депонироваться до 67% продуктов текущего фотосинтеза (рис. 2а). Инициация клубнеобразования является переломным моментом в жизни картофельного растения, канализирующим транспорт ассимилятов в акцептор с высокой емкостью и аттрагирующей способностью [16].
Для получения высоких урожаев важно обеспечить поступление в клубни достаточного количества субстрата. Сокращение естественного фотопериода не оказало существенного влияния на распределение ассимилированного углерода, но снизило продуктивность растений сортового картофеля, видимо, вследствие уменьшения суточной продолжительности фотосинтеза. Для сравнения – у количественно короткодневного по клубнеобразованию вида S. andigenum на коротком дне усиливалось распределение 14С в клубни и увеличивалась их масса на фоне уменьшения накопления биомассы целого растения. Изменение фотопериода оказывает существенное влияние на гормональный баланс фотопериодически чувствительных видов [12]. В случае S. andigenum это проявлялось в торможении роста надземной части и увеличении массы клубней. Сходный, но более слабо выраженный эффект наблюдали при обработке растений ретардантом хлорхолинхлоридом, подавляющим синтез предшественников гиббереллинов [17].
Опрыскивание растений насыщенным раствором суперфосфата в сочетании с 2,4-Д усиливало отток ассимилятов в молодые клубни вследствие ускорения старения листьев и отмирания ботвы в результате ее подсушивания. Применение этого приема, известного как “сеникация”, имеет перспективу в регионах с коротким вегетационным периодом и влажной сырой погодой во время уборки. Широко распространенное на Севере скашивание еще зеленой ботвы картофеля перед уборкой урожая приводит к потере значительного количества органического вещества, которое могло бы реутилизироваться в клубни в процессе естественного старения. Ускорение старения также способствует сокращению энерго-пластических затрат на поддержание листовой поверхности.
ЗАКЛЮЧЕНИЕ
Результаты наших исследований показали, что величина оттока ассимилятов из листьев картофеля определяется собственным возрастом листа, его положением на стебле и этапом онтогенеза растения. Включение в донорно-акцепторную систему материнского клубня позволяет существенно уменьшить потребление продуктов текущего фотосинтеза на формирование и поддержание функциональной активности листьев нижнего яруса и тем самым обеспечить создание временного фонда ассимилятов, используемых при клубнеобразовании. Листья среднего яруса потребляют на собственный рост и обновление структур 30–35% ассимилированного ими углерода, тогда как у нижних листьев эта величина втрое меньше. Инициация клубнеобразования канализирует транспорт и запасание ассимилятов. В клубнях локализуется как минимум 50–55% первоначально ассимилированного растением углерода. Воздействие коротким днем стимулировало распределение ассимилированного углерода в клубни у растений картофеля с количественно-короткодневной реакцией клубнеобразования, тогда как у сортового картофеля с нейтральной реакцией сокращение суточной продолжительности фотосинтеза приводило к торможению накопления биомассы, но не оказывало существенного влияния на характер распределения ассимилятов. В целом, полученные данные дополняют представления об организации и функционировании системы ДАС и обеспечивают основу для разработки способов управления ДАО картофеля в целях повышения продуктивности этой важнейшей сельскохозяйственной культуры.
Финансовое обеспечение работы осуществлялось из средств федерального бюджета на выполнение государственного задания № АААА-А17-117033010038-7 и АААА-А18-118012290132-0.
Список литературы
Wardlow I.F. Translocation and source-sink relationships // The biology of crop productivity. N.-Y.: Acad. Press, 1980. P. 297–339.
Dwelle R.B. Photosynthesis and photoassimilate partitioning // Potato physiology. N.-Y.: Acad. Press, 1985. P. 36–58.
Курсанов А.Л. Транспорт ассимилятов в растении. М.: Наука, 1976. 646 с.
Мокроносов А.Т. Онтогенетический аспект фотосинтеза. М.: Hayка, 1981. 198 с.
Мокроносов А.Т. Фотосинтетическая функция и целостность растительного организма. М.: Наука, 1983. 64 с.
Агроклиматические ресурсы Коми АССР. Л.: Гидрометиздат, 1973. 135 с.
Мокроносов А.Т. Полевой прибор для изучения фотосинтетического метаболизма углерода при эколого-физиологических исследованиях // Экология. № 6. 1972. С. 56–61.
Moorby J. The carbohydrate and mineral nutrient supply on the growth of potato tubers // Ann. Bot. 1970. V. 34. P. 291–308.
Борзенкова Р.А. Передвижение 14С-ассимилятов из листьев разных ярусов у картофеля // Вопросы регуляции фотосинтеза. Ученые записки УрГУ. Сер. биол. 1970. Вып. 8. № 2. С. 147–152.
Ryle G.J.A., Cobby J.M., Powell C.E. Synthetic and maintenance respiratory losses of 14CO2 in uniculm barley and maize // Ann.Bot. 1976. V. 40. P. 571–586.
Головко Т.К., Табаленкова Г.Н. Использование ассимилятов на рост и дыхание в растениях райграса однолетнего // Физиология растений. 1994. Т. 41. С. 713–719.
Маркаров А.М., Головко Т.К., Табаленкова Г.Н. Морфофизиология клубнеобразующих растений. СПб.: Наука, 2001. 208 с.
Головко Т.К. Затраты на дыхание клубней картофеля // Физиология растений. 1986. Т. 32. С. 384–390.
Головко Т.К. Дыхание в донорно-акцепторной системе растения // Физиология растений. 1998. Т. 45. С. 632–640.
Мокроносов А.Т., Гавриленко В.Ф. Фотосинтез. Физиолого-экологические и биохимические аспекты. М.: изд-во МГУ, 1992. 320 с.
Мокроносов А.Т. Клубнеобразование и донорно-акцепторные связи у картофеля // Регуляция роста и развития картофеля. М.: Наука, 1990. С. 6–12.
Табаленкова Г.Н., Маркаров А.М., Головко Т.К. Регуляция клубнеобразования Solanum andigenum cv. Zhukovskii // Физиология растений. 1998. Т. 45. С. 33–36.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений