Физиология растений, 2019, T. 66, № 4, стр. 304-312
Влияние интенсивности света на морфогенез Stevia rebaudiana в условиях in vitro
О. В. Наконечная a, И. В. Гафицкая a, Е. В. Бурковская a, Ю. А. Хроленко a, О. В. Грищенко a, Ю. Н. Журавлев a, Е. П. Субботин b, Ю. Н. Кульчин b
a Федеральный научный центр биоразнообразия наземной биоты Восточной Азии
Дальневосточного отделения Российской академии наук
Владивосток, Россия
b Институт автоматики и процессов управления Дальневосточного отделения
Российской академии наук
Владивосток, Россия
Поступила в редакцию 29.03.2018
После доработки 14.06.2018
Принята к публикации 01.11.2018
Аннотация
Изучение влияния разной интенсивности света (75, 135, 230 и 382 мкмоль/(с м2)) на морфогенез стевии медовой (Stevia rebaudiana (Bertoni) Bertoni) in vitro было проведено с применением разработанного в Институте автоматики и процессов управления ДВО РАН уникального светодиодного светильника (Sun Box) (диапазон длин волн 440–660 нм) со спектром света, приближающимся к солнечному, в сравнении с контрольным люминесцентным светом интенсивностью 49 мкмоль/(с м2). Было показано, что выращивание растений с применением светодиодного источника (СД) с интенсивностью 75 и 230 мкмоль/(с м2) способствовало развитию растений с сочетанием значений морфологических и мезоструктурных параметров, важных при микроклональном размножении и/или при адаптации к грунту. Такие растения накапливали максимальную массу надземной части и корней, что особенно важно для их последующего перевода в условия открытого грунта. Выращенные при данной интенсивности света растения с развитой корневой системой будут быстрее проходить процесс адаптации, что в свою очередь снизит процент выпада. Использование сборного СД источника света с определенной интенсивностью при культивировании стевии in vitro позволило бы оптимизировать метод выращивания и размножения маточных растений, а также снизить энергозатраты по сравнению с применением люминесцентных ламп.
ВВЕДЕНИЕ
Различные виды рода Stevia содержат несколько потенциальных подслащивающих веществ. Они найдены только у 18 из 110 видов рода, проверенных на сладость [1]. В листьях стевии медовой (S. rebaudiana (Bertoni) Bertoni) их концентрация наиболее высока [1, 2]. Стевия медовая – небольшой многолетник, достигающий 65–80 см в высоту, с сидячими, супротивно расположенными листьями. Ее родиной является Центральная и Южная Америка [3], в Парагвае это эндемичный вид [4]. В растении содержится сложная смесь лабдановых дитерпенов, тритерпенов, стигмастерола, дубильных веществ, эфирных масел и восьми дитерпеновых гликозидов: стевиозида, стевиобиозида, дулькозида и ребаудиозида A, B, C, D и E. Мажорными веществами являются стевиозид и ребаудиозид А. Потенциально растение может быть применено при лечении диабета второго типа [5]. Использование стевии приводит к увеличению толерантности к глюкозе и снижению концентрации глюкозы в плазме [6]. Стевиозид – это 100% натуральный продукт, не имеющий калорий, в 200–300 раз слаще сахара, устойчивый к нагреванию до 198°С, неферментируемый усилитель вкуса, препятствующий появлению налета на зубах и кариеса [7]. Кроме того, в стевии находятся макроэлементы (калий, кальций, натрий, фосфор, магний) и микроэлементы (марганец и кобальт) [8], необходимые для организма человека.
Как известно, растения S. rebaudiana продуцируют мало семян, которые плохо и долго прорастают [9]. Для улучшения прорастания использовали красный и белый свет [10]. Поскольку растения сложно размножаются вегетативно [9], микроклональное размножение является перспективным способом для быстрого увеличения их количества. Для ускорения роста растений (кроме часто используемого люминесцентного света) применяли светодиоды (белые, красные, синие, а также сочетание синих и красных) [11]. Ранее были проведены исследования влияния фотопериода [12, 13] и спектрального состава света [14] на рост растений, синтез и накопление стевиозидов. Указанные исследования проводили как на интактных растениях [15–17], так и in vitro [18]. Между тем параметры мезоструктуры листа у растений стевии в этих экспериментах не изучали.
Цель работы – изучение влияния сборного светодиодного (СД) источника света разной интенсивности (75, 135, 230 и 382 мкмоль/(с м2)) с близким к солнечному свету спектром излучения в области 440–660 нм на рост и развитие стевии медовой (Stevia rebaudiana) in vitrо в сравнении со стандартным люминесцентным освещением для подбора оптимальных световых условий, необходимых для получения максимальных морфометрических характеристик.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование влияния интенсивности света на рост растений проводили в ФНЦ Биоразнообразия наземной биоты Восточной Азии ДВО РАН (г. Владивосток) в 2017 г. Для эксперимента использовали растения-регенеранты стевии медовой, полученные методом черенкования при микроклональном размножении в стерильных условиях ламинарного бокса. Первичные растения были выращены из семян и введены в культуру in vitro. Экспланты представляли собой черенки стевии (часть стебля с узлом и листовой пл-астинкой) с одинаковой площадью листовой пластинки и длиной стеблевой части. Микрочеренки выращивали на агаризованной питательной среде Мурасиге и Скуга [19] в пробирках диаметром 10 мм. Культивирование микрорастений проводили при 25°С в контролируемых условиях при влажности воздуха 70% и световом режиме 16 ч света и 8 ч темноты.
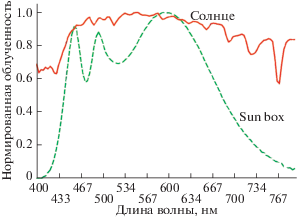
В работе был использован светодиодный источник света (Sun Box), разработанный и изготовленный в Центре лазерных технологий Института автоматики и процессов управления ДВО РАН (ЦЛТ ИАПУ ДВО РАН). Излучение светодиодов в источнике находилось в диапазоне длин волн 440–660 нм и по спектру излучения было схоже со спектром Солнца (рис. 1). Источник Sun Box характеризуется более высоким коэффициентом полезного действия, достигающим 30%; у него отсутствуют ярко выраженные пики в спектре излучения, что выгодно его отличает от ксеноновых источников света, излучение которых наиболее близко к солнечному спектру.
Рис. 1.
Нормированный спектр светодиодного источника света (Sun Box), имитирующего солнечное излучение в диапазоне 440–660 нм, в сравнении со спектром Солнца.
Для проверки влияния различной интенсивности света на развитие эксплантов стевии медовой растения были разделены на 4 группы. Каждая группа была помещена в ячейки Sun Box и подвергалась воздействию света разной интенсивности: 75, 135, 230 и 382 мкмоль/(с м2). Уровень облученности измеряли прибором “Спектрофотометр ТКА” (“ООО Научно-техническое предприятие ТКА”, Россия). В качестве контроля использовали растения, выращиваемые под люминесцентными лампами OSRAM L 36W/765 (“OSRAM”, Россия) с интенсивностью излучения 49 мкмоль/(с м2) в условиях светокультуральной комнаты. Эксперимент проводили 7 недель. Для оценки результатов изучали морфометрические показатели (высоту растения, длину междоузлий, длину и ширину листа, сырую и сухую массу корней и зеленой части – побега с листьями), а также мезоструктуру листьев.
Параметры мезоструктуры листа изучали у растений во всех вариантах опыта. Анатомические показатели определяли по модифицированной методике, как приведено ранее [20]. Число хлоропластов в клетке и число клеток на единицу площади листа изучали на материале, фиксированном в 3.5% растворе глутарового альдегида в фосфатном буфере (рН 7.0), с последующей мацерацией тканей в 5% растворе оксида хрома в 1 н НСL (для определения числа хлоропластов в клетке). В соответствии с требованиями методики количество измерений числа хлоропластов в клетке составило 30 повторов. Определение количества клеток в мацератах (для расчета числа клеток на единицу листовой поверхности) производили в 20-кратной повторности в 90 квадратах камеры Горяева [20]. К счетной камере притирали покровное стекло до появления колец Ньютона, затем тщательно перемешивали мацерат пипетированием, чтобы получилась равномерная взвесь клеток, которой и заполняли камеру. Толщину листа, клеток мезофилла, размеры пластид определяли на поперечных срезах листа. Регистрацию измерений проводили на временных давленых препаратах с помощью программы Axio Vision 4.8.3. Готовые препараты предварительно просматривали под микроскопом Leica DMLS (“Leica Microsystems”, Германия), а затем фотографировали в масляной иммерсионной системе под микроскопом Axioskop-40 (“Zeiss”, Германия) с помощью встроенной видеокамеры AxioCam HRc (“Zeiss”, Германия). Объемы и площади поверхностей клеток мезофилла сложной формы определяли по методике, разработанной Т.К. Горышиной [21]. Форму хлоропласта принимали за трехосный эллипсоид вращения. Наибольшую и среднюю оси эллипсоида измеряли на электронных фотографиях мацератов клеток, третью, меньшую ось принимали за 1 мкм, т.е. практически исключив ее из расчетов [21]. Третья ось – толщина, не может быть надежно измерена, поскольку под световым микроскопом не гарантировано точное профильное положение измеряемого хлоропласта. Для проведения сравнений с данными базы А.Т. Мокроносова объемы и площади поверхности пластид были вычислены вторым способом, при котором толщину хлоропласта принимали равной его ширине. Такой способ подсчета дает завышение объема пластид, т.к. обычное соотношение толщины к ширине составляет около 0.5–0.7. Коэффициент палисадности вычисляли как отношение толщины палисадной ткани к губчатой. Объем клетки, приходящийся на один хлоропласт (КОХ), определяли делением объема клетки на число хлоропластов в ней. Объем хлоропласта вычисляли по формуле эллипсоида вращения, поверхность хлоропласта – по формуле Чезаро.
Все полученные результаты были обработаны статистически с использованием пакета “Statistica” версии 13.3, графики строили в программе MS Excel 2010. На диаграммах показаны средние арифметические значения ростовых параметров со стандартной ошибкой (n = 30). Для сравнений групп микрорастений, выращенных при разной интенсивности света, использовали сравнение с контрольными растениями с учетом t-критерия Стьюдента для 95 и 99% уровней значимости. В эксперименте при проверке статистических гипотез критический уровень значимости принимали равным 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфометрические параметры
Значения исследованных параметров приведены в таблице 1 и на рисунках 2 и 3. Анализ полученных данных показал, что максимальная высота отмечена у растений с интенсивностью света 75 мкмоль/(с м2) – она была достоверно больше, чем у контрольных растений и растений в группах 2 и 3 (с интенсивностью освещения 135 и 230 мкмоль/(с м2), соответственно). Наименьшая высота выявлена у растений в группе 4 с наибольшей исследуемой интенсивностью света 382 мкмоль/(с м2), что говорит об избытке освещения, приводящем к ингибированию роста. Количество междоузлий на стебле при максимальных значениях интенсивности света также было минимальным, и имело достоверное отличие от контроля (таблица 1). Растения других экспериментальных групп по количеству междоузлий не имели отличий от контрольных растений, но были достоверно различны между собой. По длине междоузлий у растений всех четырех вариантов эксперимента достоверных отличий от контроля не наблюдали; максимальные значения этого параметра были отмечены у растений 1 группы (75 мкмоль/(с м2)). Длина междоузлий в данной группе была достоверно больше, чем во 2 и 4 вариантах эксперимента с интенсивностью освещения 135 и 382 мкмоль/(с м2), соответственно. Из всех исследуемых групп растений длина листа была достоверно большей у растений 1 и 3 групп (75 и 230 мкмоль/(с м2), соответственно), по сравнению с контролем. Между собой у всех групп солнечного бокса выявлены достоверные отличия по этому показателю (рис. 2а, 3). Наиболее широкие листья отмечены у растений 1 группы (75 мкмоль/(с м2)) по сравнению с контролем, а также в сравнении со 2 и 4 группами растений солнечного бокса (135 и 382 мкмоль/(с м2), соответственно) (рис. 2б).
Рис. 2.
Морфометрические параметры растений Stevia rebaudiana, культивируемых при разной интенсивности света: (a) – изменение длины листа; (б) – изменение ширины листа; (в) – изменение накопления сырой массы надземной части; (в) – изменение накопления сырой массы корней. К – контроль.
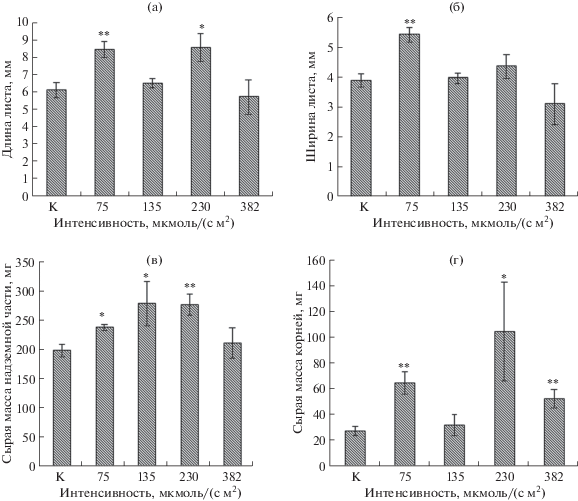
Таблица 1.
Морфометрические показатели растений и мезоструктурные характеристики листа Stevia rebaudiana при разной интенсивности излучения светодиодного источника света Sun Box
| Размерные признаки | Номер опыта/Интенсивность излучения, мкмоль/(с м2) | ||||
|---|---|---|---|---|---|
| контроль/49 | 1/75 | 2/135 | 3/230 | 4/382 | |
| Высота растения, мм | 38.87 ± 1.41 | 49.3 ± 0.62** | 35.62 ± 0.94 | 42.72 ± 3.47 | 29.42 ± 5.11* |
| Кол-во междоузлий | 5.29 ± 0.29 | 6.25 ± 0.25 | 5.25 ± 0.25 | 6.50 ± 0.29 | 4 ± 0.58* |
| Длина междоузлий, мм | 4.13 ± 0.43 | 4.89 ± 0.15 | 3.48 ± 0.09 | 4.26 ± 0.41 | 2.98 ± 0.56 |
| Сырая масса растения, мг | 224.57 ± 11.59 | 301.5 ± 12.94** | 309 ± 32.44* | 379.75 ± 45.84** | 262.5 ± 29.29 |
| Сухая масса надземной части растения, мг | 30.57 ± 1.00 | 34 ± 1.78 | 34 ± 2.04 | 38.5 ± 0.65** | 34.25 ± 1.31 |
| Сухая масса корней, мг | 2.86 ± 0.55 | 6.25 ± 0.48** | 3 ± 0.91 | 7.25 ± 2.39* | 3.50 ± 0.65 |
| Сухая масса растения, мг | 33.43 ± 1.29 | 40.25 ± 2.17* | 37.00 ± 2.89 | 45.75 ± 2.95** | 37.75 ± 1.65 |
| Толщина листа, мкм | 179.43 ± 4.46 | 155.63 ± 3.34 | 150.55 ± 2.54 | 201.15 ± 3.97 | 294.91 ± 13.27 |
| Коэффициент палисадности | 0.33 | 0.33 | 0.49 | 0.56 | 1.12 |
| Число хлоропластов в палисадных клетках, шт | 34.24 ± 1.64 | 30.55 ± 1.15 | 34.72 ± 3.07 | 39 ± 3.06 | 35.11 ± 3.15 |
| Число хлоропластов в губчатых клетках, шт | 41.14 ± 2.44 | 37.53 ± 1.53 | 40.87 ± 4.23 | 48.65 ± 4.31 | 36.17 ± 3.05 |
| Число хлоропластов в 1 см2 листа, млн | 16.38 ± 3.65 | 16.50 ± 0.67 | 32.02 ± 1.54 | 24.07 ± 5.98 | 21.74 ± 4.76 |
| КОХ, мкм3 | 129.84 ± 6.76 | 258.23 ± 10.78 | 257.35 ± 12.67 | 386.64 ± 18.45 | 583.53 ± 10.37 |
Все варианты интенсивности освещения солнечного бокса, за исключением максимальной (382 мкмоль/(с м2)), обеспечили накопление значимо большей сырой массы надземной части растений в сравнении с контрольной группой растений (рис. 2в). При сравнении четырех вариантов солнечного бокса по этому показателю отличий не выявлено.
Сырая масса корней превышала контрольные значения во всех вариантах эксперимента, кроме второго (с интенсивностью освещения 135 мкмоль/(с м2)). Масса корней для растений, выращенных при интенсивности света 230 мкмоль/(с м2), была максимальной и превышала этот показатель у контрольных растений в 3 раза (рис. 2г). Уровень накопления сырой массы растениями группы 4 (382 мкмоль/(с м2)) по своему значению был близок к таковому у растений контроля. Для остальных вариантов опыта отмечены более высокие показатели этого параметра. Для стевии из варианта 2 солнечного бокса (135 мкмоль/(с м2)) показано достоверное (в 1.4 раза) увеличение накопления общей сырой биомассы по сравнению с растениями контрольной группы. Максимальная общая сухая масса (надземной части растения и корней) отмечена у растений 3 группы (230 мкмоль/(с м2)), ее значения достоверно превышали данные, полученные для растений контроля. Несколько более низкие значения общей сухой массы показаны для растений 1 группы (75 мкмоль/(с м2)).
По совокупности исследованных параметров можно заключить, что растения, культивируемые при интенсивности 75 мкмоль/(с м2), характеризовались достоверно более высокими значениями морфометрических параметров по сравнению с растениями контрольной и других экспериментальных групп. Растения 2 группы (135 мкмоль/(с м2)) по всем характеристикам, кроме уровня накопления сырой массы надземной части растения, имели значения, близкие к контрольным. Растения, культивируемые при интенсивности 230 мкмоль/(с м2), не отличались максимальными значениями морфометрических параметров, но по многим показателям были близки к контрольной группе, а по накоплению биомассы были лидерами эксперимента. Выращивание стевии медовой in vitro при интенсивности 382 мкмоль/(с м2) не является целесообразным, так как интенсивность такого уровня угнетает рост растения (рис. 3), однако способствует активному формированию хорошо развитой корневой системы. Мы полагаем, что из всех исследованных значений интенсивности освещения оптимальны для роста и развития стевии медовой 75 и 230 мкмоль/(с м2).
Показатели мезоструктурного анализа
Мезоструктурные характеристики листьев микрорастений, выращенных при разных условиях интенсивности света, приведены в таблице 1. Толщина листа существенно изменялась в зависимости от интенсивности освещения. Самые толстые листья формировались при максимальной интенсивности света, их толщина на 39% превышала контрольные значения. Полученные результаты согласуются с приведенными ранее данными о том, что увеличение интенсивности приводит к возрастанию толщины листа и его поверхностной плотности [22, 23].
Во всех вариантах опыта у листьев наблюдалась дифференциация мезофилла на столбчатую и губчатую ткани. Первая представлена 1–2, а губчатая 3–4 слоями. Однако клетки палисадной ткани существенно различались по форме в зависимости от величины интенсивности освещения. Так, отношение их длины к ширине увеличилось в 2.5 раза от контроля до варианта с максимальной освещенностью. Подобные тенденции отмечали ранее у растений в естественной среде обитания, когда в условиях полного освещения клетки долго продолжали расти в длину, а при затенении – рост в этом направлении прекращался [22, 23]. Также известно, что у нативных растений влиянию света более подвержена форма палисадных клеток, чем губчатых [23]. В нашем эксперименте у микрорастений эта тенденция сохраняется. Коэффициент палисадности, отражающий фотосинтетическую мощь листа [24], последовательно возрастал (изменившись почти в 4 раза) с увеличением интенсивности света (таблица 1). Таким образом, показатель палисадности характеризует адаптационную пластичность растения к увеличению интенсивности света.
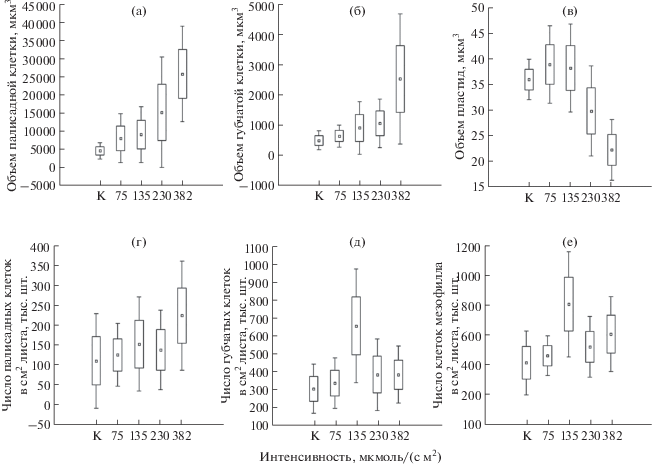
Строение мезофилла листа также менялось в зависимости от интенсивности освещения. Большинство образцов имели дорзовентральное строение мезофилла листа, и только растения, культивируемые при максимальной интенсивности света, формировали изопалисадное его строение. Эти образцы отличались наибольшими среди всех вариантов размерами клеток (рис. 4а, б). Известно, что возрастание интенсивности освещения при достаточном водоснабжении вызывает значительное увеличение размеров клеток, особенно палисадных, у нативных растений [22, 23, 25]. Другие авторы указывают, что световые листья растений характеризуются более мелкими клетками [26], что в естественных условиях может быть связано с недостатком влаги, часто сопровождающим высокую инсоляцию [21].
Рис. 4.
Диаграмма размаха параметров мезоструктуры фотосинтетического аппарата листьев микрорастений Stevia rebaudiana в зависимости от интенсивности освещения: (a) – изменение объема палисадной клетки; (б) – изменение объема губчатой клетки; (в) – изменение объема пластид; (г) – изменение числа палисадных клеток; (д) – изменение числа губчатых клеток; (е) – изменение числа клеток мезофилла. К – контроль, ◻ – среднее значение, ◻ – среднее значение ± стандартное отклонение, I – среднее значение ± 1.96 × стандартное отклонение.
В условиях низкой интенсивности освещения особенностью мезофилла листа являлось наличие столбчатых клеток, имеющих на концах перетяжки. Вероятно, подобная форма лучше подходит для фокусирования слабого и рассеянного света [27, 28], а в данном эксперименте – самой низкой его интенсивности. В прямой зависимости от интенсивности освещения находился и КОХ (объем клетки, приходящийся на один хлоропласт), характеризующий способность обеспечивать метаболитами, субстратами дыхания, АТФ и НАДФ∙H определенный объем клетки. Значения показателя возрастали при увеличении интенсивности (таблица 1).
Число пластид в клетке существенно не различалось во всех вариантах опыта. Из литературных источников известно, что этот показатель является наиболее стабильным внутри вида и его значения в большей степени зависят от хромосомного набора [24]. По нашим данным, у растений Mertensia maritima (L.) Gray, обитающих на разных широтах, также обнаруживали низкий (не более 11%) уровень изменчивости этого параметра [29].
У исследованных микрорастений объемы пластид были мелкие, их размеры различались в 1.7 раза (рис. 4в). Этот параметр считается наиболее стабильным, но именно он способен к двукратному изменению под действием затенения [24]. Во всех вариантах с использованием светодиодов наблюдалась обратная зависимость их размеров от интенсивности освещения. Значения этого показателя в контроле находились между таковыми при освещенности 135 и 230 мкмоль/(с м2), что, вероятно, может быть вызвано иным спектральным составом света.
Максимальное число клеток и минимальное соотношение количества палисадных клеток к губчатым наблюдались при интенсивности освещения 135 мкмоль/(с м2) (рис. 4г–4е). Надо отметить, что во всех случаях на единицу площади листа приходилось больше клеток губчатой ткани, чем столбчатой. Это соотношение менялось, достигая своего максимального значения при наибольшей для эксперимента интенсивности освещения.
Наиболее выраженные гелиоморфные черты наблюдали у выращенных в условиях максимальной интенсивности света образцов (382 мкмоль/(с м2)). Листья у этого варианта имели наибольшую толщину: изопалисадный мезофилл из самых крупных в опыте клеток с наибольшими (КОХ) объемами, размер которых не только значительно превышал средние значения для растений с данным типом строения мезофилла листа – 213.8 мкм, но и практически приближался к объемам у суккулентов – 758.6 мкм [30]. Кроме того, в этом варианте обнаружены самые мелкие в выборке пластиды. В совокупности с морфометрическими показателями, такими как минимальные высота и вес растения, размеры листьев, мезоструктурные данные можно квалифицировать как совокупное проявление не только гелио-, но и ксероморфных черт. Таким образом, данная интенсивность освещения, по-видимому, является избыточной для микрорастений.
Считается, что в условиях достаточного увлажнения и освещения у растений формируется дорзовентральное строение мезофилла листа, которое обнаружено во всех остальных вариантах опыта. Предпосылки для осуществления максимально высокого фотосинтеза выявлены у образца при интенсивности освещения 135 мкмоль/(с м2), где отмечено наибольшее клеточное и пластидное наполнение листа. Эти данные также согласуются с морфометрическими показателями.
Растения, выращенные при интенсивности 230 мкмоль/(с м2), также реагировали на возрастание интенсивности света увеличением толщины листа, объемов клеток мезофилла, а также вклада палисадной паренхимы в фотосинтетический потенциал, и приобретали КОХ, свойственный большинству видов с дорзовентральным строением мезофилла. Эти структурные перестройки обеспечивают формирование микрорастений с набором наиболее желательных качеств, таких как хороший рост надземной и подземной частей растений и формирование максимального количества крупных листьев.
Растения обладают арсеналом средств для адаптации к различным условиям освещения. Исследование мезоструктуры листа S. rebaudiana показало, что при росте интенсивности света наблюдается возрастание толщины листа за счет увеличения размеров клеток. При возрастании интенсивности света хлоропласты уменьшаются в размерах, показатель КОХ возрастает, следовательно, хлоропласту приходится обслуживать больший объем клетки, что в конечном итоге приводит к угнетению ростовых процессов. Наглядной характеристикой является габитус растений при интенсивности света 382 мкмоль/(с м2), при которой наблюдали формирование угнетенных растений. Другой адаптацией к увеличению интенсивности освещения является формирование определенного строения мезофилла листа, когда при низких и средних значениях интенсивности света наблюдали дорзовентральное строение, в то время как при максимальных показателях интенсивности освещения показан переход к изопалисадному строению. При понижении интенсивности на столбчатых клетках мезофилла появляются перетяжки, способствующие фокусированию рассеянного света.
ЗАКЛЮЧЕНИЕ
При изучении влияния разной интенсивности света СД светильника на морфогенез S. rebaudiana в условиях in vitro было показано, что растения экспериментальных групп имели сходные с контрольной группой или более высокие морфометрические параметры. Исключением являются растения, культивированные при интенсивности света 382 мкмоль/(с м2). Интенсивность освещения в 75 и 230 мкмоль/(с м2) способствовала развитию растений с максимальными значениями морфометрических и мезоструктурных параметров. Такие растения с развитой корневой системой будут быстрее проходить процесс адаптации к условиям грунта, что в свою очередь снизит процент выпада. Полученные результаты позволят оптимизировать метод выращивания и размножения маточных растений. Использование таких сборных СД источников света, как солнечный бокс с заданной интенсивностью освещения, будет способствовать получению оптимальных для размножения in vitro и выращивания растений стевии, по своим характеристикам не уступающих растениям из контрольной группы, культивируемым под люминесцентными лампами. Дальнейшее внедрение СД источников света позволит существенно снизить затраты на электроэнергию.
Авторы выражают благодарность ведущему инженеру лаборатории биотехнологии ФНЦ Биоразнообразия ДВО РАН Тимашевой Лидии Михайловне за предоставленные для микроклонального размножения растения стевии медовой (Stevia rebaudiana).
Работа поддержана грантом Дальневосточного отделения Российской академии наук “Дальний Восток” № 18-5-079.
Список литературы
Soejarto D.D., Douglas K, Farnsworth N.R. Potential sweetening agents of plant origin–III. Organoleptic evaluation of Stevia leaf herbarium samples for sweetness // J. Nat. Prod. 1982. V. 45. P. 590–599.
Kinghorn A.D., Soejarto N.P.D., Nanayakkara C.M. A phytochemical screening procedure for sweet entkaurene glycosides in the genus Stevia // J. Nat. Prod. 1984. V. 47. P. 439–444.
Melis M.S. Renal excretion of stevioside in rats // J. Nat. Prod. 1992. V. 55. P. 688–690.
Valio I.F.M., Rocha R.F. Effect of photoperiod and growth regulator on growth and flowering of Stevia rebaudiana Bertoni // Jpn. J. Crop Sci. 1977. V. 46. P. 243–248.
Jeppesen P.B., Gregersen S., Poulsen C.R. Stevioside acts directly on pancreatic beta cells to secrete insulin: Actions independent of cyclic adenosine monophosphate and adenosine triphosphate-sensitive K+-channel activity // Metabolism. 2000. V. 49. P. 208–214.
Curi R., Alvarez M., Bazotte R.B. Effect of Stevia rebaudiana on glucose tolerance in normal adult humans // Braz. J. Med. Biol. Res. 1986. V. 19. P. 771–774.
Pederson P. Approximate composition of Stevia rebaudiana Bertoni // Nutr. Herbol. 1987. V. 18. P. 377–380.
Goyal S.K., Goyal R.K. Stevia (Stevia rebaudiana) a bio-sweetener: a review // Int. J. Food Sci. Nutr. 2010. V. 61. P. 1–10. https://doi.org/10.3109/09637480903193049
Mitra A., Pal A. In vitro regeneration of Stevia rebaudiana (Bert.) from nodal explants // J. Plant Biochem. Biotechnol. 2007. V. 16. P. 59–62.
Abdullateef R.A., Osman M.B. Effects of visible light wavelengths on seed germinability in Stevia rebaudiana Bertoni // Int. J. Biol. 2011. V. 3. P. 83–91.
Ramírez-Mosqueda M.A., Iglesias-Andreu L.G., Bautista-Aguilar J.R. The effect of light quality on growth and development of in vitro plantlet of Stevia rebaudiana Bertoni // Sugar Tech. 2017. V. 19. P. 331–336.
Zaidan L.B., Dietrich S.M., Felippe G.M. Effect of photoperiod on flowering and stevioside content in plants of Stevia rebaudiana Bertoni // Jpn. J. Crop Sci. 1980. V. 49. P. 569–574.
Ceunen S., Werbrouck S., Geuns J.M. Stimulation of steviol glycoside accumulation in Stevia rebaudiana by red LED light // J. Plant Physiol. 2012. V. 169. P. 749–752.
Бондарев Н.И., Решетняк О.В., Носов А.М. Влияние спектрального состава света видимой области и ультрафиолетовой радиации на развитие растений Stevia rebaudiana Bertoni in vitro и биосинтез в них стевиол-гликозидов // Ученые записки Орловского государственного университета. Серия: Естественные, технические и медицинские науки, 2010. Т. 4. С. 55–62.
Evans J.M., Vallejo V.A., Beaudry R.M., Warner R.M. Daily light integral influences steviol glycoside biosynthesis and relative abundance of specific glycosides in Stevia // HortScience. 2015. V. 50. P. 1479–1485.
Ермаков Е.И., Кочетов А.А. Рост и продуктивность стевии в регулируемых условиях в зависимости от фотопериода и интенсивности света // Доклады РАСХН. 1994. № 6. С. 7–8.
Гогичайшвили Н.Е. Накопление сухой надземной массы и сладких гликозидов у растений Stevia rebaudiana Bertoni на разных световых режимах в регулируемых условиях. IV Международная конференция “Селекция, экология, технология возделывания и переработка нетрадиционных растений”. Симферополь, 1996. С. 94–96.
Бондарев Н.И., Решетняк О.В., Носов А.M. Влияние фотопериода и интенсивности облучения на развитие побегов Stevia rebaudiana in vitro и синтез в них стевиол-гликозидов // Известия ТСХА. 2008. Вып. 4. С. 102–107.
Murashige T., Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiol. Plant. 1962. V. 15. P. 473–497.
Khrolenko Yu.A., Burundukova O.L., Burkovskaya E.V., Zhuravlev Yu.N. Mesophyll structure and chloroplast density in Panax ginseng leaves from the Sikhote-Alin Mts // Acta Biol. Cracov, Ser. Bot. 2012. V. 54. P. 54–60.
Горышина Т.К. Фотосинтетический аппарат растений и условия среды. Л.: изд-во ЛГУ, 1989. 203 с.
Nobel P.S., Zaragoza G.J., Smith W.K. Relation between mesophyll surface area, photosynthetic and illumination level during development for the leaves of Plectranus parviflorus Henckel // Plant Physiol. 1975. V. 55. P. 1067–1070.
Цельникер Ю.Л. Физиологические основы теневыносливости древесных растений. М.: Наука, 1978. 216 с.
Мокроносов А.Т. Мезоструктура и функциональная активность фотосинтетического аппарата // Мезоструктура и функциональная активность фотосинтетического аппарата. Свердловск: изд-во Урал. ун-та, 1978. С. 5–30.
Мокроносов А.Т. Онтогенетический аспект фотосинтеза. М.: Наука, 1981. 196 с.
Заленский В.Р. Материалы по количественной анатомии различных листьев одних и тех же растений // Изв. Киев. политех. ин-та. 1904. Т. 4. С. 1–12.
Singh T.C.N. An anatomical and ecological study of some ferns from Mussoorie (North+Western Himalayas) // J. Indian Bot. Soc. 1963. V. 42. P. 475–544.
Vogelmann T.C. Plant tissue optics // Annu. Rev. Plant Physiol. Mol. Biol. 1993. V. 44. P. 231–251.
Бурковская Е.В. Мезоструктура фотосинтетического аппарата Mertrnsia maritima (L.) S.F. Gray на разных широтах Дальнего Востока России // Вестник КрасГАУ. 2009. № 10. С. 50–53.
Вахрушева Д.В. Мезоструктура фотосинтетического аппарата С3-растений аридной зоны Средней Азии: Автореф. дис. канд. биол. наук. Л.: АН СССР БИН, 1989. 21 с.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



