Физиология растений, 2019, T. 66, № 5, стр. 384-393
Влияние почвообитающих грибов на проростки сорго веничного в присутствии полициклических ароматических углеводородов
О. В. Турковская a, *, Е. В. Дубровская a, С. Н. Голубев a, А. Д. Бондаренкова a, С. А. Баландина a, Н. Н. Позднякова a
a Федеральное государственное бюджетное учреждение науки Институт биохимии и физиологии растений
и микроорганизмов Российской академии наук
Саратов, Россия
* E-mail: turkovskaya_o@ibppm.ru
Поступила в редакцию 25.05.2018
После доработки 28.08.2018
Принята к публикации 05.09.2018
Аннотация
Проведено исследование морфометрических и физиолого-биохимических показателей проростков Sorghum bicolor (L.) Moench при воздействии на них естественных метаболитов почвообитающих грибов Fusarium oxysporum (Schlecht. emend. Snyder & Hansen) и Stropharia rugosoannulata (Farlow ex Murrill), полициклических ароматических углеводородов (ПАУ) пирена и флуорантена, а также продуктов их грибной деградации. Полученные данные свидетельствовали о меняющемся в зависимости от срока культивирования воздействии культуральных жидкостей (КЖ) грибов на растения. В случае S. rugosoannulata усиливалось ингибирующее действие, а F. oxysporum, напротив – стимулирующее (за исключением всхожести). КЖ грибов и нативные ПАУ повышали активность пероксидаз в проростках сорго в 3–7 раз относительно контроля. При этом продолжительность культивирования грибов имела существенное и противоположное влияние на тенденцию в изменениях активности пероксидаз сорго в ответ на воздействие КЖ строфарии и фузариума. Присутствие ПАУ и продуктов их грибного разрушения существенно меняло ряд показателей, особенно характерных для F. oxysporum. Наиболее выраженным было влияние флуорантена в его КЖ, приводившее к стимуляции роста побегов и к повышению веса проростков почти в 2 раза, но при этом активность пероксидаз понижалась более чем в 2 раза. Выявленные различия в воздействии метаболитов грибов на проростки сорго могут быть связаны с различной экологической стратегией грибов, продукцией ими различных биологически активных соединений, что приводит растения к соответствующим откликам на морфологическом и физиолого-биохимическом уровнях. Существенные изменения некоторых показателей в присутствии ПАУ и их производных являются свидетельством заметного влияния загрязнителей окружающей среды на межорганизменные взаимодействия.
ВВЕДЕНИЕ
Сорго веничное (Sorghum bicolor (L.) Moench) – неприхотливое быстрорастущее засухоустойчивое растение, развивающее мощную корневую систему и являющееся привлекательным объектом для использования в рекультивационных технологиях. Это диктует необходимость детального исследования механизмов взаимодействия сорго с почвенными микроорганизмами, оказывающими разноплановое воздействие на его рост и продуктивность. В естественных условиях постоянными спутниками растений являются и сапротрофные грибы, которые широко распространены во всех типах наземных биоценозов. Они осуществляют совместно с бактериями и животными очень важную функцию разложения и минерализации растительных остатков, в результате чего растения обеспечиваются необходимыми для них элементами минерального питания. Конкурируя за субстрат и пространство, растения и грибы вступают в различные формы взаимодействия: от мутуализма до антагонизма и даже паразитизма. Экскретируемые партнерами соединения, обеспечивающие эти взаимодействия, представлены широким спектром биологически активных веществ.
В наших экспериментах в качестве партнеров сорго исследованы штаммы грибов, имеющих различную таксономическую принадлежность и экологическую стратегию: аскомицет Fusarium oxysporum и базидиомицет Stropharia rugosoannulata.
Аскомицеты рода Fusarium – известные фитопатогены, вызывающие фузариозные заболевания растений, такие как гниль корней и трахеомикозное сосудистое увядание. Они способны продуцировать микотоксины, представляющие серьезную опасность для животных и человека [1]. Однако считается, что значительная часть грибов этого рода – сапротрофы, осуществляющие свою жизнедеятельность за счет лигнина и сложных углеводов. Известны штаммы, образующие взаимовыгодный симбиоз с растениями и даже защищающие их от болезней [2–4]. Грибы рода Fusarium продуцируют фитогормоны, такие как ауксины и гиббереллины, способствующие росту растения-хозяина [5, 6].
Stropharia имеет иную экологическую стратегию. Это – почвообитающий базидиомицет, подстилочный (гумусовый) сапротроф, участвующий в разложении мертвого растительного вещества. Выделяя в субстрат ферменты и органические кислоты, грибы активно метаболизируют лигнин, целлюлозу и гуминовые вещества. Биологически активные соединения этих грибов практически не исследованы.
В условиях загрязнения окружающей среды в процессы межорганизменных взаимодействий включаются поллютанты, например, полициклические ароматические углеводороды (ПАУ), являющиеся одними из распространенных и персистентных загрязнителей природной среды. Так, период полураспада в почве и седиментах фенантрена (3 кольца) составляет от 16 до 126 дней, тогда как для бенз(а)пирена (5 колец) от 229 до 1400 дней [7]. При этом влияние на живые организмы оказывают не только нативные молекулы загрязнителей, но и продукты их биодеградации и/или биотрансформации.
Использованные в нашей работе штаммы являются деструкторами ряда веществ этого класса, в том числе 4-циклических флуорантена и пирена. В литературе имеются данные по деградации и минерализации ПАУ в почве видами F. oxysporum [8] и S. rugosoannulata [9]. Известно, что под воздействием внеклеточных ферментативных систем грибов на первом этапе деградации ПАУ в основном образуются хиноновые метаболиты, которые, постепенно утрачивая ароматические структуры, на заключительных этапах превращаются в моноароматические кислоты, такие как салициловая, фталевая, протокатеховая [10], способные включаться в основной метаболизм бактериальных и грибных клеток. Однако информация о влиянии грибов-деструкторов ПАУ на растения в присутствии этих загрязнителей в литературе отсутствует.
В представленной работе рассматривается вариант “бесконтактного” опосредованного взаимодействия грибов с растением при обработке семян сорго их культуральными жидкостями, стерилизованными фильтрованием. Это позволяет выявить реакцию растения на метаболиты, продуцируемые грибами как в чистой культуре, так и с ПАУ, но в отсутствие партнера. Таким образом, нами сделана попытка смоделировать процессы влияния ПАУ на несимбиотические растительно-грибные взаимодействия.
Цель работы – выявление изменений в ответных реакциях проростков сорго на культуральные жидкости грибов в присутствии ПАУ.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование и исследование растений. В качестве тестового растения использовали сорго веничное (Sorghum bicolor (L.) Moench). Семена предварительно калибровали и стерилизовали поверхностно смесью спирта и перекиси водорода (1 : 1). Всхожесть определяли как процент проросших семян от их общего количества, использованного в эксперименте. Морфометрические показатели изучали у 5-суточных проростков сорго, для чего измеряли длину корней и побегов, определяли вес проростков, рассчитывали их средние значения и выражали в процентах от контрольных показателей. Контролем служили проростки сорго, выращенные на фильтрах, смоченных 5 мл богатой среды для базидиомицетов.
В качестве физиолого-биохимических характеристик исследовали общее содержание белков и активность пероксидаз. Концентрацию белка в проростках сорго определяли по методу Bradford [11], активность пероксидаз – спектрофотометрически по скорости образования продуктов окисления 2,2-азино-ди-3-этилбензотиазолин-6-сульфата (АБТС) при 436 нм [12] в присутствии 3 мМ Н2О2. За единицу активности принимали количество фермента, катализирующего образование 1 мкмоль продукта окисления в мин. Удельную активность определяли как мкмоль/мин/мг белка и выражали в Ед./мг белка.
Получение и исследование влияния культуральных жидкостей грибов. В качестве воздействующих факторов исследовали два штамма грибов Fusarium oxysporum IBPPM 543 (Коллекция ризосферных микроорганизмов ИБФРМ РАН) и Stropharia rugosoannulata DSM11372 (Центр окружающей среды Гельмгольца – UFZ, Лейпциг, Германия), и два 4-циклических ПАУ – флуорантен и пирен. Грибы выращивали в течение 7 и 14 суток на качалке при 120 об/мин и 26°С в колбах объемом 250 мл с 100 мл богатой среды для базидиомицетов [13] с собственными модификациями следующего состава (г/л): NH4NO3 – 0.724, KH2PO4 – 1.0, MgSO4 ⋅ 7H2O – 1.0, KCl – 0.5, дрожжевой экстракт – 0.5, FeSO4 ⋅ 7H2O – 0.01, ZnSO4 ⋅ 7H2O – 0.0028, CaCl2 ⋅ 2H2O – 0.033, глюкоза – 10.0, пептон – 10.0, рН – 6.0. В опытных вариантах использовались те же среды с добавлением флуорантена (“Fluka”, Швейцария) или пирена (“Fluka”, Швейцария) (0.05 г/л).
Деградацию ПАУ и образование метаболитов исследовали с помощью газожидкостного хроматографа (“Shimadzu GC-2010”, Германия) и комплекса высокоэффективной жидкостной хроматографии (“Smart-Line 5000”, Knauer, Германия) [14]. Мицелий и среду культивирования грибов разделяли фильтрованием, полученную культуральную жидкость стерилизовали, пропуская через бактериальные фильтры 0.22 мкм, наносили в количестве 5 мл на стерильные бумажные фильтры, предварительно помещенные в стерильные стеклянные чашки Петри диаметром 10 см, и использовали для определения всхожести семян и выращивания проростков сорго. В качестве контроля использовалась стерильная богатая среда для базидиомицетов.
Оценка фитотоксичности ПАУ и их производных. Оценивалось воздействие чистых ПАУ флуорантена и пирена и потенциальных метаболитов, образуемых в результате их грибной деградации: 9-флуоренол (“Aldrich”, Германия), 2-карбоксибензальдегид (“Aldrich”, Германия), 2.2'-дифеновая (“Fluka”, Швейцария) и фталевая (“Реахим”, Россия) кислоты на всхожесть семян и морфометрические параметры проростков сорго. Растворы тестируемых соединений готовили в хлороформе в концентрации 0.25 мг/мл, по 1 мл раствора наносили на стерильные бумажные фильтры, предварительно помещенные в стерильные стеклянные чашки Петри диаметром 10 см. В качестве контроля использовались фильтры, смоченные 1 мл хлороформа. Через 3 суток после полного испарения растворителя фильтры смачивали 5 мл стерильной водопроводной воды и раскладывали на них по 20 семян сорго. Далее анализировали, как указано выше.
Статистическая обработка. Все эксперименты проводились в 3-кратной повторности. Статистическую обработку полученных данных выполняли, вычисляя средние значения, для сравнения которых использовали показатель наименьшей существенной разницы при P = 0.05 с применением теста Тьюки. Влияние исследуемых факторов на ростовые и биохимические показатели сорго оценивали с использованием множественного регрессионного анализа. Вычисления проводили с помощью программного обеспечения Statistica software version 7 (StatSoft Russia) и Microsoft Excell 2003.
В работе использовано оборудование Центра коллективного пользования “Симбиоз” Института биохимии и физиологии растений и микроорганизмов РАН, г. Саратов.
РЕЗУЛЬТАТЫ
Влияние грибов и продуктов деградации ПАУ на всхожесть семян и морфометрические показатели проростков сорго
Исследование влияния естественных метаболитов грибов, присутствующих в культуральных жидкостях (КЖ) после 7 и 14 суток роста (КЖ7 и КЖ14, соответственно), показало, что продолжительность культивирования обусловливает их различное воздействие на всхожесть и морфометрические показатели проростков сорго. В случае S. rugosoannulata воздействие КЖ14 было более сильным по всем показателям по сравнению с КЖ7, а в случае всхожести и длины корня менялось от стимуляции к ингибированию (рис. 1а, 1г). Развитие побегов сорго резко угнеталось под влиянием и КЖ7 на 39%, и КЖ14 – на 51% (рис. 1в). Таким же негативным было влияние на вес проростков КЖ7 и еще более КЖ14 – на 17 и 33%, соответственно (рис. 1б). Иное воздействие на растение оказывала культуральная жидкость F. oxysporum, способствуя повышению большинства показателей проростков сорго, причем увеличение срока культивирования мицелия до 14 суток повышало стимулирующую активность КЖ (КЖ14) на все показатели за исключением всхожести. Самым выраженным было ее воздействие на длину корня – на 170% относительно контроля. Длина побега при этом увеличивалась на 35%.
Рис. 1.
Влияние культуральных жидкостей грибов в присутствии и в отсутствие ПАУ на развитие проростков сорго: а ‒ всхожесть; б – вес проростка; в – длина побега; г – длина корня. FLT – флуорантен, PYR – пирен, Str – S. rugosoannulata, Fus – F. oxysporum. Продолжительность культивирования грибов: 1 – 7 суток, 2 – 14 суток.
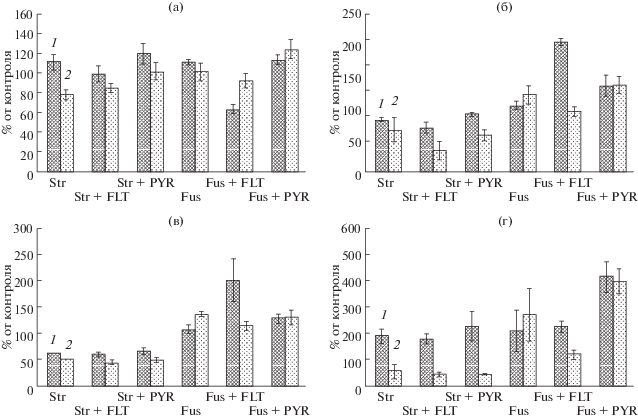
Рис. 2.
Влияние нативных ПАУ (1) и культуральных жидкостей грибов после 7 (2) и 14 (3) суток культивирования в присутствии и в отсутствие ПАУ на концентрацию белка в тканях проростков сорго. FLT – флуорантен, PYR – пирен, Str – S. rugosoannulata, Fus – F. oxysporum.

Рис. 3.
Влияние нативных ПАУ (1) и культуральных жидкостей грибов после 7 (2) и 14 (3) суток культивирования в присутствии и в отсутствие ПАУ на активность пероксидаз в проростках сорго (по отношению к АБТС). FLT – флуорантен, PYR – пирен, Str – S. rugosoannulata, Fus – F. oxysporum.

Рис. 4.
Влияние ПАУ и их производных на всхожесть семян, на длину побега и длину корня проростков сорго. 1 – Контроль, 2 – 9-гидроксифлуорен, 3 – фталевая кислота, 4 – 2-карбоксибензальдегид, 5 – 2,2'-дифеновая кислота, 6 – пирен, 7 – флуорантен. Всх. – всхожесть, ДП – длина побега, ДК – длина корня. Столбцы, помеченные одинаковыми буквами, для каждого показателя не имели существенно значимых различий при Р = 0.05.

Проведенный регрессионный анализ полученных данных не установил достоверного влияния строфарии на всхожесть и развитие корней сорго, но подтвердил сильное обратное влияние гриба на показатели длины побега и веса проростка (R2 = –0.870 и R2 = –0.912, соответственно), временной фактор оказывал умеренное обратное влияние на всхожесть и длину корня (R2 = –0.503 и R2 = –0.540, соответственно). В случае фузариума показано, что гриб достоверно влиял на все показатели развития проростков, сильным было влияние на всхожесть и развитие корня (R2 = 0.856 и R2 = 1.000, соответственно), умеренным – на вес (R2 = 0.679) и слабым – на длину побега (R2 = 0.490).
Ранее нами было установлено, что исследуемые грибы являются деструкторами ПАУ и их способность разрушать ПАУ была различной. F. oxysporum активно деградировал только флуорантен [15]. Деградация достигала 66.7% через 5 суток культивирования и практически не увеличивалась до 14 суток. При этом в качестве мажорных метаболитов на 5–8 сутки выявлялись 2-карбоксибензальдегид, 2,2'-дифеновая и фталевая кислоты, в незначительных количествах тестировался 9-гидроксифлуорен. Через 14 суток в среде культивирования эти метаболиты не определялись, что может указывать на их дальнейшую утилизацию. Пирен был практически не доступен для гриба, его разрушение составляло не более 8% за 14 суток культивирования.
Штамм S. rugosoannulata подвергал деградации оба ПАУ примерно одинаково: 86.4 и 87.4% за 14 суток для пирена и флуорантена, соответственно. При этом мицелий гриба нарастал медленнее, чем у F. oxysporum, и окисление ПАУ начиналось со второй недели культивирования. В случае пирена в качестве мажорных метаболитов выявлялись 2-карбоксибензальдегид и 2,2'-дифеновая кислота, а флуорантена – 9-гидроксифлуорен (следы) и 2-карбоксибензальдегид, на более поздних сроках культивирования при разрушении этих ПАУ обнаруживалась фталевая кислота.
Как следует из рис. 1, присутствие поллютантов при культивировании исследуемых грибов отражалось на воздействии их КЖ на всхожесть и морфометрические показатели проростков сорго.
Присутствие флуорантена в КЖ строфарии при сравнении с чистой культурой практически не оказывало влияния на всхожесть и длину корня, заметно снижая (в 2 раза) вес проростков в случае КЖ14. Пирен незначительно повышал показатели воздействия “чистых” КЖ на всхожесть и вес проростков. На длину побега и корня присутствие обоих ПАУ в КЖ строфарии практически не влияло. Таким образом, присутствие ПАУ при культивировании S. rugosoannulata не меняет тенденцию повышения фитотоксичности КЖ с возрастом грибной культуры, несколько влияя (не более 30%) на величины отдельных показателей. Использование регрессионного анализа данных этого эксперимента позволило установить, что в случае строфарии сильное влияние на вес проростков и длину побега оказывал гриб (R2 = –0.912 и R2 = –0.870), флуорантен на вес проростков влиял слабо (R2 = 0.437), однако эффект был недостоверным для P = 0.05. На всхожесть и развитие корня сорго оба исследованных ПАУ, так же, как и гриб, практически не влияли (R2 < 0.3). Пирен не влиял ни на один ростовой показатель сорго.
Иначе проявлялось влияние ПАУ в случае F. oxysporum. Как говорилось выше, КЖ этого гриба не обладала фитотоксичностью ни по одному показателю и, напротив, значительно стимулировала рост корней. При этом увеличение срока культивирования гриба до 14 дней сопровождалось усилением этой стимуляции (за исключением всхожести). Присутствие флуорантена меняло этот эффект практически на противоположный, повышая под действием КЖ7 почти в 2 раза стимуляцию накопления биомассы проростков и длину побегов и также резко снижая эти показатели при обработке семян КЖ14. На длину корня присутствие флуорантена не оказывало столь выраженного стимулирующего воздействия как на побег и вес, но КЖ14 снижала стимулирующее влияние “чистого” аналога на 150%, однако сохраняя его на положительном уровне. То есть, можно сказать, что фитотоксичность КЖ в процессе роста F. oxysporum с флуорантеном возрастает. На всхожесть присутствие этого ПАУ влияло ингибирующе только при обработке КЖ7 (на 40%). КЖ14 этого эффекта уже не имела (лишь на 10%). Влияние пирена, который фузариумом не разрушался, выражалось в повышении показателей, оказываемых чистыми КЖ, при этом срок культивирования гриба не оказывал существенного влияния. Особенно значительным это повышение касалось длины корня – практически в 2 раза. Регрессионный анализ показал, что влияние флуорантена в КЖ фузариума на вес проростков сорго был сильным (R2 = –0.741), на всхожесть семян – умеренным (R2 = –0.571), на длину корня и побега влияния не выявлено. Пирен оказывал умеренное влияние на длину корня (R2 = 0.571) и вес проростка (R2 = 0.592), на остальные параметры он практически не влиял.
Таким образом, присутствие ПАУ в среде культивирования грибов вызывало определенные изменения в воздействии их КЖ на прорастание семян и развитие проростков сорго, что, вероятно, является следствием изменений в их составе.
Влияние грибов и продуктов деградации ПАУ на продукцию белка и активность внутриклеточных пероксидаз сорго
При определении продукции белка в проростках сорго в пересчете на мг сырой биомассы установлено, что этот показатель не имел положительной корреляции с ростовыми характеристиками, причем КЖ строфарии более чем на 30% повышала концентрацию белка в проростках, а F. oxysporum снижал примерно на такую же величину. При этом возраст КЖ обоих грибов практически не влиял на эти показатели (рис. 2).
При исследовании влияния нативных ПАУ установлено, что только флуорантен оказывал существенное воздействие, снижая содержание белка почти вдвое, а пирен на этот показатель практически не влиял (рис. 2). Присутствие флуорантена в КЖ S. rugosoannulata не оказывало воздействия на концентрацию белка. Пирен несколько снижал стимулирующий эффект от КЖ гриба, однако оставляя его при этом на положительном уровне. Присутствие флуорантена в КЖ F. oxysporum оказывало негативное влияние, понижая содержание белка на 20–25% относительно “чистой” КЖ. Пирен не влиял на этот показатель.
Регрессионный анализ выявил, что S. rugosoannulata оказывала умеренное положительное (R2 = 0.572), а F. oxysporum – умеренное негативное (R2 = –0.511) влияние на концентрацию белка в проростках сорго. Присутствие пирена в КЖ S. rugosoannulata оказывало слабое влияние (R2 = 0.451), в то время как в КЖ F. oxysporum на накопление белка влияло присутствие флуорантена (R2 = 0.655).
При исследовании влияния ПАУ в чистом виде на активность пероксидаз проростков сорго показано, что флуорантен и пирен повышали активность ферментов (по окислению АБТС) в 3.2 и 2.8 раз, соответственно. Также и обработка семян всеми вариантами КЖ исследуемых грибов приводила к значительному повышению активности внутриклеточных пероксидаз в проростках сорго (рис. 3 ).
КЖ7 и КЖ14 S. rugosoannulata увеличивали активность пероксидаз сорго в 3.2 и 4.6 раз, соответственно. В случае F. oxysporum “возраст” КЖ имел существенное значение и понижал стимуляцию их активности: от более чем в 7 раз для КЖ7 до 1.7 раз для КЖ14. Влияние ПАУ в среде культивирования грибов было существенным и неоднозначным. В КЖ14 строфарии присутствие флуорантена повышало активность растительных пероксидаз на 130% по сравнению с “чистым” аналогом. В случае пирена эффект был обратным: КЖ7 повышала активность на 90%, а КЖ14 понижала на 180%. Флуорантен и пирен в КЖ7 фузариума понижали стимулирующую активность в сравнении с “чистыми” КЖ в 2.3 и 4 раза, соответственно. КЖ14 – стимулировала на 35 и 50%, соответственно.
Регрессионный анализ показал, что на активность пероксидаз сорго при воздействии КЖ S. rugosoannulata влияние гриба было сильным (R2 = = 0.790), влияние “возраста” КЖ – умеренным (R2 = 0.614), флуорантена – слабым (R2 = 0.402), пирен не влиял на этот показатель. В составе КЖ F. oxysporum на активность пероксидаз умеренно влиял пирен (R2 = 0.564), слабо – “возраст” КЖ (R2 = –0.397), влияния гриба установлено не было.
Исследование фитотоксичности ПАУ и их потенциальных метаболитов
Выяснение влияния ПАУ и возможных продуктов их деградации на растения проводилось с использованием чистых веществ в тестах на фитотоксичность (рис. 4 ). Установлено, что флуорантен обладал статистически достоверным стимулирующим эффектом на развитие проростков сорго: побеги удлинялись на 30, а корни – на 70% относительно контроля. Пирен не оказывал заметного влияния. Среди веществ – потенциальных метаболитов ПАУ, стимулирующим эффектом обладала 2,2'-дифеновая кислота: побеги удлинялись на 20, а корни – на 27%, однако отличия от контроля не были достоверными. Ингибирующий эффект проявлял 9-гидроксифлуорен, являющийся продуктом деградации флуорантена: более чем на 40% снижалась всхожесть, которая составляла в контроле 80%, на 30% – длина корня (13 мм в контроле), на 15% – длина побега (24 мм в контроле), при этом значимой разница была лишь для всхожести. 2-карбоксибензальдегид негативно влиял на длину побега и корня (на 10%), но эффект не был статистически достоверным. Остальные производные ПАУ, обнаруженные в качестве промежуточных метаболитов, не оказывали заметного влияние на развитие проростков сорго. Таким образом, флуорантен достоверно стимулировал развитие корней и побегов сорго, в то время как 9-гидроксифлуорен снижал его всхожесть.
ОБСУЖДЕНИЕ
Воздействие на растение стрессовых факторов, к которым относятся и поллютанты, отчетливо проявляется уже на ранних этапах его онтогенеза, что используется в стандартных методах токсикологического биотестирования. В нашем случае мы использовали этот подход, определяя всхожесть семян сорго, и параметры развития проростков. В качестве показателя физиолого-биохимического статуса растения определяли активность внутриклеточных пероксидаз для оценки защитных реакций растения.
Исследуемые в работе грибы имеют разные жизненные стратегии, поэтому тип их взаимодействия с растениями различен. Базидиомицет S. rugosoannulata, являясь гумусовым сапротрофом, с травянистыми растениями в природной среде имеет, вероятно, конкурентные взаимоотношения, поскольку использует те же питательные ресурсы. Сапротрофный аскомицет F. oxysporum может являться и ассоциантом и патогеном, поскольку грибы этого рода проявляют штаммоспецифичность в отношении видов растений [4]. Являясь для одного растения патогеном, для другого этот штамм может быть нейтральным. Взаимодействия патогенных грибов с растениями довольно хорошо изучены, чего нельзя сказать о несимбиотических взаимоотношениях. Вещества, обеспечивающие растительно-грибные взаимодействия, являются продуктами первичного и вторичного метаболизма. Многие грибы способны продуцировать биологически активные вещества, такие как фитогормоны, микотоксины, антибиотики и др., однако спектр этих соединений столь широк, что их разнообразие, как химическое, так и функциональное изучено еще недостаточно [16].
Загрязнение окружающей среды поллютантами, в том числе такими опасными, как ПАУ, оказывает существенное влияние на процессы межорганизменных взаимодействий. Представленная работа касается вопроса влияния естественных продуктов жизнедеятельности двух грибов на раннее развитие растений сорго веничного и изменения этого влияния в присутствии поллютантов – ПАУ. ПАУ, как известно, не являются ксенобиотиками, подобные им структуры широко представлены в живых организмах в виде биологически активных соединений (флавоноидов, терпеноидов, стероидов и пр.) [17]. Именно поэтому влияние техногенных ПАУ может существенно нарушать нормальные взаимоотношения, например, грибов с растениями. Исследуемые в нашей работе грибы обладают деструктивной активностью в отношении ПАУ, в связи с чем влияющими на растения агентами становятся и продукты грибной деградации этих веществ. Сказанное послужило основной гипотезой и нашло свое подтверждение в проведенном исследовании.
Изучаемые грибы имели различия при глубинном культивировании. S. rugosoannulata, являясь медленно растущей культурой, достигала стационарной фазы на 8–10 сутки, тогда как F. oxysporum – на 2–3 сутки. Воздействие их КЖ, отобранных через 7 и 14 суток (стерилизованных фильтрованием), также было различным.
Поскольку токсичными считаются КЖ, вызывающие снижение всхожести семян или угнетение развития проростков не менее чем на 30% [18], во внимание принимали показатели, соответствующие этому критерию. Недельная культура S. rugosoannulata обладала отчетливым воздействием на развитие проростков. При этом эффект на побег и корень был прямо противоположным: удлинение побега ингибировалось, а корня – стимулировалось почти в 2 раза. В процессе 2-недельного культивирования возрастал ингибирующий эффект грибной КЖ в отношении всех показателей, а стимуляция удлинения корня сменилась на ингибирование. Вероятно, в среде накапливались токсичные для сорго продукты. Мицелий S. rugosoannulata нарастал медленно, продукция вторичных метаболитов начиналась позже, с чем и могут быть связаны наблюдаемые эффекты. Поскольку на процессы роста и развития растений способны влиять многие первичные и вторичные грибные метаболиты, предположить, какие именно компоненты оказывают такое воздействие, сложно.
F. oxysporum рос быстрее, в связи с чем продукция вторичных метаболитов начиналась раньше и увеличивалась в течение 2 недель. С возрастом культуры усиливались стимулирующие свойства КЖ (на все ростовые показатели сорго за исключением всхожести семян). Самым выраженным было воздействие КЖ14 на длину корня – на 170% относительно контроля. Вероятно, в КЖ повышалось содержание вещества-стимулятора или снижалось – ингибитора. О присутствии какого-то эффектора именно в КЖ7 свидетельствует резкий всплеск активности пероксидаз проростков сорго (в 7.2 раз). Через неделю в КЖ14 этот эффектор уже отсутствовал или маскировался и активность фермента снижалась в 4 раза по сравнению с воздействием КЖ7. Стимулирующие свойства фузариума, как уже упоминалось выше, могут быть связаны с продукцией им таких фитогормонов как ауксин и/или гиббереллин, способствующих растяжению растительных клеток [19]. В пользу этого свидетельствовало существенное удлинение корня с одновременным его истончением.
В случае S. rugosoannulata ее культивирование с ПАУ несущественно отражалось на всех ростовых показателях сорго. При культивировании F. oxysporum с флуорантеном большинство эффектов, обнаруженных для чистой культуры, менялись на противоположные: стимуляция ростовых параметров сорго КЖ7 и ее резкое снижение под действием КЖ14 (за исключением всхожести). Так, присутствие флуорантена привело к существенному всплеску стимуляции роста побегов и повышению веса проростков (практически в 2 раза) под воздействием именно КЖ7. КЖ14 уже не имела стимулирующего эффекта, ее влияние было на уровне контроля. Вполне вероятно, что повышение стимулирующего воздействия КЖ7 связано с образованием продукта деградации флуорантена, обладающего стимулирующей активностью. Известно, что химическая структура некоторых ПАУ подобна гормонам роста, например, гиббереллин имеет структуру, подобную флуорену [20]. Последующее снижение эффекта у КЖ14, возможно, связано с деградацией этого метаболита. Однако в случае пирена, который фузариум не подвергал деградации, длина корня также увеличивалась (почти в 2 раза). Поэтому с позиции прямого влияния метаболитов ПАУ эти явления трудно объяснить. Взаимодействия фузариев с растениями представляют собой комплекс перекрестных сигнальных путей [21], которые в присутствии поллютантов еще более усложняются.
Одними из важных показателей, отражающих физиологический и биохимический статус растения, являются содержание белка и активность ферментов. При определении продукции белка в проростках сорго установлено, что этот показатель не имел положительной корреляции с ростовыми характеристиками, причем, КЖ строфарии более чем на 30% повышала концентрацию белка в проростках, а F. oxysporum снижал примерно на такую же величину. При этом, возраст КЖ обоих грибов практически не влиял на эти показатели. Различным было влияние ПАУ в чистом виде (без грибов) на содержание белка в проростках сорго: в присутствии флуорантена этот показатель снижался почти вдвое, в то время как пирен практически не оказывал воздействия. Трудно объяснить такое влияние. Возможно, различия связаны с химической структурой этих ПАУ или растворимостью в воде (0.265 и 0.013 мг/л для флуорантена и пирена, соответственно).
Индукция синтеза пероксидаз является одной из ранних реакций растения как на биотический, так и абиотический стрессы, что нашло подтверждение и в наших экспериментах. Установлено, что и нативные ПАУ, и грибные КЖ повышали исходную активность пероксидаз проростков сорго в 3–7 раз относительно контроля. Чистые КЖ грибов влияли по-разному. В случае S. rugosoannulata возраст КЖ повышал активность фермента, а F. oxysporum – наоборот. При этом отклик растения на КЖ7 и КЖ14 строфарии превышал контрольные значения в 3.2 и 4.5, соответственно, КЖ7 фузариума в 7 раз, но влияние его КЖ14 приближалось к контролю. Воздействие ПАУ было отчетливым: в случае F. oxysporum это касалось КЖ7, которая в присутствии ПАУ теряла стимулирующую активность более чем в 2–3 раза, а для S. rugosoannulata, наоборот, присутствие флуорантена повышало активность КЖ14. Как уже говорилось выше, S. rugosoannulata отличалась от F. oxysporum скоростью роста, вероятно именно поэтому продукция вторичных метаболитов смещалась к 2-недельному сроку и именно поэтому отмечалась динамика повышения пероксидазной активности сорго в ответ на обработку КЖ (этот показатель увеличился относительно контроля в 3.3 и 4.6 раз, соответственно, для КЖ7 и КЖ14).
Использование регрессионного анализа, показывающего степень влияния фактора, позволило установить, что на все исследованные параметры доминирующее влияние оказывали грибы. Влияние ПАУ было сильным только на вес проростков в случае флуорантена в КЖ фузариума. Несмотря на существенные изменения показателей пероксидазной активности под влиянием F. oxysporum и ПАУ, регрессионный анализ не оценил их влияние как существенное. В то же время, влияние S. rugosoannulata оценивается как сильное.
В литературе увеличение активности пероксидаз было показано при обработке растений горчицы естественными метаболитами S. rugosoannulata. Механизм этого явления неизвестен [22], но расценивается как реакция растения на стресс. Аналогичный эффект наблюдался и при грибном инфицировании корней каучукового дерева [23]. Появлялся новый изофермент, который мог способствовать реакции лигнификации, что является одним из защитных механизмов растения против инфекции. Поскольку нами была использована стерилизованная фильтрованием культуральная жидкость, обнаруженное повышение активности пероксидаз не может быть связано с инфекцией. Вероятнее, повышенная активность пероксидаз в проростках сорго может быть вызвана метаболитами грибов. Описано, что элиситорами стресса растений могут выступать фитотоксичные метаболиты, недиссоциированные карбоновые кислоты и грибные цианиды водорода, некоторые поверхностно-активные гидрофобины [24]. В нашем случае при обработке семян сорго культуральной жидкостью грибов происходило значительное повышение активности внутриклеточных пероксидаз в проростках сорго. Присутствие ПАУ меняло степень этого воздействия, что дает основание считать, что и естественные метаболиты грибов, и ПАУ, а также продукты их деградации грибами являются для растения сорго взаимовлияющими стрессовыми факторами, запускающими реакции активизации одного из элементов антиоксидантной защиты – внутриклеточной пероксидазы. Нельзя не учитывать и влияние внеклеточных лигнинолитических ферментов исследуемых грибов. Нами ранее показано, что S. rugosoannulata продуцирует лакказу и Mn-пероксидазу [14], а Fusarium – Mn-пероксидазу в ответ на присутствие ПАУ [15]. Эти ферменты катализируют деградацию ПАУ, в том числе флуорантен и пирен. Кроме того, и пероксидазы сорго способны окислять некоторые ПАУ и их производные, что нами также установлено [25]. Тот факт, что исследуемые ПАУ являются субстратами как для грибных ферментов, так и пероксидаз сорго, может рассматриваться как фактор, влияющий на проявление активности пероксидаз проростков сорго. В этом случае продукт окисления ПАУ одним ферментом может выступать субстратом или медиатором для другого, как это ранее нами было показано для грибных ферментов [26], что может приводить к ускорению реакции окисления ПАУ.
В целом, если рассматривать повышение пероксидазной активности проростков сорго как защитную реакцию растения на стрессовое воздействие, то присутствие ПАУ в КЖ F. oxysporum снижает уровень этой защиты. В случае S. rugosoannulata этот эффект менее выражен. Структуры вторичных метаболитов грибов (микотоксинов, фитогормонов, антибиотиков и др.) столь многообразны и многие из них имеют химическую структуру, подобную ПАУ, что влияние нативных ПАУ и их производных, образующихся в результате грибной деградации, трудно обосновать. Это требует дальнейших расширенных аналитических исследований.
В тестах на фитотоксичность ПАУ и их потенциальных грибных метаболитов установлено, что негативным эффектом на проростки обладал только 9-гидроксифлуорен. Достоверно стимулировал развитие побега и корня флуорантен. По литературным данным, для базидиомицетов рода Stropharia при деградации ПАУ выявлены хиноны (9,10-антрахинон, фенантрен-9,10-хинон и др.) [27]. Ранее нами показано, что флуоренон и фенантренхинон стимулировали длину корней сорго [28]. Однако следует учитывать, что фитотоксичность чистых веществ определялась при их концентрации 0.25 мг/мл, а содержание метаболитов ПАУ в КЖ грибов колебалось, поэтому экстраполировать полученные результаты на возможное воздействие продуктов деградации ПАУ на проростки сорго следует с осторожностью.
Вышесказанное свидетельствует о том, что грибы-деструкторы могут оказывать существенное и разноплановое влияние на рост и развитие растений, как напрямую – посредством собственных вторичных метаболитов, так и опосредованно через продукты деградации поллютантов. Таким образом, при исследовании влияния КЖ двух штаммов грибов, принадлежащих к различным экофизиологическим группам, и метаболитов, образуемых ими при деградации пирена и флуорантена, на развитие проростков сорго веничного установлено, что грибы оказывали различное воздействие, вызываемое их естественными метаболитами: от ингибирования до стимуляции. Присутствие ПАУ и продуктов их грибного разрушения существенно меняло ряд показателей растений. Полученные данные являются важным свидетельством существенного воздействия загрязняющих веществ на межорганизменные взаимодействия, которые могут происходить в природных условиях.
Авторы благодарят Дитмара Шлоссера (Центр окружающей среды Гельмгольца – UFZ, Лейпциг, Германия) за предоставленный штамм Stropharia rugosoannulata и М.П. Чернышову и В.С. Гринева (ИБФРМ РАН) за проведение хроматографических анализов.
Работа выполнена в рамках темы государственного задания Института биохимии и физиологии растений и микроорганизмов Российской академии наук № АААА-А17-117102740093-3 и при поддержке Российского фонда фундаментальных исследований (проект № 16-04-00351).
Список литературы
Antonissen G., Martel A., Pasmans F., Ducatelle R., Verbrugghe E., Vandenbroucke V., Li S., Haesebrouck F., Van Immerseel F., Croubels S. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases // Toxins. 2014. V. 6. P. 430–452.
Moretti M., Minerdi D., Gehrig P., Garibaldi A., Gullino M.L., Riedel K. A bacterial–fungal metaproteomic analysis enlightens an intriguing multicomponent interaction in the rhizosphere of Lactuca sativa // J. Proteome Res. 2012. V. 11. № 4. P. 2061–2077. https://doi.org/10.1021/pr201204v
Trillas M.I., Segarra G. Chapter 8 Interactions between nonpathogenic fungi and plants // Advances in Botanical Research. 2009. V. 51(C). P. 321–359. https://doi.org/10.1016/S0065-2296(09)51008-7
Di X., Takken F.L.W., Tintor N. How phytohormones shape interactions between plants and the soil-borne fungus Fusarium oxysporum // Front. Plant Sci. 2016. V. 7. P. 170. https://doi.org/10.3389/fpls.2016.00170
Kulkarni G.B., Sajjan S.S., Karegoudar T.B. Pathogenicity of indole-3-acetic acid producing fungus Fusarium delphinoides strain GPK towards chickpea and pigeon pea // Eur. J. Plant Pathol. 2011. V. 131. P. 355–369.
Муромцев Г.С., Раковский Ю.С., Крутова Р.Л., Первий Э.Н. Способ выделения гиббереллина из культуральной жидкости гриба Fusarium moniliforme. (А.с. СССР № 287968). Опубл. 03.12.1970. Бюл. № 36.
Lawal A.T. Polycyclic aromatic hydrocarbons. A review // Cogent Environmental Science. 2017. V. 3. P. 1339841. https://doi.org/https://doi.org/10.1080/23311843.2017.1339841
Jacques R.J., Okeke B.C., Bento F.M., Teixeira A.S., Peralba M.C., Camargo F.A. Microbial consortium bioaugmentation of a polycyclic aromatic hydrocarbons contaminated soil // Bioresour. Technol. 2008. V. 99. P. 2637–2643.
Steffen K., Schubert S., Tuomela M., Hatakka A., Hofrichter M. Enhancement of bioconversion of high-molecular mass polycyclic aromatic hydrocarbons in contaminated non-sterile soil by litter-decomposing fungi // Biodegradation. 2007. V. 18. P. 359–369.
Steffen K., Hatakka A., Hofrichter M. Degradation of humic acids by the litter-decomposing basidiomycete Collybia dryophila // Appl. Environ. Microbiol. 2002. V. 68. P. 3442–3448.
Bradford M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248–254.
Niku-Paavola M., Karhunen E., Salola P., Raunio V. Ligninolytic enzymes of the white rot fungus Phlebia radiate // Biochem. J. 1988. V. 254. P. 877–884.
Bezalel L., Hadar Y., Cerniglia C. Enzymatic mechanisms involved in phenanthrene degradation by the white rot fungus Pleurotus ostreatus // Appl. Environ. Microbiol. 1997. V. 63. P. 2495–2501.
Pozdnyakova N., Schlosser D., Dubrovskaya E., Balandina S., Sigida E., Grinev V., Turkovskaya O. The degradative activity and adaptation potential of the litter-decomposing fungus Stropharia rugosoannulata // World Journal of Microbiology and Biotechnology. 2018. V. 34. P. 133. https ://doi.org/4-018-2516-6https://doi.org/10.1007/ s1127
Pozdnyakova N., Varese G.C., Prigione V., Dubrovskaya E., Balandina S., Turkovskaya O. Degradative properties of two new-isolated strains of ascomycetes: Fusarium oxysporum and Lecanicilium aphanocladii // Int. Microbiol. 2018. https://doi.org/https://doi.org/10.1007/s10123-018-0032-z
Багирова С.Ф., Джавахия В.Г., Дьяков Ю.Т., Озерецковская О.Л., Проворов Н.А., Тихонович И.А., Щербакова Л.А. // Фундаментальная фитопатология / Под ред. Ю.Т. Дьякова. М.: Издательство КРАСАНД, 2012. 512 с.
Kovaґcs A., Vasas A., Hohmann J. Natural phenanthrenes and their biological activity // Phytochemistry. 2008. V. 69. 1084–1110. https://doi.org/10.1016/j.phytochem.2007.12.005
Берестецкий О.А. Изучение фитотоксических свойств микроскопических грибов // Методы экспериментальной микологии. Киев: Наукова думка, 1982. С. 321–333.
Блюм Я.Б., Красиленко Ю.А., Емец А.И. Влияние фитогормонов на цитоскелет растительной клетки // Физиология растений. 2012. Т. 59. С. 557–573.
Seta Y., Kitamura H., Takahashi N., Sumiki Y. Chemical structure of gibberellins VIII // Journal of the Agricultural Chemical Society of Japan. 1957. V. 21. № 1. P. 73–74. https://doi.org/10.1080/03758397.1957.10857360
Dinolfo M.I., Castanares E., Stenglein S.A. Fusarium–plant interaction: state of the art – A review // Plant Protect. Sci. 2017. V. 53. № 2. P. 61–70.
Gramss G., Mascher R. Mutual influence of soil basidiomycetes and white mustard plants on their enzymatic and catabolic activities // Journal of Basic Microbiology. 2011. V. 51. P. 40–51.
Geiger J.P., Riot B., Nandris D., Nicole M. Peroxidase production in tissues of the rubber tree following infection by root rot fungi // Physiological and Molecular Plant Pathology. 1989. V. 34. P. 241–256.
Gramss G. The universe of basidiomycetous ground fungi / Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology / A. Méndez, Ed., Formatex Microbiology Series Publication, Formatex Research Center, Badajoz, 2010. V. 1. P. 218–229.
Dubrovskaya E., Pozdnyakova N., Golubev S., Muratova A., Grinev V., Bondarenkova A., Turkovskaya O. Peroxidases from root exudates of Medicago sativa and Sorghum bicolor: Catalytic properties and involvement in PAH degradation // Chemosphere. 2017. V. 169. P. 224–232.
Pozdnyakova N.N., Rodakiewicz-Nowak J., Turkovskaya O.V., Haber J. Oxidative degradation of polyaromatic hydrocarbons catalysed by blue laccase from Pleurotus ostreatus D1 in the presence of synthetic mediators // J. Enzyme Microb. Technol. 2006. V. 39. № 6. P. 1242–1249.
Ghosal D., Ghosh S., Dutta T., Ahn Y. Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons (PAHs): A review // Front. Microbiol. 2016. V. 7. P. 1369.
Дубровская Е.В., Позднякова Н.Н., Муратова А.Ю., Турковская О.В. Изменение фитотоксичности полициклических ароматических углеводородов в процессе их микробной деградации // Физиология растений. 2016. Т. 63. С. 180–188.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


