Физиология растений, 2019, T. 66, № 6, стр. 403-411
Участие компонентов сигналинга синего света в регуляции цитокинин-зависимого зеленения проростков Arabidopsis thaliana
А. С. Дорошенко a, М. Н. Данилова a, *, А. С. Медведева a, В. В. Кузнецов a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева РАН
Москва, Россия
* E-mail: mariadanilova86@yandex.ru
Поступила в редакцию 03.12.2018
После доработки 24.01.2019
Принята к публикации 28.01.2019
Аннотация
Деэтиоляция проростков контролируется сложной сетью светового и гормонального сигналинга. Этот процесс сопровождается развитием хлоропластов и началом биосинтеза хлорофилла, что приводит к зеленению семядолей. В работе исследовали особенности регуляции экспрессии ключевых генов ферментов биосинтеза хлорофилла в растениях дикого типа и в мутантах Arabidopsis thaliana по генам восприятия и передачи сигнала синего света в процессе цитокинин-зависимого зеленения. Инактивация компонентов сигналинга синего света (CRY1, CRY2 и HY5) приводила к более медленному накоплению хлорофилла и снижению экспрессии ключевых генов его биосинтеза. Экзогенный цитокинин ускорял деэтиоляцию проростков как дикого типа, так и нокаут-мутантов cry1cry2 и hy5, что выражалось в повышении флуоресценции хлорофилла а и накоплении транскриптов ряда генов биосинтеза хлорофилла. Совокупность полученных данных может свидетельствовать о значительном вкладе сигналинга синего света в регуляцию зеленения на ранних этапах деэтиоляции проростков и вовлеченности белка HY5 в реализацию позитивного эффекта цитокинина на начальных стадиях фотоморфогенеза.
ВВЕДЕНИЕ
Прорастание семян растений в почве происходит в условиях полной темноты (этиоляции), когда молодой проросток стремится достигнуть ее поверхности посредством удлинения гипокотиля благодаря гетеротрофному росту за счет запасающих веществ семени. Достигнув поверхности почвы, этиолированный проросток претерпевает деэтиоляцию, в результате которой происходит переход на автотрофный тип питания. Характерными чертами этого процесса являются ингибирование роста гипокотиля, раскрытие семядолей и их зеленение (накопление хлорофилла) [1]. Процесс биосинтеза хлорофилла находится под контролем многочисленных эндогенных и экзогенных факторов, ключевым триггером которого является свет. Восприятие света у высших растений происходит при участии фоторецепторов, которые обеспечивают распознавание направления света, его продолжительность, качество и интенсивность [2, 3]. К ним относятся рецепторы синего и ультрафиолетового света – криптохромы (CRY1, CRY2), фототропины (PHOT1, PHOT2) и Zeitlupe белки, а также рецепторы красного и дальнего красного света – фитохромы (PHYA – PHYE) [2, 3]. Фотоактивированные рецепторы синего света подавляют активность убиквитинлигазного комплекса, тем самым освобождая от деградации многочисленные позитивные регуляторы деэтиоляции, прежде всего транс-фактор HY5 типа bZIP (basic domain/Leucine zipper). Функции рецепторов света перекрываются в регуляции фотоморфогенеза [3, 4]. Помимо внешних сигналов процесс зеленения контролируется эндогенными факторами, среди которых особое место занимают фитогормоны. В частности, цитокинины, обладая полифункциональным эффектом на рост и развитие растений, способны обеспечивать эффективное прохождение начальной стадии фотоморфогенеза. Они стимулируют экспрессию генов биосинтеза тетрапирролов, накопление хлорофиллов, снижение уровня активных форм кислорода и снижение фотоповреждения [1, 5]. Даже в темноте цитокинины способны имитировать эффект света и приводить к формированию некоторых свойств, характерных для проростков, выращенных на свету: укорочение гипокотиля, формирование настоящих листьев, частичное развитие системы мембран в пластидах из проламеллярного тела [6].
Светозависимое накопление хлорофиллов и хлорофилл-связывающих белков определяет запуск фотосинтеза в формирующихся из этиопластов хлоропластах. Эти процессы являются центральными в деэтиоляции, в основе которых лежит масштабное перепрограммирование экспрессии генов трех геномов растительной клетки: хлоропластного, ядерного и митохондриального. К настоящему времени все гены биосинтеза хлорофилла у Arabidopsis идентифицированы [7]. Биосинтез хлорофилла – многоступенчатый процесс, включающий большое количество интермедиатов, превращение которых катализируется при участии различных ферментов. Все они кодируются ядерным геномом, однако глутаминовая транспортная РНК, trnE, участвующая в биосинтезе хлорофилла, кодируется пластомом. Сам процесс биосинтеза тетрапирролов, к которым относится и хлорофилл, локализован в пластидах и берет начало с образования АЛК из глутамил-тРНК при участии ферментов глутамил-тРНК-редуктаз – HEMA1 – HEMA3 [7]. Одним из ключевых генов биосинтеза хлорофилла является Mg-хелатаза, ответственная за встраивание Mg2+ в протопорфирин IX. В анализ были взяты гены GUN4 и GUN5, кодирующие регуляторный тетрапиррол-связывающий белок, координирующий активность фермента Mg-хелатазы, и H-субъединицу Mg-хелатазы, функционирующие в середине пути образования хлорофилла [8]. Ген PORA кодирует светозависимый фермент ПОР (протохлорофиллидоксидоредуктазу), который осуществляет превращение протохлорофиллида в хлорофиллид. ПОР катализирует одну из завершающих реакций биосинтеза хлорофилла. В данной работе для анализа были выбраны ключевые гены биосинтеза хлорофилла, кодирующие ферменты и регуляторный белок, которые контролируют некоторые этапы формирования промежуточных соединений и хлорофилла в цепи его биосинтеза.
Роль света в регуляции экспрессии генов хлоропластных белков в зеленом растении хорошо исследована, однако роль света разного качества и участие цитокининов в контроле начального этапа фотоморфогенеза изучены недостаточно. В литературе представлено очень мало данных о механизме регуляции синим светом процесса зеленения проростков на уровне регуляции экспрессии ключевых генов биосинтеза хлорофилла на начальной стадии фотоморфогенеза. Синий свет и цитокинины – важнейшие факторы, регулирующие процесс зеленения, однако их интеграция в контроле этого процесса остается не известной.
Цель работы – исследование роли ключевых компонентов сигналинга синего света в транскрипционной регуляции экспрессии генов биосинтеза хлорофилла и его флуоресценции в ходе цитокинин-зависимой деэтиоляции нокаут-мутантов A. thaliana по генам CRY1, CRY2 и HY5.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Объектом исследования служили 4-дневные этиолированные проростки Arabidopsis thaliana дикого типа (Landsberg erecta), а также созданные на его основе нокаут-мутанты по генам рецепторов синего света cry1cry2 и гену фактора транскрипции hy5.
Условия эксперимента. Семена растений стерилизовали в растворе гипохлорита натрия и высевали на чашки Петри с половинной питательной средой Мурасиге-Скуга (“Duchefa”, Нидерланды) без сахарозы и цитокинина (0 мкМ транс-зеатина) и с добавлением транс-зеатина (1 мкМ). Для синхронизации прорастания семян чашки Петри выдерживали 2 дня при 4ºC, после чего для стимуляции прорастания семян их освещали в течение 3 ч белым светом интенсивностью 120 мкмоль/(м2 c). Проростки выращивали в условиях полной темноты 4 дня при температуре 22°C. Далее этиолированные проростки в чашках Петри переносили в климатическую камеру MLR-352Н-PE (“Sanyo”, Япония) с интенсивностью освещения 120 мкмоль/(м2 c) и температурой 22°C. Для исследования действия белого света и экзогенного цитокинина на экспрессию генов биосинтеза хлорофилла в процессе деэтиоляции проростки дикого типа и мутантов фиксировали в жидком азоте после 6-часовой экспозиции на свету. Все манипуляции с этиолированными проростками проводились на зеленом свету низкой интенсивности (0.25 мкмоль/(м2 c)), который, как считается, имеет слабый физиологический эффект при кратковременном воздействии [9, 10]. При определении длины гипокотилей для каждого варианта было измерено не менее 50 проростков.
Анализ пигментов. Фиксацию образцов (по 50 проростков) проводили в 0.5 мл 80% ацетона спустя 3, 6, 9 и 16 ч освещения. Для экстракции пигментов растительный материал растирали с добавлением кварцевого песка, дважды отмывали 80% ацетоном и доводили конечный объем пробы до 3 мл. Определение хлорофилла а проводили при комнатной температуре на спектрофлуориметре Shimadzu RF-5301PC (Япония) с использованием программы Panorama 3.1. Измерение проводили согласно следующим параметрам при соответствующих длинах волн возбуждения и испускания хлорофилла а: λex = 440 нм; λem = 600–800 нм.
Анализ экспрессии генов. Относительный уровень транскриптов изучаемых генов определяли методом количественной полимеразной цепной реакции в режиме реального времени после обратной транскрипции (ПЦР-РВ) на приборе LigthCyclerR96 (“Roche”, Швейцария) согласно методике, описанной ранее [11]. Уровень транскриптов целевых генов был нормирован относительно уровня транскриптов гена полиубиквитина (UBQ10). Для ПЦР-РВ анализа использовали последовательности праймеров, указанные в таблице 1.
Таблица 1.
Последовательности праймеров для ПЦР-РВ
| Ген | Локус | Продукт гена | Нуклеотидная последовательность, 5′–3′ |
|---|---|---|---|
| ARR5 | At3G48100 | Ген первичного ответа на цитокинин, регулятор ответа типа А | CTACTCGCAGCTAAAACGC GCCGAAAGAATCAGGACA |
| LHCB2.4 | At3G27690 | Хлорофилл а/b-связывающий белок | CCAACGATCTCCTCCGCAAA AGACTTGACGGTACGACGCA |
| HEMA1 | At3G54890 | Глутамил-тРНК-редуктаза | TCTGGTGCGGTTTCGGTTAG CACCCTTAGCCATCAAATGC |
| GUN4 | AT3G59400 | Тетрапиррол- и Mg-хелатаза-связывающий белок | CTGCTCTGCTTCTTCCACCTCCT GTGTCTCCTCGTCGGCTTGTCT |
| GUN5 | AT5G13630 | H-субъединица Мg-хелатазного комплекса | CCTCAATGTGTTTGCTTCCA GTTTCCCCCAGTTTTCTTCC |
| PORA | AT5G54190 | Протохлорофиллид-оксидоредуктаза А | TACCCTCTTCCCTCCTTTCCA AGCTCCAATACACTCCCGAC |
| UBQ10 | At4G05320 | Полиубиквитин 10 | GCGTCTTCGTGGTGGTTTCTAA GAAAGAGATAACAGGAACGGAAACA |
Статистический анализ. Каждое исследование проводили в 3–4-кратной биологической повторности в ходе независимых экспериментов. На гистограммах приведены средние значения и стандартные ошибки. Для оценки значимости различий средних значений использовали t-критерий Стьюдента.
РЕЗУЛЬТАТЫ
Влияние цитокинина на длину гипокотилей этиолированных проростков дикого типа и мутантов по компонентам сигналинга синего света
Для изучения влияния транс-зеатина на рост и развитие проростков измеряли длину гипокотилей дикого типа и нокаут-мутантов cry1cry2 и hy5, выращенных в условиях темноты на питательной среде с добавлением цитокинина или без гормона. Выращивание растений с гормоном приводило к значительному укорочению гипокотиля как у родительской линии, так и у мутантов по генам рецепции и трансдукции синего света (рис. 1а, б). Это позволяет сделать вывод об эффективности выбранной модельной системы и о том, что нокаут-мутанты по восприятию и трансдукции сигнала синего света чувствительны к цитокинину.
Рис. 1.
Фотография (а) и длина гипокотилей (б) 4-дневных этиолированных проростков A. thaliana дикого типа и нокаут-мутантов по компонентам сигналинга синего света. 1 – 0 мкМ транс-зеатина; 2 – 1 мкМ транс-зеатина. ** – достоверные различия между средними значениями длины гипокотилей проростков, выращенных с гормоном и средними значениями длины гипокотилей проростков, выращенных без гормона при P ≤ 0.01.

Экспрессия генов-маркеров ответа на свет и цитокинин у нокаут-мутантов cry1cry2 и hy5 в ходе деэтиоляции
Эффективность действия цитокинина оценивали по относительному содержанию транскриптов гена-маркера ответа на цитокинин – ARR5. Результаты показали, что цитокинин увеличивал уровень матриц гена ARR5 в проростках дикого типа и нокаут-мутантов cry1cry2 и hy5 как в темноте, так и на свету (рис. 2а). При этом мутант cry1cry2 характеризовался повышенной экспрессией гена ответа на ЦК – ARR5 (рис. 2а). Анализ экспрессии гена LHCB2.4, кодирующего белок светособирающего комплекса фотосистемы II, показал его активацию светом как в проростках дикого типа, так и у мутантов по рецепции и трансдукции синего света. Однако мутант hy5 отличался достоверно пониженной способностью накапливать транскрипты гена LHCB2.4 спустя 6 часов освещения (рис. 2б). Цитокинин, на фоне действия белого света, приводил к еще большему росту уровня матриц как у дикого типа, так и у мутантов по сигналингу синего света, при этом значимые отличия между мутантом hy5 и родительской линией отсутствовали (рис. 2б). Это может говорить о существовании независимого от транс-фактора HY5 пути активации цитокинином экспрессии этого гена.
Рис. 2.
Экспрессия генов-маркеров ответа на цитокинин ARR5 (а) и свет LHCB2.4 (б) в 4-дневных этиолированных проростках A. thaliana дикого типа и нокаут-мутантов cry1cry2 и hy5 через 6 ч после перенесения на свет. 1 – 0 мкМ транс-зеатина; 2 – 1 мкМ транс-зеатина. ⚫ – достоверные различия между средними значениями экспрессии у нокаут-мутантов в темноте без цитокинина и экспрессии у дикого типа в темноте без цитокинина при P ≤ 0.05, ⚫⚫ при P ≤ 0.01; ** – достоверные различия между средними значениями экспрессии у нокаут-мутантов в темноте с цитокинином и экспрессии у дикого типа в темноте с цитокинином при P ≤ 0.01. ◆ – достоверные различия между средними значениями экспрессии у нокаут-мутантов на свету и экспрессии у дикого типа на свету при P ≤ 0.01; ## – достоверные различия между средними значениями экспрессии у нокаут-мутантов на свету с цитокинином и экспрессии у дикого типа на свету с цитокинином при P ≤ 0.01.

Особенности регуляции цитокинином экспрессии генов биосинтеза хлорофилла в ходе деэтиоляции проростков с инактивированными генами сигналинга синего света
Перенесение этиолированных проростков дикого типа на свет, как и ожидалось, приводило к увеличению уровня транскриптов трех генов биосинтеза хлорофилла (HEMA1, GUN4, GUN5) и подавлению экспрессии гена PORA, кодирующего протохлорофиллидоксидоредуктазу (рис. 3а–г). Этиолированные проростки дикого типа, выращенные на среде с цитокинином, характеризовались значительно повышенным уровнем транскриптов трех исследованных генов биосинтеза хлорофилла в условиях темноты, кроме PORA (рис. 3а–г). При этом проростки дикого типа, выращенные в присутствии гормона через 6 ч освещения, содержали большее количество мРНК по сравнению с проростками, выращенными без гормона (рис. 3а–в). Гены HEMA1, GUN4 и GUN5 имели значительное сходство в регуляции светом и цитокинином, однако ген GUN5, кодирующий H-субъединицу магний-хелатазы, ключевого фермента биосинтеза хлорофилла, имел наибольшую активацию цитокинином как в темноте (~20 раз), так и на свету (~30 раз). Уровень транскриптов всех исследованных генов биосинтеза хлорофилла в этиолированных проростках мутантов cry1cry2 и hy5 без гормона был ниже по сравнению с диким типом (рис. 3а–г). Этиолированные проростки cry1cry2 накапливали меньшее количество матриц генов биосинтеза хлорофилла (HEMA1 и GUN4), но не GUN5 через 6 часов освещения белым светом по сравнению с диким типом (рис. 3а, б). В то же время экзогенный цитокинин компенсировал недостаток эффекта синего света и стимулировал рост уровня транскриптов генов HEMA1, GUN4, GUN5 у мутанта cry1cry2 (рис. 3а–в).
Рис. 3.
Влияние цитокинина и света на содержание транскриптов генов биосинтеза хлорофилла HEMA1 (а), GUN4 (б), GUN5 (в) и PORA (г) в 4-дневных этиолированных проростках A. thaliana дикого типа и нокаут-мутантов cry1cry2 и hy5. 1 – 0 мкМ транс-зеатина; 2 – 1 мкМ транс-зеатина. ⚫ – достоверные различия между средними значениями экспрессии у нокаут-мутантов в темноте без цитокинина и экспрессии у дикого типа в темноте без цитокинина при P ≤ 0.05, ⚫⚫ – при P ≤ 0.01; * – достоверные различия между средними значениями экспрессии у нокаут-мутантов в темноте с цитокинином и экспрессии у дикого типа в темноте с цитокинином при P ≤ 0.05, ** – при P ≤ 0.01. ◆ – достоверные различия между средними значениями экспрессии у нокаут-мутантов на свету и экспрессии у дикого типа на свету при P ≤ 0.05, ◆◆ – при P ≤ 0.01; # – достоверные различия между средними значениями экспрессии у нокаут-мутантов на свету с цитокинином и экспрессии у дикого типа на свету с цитокинином при P ≤ 0.05, ## – при P ≤ 0.01.

Отсутствие белка HY5, являющегося фактором транскрипции и позитивным регулятором фотоморфогенеза, приводило к сходному с cry1cry2 снижению уровня транскриптов всех исследованных генов, как в темноте, так и после 6 ч освещения (рис. 3а–в). В ходе деэтиоляции проростков мутанта hy5 экзогенный цитокинин стимулировал рост матриц генов биосинтеза хлорофилла как в темноте, так и на свету. Тем не менее, мутантные проростки Arabidopsis hy5, выращенные на среде с цитокинином, при деэтиоляции накапливали меньшее количество мРНК гена HEMA1, кодирующего фермент глутамил-тРНК-редуктазу, а также гена белка, координирующего активность фермента Mg-хелатазы (GUN4) и H‑субъединицу Mg-хелатазного комплекса (GUN5) по сравнению с диким типом. Любопытно, что в темноте экзогенный цитокинин приводил к повышенному накоплению транскриптов гена PORA у мутанта cry1cry2 и hy5 (рис. 3г). Свет значительно ингибировал уровень матриц гена PORA у всех исследованных генотипов, причем цитокинин практически не оказывал влияния на содержание транскриптов при действии света (рис. 3г).
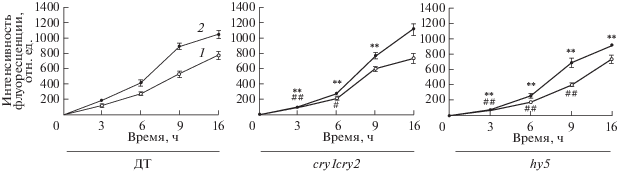
Динамика флуоресценции хлорофилла а у нокаут-мутантов по восприятию и передаче сигнала синего света при цитокинин-зависимой деэтиоляции
Поскольку деэтиоляция внешне проявляется как зеленение семядолей, следующим этапом работы был анализ флуоресценции хлорофилла а. Освещение этиолированных проростков дикого типа стимулировало накопление хлорофилла а в ходе деэтиоляции уже через 3 часа (рис. 4). Инактивация генов криптохромов негативно влияла на показатели флуоресценции хлорофилла а у мутанта cry1cry2 на начальных часах деэтиоляции (рис. 4), что согласуется со сниженной экспрессией генов биосинтеза хлорофилла при 6 ч освещении проростков (рис. 3а, б). Отсутствие транс-фактора HY5 замедляло рост флуоресценции хлорофилла а на ранних этапах деэтиоляции проростков, тогда как через 16 ч освещения этот показатель достигал значения дикого типа (рис. 4). Пониженный уровень флуоресценции хлорофилла а у мутанта hy5 согласуется с установленным снижением экспрессии генов HEMA1, GUN4, GUN5 (рис. 3а–в). Этиолированные проростки дикого типа и cry1cry2 мутанта, выращенные с транс-зеатином, характеризовались большим уровнем флуоресценции хлорофилла а. При этом нокаут-мутант hy5 имел пониженную способность накапливать хлорофилл а в ходе цитокинин-зависимой деэтиоляции, что указывает на возможное участие транс-фактора HY5 в регуляции цитокинином биосинтеза хлорофилла а (рис. 4).
Рис. 4.
Динамика флуоресценции хлорофилла а в 4-дневных этиолированных проростках A. thaliana дикого типа и нокаут-мутантов cry1cry2 и hy5 в ходе цитокинин-зависимой деэтиоляции. 1 – 0 мкМ транс-зеатина; 2 – 1 мкМ транс-зеатина. # – достоверные различия между средними значениями флуоресценции хлорофилла а у нокаут-мутантов без цитокинина и флуоресценции у дикого типа без цитокинина при P ≤ 0.05, ## – при P ≤ 0.01; ** – достоверные различия между средними значениями флуоресценции хлорофилла а у нокаут-мутантов с цитокинином и флуоресценции хлорофилла а у дикого типа с цитокинином при P ≤ 0.01.
Таким образом, с применением нокаут-мутантов по генам восприятия и трансдукции сигнала синего света было установлено, что компоненты сигналинга синего света вносят значительный вклад в регуляцию генов пути биосинтеза хлорофилла, а экзогенный цитокинин способен ускорять процесс зеленения семядолей как за счет транскрипционной активации экспрессии ряда генов биосинтеза хлорофилла, так и благодаря способности компенсировать отсутствие криптохромов, возможно, при участии позитивного регулятора фотоморфогенеза HY5.
ОБСУЖДЕНИЕ
Рост и развитие молодого проростка зависит от изменяющихся условий освещения, приспособление к которым происходит при активном участии гормональной системы. Потребность молодых проростков в хлорофилле на ранних этапах деэтиоляции требует интенсификации процесса его биосинтеза. Фотосинтетическая активность семядольных листьев развивающегося растения зависит от эффективного превращения этиопластов в хлоропласты и накопления в них хлорофилла и хлорофилл-связывающих белков. Свет и цитокинины стимулируют процесс деэтиоляции [1, 12]. Физиологический эффект этих двух факторов реализуется при участии в растительной клетке сложных путей сигналинга, включающих компоненты восприятия и передачи сигналов.
По литературным данным, синий свет регулирует около 6000 генов, которые кодируют фотосинтетические белки, белки, участвующие в биосинтезе клеточной стенки, в ответе на ауксин, гиббереллины, АБК, брассиностероиды и салициловую кислоту [13]. Ранее с помощью нокаут-мутантов по генам рецепторов синего света было показано, что синий свет вовлечен в контроль реорганизации хроматина, перепрограммирование транскрипции генов и изменение профиля протеома на начальных этапах деэтиоляции [14, 15]. В свою очередь, цитокинины ускоряют зеленение и активируют развитие ультраструктуры формирующихся хлоропластов [1, 16]. Стимулирующий эффект цитокинина на зеленение и уровень мРНК гена POR был ранее показан на семядолях люпина [12].
Несмотря на многочисленные сообщения о позитивной роли света и цитокининов в регуляции генов биосинтеза хлорофилла в процессе деэтиоляции, вклад отдельных участников пути передачи сигнала синего света и влияние ЦК на этот процесс детально не был исследован. Результаты, полученные при помощи нокаут-мутантов A. thaliana по генам рецепции (cry1cry2) и передачи (hy5) сигнала синего света, демонстрируют строгую необходимость криптохромов и фактора транскрипции HY5 для активации экспрессии генов начального, среднего и позднего этапов биосинтеза хлорофилла не только в темноте, но и при освещении. Способность мутантов накапливать некоторый уровень матриц генов биосинтеза хлорофилла и хлорофилла а при действии белого света, вероятно, обеспечивается за счет функционирования в клетке других фоторецепторов, например, фитохромов, которые также вносят существенный вклад в регуляцию деэтиоляции [17].
Экзогенный ЦК значительно ускоряет процесс деэтиоляции проростков дикого типа, активируя экспрессию генов начала (HEMA1) и середины пути (GUN4, GUN5) и подавляя экспрессию гена фермента завершающего этапа биосинтеза хлорофилла (PORA), проявляя яркий синергетический эффект со светом. Полученные нами данные приводят к выводу, что цитокинины ускоряют процесс зеленения даже при условии нарушения восприятия синего света, тогда как нарушение передачи сигнала света у мутанта hy5 приводит к снижению способности экзогенного цитокинина активировать экспрессию генов биосинтеза хлорофилла в отсутствие белка HY5.
Выявленная в работе активация экспрессии гена ответа на ЦК – ARR5 у мутанта cry1cry2 по сравнению с диким типом (рис. 2а) может свидетельствовать о том, что сигналинг цитокининов – одна из мишеней действия синего света. Данные о способности криптохромов задерживать деградацию цитокининов при старении листьев пшеницы подтверждают участие синего света в поддержании цитокининового гомеостаза [18].
Причиной замедленного ЦК-зависимого зеленения семядолей мутанта hy5 на свету по сравнению с диким типом может быть участие белка HY5 в реализации ЦК сигнала в ходе деэтиоляции. В пользу этого предположения свидетельствуют данные, согласно которым HY5 является точкой пересечения сигналов синего света и цитокининов [19]. ЦК способны модулировать световой сигналинг, возможно, благодаря своей способности стабилизировать ключевой транс-фактор фотоморфогенеза растений – HY5, белок семейства bZIP, путем подавления активности убиквитинлигазы COP1 [19]. Транс-фактор HY5 ускоряет фотоморфогенез, поскольку интегрирует и другие сигнальные пути фитогормонов (например, абсцизовой кислоты с участием транс-фактора ABI5). HY5 ингибирует удлинение гипокотиля на свету и ускоряет автотрофный рост растения, индуцируя экспрессию генов ферментов, связанных с поглощением азота, серы, цинка и магния [20].
В свою очередь, слабая активация цитокинином процесса зеленения мутанта hy5 наводит на мысль о существовании и других интеграторов путей передачи сигналов света и ЦК. Претендовать на их роль могут недавно выявленные транскрипционные факторы GNL и GNC из семейства GATA, позитивные регуляторы развития пластид и биосинтеза хлорофилла, экспрессия которых положительно регулируется цитокининами [5, 21]. Тем не менее, сигнальный каскад с участием HY5, который предшествует развитию физиологического ответа, детально не охарактеризован.
Цитокинины играют очень важную роль в процессе зеленения растений. Это подтверждают данные о замедленном, по сравнению с растениями дикого типа, зеленении и накоплении матриц ядерных генов аппарата транскрипции пластома у нокаут-мутанта ahk2ahk3 по рецепторам цитокинина A. thaliana [1, 11]. Регуляторы ответа типа B, транс-факторы ЦК сигналинга, также вовлечены в контроль биосинтеза хлорофилла [1].
Промежуточные метаболиты пути биосинтеза хлорофилла также вовлечены в регуляцию экспрессии как ядерного, так и пластидного геномов. Показано, что Mg-протопорфирин IX и Н‑субъединица Mg-хелатазы вовлечены в ретроградную регуляцию экспрессии ядерных фотосинтетических генов [22]. Известно, что тРНКглу является ключевым регулятором, координирующим синтез не только хлоропластных белков и тетрапирролов, но и экспрессии генов пластома. Связываясь с пластидной РНК-полимеразой ядерного кодирования, она подавляет ее активность, тем самым способствуя увеличению активности второй пластидной РНК-полимеразы, ответственной за транскрипцию генов фотосинтеза [23].
Полученные данные показывают роль криптохромов и цитокининов в регуляции экспрессии генов, кодирующих белки, вовлеченные в биосинтез хлорофилла в ходе деэтиоляции проростков A. thaliana. Результаты позволяют заключить, что свет и цитокинины могут участвовать в контроле зеленения как на транскрипционном, так и посттранскрипционном уровнях. Тем не менее, выявленные закономерности регуляции зеленения не исключают возможности независимого влияния этих двух факторов на процесс накопления хлорофилла. Проведенные исследования демонстрируют существование механизмов дифференциальной регуляции светом разного качества генов биосинтеза хлорофилла на раннем этапе фотоморфогенеза и интеграции светового и цитокининового сигналов на уровне факторов транскрипции.
Авторы выражают благодарность профессору C. Lin из Университета Беркли за любезно предоставленные семена нокаут-мутантов Arabidopsis thaliana.
Работа выполнена при финансовой поддержке гранта Президента МК-1908.2017.4.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Cortleven A., Marg I., Yamburenko M.V., Schlicke H., Hill K., Grimm B., Schaller G.E., Schmülling T. Cytokinin regulates etioplast-chloroplast transition through activation of chloroplast – related genes // Plant Physiol. 2016. V. 172. P. 464.
Liu B., Yang Z., Gomez A., Liu B., Lin C., Oka Y. Signaling mechanisms of plant cryptochromes in Arabidopsis thaliana // J. Plant Res. 2016. V. 129. P. 137.
Hoecker U. The activities of the E3 ubiquitin ligase COP1/SPA, a key repressor in light signaling // Curr. Opin. Plant Biol. 2017. V. 37. P. 63.
Holtkotte X., Ponnu J., Ahmad M., Hoecker U. The blue light-induced interaction of cryptochrome 1 with COP1 requires SPA proteins during Arabidopsis light signaling // PLoS Genet. 2017. V. 13. P. 1007.
Cortleven A., Nitschke S., Klaumünzer M., AbdElgawad H., Asard H., Grimm B., Riefler M., Schmülling T. A novel protective function for cytokinin in the light stress response is mediated by the ARABIDOPSIS HISTIDINE KINASE 2 and ARABIDOPSIS HISTIDINE KINASE 3 receptors // Plant Physiol. 2014. V. 164. P. 1470.
Chory J., Reinecke D., Sim S., Washburn T., Brenner M. A role for cytokinins in de-etiolation in Arabidopsis // Plant Physiol. 1994. V. 104. P. 339.
Kobayashi K., Masuda T. Transcriptional regulation of tetrapyrrole biosynthesis in Arabidopsis thaliana // Front. Plant Sci. 2016. V. 7. 1811.
Larkin R.M., Alonso J.M., Ecker J.R., Chory J. GUN4, a regulator of chlorophyll synthesis and intracellular signaling // Science. 2003. V. 299. P. 902.
Wang Y., Folta K.M. Contributions of green light to plant growth and development // Am. J. Bot. 2013. V. 100. P. 70.
Головацкая И.Ф., Карначук Р.А. Роль зеленого света в жизнедеятельности растений // Физиология растений. 2015. Т. 62. С. 776.
Данилова М.Н., Дорошенко А.С., Кудрякова Н.В., Андреева А.А., Кузнецов В.В. Аппарат транскрипции пластома и особенности экспрессии его генов в процессе цитокинин-зависимой деэтиоляции Arabidopsis thaliana // Физиология растений. 2018. Т. 65. С. 438.
Kusnetsov V.V., Herrmann R.G., Kulaeva O.N., Oelmüller R. Cytokinin stimulates and abscisic acid inhibits greening of etiolated Lupinus luteus cotyledons by affecting the expression of the light-sensitive protochlorophyllide oxidoreductase // Mol. Gen. Genet. 1998. V. 259. P. 21.
Wang W., Lian H., Zhang L., Mao Z., Li X., Xu F., Li L., Yang H. Transcriptome analyses reveal the involvement of both C and N termini of Cryptochrome 1 in its regulation of phytohormone-responsive gene expression in Arabidopsis // Front. Plant Sci. 2016. V.7. 294.
Perrella G., Kaiserli E. Light behind the curtain: photoregulation of nuclear architecture and chromatin dynamics in plants // New Phytol. 2016. V. 212. P. 908.
Bourbousse C., Mestiri I., Zabulon G., Bourge M., Formiggini F., Koini MA., Brown SC., Fransz P., Bowler C., Barneche F. Light signaling controls nuclear architecture reorganization during seedling establishment // Proc. Natl. Acad. Sci. USA. 2015. V. 112. P. 2836.
Kravtsov A.K., Zubo Ya.O., Yamburenko M.V., Kulaeva O.N., Kusnetsov V.V. Cytokinin and abscisic acid control plastid gene transcription during barley seedling de-etiolation // Plant Growth Regul. 2011. V. 64. P. 173.
Kreslavski V.D., Los D.A., Schmitt F.J., Zharmukhamedov S.K., Kuznetsov V.V., Allakhverdiev S.I. The impact of the phytochromes on photosynthetic processes // Biochim. Biophys. Acta Bioenerg. 2018. V. 1859. P. 400.
Marchetti C.F., Škrabišová M., Galuszka P., Novákb O., Causin H.F. Blue light suppression alters cytokinin homeostasis in wheat leaves senescing under shading stress // Plant Physiology and Biochemistry. V. 130. 2018. P. 647.
Vandenbussche F., Habricot Y., Condiff A.S., Maldiney R., Van Der Straeten D., Ahmad M. HY5 is a point of convergence between cryptochrome and cytokinin signaling pathways in Arabidopsis thaliana // Plant J. 2007. V. 49. P. 428.
Gangappa S.N., Botto J.F. The multifaceted roles of HY5 in plant growth and development // Molecular Plant. 2016. V. 9. P. 1353.
Bastakis E., Hedtke B., Klermund C., Grimm B., Schwechheimer C. LLM-domain B-GATA transcription factors play multifaceted roles in controlling greening in Arabidopsis // Plant Cell. 2018. V. 30. P. 582.
Юрина Н.П., Осипенкова О.В., Одинцова М.С. Тетрапирролы высших растений: биосинтез, его регуляция и их роль в передаче ретроградных сигналов // Физиология растений. 2012. Т. 59. С. 3.
Hanaoka M., Kanamaru K., Fujiwara M., Takahashi H., Tanaka K. Glutamyl-tRNA mediates a switch in RNA polymerase use during chloroplast biogenesis // EMBO. 2005. V. 6. P. 545.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


