Физиология растений, 2019, T. 66, № 6, стр. 412-421
Характеристика растений Arabidopsis thaliana, экспрессирующих бактериальную фитазу
Л. Р. Валеева a, *, Ч. Нямсурэн a, Е. В. Шакиров a, М. Р. Шарипова a
a Федеральное государственное автономное образовательное учреждение высшего образования
“Казанский (Приволжский) федеральный университет”
Казань, Россия
* E-mail: lia2107@yandex.ru
Поступила в редакцию 04.10.2018
После доработки 31.01.2019
Принята к публикации 06.02.2019
Аннотация
Получение трансгенных растений с интегрированными генами фитаз бактериального происхождения является одним из перспективных решений проблемы дефицита фосфора в питании растений, а также животных с однокамерным желудком. Гистидиновая кислая фитаза PaPhyC бактерии Pantoea agglomerans обладает высокой активностью и представляет собой перспективную основу для биотехнологии растений. Мы провели анализ морфологических характеристик, фитазной активности и содержания фосфора в тканях полученных нами ранее модифицированных растений Arabidopsis thaliana, синтезирующих внеклеточную фитазу PaPhyC. Показано, что модифицированные растения способны расти на среде с фитатом в качестве единственного источника фосфора. Внешние характеристики (диаметр и площадь листьев розетки) модифицированных растений, экспрессирующих фитазу, не различались при росте на средах с фитатом и неорганическим фосфатом, что свидетельствовало об использовании фитата растениями в качестве источника фосфора. При росте на среде с фитатом высокая фитазная активность присутствовала в клеточной стенке модифицированных растений. Содержание неорганического фосфата в тканях модифицированных растений не изменялось в случае их роста на среде с фитатом в качестве единственного источника фосфора.
ВВЕДЕНИЕ
Фосфорный дефицит в питании растений и животных, возникший в результате нерационального использования ресурсов Земли, стал глобальной проблемой, требующей разработки новых подходов к ее решению. Одной из причин, усугубляющих проблему недостатка фосфора, является широкое распространение труднодоступных форм фосфата в природе, в частности, фитата (мио-инозитол гексакисфосфата). Фитат составляет до 60% органического фосфата в различных типах почв, однако он не может быть использован в качестве источника неорганического фосфата в силу высокой стабильности в среде, а также неспособности растений и большинства животных к расщеплению его молекул [1, 2]. Фитат является запасной формой фосфата в семенах растений, но мобилизация фосфата из фитата семян возможна только в период их прорастания, в то время как в тканях вегетативных органов растений экспрессия активных фитаз прекращается [3, 4]. Кроме того, фитат способен связывать ионы металлов (Ca2, Mg2, Zn2, Fe2), олигопептиды и сахара, делая их недоступными для усвоения [5, 6].
Широкая распространенность фитата в окружающей среде представляет интерес в качестве альтернативного источника фосфора. Это связано с уникальным действием специфических фосфогидролаз – фитаз (мио-инозитолгексакисфосфат фосфогидролаз), поэтапно дефосфорилирующих молекулу фитата с высвобождением фосфата. Фитазы синтезируются многими почвенными микроорганизмами. Использование фитаз бактерий и микромицетов является эффективным способом утилизации фитата и повышения доступности фосфата почв и кормов на основе семян растений [7]. Перспективным направлением в биотехнологии является получение растений, продуцирующих микробные фитазы и способных усваивать фитат-связанный фосфор почв [8]. Синтез рекомбинантных фитаз растениями имеет ряд преимуществ: например, это возможность использования модифицированных растений и их семян в качестве сырья для производства кормов с низким содержанием фитата. К настоящему времени получены различные растения, синтезирующие бактериальные и грибные фитазы: табак (Nicotiana tabacum) (листья и семена), люцерна (Medicago sativa) (листья), резуховидка Таля (Arabidopsis thaliana) (корни), рис (Oryza sativa) (семена) и пшеница (Triticum vulgare) (семена) [9]. Также производится модифицированная кукуруза, в зернах которой синтезируется рекомбинантная грибная фитаза с высокой активностью, причем активность стабильно сохраняется на высоком уровне в нескольких поколениях растений [9]. На основе водорослей Chlamidomonas reinhardtii разработана экспрессионная система, продуцирующая бактериальную фитазу Escherichia coli AppA в хлоропластах, что позволяет использовать модифицированные водоросли в качестве кормовой добавки, опуская этап очистки целевого белка [9, 10]. Другим направлением является обеспечение растений необходимым фосфором из труднодоступного фитата почв [9]. Описаны системы экспрессии фитаз в корнях растений, что позволяет повысить эффективность биоутилизации внеклеточного фитата [11, 12]. Преимуществом бактериальных фитаз для получения модифицированных растений является их высокая специфическая активность и термостабильность по сравнению с грибными фитазами. В связи с различиями в условиях роста растений и специфичностью свойств рекомбинантных ферментов нет возможности получить универсальную систему экспрессии, которая могла бы подходить для всех растений во всех условиях произрастания. Использование разных микробных фитаз и создание новых систем гетерологичной экспрессии позволяет расширить возможности этого направления биотехнологии растений.
Ранее нами были получены растения A. thaliana с интегрированной в геном конструкцией, состоящей из модифицированного кодон-оптимизированного гена бактериальной фитазы paPhyC Pantoea agglomerans под контролем конститутивного промотора вируса мозаики цветной капусты CaMV35S и установлена экспрессия рекомбинантной фитазы в тканях растений на уровне транскрипции гена и трансляция белка [13]. Цель настоящей работы – оценить способность роста модифицированных растений в условиях дефицита неорганического фосфора в среде с добавлением фитата в качестве единственного источника фосфата.
МАТЕРИАЛЫ И МЕТОДЫ
Плазмиды и конструкции экспрессионных систем. Ранее нами были получены модифицированные растения A. thaliana с интегрированной генетической конструкцией, включающей кодон-оптимизированный ген бактериальной фитазы paPhyC, находящейся под контролем конститутивного вирусного промотора CaMV35S совместно с растительным сигнальным пептидом (AtEx) (модифицированные растения линий E168, E27142, E382) (табл. 1) [13]. В качестве векторов для модификации растений использовали плазмиды pCBK05 и pCEV04, полученные на основе вектора pCBK05 [13]. pCBK05 – бинарный вектор для экспрессии в клетках агробактерий и E. coli, содержащий в области Т-ДНК промотор вируса мозаики цветной капусты CaMV35S (343 п.о.) и ген bar устойчивости к селективному гербициду BASTA (глюфосинат аммония), регулируемые промотором гена нопалинсинтазы A. tumefaciens (Pnos) (рис. 1а). Вектор pCBK05 использовали в качестве контрольной конструкции для трансформации растений A. thaliana (модифицированные растения линии О115) (табл. 1). Вектор pСEV04 получен на основе вектора pCBK05 и содержал модифицированный ген фитазы AtEx::paPhyC::His-Strep-Tag (1326 п.о.) под управлением CaMV35S промотора (рис. 1б). Последовательность бактериального гена фитазы paPhyC (ABD85282.1), полученную из базы данных GenBank (https://ncbi.nih.gov/genbank), оптимизировали в программе Codon Adaptation Tool (http:// www.JCat.com) для эффективной экспрессии в клетках растений A. thaliana. Ген модифицировали с 5'- и 3'-концов присоединением последовательностей сигнального пептида экстенсина арабидопсиса (AtEx) и His-Strep-Tag, соответственно. Модифицированную последовательность гена фитазы AtEx::paPhyC::His-Strep-Tag синтезировали химически (“GenScript”, США, http://www.genscript.com). Модифицированный ген интегрировали в бинарный вектор pCBK05 с использованием сайтов рестрикции BamHI и SpeI под контроль конститутивного промотора вируса мозаики цветной капусты CaMV35S [13].
Таблица 1.
Линии растений Arabidopsis thaliana, использованные в работе
| Линия растений A. thaliana |
Описание | Назначение |
|---|---|---|
| WT | Экотип Columbia, дикий тип | Контроль |
| O115 | Модифицированные растения гомозиготные по вставке, не содержащей гена фитазы | Отрицательный контроль на влияние модификации на растения |
| Е168, Е27142, Е382 | Модифицированные растения гомозиготные по вставке AtEx::paPhyC::His-Strep-Tag под контролем промотора CaMV35S | Экспрессия бактериальной фитазы PaPhyC |
Рис. 1.
Карта Т-ДНК области бинарных векторов для трансформации растений: (а) – pCBK05 (6100 п.о.) – вектор, содержащий вирусный промотор CaMV35S, без интегрированного гена фитазы; (б) – pCEV04 (7426 п.о.) – вектор с интегрированным модифицированным геном фитазы AtEx::paPhyC::His-Strep-Tag. PCaMV35S – конститутивный промотор вируса мозаики цветной капусты; bar – ген устойчивости к гербициду BASTA; Pnos, Tnos – промоторная и терминаторная последовательности гена нопалинсинтазы; П, Л – правая и левая фланкирующие последовательности Т-ДН-К; paPhyC – модифицированный ген фитазы P. agglomerans. Линиями обозначены сайты рестрикции EcoRI, BamHI, SmaI, SpeI, SacI, KpnI, HindIII, XbaI, PstI, ClaI. Сайты рестрикции для клонирования гена фитазы выделены прямоугольной рамкой (BamHI, SpeI).

Полученный бинарный вектор, содержащий конструкцию AtEx::paPhyC::His-Strep-Tag трансформировали в клетки агробактерий A. tumefaciens GV3101 методом электропорации. Рекомбинантные штаммы агробактерий использовали для получения трансгенных линий растений.
Растения Arabidopsis thaliana. В работе использовали растения A. thaliana дикого типа (экотип Columbia, далее WT) и полученные нами ранее модифицированные растения контрольной линии с интегрированной вставкой без гена фитазы (линия О115) и экспрессирующие бактериальную фитазу PaPhyC (линии E168, E27142, E382) (табл. 1).
Модификацию растений A. thaliana (экотип Col-0) проводили методом агробактериальной трансформации in planta (floral-dip метод) [14]. Далее трансформированные растения (Т0 поколение) выращивали на почве и получали от них семена (Т1 поколение). Селекцию растений Т1 поколения проводили путем их выращивания на стерильных чашках Петри на среде с добавлением гербицида BASTA (глюфосинат-аммония). Отобранные растения генотипировали и выращивали каждое индивидуально для получения семян (Т2 поколения). Повторяли селекцию и генотипирование растений Т2, Т3, Т4, Т5 поколений для выявления гомозиготных по гетерологичной вставке растений (100% выживаемость проростков на среде с гербицидом). В результате нами были получены три независимые линии растений Е1, Е2 и Е3, в каждой из которых были отобраны гомозиготные по трансгенной вставке линии (3, 2 и 3, соответственно). Также были получены три независимые линии растений с “нулевым” вектором (О1, О5 и О11) и гомозиготные растения данных линий. В работе мы использовали растения линий Е168, Е27412 и Е382, поскольку в них была подтверждена экспрессия гена на уровне транскрипции и синтез рекомбинантной фитазы. Стоит отметить, что линии Е168 и Е382 несли одну вставку конструкции AtEx::paPhyC::His-Strep-Tag в геноме, тогда как линия Е27142 имела множественную вставку в геноме. Также были использованы растения линии О115 в качестве отрицательного контроля.
Растения выращивали в климатической камере (MLR-352 H, “Sanyo”, Япония). Перед посадкой семена предварительно подвергали вернализации, выдерживая 2–3 суток при 4°С для синхронизации всхожести. Стандартные условия роста A. thaliana: фотопериод 16/8 ч день/ночь, 800 люкс, 20°С, влажность воздуха 65%.
Выращивание растений в гидропонной системе. Эксперименты по росту растений на различных источниках фосфора проводили в гидропонных установках. Гидропонная установка состояла из светонепроницаемого контейнера объемом 600 мл с 12 индивидуальными лунками для растений с установленными в них пластиковыми пробирками объемом 200 мкл (типа “Эппендорф”), заполненными 0.7% агаром, со срезанным дном для выхода корней в жидкую среду. Контейнеры и пробирки предварительно стерилизовали автоклавированием. Растения выращивали на минеральной среде с рН 5.5 [15]. В качестве источника фосфора добавляли 0.8 мМ Na2HPO4 или 0.133 мМ фитат натрия (myo-inositol hexaphosphoric acid dodecasodium salt, “Sigma-Aldrich”, США). Среду стерилизовали автоклавированием и остужали до комнатной температуры. Фитат натрия стерилизовали фильтрованием и вносили в минеральную среду. Растения предварительно выращивали на среде Мурасиге-Скуга (МС) (“Sigma-Aldrich, США) в чашках Петри в течение 10 суток. Для проращивания растений семена высевали стерильно на чашки Петри с использованием среды МС: 50% МС, 2% сахароза, 0.7% агар, в случае модифицированных линий – с добавлением гербицида BASTA в концентрации 25 мкг/мл. Перед посевом семена стерилизовали по следующей методике: промывание 70% этанолом при перемешивании – 1 мин, промывание 50% раствором коммерческого отбеливателя “Белизна” (ООО “Бытовая химия”, Россия) с добавлением 0.5% Тритон-Х100 при перемешивании – 7 мин, промывание стерильной дистиллированной водой 5 раз до полного удаления раствора для стерилизации. Стерильные семена растений высевали на среду МС на чашки Петри и выращивали 7–10 дней. Далее в каждую ячейку контейнера пересаживали по одному растению и покрывали контейнер целлофановой пленкой, которую снимали через 4–5 суток. Растения выращивали в течение 35 суток в климатической камере при стандартных условиях и далее проводили анализ внешнего вида, измерение фитазной активности и содержания фосфора в тканях. Для анализа фитазной активности растения отбирали и замораживали в жидком азоте. Образцы тканей хранили при температуре –80°С.
Характеристика внешнего вида растений. Способность растений расти на средах с разными источниками фосфора анализировали путем измерения их морфологических параметров: диаметра и общей площади листьев розетки. Собранные растения фотографировали с помощью гель-документирующей системы “Vilber Lourmat E-box VX2” (Франция) со встроенной цифровой камерой “Sony” 1.4 Мп (Япония). Полученные фотографии растений обрабатывали в программе ImageJ. За масштабную шкалу при расчете диаметра и общей площади розетки брали 1 мм. Диаметр розетки листьев измеряли от внешних концов наибольших противоположно (супротивно) расположенных листьев и рассчитывали как среднее значение. Общую площадь листьев определяли как сумму площадей всех листьев в розетке растения. Размерная шкала для каждого изображения устанавливалась автоматически в программе. Измерение проводили для 4–6 индивидуальных растений для каждой линии растений в 3–5 биологических повторностях.
Измерение сухой массы растений. Для измерения сухой массы каждое индивидуальное растение собирали и разделяли на побеги и корни. Далее образцы высушивали в фольге при 70°С в течение 48 ч в сухожаровом шкафу. Высушенные образцы взвешивали на аналитических весах с точностью до 0.0001 знака.
Определение содержания фосфора в тканях растений. Содержание фосфора в тканях растений определяли в озоленных образцах колориметрическим методом по протоколу ГОСТ 26657-97 с изменениями. Побеги и корни раздельно высушивали до постоянной массы в сухожаровом шкафу при 70°С в течение 48 ч. Высушенные образцы побегов и корней растений сжигали в муфельной печи (модель ЭКПС-10, ОАО “Смоленское СКТБ СПУ”, Россия) при 400°С в течение 4 ч. Полученную золу помещали в пробирку и растворяли в 0.9М H2SO4 в соотношении 1 мл кислоты на 10 мг озоленного образца и инкубировали в течение 24 ч при комнатной температуре для осаждения нерастворившихся частиц. Далее отбирали надосадочную жидкость и определяли содержание фосфора в полученном растворе методом образования молибденовой сини. В лунку 96-луночного планшета помещали 90 мкл реакционной смеси и добавляли 210 мкл раствора, содержащего молибдат аммония (NH4)2MoO4 и аскорбиновую кислоту (в соотношении 1 часть 10% аскорбиновой кислоты к 6 частям 0.42% молибдата аммония, растворенного в 0.5 М серной кислоте). Пробы инкубировали в течение 1 ч при 37°С. Далее измеряли оптическую плотность реакционной смеси при длине волны 820 нм (ОD820). Концентрацию неорганического фосфата в пробах определяли по калибровочной кривой.
Выделение белкового экстракта из тканей растений. Для получения белкового экстракта ткань растений, ранее замороженную в жидком азоте и хранящуюся при –80°С, растирали в жидком азоте в ступке до порошкообразного состояния. Полученный материал переносили в буфер для выделения растворимой фракции белка (рН 5.5) (15 мМ MES, 0.5 мМ CaCl2, 1 мМ цистеин, 1 мМ PMSF). Раствор центрифугировали при 12 тыс. об/мин в течение 10 мин при 4ºС. Супернатант отбирали и переносили в чистые пробирки. К полученному осадку добавляли буфер для выделения фракции белка клеточной стенки клеток растений (рН 8.5) (15 мМ МЕS, 1 мМ ЭДТА, 100 мМ NaCl, 1% ТритонХ-100, 5 мМ цистеин) [16]. Осадок ресуспендировали и центрифугировали при 15 тыс. об/мин в течение 15 мин при 4°С. Надосадочную жидкость отбирали и переносили в чистые пробирки. Концентрацию белка в пробах измеряли с помощью набора реактивов DC Protein Assay (“Bio-Rad”, США). Измерение проводили на спектрофотометре при длине волны 750 нм. Для хранения пробы замораживали в жидком азоте и хранили при –80°С.
Определение фитазной активности. Активность фитазы определяли по расщеплению фитата под действием белковых экстрактов корней растений. Фитазную активность рассчитывали по количеству высвобожденного неорганического фосфата при расщеплении молекул фитата под действием фитазы. Реакционная смесь состояла из 200 мкл 15 мМ MES буфера, рН 5.5, 1.25 мМ фитата натрия и 50 мкл белкового экстракта тканей растений. Реакционную смесь инкубировали в течение 1 ч при 37°С. Останавливали реакцию добавлением 50 мкл 50% ТХУ. Образцы центрифугировали при 13 тыс. об/мин в течение 3 мин для осаждения образовавшейся взвеси. Измерение высвободившегося неорганического фосфата проводили с помощью колориметрической реакции с образованием молибденовой сини. За единицу активности принимали количество фермента, гидролизующего в условиях эксперимента 1 мM субстрата за 1 мин.
Статистическая и компьютерная обработка данных. Статистический анализ данных проводили с использованием программного обеспечения Microsoft Exel 2008 и программного приложения GraphPad Software (www.graphpad.com). Статистическую значимость рассчитывали с использованием коэффициента Стьюдента и 95% стандартных отклонений.
РЕЗУЛЬТАТЫ
Влияние рекомбинантной фитазы на жизнеспособность семян
Нами показано, что у семян растений с интегрированным геном бактериальной фитазы не снижалась способность к прорастанию. Семена растений дикого типа и растений, экспрессирующих рекомбинантную фитазу, а также семена контрольной модифицированной линии имели одинаково высокий уровень прорастания: 97.6% (WT), 94.6% (линия О115), 98.4% (линия E168), 98.9% (линия Е27142) и 97.3% (линия Е382) проросших и не имеющих дефектов в развитии растений из общего количества посеянных семян. Проростки растений модифицированных линий и растений дикого типа не имели визуальных различий.
Влияние рекомбинантной фитазы на рост и внешние характерисктики модифицированных растений
Характеристику растений A. thaliana, экспрессирующих модифицированный ген бактериальной фитазы paPhyC, проводили по внешним параметрам побегов (надземной части растений). На 30–35 сутки роста на среде с фитатом в качестве единственного источника фосфора растения, синтезирующие бактериальную фитазу, визуально имели большие размеры, чем растения дикого типа и контрольной группы модифицированных растений. Изменения размеров, формы и окраски листьев у модифицированных растений не наблюдали (рис. 2).
Рис. 2.
Рост модифицированных растений и растений дикого типа на среде с фитатом в качестве единственного источника фосфора. WT – дикий тип A. thaliana; O115 – контрольная линия модифицированных растений; Е2741, Е382 – линии модифицированных растений, продуцирующих бактериальную фитазу PaPhyC. Pi – неорганический фосфат; IHP – фитат.

При анализе внешних параметров побегов растений нами показано, что растения, продуцирующие бактериальную фитазу PaPhyC, в отличие от растений дикого типа и контрольной модифицированной линии, способны расти на среде с фитатом. Значительного изменения сухой массы побегов, диаметра и площади листьев розетки по сравнению со значениями исследуемых параметров растений при их росте на среде с неорганическим фосфатом не установлено (рис. 3а–в). Рост побегов растений дикого типа и контрольной линии О115, в свою очередь, угнетался на среде с фитатом: их сухая масса снижалась, соответственно, в 2.24 и 2.05 раз по сравнению с сухой массой растений, росших на среде с неорганическим фосфатом (рис. 3а). На среде с фитатом сухая масса модифицированных растений превышала показатели растений дикого типа в 3.27, 4.10 и 4.81 раз для линий Е168, Е27142 и Е382, соответственно (рис. 3а). Диаметр листьев розетки модифицированных растений был больше, чем у контрольных растений дикого типа и растений модифицированной линии в среднем в 1.7, 1.9 и 2.39 раз при росте на среде с фитатом (соответственно, для линий Е168, Е27142 и Е382) (рис. 3б). Общая площадь листьев розетки модифицированных растений была больше, чем у растений контрольных линий и превышала значения линии дикого типа в среднем в 3.02, 3.81 и 3.51 раз (рис. 3в).
Рис. 3.
Характеристика побегов растений, экспрессирующих бактериальную фитазу: (а) – сухая масса побегов; (б) – диаметр листьев розетки; (в) – общая площадь листьев розетки. Na2HPO4 – неорганический фосфат. WT – дикий тип растений, О – контрольная линия, E – линии модифицированных растений. *P < 0.05, **P < 0.01 (статистическая значимость).

Содержание фосфора в тканях растений при росте на среде с фитатом
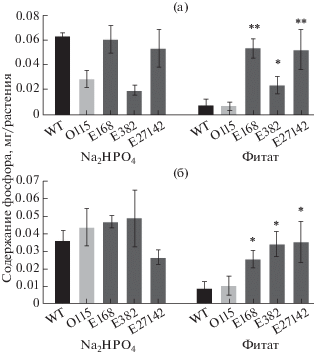
Способность растений, продуцирующих бактериальную фитазу, усваивать фитат-связанный фосфор оценивали по содержанию общего фосфора в тканях растений. Показано, что модифицированные растения содержат столько же фосфора в тканях, как и при росте на среде с неорганическим фосфатом, тогда как в тканях растений дикого типа содержание фосфора понижалось при росте на среде с фитатом (рис. 4а, б). Таким образом, экспрессия бактериальной фитазы позволила растениям поддерживать необходимое количество фосфора в тканях и не оказывала негативного влияния, например, посредством повышенного усвоения фосфора.
Рис. 4.
Содержание общего фосфора в тканях растений, экспрессирующих бактериальную фитазу при росте на средах с фитатом натрия или неорганическим фосфатом в качестве единственного источника фосфора: (а) – в побегах; (б) – в корнях растений. Na2HPO4 – неорганический фосфат. WT – дикий тип растений, О – контрольная линия, E – линии модифицированных растений. *P < 0.05, **P < 0.01 (статистическая значимость).
Активность бактериальной фитазы, продуцируемой растениями
Фитазная активность присутствовала в корнях модифицированных растений в отличие от растений контрольных групп (статистическая значимость различия P < 0.05) как при росте на среде с фитатом, так и на среде с неорганическим фосфатом (рис. 5). Установлено, что фитазная активность присутствует как во фракции белка, связанного с клеточной стенкой клеток корней растений, так и в растворимой белковой фракции корней модифицированных растений (рис. 5а, б). В белковой фракции клеточной стенки клеток растений фитазная активность для трех линий A. thaliana определялась на одинаковом уровне, независимо от источника фосфата в питательной среде, что подтверждало конститутивную экспрессию фитазы (рис. 5б). В растворимой белковой фракции фитазная активность растений была выше при росте на среде с неорганическим фосфатом, чем с фитатом.
Рис. 5.
Фитазная активность растений дикого типа и растений, модифицированных геном бактериальной фитазы paPhyC: (а) – растворимая белковая фракция клеток корней; (б) – белковая фракция, ассоциированная с клеточной стенкой клеток корней растений. Na2HPO4 – неорганический фосфат. WT – дикий тип растений, О – контрольная линия, E – линии модифицированных растений. *P < 0.05, **P < 0.01, ***P < < 0.001 (статистическая значимость).

ОБСУЖДЕНИЕ
Разработка гетерологичных систем экспрессии фитаз микроорганизмов является широко используемым в мире направлением в решении проблемы фосфорного недостатка. Получение растений, способных расти в условиях дефицита фосфора и использовать внеклеточный фитат в качестве единственного источника фосфора в лабораторных условиях показывает, что этот подход может быть эффективно использован для решения проблемы дефицита фосфора в питании растений. Также растения, экспрессирующие микробные фитазы, создают с целью получения сырья с низким содержанием фитата для приготовления кормов сельскохозяйственным животным и птицам [17].
Для создания модифицированных растений, способных усваивать фитат-связанный фосфат, нами была использована последовательность гена paPhyC гистидиновой кислой фитазы Pantoea agglomerans, обладающей высокой активностью и специфичностью в отношении фитата [18]. Бактерии рода Pantoea sp. с фитазной активностью обнаружены и выделены в том числе из почв Татарстана [19]. Эти бактерии относятся к семейству энтеробактерий Enterobacteriacea – так же, как и E. coli, фитаза которых хорошо исследована и используется для разработки систем экспрессии и их модификаций [20, 21]. Тем самым, ген фитазы PaPhyC был выбран нами в качестве основы для создания рекомбинантой системы экспрессии в растениях. Также важным этапом в создании экспрессионного вектора для растений является оптимизация кодонов в последовательности бактериального гена [22]. Метод оптимизации кодонов для гетерологичной экспрессии позволяет избежать абортивных считываний и отсутствия трансляции вследствие неспецифического и несовпадающего набора тРНК в клетках организма-реципиента [23]. Мы оптимизировали последовательности кодонов в гене фитазы paPhyC P. agglomerans для эффективной экспрессии рекомбинантной фитазы в растениях A. thaliana. Дальнейший анализ экспрессии показал, что в результате оптимизации происходила полноценная трансляция рекомбинантного белка, идентичного нативному. Кроме того, включение последовательности растительного сигнального пептида в состав генетической конструкции позволило достичь внеклеточной продукции рекомбинантной фитазы.
Для установления способности модифицированных растений использовать фитат как источник фосфора проводили измерение внешних параметров побегов и корней полученных растений при росте на среде с фитатом, их фитазную активность и содержание фосфора в тканях, а также исследовали жизнеспособность семян и проростков растений.
Интегрирование чужеродных генов в геном растений методом агробактериальной трансформации носит случайный и ненаправленный характер, что может привести к вставкам в функционально значимые участки ДНК и тем самым повлиять на жизнедеятельность растения в целом. Таким образом, помимо анализа экспрессии чужеродного гена и синтеза белка в трансформантах, необходимо изучить основные параметры их развития, такие как всхожесть семян и жизнеспособность проростков. Мы показали, что семена трансгенных растений контрольной линии и линий, продуцирующих фитазу PaPhyC, не теряют всхожести по сравнению с семенами дикого типа. Отметим, что генетическая конструкция содержала сигнальный пептид, позволявший секретировать рекомбинантную фитазу во внеклеточную среду, что обусловливало отсутствие чужеродного фермента в клетках и возможного негативного влияния на растение. В работе по получению растений табака (Nicotiana tabacum) с интегрированным в геном β-пропеллерной фитазы Bacillus subtilis 168 PhyA было показано, что растения, синтезирующие внутриклеточную бациллярную фитазу, характеризуются более мелкими семенами, чем растения дикого типа [24]. Так, 18.6% семян трансгенного табака имели меньшую массу, а также деформированную поверхность по сравнению с нормой, причем мелкие семена модифицированных растений были нежизнеспособны. Таким образом, конструирование с использованием сигнального пептида является оптимальным для создания гетерологичной системы экспрессии фитазы для растений.
Эффективность гетерологичной экспрессии фитазы в растениях в первую очередь проявляется в приобретении способности расти на средах с труднодоступным фитатом в качестве единственного источника фосфора. Основными признаками фосфорного дефицита растений является торможение синтеза белка и накопление антоцианов, уменьшение листьев, угнетение роста и перехода к репродуктивному развитию растений [25]. Для оценки эффективности действия экспрессируемой модифицированными растениями рекомбинантной фитазы PaPhyC нами изучены морфологические и биохимические параметры полученных растений A. thaliana.
При росте на среде с фитатом у полученных нами растений, продуцирующих рекомбинантную фитазу, не наблюдали отличительных признаков фосфорного голодания, таких как мелкие листья, появление темно-красной, пурпурной окраски побега (что может свидетельствовать о накоплении антоцианов) и нарушений в репродуктивном цикле. Сухая масса побегов в случае роста на среде с фитатом не изменялась по сравнению с растениями, росшими на среде с добавлением неорганического фосфата (рис. 2–5). Таким образом, растения, конститутивно продуцирующие внеклеточную фитазу, способны обеспечить себя необходимым количеством фосфата путем мобилизации его из молекул фитата. Ранее положительные результаты по получению растений, продуцирующих микробные фитазы, были показаны в работах с трансформированными растениями A. thaiana, табака (N. tabacum), рапса (Brassica napus), сои (Glycine max), кукурузы (Zea mays), люцерны (M. sativa) [21, 24, 26, 27]. Причем для трансформации растений часто использовались гены фитаз двух классов – гистидиновых кислых фитаз HAPs и β-пропеллерных фитаз BPPs [21, 26–28]. Так, растения рапса (B. napus), экспрессировавшие рекомбинантную гистидиновую кислую фитазу E. coli AppA, имели значительно большую биомассу, чем растения дикого типа при росте на песке и на почве с добавлением фитата в качестве единственного источника фосфора [21]. Растения A. thaliana, модифицированные геном фитазы, не только росли в условиях с фитатом в качестве источника фосфора, но и способствовали в этих условиях лучшему росту немодифицированных растений другого вида – табака (N. tabacum), при их совместном культивировании [28].
По нашим данным у растений A. thaliana, экспрессирующих бактериальную фитазу, происходит повышение фитазной активности в лизатах по сравнению с растениями дикого типа. Причем в условиях с добавлением неорганического фосфата фитазная активность в растворимой фракции и фракции клеточной стенки клеток не различается (рис. 1а, б). При росте на фитате фитазная активность ассоциирована с фракцией белка клеточной стенки растений, тогда как в растворимой фракции активность снижена, хотя и превосходила значения активности у контрольных линий растений. Полученные данные коррелируют с результатами конститутивной экспрессии бациллярной фитазы в растениях A. thaliana [27]. Однако в отличие от данных, полученных нами, в этой работе рекомбинантная фитаза имеет внутриклеточную локализацию, что не эффективно для усвоения фитата из среды и неблагоприятно для метаболического статуса клеток. Описаны трансгенные растения B. napus с генами фитаз phyA и appA из A. niger и E. coli под контролем промотора CaMV35S [21]. Фитазная активность в корнях модифицированных растений была выше по сравнению с диким типом растений вне зависимости от источника фосфора, на котором росли растения [21].
На активность рекомбинантной фитазы может влиять количество вставок гена в геноме растения. В большинстве случаев множественные вставки гетерологичной последовательности приводят к снижению уровня его экспрессии вследствие механизмов гомологозависимого умолкания генов, в том числе РНК-интерференции [29]. Однако в ряде работ по получению модифицированных растений, продуцирующих рекомбинантные фитазы, наблюдалось повышение активности фермента у растений с несколькими вставками чужеродного гена [21, 30]. Полученная нами линия растений Е27142 со множественной вставкой гена фитазы paPhyC в геноме не обладала повышенной фитазной активностью по сравнению с растениями с единичной вставкой гена.
Синтез рекомбинантных фитаз в растениях направлен на приобретение растениями способности усваивать фосфат из молекул фитата и поддерживать фосфорный метаболизм и необходимое содержание фосфата в тканях на физиологическом уровне. При измерении содержания фосфора в тканях растений, росших на среде с фитатом, нами показано его увеличение у растений, продуцирующих фитазу (рис. 4). Содержание фосфора в тканях растений линии Е27142 ниже по сравнению с двумя другими линиями, что коррелирует с уровнем фитазной активности. По данным литературы в побегах растений, внеклеточно продуцирующих бациллярную фитазу, содержание фосфора при росте на среде с фитатом не изменялось по сравнению с показателями при росте на среде с неорганическим фосфатом [28]. Таким образом, продукция фитазы способствовала поддержанию необходимого уровня фосфата в тканях и не приводила к нарушениям в фосфорном метаболизме.
Основываясь на полученных нами данных, можно заключить, что внеклеточная продукция бактериальной фитазы растениями A. thaliana способствовала использованию в качестве источника фосфора молекул фитата и обусловливала физиологически нормальный рост модифицированных растений. Таким образом, нами разработана и успешно интегрирована в геном растений A. thaliana конструкция, содержащая модифицированный ген бактериальной фитазы paPhyC под контролем промотора CaMV35S. Экспрессия бактериальной фитазы позволила растениям расти и развиваться в условиях дефицита неорганического фосфата. Дальнейшие разработки в данном направлении могут быть использованы в биотехнологии кормов при создании биодобавок для животных в качестве альтернативы внесения дорогостоящих минеральных фосфатов.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований 16-08-00583.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Doolette A.L. Improved techniques for the charachterisation of soil organic phosphorus using 31P nuclear magnetic resonance spectroscopy and their application to Australian soils: Ph.D. Thesis. Adelaide: University of Adelaide, School of Agriculture, Food and Wine, 2010. 131 p.
Stout L.M., Nguyen T.T., Jaisi D.P. Relationship of phytate, phytate-mineralizing bacteria, and beta-propeller phytase genes along a coastal tributary to the Chesapeake Bay // Soil Sci. Soc. Am. J. 2016. V. 80. P. 84.
Dionisio G., Madsen C. K., Holm P.B., Welinder K.G., Jorgensen M., Stoger E., Arcalis E., Brinch-Pedersen H. Cloning and characterization of purple acid phosphatase phytases from wheat, barley, maize, and rice // Plant Physiol. 2011. V. 156. P. 1087.
Phillippy B.Q., Perera I.Y., Donahue J.L., Gillaspy G.E. Certain Malvaceae plants have a unique accumulation of myo-inositol 1,2,4,5,6-pentakisphosphate // Plants. 2015. V. 4. P. 267.
Gerke J. Phytate (inositol hexakisphosphate) in soil and phosphate acquisition from inositol phosphates by higher plants // Plants. 2015. V. 4. P. 253.
Balaban N.P., Suleimanova A.D., Valeeva L.R., Chastukhina I.B., Rudakova N.L., Sharipova M.R., Shakirov E.V. Microbial phytases and phytate: exploring opportunities for sustainable phosphorus management in agriculture // Am. J. Mol. Biol. 2017. V. 7. P. 11.
Lei X.G., Weaver J.D., Mullaney E., Ullah A.H., Azain M.J. Phytase, a new life for an ‘old’ enzyme // Annu. Rev. Anim. Biosci. 2013. V. 1. P. 283.
Reddy C.S., Kim S.-C., Kaul T. Genetically modified phytase crops role in sustainable plant and animal nutrition and ecological development: a review // Biotech. 2017. V. 7: 195. https://doi.org/10.1007/s13205-017-0797-3
Joshi S., Satyanarayana T. Heterologous expression of yeast and fungal phytases: developments and future perspectives // Ind. J. Biotech. 2015. V. 14. P. 293.
Erpel F., Restovic F., Arce-Johnson P. Development of phytase-expressing Chlamydomonas reinhardtii for monogastric animal nutrition // BMC Biotechnol. 2016. V. 16 https://doi.org/10.1186/s12896-016-0258-9
Nyamsuren Ch., Valeeva L.R., Sharipova M.R., Shakirov E.V. An improved gene expression system to generate transgenic Arabidopsis thaliana plants harboring a Bacillus ginsengihumi phytase gene // RJPBC. 2015. V. 6. P. 18.
Valeeva L.R., Chuluuntsetseg N., Sharipova M.R., Shakirov E.V. Heterologous expression of secreted bacterial BPP and HAP phytases in plants stimulates Arabidopsis thaliana growth on phytate // Front. Plant. Sci. 2018. V. 9. https://doi.org/10.3389/fpls.2018.00186
Valeeva L.R., Nyamsuren Ch., Troshagina D.S., Sharipova M.R., Shakirov E.V. Expression of Pantoea agglomerans phytase from a strong constitutive promoter in Arabidopsis thaliana plants // RJPBCS. 2015. V. 6. P. 99.
Clough S.J., Bent A.F. Floral dip: a simplified method or Agrobacterium-mediated transformation of Arabidopsis thaliana // The Plant J. 1998. V. 16. P. 735.
Tocquin P., Corbesier L., Havelange A., Pieltain A., Kurtem E., Bernier G., Perilleux C. A novel high efficiency, low maintenance, hydroponic system for synchronous growth and flowering of Arabidopsis thaliana // BMC Plant Biol. 2003. V. 3. P. 1.
George T.S., Richardson A.E., Simpson R.J. Behaviour of plant-derived extracellular phytase upon addition to soil // Soil Biol. Chem. 2005. V. 37. P. 977.
Oh T.K., Oh S., Kim S., Park J.S., Vinod N., Jang K.M., Kim S.C., Choi C.W., Ko S.M., Jeong D.K., Udayakumar R. Expression of Aspergillus nidulans phy gene in Nicotiana benthamiana produces active phytase with broad specificities // Int. J. Mol. Sci. 2014. V. 15. P. 15571.
Greiner R. Degradation of myo-inositol hexakisphosphate by a phytate-degrading enzyme from Pantoea agglomerans // The Protein J. 2004. V. 23. P. 577.
Suleimanova A.D., Beinhauer A., Valeeva L.R., Chastukhina I.B., Balaban N.P., Shakirov E.V., Greiner R., Sharipova M.R. Novel glucose-1-phosphatase with high phytase activity and unusual metal ion activation from soil bacterium Pantoea sp. strain 3.5.1. // Appl. Environ. Microbiol. 2015b. V. 81. P. 6790.
Yao M.-Z., Wang X., Wang W., Fu Y.-J., Liang A.-H. Improving the thermostabolity of Escherichia coli phytase appA, by enhancement of glycosylation // Biotechnol. Lett. 2013. V. 35. P. 1669.
Wang Y., Ye X., Ding G., Xu F. Overexpression of phyA and appA genes improves soil organic phosphorus utilisation and seed phytase activity in Brassica napus // PLoS ONE. 2013. V. 8. P. 1.
Angov E. Codon usage: nature’s roadmap to expression and folding of proteins // Biotech. J. 2011. V. 6. P. 650.
Ressayre A., Glemin S., Montalent P., Serre-Giardi L., Dilmann C., Joets J. Introns structure patterns of variation in nucleotide composition in Arabidopsis thaliana and rice protein-coding genes // Genome Biol. Evol. 2015. V. 7. P. 2913.
Yip W., Wang L., Cheng C., Wu W., Lung S., Lim B.-L. The introduction of a phytase gene from Bacillus subtilis improved the growth performance of transgenic tobacco // Biochem. Biophys. Res. Comm. 2003. V. 310. P. 1148.
Медведев С.С. Физиология растений: учебник. СПб.: Санкт-Петербургский университет, 2004. 336 с.
Lung S.-C., Chan W.-L., Yip W., Wang L., Yeung E.C., Lim B.L. Secretion of beta-propeller phytase from tobacco and Arabidopsis roots enhances phosphorus utilization // Plant Sci. 2005. V. 169. P. 341.
Belgaroui N., Zaidi I., Farhat A., Chouayekh H., Bouain N., Chay S., Curie C., Mari S., Masmoudi K., Davidian J.-C., Berthomieu P., Rouached H., Hanin M. Over-expression of the bacterial phytase US417 in Arabidopsis reduces the concentration of phytic acid and reveals its involvement in the regulation of sulfate and phosphate homeostasis and signaling // Plant, Cell Physiol. 2014. V. 55. P. 1912.
Belgaroui N., Berthomieu P., Rouached H., Hanin M. The secretion of the bacterial phytase PHY-US417 by Arabidopsis roots reveals its potential for increasing phosphate acquisition and biomass production during co-growth // Plant Biotech. J. 2016. V. 14. P. 1914.
Matzke M.A., Aufsatz W., Kanno T., Mette M.F., Matzke A.J. Homology-dependent gene silencing and host defense in plants // Adv. Genet. 2002. V. 46. P. 235.
Hong C.Y., Chang K.J., Tseng T.H., Wang C.S., Liu L.F., Yu S.M. The sweet potato sporamin promoter confers high-level phytase expression and improves organic phosphorus acquisition and tuber yield of transgenic potato // Transgenic Res. 2004. V. 13. P. 29.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


