Физиология растений, 2019, T. 66, № 6, стр. 441-451
Адаптивные возможности плода Malus domestica Borkh. (Rosaceae) в условиях высотной поясности
А. С. Воронков a, *, Т. В. Иванова a, Э. И. Кузнецова a, Т. Х. Кумахова b
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
Российский государственный аграрный университет – МСХА им. К.А. Тимирязева
Москва, Россия
* E-mail: voronkov_as@mail.ru
Поступила в редакцию 24.12.2018
После доработки 28.02.2019
Принята к публикации 01.03.2019
Аннотация
Изучены некоторые цитофизиологические адаптивные возможности плодов яблони (Malus domestica Borkh.) на разных высотах – 300, 500, 700 и 1200 м над уровнем моря в горах Северного Кавказа. Условия произрастания плодовых деревьев отличались комплексом ограничивающих факторов в зависимости от высоты, ведущая роль принадлежала высоким дозам солнечного излучения и низким температурам. Впервые выявлено, что с увеличением высоты в наружных слоях плода M. domestica возрастало число клеток, содержащих вещества фенольной природы и количество этих веществ, а также повышалось содержание полиненасыщенных жирных кислот, что обуславливало рост индекса ненасыщенности (ИН). Фенольные соединения предохраняют наружные ткани плода, экранируя их от высоких доз УФ и являясь мощными антиоксидантами, а вследствие роста ИН, вероятнее всего, поддерживаются физиологические параметры текучести мембран клеток при низких температурах. Таким образом, установлено, что адаптация плода к комплексным изменениям условий произрастания с увеличением высоты над уровнем моря обусловлена совокупностью структурно-функциональных приспособлений наружных тканей, способствующих сохранению гомеостаза внутренних слоев клеток. Наблюдаемые комбинированные изменения параметров тканей плода M. domestica позволяют ей не только произрастать в перманентно изменяющихся условиях высотной поясности, но и успешно плодоносить на всех высотах.
ВВЕДЕНИЕ
Изучение адаптации и стрессоустойчивости растений к неблагоприятным факторам внешней среды – одно из востребованных направлений современной биологии, особенно экологической физиологии растений [1]. Чрезвычайно актуальными для исследований являются вопросы повышения устойчивости культурных растений, которые зачастую оказываются в экстремальных условиях под воздействием абиотических и биотических стрессоров [2]. Горные агробиоценозы в этом плане представляют собой уникальные природные модели для исследования приспособительных возможностей различных форм культурных растений, так как условия произрастания изменяются не только сообразно смене времен года, но также напрямую зависят от высоты расположения над уровнем моря. Произрастание в горных экосистемах сопряжено с рядом особенностей. Растительный покров в горах сильно препятствует теплообмену со свободно циркулирующим атмосферным воздухом, поэтому днем благодаря высоким дозам инсоляции на поверхности почвы могут возникать тропические температуры. В ясные ночи тепловая отдача сильно понижает температуру поверхности растительных насаждений по сравнению с температурой воздуха, что может повлечь за собой значительные повреждения мембран клеток и их внутренних компартментов. Комплексное воздействие рельефа и микроклимата подвергает растения воздействию температур и сильной солнечной радиации, в особенности жесткому ультрафиолетовому облучению [3]. С увеличением высоты произрастания над уровнем моря сочетание и контрастность перечисленных абиотических факторов среды будут иметь все больший спектр воздействия на организм растения. Таким образом, данные динамические изменения условий произрастания в горах могут оказывать широкое комплексное воздействие на растительные организмы на различных уровнях их организации. Тем не менее, адаптивные возможности культиваров в столь сложных условиях горных агробиоценозов в настоящее время изучены недостаточно и заслуживают большего внимания. Кроме фундаментальной ценности таких исследований, они необходимы и для разработки методологических подходов по сохранению генофонда, отбору наиболее приспособленных форм растений, их интродукции и выращивания в условиях культуры, а также адаптивного сельского хозяйства в зонах рискованного земледелия и техногенных ландшафтов. В связи с этим, модельным объектом для исследования мы выбрали плоды яблони домашней Malus domestica Borkh. (Rosaceae) как одного из наиболее широко распространенных культиваров, исторически возделываемого в горных агроландшафтах и имеющего большое экономическое и продовольственное значение.
Структурная организация и функциональные особенности плодов, несмотря на относительную их консервативность, выступают как индикаторы адаптивных преобразований. Эти особенности плодов так же, как и семян, расцениваются многими исследователями как “информационная память” о прошлых эколого-географических условиях произрастания растений [4]. По мнению А.Л. Тахтаджяна [5], плод является венцом приспособительной эволюции покрытосеменных и его значение выходит далеко за пределы этих растений. Плоды не просто органы в пределах тела растения, которые, как и многие другие части, выполняют определенные функции, они также наделены важной ролью (функциональностью) в системе фитосферы и биосферы в целом.
Цель работы – выявление некоторых цитофизиологических приспособлений тканей плода Malus domestica к условиям высотной поясности по накоплению веществ фенольной природы и составу жирных кислот суммарных липидов как возможных структурно-функциональных и биохимических маркеров ответа на совокупность основных абиотических воздействий горной среды.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В качестве объекта исследования были использованы плоды яблони домашней (Malus domestica Borkh.) позднезимнего сорта Ренет Симиренко, произрастающей на высотах 300, 500, 700 и 1200 м над уровнем моря в центральной части предгорий Северного Кавказа, в частности Кабардино-Балкарии (табл. 1) [6, 7].
Таблица 1.
Климатические характеристики экологических зон произрастания Malus domestica
| Показатель | Экологическая зона | |||
|---|---|---|---|---|
| степная | предгорная | лесогорная | горно-степная | |
| Высота площадки сбора материала над уровнем моря, м | 300 | 500 | 700 | 1200 |
| Сумма эффективных температур, °С | 3200–3400 | 3000–3200 | 2600–2800 | 1800–2600 |
| ГТК* | 0.9–1.2 | 1.3 | 1.6–1.9 | 1.8–2 |
| Количество осадков в год, мм | 435 | 630 | 650–780 | 550–750 |
| Количество осадков за вегетационный период, мм | 315 | 450 | 500 | 350–600 |
| Влажность воздуха за вегетационный период, % | 66 | 74 | 78–80 | 76–80 |
| Количество суховеев, дней | 70 | 35–40 | 15–20 | 8 |
| Среднесуточная температура июля, °С | 24.6 | 21.9 | 20.0 | 15.6 |
| Максимальная температура, °С | 42 | 39 | 38 | 36 |
| Солнечных дней в вегетационный период | 118 | 80–85 | 85 | 80–90 |
| Пасмурных дней в вегетационный период | 74 | 90–100 | 80–90 | 60–70 |
| Продолжительность вегетационного периода, дней | 195 | 185 | 175 | 150 |
Образцы для исследований (зрелые плоды на стадии съемной зрелости) были собраны в 3‑кратной повторности из средней части кроны, где отсутствует прямое солнечное облучение, трех модельных деревьев в специально заложенных опытных и коллекционных посадках Северо-Кавказского научно-исследовательского института горного и предгорного садоводства (ФГБНУ СевКавНИИГиПС). В степной зоне (300 м над уровнем моря) использовали площадки Терского – “Урожайненские сады” и Урванского – КФХ “Долов” районов; в предгорной (500 м) – Затишьенский опытный полигон ФГБНУ СевКавНИИГиПС (г. Нальчик); лесогорной (700 м) – ОАО “Кенже”, Баксанский и Зольский районы; горностепной (1200 м) – Черекский и Эльбрусский районы. Сроки наступления съемной зрелости плодов существенно изменяются в зависимости от экологических условий. Съемная зрелость сорта Ренет Симиренко после полного цветения (10–16 мая) наступает в разные сроки: на высоте 300 м через 149–162 дня (28 сентября–13 октября); 500 м – 155–169 дней (08–25 октября); 700 и 1200 м – 162–176 дней (10–20 октября).
Микроскопические исследования клеток плодов M. domestica проводили на микроскопе AxioImager D1 (“Carl Zeiss”, Германия) в проходящем свете. Срезы для анатомических и гистохимических исследований изготавливали из 3–4 секций наружных тканей (эпидерма, гиподерма) и паренхимной части, взятых с противолежащих участков в области экватора плода на одинаковом расстоянии от долей чашечки и плодоножки, с помощью микротома с вибрирующим лезвием Microm HM 650V (“Thermo Scientific”, Германия), толщина срезов 30–50 мкм. Для визуализации фенольных соединений (ФеС) срезы обрабатывали хлоридом железа (III) (FeCl3), бихроматом калия (K2Cr2O7) [8] или 4-(Dimethylamino)cinnamaldehyde (DMACA, “Sigma-Aldrich”, США) [9]. Микрофотографии получали с помощью камеры AxioCam MRc (“Carl Zeiss”, Германия). Изображения обрабатывали в программе ZEN lite 2012. Для обсчетов использовали не менее 50 микрофотографий для каждой из трех биологических повторностей.
Электронно-микроскопические исследования осуществляли на трансмиссионном электронном микроскопе (ТЭМ) JEM-1400 (“JEOL Ltd.”, Япония). Подготовку материала проводили по модифицированной ранее методике [10]. Материал фиксировали глутаровым альдегидом (на 0.1 М фосфатном буфере, pH 7.2) и 1% раствором четырехокиси осмия. Затем образцы обезвоживали в серии спиртов и ацетонов возрастающей концентрации и заливали в Эпон-812. Ультратонкие срезы получали на ультрамикротоме LKB-III-8801A (“LKB Bromma”, США). Срезы контрастировали 2% водным раствором уранил-ацетата (37°С) и цитратом свинца по Рейнольдсу.
Определение состава ЖК суммарных липидов. Полностью препарированные наружные ткани и всю паренхимную часть плода M. domestica фиксировали по отдельности в кипящем изопропаноле (предварительно смыв поверхностные воска хлороформом), содержавшем 0.001% ионола в качестве антиоксиданта, и гомогенизировали. Абсолютное содержание и состав ЖК суммарных липидов в полученных гомогенатах определяли, как описано ранее [11]. Идентификацию и определение количественного содержания метиловых эфиров ЖК (МЭЖК) выполняли с помощью ГЖХ-МС на приборе Agilent 7890A GC (“Agilent Technologies Inc.”, США) с 60-метровой капиллярной колонкой с внутренним диаметром 0.25 мм (DB-23, № US8897617H). Для оценки уровня ненасыщенности ЖК в липидах околоплодника рассчитывали индекс ненасыщенности (ИН) [12]. Абсолютное содержание липидов выражали в мкмолях этерифицированных ЖК в расчете на 1 г сырой массы [13].
Все опыты были выполнены в трех биологических и трех аналитических повторностях. В таблицах и на графиках представлены средние значения и их стандартные отклонения. Достоверность различий между средними значениями оценена по t-критерию Стьюдента при Р ≤ 0.05. Количественные данные обрабатывали с помощью однофакторного и двухфакторного дисперсионного анализа, достоверно различающиеся между собой величины обозначены разными буквами.
РЕЗУЛЬТАТЫ
Толщина кутикулы
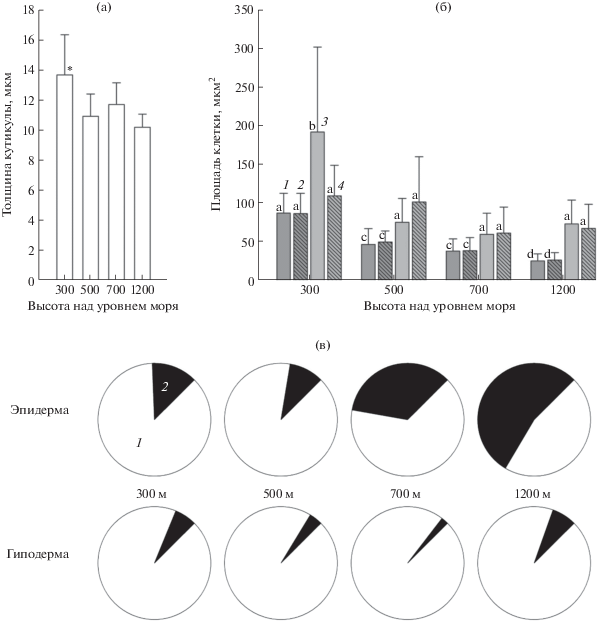
Наиболее толстая кутикула была отмечена у плодов M. domestica на высоте 300 м (~14 мкм). У образцов, собранных с деревьев на других высотах, она была более тонкой и достоверно между собой не различалась (рис. 1а).
Рис. 1.
Морфометрические показатели наружных тканей плода Malus domestica: (а) – толщина кутикулы на разных высотах, * – достоверно отличающиеся величины; (б) – площадь клеток эпидермы не содержащих (1) и содержащих (2) ФеC, гиподермы не содержащих ФеС (3) и с ФеC (4), разными буквами обозначены достоверно отличающиеся величины; (в) – поверхность не экранированная (1) и экранированная (2) ФеС.
Фенольные соединения
Гистохимический скрининг общего содержания ФеС с помощью FeCl3 [14], а также проантоцианидинов (танинов) – бихроматом калия (рис. 2б–д, темно-коричневое окрашивание) или DMACA (рис. 2е–ж, синее окрашивание) [9, 15–17] показал значительное накопление в клетках наружных тканей плодов яблони веществ фенольной природы. Клетки, содержащие ФеС, не отличались по размеру от обычных (рис. 1б), т.е. являлись неспециализированными клетками эпидермы и гиподермы, в которых индуцирован синтез и накопление ФеС. С увеличением высоты (до 500, 700 и 1200 м над уровнем моря) происходило уменьшение размеров клеток эпидермы и гиподермы, причем первой в большей степени (рис. 2в–д). Несмотря на мелкоклеточность (рис. 1б), с увеличением высоты количество клеток, содержащих ФеС, становилось больше (рис 2б–д), особенно в эпидермальной ткани, где на высоте 1200 м этими веществами экранировано более 50% поверхности плода (рис. 1в).
Рис. 2.
Гистологические срезы плода Malus domestica с разных высот над уровнем моря: (a) – неокрашенный (700 м); (б, в, г, д) – окрашенные K2Cr2O7 (300, 500, 700 и 1200 м, соответственно), темно-коричневое окрашивание; (е, ж) – окрашенные DMACA (700 и 1200 м, соответственно), синее окрашивание. Масштабная шкала – 50 мкм.

Проведенные электронно-микроскопические исследования наглядно показали, что увеличение высоты произрастания над уровнем моря изменяло не только количество клеток с ФеС (рис. 1в), но и характер отложений этих веществ в клетке (рис. 3). Так, на высоте 300 м над уровнем моря в клетках наружных тканей плода M. domestica электронно-плотный материал (ЭПМ) был немногочисленным, встречался главным образом на тонопласте центральной вакуоли в виде отдельных небольших образований (рис. 3а) и более крупных скоплений в цитоплазме (рис. 3б), или же накапливался в мелких цитоплазматических вакуолях (рис. 3в). У яблок с высоты 500 м над уровнем моря ЭПМ так же представлен отдельными мелкими образованиями на тонопласте и крупными танноглобулами (ТГ) [14] в центральной вакуоли (рис. 3г) либо более крупными отдельными или сгруппированными отложениями (рис. 3д). На высоте 700 м ЭПМ сконцентрирован в центральной вакуоли, либо в виде ТГ (рис. 3е–ж), либо на тонопласте слоем из мелких сливающихся образований (рис. 3ж, указано стрелками). На 1200 м ЭПМ располагался в виде множества отдельных крупных конгломератов на тонопласте (рис. 3з, указано стрелками), либо образовывал на нем сплошной слой (рис. 3и, указано стрелками) наряду с содержанием в центре вакуоли ТГ (рис. 3з–и). Подобную картину в виде сплошного синего канта по периметру клетки можно было наблюдать и при окрашивании препаратов плода DMACA (рис. 2ж), что является дополнительным свидетельством в пользу полифенольной природы ЭПМ, наблюдаемого на ТЭМ-микрографиях (рис. 3а–и).
Рис. 3.
Микрографии (a–и) и морфометрические характеристики (к) плода Malus domestica с разных высот над уровнем моря: (a) – 300 м, масштабная шкала (МШ) = 50 мкм; (б) – 300 м, МШ = 10 мкм; (в) – 300 м, МШ = 0.2 мкм; (г) – 500 м, МШ = 50 мкм; (д) – 500 м, МШ = 20 мкм; (е) – 700 м, МШ = 1 мкм; (ж) – 700 м, МШ = 50 мкм; (з) – 1200 м, МШ = 5 мкм; (и) – 1200 м, МШ = 10 мкм; (к) – площадь клеток эпидермы (1), гиподермы (3) и занимаемая ФеС в них площадь (2 и 4, соответственно). Разными буквами обозначены достоверно отличающиеся величины. В – вакуоль, К – кутикула, КС – клеточная стенка, ПГ – пластоглобула, ТГ – танноглобула, ХЛ – хлоропласт, ЭПМ – электронно-плотный материал, Я – ядро.

Морфометрический анализ электронных микрографий показал, что в абсолютных величинах (мкм2) площадь, занимаемая ФеС в клетке, становилась меньше с увеличением высоты (рис. 3к) произрастания плодовых деревьев, но при этом следует учесть, что в предгорной, лесогорной и горно-степной экологических зонах наблюдалась мелкоклеточность наружных тканей (рис. 1б). Поэтому в пересчете на процент от площади одной клетки количество полифенолов постепенно возрастало с увеличением высоты над уровнем моря (на 300 м – ЭПМ занимал 15 и 4% от площади клетки эпидермы и гиподермы, соответственно; на 500 м – 18 и 4%; на 700 м – 24 и 3%; на 1200 м – 27 и 13%).
Состав жирных кислот суммарных липидов
Состав ЖК суммарных липидов наружных слоев (эпидерма + гиподерма) плода M. domestica был представлен 21 индивидуальным видом ЖК на высоте 300 м над уровнем моря, при этом с увеличением высоты произрастания происходило уменьшение видового состава ЖК до 15 кислот (табл. 2). Главными кислотами в наружных слоях плодов на всех высотах произрастания плодовых деревьев (300, 500, 700 и 1200 м над уровнем моря) являлись пальмитиновая (С16:0), стеариновая (С18:0), олеиновая (С18:1Δ9), линолевая (С18:2Δ9,12), линоленовая (С18:3Δ9,12,15) (табл. 2). С увеличением высоты доля главных ЖК в составе липидов увеличивалась на ~10% и происходило перераспределение их состава: доля С18:1Δ9 уменьшалась в 2 раза при увеличении на треть С18:2Δ9,12 и в несколько раз С18:3Δ9,12,15.
Таблица 2.
ЖК-состав липидов наружной зоны плодов Malus domestica на разных высотах (масса % от суммы МЭЖК)
| ЖК | Высота над уровнем моря, м | |||
|---|---|---|---|---|
| 300 | 500 | 700 | 1200 | |
| C12:0 | 0.4 ± 0.05a | 0.5 ± 0.053a | 0.3 ± 0.05a | 0.6 ± 0.06a |
| C13:0 | 0.1 ± 0.01a | – | 0.1 ± 0.01a | – |
| C14:0 | 1.4 ± 0.119a | 1.2 ± 0.11a | 1.3 ± 0.12a | 1.9 ± 0.12b |
| C15:0 | 0.4 ± 0.05a | 0.3 ± 0.45b | 0.5 ± 0.05a | 0.4 ± 0.05a |
| C16:0 | 20.7 ± 1.25a | 16.9 ± 1.35b | 17.9 ± 1.36b | 18.6 ± 1.4ab |
| С16:1Δ7 | 0.3 ± 0.05a | – | 0.9 ± 0.06b | – |
| С16:1Δ9 | 0.4 ± 0.05a | 0.3 ± 0.05a | 0.2 ± 0.03b | 0.6 ± 0.05c |
| С17:1Δ10 | 0.1 ± 0.01a | 0.1 ± 0.01a | 0.2 ± 0.013b | – |
| С17:2Δ9,12 | – | 0.2 ± 0.03a | 0.3 ± 0.05b | – |
| C18:0 | 10.6 ± 0.63a | 8.6 ± 0.42b | 8.8 ± 0.43b | 8.7 ± 0.42b |
| С18:1Δ7 | 6.9 ± 0.43a | – | 0.1 ± 0.012b | 0.5 ± 0.045c |
| С18:1Δ9 | 15.9 ± 1.58a | 7.3 ± 0.87b | 7.8 ± 0.85b | 7.7 ± 0.9b |
| С18:1Δ11 | 0.7 ± 0.175a | 0.5 ± 0.195b | 0.6 ± 0.187ab | 0.3 ± 0.174b |
| С18:1Δ13 | 3.1 ± 0.27 | – | – | – |
| С18:2Δ10,13 | 0.1 ± 0.095a | – | – | 1.1 ± 0.46b |
| С18:2Δ9,12 | 31.0 ± 2.77a | 38.5 ± 2.43b | 44.2 ± 3.9b | 40.7 ± 3.25b |
| C19:0 | 0.4 ± 0.05a | 0.3 ± 0.05a | 0.2 ± 0.03b | 0.3 ± 0.05a |
| C18:3Δ9,12,15 | 6.2 ± 0.93a | 23.8 ± 4.28b | 14.6 ± 1.6c | 17.6 ± 2.11bc |
| C20:0 | 1.0 ± 0.2a | 1.2 ± 0.3a | 1.2 ± 0.3a | 1.1 ± 0.33a |
| С20:1Δ11 | 0.1 ± 0.4 | – | – | – |
| С20:2Δ11,14 | 0.02 ± 0.01a | – | 0.2 ± 0.06b | – |
| C22:0 | 0.2 ± 0.06a | 0.4 ± 0.05b | 0.3 ± 0.05b | 0.1 ± 0.02c |
| ИН | 1.084 ± 0.065a | 1.568 ± 0.094b | 1.432 ± 0.075b | 1.455 ± 0.08b |
| Масса ЖК на 1 г сырого веса, мкмоль | 5.46 ± 0.3a | 5.214 ± 0.28ab | 4.801 ± 0.2b | 1.78 ± 0.09c |
| Масса ЖК на 1 г сухого веса, мкмоль | 25.10 ± 1.5a | 18.35 ± 0.97b | 18.45 ± 0.1b | 6.40 ± 0.38c |
| Сухой вес, % | 21.8 ± 1.9a | 28.4 ± 1.4b | 26.0 ± 1.3b | 27.8 ± 1.4b |
Состав ЖК суммарных липидов паренхимной части плодов M. domestica представлен 21 индивидуальным видом на высоте 300 м над уровнем моря, а на 1200 м их количество уменьшалось до 10 (табл. 3). Главными кислотами паренхимы плода на всех высотах являлись пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая. Содержание этих кислот существенно не изменялось с повышением высоты произрастания, за исключением С18:3Δ9,12,15: на высотах 500, 700 и 1200 м над уровнем моря ее доля в составе ЖК липидов вырастала в ~2 раза. В содержании минорных кислот заметные изменения наблюдались у эйказановой кислоты (С20:0), при этом с увеличением высоты произрастания ее количество снижалось более чем в 10 раз (табл. 3).
Таблица 3.
ЖК-состав липидов паренхимной зоны плодов Malus domestica на разных высотах (масса % от суммы МЭЖК)
| ЖК | Высота над уровнем моря, м | |||
|---|---|---|---|---|
| 300 | 500 | 700 | 1200 | |
| C12:0 | 0.3 ± 0.045a | 0.1 ± 0.02b | 0.2 ± 0.035c | 0.3 ± 0.05a |
| C13:0 | 0.1 ± 0.012a | – | 0.02 ± 0.009b | – |
| C14:0 | 0.9 ± 0.07a | 0.5 ± 0.06b | 0.7 ± 0.07b | 0.8 ± 0.075ab |
| C15:0 | 0.5 ± 0.04a | 0.3 ± 0.025b | 0.3 ± 0.03b | 0.5 ± 0.05a |
| C16:0 | 23.3 ± 1.9a | 22.3 ± 1.6ab | 18.5 ± 2.3bc | 16.9 ± 1.7c |
| С16:1Δ7 | 0.8 ± 0.04a | 0.2 ± 0.04b | 0.1 ± 0.025c | – |
| С16:1Δ9 | 0.2 ± 0.06a | 0.1 ± 0.045a | 0.1 ± 0.04a | 1.2 ± 0.11b |
| С17:1Δ10 | – | 0.03 ± 0.014 | – | – |
| C18:0 | 3.9 ± 0.32a | 2.7 ± 0.16b | 1.4 ± 0.08c | 2.4 ± 0.16b |
| С18:1Δ7 | 0.2 ± 0.07 | – | – | – |
| С18:1Δ9 | 5.5 ± 0.33a | 3.4 ± 0.2b | 2.5 ± 0.2c | 3.7 ± 0.2b |
| С18:1Δ11 | 0.8 ± 0.12a | 0.3 ± 0.027b | 0.2 ± 0.02c | – |
| С18:2Δ10,13 | 1.1 ± 0.06a | 0.4 ± 0.04b | – | – |
| С18:2Δ9,12 | 52.2 ± 3.13a | 50.1 ± 4.85ab | 60.3 ± 4.63c | 57.8 ± 4.36ac |
| C19:0 | 0.4 ± 0.03a | 0.1 ± 0.01b | – | – |
| C18:3Δ9,12,15 | 8.2 ± 0.56a | 19.5 ± 1.44b | 15.6 ± 1.1c | 15.9 ± 1.1c |
| C20:0 | 1.3 ± 0.07a | 0.1 ± 0.03b | 0.1± 0.034b | 0.5 ± 0.06c |
| С20:1Δ11 | 0.02 ± 0.008 | – | – | – |
| C21:0 | 0.1 ± 0.02 | – | – | – |
| C22:0 | 0.2 ± 0.036 | – | – | – |
| C23:0 | 0.01 ± 0.003 | – | – | – |
| C24:0 | 0.01 ± 0.002 | – | – | – |
| ИН | 1.386 ± 0.072a | 1.633 ± 0.086b | 1.703 ± 0.078b | 1.685 ± 0.085b |
| Масса ЖК на 1 г сырого веса, мкмоль | 1.909 ± 0.12a | 3.018 ± 0.18b | 3.705 ± 0.22c | 3.977 ± 0.24c |
| Масса ЖК на 1 г сухого веса, мкмоль | 18.42 ± 1.19a | 21.05 ± 1.4b | 35.87 ± 2.4c | 30.05 ± 1.95d |
| Сухой вес, % | 10.4 ± 0.55a | 14.3 ± 0.85b | 10.3 ± 0.55a | 13.2 ± 1.05b |
ОБСУЖДЕНИЕ
Анализ литературных данных показал, что все экологические зоны, в которых произрастали модельные плодовые растения, с которых собирали образцы, характеризуются широкой амплитудой значений множества климатических показателей [6, 7]. С повышением высоты происходит снижение средних показателей температур и, напротив, возрастает освещенность (табл. 1). На высоте 300 м над уровнем моря гидротермический коэффициент увлажнения (ГКТ) [18] в разные годы колеблется около единицы, что является краем границы степной зоны, однако в условиях данного агробиоценоза M. domestica успешно произрастает и плодоносит. С увеличением высоты произрастания количество осадков за вегетационный сезон неуклонно возрастает. Кроме того, с повышением высоты над уровнем моря на каждые 100 м величина солнечной радиации возрастает на ~1.5% [19], поэтому для образцов, собранных с площадки 1200 м индекс УФ-облучения более чем на 10% выше, чем для плодов M. domestica с высоты 300 м. Учитывая также, что количество солнечных дней с повышением высоты практически не изменяется в предгорной, лесогорной и горно-степной зонах (табл. 1), плоды на высоте 1200 м подвергаются большему облучению в сравнении с образцами, собранными с других высот. Таким образом, основными ограничивающими факторам в условиях высотной поясности Северного Кавказа можно считать температуру и УФ-излучение.
С повышением высоты произрастания над уровнем моря происходит понижение температуры воздуха, увеличивается влажность и уровень солнечной радиации, в особенности ультрафиолета-В (УФ-В) [20]. Первым препятствием для проникновения УФ в ткани плода является кутикула, которая может рассеивать свет и снижать интенсивность облучения в среднем на 20% [21]. Однако нами не было обнаружено достоверных различий в толщине кутикулы с повышением высоты произрастания. Более толстая кутикула на поверхности эпидермы M. domestica с высоты 300 м связана, вероятнее всего, с большим количеством суховеев за вегетационный период (70 дней) в данной экологической зоне (табл. 1). Таким образом, эта адаптационная особенность плодов с наименьшей высоты способствует сохранению определенного константного уровня оводненности (100% – сухой вес) их клеток как в наружных тканях (табл. 2), так и в паренхиме (табл. 3).
По многочисленным литературным данным, облучение клеток растений УФ [22], в частности листьев винограда Vitis vinifera L. [23] и плодов M. domestica [21, 24] приводит к образованию и накоплению в них ряда фенольных соединений [25, 26]. Действительно, с увеличением высоты произрастания мы зарегистрировали увеличение количества ФеС в наружных слоях плодов яблони. Причем следует отметить важный факт, что изменения носят двойственный характер, а именно увеличивается как количество клеток, содержащих ФеС, так и процент, занимаемый ФеС от площади каждой такой клетки.
В ходе исследования нами была обнаружена мелкоклеточность наружных тканей плодов M. domestica, произрастающих на площадках 500, 700 и 1200 м. Можно было бы предположить, что это ксероморфный признак, но с увеличением высоты количество осадков и показатель ГКТ возрастает (табл. 1) и, вероятнее всего, обнаруженные изменения размеров клеток вызваны низкими температурами среды (табл. 1) и большими энергетическими затратами клеток по накоплению пластического материала (ФеС).
Таким образом, чем больше высота произрастания M. domestica над уровнем моря, тем больше в наружных слоях плода, непосредственно подвергающихся УФ-облучению, содержится ФеС. Благодаря этому, плоды M. domestica с подъемом в горы приспосабливаются к увеличивающейся солнечной радиации вследствие экранирования клеток наружных слоев фенольными соединениями [21, 25, 26]. Особенно актуальна такая защита на больших высотах с более низкими среднесуточными температурами, где ферментативные системы деактивации активных форм кислорода, образуемые при УФ-облучении, функционируют слабее [27]. Эта особенность обусловлена приспособлением растительного организма к увеличению УФ-облучения [28] с изменением высоты произрастания над уровнем моря плодовых деревьев. Известно, что ФеС обладают выраженными антиоксидантными свойствами, а высокие дозы УФ вызывают окислительный стресс в растительной клетке. Следовательно, увеличение количества ФеС является защитным механизмом, позволяющим тканям плода M. domestica успешно завершить программу созревания на высотах с контрастными почвенно-климатическими условиями, сохраняя при этом генетический материал семян от вредного воздействия высоких доз УФ.
УФ-излучение может приводить к изменениям в составе ЖК липидов мембран клеток [22, 29]. Из анализа полученных результатов состава МЭЖК ацилсодержащих суммарных липидов следует, что качественные и количественные отличия в паренхиме плодов M. domestica на всех высотах (300–1200 м над уровнем моря) носят минимальный характер, а явные различия обнаружены нами снова в их наружных слоях. Также с повышением высоты произрастания M. domestica до 1200 м в наружных тканях плода наблюдается увеличение значения индекса ненасыщенности (ИН) по сравнению с высотой 300 м (1.455 и 1.084, соответственно) (табл. 2). Эта закономерность объясняется повышением содержания в наружных слоях плодов M. domestica полиненасыщенных С18:2 и С18:3 жирных кислот. Как известно, с повышением высоты понижается среднесуточная температура (табл. 1), что может вызывать изменение состояния клеточных мембран (снижение текучести). Однако из-за способности растений адаптироваться к холоду происходит гомеостатирование текучести мембраны путем синтеза полиненасыщенных ЖК [30], благодаря чему клетки наружных слоев плодов поддерживают физиологические параметры текучести своих мембран.
Таким образом, в ходе исследования был выявлен ряд приспособительных возможностей тканей плодов M. domestica в условиях высотной поясности: прежде всего, накопление в клетках наружных слоев ФеС и увеличение ИН. Причем эти адаптационные механизмы работают взаимосвязанно, приспосабливая плоды M. domestica к изменяющимся сублимитирующим факторам окружающей среды. Накопление ФеС, по нашему мнению, в первую очередь связано с возрастающим в горах индексом УФ-облучения, а рост доли полиненасыщенных ЖК суммарных липидов – с резкими колебательными изменениями температур в горах. Мы видим, что с увеличением высоты произрастания накопление ФеС и изменение ИН происходит сообразно изменениям каждого из ограничивающих развитие факторов среды, и так как модуляция погоды в горах обусловлена изменением ряда климатических факторов, то и невозможно представить, что какой-то один адаптационный механизм сможет обеспечить результативное приспособление. Следовательно, именно комплексное приспособление на клеточном и биохимическом уровнях определяет не только успешное произрастание M. domestica в жестких климатических условиях высотной поясности, но дает возможность для продуктивного завершения вегетационного периода, а именно программы созревания плода.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Колупаев Ю.Е., Трунова Т.И., Мошков И.Е. Всероссийский симпозиум “Растение и стресс” (9–12 ноября, 2010 г., Москва) // Физиология растений. 2011. Т. 58. С. 797.
Жученко А.А. Адаптивное растениеводство (эколого-генетические основы). Теория и практика. Москва: Агрорус, 2008. Т. 1. 814 с.
Зитте П., Вайлер Э.В., Кадерайт Й.В., Брезински А., Кёрнер К. Ботаника. Учебник для вузов. Т. 4. Экология / на основе учебника Э. Страсбургера и др.; пер. с нем. Поспеловой Е.Б. / Под ред. А.Г. Еленевского, В.Н. Павлова. Москва: Академия, 2007. 256 с.
Матиенко Б.Т. Адаптивная природа функциональности плодов и проблема формирования и обеспечения их лежкоспособности // Известия Академии наук Молдавской ССР. Серия биологических и химических наук. 1985. С. 3.
Тахтаджян А.Л. Морфологическая эволюция покрытосеменных. Москва: Московское общество испытателей природы, 1948. 301 с.
Шидаков Р.С. Сортимент яблони и совершенствование его путем селекции в предгорьях Северного Кавказа. Нальчик: Эльбрус, 1991. 303 с.
Шидаков Р.С., Шидакова А.С. Экономическая оценка сортов и элит яблони в агроландшафтах в разных экологических зонах Северного Кавказа // Успехи современного естествознания. 2006. № 11. С. 12.
Marin M., Jasnić N., Lakušić D., Duletić-Laušević S., Ascensão L. The micromorphological, histochemical and confocal analysis of Satureja subspicata Bartl. ex Vis. glandular trichomes // Arch. Biol. Sci. 2010. V. 62. P. 1143. https://doi.org/10.2298/ABS1004137G
Brillouet J.-M., Escoute J. A new technique for visualizing proanthocyanidins by light microscopy // Biotech. Histochem. 2012. V. 87. P. 195. https://doi.org/10.3109/10520295.2011.603703
Кумахова Т.Х., Меликян А.П. Ультраструктура кутикулы плодов разных сортов Malus domestica (Rosaceae) // Ботанический журнал. 1989. Т. 74. С. 328.
Цыдендамбаев В.Д., Иванова Т.В., Халилова Л.А. Куркова Е.Б., Мясоедов Н.А., Балнокин Ю.В. Жирнокислотный состав липидов вегетативных органов галофита Suaeda altissima при разном уровне засоления // Физиология растений 2013. Т. 60. С. 700. https://doi.org/10.7868/S001533031305014X
Lyons J.M., Weaton T.A., Pratt H.K. Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plants // Plant Physiol. 1964. V. 39. P. 262
Иванова Т.В., Майорова О.В., Орлова Ю.В., Кузнецова Э.И., Халилова Л.А., Мясоедов Н.А., Балнокин Ю.В., Цыдендамбаев В.Д. Ультраструктура и жирнокислотный состав липидов клеток вегетативных органов Chenopodium album L. в условиях солевого стресса // Физиология растений. 2016. Т. 63. С. 783. https://doi.org/10.7868/S0015330316060051
Кумахова Т.Х., Воронков А.С., Орлова Ю.В., Жиров В.К. Танносомы в клетках перикарпия Maloideae (Rosaceae) // Докл. Акад. наук. 2018. Т. 482. C. 605. https://doi.org/10.31857/S086956520002994-6
Brillouet J.-M., Romieu C., Schoefs B., Solymosi K., Cheynier V., Fulcrand H., Verdeil J.-L., Conejero G. The tannosome is an organelle forming condensed tannins in the chlorophyllous organs of Tracheophyta // Ann. Bot. 2013. V. 112. P. 1003. https://doi.org/10.1093/aob/mct168
Cadot Y., Minana Castello M.T., Chevalier M. Flavan-3-ol compositional changes in grape berries (Vitis vinifera L. cv Cabernet Franc) before veraison, using two complementary analytical approaches, HPLC reversed phase and histochemistry // Anal. Chim. Acta. 2006. V. 563. P. 65. https://doi.org/10.1016/j.aca.2006.01.063
Fleurat-Lessard P., Béré E., Lallemand M., Dédaldéchamp F., Gabriel Roblin G. Co-occurrence of tannin and tannin-less vacuoles in sensitive plants // Protoplasma. 2016. V. 253. № 3. P. 821. https://doi.org/10.1007/s00709-015-0844-z
Taparauskiene L., Miseckaite O. Comparison of watermark soil moisture content with Selyaninov hydrothermal coefficient // AGROFOR International Journal. 2017. V. 2. P. 106.
Алисов Б.П., Полтараус Б.В. Климатология // М.: Изд-во Моск. ун-та. 1974. 299 с.
Bondarenko S.L., Savchuk D.A. Response of conifers to UV-B and climate in mountain areas // Global J. Environ. Sci. Manage. 2018. V. 4. P. 299. https://doi.org/10.22034/gjesm.2018.03.004
Solovchenko A., Merzlyak M. Optical properties and contribution of cuticle to UV protection inplants: experiments with apple fruit // Photochem. Photobiol. Sci. 2003. V. 2. P. 861. https://doi.org/10.1039/b302478d
Hollosy F. Effects of ultraviolet radiation on plant cells // Micron. 2002. V. 33. P. 179.
Verdaguera D., Jansenb M.A.K., Llorensa L., Moralesc L.O., Neugartd S. UV-A radiation effects on higher plants: Exploring the known unknown // Plant Science. 2017. V. 255. P. 72. https://doi.org/10.1016/j.plantsci.2016.11.014
Assumpcaoa C.F., Hermesa V.S., Pagnoa C., Castagna A., Mannucci A., Sgherri C., Pinzino C., Ranieri A., Flores S.H., Rios A.O. Phenolic enrichment in apple skin following post-harvest fruit UV-B treatment // Postharvest Biol. Technol. 2018. V. 138. P. 37. https://doi.org/10.1016/j.postharvbio.2017.12.010
Solovchenko A., Schmitz-Eiberger M. Significance of skin flavonoids for UV-B-protection in apple fruits // J. Exp. Bot. 2003. V. 54. № 389. P. 1977. https://doi.org/10.1093/jxb/erg199
Merzlyak M.N., Solovchenko A.E., Smagin A.I., Gitelson A.A. Apple flavonols during fruit adaptation to solar radiation: Spectral features and technique for non-destructive assessment // J. Plant Physiol. 2005. V. 162. P. 151. https://doi.org/10.1016/j.jplph.2004.07.002
Oncel I., Yurdakulol E., Keles Y., Kurt L., Yıldız A. Role of antioxidant defense system and biochemical adaptation on stress tolerance of high mountain and steppe plants // Acta Oecol. 2004. V. 26. P. 211. https://doi.org/10.1016/j.actao.2004.04.004
Berli F., D’Angelo J., Cavagnaro B., Bottini R., Wuilloud R., Silva M.F. Phenolic composition in grape (Vitis vinifera L. cv. Malbec) ripened with different solar UV-B radiation levels by capillary zone electrophoresis // J. Agric. Food Chem. 2008. V. 56. P. 2892. https://doi.org/10.1021/jf073421+
Santin M., Lucini L., Castagna A., Chiodelli G., Hauser M.-T., Ranieri A. Post-harvest UV-B radiation modulates metabolite profile in peach fruit // Postharvest Biol. Technol. 2018. V. 139. P. 127. https://doi.org/10.1016/j.postharvbio.2018.02.001
Лось Д.А. Десатуразы жирных кислот. Москва: Научный мир, 2014. 372 с.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


