Физиология растений, 2019, T. 66, № 6, стр. 431-440
Дневная динамика структурно-функциональных параметров фотосинтетического аппарата галофитов дикой флоры
О. А. Розенцвет a, А. А. Кособрюхов b, Е. С. Богданова a, В. Н. Нестеров a, *
a Федеральное государственное бюджетное учреждение науки
Институт экологии Волжского бассейна Российской академии наук
Тольятти, Россия
b Федеральное государственное бюджетное учреждение науки
Институт фундаментальных проблем биологии Российской академии наук
Пущино, Россия
* E-mail: nesvik1@mail.ru
Поступила в редакцию 25.07.2018
После доработки 14.12.2018
Принята к публикации 28.01.2019
Аннотация
Исследована динамика структурно-функциональных параметров фотосинтетического аппарата (ФА) эугалофита Salicornia perennans, криногалофита Limonium gmelinii и гликогалофита Artemisia santonica в течение дня. Наибольшую активность ФА по скорости поглощения/выделения СО2 листьями наблюдали в утренние часы. У соленакапливающих (S. perennans) и соленепроницаемых (A. santonica) видов интенсивность фотосинтеза была выше, чем у растений вида L. gmelinii, имеющих солевыделительные системы. Содержание зеленых пигментов снижалось в течение дня у A. santonica и S. perennans, а у L. gmelinii оставалось стабильным. В течение дня увеличивалось отношение пластидные липиды/пигменты у растений A. santonica и S. perennans. В липидах хлоропластов S. perennans снижение относительного содержания моногалактозилдиацилглицерина (МГДГ) компенсировалось увеличением относительного содержания дигалактозилдиацилглицерина (ДГДГ) на фоне неизменного вклада сульфохиновозилдиацилглицерина (СХДГ) и фосфатидилглицерина (ФГ). В хлоропластах L. gmelinii доля нейтральных липидов МГДГ и ДГДГ не менялась в отличие от содержания анионных липидов СХДГ и ФГ. Для A. santonica установлены изменения как нейтральных, так и анионных липидов. Высокая доля ненасыщенных ЖК (ННЖК) (более 70%) в общем пуле обусловлена, в основном, α-линоленовой кислотой. Обнаружена общая тенденция увеличения доли насыщенных ЖК в вечернее время. Все выявленные структурно-функциональные перестройки ФА, связанные с динамикой пигмент-липидного фонда тилакоидных мембран, являются адаптивными и направлены на оптимизацию процесса фотосинтеза к условиям окружающей среды.
ВВЕДЕНИЕ
Засоление почвы является одним из основных факторов, определяющих рост и развитие галофитов [1]. Кроме засоления галофиты природной флоры, как правило, в течение большей части вегетационного периода испытывают воздействие высоких уровней инсоляции и температуры. Приспособление растений к изменяющимся условиям происходит в динамическом режиме в соответствии с изменением факторов среды [2].
Галофиты выработали несколько способов адаптации к подобным условиям, которые реализуются на уровне целого растения, растительной ткани и клеточно-молекулярном уровне, для обеспечения успешного роста и развития растений [3]. Фотосинтетический аппарат (ФА) играет одну из ключевых ролей в адаптации растений к засолению среды, что связано с необходимостью сохранения функциональной активности фотосинтетических систем (ФС) и участием пластидного генома в регуляции состава белков и проницаемости мембран [4]. Анатомические адаптивные особенности галофитов сформированы в процессе эволюции и направлены на защиту ФА. Такими считают уменьшение листовой поверхности, изменение количества устьиц на единицу площади, суккулентность, наличие специализированных солевыделяющих систем и т.д. [5]. На уровне мезоструктуры листа установлены более крупные размеры фотосинтетических клеток хлоренхимы у растений эугалофитов, накапливающих соли в надземной части, по сравнению с крино-(солевыделяющие) и гликогалофитами (ограничивают поступление солей) [3, 6]. В свою очередь, гликогалофиты характеризуются повышенной способностью к синтезу и накоплению низкомолекулярных осмолитов и антиоксидантов [7], что говорит о разных приспособительных механизмах галофитов [8].
ФА способен перестраиваться в ответ на кратковременные изменения освещения, температуры и др. факторов. В этом случае адаптация ФА происходит на клеточном уровне организации [9]. Пигмент-белковые комплексы ФА встроены во внутренние мембраны хлоропластов и разделены на два морфологических домена: тилакоиды гран и тилакоиды стромы [10]. Липиды являются ключевыми молекулами в формировании динамических свойств фотосинтетических мембран [11, 12]. Главными липидами тилакоидов являются моногалактозилдиацилглицерин (МГДГ) и дигалактозилдиацилглицерин (ДГДГ), сульфолипид сульфохиновозилдиацил глицерин (СХДГ) и фосфолипид фосфатидилглицерин (ФГ). Физическое поведение различных мембранных липидных классов определяется структурой их головной группы. МГДГ и ДГДГ являются нейтральными липидами, а СХДГ и ФГ несут один отрицательный заряд [13]. Различие в строении МГДГ и ДГДГ определяет их способность к образованию бислойных и небислойных структур в мембране. Молекулы МГДГ формируют монослойные мембраны, а ДГДГ, СХДГ и ФГ являются типичными двухслойными липидами, имеющими большую головку и цилиндрические формы [14]. Точная настройка отношения МГДГ/ДГДГ делает тилакоидные мембраны чрезвычайно динамичными и гибкими, чтобы справляться с различными негативными факторами, включая засоление [7]. Например, по мере возрастания галофильности у ряда растений отношение МГДГ/ДГДГ снижалось, но увеличивалось соотношение между глико- и фосфолипидами [15]. Роль тилакоидных липидов, кроме создания микроокружения для белков, тесно связана с функционированием отдельных субъединиц ФА, в частности с поддержанием олигомерной структуры обеих ФС и светособирающих комплексов (ССК). Известно также, что оба галактолипида и СХДГ активируют комплекс цитохромов b6 f и CF0-CF1-АТФазу. Фосфолипид ФГ вовлечен также в транспорт электронов комплекса ФС II, сборку ССК и образование гран [16].
Физические свойства мембран зависят не только от головных групп липидов, но и от состава их жирных кислот (ЖК) [17]. Так, текучесть мембран определяется соотношением насыщенных (НЖК) и ненасыщенных ЖК (ННЖК) в мембранных липидах. Регуляция текучести мембран в условиях засоления среды необходима для поддержания мембранного барьера, обеспечения условий эффективного восстановления разрушенных ФС, оптимального функционирования Na+/H+-обменников, Н+-АТФаз, водных и ионных каналов [18, 19]. Ферментами, ответственными за введение двойных связей в конкретные участки ацильных цепей ЖК являются десатуразы [20].
Фотосинтетические пигменты – хлорофиллы и каротиноиды – ответственны за поглощение света и фотохимические реакции [21]. Изменение концентрации хлорофилла представляет другой способ адаптации фотосинтетической функции к различным условиям окружающей среды, но прежде всего к интенсивности света и влагообеспеченности [22]. Каротиноиды, кроме участия в процессе светосбора, обладают дополнительными функциями – стабилизируют мембранные структуры и защищают их от стрессовых факторов, являясь липофильными антиоксидантами внутри бислоя липидов [23].
Ранее нами показано, что ФА разных типов галофитов способен поддерживать высокую интенсивность фотохимических процессов в значительном диапазоне плотности потока фотосинтетически активной радиации (ФАР) и успешно адаптируется к световым и температурным условиям [6, 7]. Установлены также структурно-функциональные перестройки ФА факультативного галофита Artemisia santonica в течение дневного времени суток. С экологических позиций представляет интерес изучение динамики таких процессов у облигатных галофитов. Устойчивость ФА является ключом в адаптации растений к изменяющимся условиям окружающей среды, захвату новых территорий, продвижению и расселению видов.
Цель работы заключалась в сравнительном изучении структурно-функциональных параметров ФА, таких как скорость поглощения/выделения СО2, состав и содержание пластидных липидов, зеленых и желтых пигментов в листьях галофитов, различающихся по стратегии солеустойчивости, в ответ на меняющиеся условия освещения и температуры в течение дня.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. Объектами исследования являлись побеги эугалофита Salicornia perennans Willd. (сем. Chenopodiaceae), листья криногалофита – Limonium gmelinii (Willd.) O. Kuntze (сем. Plumbaginaceae) и гликогалофита – Artemisia santonica L. (сем. Asteraceae). Все растения обладают С3-типом фотосинтеза.
Растительный материал отбирали на площадках (20 × 20 м) в 9:00 (утро), 14:00 (день), 20:00 ч (вечер) по местному времени в конце июня 2014 и 2015 гг. Для биохимических анализов использовали 10–15 листьев среднего яруса (в случае S. perennans – средняя часть побега) из 15–20 растений одного и того же вида, произрастающих в пределах одного биотопа. Из объединенной биомассы растений одного вида составляли три биологические пробы для каждого вида анализов (0.5 г для анализа липидов и пигментов; 5 г – для выделения хлоропластов), замораживали в жидком азоте и хранили до проведения анализов.
Фотосинтетическая активность. Интенсивность фотосинтеза оценивали по скорости поглощения/выделения СО2 листьев галофитов в полевых условиях в утреннее, дневное и вечернее время, используя портативный инфракрасный газоанализатор LCPro+ (“ADC BioScientific Ltd”, Великобритания). Скорость СО2 газообмена в расчете на м2 листовой поверхности определяли с помощью программы газоанализатора, с учетом того, что площадь листовой камеры, куда помещается лист, составляет 6.25 см2. Интенсивность падающего светового потока в области ФАР определяли с помощью датчика интенсивности света находящегося непосредственно на листовой камере прищепки газоанализатора и далее по показаниям на шкале прибора.
Выделение хлоропластов. Навеску растений массой 5 г после извлечения из жидкого азота и размораживания отмывали дистиллированной водой, гомогенизировали с помощью фарфоровой ступки и пестика с добавлением 15 мл охлажденной среды выделения (0.5 М сахарозы, 50 мМ трис-НС1, 5 мМ ЭДТА, 5 мкМ меркаптоэтанола, рН 7.8), фильтровали через три слоя марли. На первом этапе гомогенат центрифугировали 1 мин при 500 g для отделения тяжелых элементов клетки, затем супернатант центрифугировали 10 мин при 3500 g. В полученном осадке содержится фракция хлоропластов. Контроль чистоты фракций хлоропластов проводили с использованием инвертированного биологического микроскопа (“Axio observer Z1”, Carl Zeiss, Германия), а также по содержанию маркерных липидов – ФГ и СХДГ в сумме пластидных липидов. Все операции проводили при температуре 4°С.
Выделение и анализ липидов. Липиды из фракции хлоропластов галофитов экстрагировали смесью хлороформа и метанола 1 : 2 (по объему) и разделяли методом тонкослойной хроматографии как описано ранее [7]. Количество липидов определяли денситометрически, с помощью программы Денскан-04 (“Ленхром”, Россия), в отдельных случаях – спектрофотометрически на приборе ПромЭкоЛаб ПЭ-3000 УФ (“ПРОМЭКОЛАБ”, Россия). На денситометре хроматограммы анализировали в режиме параболической аппроксимации по калибровочным кривым, используя МГДГ и ФГ (“Sigma”, Германия) в качестве стандартов.
Фотосинтетические пигменты. Пигменты из листьев галофитов экстрагировали 100% ацетоном при температуре 4°С сразу после извлечения из жидкого азота. Содержание пигментов определяли спектрофотометрически при длине волны 662, 645 и 470 нм. Соотношение растворителя и сырой массы, число экстракций и расчет концентрации хлорофиллов а, b и каротиноидов проводили по методу H.K. Lichtenthaller [24].
Анализ метиловых эфиров ЖК. После гидролиза липидов ЖК метилировали кипячением в 5% растворе HCl в метаноле в течение 1 ч [25]. Полученные метиловые эфиры ЖК анализировали на хроматографе Кристалл 5000.1 (“Хроматэк”, Россия) в изотермическом режиме с использованием капиллярной колонки длиной 105 м и диаметром 0.25 мм (“RESTEK”, США) и пламенно-ионизационного детектора. Температура колонки – 180°С, испарителя и детектора – 260°С, скорость тока газа-носителя (гелий) – 2 мл/мин. Для оценки уровня ННЖК липидов хлоропластов растений рассчитывали индекс ненасыщенности (ИН) как сумму произведений доли каждой ненасыщенной ЖК на количество ее двойных связей. Активность ацил-липидных ω9, ω6 и ω3 десатураз рассчитывали как стеароил- (SDR), олеил- (ODR) и линолеил- (LDR) десатуразные отношения по формулам:
(1)
${\text{SDR}} = {{\left( {\% {{{\text{С}}}_{{18:1}}}} \right)} \mathord{\left/ {\vphantom {{\left( {\% {{{\text{С}}}_{{18:1}}}} \right)} {\left( {\% {{{\text{С}}}_{{18:0}}} + \% {{{\text{С}}}_{{18:1}}}} \right)}}} \right. \kern-0em} {\left( {\% {{{\text{С}}}_{{18:0}}} + \% {{{\text{С}}}_{{18:1}}}} \right)}},$(2)
$\begin{gathered} {\text{ODR}} \\ = {{(\% {{{\text{C}}}_{{18:2}}} + \% {{{\text{C}}}_{{18:3}}})} \mathord{\left/ {\vphantom {{(\% {{{\text{C}}}_{{18:2}}} + \% {{{\text{C}}}_{{18:3}}})} {\left( {\% {{{\text{С}}}_{{18:1}}} + \% {{{\text{С}}}_{{18:2}}} + \% {{{\text{С}}}_{{18:3}}}} \right)}}} \right. \kern-0em} {\left( {\% {{{\text{С}}}_{{18:1}}} + \% {{{\text{С}}}_{{18:2}}} + \% {{{\text{С}}}_{{18:3}}}} \right)}}, \\ \end{gathered} $(3)
${\text{LDR}} = {{\left( {\% {{{\text{С}}}_{{18:3}}}} \right)} \mathord{\left/ {\vphantom {{\left( {\% {{{\text{С}}}_{{18:3}}}} \right)} {\left( {\% {{{\text{С}}}_{{18:2}}} + \% {{{\text{С}}}_{{18:3}}}} \right)}}} \right. \kern-0em} {\left( {\% {{{\text{С}}}_{{18:2}}} + \% {{{\text{С}}}_{{18:3}}}} \right)}},$В таблицах и на рисунках показаны средние арифметические значения из трех биологических проб и их стандартные ошибки. Достоверность отличий оценивали с помощью стандартного дисперсионного анализа в статистической программе PAST 3.0. Статистическую обработку результатов анализов проводили с использованием программ Statistica 6.0 for Windows, Microsoft E-xcel 2003 и 2007.
РЕЗУЛЬТАТЫ
В предыдущих исследованиях было показано, что исследованные галофиты приурочены к различным почвенным субстратам. Так, эугалофит S. perennans произрастает на почвах с сильной степенью засоления (до 8% от сухой массы почвы) и высоким уровнем увлажнения (до 38%) [7]. Криногалофит L. gmelinii способен вегетировать при засолении почвы до 3% от сухой массы и при влажности до 29%. Гликогалофит A. santonica произрастает в более благоприятных условиях – при уровне увлажнения почвы до 27% и при засолении среды не более 2% от сухой массы почвы. Интенсивность солнечной радиации в период проведения настоящих исследований варьировала в интервале 10–1830 мкмоль/(м2 с). Температура воздуха в полдень достигала 36°С, а к вечеру снижалась до 23ºС (табл. 1).
Таблица 1.
Динамика скорости поглощения/выделения СО2 галофитов в течение дня
| Время дня, ч | Условия измерения | Скорость газообмена |
|---|---|---|
| S. perennans | ||
| 9:00 | Irr = 1770 мкмоль /(м2 с), T = 29.5°C |
32.5 ± 2.8 мкмоль СО2/(м2 с) |
| 14:00 | Irr = 1200 мкмоль/(м2 с), T = 35.8°C |
19.8 ± 1.8 мкмоль СО2/(м2 с) |
| 20:00 | Irr = 10 мкмоль/(м2 с), T = 22.8°C |
–1.0 ± 0.2 мкмоль СО2/(м2 с) |
| L. gmelinii | ||
| 9:00 | Irr = 1830 мкмоль/(м2 с), T = 31.8°C |
4.1 ± 0.4 мкмоль СО2/(м2 с) |
| 14:00 | Irr = 1200 мкмоль/(м2 с), T = 36.2°C |
3.3 ± 0.2 мкмоль СО2/(м2 с) |
| 20:00 | Irr = 50 мкмоль/(м2 с), T = 24.2°C |
0.1 ± 0.1 мкмоль СО2/(м2 с) |
| A. santonica | ||
| 9:00 | Irr = 1650 мкмоль/(м2 с), T = 28.7°C |
20.0 ± 1.8 мкмоль СО2/(м2 с) |
| 14:00 | Irr = 700 мкмоль/(м2 с), T = 36.0°C |
12.5 ± 1.0 мкмоль СО2/(м2 с) |
| 20:00 | Irr = 20 мкмоль/(м2 с), T = 25.0°C |
–6.2 ± 0.8 мкмоль СО2/(м2 с) |
СО2 газообмен галофитов
В условиях различной степени засоления почвы, изменения уровня интенсивности света и температуры наибольшую активность ФА по скорости поглощения/выделения СО2 листьями наблюдали в утренние часы. Причем у растений, контрастных по стратегии соленакопления – эугалофита S. perennans и гликогалофита A. santonica скорость поглощения СО2 была более чем пятикратно выше, чем у L. gmelinii, имеющего солевыделительные системы (табл. 1). В середине дня наблюдаемая скорость фотосинтеза снижалась, а в вечерний период в темноте наблюдали темновое дыхание.
Фотосинтетические пигменты
Изменение скорости газообмена и активности реакций световой стадии фотосинтеза в течение светового дня во многом зависит от содержания фотосинтетических пигментов. Исследованные растения различались по количеству и динамике содержания пигментов. В листьях эугалофита S. perennans суммарное содержание пигментов в расчете на 1 г сухой массы было в 1.5–2 раза ниже (F = 35, P = 0.001) по сравнению с глико- и криногалофитами в течение всего дня (рис. 1). Суммарное содержание хлорофиллов а и b в листьях S. perennans и A. santonica в течение дня снижалось, составляя 80 и 70% (F = 21, P = 0.01) от утренних значений, соответственно.
Рис. 1.
Динамика суммарного содержания зеленых (а) и желтых (б) пигментов листьев галофитов в течение дня. 1 – S. perennans, 2 – L. gmelinii, 3 – A. santonica. Хл – хлорофилл. Представлены средние значения и их стандартные ошибки. Различные буквы указывают на отличия между вариантами при P < 0.05.

Концентрация каротиноидов у исследованных галофитов была в 4.6–6.5 раз ниже, чем зеленых пигментов. Большее их количество обнаружено у растений L. gmelinii и A. santonica. Характер дневной динамики содержания был следующим: количество каротиноидов у S. perennans и L. gmelinii не менялось в течение дня, а у A. santonica – постепенно снижалось к вечеру (F = 15, P = 0.02).
Липиды фотосинтетических мембран галофитов
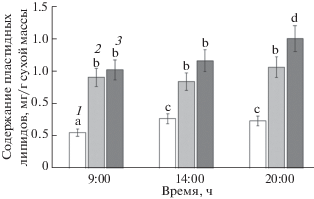
Одновременно с оценкой функциональной активности было исследовано состояние фотосинтетических мембран по данным анализа пластидных липидов в расчете на 1 г сухой массы. Отметим, что оводненность надземных органов составляла 88–90% у S. perennans, 70–74% у L. gmelinii и 62–65% от сухой массы у A. santonica. Меньшее содержание суммы этих липидов соответствовало меньшему количеству пигментов. Так в листьях эугалофита S. perennans их содержание было примерно в 2–3 раза меньше, чем в листьях криногалофита L. gmelinii и гликогалофита A. santonica. Изменчивость суммарного содержания липидов фотосинтетических мембран в течение дня составляла 10% у L. gmelinii и 20–25% у S. perennans и A. santonica (рис. 2).
Рис. 2.
Динамика суммарного содержания основных пластидных липидов листьев галофитов в течение дня. 1 – S. perennans, 2 – L. gmelinii, 3 – A. santonica. Представлены средние значения и их стандартные ошибки. Различные буквы указывают на отличия между вариантами при P < 0.05.
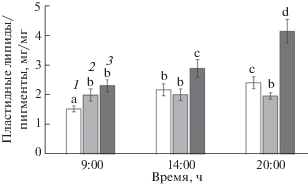
Расчет содержания пластидных липидов на единицу массы хлорофилла показал, что в течение дня этот показатель увеличивался у растений S. perennans и A. santonica в 1.5–2 раза, а у L. gmelinii – оставался стабильным и был равен величине 2.3 (рис. 3).
Рис. 3.
Динамика coотношений пластидных липидов и пигментов в листьях галофитов в течение дня. 1 – S. perennans, 2 – L. gmelinii, 3 – A. santonica. Представлены средние значения и их стандартные ошибки. Различные буквы указывают на отличия между вариантами при P < 0.05.
Кроме количественных изменений общего содержания пластидных липидов обнаружены изменения в их составе. Так, в хлоропластах S. perennans относительное содержание МГДГ в общем пуле пластидных липидов уменьшалось в 1.6 раза (F = 18, P = 0.01) (рис. 4). Относительное содержание ДГДГ напротив увеличилось за это же время в 1.4 раза (F = 13, P = 0.02). Вклад СХДГ и ФГ практически не менялся. В хлоропластах L. gmelinii доли МГДГ и ДГДГ в течение дня оставались стабильными, но относительное содержание СХДГ снижалось с 14 до 9% (F = 9, P = 0.04) на фоне увеличения содержания ФГ. В отношении A. santonica установлено, что относительное содержание МГДГ и ДГДГ менялось только в дневное время в сторону увеличения ДГДГ и снижения МГДГ (F = 18, P = 0.01). В то же время доля СХДГ увеличивалась при снижении относительного содержания ФГ. Вместе с изменением относительного содержания индивидуальных липидов менялось соотношение анионных (ФГ/СХДГ) и нейтральных (МГДГ/ДГДГ) глицеролипидов. У эугалофита S. perennans величина отношения МГДГ/ДГДГ снижалась в течение дня, у криногалофита L. gmelinii – не менялась, а у гликогалофита A. santonica – изменялось только в самое жаркое дневное время (рис. 5). Отношение ФГ/СХДГ в течение суток достоверно возрастало у L. gmelinii, снижалось у A. santonica, а у S. perennans в утренние и дневные часы было стабильным и сокращалось только к вечеру.
Рис. 4.
Динамика относительного содержания основных пластидных липидов в листьях галофитов в течение дня. (а) – S. perennans, (б) – L. gmelinii, (в) – A. santonica; 1 – МГДГ, 2 – ДГДГ, 3 – СХДГ, 4 – ФГ. Представлены средние значения и их стандартные ошибки. Различные буквы указывают на отличия между вариантами при P < 0.05.

Жирнокислотный состав хлоропластных липидов галофитов
Результаты анализа состава ЖК в липидах, выделенных из фракции хлоропластов, приведены в табл. 2. Как и следовало ожидать, среди общего числа ЖК большую часть составляли ННЖК, доля которых превышала 70%. Среди них идентифицированы моно-, ди- и триеновые кислоты ω9, ω6 и ω3 биосинтетических семейств. ЖК ω9 представлены олеиновой С18:1 и пальмитоолеиновой С16:1 кислотами. Содержание первой варьировало в интервале 1.7–8.3% от суммы ЖК, а второй – 1.7–3.4%. Из семейства диеновых ЖК, в синтезе которых принимает участие ω6 десатураза, была идентифицирована линолевая кислота (С18:2 ω6) в количестве 7.4–23.5%. Триеновые кислоты представлены α-линоленовой кислотой (С18:3ω3), содержание которой составляло 34.7–63.0%. Из полученных данных следует, что высокая степень ненасыщенности ЖК в хлоропластах всех исследованных видов обусловлена, в основном, α-линоленовой кислотой. Среди насыщенных ЖК доминирует пальмитиновая кислота С16:0. Кроме указанных главных ЖК идентифицирован ряд минорных ЖК (С12:0, С14:0, С13:0 и др.). Широкий диапазон изменчивости содержания различных ЖК и активности десатураз связан с видовыми особенностями. Расчет активности ацил-липидных десатураз, катализирующих введение двойных связей в углеводородную цепь ЖК, показал, что наибольшую активность для исследованных видов галофитов проявляли десатуразы ω6 и ω3. При этом величина LDR, характеризующая активность ω3 десатуразы, была выше в хлоропластах S. perennans. У других видов величина LDR была ниже, чем у S. perennans, что компенсировалось большей активностью ω9 десатуразы. Что касается динамики состава ЖК, обнаружена общая тенденция увеличения доли НЖК в вечернее время у всех исследованных растений. При этом ИН у растений S. perennans и A. santonica снижался, а у L. gmelinii оставался постоянным.
Таблица 2.
Жирнокислотный состав пластидных липидов листьев галофитов в течение дня
| ЖК | Состав ЖК, масс. % от суммы | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| S. perennans | L. gmelinii | A. santonica | |||||||
| утро (9:00) | день (14:00) | вечер (20:00) | утро (9:00) | день (14:00) | вечер (20:00) | утро (9:00) | день (14:00) | вечер (20:00) | |
| С12:0 | 0.7 | 0.5 | 0.4 | 0.3 | 0.7 | 1.1 | 0.5 | 0.5 | 0.7 |
| С13:0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.5 | 0.0 |
| С14:0 | 0.6 | 1.2 | 1.2 | 0.8 | 1.0 | 1.6 | 1.2 | 1.3 | 2.0 |
| С15:0 | 0.2 | 0.7 | 1.8 | 0.0 | 0.0 | 0.0 | 0.0 | 0.6 | 0.6 |
| С16:0 | 18.1 | 19.0 | 18.1 | 23.8 | 21.4 | 21.0 | 18.0 | 17.8 | 20.0 |
| С16:1 n-9 | 3.2 | 3.4 | 4.0 | 1.7 | 2.0 | 2.3 | 1.9 | 2.4 | 2.0 |
| С17:1 | 0.3 | 0.2 | 0.3 | 0.0 | 0.3 | 0.2 | 0.2 | 0.5 | 0.8 |
| С18:0 | 1.7 | 2.1 | 2.4 | 2.7 | 1.9 | 2.5 | 3.7 | 4.0 | 3.6 |
| С18:1n-9 | 1.7 | 2.1 | 3.6 | 3.8 | 8.3 | 5.4 | 7.9 | 8.5 | 7.7 |
| C18:1 n-11 | 0.4 | 0.3 | 0.4 | 0.7 | 1.3 | 0.6 | 0.0 | 0.0 | 0.0 |
| C18:2 n-6 | 9.4 | 11.0 | 7.4 | 19.7 | 14.8 | 15.1 | 18.4 | 16.0 | 23.5 |
| C19:0 | 0.3 | 0.4 | 0.4 | 0.0 | 0.0 | 0.5 | 0.0 | 0.4 | 0.0 |
| C18:3 n-3 | 63.0 | 58.3 | 59.3 | 43.8 | 46.6 | 48.7 | 45.2 | 43.8 | 34.7 |
| С20:0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 1.8 |
| C22:2 | 0.2 | 0.4 | 0.2 | 1.8 | 1.2 | 0.7 | 0.5 | 2.0 | 1.7 |
| C24:0 | 0.2 | 0.4 | 0.5 | 0.9 | 0.5 | 0.3 | 2.5 | 0.4 | 0.9 |
| С24:1 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 1.3 | 0.0 |
| НЖК | 21.7 | 24.3 | 25.0 | 28.5 | 25.8 | 27.1 | 25.9 | 25.4 | 29.6 |
| ННЖК | 78.3 | 75.6 | 75.0 | 71.5 | 74.5 | 72.1 | 74.1 | 74.6 | 70.4 |
| ИН | 2.1 | 2.0 | 2.0 | 1.8 | 1.8 | 1.8 | 1.8 | 1.8 | 1.6 |
| SDR | 0.5 | 0.5 | 0.6 | 0.6 | 0.8 | 0.7 | 0.7 | 0.7 | 0.7 |
| ODR | 1.0 | 1.0 | 0.9 | 0.9 | 0.8 | 0.9 | 0.9 | 0.8 | 0.9 |
| LDR | 0.9 | 0.9 | 0.9 | 0.7 | 0.8 | 0.8 | 0.7 | 0.7 | 0.6 |
| Сумма ЖК | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
ОБСУЖДЕНИЕ
Проведенные исследования позволили выявить характер и степень изменчивости структурных и функциональных параметров, ответственных за фотосинтетическую функцию растений галофитов, в естественных условиях произрастания в ответ на изменения температуры и интенсивности света в течение дня. У всех исследованных галофитов наблюдали снижение скорости наблюдаемого поглощения СО2. Избыточная инсоляция, повышение температуры в дневное время в совокупности с засолением могут служить теми факторами, которые оказывают значительное влияние на фотосинтетические параметры растений. Однако степень изменений была различной. Если скорость поглощения СО2 в листьях S. perennans и A. santonica снижалась в дневное время на 40%, то у криногалофита L. gmelinii – не более чем на 20%. Причем скорость поглощения СО2 у растений S. perennans, накапливающих соли в клетках надземных органов, и растений A. santonica, предотвращающих их накопление, была пятикратно выше, чем в листьях растений L. gmelinii, имеющих солевыделительные системы. Ранее было показано, что S. perennans обладает более крупными клетками мезофилла и большим числом хлоропластов в клетке, что, может способствовать большей эффективности фотосинтеза растений, которые аккумулируют соли внутри клетки [27].
Полуденная депрессия фотосинтеза и низкая освещенность в вечернее время приводили к снижению содержания фотосинтетических пигментов у растений S. perennans и A. santonica. Поскольку в наших исследованиях концентрация соли в почве не менялась, то выявленные изменения, по-видимому, определяются изменением свето-температурного режима. Однако общее снижение содержания хлорофилла в дневное время у всех трех видов галофитов свидетельствует скорее о частичной редукции ФА. Снижение концентрации зеленых пигментов также может быть одним из способов защиты от избыточной инсоляции, как было показано на листьях растений, произрастающих на полном свету [28]. Однако и в этом случае степень изменчивости содержания пигментов была разная. Обычно в зеленых листьях растений в течение суток обновляется до 10% пигментов [29]. В листьях S. perennans и A. santonica степень изменения содержания зеленых пигментов в течение дня составляла 20–30%, а каротиноидов – 25% (у A. santonica). В отличие от них у растений L. gmelinii суммарное содержание хлорофиллов а и b было стабильным. Большая вариативность содержания зеленых пигментов была характерна для растений, которые способны накапливать соли или предотвращать их поступление в клетки надземных органов.
Существует предположение, что структура хлоропласта более уязвима в сравнении с фотосинтетической активностью [14]. Результаты анализа соотношения липидов и хлорофилла показывают, что данный параметр претерпевает более существенные изменения в сравнении с пигментным пулом. Для растений, у которых выявлены эти изменения – эугалофита S. perennans и гликогалофита A. santonica – данный показатель увеличивался в течение дня в 1.5–2 раза. Эти виды отличались от криногалофита L. gmelinii и большей скоростью поглощения/выделения СО2. Поскольку ключевые компоненты ФА – пигмент-белковые комплексы – характеризуются постоянством состава и структуры, то обнаруженные изменения могут говорить об адаптивных перестройках, связанных с изменением числа этих комплексов или их соотношения в мембранах тилакоидов.
Ранее нами показано снижение величины Fv/Fm в листьях исследованных галофитов в дневное время, что свидетельствует о снижении функциональной активности ФС II вследствие фотоингибирования и развития окислительного стресса [27]. В то же время, восстановление в вечернее время максимального квантового выхода ФС II свидетельствует о сбалансированности процессов разрушения и репарации пигмент-белковых комплексов. Эти данные, наряду со снижением содержания хлорофилла, а также изменением отношения пластидные липиды/пигменты, свидетельствуют о структурной реорганизации ФА.
Целостность и состояние мембран тилакоидов имеют ключевое значение для эффективного функционирования ФА [4]. Данные липидного анализа свидетельствуют о специфичной дневной динамике компонентов, отвечающих за структуру мембран, у растений с разным типом соленакопления. В частности, характерными были изменения в относительном содержании незаряженных глицеролипидов – МГДГ и ДГДГ (рис. 5). Известно, что МГДГ способствует физическому взаимодействию ССК с ядром ФС II и увеличивает их энергетическую связь [3]. Снижение доли МГДГ может отрицательно повлиять на фотозащитную способность и уменьшить фотостабильность ФС II, особенно при длительном воздействии света высокой интенсивности [27]. С другой стороны, переналадка липидного состава за счет снижения МГДГ и увеличения ДГДГ способствует предотвращению разрыва двухслойных мембран. Следует отметить также, что у мутантов, неспособных синтезировать ДГДГ, появлялась термическая нестабильность ФС II по сравнению с диким типом [30]. Не исключено, что возрастание доли ДГДГ связано с повышением термоустойчивости растений. По-видимому, компенсаторные изменения содержания этих галактолипидов являются ответом на повышение температуры воздуха в полдень. Этот эффект в большей степени выражен у эугалофита S. perennans и у гликогалофита A. santonica.
Изменение соотношения анионных глицеролипидов – ФГ и СХДГ, было характерно для криногалофита L. gmelinii и гликогалофита A. santonica (рис. 5). Однако в первом случае соотношение ФГ/СХДГ возрастало в течение дня, а во втором – наоборот, снижалось. Оба липида несут отрицательный заряд и повышают стабильность мембран за счет электростатических взаимодействий. Галактолипиды МГДГ и ДГДГ не могут функционально заменить ФГ, несмотря на то, что образуют тилакоидные мембраны и без его присутствия. В отличие от них СХДГ способен компенсировать истощение ФГ и тем самым восстанавливать баланс анионных липидов в листьях высших растений для повышения стабильности мембран [3]. На примере Chlamydomonas показано, что активность ФС II восстанавливалась добавлением СХДГ в клетки [16]. Можно предполагать, что у растений A. santonica, обладающих большей интенсивностью поглощения СО2 в суточном цикле, чем растения L. gmelinii, повышение доли СХДГ в составе липидов способствовало поддержанию активности ФС II на более высоком уровне.
Полученные данные подтверждают способность ФА к перестройке к непрерывно меняющимся условиям освещения и температуры в течение дня. Дополнительным свидетельством участия липидов в адаптации ФА является изменение состава ЖК и активности десатураз. Было установлено, что активность десатуразы ω6 была выше, чем десатуразы ω3. Как известно, наличие в мембранных липидах линолевой кислоты – продукта ω6- ацил-липидной десатурации, является критическим и достатачным условием для формирования характерной для организма текучести мембраны [20]. Снижение ее активности, наблюдаемое в липидах хлоропластов A. santonica и S. perennans в течение дня, направлено на ограничение текучести мембран, вызванное изменением свето-температурного режима для предотвращения дезинтеграции липидного бислоя. Однако в целом текучесть мембран в исследованных галофитах регулируется таким образом, чтобы поддерживать их стабильность за счет изменения соотношения ННЖК/НЖК.
Таким образом, проведено сравнительное исследование структурно-функциональных параметров разных типов галофитов в естественных условиях произрастания в ответ на меняющиеся условия освещения и температуры. Установлено, что наибольшую фотосинтетическую активность по СО2 газообмену проявляли эугалофит S. perennans и гликогалофит A. santonica в сравнении с криногалофитом L. gmelinii. С изменением свето-температурного режима скорость СО2 газообмена у всех видов галофитов снижалась. При этом наблюдали изменения в содержании пигментов и тилакоидных липидов, свидетельствующие о мобильности ФА. Характер реорганизации ФА был специфичен: большая изменчивость нейтральных липидов (МГДГ/ДГДГ) обнаружена у S. perennans и A. santonica, а анионных липидов (ФГ/СХДГ) – у L. gmelinii. Текучесть мембран регулируется путем изменения соотношения ННЖК/НЖК. Все выявленные структурно-функциональные перестройки ФА, связанные с динамикой пигмент-липидного фонда тилакоидных мембран, являются адаптивными и направлены на оптимизацию процесса фотосинтеза к условиям окружающей среды.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Amiri B., Assareh M.H., Jafari M., Rasuoli B., Arzani H., Jafari A.A. Effect of salinity on growth, ion content and water status of glasswort (Salicornia herbacea L.) // Casp. J. Environ. Sci. 2010. V. 8. № 1. P. 79.
Кособрюхов А.А. Активность фотосинтетического аппарата при периодическом повышении концентрации СО2 // Физиология растений. 2009. Т. 56. С. 8.
Rozentsvet O.A., Nesterov V.N., Bogdanova E.S. Structural, physiological, and biochemical aspects of salinity tolerance of halophytes // Rus. J. Plant Physiol. 2017. V. 64. P. 464.
Allakhverdiev S.I. Photosynthesis. New approaches to the molecular, cellular, and organismal levels. Scrivener Publishing, 2016. 386 p.
Wahid A. Physiological significance of morpho-anatomical features of halophytes with particular reference to Cholistan flora // Int. J. Agri. Biol. 2003. V. 5. № 2. P. 207.
Rozentsvet O.A., Nesterov V.N., Bogdanova E.S., Kosobryukhov A.A., Subova S.N., Semenova G.A. Structural and molecular strategy of photosynthetic apparatus organization of wild flora halophytes // Plant Physiol. Biochem. 2018. V. 129. P. 213.
Rozentsvet O.A., Nesterov V.N., Bogdanova E.S., Tabalenkova G.N., Zakhozhiy I.G. Biochemical conditionality of differentiation of halophytes by the type of regulation of salt metabolism in Prieltonye // Contemp. Prob. Ecol. 2016. V. 9. № 1. P. 98.
Flowers T.J., Colmer T.D. Salinity tolerance in halophytes // New Phytol. 2008. V. 179. P. 945.
Sudhir P., Murthy S.D.S. Effects of salt stress on basic processes of photosynthesis // Photosynthetica. 2004. V. 42. P. 481.
Nevo R., Charuvi D., Tsabari O., Reich Z. Composition, architecture and dynamics of the photosynthetic apparatus in higher plants // Plant J. 2012. V. 70. № 1. P. 157.
Liberton M., Pakrasi H. Membrane systems in cyanobacteria / The Cyanobacteria: Molecular Biology, Genomics and Evolution / Herrero A., Flores E. (Eds.). Caister Academic Press, Norfolk, UK, 2008. P. 271.
Nevo R., Chuartzman S.G., Tsabari O., Reich Z., Charuvi D., Shimoni E. Architecture of thylakoid membrane networks / Advances in Photosynthesis and Respiration: Lipids in Photosynthesis, Essential and Regulatory Functions / Wada H., Murata N. (Eds.). Springer Dordrecht, The Netherlands, 2009. V. 30. P. 295.
Sui N., Li M., Li K., Song J., Wang B.-S. Increase in unsaturated fatty acids in membrane lipids of Suaeda salsa L. enhances protection of photosystem II under high salinity // Photosynthetica. 2010. V. 48. P. 623.
Ladygin V.G. Structural and functional organization of photosystems in Chlamydomonas reinhardtii chloroplasts // Rus. J. Plant Physiol. 1998. V. 45. P. 655.
Hirayama O., Mihara M. Characterization of membrane lipids of higher plants different in salt tolerance // Agric. Biol. Chem. 1987. V. 51. P. 3215.
Minoda A., Sonoike K., Okada K., Sato N., Tsuzuki M. Decrease in the efficiency of the electron donation to tyrosine Z of photosystem II in an SQDG-deficient mutant of Chlamydomonas // FEBS Lett. 2003. V. 553. P. 109.
Wu J., Seliskar D., Gallagher J. The response of plasma membrane lipid composition in callus of the halophyte Spartina patens (Poaceae) to salinity stress // Am. J. Bot. 2005. V. 92. P. 852.
Yamamoto Y., Kai S., Ohnishi A., Tsumura N., Ishikawa T., Hori H., Morita N., Ishikawa Y. Quality control of PSII: behavior of PSII in the highly crowded grana thylakoid under excessive light // Plant Cell Physiol. 2014. V. 55. P. 1206.
Allakhverdiev S.I., Nishiyama Y., Suzuki I., Tasaka Y., Murata N. Genetic engineering of the unsaturation of fatty acids in membrane lipids alters the tolerance of Synechocystis to salt stress // Prog. Natl. Acad. Sci. USA. 1999. V. 96. № 10. P. 5862.
Лось Д.А. Десатуразы жирных кислот. Москва: Научный мир, 2014. 346 с.
Lichtenthaler H.K., Buschmann C. Chlorophylls and carotenoids – measurement and characterization by UV-VIS // Cur. Prot. Food Anal. Chem. 2001.
Ivanova L.A., Yudina P.K., Ronzhina D.A., Ivanov L.A., Hölzel N. Quantitative mesophyll parameters rather than whole-leaf traits predict response of C3 steppe plants to aridity // New Phytol. 2017. V. 217. № 2. P. 558.
Andersson B., Anderson J.M. Lateral heterogeneity in the distribution of chlorophyll-protein complexes of the thylakoid membranes of spinach chloroplasts // Biochim. Biophys. Acta. 1980. V. 593. № 2. P. 427.
Lichtenthaller H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Meth. Enzym. 1987. V. 148. P. 350.
Кейтс М. Техника липидологии. Москва: Мир, 1975. 323 с.
Романова И.М., Живетьев М.А., Дудаева Л.В., Граскова И.А. Динамика жирнокислотного состава и активности ацил-липидных десатураз в хвое Pinus sylvestris L., произрастающей в Иркутской области // Химия растит. сырья. 2016. № 2. С. 61.
Rozentsvet O.A., Bogdanova E.S., Ivanova L.A., Ivanov L.A., Tabalenkova G.N., Zakhozhiy I.G., Nesterov V.N. Structural and functional organisation of the photosynthetic apparatus in halophytes with different strategies of salt tolerance // Photosynthetica. 2016. V. 24. P. 405.
Golovko T.K., Dalke I.V., Zakhozhiy I.G., Tabalenkova G.N. Functional plasticity and stability of the photosynthetic apparatus Plantago media by photoinhibition // Rus. J. Plant Physiol. 2011. V. 58. P. 490.
Мокроносов А.Т., Гавриленко В.Ф. Фотосинтез. Физиолого-экологические и биохимические аспекты. Москва: МГУ, 1992. 320 с.
Wu W., Ping W., Wu H., Li M., Gu D., Xu Y. Monogalactosyldiacylglycerol deficiency in tobacco inhibits the cytochrome b 6 f-mediated intersystem electron transport process and affects the photostability of the photosystem II apparatus // Biochim. Biophys. Acta. 2013. V. 1827. № 6. P. 709.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



