Физиология растений, 2020, T. 67, № 1, стр. 84-95
Влияние скорости тепловой акклимации на полярные липиды Ulva lactuca
М. Ю. Баркина a, *, Л. А. Помазёнкова a, Н. С. Чопенко a, П. В. Веланский a, Э. Я. Костецкий a, Н. М. Санина a
a Дальневосточный федеральный университет
Владивосток, Россия
* E-mail: marybarkin@yandex.ru
Поступила в редакцию 19.02.2019
После доработки 01.05.2019
Принята к публикации 05.06.2019
Аннотация
Изучена способность морской макроводоросли ульвы лактука Ulva lactuca (L.) приспосабливать липидный матрикс мембран к повышенной температуре морской воды в зависимости от скорости тепловой акклимации. Растения собирали в заливе Петра Великого Японского моря зимой при 4°С и акклимировали к летней температуре (20°С) с разной скоростью: 16 или 2°С/сут. Жирнокислотный состав и тепловые переходы кристалл–жидкий кристалл гликолипидов (моногалактозилдиацилглицерола, дигалактозилдиацилглицерола, сульфохиновозилдиацилглицерола) и бетаинового липида 1,2-диацилглицеро-(N,N,N-триметил)-гомосерина (ДГТС), выделенных из U. lactuca, были исследованы с помощью ГЖХ, ВЭЖХ-МС и дифференциальной сканирующей калориметрии соответственно. Показана зависимость результатов температурной акклимации от ее скорости. Так, при быстрой тепловой акклимации происходило снижение соотношений n-3/n-6 полиненасыщенных ЖК и ненасыщенные/насыщенные ЖК, а также индекса ненасыщенности ЖК состава липидов, что соответствовало сезонным изменениям. Однако при меньшей скорости прогрева данная тенденция не сохранялась, или даже происходили обратные изменения. Перераспределение состава молекулярных форм гликолипидов в акклимированных водорослях приводило не только к поддержанию температуры максимума теплопоглощения тепловых переходов (Тmaх), но и фазового разделения гликолипидов. Это способствовало подгонке профилей термограмм к таковым летних образцов. Наиболее эффективно изменялся калориметрический переход ДГТС: даже при быстрой акклимации достигалось значение Tmax летнего образца. В целом, U. lactuca проявила способность адаптировать липидный матрикс мембран при различных скоростях прогрева морской воды.
ВВЕДЕНИЕ
Морские макрофиты (макроводоросли и травы) – важный компонент морских экосистем. Они являются главными продуцентами кислорода и органического вещества в Мировом океане. Это ценный пищевой ресурс, а также источник различных биоактивных веществ, полезных для здоровья человека. Поэтому изучение механизмов адаптации морских макрофитов важно для понимания динамики морских экосистем и рациональной марикультуры.
Изменения в составе мембранных липидов являются ключевым молекулярным механизмом адаптации эктотермных организмов, в том числе морских растений, к колебаниям температуры окружающей среды [1]. Этот механизм, получивший название гомеовязкостной адаптации [2], в первую очередь связан с изменением жирнокислотного состава полярных липидов и направлен на поддержание оптимального для функционирования жидкокристаллического состояния липидного матрикса биомембран.
Предыдущие исследования основных полярных липидов выявили ряд общих закономерностей при акклиматизации морских макрофитов Японского моря от зимы к лету. В частности, наблюдалось снижение соотношения между содержанием ненасыщенных ЖК к насыщенным (НЖК), которое сопровождалось значительным снижением соотношения между содержанием полиненасыщенных ЖК (ПНЖК) n-3 ряда и n-6 ПНЖК. Возрастание доли n-6 ПНЖК летом, вероятно, связано с потребностью в более сильных n-6 оксилипинах, чем в оксилипинах, образующихся из n-3 ПНЖК [3], в период наибольшей физиологической активности морских макрофитов. Несмотря на значительные изменения этих соотношений в липидах тилакоидных мембран (гликолипидах и фосфатидилглицероле), температуры максимумов теплопоглощения их тепловых переходов (Tmax) не повышались, в отличие от фосфатидилхолина (ФХ), фосфатидилэтаноламина (ФЭ) и 1,2-диацилглицеро-(N,N,N-триметил)-гомосерина (ДГТС), не задействованных в фотосинтетических процессах [4]. Такое же термотропное поведение гликолипидов, не соответствующее классическим представлениям о гомеовязкостной адаптации, отмечалось при сравнении полярных липидов Ulva lactuca из разных климатических зон [5].
Согласно последним прогнозам, повышение средних температур в океане будет сопровождаться частыми и резкими колебаниями температуры [6]. Следовательно, в условиях усиления вариабельности температуры окружающей среды скорость тепловой акклимации будет иметь большое значение, так как быстро акклимирующиеся виды смогут получить конкурентные преимущества при внезапных изменениях температуры [7]. Поэтому, при рассмотрении способности организмов к тепловой акклимации в качестве ключевого фактора их устойчивости к изменению климата, необходимо учитывать скорость акклимации [8]. Однако до настоящего времени эффект скорости температурной акклимации на эктотермные организмы мало изучен.
С этой точки зрения U. lactuca представляет собой удобный объект для изучения влияния скорости тепловой акклимации на адаптационные процессы морских макрофитов, так как она является очень пластичным в экологическом отношении видом. U. lactuca относится к литоральным водорослям, для которых характерна способность переносить как аномально низкую, так и высокую температуру [9]. В литоральной зоне, в отличие от других зон моря, наиболее резко выражены колебания температуры. Во время приливов, которые могут иметь разную продолжительность (0.5–1 суток и более), температура морской воды может повышаться от низких (зимних) температур до высоких (летних) [10]. Показано, что температура значительно влияет на рост и репродукцию U. lactuca. При 10°С наблюдается оптимальный рост талломов, который подавляется при повышении или понижении температуры морской воды на 5°С [11]. Рабочая гипотеза исследования базируется на предположении о том, что способность U. lactuca приспосабливаться к резким колебаниям температуры связана на молекулярном уровне с быстрыми компенсаторными изменениями в липидном матриксе биологических мембран, большая часть которых в растениях представлена мембранами тилакоидов.
Целью настоящей работы явилось исследование адаптационных изменений в главных липидах мембран морской макроводоросли U. lactuca в зависимости от скорости ее тепловой акклимации. В связи с этим была поставлена следующая задача: исследовать ЖК состав и термотропное поведение гликолипидов моногалактозилдиацилглицерола (МГДГ), дигалактозилдиацилглицерола (ДГДГ) и сульфохиновозилдиацилглицерола (СХДГ), которые являются основными компонентами тилакоидных мембран растений [12], а также основного структурообразующего липида экстрапластидных мембран – ДГТС [13] U. lactuca при быстрой (16°С/сут) и медленной (2°С/сут) акклимации от зимней температуры (4°С) к летней (20°С).
МАТЕРИАЛЫ И МЕТОДЫ
Сбор растительного материала и постановка эксперимента по тепловой акклимации. Талломы U. lactuca L. (Chlorophyta) собирали в Заливе Петра Великого Японского моря в феврале при температуре воды 4°C на глубине 1.5–3 м. Собранные водоросли (по 500 г сырой массы) помещали в термостатируемые аквариумы с морской водой (объем – 100 л) при 4°C. Аквариумы были оснащены системой аэрации и рециркуляции воды, что обеспечивало не только насыщение воды кислородом, но и выравнивание температуры воды по всему объему аквариума. Освещенность – 40 мкЕ/(м2 с) при фотопериоде 12/12 ч свет/темнота. Температуру воды поднимали до 20°С со скоростью 16°С/сут (быстрая акклимация) или 2°С/сут (медленная акклимация) в установленном автоматическом режиме. Также использовали талломы водорослей, собранные в феврале и августе при температуре воды 4 и 20°C соответственно. Эксперименты проводили в трех повторностях.
Водоросли очищали от эпифитов и мелких беспозвоночных и затем помещали в кипящую воду на 2 мин для инактивации липолитических ферментов.
Экстракция и выделение липидов. Экстракт общих липидов получали по методу Блайя и Дайера [14]. Индивидуальные липиды выделяли из полученного экстракта с помощью колоночной хроматографии на силикагеле при последовательном элюировании системой растворителей хлороформ/ацетон (1 : 1, об./об.), ацетоном и смесью ацетон : бензол : уксусная кислота : вода (200 : 30 : 3 : 10, об./об.) [15]. Дополнительную очистку гликолипидов проводили с помощью препаративной одномерной ТСХ на силикагеле последовательно в системах хлороформ : ацетон (1 : 1, об./об.) и ацетон : бензол : вода (91 : 30 : 6, об./об.). ДГТС дочищали в системах хлороформ : ацетон (1 : 1, об./об.) и хлороформ : ацетон : метанол : уксусная кислота : вода (30 : 40 : 10 : 10 : 5, об./об.). Чистоту липидов проверяли с помощью двумерной ТСХ на силикагеле [16]. Процедуру выделения индивидуальных липидов повторяли трижды.
Анализ жирнокислотного состава липидов. Анализ жирных кислот хроматографически чистых липидных препаратов проводили с помощью ГЖХ, как описано ранее [4]. Этерификацию липидов выполняли с помощью системы ацетилхлорид : метанол (1 : 10, об./об.) при 95°С в течение 1 ч. Метиловые эфиры жирных кислот (МЭЖК) экстрагировали н-гексаном и дочищали с помощью ТСХ. Анализ МЭЖК проводили на газожидкостном хроматографе Agilent 6890 с пламенно-ионизационным детектором, в капиллярной колонке HPInnovax (30 м × 0.25 мм). В качестве газа-носителя использовали гелий (He). Колонку термостатировали при 200°С. Идентификацию МЭЖК проводили по времени удерживания на основании расчета эквивалентной длины цепи [17] и путем сравнения с известными стандартами. Процентное содержание каждой жирной кислоты рассчитывали по методу Кэррола [18]. Индекс ненасыщенности (ИН) рассчитывали по формуле:
где Рi – содержание i-той ЖК (%), ei – число двойных связей в i-той ЖК.Анализ состава молекулярных видов липидов. Анализ молекулярных видов липидов проводили методом ВЭЖХ на хроматографе Shimadzu-LC20 с масс-спектрометрическим детектором LCMS-2010EV с электроспрей-ионизацией. Колонку Ascentis C18 (25 см × 2.1 мм, размер частиц силикагеля 5 мкм) термостатировали при 45°С. Разделение проводили в непрерывном потоке растворителей (5 мМ водный раствор ацетата аммония : метанол : изопропанол) при скорости потока 0.3 мл/мин со следующими интервалами постоянного состава элюента: 0 мин – 6 : 92 : 2, 30 мин – 6 : 79 : 15, 35–38 мин – 6 : 69 : 25, об./об. для МГДГ, ДГДГ и СХДГ; 0 мин – 6 : 92 : 2, 45 мин – 6 : 86 : 8, 50–65 мин – 6 : 54 : 40, об./об. для ДГТС. Детекцию МГДГ, ДГДГ и ДГТС проводили в режиме положительных ионов, а СХДГ – в режиме отрицательных ионов. Содержание аналитов рассчитывали по площади хроматографических пиков их квазимолекулярных ионов [18].
Калориметрия. Термотропное поведение хроматографически чистых липидов исследовали методом дифференциальной сканирующей калориметрии (ДСК), как описано ранее [4]. Образцы липидов, растворенные в хлороформе, помещали в стандартные алюминиевые контейнеры и высушивали под вакуумом до постоянной массы (около 10 мг), запаковывали и помещали в измерительную ячейку дифференциального сканирующего калориметра ДСМ-2М (ИБП РАН, Пущино, Россия). Образцы нагревали со скоростью 16°С/мин в интервале от –135 до 80°С при чувствительности 5 мВт. За температуру теплового перехода принимали температуру максимума теплопоглощения (Tmax). Температурный диапазон калибровали с использованием реперных образцов нафталина, ртути и индия.
Статистический анализ. Полученные результаты представлены в виде средних арифметических значений ± доверительный интервал, n = 9. Данные анализировали с использованием t-критерия Стьюдента. Различия между средними арифметическими значениями считали достоверными при Р ≤ 0.05.
РЕЗУЛЬТАТЫ
Для сравнительной оценки эффективности адаптационных перестроек в липидах U. lactuca в зависимости от скорости тепловой акклимации был исследован жирнокислотный состав и термотропное поведение гликолипидов и ДГТС U. lactuca, собранной в летний и зимний периоды (рис. 1, табл. 1–4). Полученные результаты согласуются с ранее опубликованными данными [4, 19].
Рис. 1.
Типичные ДСК термограммы гликолипидов МГДГ (а), ДГДГ (б), СХДГ (в) и бетаинового липида ДГТС (г) Ulva lactuca при быстрой, 16°С/сут ($ - \circ - $) и медленной, 2°С/сут ($ - \centerdot - $) акклимации, а также летом (-----) и зимой ($ - - - $). Вертикальная линия составляет 1 мВт. Скорость сканирования 16°С/мин. Вес образца 10 мг. Каждый образец сканирован минимум 3 раза.
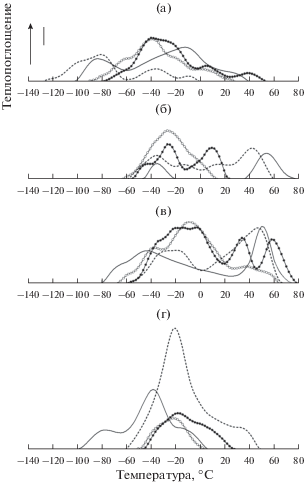
Таблица 1.
Состав жирных кислот МГДГ Ulva lactuca в зависимости от скорости тепловой акклимации (% от суммы жирных кислот)
| Жирные кислоты | Зима | Быстрая
акклимация, 16°С/сут |
Медленная акклимация, 2°С/сут |
Лето |
|---|---|---|---|---|
| 16:4 n-3 | 43.5 ± 0.2a | 43.4 ± 0.1a | 44.6 ± 0.1b | 43.2 ± 0.1a |
| 18:3 n-3 | 17.6 ± 0.3a | 22.3 ± 0.1b | 16.4 ± 0.2c | 23.8 ± 0.1d |
| 18:4 n-3 | 32.4 ± 0.3a | 27.1 ± 0.2b | 32.7 ± 0.3a | 24.0 ± 0.1c |
| НЖК | 1.0 ± 0.1a | 1.3 ± 0.2a | 1.2 ± 0.2a | 2.2 ± 0.2b |
| МНЖК | 1.7 ± 0.2a | 1.8 ± 0.3a | 1.9 ± 0.2a | 3.1 ± 0.3b |
| ПНЖК | 97.3 ± 0.2a | 96.9 ± 0.3a | 96.9 ± 0.4a | 94.7 ± 0.2b |
| n-3 ПНЖК | 96.2 ± 0.2a | 95.0 ± 0.1b | 95.9 ± 0.2a | 92.4 ± 0.1c |
| n-6 ПНЖК | 1.1 ± 0.2a | 1.8 ± 0.2b | 1.0 ± 0.2a | 2.4 ± 0.2c |
| n-3/n-6 ПНЖК | 85.4 ± 0.2a | 51.5 ± 0.3b | 91.6 ± 0.3c | 38.9 ± 0.2d |
| ИН | 370 ± 2a | 362 ± 3b | 370 ± 2a | 353 ± 3c |
| ненасыщ./насыщ. | 102.0 ± 0.2a | 76.7 ± 0.3b | 82.3 ± 0.2c | 44.8 ± 0.2d |
Примечание. Жирные кислоты, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты; ИН – индекс ненасыщенности; ненасыщ./насыщ. – ненасыщенные/насыщенные жирные кислоты. Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждой ЖК.
Таблица 2.
Состав жирных кислот ДГДГ Ulva lactuca в зависимости от скорости тепловой акклимации (% от суммы жирных кислот)
| Жирные кислоты | Зима | Быстрая акклимация, 16°С/сут | Медленная акклимация, 2°С/сут | Лето |
|---|---|---|---|---|
| 16:0 | 12.9 ± 0.2a | 12.3 ± 0.4a | 14.4 ± 0.1b | 26.9 ± 0.2c |
| 16:3 n-3 | 23.5 ± 0.3a | 19.2 ± 0.1b | 16.7 ± 0.2c | 3.9 ± 0.2d |
| 16:4 n-3 | 3.9 ± 0.4a | 7.7 ± 0.2b | 9.7 ± 0.2c | 2.8 ± 0.1d |
| 18:1 n-7 | 3.0 ± 0.1a | 4.1 ± 0.1b | 5.4 ± 0.1c | 5.4 ± 0.4c |
| 18:2 n-6 | 6.9 ± 0.2a | 8.7 ± 0.3b | 7.3 ± 0.2a | 15.4 ± 0.1c |
| 18:3 n-3 | 41.1 ± 0.5a | 33.6 ± 0.2b | 31.4 ± 0.1c | 15.0 ± 0.3d |
| 18:4 n-3 | 2.9 ± 0.2a | 4.5 ± 0.3b | 7.2 ± 0.2c | 25.8 ± 0.2d |
| НЖК | 15.8 ± 0.2a | 18.3 ± 0.4b | 18.9 ± 0.1c | 28.6 ± 0.2d |
| МНЖК | 4.9 ± 0.2a | 6.8 ± 0.3b | 7.7 ± 0.1c | 8.2 ± 0.2d |
| ПНЖК | 79.3 ± 0.2a | 74.9 ± 0.1b | 73.4 ± 0.2c | 63.2 ± 0.2d |
| n-3 ПНЖК | 69.0 ± 0.3a | 60.8 ± 0.2b | 58.1 ± 0.2c | 22.0 ± 0.2d |
| n-6 ПНЖК | 6.9 ± 0.2a | 8.7 ± 0.3b | 7.3 ± 0.2a | 15.4 ± 0.1c |
| n-3/n-6 ПНЖК | 10.0 ± 0.2a | 7.0 ± 0.2b | 7.9 ± 0.2c | 1.4 ± 0.1d |
| ИН | 242 ± 3a | 232 ± 3b | 235 ± 2b | 212 ± 2c |
| ненасыщ./насыщ. | 5.3 ± 0.3a | 4.5 ± 0.2b | 4.3 ± 0.3b | 2.5 ± 0.2c |
Примечание. Жирные кислоты, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты; ИН – индекс ненасыщенности; ненасыщ./насыщ. – ненасыщенные/насыщенные жирные кислоты. Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждой ЖК.
Таблица 3.
Состав жирных кислот СХДГ Ulva lactuca в зависимости от скорости тепловой акклимации (% от суммы жирных кислот)
| Жирные кислоты | Зима | Быстрая акклимация, 16°С/сут | Медленная акклимация, 2°С/сут | Лето |
|---|---|---|---|---|
| 16:0 | 46.9 ± 0.3a | 53.0 ± 0.1b | 54.2 ± 0.2c | 58.2 ± 0.2d |
| 18:1 n-7 | 19.4 ± 0.1a | 20.0 ± 0.1b | 19.3 ± 0.2a | 15.3 ± 0.1c |
| 18:3 n-3 | 28.2 ± 0.4a | 19.6 ± 0.2b | 20.5 ± 0.1c | 18.4 ± 0.3d |
| НЖК | 47.7 ± 0.3a | 54.1 ± 0.1b | 55.6 ± 0.2c | 60.1 ± 0.3d |
| МНЖК | 20.3 ± 0.1a | 21.5 ± 0.3b | 20.5 ± 0.2a | 17.4 ± 0.2c |
| ПНЖК | 32.0 ± 0.3a | 24.4 ± 0.3b | 23.9 ± 0.3b | 22.5 ± 0.2c |
| n-3ПНЖК | 29.9 ± 0.3a | 22.0 ± 0.2b | 22.2 ± 0.1b | 20.4 ± 0.2c |
| n-6ПНЖК | 1.9 ± 0.2a | 2.1 ± 0.2a | 1.5 ± 0.1b | 2.1 ± 0.1a |
| n-3/n-6 ПНЖК | 15.6 ± 0.2a | 10.6 ± 0.2b | 14.9 ± 0.1c | 9.8 ± 0.1d |
| ИН | 116 ± 2a | 93 ± 1b | 91 ± 2b | 84.5 ± 2c |
| ненасыщ./насыщ. | 1.1 ± 0.2a | 0.8 ± 0.2a | 0.8 ± 0.1a | 0.7 ± 0.2a |
Примечание. Жирные кислоты, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты; ИН – индекс ненасыщенности; ненасыщ./насыщ. – ненасыщенные/насыщенные жирные кислоты. Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждой ЖК.
Таблица 4.
Состав жирных кислот ДГТС Ulva lactuca в зависимости от скорости тепловой акклимации (% от суммы жирных кислот)
| Жирные кислоты | Зима | Быстрая акклимация, 16°С/сут | Медленная акклимация, 2°С/сут | Лето |
|---|---|---|---|---|
| 16:0 | 23.2 ± 0.2a | 35.1 ± 0.1b | 28.7 ± 0.2c | 35.1 ± 0.3b |
| 18:1 n-7 | 16.9 ± 0.1a | 16.4 ± 0.1b | 12.8 ± 0.3c | 8.3 ± 0.1d |
| 18:2 n-6 | 2.9 ± 0.1a | 3.7 ± 0.2b | 2.9 ± 0.2a | 6.8 ± 0.2c |
| 18:3 n-6 | 2.4 ± 0.1a | 2.8 ± 0.1b | 2.3 ± 0.1a | 5.4 ± 0.2c |
| 18:3 n-3 | 14.7 ± 0.1a | 8.3 ± 0.3b | 14.4 ± 0.2a | 14.4 ± 0.2a |
| 18:4 n-3 | 26.0 ± 0.2a | 15.9 ± 0.1b | 21.8 ± 0.3c | 15.6 ± 0.2b |
| 20:4 n-6 | 0.3 ± 0.2a | 0.5 ± 0.1a | 0.6 ± 0.1a | 4.8 ± 0.2b |
| 20:5 n-3 | 1.6 ± 0.1a | 1.2 ± 0.1b | 2.1 ± 0.1c | 3.5 ± 0.2d |
| 22:5 n-3 | 5.8 ± 0.2a | 4.5 ± 0.2b | 6.8 ± 0.3c | 0.9 ± 0.1d |
| НЖК | 24.3 ± 0.2a | 38.2 ± 0.1b | 30.1 ± 0.2c | 35.9 ± 0.3d |
| МНЖК | 19.3 ± 0.1a | 21.4 ± 0.1b | 15.2 ± 0.2c | 10.7 ± 0.2d |
| ПНЖК | 56.4 ± 0.1a | 40.4 ± 0.2b | 54.7 ± 0.1c | 53.4 ± 0.2d |
| n-3 ПНЖК | 50.2 ± 0.1a | 32.4 ± 0.2b | 47.9 ± 0.1c | 36.1 ± 0.2d |
| n-6 ПНЖК | 5.9 ± 0.1a | 7.4 ± 0.1b | 6.6 ± 0.1c | 17.3 ± 0.2d |
| n-3/n-6 ПНЖК | 8.5 ± 0.1a | 4.4 ± 0.2b | 7.3 ± 0.1c | 2.1 ± 0.2d |
| ИН | 227 ± 2a | 166 ± 3b | 217 ± 3c | 194 ± 4d |
| ненасыщ./насыщ. | 3.1 ± 0.1a | 1.6 ± 0.1b | 2.3 ± 0.1a | 1.8 ± 0.1a |
Примечание. Жирные кислоты, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты; ИН – индекс ненасыщенности; ненасыщ./насыщ. – ненасыщенные/насыщенные жирные кислоты. Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждой ЖК.
Жирнокислотный состав липидов U. lactuca
При быстрой тепловой акклимации значения общих параметров жирнокислотного состава МГДГ (ИН, ненасыщенные/насыщенные ЖК и соотношение между n-3 и n-6 полиненасыщенными ЖК (n-3/n-6 ПНЖК)) падали, но, как правило, не достигали летних уровней [4, 19]. Снижение скорости акклимации в 8 раз приводило к меньшим изменениям соотношения ненасыщенные/насыщенные ЖК, не влияло на ИН или даже вызывало обратный эффект в соотношении n-3/n-6 ПНЖК, которое возрастало по сравнению с зимним уровнем (табл. 1).
В акклимационный процесс вовлекались в основном две из трех главных ЖК МГДГ: 18:3 n-3 и 18:4 n-3, содержание которых при быстрой акклимации изменялось в противоположных направлениях, но в обоих случаях акклимационные изменения соответствовали сезонным трендам. При увеличении периода акклимации эти параметры практически не изменялись по сравнению с их значениями в зимний период. Судя по стабильному содержанию 16:4 n-3, эта ПНЖК не принимала участия в адаптационном процессе.
В процесс термоадаптации вовлекалось гораздо большее число ЖК в составе ДГДГ (табл. 2), чем в МГДГ. Большинство основных ЖК ДГДГ (16:3 n-3, 18:1 n-7, 18:3 n-3 и 18:4 n-3), в отличие от основных ЖК МГДГ, показало последовательное изменение их содержания в сторону летних значений при удлинении периода акклимации. Интересно, что при быстрой акклимации содержание 18:3 n-3 и 18:4 n-3 изменялось, как и в составе МГДГ, в противоположных направлениях. Однако в ДГДГ уровень 18:3 n-3 понижался, а 18:4 n-3 повышался в отличие от МГДГ. Причем подобные изменения также наблюдались в ДГДГ при смене сезона от зимы к лету. При медленной акклимации изменения в содержании 18:3 n-3 и 18:4 n-3, отмеченные при быстрой акклимации, усиливались в ДГДГ, в отличие от МГДГ. Однако тренд, который наблюдался в содержании линолевой кислоты (18:2 n-6) в результате быстрого прогрева, не усиливался при медленной акклимации, хотя в обоих случаях направление акклимационных изменений соответствовало сезонным изменениям. Содержание пальмитиновой кислоты (16:0) заметно менялось в сторону летних значений только после медленной акклимации. Необычными были изменения в содержании 16:4 n-3, которое резко увеличивалось примерно в 2 и 2.5 раза при быстрой и медленной акклимации соответственно по сравнению с зимними значениями в противоположность тенденции, отмеченной при сезонной акклиматизации от зимы к лету.
В целом, изменения общих параметров ЖК состава ДГДГ при быстрой акклимации были подобны изменениям в МГДГ, но, в отличие от МГДГ, разные скорости акклимации вызывали практически одинаковые эффекты (табл. 2).
Аналогично реагировали на изменение скорости тепловой акклимации общие параметры ЖК состава СХДГ. Суммарный результат акклимации определяли только две из трех основных ЖК в составе СХДГ – 16:0 и 18:3 n-3 (табл. 3), на долю которых приходилось приблизительно 70% от суммы ЖК. Как и в галактолипидах, значения главных параметров общей ненасыщенности ЖК СХДГ U. lactuca снижались при тепловой акклимации, но в меньшей степени, чем при сезонной акклиматизации от зимы к лету. При этом небольшое усиление эффекта при понижении скорости акклимации наблюдалось только в ИН. Соотношение n-3/n-6 ПНЖК в СХДГ достигало летнего значения при быстром прогреве. Однако после медленного прогрева оно мало отличалось от такового в зимний период.
Наконец, в бетаиновом липиде ДГТС также, как и в случае МГДГ, наблюдался больший эффект быстрой акклимации на ЖК состав по сравнению с влиянием медленной акклимации. Так, значения общих параметров (n-3/n-6 ПНЖК, ИН и ненасыщенные/насыщенные ЖК) и содержание главных ЖК (16:0 и 18:4 n-3) соответствовали летним значениям или приближались к ним после быстрой акклимации в большей степени, чем после медленной (табл. 4). Исключением были такие главные ЖК как цис-вакценовая (18:1 n-7), содержание которой изменялось в сторону летних значений только после медленной акклимации, и α-линоленовая кислота (18:3 n-3), уровень которой не изменялся ни при сезонной акклиматизации, ни при медленной акклимации, но почти в 2 раза снижался при быстрой акклимации по сравнению с содержанием этой ПНЖК в зимний период.
Термотропное поведение и молекулярные виды полярных липидов U. lactuca
Для оценки эффективности адаптивных перестроек в составе жирных кислот основных полярных липидов U. lactuca при тепловой акклимации были проведены калориметрические исследования тепловых переходов этих липидов из кристаллического в жидкокристаллическое состояние, которое является оптимальным для функционирования клеточных мембран организма.
Из рисунка 1 следует, что термограммы гликолипидов обладали особенно сложным профилем, вероятно, обусловленным фазовым разделением гетерогенных систем их молекулярных видов (табл. 5–8).
Таблица 5.
Состав молекулярных видов МГДГ Ulva lactuca в зависимости от скорости тепловой акклимации и сезона (% от суммы молекулярных видов)
| Молекулярные виды | Зима | Быстрая акклимация, 16°С/сут | Медленная акклимация, 2°С/сут | Лето |
|---|---|---|---|---|
| 18:1/16:4 | 9.2 ± 0.2a | 7.0 ± 0.3b | 7.2 ± 0.2b | 4.6 ± 0.1c |
| 16:2/18:2 | – | 3.5 ± 0.2a | 3.0 ± 0.3a | 3.3 ± 0.2a |
| 16:2/18:3 | 4.8 ± 0.3a | 4.6 ± 0.1a | 3.4 ± 0.2b | 7.6 ± 0.3c |
| 18:2/16:4 | 4.4 ± 0.2a | 6.9 ± 0.3b | 4.5 ± 0.2a | 6.1 ± 0.3c |
| 16:3/18:3 | 6.6 ± 0.2a | 6.5 ± 0.1a | 5.3 ± 0.3b | 13.5 ± 0.2c |
| 18:3/16:4 | 26.9 ± 0.3a | 26.7 ± 0.2a | 24.1 ± 0.3b | 39.4 ± 0.1c |
| 16:4/18:4 | 34.7 ± 0.2a | 28.2 ± 0.2b | 36.5 ± 0.1c | 18.7 ± 0.3d |
| МНЖК/ПНЖК | 14.3 ± 0.2a | 12.2 ± 0.3b | 12.0 ± 0.2b | 7.4 ± 0.1c |
| ПНЖК/ПНЖК | 81.4 ± 0.2a | 82.5 ± 0.2b | 83.3 ± 0.2c | 90.7 ± 0.3d |
Примечание. Молекулярные виды, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. МНЖК, ПНЖК – мононенасыщенные, полиненасыщенные жирные кислоты. Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждого молекулярного вида/молекулярной формы.
Таблица 6.
Состав молекулярных видов ДГДГ Ulva lactuca в зависимости от скорости тепловой акклимации и сезона (% от суммы молекулярных видов)
| Молекулярные виды | Зима | Быстрая акклимация, 16°С/сут | Медленная акклимация, 2°С/сут | Лето |
|---|---|---|---|---|
| 16:0/18:1 | 0.5 ± 0.1a | 2.1 ± 0.1b | 3.7 ± 0.2c | 7.9 ± 0.3d |
| 16:0/18:2 | 14.5 ± 0.4a | 8.7 ± 0.3b | 8.3 ± 0.3b | 20.9 ± 0.2c |
| 16:0/18:3 | 26.4 ± 0.3a | 12.9 ± 0.2b | 12.8 ± 0.2b | 14.2 ± 0.3c |
| 16:1/18:3 | 1.2 ± 0.1a | 1.8 ± 0.1b | 1.7 ± 0.1b | 9.3 ± 0.3c |
| 18:1/16:3 | 4.0 ± 0.3a | 3.2 ± 0.2b | 2.6 ± 0.2c | сл. |
| 16:2/18:2 | 2.4 ± 0.2a | 3.0 ± 0.1b | 2.0 ± 0.2a | 3.5 ± 0.2c |
| 16:2/18:3 | 5.1 ±0.2a | 12.3 ± 0.5b | 8.1 ± 0.3c | 13.8 ± 0.2d |
| 16:3/18:3 | 33.0 ± 0.3a | 15.6 ± 0.3b | 20.9 ± 0.2c | 14.4 ± 0.3d |
| 18:3/18:3 | 1.9 ± 0.1a | 3.6 ± 0.1b | 3.2 ± 0.1c | 2.9 ± 0.2c |
| 18:3/16:4 | 0.7 ± 0.1a | 15.9 ± 0.3b | 12.3 ± 0.3c | 2.3 ± 0.1d |
| 16:4/18:4 | 0.7 ±0.1a | 8.3 ± 0.4b | 12.7 ± 0.2c | 0.1 ± 0.1d |
| НЖК/МНЖК | 0.8 ± 0.1a | 2.2 ± 0.1b | 3.8 ± 0.2c | 8.0 ± 0.3d |
| НЖК/ПНЖК | 42.8 ± 0.3a | 24.2 ± 0.3b | 23.6 ± 0.3b | 15.2 ± 0.3 |
| МНЖК/МНЖК | – | 0.1 ± 0.1a | 0.1 ± 0.1a | 21.1 ± 0.2b |
| МНЖК/ПНЖК | 11.6 ± 0.2a | 9.9 ± 0.2b | 8.4 ± 0.2c | 13.9 ± 0.2d |
| ПНЖК/ПНЖК | 44.5 ± 0.2a | 62.8 ± 0.3b | 63.3 ± 0.2b | 39.1 ± 0.2c |
Примечание. Молекулярные виды, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты; сл. – следовые количества (меньше 0.1% от суммы). Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждого молекулярного вида/молекулярной формы.
Таблица 7.
Состав молекулярных видов СХДГ Ulva lactuca в зависимости от скорости тепловой акклимации и сезона (% от суммы молекулярных видов)
| Молекулярные виды | Зима | Быстрая акклимация, 16°С/сут | Медленная акклимация, 2°С/сут | Лето |
|---|---|---|---|---|
| 16:0/16:0 | 2.9 ± 0.1a | 4.1 ± 0.2b | 7.8 ± 0.3c | 11.3 ± 0.2d |
| 16:0/18:1 | 44.8 ± 0.1a | 35.2 ± 0.2b | 36.6 ± 0.3c | 27.4 ± 0.2d |
| 16:0/18:2 | 2.9 ± 0.1a | 8.8 ± 0.2b | 3.7 ± 0.2c | 6.5 ± 0.2d |
| 16:0/18:3 | 47.2 ± 0.2a | 43.2 ± 0.3b | 45.6 ± 0.1c | 50.9 ± 0.1d |
| 16:0/18:4 | 0.6 ± 0.1a | 3.8 ± 0.2b | 3.2 ± 0.2c | сл. |
| НЖК/НЖК | 3.0 ± 0.2a | 4.4 ± 0.1b | 8.1 ± 0.2c | 11.3 ± 0.2d |
| НЖК/МНЖК | 44.8 ± 0.1a | 36.4 ± 0.2b | 37.6 ± 0.2c | 29.3 ± 0.2d |
| НЖК/ПНЖК | 51.5 ± 0.2a | 57.5 ± 0.3b | 53.3 ± 0.2c | 57.5 ± 0.2b |
Примечание. Молекулярные виды, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты; сл. – следовые количества (меньше 0.1% от суммы). Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждого молекулярного вида/молекулярной формы.
Таблица 8.
Состав молекулярных видов ДГТС Ulva lactuca в зависимости от скорости тепловой акклимации и сезона (% от суммы молекулярных видов)
| Молекулярные виды | Зима | Быстрая акклимация, 16°С/сут | Медленная акклимация, 2°С/сут | Лето |
|---|---|---|---|---|
| 16:0/16:1 | 0.6 ± 0.1a | 1.2 ± 0.1b | 1.2 ± 0.2b | 3.3 ± 0.2c |
| 16:0/18:2 | 1.5 ± 0.1a | 3.9 ± 0.2b | 3.6 ± 0.2b | 7.0 ± 0.2c |
| 16:0/18:3 | 9.9 ± 0.3a | 11.6 ± 0.2b | 13.7 ± 0.1c | 12.2 ± 0.3d |
| 16:0/18:4 | 15.3 ± 0.2a | 14.1 ± 0.1b | 16.8 ±0.2c | 15.2 ± 0.3a |
| 16:0/22:5 | 2.4 ± 0.2a | 4.2 ± 0.2b | 6.0 ± 0.3c | 2.5 ± 0.1a |
| 18:1/18:3 | 6.2 ± 0.3a | 5.7 ± 0.2 a | 6.3 ± 0.3a | 4.2 ± 0.1b |
| 18:1/18:4 | 15.5 ± 0.1a | 11.3 ± 0.2b | 10.7 ± 0.2c | 7.0 ± 0.3d |
| 18:1/22:5 | 5.0 ± 0.3a | 2.7 ± 0.2b | 2.0 ± 0.1c | 3.0 ± 0.2b |
| 18:2/18:4 | 3.8 ± 0.1a | 1.6 ± 0.2b | 1.2 ± 0.2b | 1.7 ± 0.3b |
| 18:3/18:4 | 3.9 ± 0.2a | 2.5 ± 0.2b | 3.2 ± 0.3c | 1.2 ± 0.2d |
| НЖК/МНЖК | 1.5 ± 0.1a | 1.8 ± 0.2a | 3.0 ± 0.1b | 5.8 ± 0.2c |
| НЖК/ПНЖК | 40.6 ± 0.3a | 48.9 ± 0.2b | 51.9 ± 0.3c | 30.5 ± 0.2d |
| МНЖК/ПНЖК | 36.4 ± 0.2a | 28.3 ± 0.2b | 26.0 ± 0.2c | 39.0 ± 0.2d |
| ПНЖК/ПНЖК | 18.6 ± 0.2a | 16.4 ± 0.2b | 16.1 ± 0.2b | 17.4 ± 0.2d |
Примечание. Молекулярные виды, процентное содержание которых во всех четырех экспериментальных группах было ниже 3%, в таблице не представлены, но учтены в расчетах общих параметров. НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты. Представлены средние значения ± доверительный интервал, n = 9. Надстрочные латинские буквы обозначают достоверность различий средних значений при Р ≤ 0.05 по содержанию каждого молекулярного вида/молекулярной формы.
Так, тепловой переход МГДГ из U. lactuca, собранной зимой, осуществлялся в широком температурном интервале от –104 до 40°С и характеризовался главным пиком теплопоглощения при –12°С, а также дополнительным, меньшим по интенсивности, пиком при –82°С, тогда как профиль термограммы МГДГ U. lactuca, взятой в летний период, усложнялся, и ее температурный интервал сдвигался в сторону более низких температур. При этом интенсивность пика в области –10°С резко снижалась, и пик в области –80°С становился главным.
В результате краткосрочной и долгосрочной тепловой акклимации в целом происходило смещение температуры максимума теплопоглощения главного пика с –12 до –38°С, то есть в сторону его значения в летний период. Пролонгация периода акклимации также способствовала усложнению профиля термограммы МГДГ. Такое термотропное поведение не укладывается в концепцию гомеовязкостной адаптации и его затруднительно интерпретировать только с точки зрения изменений в составе ЖК МГДГ при тепловой акклимации/акклиматизации (табл. 1). Более приемлемыми оказались данные о составе молекулярных видов МГДГ (табл. 5), показавшие значительное снижение содержания одной из двух главных молекулярных форм – МНЖК/ПНЖК при общем возрастании уровня более ненасыщенной формы ПНЖК/ПНЖК под действием тепловой адаптации. Это могло способствовать понижению Tmax теплового перехода липида при повышении температуры окружающей среды.
ДГДГ зимнего образца U. lactuca характеризовался сильно выраженным фазовым разделением. На термограмме наблюдались два дискретных пика, близких по интенсивности: больший при 56°С (Tmax) и меньший при –36°С. Вероятно, усиление фазового разделения по сравнению с МГДГ объясняется как большей гетерогенностью молекулярных видов в целом, так и наличием не одной (ПНЖК/ПНЖК), а двух доминирующих молекулярных форм: НЖК/ПНЖК и ПНЖК/ПНЖК (рис. 1б, табл. 6). При акклиматизации водоросли от зимы к лету два близких по интенсивности пика сохранялись. То есть поддерживалось фазовое разделение, но в менее выраженном виде. Температура максимума низкотемпературного пика не изменялась, а температура максимума высокотемпературного (Tmax) понижалась на 16°С. Быстрая тепловая акклимация приводила к тому, что на термограмме ДГДГ оставался только низкотемпературный пик теплопоглощения, но его интенсивность значительно возрастала. Более длительная акклимация способствовала восстановлению фазового разделения гликолипида, о чем свидетельствовали два близких по интенсивности пика, занимавшие промежуточное положение по сравнению с соответствующими пиками на термограмме летнего образца ДГДГ. Вероятно, эти последовательные события, вызванные быстрой и медленной акклимацией, связаны с возрастанием содержания ПНЖК/ПНЖК форм и одновременным снижением уровня МНЖК/ПНЖК. Противоположные изменения в содержании этих форм наблюдались при акклиматизации в сочетании с общим снижением вклада более насыщенной молекулярной формы НЖК/ПНЖК. Различия в содержании главных молекулярных форм при быстрой и медленной акклимации были незначительными, но, вероятно, они оказались достаточными, чтобы сработать в качестве триггера при разделении фаз и, соответственно, способствовать лучшей подгонке профиля термограммы к таковому летнего образца ДГДГ.
Термограммы СХДГ (рис. 1в) также характеризовались сложным профилем. Главные пики на термограммах летних и зимних образцов СХДГ U. lactuca почти совпадали, и их максимумы теплопоглощения приходились на сравнительно высокие температуры (Tmax) – 50 и 52°С соответственно, что объясняется повышенной насыщенностью жирнокислотных остатков по сравнению с другими гликолипидами. Но менее интенсивные пики располагались при существенно разных температурах: в области –20 и –40°С соответственно. Фазовое разделение СХДГ можно объяснить наличием двух доминирующих молекулярных форм НЖК/МНЖК и НЖК/ПНЖК, а также заметным вкладом самой насыщенной формы НЖК/НЖК (табл. 7). При тепловой акклимации и, особенно, при акклиматизации содержание НЖК/МНЖК падало, а уровень НЖК/НЖК повышался, что, вероятно, способствовало смещению низкотемпературного пика в сторону более высоких температур. Интенсивность высокотемпературного пика резко снижалась при быстрой акклимации. Эффект увеличения времени акклимации сводился к появлению в этой области двух интенсивных пиков, что способствовало подгонке термограммы к калориметрической кривой летнего образца СХДГ.
Профиль термограмм ДГТС был намного проще: в нем отчетливо выделялся главный пик теплопоглощения. Термограмма летнего образца смещалась в область температур выше 0°С относительно термограммы зимнего образца ДГТС (рис. 1г). При быстрой акклимации Тmaх ДГТС достигала летнего значения и не изменялась при медленной акклимации. Но более длительная акклимация приводила к увеличению интенсивности главного пика и расширению температурной области перехода в сторону температур выше 0°С. Сдвиг Tmax калориметрического перехода ДГТС на 20°С в сторону более высоких температур при тепловой акклимации/акклиматизации коррелировал с общим снижением ИН и соотношениями ненасыщенные/насыщенные ЖК и n-3/n-6 ПНЖК по сравнению с зимним образцом. Состав молекулярных видов ДГТС показал, что основными по процентному содержанию являлись три молекулярные формы, содержащие ПНЖК: НЖК/ПНЖК, МНЖК/ПНЖК и ПНЖК/ПНЖК, но в адаптационном процессе в основном принимали участие первые две формы, которые к тому же являлись доминирующими (табл. 8) и, вероятно, определяли формирование профиля термограмм.
ОБСУЖДЕНИЕ
Исследованные в настоящей работе липиды представляют разные типы мембран U. lactuca. Если гликолипиды являются типичными компонентами тилакоидных мембран хлоропластов [12], то бетаиновый липид ДГТС структурно и функционально замещает ФХ – основной фосфолипид плазматических и других экстрапластидных мембран растительных клеток [13]. Тем не менее, в составе ЖК этих липидов наблюдались общие изменения в зависимости от скорости тепловой акклимации. Так, в результате быстрой тепловой акклимации U. lactuca происходило снижение соотношений n-3/n-6 ПНЖК и ненасыщенные/насыщенные ЖК, а также ИН ЖК состава и гликолипидов, и ДГТС, что соответствовало сезонным изменениям. Однако при меньшей скорости прогрева данная тенденция не усиливалась, или даже происходили обратные изменения. Вероятно, способность быстро перестраивать ЖК состав мембранных липидов связана с особыми условиями существования U. lactuca в прибрежной зоне приливов и отливов. Таким образом, экологическая пластичность U. lactuca, которая может способствовать устойчивости к изменению климата [20], коррелирует с высокой пластичностью ЖК состава липидов мембран, необходимой для жизнеспособности клеток водоросли. Реорганизация ЖК состава липидов мембран направлена на изменение вязкости липидов при термоадаптации и, следовательно, может выполнять центральную роль в модуляции функциональной активности белков, погруженных в липидный матрикс мембран.
Как и при тепловой акклиматизации [4], наибольшую пластичность проявил липид экстрапластидных мембран зеленых водорослей ДГТС. В результате тепловой акклимации, независимо от скорости прогрева морской воды, Тmaх калориметрического перехода ДГТС достигала значения летнего образца. Это соответствует концепции гомеовязкостной адаптации, согласно которой повышение температуры окружающей среды способствует повышению насыщенности ЖК мембранных липидов для поддержания оптимального жидкокристаллического состояния мембран клеток эктотермных организмов [2].
Адаптационные перестройки липидного матрикса особенно важны для тилакоидных мембран, которые содержат фотосинтетический аппарат. Судя по полученным данным, акклимационные изменения термотропного поведения основных липидов тилакоидных мембран, гликолипидов, носили более сложный характер по сравнению с ДГТС. В результате тепловой акклимации наблюдалась не только подгонка Тmaх к ее значению в летний период, но и поддержание фазового разделения, которое определялось составом молекулярных форм в большей степени, чем общими параметрами насыщенности ЖК (ИН, ненасыщенные/насыщенные ЖК). Так, причиной понижения Tmax теплового перехода липида при повышении температуры окружающей среды могло быть замещение одной из двух главных молекулярных форм – МНЖК/ПНЖК на более ненасыщенную молекулярную форму ПНЖК/ПНЖК. Тогда как изменения общих параметров насыщенности ЖК состава МГДГ не позволяли дать приемлемую интерпретацию. Понижению Тmax МГДГ также могло способствовать уменьшение соотношения n-3/n-6 ПНЖК, то есть увеличение доли n-6 ПНЖК, которые в значительно большей степени способствуют понижению Тmax, чем n-3 ПНЖК [21].
Важное значение фазового разделения гликолипидов, вероятно, связано с тем, что ФСI и ФСII, сконцентрированные в стромальных и гранальных тилакоидных мембранах соответственно [22], нуждаются в липидном окружении с разной вязкостью. Известно, что неламеллярный высоко ненасыщенный МГДГ, являясь основным по содержанию липидом тилакоидных мембран, обеспечивает их высокую кривизну, необходимую для включения многочисленных мембранных белков в липидный бислой [23]. Полиненасыщенные жирнокислотные хвосты, обладающие значительной структурной гибкостью, позволяют липидам приспосабливаться к различным формам белков в сосуществующих мембранных комплексах и стабилизировать их [2]. Включаясь в структуры белковых макроансамблей ФСII и ФСI, светособирающего комплекса II (ССКII), цитохрома b6/f, а также CF0CF1-АТФазы в хлоропластах, МГДГ играет решающую роль в их структурной гибкости [24]. В частности, поддержание жидкокристаллического состояния липидного матрикса тилакоидных мембран особенно важно для эффективной замены поврежденных белков реакционного центра ФСII, главным образом D1. Такая замена протекает путем диссоциации ФСII на два мономера путем их латеральной диффузии [25]. Так как МГДГ находится в зоне контакта мономеров ФСII, то отмеченный разжижающий эффект в сочетании с возрастанием содержания ПНЖК/ПНЖК форм при повышении температуры может способствовать подвижности фотосинтетических белковых комплексов и повышать фотосинтетическую активность. Так, было показано, что повышение температуры до 20°С способствует возрастанию фотосинтетической активности и продуктивности фотосинтеза родственного вида U. linza [26]. Конусообразная форма молекул МГДГ также важна для стабилизации тримерных комплексов ССКII [27].
Остальные гликолипиды, ДГДГ и СХДГ, которые, в отличие от МГДГ, относятся к ламеллярным, составляют менее половины от суммы гликолипидов U. lactuca: 20–28% и 10–14% соответственно [28]. Однако они также задействованы в структуре и функционировании тилакоидных мембран, включаясь в структуры ФСII и ФСI.
Изменения термотропного поведения ДГДГ зависели от скорости тепловой акклимации, в отличие от таковых его биосинтетического предшественника МГДГ [29]. Если быстрая акклимация приводила к сохранению пула молекулярных видов ДГДГ, которому соответствовал только низкотемпературный пик теплового перехода, то увеличение времени акклимации было необходимо для появления дополнительного кластера ДГДГ, калориметрический переход которого осуществлялся в высокотемпературной области. В результате профиль термограммы последовательно подгонялся к структуре термограммы летнего образца.
СХДГ также является ламеллярным гликолипидом тилакоидных мембран. Вместе с МГДГ этот анионный гликолипид обнаружен в структурах фотосинтетических комплексов в качестве кофакторов, в частности, в зоне контакта димеров ФСII [12]. Насыщенность ЖК состава СХДГ возрастала независимо от скорости прогрева морской воды. В результате термотропное поведение СХДГ изменялось сходным образом: интенсивность дополнительного пика значительно возрастала, а его температура максимума теплопоглощения смещалась в сторону значения в летний период. Однако, лучшая подгонка профиля термограммы СХДГ к летнему виду наблюдалась при медленной акклимации. Так как результатом тепловой акклимации явилось резкое понижение Тmax доминирующего гликолипида МГДГ, то, вероятно, кластеры молекулярных видов ДГДГ и СХДГ, калориметрический переход которых осуществлялся в низкотемпературной области, имеют важное значение для поддержания и усиления общей динамичности тилакоидных мембран и, следовательно, фотосинтетической активности водоросли при тепловом стрессе.
В целом, U. lactuca проявила способность быстро реагировать на резкое повышение температуры морской воды, адаптируя липидный матрикс мембран к новым условиям окружающей среды. Результатом тепловой акклимации U. lactuca были изменения термотропного поведения и жирнокислотного состава полярных липидов, которые происходили в том же направлении, что и в естественной среде обитания при сезонной акклиматизации. Быстрая тепловая акклимация вызывала эффективную перестройку жирнокислотного состава всех исследованных липидов, направленную на изменение Tmax их калориметрических переходов. Замедление скорости акклимации приводило к большей подгонке профиля термограмм липидов к виду, характерному для летних образцов. Кроме участия в регуляции динамической структуры тилакоидных мембран, галактолипиды, обогащенные ПНЖК, выполняют функцию субстратов для продукции оксилипинов, регулирующих различные процессы в растениях в ответ на изменения в окружающей среде [30]. В экстрапластидных мембранах главным поставщиком предшественников оксилипинов, вероятно, является ДГТС, полностью замещающий ФХ в U. lactuca [28]. Поэтому увеличение доли n-6 ПНЖК, предшественников более сильных n-6 оксилипинов, чем n-3 оксилипины [3], которое происходило в этих липидах при быстрой тепловой акклимации, можно расценивать как дополнительный вклад в адаптацию водоросли к тепловому стрессу. Высокая пластичность основных липидов мембран U. lactuca коррелирует с приспособленностью водоросли к частым перепадам температуры морской воды в литоральной зоне.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках государственного задания № 6.5736.2017/6.7.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Murakami Y., Tsuyama M., Kobayashi Y., Kodama H., Iba K. Trienoic fatty acids and plant tolerance of high temperature // Sci. 2000. V. 287. P. 435.
Ernst R., Ejsing C.S., Antonny B. Homeoviscous adaptation and the regulation of membrane lipids // J. Mol. Biol. 2016. V. 428. P. 4776.
Lauritzen L., Hansen H.S., Jorgesen M.H., Michaelsen K.F. The essentiality of long chains n-3 fatty acids in relation to development and function of the brain and retina // Prog. Lipid Res. 2001. V. 40. P. 1.
Sanina N., Goncharova S., Kostetsky E. Seasonal changes of fatty acid composition and thermotropic behavior of polar lipids from marine macrophytes // Phytochemistry. 2008. V. 69. P. 1517.
Kostetsky E., Chopenko N., Barkina M., Velansky P., Sanina N. Fatty acid composition and thermotropic behavior of glycolipids and other membrane lipids of Ulva lactuca(Chlorophyta) inhabiting different climatic zones // Mar. Drugs. 2018. V. 16: E494. https://doi.org/10.3390/md16120494
Seneviratne S.I., Donat M.G., Mueller B., Alexander L.V. No pause in the increase of hot temperature extremes // Nat. Clim. Change. 2014. V. 4. P. 161.
Perkins S.E., Alexander L.V., Nairn J.R. Increasing frequency, intensity and duration of observed global heatwaves and warm spells // Geophys. Res. Lett. 2012. V. 39: L20714. https://doi.org/10.1029/2012GL053361
Sandblom E., Gräns A., Axelsson M., Seth H. Temperature acclimation rate of aerobic scope and feeding metabolism in fishes: implications in a thermally extreme future // Proc. R. Soc. B. 2014. V. 281: 20141490. https://doi.org/10.1098/rspb.2014.1490
Иванова М.Б., Цурпало А.П. Состав и распределение сообществ макробентоса на литорали острова Путятина (залив Петра Великого, Японское море) // Известия ТИНРО. 2013. Т. 172. С. 149.
Кусакин О.Г., Иванова М.Б. Состав, распределение и количественная характеристика макробентоса литорали беринговоморского побережья Камчатки (заливы Карагинский и Олюторский) // Известия ТИНРО. 2002. Т. 130. С. 266.
Калита Т.Л., Титлянов Э.А. Влияние температуры и освещенности на рост и репродукцию зеленой водоросли Ulva fenestrata // Биология моря. 2003. Т. 29. С. 351.
Kobayashi K., Endo K., Wada H. Roles of lipids in photosynthesis // Lipids in Plant and Algae Development / Eds. Nakamura Y., Li-Beisson Y. Switzerland: Springer International Publishing, Subcell. Biochem. 2016. V. 86. P. 21.
Van Ginneken V., Gittenberger A., Rensing M., de Vries E., Peeters E.T.H.M., Verheij E. Seaweed competition: Ulva sp. has the potential to produce the betaine lipid diacylglyceryl-O-4'-(N,N,N,-trimethyl) homoserine (DGTS) in order to replace phosphatidylcholine (PC) under phosphate-limiting conditions in the P-limited Dutch Wadden Sea and outcompete an aggressive non-indigenous Gracilaria vermiculophylla red drift algae out of this Unique Unesco World Heritage coastal area // Ocean & fish Open Access J. 2017. V. 2: 555596. https://doi.org/10.19080/OFOAJ.2017.02.555596
Bligh E.G., Dyer W.I. A rapid method of total lipid extraction and purification // Canad. J. Biochem. Physiol. 1959. V. 37. P. 911. https://doi.org/10.1139/o59-099
Vaskovsky V.E., Khotimchenko S.V. HPTLC of polar lipids of algae and other plants // J. High Resol. Chromatogr. 1982. V. 5. P. 635. https://doi.org/10.1002/jhrc.1240051113
Christie W.W. Equivalent chain length of methyl ester derivatives of fatty acids on gas chromatography // J. Chromatogr. 1988. V. 447. P. 305.
Carrol K.K. Quantitative estimation of peak areas in gas-liquid chromatography // Nature. 1961. V. 191. P. 377.
Костецкий Э.Я., Веланский П.В., Санина Н.М. Фазовые переходы фосфолипидов как критерий оценки способности рыб к термоадаптации // Биология моря. 2013. Т. 39. С. 136.
Sanina N.M., Goncharova S.N., Kostetsky E.Y. Fatty acid composition of individual polar lipids from marine macrophytes // Phytochemistry. 2004. V. 65. P. 721.
Seebacher F., White C.R., Franklin C.E. Physiological plasticity increases resilience of ectothermic animals to climate change // Nat. Clim. Chang. 2015. V. 5. P. 61.
Костецкий Э.Я., Санина Н.М., Науменко Н.В. Влияние состава жирных кислот на структуру термограммы фазового перехода фосфатидилхолина из голотурии Cucumaria fraudatrix // Журнал эволюционной биохимии и физиологии. 1992. Т. 28. С. 426.
Kirchhoff H., Sharpe R.M., Herbstova M., Yarbrough R., Edwards G.E. Differential mobility of pigment-protein complexes in granal and agranal thylakoid membranes of C3 and C4 plants // Plant Physiol. 2013. V. 161. P. 497. https://doi.org/10.1104/pp.112.207548
Brown M.F. Curvature forces in membrane lipid–protein interactions // Biochemistry. 2012. V. 51. P. 9782.
Garab G., Ughy B., Goss R. Role of MGDG and non-bilayer lipid phases in the structure and dynamics of chloroplast thylakoid membranes // Nakamura Yu., Li-Beisson Yo. (Eds.). Lipids in Plant and Algae Development. Springer International Publishing, Switzerland. 2016. P. 127.
Yamamoto Y. Quality control of photosystem II: the mechanisms for avoidance and tolerance of light and heat stresses are closely linked to membrane fluidity of the thylakoids // Front. Plant Sci. 2016. V. 7: 1136. https://doi.org/10.3389/fpls.2016.01136
Kim J.H., Kang E.J., Park M.G., Lee B.G., Kim K.Y. Effects of temperature and irradiance on photosynthesis and growth of a green-tide-forming species (Ulva linza) in the Yellow Sea // J. Appl. Phycol. 2011. V. 23. P. 421.
Seiwert D., Witt H., Janshoff A., Paulsen H. The non-bilayer lipid MGDG stabilizes the major light-harvesting complex (LHCII) against unfolding // Scientific Reports. 2017. V. 7: 5158. https://doi.org/10.1038/s41598-017-05328-7
Гончарова С.Н., Костецкий Э.Я., Санина Н.М. Влияние сезонных изменений температуры на липидный состав морских макрофитов // Физиология растений. 2004. Т. 51. С. 190.
Wallis J.G., Browse J. Lipid biochemists salute the genome // Plant J. 2010. V. 61. P. 1092.
Savchenko T.V., Zastrijnaja O.M., Klimov V.V. Oxylipins and plant abiotic stress resistance // Biochemistry (Moscow). 2014. V. 79. P. 362.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


