Физиология растений, 2020, T. 67, № 1, стр. 75-83
Роль устьиц в адаптации растений Plantago maritima L. к приливно-отливной динамике на литорали Белого моря
Е. Ф. Марковская a, *, Е. Н. Гуляева a
a Федеральное государственное бюджетное образовательное учреждение высшего профессионального
образования Петрозаводский государственный университет
Петрозаводск, Россия
* E-mail: volev10@mail.ru
Поступила в редакцию 07.11.2018
После доработки 27.12.2018
Принята к публикации 28.01.2019
Аннотация
Исследованы структурно-функциональные особенности листьев растений подорожника морского, или приморского, (Plantago maritima L.), произрастающих на литорали и супралиторали побережья Белого моря. Растения на литорали имели более мелкие и утолщенные листья, отмечено увеличение количества устьиц и уменьшение толщины покровных тканей по сравнению с растениями супралиторали. Исследование флуоресценции и устьичной проводимости на растениях супралиторали показало, что все показатели подчиняются циркадной ритмике. Динамика исследованных параметров у растений литорали резко изменяется и согласуется с приливно-отливной динамикой. Отмечается два стабильных состояния (полный прилив и осушка) и два переходных (в динамике прилива и отлива). В стабильном состоянии растения имеют высокие функциональные показатели флуоресценции (Fv/Fm, Y(II), ETR) и открытые устьица, а в переходные состояния отмечается частичное закрытие устьиц и ингибирование функциональной активности. Выдвинуты гипотезы и обсуждаются возможные механизмы участия особенностей анатомии листа, газовой пленки, наличии индуцибельного СО2-концентрирующего механизма и ведущая роль устьиц в реакции растения подорожника морского на приливно-отливную динамику на побережье Белого моря.
ВВЕДЕНИЕ
Одной из особенностей Белого моря являются значительные колебания уровня воды за счет приливно-отливной динамики [1]. Дважды в сутки на литорали растения заливаются водой, а затем выходят на осушку – происходит смена водной и воздушной сред. Эта смена сред сопровождается изменением освещенности, температуры, концентрации кислорода и углекислого газа, давления и ряда других климатических параметров [2–4]. Данные условия привели к формированию уникального галофитного комплекса высших наземных растений [5], которые устойчивы к резкой смене экологических условий за счет специального развития анатомических структур (аэренхима, водозапасающая ткань, механическая ткань, гидрофобная поверхность листа с тонкой газовой пленкой и др.) [6, 7]; изменения морфологии (разветвление корневой системы, уменьшение размеров растения, увеличение толщины листа и др.) [8] и адаптаций на уровне физиолого-биохимических механизмов, связанных с поддержанием водного режима, фотосинтеза, устойчивостью к недостатку кислорода, углекислого газа и условий освещенности [9, 10, 7 ] и т.д. Однако реакция растений на изменение сред, регуляция и возможные механизмы ответных реакций организма у растений приливно-отливной зоны приморских экосистем не обсуждаются. Ранее нами было установлено, что количество устьиц у растений Tripolium vulgare Ness изменяется в зависимости от места их произрастания на прибрежной территории: их количество увеличивается от берега к урезу воды, где и отмечаются максимальные параметры приливно-отливного цикла (ПОЦ) [10]. Это наблюдение является основанием для гипотезы об активном участии устьичного аппарата высших наземных растений в процессах регуляции реакции растений на приливно-отливную динамику.
Различные виды подорожников используются в качестве модельных объектов для сравнительного анализа особенностей адаптации растений к неблагоприятным условиям внешней среды. Исследования подорожника морского, или приморского – Plantago maritima L. – в основном связаны с камеральным изучением механизмов адаптации к условиям засоления [11]. Однако, авторы не касаются вопроса ответных реакций P. maritima на приливно-отливную динамику. В условиях литорали создаются уникальные условия природного эксперимента: грунтовое засоление в области корневой системы сохраняется в течение суток, а надземная часть дважды в сутки заливается водой и дважды выходит в воздушную среду. Растения этого вида, растущие рядом на супралиторали, этим воздействиям не подвергаются. Причем для P. maritima типичным местообитанием является литораль, тогда как на супралиторали данный вид встречается реже [12].
Целью настоящего исследования явилось сравнительное изучение анатомии и параметров флуоресценции и устьичной проводимости листьев растений P. maritima, произрастающих на литорали и супралиторали в прибрежных экосистемах Белого моря.
МАТЕРИАЛЫ И МЕТОДЫ
Место исследования. Исследование выполнено в конце июля в устье реки Кереть на западном побережье Белого моря (66°16′ с.ш., 33°33′ в.д.) в 2016–2018 гг. Керетская губа представляет собой небольшой залив, который также является эстуарием реки Кереть. Устье залива выходит в губу Чупа, последняя является образованием типа фьорда и выходит в Кандалакшский залив Белого моря. Согласно классификации климатов Б.П. Алисова, климат в районе места исследования относится к умеренному типу [13]. Лето прохладное, температура обычно держится в пределах 15–20°С [14]. Керетская губа характеризуется сложными гидрологическими явлениями, для залива характерна приливо-отливная динамика. Средняя величина приливов от 2 до 3.5 м, соленость вод залива пониженная – 20–22 ‰, вблизи устья 3–12‰. В регионе в течение двух летних месяцев длится круглосуточный полярный день.
Измерение интенсивности света на суше проводили с помощью люксметра “ТКА-ЛЮКС” (Россия) с дальнейшим пересчетом люксов в фотоны (рис. 1) [15]. Интенсивность света под водой рассчитывали по ослаблению светового потока на разных глубинах [16]. Температуру и относительную влажность воздуха фиксировали с помощью мобильного автономного регистратора температуры и относительной влажности (“ТРВ-2”, Россия). Соленость воды измеряли с помощью рефрактометра Master (“Atago”, Япония).
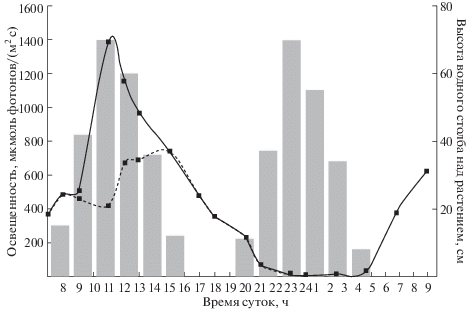
Рис. 1.
Освещенность и высота водного столба вблизи растений Plantago maritima на литорали и супралиторали. Сплошная линия – значения освещенности вблизи растений на открытом воздухе, пунктирная линия – изменение показателя на/под водой.
В качестве объекта исследования выбраны растения подорожника морского, или приморского (Plantago maritima L.) из семейства Подорожниковые (Plantaginaceae Juss.). Это многолетние травянистые растения с толстым и усеченным корневищем – каудексом. Листья собраны в прикорневые розетки, мясистые, узколанцетные. Соцветие – колос. Эвгалофит. Типичное растение морских побережий, доминирует на литорали Беломорского побережья, единичные экземпляры (редкие) встречаются на супралиторали вне ежесуточного заливания.
Для исследования были выбраны по три хорошо развитых цветущих растения (клонов) P. maritima из естественных условий местообитания: на литорали в условиях заливания и на супралиторали вне заливания. Для исследования брали полностью развернутые листья без признаков повреждения, в трехкратной биологической повторности, на разных стадиях ПОЦ (табл. 1).
Таблица 1.
Суточная схема взятия проб растений для исследования в приливно-отливной динамике
| Стадия взятия проб | Описание положения растения во время приливно-отливного цикла |
|---|---|
| I | Прилив, залита только нижняя часть растений |
| II | Прилив, растения залиты наполовину |
| III | Максимум прилива, полное погружение растений, над растениями отмечается наибольшая высота столба воды (около 70 см) |
| IV | Стагнация прилива, продолжительность пребывания растения под водой около трех часов |
| V | Отлив, растения залиты наполовину |
| VI | Отлив, залита только нижняя часть растений |
| VII | Максимальный отлив, растения Plantago maritima освобождены от воды |
| VIII | Стагнация отлива, продолжительность пребывания растения в воздушной среде около трех часов |
Опыты проводили по схеме: прилив-отлив с учетом сдвига максимума прилива в сутках (на час) по местному времени (UTC + 3). Максимальная высота столба воды над растениями P. maritima составляла около 70 см (рис. 1). Относительная влажность воздуха незначительно изменялась в течение ПОЦ и составляла 68.8 ± 2.9%. Соотношения значений температуры воздуха и температуры воды в течение ПОЦ составили (22.8 ± 3.2)/(20.3 ± 1.6) днем и (16.6 ± 1.5)/(18.4 ± 0.89) ночью, соответственно. Изменение освещенности в ходе эксперимента представлено на рис. 1. Соленость воды, измеренная непосредственно около растений во время прилива, составляла 3.2 ± 0.6‰. Низкие значения солености воды связаны с большим объемом пресных вод реки Кереть в месте исследования. Во время эксперимента пробы растений P. maritima на супралиторали брались одновременно с пробами на литорали.
Анатомия. Для исследования отбирали по 10 листьев растений из двух местообитаний, средняя часть листьев была зафиксирована в 70% этаноле [17]. Количественные показатели мезофилла изучали на поперечных срезах по методике Мокроносова, Борзенковой [18]. Анатомическую структуру эпидермы листьев изучали методом отпечатков по Полаччи [19]. Полученные временные препараты изучались при помощи светового микроскопа Микмед-6 (“ЛОМО”, Россия) с увеличением 40× и 100×. Измерение показателей проводили в 30-кратной повторности с помощью программы ImageJ [20].
Устьичная проводимость. Проводимость устьиц в листе определяли с помощью SC-1 Leaf Porometer (“Decagon Devices, Inc.”, США) в трехкратной повторности, в течение 2 ПОЦ в каждую из его стадий (табл. 1). Параллельно оценивали степень открытия устьиц на микроскопе по ширине устьичной щели на фрагментах листьев, фиксированных в 70% этаноле в полевых условиях. Повторность 30-кратная.
Содержание пигментов. Пробы листьев растений для анализа брали одновременно из двух мест обитания в двукратной биологической повторности и фиксировали в полевых условиях в спирте. Содержание хлорофиллов и каротиноидов определяли спектрофотометрическим методом (“СФ-26”, Россия) в спиртовой вытяжке по оптической плотности в максимумах поглощения хлорофиллов a, b и каротиноидов [21].
Измерение параметров ИФХ. Параметры интенсивности флуоресценции хлорофилла а (ИФХ) регистрировали с помощью флуориметра JU-NIOR-PAM (“Heinz Walz GmbH”, Германия) после 30-минутной темновой адаптации. Определяли начальную (F0) и максимальную (Fm) флуоресценцию, максимальный фотохимический квантовый выход ФС II (Fv/Fm). Также определяли эффективный квантовый выход ФС II (Y(II)), скорость фотосинтетического транспорта электронов (ETR) и нефотохимическое тушение флуоресценции хлорофилла a (NPQ). Параметры флуоресценции измеряли при интенсивности действующего света 820 мкмоль/(м2 с). Исследование проведено в трехкратной повторности в течение 2 ПОЦ в каждую из его стадий (табл. 1)
Статистика. Для статистической обработки данных использовали программы Statistica 6.0 и MS Excel 2007. Достоверность различий оценивали с помощью t-критерия Стьюдента. На графиках и в таблицах приведены средние значения и ошибка определения среднего.
РЕЗУЛЬТАТЫ
Сравнительный анализ морфолого-анатомических параметров листьев Plantago maritima из двух местообитаний
Для анатомии листа подорожника приморского характерно изолатеральное строение, при котором структура фотосинтезирующей паренхимы на адаксиальной и абаксиальной сторонах была одинакова. Центральное положение в листовой пластинке занимали крупные клетки водозапасающей паренхимы. Проводящая система представлена тремя крупными проводящими пучками, расположенными в центре листа, и множеством мелких проводящих пучков по периферии листа.
На литорали в условиях действия ПОЦ у растений P. maritima формируются более мелкие листья с большим объемом водозапасающей паренхимы, а у растений на супралиторали в большей степени получают развитие покровные ткани: увеличивается толщина эпидермы и кутикулы (табл. 2). Эпидерма листьев P. maritima однослойная с устьицами, расположенными на адаксиальной и абаксиальной сторонах листа. Расчет показал, что количество устьиц больше у растений на литорали, тогда как размеры устьиц крупнее у растений на супралиторали (табл. 2). Клетки эпидермы у растений P. maritima обоих экотопов одинаковые: прямоугольные с гладкими стенками.
Таблица 2.
Количественная характеристика мезофилла листьев Plantago maritima
| Исследованные показатели | Литораль | Супралитораль |
|---|---|---|
| Длина листа, см | 35.1 ± 4.8* | 52.8 ± 14.2* |
| Ширина листа, см | 2.4 ± 0.1* | 3.5 ± 0.4* |
| Толщина листа, мкм | 641.2 ± 35.8* | 574.2 ± 21.7* |
| Толщина водозапасающей ткани, мкм | 64.8 ± 4.9* | 38.2 ± 4.0* |
| Толщина эпидермы, мкм | 19.1 ± 2.1* | 26.8 ± 3.2* |
| Толщина кутикулы, мкм | 3.5 ± 0.5* | 6.2 ± 0.8* |
| Количество устьиц на 1 мм2 | 121 ± 6* | 86 ± 13* |
| Площадь устьица, мкм2 | 648.1 ± 37.8* | 706.3 ± 54.8* |
| Количество клеток эпидермы на 1 мм2 | 37 ± 4 | 38 ± 2 |
| Количество хлоропластов в клетке | 25 ± 3 | 24 ± 2 |
| Хлорофилл а, мг/г сухой массы | 2.7 ± 0.4* | 2.1 ± 0.1* |
| Хлорофилл b, мг/г сухой массы | 1.3 ± 0.2* | 0.9 ± 0.1* |
| Каротиноиды, мг/г сухой массы | 0.5 ± 0.1 | 0.3 ± 0.05 |
Хлоропласты в листьях литоральных растений ориентированы на эпидерму, у супралиторальных отмечается межклеточная ориентация. Количество хлоропластов сходно у растений на литорали и супралиторали. Содержание хлорофиллов и каротиноидов наблюдалось выше у растений, произрастающих на литорали.
Суточная динамика флуоресценции
У растений P. maritima после начала прилива и до его максимального уровня значения F0 и Fm снижались. В условиях стационарного состояния уровня воды на приливе в течение 2 ч показатели флуоресценции возрастали, а перед началом отлива отмечалось их снижение (F0 и Fm), которое достигало минимальных значений при выходе растения из заливания.
Однако уже через час после нахождения растений в стабильном состоянии в воздушной среде эти показатели опять увеличивались и достигали высоких значений, сходных с растениями при длительном заливании (рис. 2). В этот период времени показатели флуоресценции у растений P. maritima, растущих вне зоны заливания, поддерживались на постоянном уровне. Расчет Fv/Fm показал, что наиболее высокие значения, свидетельствующие о высоком квантовом выходе, отмечались во время длительного нахождения растений в стабильных условиях при заливании (под водой) и на осушке (в воздушной среде). У растений в переходных состояниях процесса прилива и отлива значение Fv/Fm снижалось (до 0.7) (рис. 2). У растений P. maritimа на супралиторали данный показатель в исследуемый период оставался стабильным.
Рис. 2.
Изменение показателей интенсивности флуоресценции хлорофилла а (F0 (a), Fm (б), Fv/Fm (в), NPQ (г), Y(II) (д), ETR (е)) Plantago maritima на литорали и супралиторали (серым цветом выделено время, когда растения залиты водой). Интенсивность действующего света – 820 мкмоль/(м2 с). Сплошная линия – значения показателя на литорали, пунктирная линия – изменение показателя на супралиторали. Римскими цифрами обозначены стадии взятия проб, указанные в табл. 1.

Во время длительного нахождения растений под водой и на отливе (осушка) отмечались максимальные значения ETR, Y(II) и NPQ. При смене воздушной и водной сред у растений происходило снижение всех показателей. Причем минимальные значения отмечались сразу после полного освобождения растений от воды (рис. 2). У растений P. maritima на супралиторали параметры флуоресценции (NPQ, ETR) не изменялись в период эксперимента, а небольшие изменения Y(II) (с учетом разброса) к 10 часам могут быть связаны с увеличением освещенности.
Суточная динамика состояния устьичной щели и величины устьичной проводимости
Величина устьичной щели и значений устьичной проводимости у растений P. maritimа в суточном цикле (2 ПОЦ) достигали максимальных значений в период максимального отлива и максимального прилива (рис. 3). Это состояние достигалось через час после отлива и за час до прилива, а также через час после прилива и за час до отлива. Эта закономерность не зависит от освещенности в течение светового дня. В ясные дни (“полярный” день) в ночной период устьица остаются незначительно, но открытыми, а в пасмурные ночи они могут на 2–4 часа закрываться. Ночное закрытие, отмеченное в наших экспериментах, было связано с резким снижением освещенности, которое достигало минимальных значений в условиях заливания.
Рис. 3.
Изменение показателей устьичной проводимости (а) и ширины устьичных щелей (б) Plantago maritima на литорали и супралиторали. Серым цветом выделено время, когда растения залиты водой. Сплошная линия – значения показателя на литорали, пунктирная линия – изменение показателя на супралиторали. Римскими цифрами обозначены стадии взятия проб, указанные в табл. 1.

Исследование работы устьиц растений P. maritima на супралиторали позволило установить двухвершинную кривую их суточной динамики, на которой максимальные значения устьичной проводимости (ширины устьичной щели) наблюдались в утренние (8–11) и вечерние (16–20) часы. Снижение данных показателей днем, скорее всего, связано с высокой интенсивностью света и повышением температуры воздуха. В утреннее время (с 2 до 5 часов утра) устьица были закрыты.
ОБСУЖДЕНИЕ
Сравнительное исследование структурно-функциональных показателей растений P. maritima, произрастающих на литорали и супралиторали Белого моря, выявило различия в путях адаптации растений к двум контрастным условиям обитания. Для растений литорали характерны уменьшение площади поверхности листа, но увеличение его толщины; увеличение количества устьиц, но уменьшение их размеров; уменьшение толщины эпидермы и кутикулы; увеличение водозапасающей ткани; ориентация хлоропластов в клетках мезофилла на эпидерму как на покровную ткань, прямо связанную с получением световой энергии. Перечисленные особенности, а также увеличение содержания фотосинтетических пигментов свидетельствуют об адаптивных изменениях, прежде всего связанных с условиями затенения во время прилива, а при выходе на сушу – с необходимостью поддержания водного режима на отливе. На супралиторали у растений, постоянно находящихся в суточной динамике при естественной освещенности, увеличивается толщина покровных тканей, что является защитной реакцией на избыток света, отмечается межклеточная ориентация хлоропластов, уменьшение количества устьиц и увеличение их размеров.
Исследование суточной динамики функциональных показателей супралиторальных растений P. maritima показало, что суточная ритмика флуоресценции и устьичной проводимости сходна с данными показателями у других наземных растений [22, 23], в то время как у растений на литорали обнаружены отличия. Растения P. maritima на супралиторали функционируют в системе циркадной ритмики, а растения литорали зависят еще и от приливно-отливной динамики (лунной ритмики). Наземные растения в условиях полного погружения под воду во время прилива оказываются в условиях сильного затенения и лимитирования доступного неорганического углерода, из-за многократного (104) снижения скорости диффузии газов в воде по сравнению с воздухом [23], что сильно ограничивает подводный газообмен.
В условиях заливания устьица открываются. Известно, что свет индуцирует открытие устьиц, а его сильное снижение приводит к их закрытию [24], что и должно было быть в условиях заливания. Закрытие устьиц автоматически начинает лимитировать поступление в растение атмосферного СО2 и ингибирование процесса карбоксилирования. Факт открытия устьиц в условиях заливания был отмечен для Tripolium vulgare Ness [10], что также может свидетельствовать о возможности активизации работы фотосинтетического аппарата при заливании. На основании косвенных данных ранее была высказана гипотеза о возможности факультативного подключения в этих условиях ССМ-механизма (CO2-концентрирующий механизм) с участием ФЭП-карбоксилазы [10] и активизации карбоангидразы, которая может поставлять углекислый газ для работы Рубиско из воды. Согласно данной гипотезе, это может привести к увеличению концентрации СО2 в листе, что может индуцировать открытие устьиц под водой [25]. Это предположение поддерживается наличием аэренхимы в верхней части корневища (каудекс), где может депонироваться кислород и поступающий углекислый газ. Эта ткань отсутствует у подорожника, произрастающего вне заливания. Фиксация СО2, вызывающая открытие устьиц, как и у САМ-растений в ночной период, может обеспечить доставку углекислого газа к центру карбоксилирования [25]. Данные об участии СО2-концентрирующего механизма у растений затопляемых местообитаний [3], а также о возможности использования растворенного в воде ${\text{HCO}}_{3}^{ - }$ [4] или депонированного СО2 [2] в качестве источника углекислого газа для подводного фотосинтеза известны. Если поступление углекислого газа через эпидерму листа в водной среде хорошо изучено на морских травах (Zostera marina L.), которые являются водными растениями [26], то для поступления углекислого газа через открытые устьица в лист P. maritima в водной среде требуются специальные условия. Отмечается, что листья большинства маршевых и водных растений, к которым относится и P. maritima, обладают свойством гидрофобности [27], которое способствует формированию на их поверхности уникальной газовой пленки в условиях затопления [25, 28]. В эту группу входят и растения риса, в листьях которых открыт ген LGF1 (leaf gas film), контролирующий синтез растительного воска, наноструктуры которого могут обеспечивать гидрофобность и создавать условия для перехода молекулы СО2 из водной среды в устьичную щель через газовую пленку [25].
К концу прилива отмечалась стагнация водного потока, и в этот период были получены высокие значения активности параметров флуоресценции, что свидетельствует об улучшении газообмена между растением и водной средой. С началом отлива быстрое движение воды приводило к закрытию устьиц и снижению всех показателей флуоресценции. К моменту снижения уровня воды и выхода растения в воздушную среду, на отливе увеличивался доступ атмосферного воздуха, но это резкое увеличение атмосферного СО2 также могло препятствовать открытию устьиц [25]. В связи с этим, на отливе открытие устьиц в воздушной среде происходит не сразу после выхода растения на воздух, а с запаздыванием (около часа), во время которого происходит координация необходимого углекислотного баланса между устьичными клетками и межклеточным пространством, который и приводит к их открытию. Высокая освещенность на отливе активизирует фотосинтез с использованием атмосферного СО2, сродство к которому РДФ-карбоксилазы очень высокое, а устьица за счет варьирования устьичного сопротивления контролируют эти процессы. С началом прилива при затоплении растений движение (подъем) воды приводит к закрытию устьиц. Полученные данные дают возможность объяснить высокую суточную биологическую продуктивность растений, произрастающих на приливно-отливной зоне, которые в период вегетации накапливают биомассу, сходную или большую в сравнении с растениями на супралиторали. В условиях вегетации во время длинного полярного дня на побережье Белого моря эти растения остаются функционально активными большую часть суток. Основным механизмом, поддерживающим эти растения в активном состоянии в ритмике приливно-отливной динамики, является механизм, который дважды в сутках изменяет состояние устьиц (лунный цикл). Открытые большую часть суток устьица поддерживают баланс углекислого газа в листьях P. maritima как под водой, так и на осушке и обеспечивают суточный газообмен у вида, произрастающего в суточной приливно-отливной динамике.
Однако остается открытым вопрос относительно функциональной активности фотосинтетического аппарата растений Р. maritima в условиях низкой освещенности при заливании. В суточной динамике не отмечается существенных изменений в содержании хлорофилла у растений Р. maritima в заливании и на осушке. Это означает, что высокая фотохимическая активность (по флуоресценции хлорофилла а) на осушке при высокой освещенности и в условиях заливания (сильное затенение) поддерживается имеющимся пигментным аппаратом, который должен обладать способностью к структурной перестройке в связи с изменением условий освещенности. Морская трава Zostera marina, имеющая фотосинтетический аппарат, сходный с наземными растениями [29], отличается способностью к быстрой перестройке при изменении освещенности, которая включает структурную переорганизацию листа и специфичную “переупаковку пигментов” [29]. Это обеспечивает возможность ее произрастания в широком диапазоне переменной освещенности на литорали в течение ПОЦ. Если предположить наличие сходного механизма у литорального вида P. maritima, то становится понятным и некоторое запаздывание реакции растения на изменение условий, в том числе и освещенности, в первый час прилива и отлива. Показатели флуоресценции остаются низкими, так как идут перестройки в пигментном аппарате ФС II, который адаптируется в одном случае к высокой освещенности на осушке, а в другом случае – к низкой освещенности при затоплении в прилив. В период летнего солнцестояния в ясные ночи в высоких широтах устьица P. maritima остаются открытыми, и круглосуточный фотосинтез происходит не только у наземных [30], но и у заливных растений. Однако в очень пасмурную погоду устьица в листьях P. maritima ночью закрываются на 2–4 часа, когда световой энергии оказывается недостаточно для фотосинтеза, особенно когда цикл прилива приходится на ночные часы.
Полученные данные показали, что растения P. maritima, произрастающие на супралиторали, адаптированы к суточной циркадной ритмике климатических условий, а на литорали в эту динамику включается приливно-отливная ритмика, которая поддерживается устьичным аппаратом растения.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Барышев И.А., Брызгало В.А., Дружинин П.В., Здоровеннов Р.Э., Иванов В.В., Круглова А.Н., Комулайнен С.Ф., Литвиненко А.В., Максимова М.П., Назарова Л.Е., Неелов И.А., Савчук О.П., Семенов Е.В., Сало Ю.А., Тержевик А.Ю. и др. Белое море и его водосбор под влиянием климатических и антропогенных факторов. Петрозаводск: Карельский научный центр РАН, 2007. 335 с.
Pedersen O., Sand-Jensen K., Revsbech N.P. Diel pulses of O2 and CO2 in in sandy lake sediments inhabited by Lobelia dortmanna // Ecol. 1995. V. 76. P. 1536.
Bowes G., Rao S.K., Estavillo G.M., Reiskind J.B. C-4 mechanisms in aquatic angiosperms: comparisons with terrestrial C-4 systems // Funct. Plant Biol. 2002. V. 29. P. 379.
Maberly S.C., Madsen T.V. Freshwater angiosperm carbon concentrating mechanisms: processes and patterns // Funct. Plant Biol. 2002. V. 29. P. 393.
Сергиенко Л.А. Флора и растительность побережий Арктики и сопредельных территорий. Петрозаводск: ПетрГУ, 2008. 225 с.
Colmer T.D. Long-distance transport of gases in plants: a perspective on internal aeration and radial oxygen loss from roots // Plant, Cell Environ. 2003. V. 26. P. 17.
Горышина Т.К. Фотосинтетический аппарат растений и условия среды. Л.: ЛГУ, 1979. 204 с.
Mommer L., Visser E.J.W. Underwater photosynthesis in flooded terrestrial plants: a matter of leaf plasticity // Ann. Bot. 2005. V. 96. P. 581.
Colmer T.D., Winkel A., Pedersen O. A perspective on underwater photosynthesis in submerged terrestrial wetland plants // AoB PLANTS. 2011. V. 2011: plr030. https://doi.org/10.1093/aobpla/plr030
Markovskaya E.F., Kosobryukhov A.A., Morozova K.V., Gulyaeva E.N. Photosynthesis and anatomic-morphological characteristics of sea aster leaves on the White Sea coast // Russ. J. Plant Physiol. 2015. V. 62. P. 830.
Карташов А.В. Значение морфофизиологических особенностей растений подорожника приморского и подорожника большого для поддержания водно-солевого баланса при засолении: Автореф. дисс. …. канд. биол. наук. Москва: ИФР РАН, 2013. 29 с.
Раменская М.Л., Андреева В.Н. Определитель высших растений Мурманской области и Карелии. Л.: Наука, 1982. 432с.
Хромов С.П., Петросянц М.А. Метеорология и климатология. Москва.: МГУ, 2001. 528 с.
Агроклиматический справочник по Карельской АССР. Ленинград: Гидрометеоиздат, 1959. 184 с.
Bouma E. Weather and crop protection. Zutphen: Roodbont Publishers, 2008. 84 p.
Макаров М.В., Рыжик И.В., Воскобойников Г.М. Влияние глубины произрастания на морфофизиологические показатели Fucus vesiculosus L. Баренцева моря // Альгология. 2012. Т. 22, № 4. С. 345.
Фурст Г.Г. Методы анатомо-гистохимического исследования растительных тканей. Москва: Наука, 1975. 155 с.
Мокроносов А.Т., Борзенкова Р.А. Методика количественной оценки структуры функциональной активности фотосинтезирующих тканей и органов // Труды по прикладной ботанике, генетике и селекции. 1978. Т. 61. Вып. 3. С. 119.
Практикум по физиологии растений / Под ред. И.И. Гунара. Москва: Колос, 1972. 168 с.
Schneider C.A., Rasband W.S., Eliceiri K.W. NIH Image to ImageJ: 25 years of image analysis // Nat. Methods. 2012. V. 9. P. 671.
Сапожников Д.И., Маслова Т.Г., Попова О.Ф., Попова И.А., Королева О.Я. Метод фиксации и хранения листьев для количественного определения пигментов пластид // Ботанический журнал. 1978. Т. 63. № 11. С. 1586.
Schindler C., Lichtenthaler H. Is there a correlation between light-induced zeaxanthin accumulation and quenching of variable chlorophyll a fluorescence // Plant Physiol. Biochem. 1994. V. 32. P. 813.
Jackson D.D., Andrews G.L., Claridge E.L. Optimum WAG ratio vs. rock wettability in CO2 flooding // Annual Technical Conference and Exhibition. Las Vegas, Nevada. 1985. https://doi.org/10.2118/14303-MS
Зитте П., Вайлер Э.В., Кадерайт Й.В., Брезински А., Кёрнер К. Ботаника. Москва: Академия, 2007. 368 с.
Kurokawa Y., Nagai K., Huan P.D., Shimazaki K., Qu H., Mori Y., Toda Y., Kuroha T., Hayashi N., Aiga S., Itoh J.I., Yoshimura A., Sasaki-Sekimoto Y., Ohta H., Shimojima M., et al. Rice leaf hydrophobicity and gas films are conferred by a wax synthesis gene (LGF1) and contribute to flood tolerance // New Phytol. 2018. V. 218. P. 1558.
Larkum A., Davey P., Kuo J., Ralph P., Raven J. Carbon-concentrating mechanisms in seagrasses // J. Exp. Bot. 2017. V. 68. P. 3773.
Neinhuis C., Barthlott W. Characterization and distribution of water-repellent, self-cleaning plant surfaces // Ann. Bot. 1997. V. 79. P. 667.
Colmer T.D., Pedersen O. Underwater photosynthesis and respiration in leaves of submerged wetland plants: gas films improve CO2 and O2 exchange// New Phytol. 2008. V. 177. P. 918.
Larkum A. Seagrasses: biology, ecology and conservation. Netherlands: Springer, 2006. 690 p.
Лукьянова Л.М. Эколого-физиологические аспекты изучения пигментной системы растений. 1. Влияние внешних факторов, сезонная и суточная динамика // Ботанический журнал. 1982. Т. 67. № 3. С. 265.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


