Физиология растений, 2020, T. 67, № 1, стр. 20-34
Нитчатые цианобактерии как прототип многоклеточных организмов
Т. В. Потапова a, О. А. Кокшарова a, b, *
a Московский государственный университет имени М.В. Ломоносова,
Научно-исследовательский институт физико-химической биологии имени А.Н. Белозерского
Москва, Россия
b Институт молекулярной генетики Российской академии наук
Москва, Россия
* E-mail: koksharova@genebee.msu.ru
Поступила в редакцию 13.03.2019
После доработки 21.03.2019
Принята к публикации 21.03.2019
Аннотация
Нитчатые цианобактерии принадлежат к древнейшим организмам нашей планеты. Многие цианобактерии существуют в виде трихомов – нитей из сотен клеток, связанных межклеточными взаимодействиями. В трихомах некоторых цианобактерий в отсутствии азота развивается специализация клеток для решения разных функциональных задач: фотосинтеза с выделением кислорода и фиксации азота, так что трихом превращается в сложный организм (сложную систему) с обменом продуктами фотосинтеза и фиксации азота между вегетативными клетками и гетероцистами. Передача молекул может происходить через периплазму или через специальные контактные структуры, называемые микроплазмадесмами, септосомами, септальными контактами или нанопорами. У нитчатых цианобактерий запасание и передача энергии на клеточном уровне сопровождается электрическими процессами, происходящими в клеточных мембранах. Теоретический и модельный анализ внеклеточных токов, индуцированных локальным освещением трихомов Phormidium uncinatum, показал, что трихомы представляют собой ассоциации клеток, организованные в единые кабельные структуры, способные к передаче энергии вдоль трихома. Для современной молекулярной генетики нитчатые цианобактерии с разделением функций между соседними клетками – прообраз многоклеточного организма и удобная модель для выяснения механизмов регуляции многоклеточности, которая, по-видимому, появлялась не раз в ходе эволюции в разных филогенетических группах, включая бактерии, грибы, водоросли, растения.
ВВЕДЕНИЕ
Многие процессы на разных уровнях организации живых систем опираются на сходные принципы, которые приобретают лишь некоторые различия в деталях молекулярных механизмов при усложнении генетических программ в ходе эволюции [1]. Опираясь на представления о сходстве протекания естественных процессов в различных живых системах, можно сосредоточить внимание на изучении не миллионов различных видов, обитающих на планете, а на модельных объектах, таких как дрозофила, мышь, арабидопсис, пшеница, рис, дрожжи, хламидомонада, реснитчатые простейшие, кишечная палочка, ряд бактериальных вирусов. Важное место в этом ряду занимают нитчатые цианобактерии. По состоянию на ноябрь 2018 г. расшифрованы геномы около 328 видов и штаммов цианобактерий (https://www.ncbi.nlm.nih.gov/ g-enome/browse#!/overview/cyanobacteria). К наиболее популярным модельным видам нитчатых цианобактерий относят: Anabaena sp. штаммы ATCC 29413, PCC 7120; Nostoc sp. штамм ATCC 29133 [2].
Цианобактерии принадлежат к древнейшим фотоавтотрофным организмам нашей планеты. Они распространены повсеместно. Появление фотосинтеза с выделением кислорода у древних цианобактерий около 2.4–2.7 млрд. лет назад было одним из главных эволюционных факторов в истории Земли, положившим начало эволюции эукариотов [3]. За счет активности цианобактерий в атмосфере и в поверхностных водах накопилось достаточно кислорода, чтобы появились формы жизни, использующие кислород, в том числе животные с высокой скоростью кислородного дыхания [4]. Древние цианобактерии положили начало симбиозу пластид с водорослями и высшими растениями [5–7]. В настоящее время пластиды растений и сами цианобактерии, населяющие большинство разнообразных природных ниш, создают большую долю первичной продукции, лежащей в основе пищевых цепей биосферы. Осуществляя фотосинтез с выделением кислорода, они играют ключевую роль в круговороте углерода в биосфере. Кроме того, цианобактерии – основные фиксаторы азота в океанах и в наземных экосистемах, поставляющие связанный азот в биосферу.
Многие цианобактерии существуют в виде трихомов – нитей из сотен клеток, связанных межклеточными взаимодействиями. Судя по ископаемым остаткам цианобактерий, многоклеточность появилась примерно 2.45–2.22 млрд. лет тому назад. Сравнительный филогенетический анализ последовательностей 16S рРНК показал, что нитчатые цианобактерии появились раньше, чем произошла великая кислородная катастрофа (Great Oxidation Event), и, видимо, играли ключевую роль в этом событии [8]. В результате сравнительного филогенетического анализа последовательностей генов 16S рРНК морфологически и генетически разных таксонов цианобактерий был сделан интересный вывод о том, что большинство современных цианобактерий происходит от одного многоклеточного предка и возврат к одноклеточности происходил не менее 5 раз [9].
К важнейшим универсальным естественным технологиям биологических систем [1] следует отнести связь мембранного электрогенеза с клеточной энергетикой. Первый закон биоэнергетики гласит: “Живая клетка избегает прямой утилизации энергии внешних ресурсов при совершении полезной работы. Сначала она трансформирует эту энергию в конвертируемую форму ATФ, ΔµH+ или ΔµNa+, и использует ее затем в различных энергоемких процессах” [10, стр. 12–16]. Транспорт веществ через плазматическую мембрану против градиента концентраций требует энергетических затрат. Первичные мембранные транспортеры – встроенные в мембрану белки, непосредственно использующие для своей работы энергию света, редокс-энергию или гидролиз АТФ. Вторичные мембранные транспортеры – встроенные в мембрану белки, переносящие через мембрану те или иные молекулы путем сопряженного транспорта с определенным ионом по его градиенту. В этом случае энергия расходуется предварительно на создание ионного градиента. В обзоре [2] рассмотрено современное состояние вопроса о системах транспорта органических соединений у цианобактерий, что очень важно ввиду большого экологического и промышленного значения этих микроорганизмов.
В эукариотических клетках первичные процессы трансформации энергии внешних источников в конвертируемые формы происходят в мембранах органелл: митохондрий и хлоропластов. У цианобактерий эти процессы протекают в мембранах тилакоидов и частично в цитоплазматических мембранах [11, 12]. В настоящее время достаточно полно изучены на молекулярно-генетическом и биофизическом уровнях строение и функции основных биоэнергетических комплексов, включая системы переноса электронов в фотосинтетических комплексах, захватывающих энергию света и передающих ее протонным АТФазам. Как же регулируется скоординированное функционирование отдельных биоэнергетических комплексов в мембранах конкретных типов живых клеток и далее в кооперативных взаимодействиях соседних клеток? Многие аспекты этой проблемы рассматриваются в специальном сборнике “Organization and dynamics of bioenergetic systems in bacteria” [13]. В этом сборнике освещены такие вопросы, как транспорт электронов в дыхательных цепях плазматических мембран гетеротрофных бактерий и в тилакоидных мембранах цианобактерий. Большое внимание уделено пространственному распределению транспорта электронов и протон-движущей силы в разных мембранных областях; рассмотрены биоэнергетические мембраны как динамичные системы, а также биогенез мембран и вопросы регуляции и развития строения и функций мембран.
Изучение фотоэлектрической активности нитчатых цианобактерий представляет собой интересную и перспективную возможность исследования закономерностей участия в функционировании трихома электрических процессов, происходящих в клеточных мембранах. Во второй половине прошлого века отечественными авторами при рассмотрении функциональной роли взаимодействий между клетками через проницаемые межклеточные контакты [14] был проведен теоретический и модельный анализ внеклеточных токов, индуцированных локальным освещением трихомов нитчатой цианобактерии Phormidium uncinatum [15–18]. Анализ показал, что трихомы представляют собой ассоциации клеток, организованные в единые кабельные структуры, способные к передаче энергии на значительное расстояние, так же как мицелиальные грибы и монослойные культуры животных клеток [19–21]. В работе [22] описан один из вариантов использования живых цианобактерий (Synechocystis sp. PCC 6803) как генераторов электрического тока, что отвечает современным целям “зеленой электроники” [23, 24].
Данный обзор посвящен анализу успехов и проблем в исследованиях разделения функций между клетками у нитчатых цианобактерий. Особое внимание уделено возможности эффективной энергетической кооперации между фотосинтезирующими и азотфиксирующими клетками на основе электрических (электрогенных) процессов в клеточных мембранах и электрической связи между клетками трихома.
ФОТОСИНТЕЗ И ЭЛЕКТРОГЕНЕЗ У ЦИАНОБАКТЕРИЙ
Цианобактерии способны в ходе фотосинтеза с помощью процесса переноса электронов преобразовывать энергию света в формы, доступные для клеточного метаболизма, например, в трансмембранную разность электрических потенциалов (МП), которая в свою очередь обеспечивает энергией работу других внутримембранных белков, не контактирующих непосредственно с белками, воспринимающими энергию света [25, 26, стр. 84–85]. Одним из таких белков является фермент, синтезирующий АТФ из АДФ и фосфата: АТФ-синтаза (F0F1-АТФаза). Этот эволюционно консервативный фермент присутствует в плазматических и тилакоидных мембранах бактерий, в тилакоидных мембранах растений, в хлоропластах водорослей и во внутренних мембранах митохондрий [27]. Энергию для синтеза АТФ дает движение протонов через биомембрану по градиенту электрохимического потенциала. Трансмембранная разность потенциалов создается за счет переноса электронов через мембрану ферментными комплексами дыхательных цепей или фотосинтеза и требует активного поглощения энергии света.
У цианобактерий есть три типа мембран: наружная, плазматическая и тилакоидная. Установлено, что у цианобактерий процесс фотосинтеза происходит в мембранах тилакоидов [28]. Только у одноклеточной цианобактерии Gloeobacter violaceous, рано отделившейся в эволюции от остальных цианобактерий, тилакоиды отсутствуют, и фотосинтез происходит в специальных участках цитоплазматической мембраны [29]. Ряд авторов не исключает, что плазматическая и тилакоидная мембраны связаны в единую сеть [30–32] или, по крайней мере, полагает, что мембраны тилакоидов у нитчатых цианобактерий имеют точки соприкосновения с плазматическими мембранами [28]. В клетках Synechocystis sp. PCC 6803 находят прямые контакты между цитоплазматической и тилакоидной мембранами [33–35]. Возможно, такие мембранные контакты позволяют осуществляться диффузии водорастворимых и липидорастворимых молекул по системе мембран [35].
Группой авторов [36] для одноклеточной цианобактерии Synechocystis sp. PCC 6803 разработана процедура разделения плазматических и тилакоидных мембран. С помощью иммуноблоттинга изолированных очищенных мембран показано, что плазматические мембраны содержат много белковых компонентов, тесно связанных с реакционными центрами обеих фотосистем, причем эти белки присутствуют в мембранах в форме хлорофилл-содержащих мультибелковых комплексов. Биогенез тилакоидной мембраны коррелирует с развитием и процессингом цитоплазматической мембраны. Предполагается, что плазматическая, а не тилакоидная мембрана является местом многих ранних стадий биогенеза комплексов фотосинтезирующих реакционных центров у этих цианобактерий [36].
В исследованиях функциональной активности фотосистем цианобактерий задействованы самые современные технологии. С помощью наблюдений, проведенных с использованием гиперспектральной конфокальной флуоресцентной микроскопии, описана физическая сегрегация фотосинтетических комплексов у Synechocystis sp. PCC 6803: во внутренних областях тилакоида концентрируется фотосистема I (ФС I), в то время как фикобилисомы и фотосистема II (ФС II) преимущественно локализуются снаружи тилакоидов [37, 38]. В то же время совместное использование электронной микроскопии и иммунохимии показывает, что у Synechococcus sp. PCC 7942 АТФазы и комплексы ФС I локализуются в основном на наружной поверхности мембраны тилакоидов, тогда как ФС II и цитохром b6f распределены случайным образом между внутренней и наружной поверхностями мембраны тилакоидов [39].
Недавно в арсенале исследователей цианобактерий появилась техника криоэлектронной томографии – метод исследования объекта, основанный на измерении интенсивности рассеянного пучка нейтронов на объекте при малых значениях углов рассеяния (малоугловое рассеяние нейтронов), а также конфокальная микроскопия и атомно-силовая микроскопия [40]. Исследования с помощью малоуглового нейтронного рассеяния показали, что свет может вызывать обратимую реорганизацию в тилакоидной мембране цианобактерий [41, 42]. Варьирование расстояния между тилакоидными мембранами рассматривается как регуляторный фактор, коррелирующий со многими фотосинтетическими процессами in vivo.
В реакционном центре ФС II происходит серия индуцированных светом переносов электронов, преобразующая энергию света в энергию электрохимического потенциала и вызывающая расщепление воды. Реакции переноса электронов сопряжены с образованием необходимого для работы АТФ-синтазы электрохимического градиента через тилакоидную мембрану. Помимо этого, синтезируется НАДФ · H [43]. АТФ и НАДФ · H расходуются в процессе фиксации СО2 в цикле Кальвина и в других анаболических процессах, происходящих в клетках цианобактерий. Исследованы детали функционирования генов и белков, обеспечивающих уникальную способность цианобактерий активно поглощать из атмосферы углекислый газ, необходимый для осуществления темновых реакций фотосинтеза [44].
В последние десятилетия усовершенствование технологий структурной биологии принесло много информации о молекулярных деталях структуры и функции комплексов, транспортирующих электроны в тилакоидных мембранах цианобактерий. Зарегистрированы атомные структуры индивидуальных белковых комплексов и проведен их спектроскопический анализ [45, 46]. Но еще остается масса вопросов о том, как синтезируются и как деградируют отдельные компоненты транспорта электронов, как регулируются их функции, как они взаимодействуют друг с другом в одной и той же мембране или в разных клеточных мембранах. А также остается проблема понять, как все работает и тонко регулируется в живой клетке.
МЕМБРАННЫЙ ТРАНСПОРТ В КЛЕТКАХ ЦИАНОБАКТЕРИЙ
Помимо плазматической мембраны, клетки цианобактерий окружены наружной мембраной и слоем пептидогликана, а внутри клеток большинства цианобактерий содержатся тилакоидные мембраны, в которых размещаются системы фотосинтеза. На интактных клетках, изолированных мембранных везикулах и протеолипосомах, включающих специфические белки-переносчики, изучались свойства конкретных цианобактериальных систем ионного транспорта, их кинетика и энергообеспечение. К сожалению, пока мало данных, характеризующих особенности транспортных процессов в разных типах мембран цианобактерий.
Особенности строения трихома цианобактерий допускают передачу из клетки в клетку конкретных ионов и молекул через периплазму. Для этого в цитоплазматических мембранах соседних клеток должны присутствовать специфические транспортные белки, переносящие определенные вещества через клеточную мембрану в нужном направлении. В обзоре [47] приводятся данные о многих транспортерах в цитоплазматических мембранах нитчатых цианобактерий, образующих гетероцисты, включая транспортеры аминокислот, оксокислот и сахарозы, а также некоторых аминокислот, необходимых для оптимального диазотрофного роста. Однако в целом проблема возможностей диффузионного обмена между вегетативными клетками и гетероцистами через периплазму дискутируется и еще далека от решения.
Для тилакоидной мембраны модельной цианобактерии Synechocystis sp. PCC 6803 описаны представители всех основных известных типов мембранных каналов и переносчиков [48]: (1) K+-каналы, которые у этого объекта принимают участие в регуляции электрического компонента протон движущей силы, (2) первичные транспортеры, представлены АТФазой, транспортирующей ионы Ca2+, необходимые для функционирования тилакоидной мембраны, и (3) вторичные транспортеры в виде ионообменника Na+/H+, обеспечивающего баланс между ионами натрия и калия и снижение токсического действия избытка ионов Na+ .
В обзоре Stebegg с соавт. [2] рассмотрены современные данные о транспорте разных классов органических соединений через плазматические мембраны модельных видов цианобактерий. В частности, приводятся детали транспорта сахаров, включая моносахариды (глюкозу, ксилозу, арабинозу и др.), дисахариды (сахарозу, мальтозу, лактозу и др.) и полисахариды. Рассматриваются детали транспорта аминокислот и пептидов, карбоновых кислот, спиртов, органических красителей, ДНК, мочевины, гербицидов, антибиотиков и других соединений.
Очень важной для цианобактерий группой транспортных белков являются так называемые ABC-транспортеры: внутримембранные белки, использующие энергию АТФ для переноса через мембрану веществ против концентрационных градиентов [49]. Все такие транспортеры имеют в составе трансмембранный домен и две связанных с ним АТФазы, локализованные в цитоплазме. Четвертичная структура ABC-транспортеров эволюционно достаточна консервативна. Механизм транспорта основан на конформационных изменениях трансмембранного домена за счет гидролиза АТФ соответствующим АТФазным доменом.
По мнению Davidson с соавт. [50], ABC-транспортеры можно отнести к универсальным технологиям биологических систем, так как они распространены во всех царствах живого и, по-видимому, имеют общего предшественника. Функционально ABC-транспортеры можно разделить на три группы: (1) импортеры пептидов, аминокислот, моно- и олигосахаридов, ионов, металлов и витаминов; (2) экспортеры таких веществ, как липиды, полисахариды и белки, включая токсины и факторы вирулентности; и (3) не транспортирующие никаких веществ, но принимающие участие в репарации ДНК и транслокации мРНК [50].
По данным Shvarev и Maldener [49], геном модельной нитчатой цианобактерии Anabaena sp. PCC 7120, способной образовывать гетероцисты, содержит 187 открытых рамок считывания, кодирующих домены ABC-транспортеров. Это примерно две трети от 313 генов, кодирующих транспортные и связанные с ними белки и примерно 3% всего генома. Сюда входят 91 домен, связывающий АТФ, 51 пермеазный домен (трансмембранный домен) и 38 доменов, связывающих белки периплазмы. Авторы обзора [49] детально рассматривают участие конкретных ABC-транспортеров в приспособлении Anabaena sp. PCC 7120 к диазотрофному росту.
Для цианобактерий функционирование ABC-транспортеров является необходимым условием выживания в окружающей среде и охарактеризованы они были впервые именно для цианобактерий [50–52]. К сожалению, пока недостаточно данных in vivo о динамике и функционировании в фотосинтезирующих мембранах цианобактерий наиболее известной системы первичного транспорта – АТФазы, перемещающей ионы H+ [12]. В то же время эти знания принципиально важны для понимания функционирования трихома с разделением труда между вегетативными клетками и гетероцистами.
В последнее время усилился интерес к электрическим явлениям у бактерий. В работе Prindle с соавт. [53] оценивали мембранный потенциал (МП) бактериальных пленок с помощью флуоресцентного индикатора МП – тиофлавина T (ThT) и установили связь между метаболическими осцилляциями и колебаниями МП. С помощью математического моделирования авторы пришли к выводу, что бактерии меняют в состоянии стресса проницаемость калиевых каналов и используют возникающие при этом осцилляции МП как электрические сигналы соседним клеткам в составе биопленки. Авторы полагают, что волна деполяризации может ограничить накопление глутамата или выделение аммония периферическими клетками, создавая более благоприятные условия для функционирования клеток в центре бактериального пласта. Рассмотрена возможность электрических взаимодействий в бактериальных биопленках, основанная на регуляции проводимости калиевых каналов плазматической мембраны. Авторы приводят обзор данных о наличии в плазматических мембранах бактерий важнейших ионных каналов, известных и для других организмов: калиевых, натриевых и хлорных. Предлагается гипотеза о возможности электрических взаимодействий в бактериальных биопленках, основанная на регуляции проводимости калиевых каналов плазматической мембраны. В качестве потенциальных участников электрических взаимодействий рассматриваются системы транспорта электрически заряженных метаболитов, таких как глутамат (–) и аммоний (+), транспорт которых зависит от трансмембранной разности электрического потенциала и протон-движущей силы.
“РАЗДЕЛЕНИЕ ТРУДА” И МЕЖКЛЕТОЧНЫЙ ОБМЕН В ТРИХОМАХ ЦИАНОБАКТЕРИЙ
В трихомах некоторых цианобактерий в отсутствии азота развивается специализация клеток для решения разных функциональных задач: вегетативные клетки осуществляют фотосинтез с выделением кислорода, а гетероцисты фиксируют атмосферный азот. При этом имеет место межклеточный обмен метаболитами и регуляторными соединениями. В диазотрофных нитях цианобактерий благодаря межклеточному обмену восстановленный углерод транспортируется в гетероцисты, а фиксированный азот в вегетативные клетки [47]. При статистическом анализе флуктуаций в экспрессии генов отдельными клетками и корреляции этих флуктуаций вдоль трихома наблюдается корреляция в экспрессии генов у соседних клеток [54], что свидетельствует в пользу функционирования межклеточной связи вдоль трихомов цианобактерий.
Передача ионов и молекул между клетками может происходить через периплазму [55–57] или через специальные контактные структуры, называемые микроплазмадесмами, септосомами, септальными контактами или нанопорами [57–60]. В работе [61] показано, что в септах между гетероцистами и вегетативными клетками есть каналы диаметром 12 нм и длиной 20 нм. В септах между вегетативными клетками находят 100–250 микроплазмадесм [62] и около 50 микроплазмадесм – между вегетативными клетками и гетероцистами [58].
Показано, что между клетками вдоль трихома распространяется локально инъецированный маркер проницаемых контактов – краситель флуоресцеин [16]. Функционирование путей транспорта веществ между клетками исследовано также с помощью таких флуоресцентных зондов, как 5-карбоксифлуоресцеин (376 Д) и кальцеин (622 Д) методом FRAP-анализа (восстановление флуоресценции после фотовыжигания). Для модельной цианобактерии Anabaena sp. PCC 7120 в экспериментах с восстановлением флуоресценции после фотовыжигания показано, что кальцеин диффундирует как между вегетативными клетками, так и между ними и гетероцистами, причем эта диффузия в 10 раз увеличена в трихомах, растущих в среде с дефицитом азота, по сравнению с трихомами, растущими в присутствии нитрата [63]. Межклеточный обмен кальцеином отсутствует у Oscillatoria – нитчатой цианобактерии, не образующей гетероцисты [64]. Кальцеин и 5‑карбоксифлуоресцеин не участвуют в метаболизме клетки, в отличие от флуоресцентного индикатора эскулина (гликозилированного кумарина, 340 Д), являющегося аналогом сахарозы и также недавно введенного в практику тестирования межклеточного обмена [65]. Связь между клетками позволяет мелким молекулам, таким как, например, сахароза, перемещаться из вегетативных клеток в гетероцисты [65–69], а дипептиду бета-аспартил-аргинину – из гетероцист в вегетативные клетки [70, 71].
Межклеточный обмен нарушен у мутантов, характеризующихся дефектами в белках SepJ, FraC и/или FraD (по данным, полученным с использованием флуоресцентных индикаторов [63–65, 72–74]). В то же время у разных мутантов нарушен обмен разными метками.
В принципе не исключается, что вещества, проходящие через септальные контакты, могут вытекать в периплазму и оттуда попадать в соседние клетки с помощью специфических транспортеров. Например, можно предполагать, что в цитоплазматических мембранах вегетативных клеток имеются экспортеры сахаров, а у гетероцист – импортеры и, наоборот, у гетероцист – экспортеры аминокислот, а у вегетативных клеток – импортеры [55]. Инактивация двух транспортеров аминокислот, функционирующих только в вегетативных клетках, специфически нарушает N2-зависимый рост Anabaena sp. PCC 7120, доказывая роль этих транспортеров в диазотрофной физиологии [75, 76]. Значение периплазмы как пути обмена веществами предполагает низкую проницаемость наружной мембраны для определенных метаболитов, что было недавно показано для сахарозы и глутамата [77]. Многие транспортеры охарактеризованы для цитоплазматических мембран модельного вида цианобактерии Anabaena [78], включая транспортеры аминокислот, оксокислот и сахарозы [79, 80], а также некоторых аминокислот, необходимых для оптимального диазотрофного роста [75, 76].
Сообщается об участии ABC-экспортера HetG в передаче PatS-белка и сигнала, обусловленного активностью белка HetN и передаваемого от гетероцист вегетативным клеткам, а также об участии белка SepJ в передаче этих регуляторов, по крайней мере, между вегетативными клетками. В работе Frain с соавт. [81] содержится обзор основных путей транслокации белков, имеющих отношение к межклеточному обмену: general secretory (Sec), twin arginine translocation (Tat) и signal recognition particle (SRP), а также рассмотрена важность организации разных типов мембран и взаимоотношений между транслокацией, интеграцией и размещением белков в различных мембранах цианобактерий. Подвижность трихомов требует координации активности молекулярных моторов в разных клетках, что также требует коммуникации между клетками [82].
В обзоре Flores и Herrero [83] рассматриваются специальные механизмы, посредством которых цианобактерии: (1) образуют два типа клеток с разной метаболической активностью: фотосинтезирующие вегетативные клетки и фиксирующие азот гетероцисты; (2) – удерживают их вместе и (3) позволяют этим клеткам обмениваться необходимыми для роста веществами. Особая роль в функционировании трихомов нитчатых цианобактерий принадлежит межклеточным контактам, содержащим SepJ. С этим белком взаимодействует и белок ZipN [84], идентифицированный ранее как важный компонент белкового комплекса, ответственного за деление клеток цианобактерий. Формирование гетероцист из вегетативных клеток зависит от активности целого ряда белков, регулирующих генетическую программу дифференцировки. Эта программа запускается как ответ на лишение азота при участии белка NtcA, глобального контролируемого азотом фактора транскрипции у цианобактерий, и нуждается в специфических регуляторах, таких как HetR, необходимых для дифференцировки и синтезируемых в клетке в первые часы азотного голодания. Важно понять функциональные взаимодействия между NtcA и HetR и то, как другие регуляторы не допускают превращения слишком многих вегетативных клеток в гетероцисты, чтобы представить в итоге процесс, ведущий к образованию настоящей многоклеточной бактерии [85]. Количество гетероцист в трихоме находится также под строгим генетическим контролем. Дифференцировка избыточного количества гетероцист предотвращается диффундирующими ингибиторами, образующимися в прогетероцистах или гетероцистах [47]. В ингибировании участвуют продукты генов patS и hetN [86–88].
Группа авторов [89] исследовала диазотрофный рост и механизмы межклеточного транспорта в трихомах Cylindrospermopsis raciborskii CS-505, состоящих из 100 вегетативных клеток и только двух концевых гетероцист. Было показано, что скорость передачи флуоресцентных маркеров между быстро растущими концевыми вегетативными клетками и гетероцистами выше, чем между медленно растущими вегетативными клетками в середине трихома.
Большой интерес представляет вопрос о роли септированных контактов и периплазмы в обмене молекулами между клетками. С помощью анализа мутантов, не способных фиксировать азот и фрагментирующихся в жидкой среде, выявлена роль продуктов нескольких генов (fraC, fraD, fraG (другое название – sepJ)) в межклеточной передаче молекул [72–74]. В обзоре, посвященном анализу результатов исследований морфологии, физиологии и генетики межклеточных взаимодействий у нитчатых цианобактерий [74], отмечено, что для цианобактерии Anabaena sp. PCC 7120 были охарактеризованы, помимо обязательных компонентов септальных контактов: белков SepJ, FraC и FraD, – еще и белки, необходимые для формирования и функционирования нанопор. Среди них идентифицированы некоторые амидазы, белки, связывающие пептидогликан, и несколько мембранных транспортеров. Также рассмотрены экспериментальные данные, относящиеся к изучению нарушений межклеточного обмена у мутантов Anabaena, и подчеркнуто функциональное сходство межклеточных септальных контактов цианобактерий со щелевыми контактами клеток животных [74].
Таким образом, принято считать, что в трихомах с “разделением труда” необходим прямой диффузионный перенос веществ через межклеточные контакты, благодаря которому вегетативные клетки получают из гетероцист органические соединения, содержащие азот [71, 90], а гетероцисты получают из вегетативных клеток продукты фиксации углекислого газа [65, 90]. В то же время исследование электрических кабельных свойств трихома позволяет считать, что в гетероцистах могут непосредственно функционировать системы мембранного транспорта, способные использовать для своей работы энергию мембранного потенциала, в первую очередь – мембранные АТФазы [14–21]. Гетероцисты нуждаются в АТФ как для работы нитратредуктазы, так и для активности ABC-транспортеров [49]. Не случайно в нитях цианобактерий, состоящих из дифференцированных клеток, гетероцисты располагаются достаточно удобно (через каждые 10–15 вегетативных клеток [47]), чтобы с помощью электрических токов через межклеточные контакты эффективно использовать энергию мембранного потенциала, генерируемого вегетативными клетками.
ЭЛЕКТРИЧЕСКАЯ СВЯЗЬ В ТРИХОМАХ И ВОЗМОЖНОСТЬ ПЕРЕДАЧИ ЭНЕРГИИ МЕЖДУ КЛЕТКАМИ
В 1946 г. Hodgkin и Rushton [91] экспериментально показали, что такие одиночные волокна, как гигантский аксон кальмара, ведут себя подобно электрическому кабелю, к распространению электрического потенциала в котором полностью применима теория, разработанная ранее лордом Томсоном для описания распространения электричества в телеграфном кабеле, проложенном по дну Тихого океана. В аксон вводили микроэлектрод и пропускали через него ток, создавая в этой точке изменение мембранного потенциала. С помощью второго микроэлектрода измеряли разность потенциалов на мембране на разных расстояниях от первого электрода. Потенциал спадал по экспоненте, и непосредственно по графику спада потенциала можно было оценить характерные параметры кабеля. Измеряя напряжение на мембране непосредственно около токового электрода и зная силу пропускаемого тока, можно найти так называемое входное сопротивление волокна (Rвх), которое ровно в два раза меньше характеристического, так как ток, входящий в волокно, растекается в двух направлениях. Исходя из оценки диаметра волокна, были рассчитаны сопротивление мембраны аксона, оказавшееся очень малым по сравнению с изоляцией технических кабелей, и удельное сопротивление аксоплазмы, оказавшееся, напротив, примерно в 25 миллионов раз выше, чем у меди.
Работа Ходжкина, Хаксли и Раштона была удостоена Нобелевской премии, а введение в практику работы электрофизиологов представлений кабельной теории способствовало бурному прогрессу в этой области. В частности, эти представления были успешно использованы при анализе электрических взаимодействий в разнообразных системах живых клеток, связанных проницаемыми межклеточными контактами: многоклеточных микроорганизмах, развивающихся зародышах, сердечной и мышечной ткани и др. [14]. Понятия большого или малого расстояния для биологических кабелей определяются константой затухания и измеряются в метрах, сантиметрах и т.д. Понятия “быстро” или “медленно” характеризует так называемая постоянная времени, зависящая от удельного сопротивления и емкости мембраны. Размерность “постоянной времени” для биологических кабелей – секунды.
С помощью стандартных методических приемов, разработанных для изучения генерации и распространения потенциалов в нервных и мышечных волокнах, в 80-х гг. прошлого века в прямых электрофизиологических экспериментах было показано, что действие света приводит к появлению разности потенциалов (электроотрицательность внутри клетки) на клеточных мембранах цианобактерии Phormidium uncinatum [14–17]. Теоретический и модельный анализ внеклеточных токов, индуцированных локальным освещением пучка трихомов Ph. uncinatum, показал, что трихомы представляют собой ассоциации клеток, организованные в единые кабельные структуры (рис. 1).
Рис. 1.
Распространение электричества вдоль пучка трихомов нитчатой цианобактерии Phormidium uncinatum [14, стр. 93–94]. (а) – Схема внеклеточной регистрации фотоэлектрических ответов: пучок параллельно лежащих трихомов помещали в бороздку на дно плексигласовой камеры с дистиллированной водой. U1, U2, U3 — серебряные электроды, соединенные с индифферентным электродом. (б) – Форма ответов пучка трихомов на локальное освещение лучом (d = 20 мкм) фотосинтетически активного света: сплошные линии – теоретические кривые, построенные для эквивалентного электрического кабеля при положении регистрирующих электродов на расстояниях x1 = 0, x2 = 400 мкм и x3 = 800 мкм от светового пятна; пунктирные линии – формы регистрируемых в эксперименте ответов для тех же х1, х2 и х3. (в) – Схема строения участка трихома: 1 – внеклеточная среда; 2 – проницаемые межклеточные каналы; 3 – клеточная мембрана; 4 – внутриклеточная среда; 5 – линии протекания электрических токов при локальном освещении трихома. (г) – Эквивалентная электрическая схема участка трихома: rk – сопротивление межклеточных каналов; rb – сопротивление внешней среды; G – утечка через клеточную мембрану; C – емкость клеточной мембраны; E – генератор.
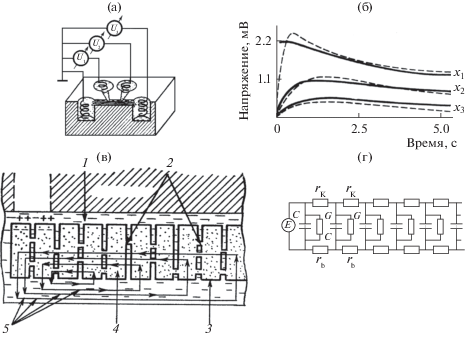
При внеклеточных электрических отведениях от пучка трихомов Ph. uncinatum [14–17] или от одиночного трихома [18, 92] мы регистрировали значительную гиперполяризацию темновых участков трихомов в ответ на локальное освещение небольшой части клеток фотосинтетически активным светом. С позиций представлений кабельной теории, уменьшение величины электрических токов при локальной продолжительной засветке трихома объясняется гиперполяризацией плазматических мембран неосвещенных участков трихома, обусловленной наличием электрической связи через межклеточные каналы [14–17]. Характер регистрируемых при локальном освещении пучка трихомов электрических токов и сравнение их с реакциями на локальное включение генератора в искусственной кабельной схеме, а также с ответами, рассчитанными по параметрам математической модели, описывающей эквивалентный электрический кабель, подтверждает предположение о кабельном строении трихома и позволяет получить количественные оценки кабельных свойств трихома нитчатой цианобактерии. В наших экспериментах гиперполяризация распространялась от освещенных клеток к темновым как по электрическому кабелю с константой длины около 400 мкм.
В 80-х гг. прошлого века в Институте биофизики АН СССР была создана уникальная установка для одновременной регистрации фотоэлектрических ответов и спектральных характеристик пролонгированных микрообъектов [92] (Рис. 2).
Рис. 2.
Принципиальная оптическая схема установки, использованной для регистрации фотоэлектрических ответов и спектральных характеристик одиночного трихома [96]. 1 – лампа накаливания КГМ9-70; 2 – конденсор; 3 – зеркало револьверной головки под предметным столиком микроскопа; 4 – конденсор микроскопа; 5 – объект; 6 – объектив микроскопа; 7 – сменная светоделительная пластинка со светофильтром; 8 – отверстие-зонд сферического зеркала; 9 – зеркало; 10 – окуляр; 11 – монохроматор МЗД-2; 12 – фотоумножитель; 13 – усилитель тока ФЭУ; 14 – двухкоординатный самописец; 15 – ксеноновая лампа ДксШ-120; 16 – конденсор; 17 – монохроматор МЗД-1; 18 – оптический клин; 19 – зеркало; 20 – термопара; 21 – предусилитель; 22 – регистратор; 23 – лазер ЛГН-105; 24 – лампа ДксШ-150; 25 – конденсор; 26 – поворотное зеркало; 27 – набор светофильтров; 28 – газовый лазер ЛГИ-21; 29, 30 – микроэлектроды; 31 – предусилитель; 32 – самописец.
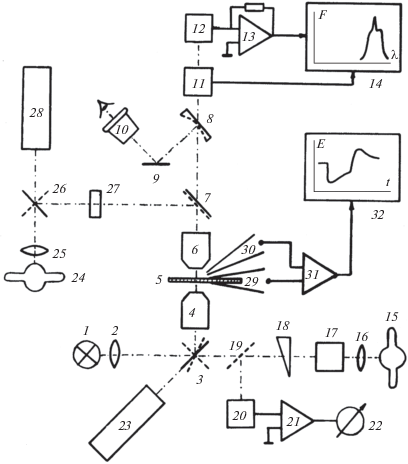
При наблюдении объекта в проходящем свете свет от лампы накаливания КГМ9-70 (1) через конденсор (2) попадает на соответствующее зеркало (3) револьверной головки, расположенной под предметным столиком микроскопа, а затем на конденсор микроскопа (4). Изображение объекта (5) собирается объективом (6) микроскопа и через сменную светоделительную пластинку с отрезающим светофильтром (7) направляется на фотометрическую насадку ФМЭЛ-1, где сферическим зеркалом с отверстием-зондом (8) и зеркалом (9) направляется в окуляр (10). При этом плоскость изображения изучаемого объекта совпадает с плоскостью зеркала (8).
Регистрация спектров поглощения осуществлялась с помощью света от того же источника (1). Для измерений в ультрафиолетовой области спектра лампу накаливания заменяли на лампу ДксШ-120. В качестве конденсора (4) использовали объектив 59Х0,65 УФ. Перед объективом (5) вводилась рассеивающая подложка – нелюминесциирующий мембранный фильтр Millipor, а светоделительная пластинка (7) изымалась. Критерием качества компенсации рассеяния являлось отсутствие ослабления объектом света в дальней красной области (λ > 730 нм). Оптическую плотность (D) определяли по формуле:
Для локальной монохроматической фотостимуляции отдельных клеток изображение дуги ксеноновой лампы ДксШ-120 (15) посредством конденсора (16) формировалось на входной щели монохроматора МЗД-1 (17). В дальнейшем монохроматический свет через оптический клин (18) поступал на зеркало (19) в термопару (20). Напряжение термопары усиливалось при помощи предусилителя (21), собранного на микросхеме К284УД1А, и поступало на регистратор (22). После установки необходимой интенсивности монохроматического излучения с помощью оптического клина (18) световой поток поворотом зеркала (18) направлялся на соответствующее зеркало (3) револьверной головки и конденсор (4). В качестве конденсора использовали различные ультрафиолетовые объективы, что позволяло в широких пределах изменять размер и интенсивность изображения выходной щели монохроматора (17) в плоскости объекта. Для локальной стимуляции когерентным монохроматическим светом может использоваться лазер ЛГН-105 (23).
Возбуждение люминесценции объекта осуществлялось от лампы ДксШ-150 (24), закрепленной на корпусе микроскопа. При этом возбуждающий свет через конденсор (25), поворотное зеркало (26) и набор светофильтров (27) попадал на светоделительную пластинку (7) и далее через объектив (6) на объект (5). Регистрация спектров люминесценции аналогична регистрации проходящего света.
Оценивая чувствительность установки, можно отметить, что даже при использовании минимального зонда, диаметр которого в плоскости препарата составляет около 2 мкм, коэффициент вариации люминесцентных измерений для эталонного уранового стекла не превышал 1%.
Для локального облучения отдельных клеточных структур с длиной волны 337 нм использовали газовый лазер ЛГИ-21 (28) совместно с “голубой” светоделительной пластинкой. Оптическая схема прибора позволяла получать в плоскости препарата минимальный угол диаметром до 1 мкм. Установка обеспечивала изучение объектов по методу фазового контраста, абсорбционной и люминесцентной фотометрии. Разность потенциалов между микроэлектродами (29, 30) поступала на предусилитель (31) и регистрировалась на самописце (32).
В экспериментах с одновременной регистрацией микроспектральных характеристик и внеклеточных электрических токов одиночного трихома Phormidium uncinatum подтвердилось, что именно фотосинтетически активные участки спектра вызывают гиперполяризацию клеточных мембран (рис. 3, 4).
Рис. 3.
Индукция электрических токов в трихоме локальным освещением. (а) – Схема распространения электрических токов, вызванных локальным освещением трихома фотосинтетически активным светом [19]. Локальное освещение любых 2–10 клеток индуцировало внеклеточные электрические токи, величина и положение которых зависели от положения зоны засветки. (б) – Схема эксперимента [18]. U – электрическое напряжение (мВ); t – время (секунды).
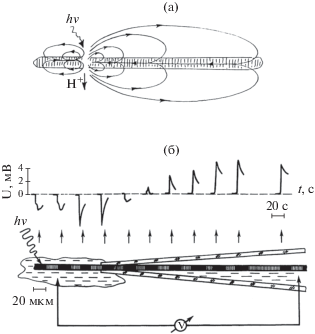
Рис. 4.
Спектральные характеристики электрических ответов одиночного трихома Ph. uncynatum. Изменения фотоэлектрических ответов (а) и спектров флуоресценции (б) одного и того же участка трихома Ph. uncynatum под влиянием интенсивного излучения ртутной лампы (λ = 436 нм). Длина освещаемого участка и диаметр оптического зонда – 20 мкм. (а) – Засветка монохроматическим светом (λ = 620 нм); (б) – возбуждение флуоресценции при λ = 436 нм. Время облучения: 1 – 45 с; 2 – 3 мин; 3 – 4 мин; 4 – 6 мин [18]. Показания снимались с экрана осциллографа. Показан масштаб для горизонтальной и вертикальной оси.
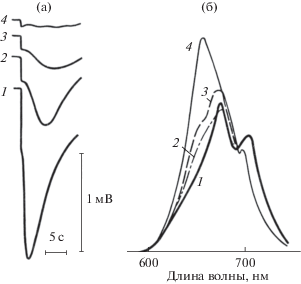
Одиночный трихом Ph. uncinatum плотно фиксировали в стеклянной микропипетке с диаметром кончика 5–6 мкм (сравнимым с диаметром трихома), заполненной дистиллированной водой. Меньшая часть трихома располагалась в капле дистиллированой воды на предметном стекле на столике микроскопа, а большая – внутри пипетки. Такая фиксация трихома уменьшала электрические токи утечки и увеличивала падение напряжения в зоне фиксации. Электрическое сопротивление между электродом в капле воды и электродом внутри пипетки составляло 100–200 МОм в отсутствие трихома и 200–700 МОм с трихомом (рис. 3).
Внеклеточный фотоэлектрический ответ трихома на локальную засветку отражает сложный многоступенчатый процесс гиперполяризации клеточной мембраны. Типичный ответ представляет собой двухступенчатое увеличение внеклеточного электрического тока с последующим падением при длительной засветке (рис. 4).
Величина и форма конкретного ответа зависят от интенсивности и спектрального состава света, времени предварительной темновой адаптации, рН среды и условий культивирования [93]. Сравнительный анализ фотоэлектрических ответов и спектров поглощения трихома демонстрирует участие в фотоэлектрической активности системы фотосинтеза, связанной как с хлорофиллом (680 нм), так и с фикоцианином (625 нм) – основными фотосинтетическими пигментами цианобактерий [18, 93]. При этом обнаруживаются локальные гетерогенности спектральных характеристик электрических реакций на свет [18, 93, 94].
Индуцированная локальным освещением гиперполяризация клеточных мембран, распространяясь на десятки клеток, может быть использована АТФ-синтазами мембран соседних неосвещенных клеток для синтеза АТФ. В наших опытах дициклогексилкарбодиимид (DCCD) – блокатор АТФ-синтазы – в несколько раз увеличивал амплитуду внеклеточных электрических токов [15].
Таким образом, изучение фотоэлектрической активности трихомов нитчатой цианобактерии Phormidium uncinatum вместе с теоретическим и модельным анализом показывает, что трихом с помощью электрической связи между клетками организован в единую кабельную структуру [14–17]. Электрические токи, генерируемые фотосистемами плазматических мембран освещенных клеток, переносят способность производить работу от клеток, воспринявших энергию света, к клеткам, лишенным в данной конкретной ситуации (условия освещения) возможности прямо энергизоваться от внешнего источника. Гиперполяризация клеточных мембран, генерируемая фотосинтетическим аппаратом, может выполнять целый ряд энергетических функций: обеспечивать работу АТФ-синтаз, транспортных механизмов, двигательного аппарата и т.д., – как в месте освещения, так и на расстоянии десятков клеток от него. Трихомам тех нитчатых цианобактерий, у которых имеет место разделение функций между гетероцистами и вегетативными клетками, межклеточная электрическая связь дает реальную возможность для полноценной работы АТФ-синтаз плазматических мембран гетероцист при отсутствии активности их собственных систем фотосинтеза, то есть позволяет обеспечивать их функциональность достаточными ресурсами АТФ без повышения концентрации кислорода.
Можно ориентировочно оценить величину мощности, передаваемой вдоль трихома через межклеточные каналы. При локальном освещении 2–10 клеток трихома регистрируется скачок разности потенциалов, V, величиной около 20 мВ [18, 93]. Сопротивление микропипетки, R, в этих опытах составляло 400 МОм, таким образом, можно оценить внеклеточный ток I = V/R = 50 пикоА. Поскольку электрический ток в 1 пикоА переносит 6 × × 106 электрических зарядов в секунду, а для производства 1 молекулы АТФ требуется перенести через тилакоидную мембрану цианобактерий 4–5 H+ [95], можно заключить, что освещенные клетки обеспечивают темновым клеткам трихома возможность производить около (1.2–1.5) × 106 АТФ/с. Оборот АТФ в бактериальной клетке составляет в среднем 107–7 × 107 АТФ/с [96]. Можно сделать вывод, что передача энергии вдоль трихома может внести существенный вклад в суммарное клеточное производство энергии.
ЗАКЛЮЧЕНИЕ
Многоклеточность – это форма организации живых систем, при которой группа клеток выполняет более сложные функции, чем отдельная клетка. Нитчатые цианобактерии, образующие гетероцисты, – прототип многоклеточного организма, так как это не просто скопления клеток в виде агрегатов, но их функциональное объединение с наличием обмена продуктами метаболизма и регуляторными молекулами, а также с электрической связью через проницаемые межклеточные контакты (ПМК).
В разнообразных многоклеточных системах: органах, тканях, развивающихся эмбрионах, клеточных культурах, многоклеточных микроорганизмах, ПМК обеспечивают условия для обобществления внутриклеточных компонентов низкомолекулярного пула (см. обзоры [14, 97]). Способность ПМК пропускать ионные потоки, сравнимые по величине с потоками через плазматическую мембрану, позволяет этим структурам реально принимать участие в процессах самоорганизации многоклеточных систем. Разделение функций между соседними клетками в любой ткани создает возможность для части клеток получать с помощью ионных потоков через ПМК “энергетическую субсидию” от соседей, соответствующую энергии, необходимой для поддержания работы первичных ионных насосов (до трети общей энергетической продукции клетки) [98]. Передачу энергии между клетками с помощью межклеточной электрической связи через проницаемые межклеточные контакты следует, по-видимому, отнести к одной из древнейших естественных технологий биологических систем [19, 20].
Многоклеточность – эволюционная инновация, представляющая новый уровень организации и являющаяся необходимым инструментом усложнения адаптации. Для современной молекулярной генетики нитчатые цианобактерии с разделением функций между соседними клетками – прообраз многоклеточности и удобная модель для выяснения механизмов регуляции многоклеточности, которая, по-видимому, появлялась не раз в ходе эволюции в разных филогенетических группах [99, 100]. Очень важно, что сама способность к энергетической кооперации между клетками с помощью межклеточной электрической связи появилась на заре эволюции миллиарды лет назад как структурно-функциональная база для разделения труда в трихомах нитчатых цианобактерий – первых многоклеточных организмов нашей планеты.
Авторы благодарят доктора биологических наук В.В. Алешина и доктора физико-математических наук Ю.А. Кокшарова за внимательное чтение рукописи, обсуждение и критические замечания.
Работа выполнена в рамках Госзаданий № АААА-А17-117120570011-4 и № АААА-А17-117120820043-7 и при поддержке Российского фонда фундаментальных исследований (грант № 17-04-00412).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Уголев А.М. Естественные технологии биологических систем. Ленинград: Наука, 1986. 317 с.
Stebegg R., Schmetterer G., Rompel A. Transport of organic substances through the cytoplasmic membrane of cyanobacteria // Phytochemistry. 2019. V. 157. P. 206.
Ku C., Nelson-Sathi S., Roettger M., Sousa F.L., Lockhart P.J., Bryant D., Hazkani-Covo E., McInerney J.O., Landan G., Martin W.F. Endosymbiotic origin and differential loss of eukaryotic genes // Nature. 2015. V. 524. P. 427.
Lyons T.W., Reinhard C.T., Planavsky N.J. The rise of oxygen in Earth’s early ocean and atmosphere // Nature. 2014. V. 506. P. 307.
Mereschkowsky K.S. Uber natur und ursprung der chromatophoren im pflanzenreiche // Biol. Zentralblat. 1905. V. 25. P. 593.
Фаминцын А.С. О роли симбиоза в эволюции организмов // Санкт-Петербург: Имп. Акад. наук, 1907. 14 с.
Sánchez-Baracaldoa P., Raven J.A., Pisani D., Knoll A.H. Early photosynthetic eukaryotes inhabited low-salinity habitats. // Proc. Natl. Acad. Sci. USA. 2017. V. 114: e7737. https://doi.org/10.1073/pnas.1620089114
Schirrmeister B.E., de Vos J.M., Antonelli A., Bagheri H.C. Evolution of multicellularity coincided with increased diversification of cyanobacteria and the Great Oxidation Event // Proc. Natl. Acad. Sci. U. S. A. 2013. V. 110. P. 1791.
Schirrmeister B.E., Antonelli A., Bagheri H.C. The origin of multicellularity in cyanobacteria // BMC Evol. Biol. 2011. V. 11. P. 45. https://doi.org/10.1186/1471-2148-11-45
Скулачев В.П., Богачев А.В., Каспаринский Ф.О. Мебранная биоэнергетика. Учебное пособие. Москва: Московский университет, 2010. 368 с.
Cardona T., Battchikova N., Zhang P., Stensjo K., Aro E.-M., Lindblad P., Magnuson A. Electron transfer protein complexes in the thylakoid membranes of heterocysts from the cyanobacterium Nostoc punctiforme // Biochim. Biophys. Acta. 2009. V. 1787. P. 252.
Liu L.-N. Distribution and dynamics of electron transport complexes in cyanobacterial thylakoid membranes //Biochim. Biophys. Acta. 2016. V. 1857. P. 256.
Mullineaux C.W. (ed.) Organization and dynamics of bioenergetic systems in bacteria //Biochim. Biophys. Acta. 2016. V. 1857. https://doi.org/10.1016/j.bbabio.2016.01.004
Беркинблит М.Б., Божкова В.П., Бойцова Л.Ю., Миттельман Л.А., Потапова Т.В., Чайлахян Л.М., Шаровская Ю.Ю. // Высокопроницаемые контактные мембраны. Москва: Наука, 1981. 466 с.
Chailakhyan L.M., Glagolev A.N., Glagoleva T.N., Murvanidze G.M., Potapova T.V., Skulachev V.P. Intercellular power transmission along trichomes of cyanobacteria. //Biochim. Biophys. Acta. 1982. V. 679. P. 60.
Левин С.А., Потапова Т. В., Скулачев В.П., Чайлахян Л.М. Распространяющиеся изменения электрического потенциала у нитчатых цианобактерий // Биофизика. 1982. Т. 27. С. 280–284.
Левин С.А., Потапова Т.В., Скулачев В.П., Чайлахян Л.М. Анализ кабельной структуры синезеленых водорослей // Биофизика. 1982. Т. 27. С. 684.
Потапова Т.В., Асланиди К.Б., Шалапенок А.А., Карнаухов В.Н., Чайлахян Л.М. Фотоэлектрическая активность и спектральные характеристики одиночного трихома цианобактерии Phormidium uncinatum // Докл. АН СССР. 1986. Т. 289. С. 1504.
Potapova T.V. Energetic functions of permeable intercellular junctions. // Intercell. commun. / Ed. Bukauskas F. Manchester: Univ. Press, 1991. P. 143.
Potapova T.V., Aslanidi KB. Energy coupling of adjacent cells as an universal function of cell-to-cell permeable junctions // Prog. Cell Res. 1995. V. 4. P. 53.
Потапова Т.В., Бойцова Л.Ю. Структура, функция, управление. Возможности экспериментального анализа в группах невозбудимых клеток, связанных проницаемыми контактами // Биол. мембраны. 1997. Т. 14. С. 661.
Sawa M., Fantuzzi A., Bommelli P., Howe C.J., Hellgardt K., Nixon P.J. Electricity generation from digitally printed cyanobacteria // Nat. commun. 2017. V. 8. P. 1327. https://doi.org/10.1038/s41467-017-01084-4
Irimia-Vladu M. “Green” electronics: biodegradable and biocompatible materials and devices for sustainable future // Chem. Soc. Rev. 2014. V. 43. P. 588.
Choi S. Nicroscale microbial fuel cells: advances and challenges // Biosens. Bioelectron. 2015. V. 69. P. 8.
Скулачев В.П. Аденозинтрифосфат и трансмембранный потенциал ионов водорода — две конвертируемые и транспортабельные формы энергии в живой клетке // Успехи соврем. биол. 1977. Т. 84. С. 165.
Harold F.M. The way of the cell: molecules, organisms and the order of life. Oxf. Univ. Press, 2001. 305 p.
Bald D. ATP synthase: structure, function and regulation of a complex machine // Bioenergetic Processes of Cyanobacteria: From evolutionary singularity to ecological diversity / Eds. Peschek G., Obinger C., Renger G. Springer: Dordrecht Heidelberg London New York, 2011. P. 239–262. https://doi.org/10.1007/978-94-007-0388-9
Liberton M., Pakrasi H.B. Membrane systems in cyanobacteria // The Cyanobacteria: Molecular Biology, Genomics and Evolution / Eds. Herrero A., Flores E. Norfolk, UK: Caister Academic Press, 2008. P. 217.
Rexroth S., Mullineaux C.W., Ellinger D. Sendtko E., Rögner M., Koenig F. The plasma membrane of the cyanobacterium Gloeobacter violaceus contains segregated bioenergetic domains // Plant Cell. 2011. V. 23. P. 2379.
Vothknecht U.C., Westhoff P. Biogenesis and origin of thylakoid membranes // Biochim. Biophys. Acta. 2001. V. 1541. P. 91.
Nickelsen J., Rengstl B., Stengel A., Schottkowski M., Soll J., Ankele E. Biogenesis of the cyanobacterial thylakoid membrane system – an update // FEMS Microbiol. Lett. 2011. V. 315. P. 1.
Rast A., Heinz S., Nickelsen J. Biogenesis of thylakoid membranes // Biochim. Biophys. Acta. 2015. V. 1847. P. 821.
van de Meene A.M., Hofmann-Marriott M.F., Vermaas W.F., Roberson R.W. The three-dimensional structure of the cyanobacterium Synechocystis sp. PCC 6803 // Arch. Microbiol. 2006. V. 184. P. 259.
van de Meene A.M., Sharp W.P., McDaniel J.H., Friedrich H., Vermaas W.F., Roberson R.W. Gross morphological changes in thylakoid membrane structure are associated with photosystem I deletion in Synechocystis sp. PCC 6803 // Biochim. Biophys. Acta. 2012. V. 1818. P. 1427.
Nevo R., Charuvi D., Shimoni E., Schwarz R., Kaplan A., Ohad I., Reich Z. Thylakoid membrane perforations and connectivity enable intracellular traffic in cyanobacteria // EMBO J. 2007. V. 26. P. 1467.
Zak E., Norling B., Maitra R., Huang F., Andersson B., Parkasi H.B. The initial steps of biogenesis of cyanobacterial photosystems occur in plasma membrane // Proc. Natl. Acad. Sci. U. S. A. 2001. V. 98. P. 13443.
Vermaas W.F., Timlin J.A., Jones H.D., Siclair M.B., Nieman L.T., Hamad S.W., Melgaard D.K., Haaland D.M. In vivo hyperspectral confocal fluorescence imaging to determine pigment localization and distribution in cyanobacterial cells // Proc. Natl. Acad. Sci. U. S. A. 2008. V. 105. P. 4050.
Collins A.M., Liberton M., Jones H.D., Garcia O.F., Pakrasi H.B., Timlin J.A. Photosynthetic pigment localization and thylakoid membrane morphology are altered in Synechocystis 6803 phycobilisome mutants // Plant Physiol. 2012. V. 158. P. 1600.
Sherman D.M., Troyan T.A., Sherman L.A. Localization of membrane proteins in the cyanobacterium Synechococcus sp. PCC7942 // Plant Physiol. 1994. V. 106. P. 251.
Liu L.N., Scheuring S. Investigation of photosynthetic membrane structure using atomic force microscopy // Trends Plant Sci. 2013. V. 18. P. 277.
Nagy G., Posselt D., Kovacs L., Holm J.K., Szabo M., Ughy B., Rosta L., Peters J., Timmins P., Garab G. Reversible membrane reorganizations during photosynthesis in vivo: revealed be small-angle neutron scattering // Biochem. J. 2011. V. 436. P. 225.
Liberton M., Page L.E., O’Dell W.B., O’Neill H., Mamontov E., Urban W.S., Pakrasi H.B. Organization and flexibility of cyanobacterial thylakoid membranes examined by neutron scattering // J. Biol. Chem. 2013. V. 288. P. 3632.
Johnson G.N. Physiology of PSI cyclic electron transport in higher plants // Biochim. Biophys. Acta. 2011. V. 1807. P. 384.
Badger M.R., Price G.D. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution // J. Exp. Bot. 2003. V. 54. P. 609–622.
Grotjohann I., Fromme P. Structure of cyanobacterial Photosystem I. // Photosynth. Res. 2005. V. 85. P. 51.
Gabdulkhakov A.G., Dontsova M.V. Structural Studies on Photosystem II of Cyanobacteria // Biochemiya (Moscow). 2013. V. 78. P. 1524. https://doi.org/10.1134/S0006297913130105
Herrero A., Stavans J., Flores E. The multicellular nature of filamentous heterocyst-forming cyanobacteria // FEMS Microbiol. Rev. 2016. V. 40. P. 831. https://doi.org/10.1093/femsre/fuw029
Pfeil B.E., Schoefs B., Spetea C. Function and evolution of channels and transporters in photosynthetic membranes // Cell. Mol. Life Sci. 2014. V. 71. P. 979. https://doi.org/10.1007/s00018-013-1412-3
Shvarev D., Maldener I. ATP-binding cassette transporters of the multicellular cyanobacterium Anabaena sp. PCC 7120: a wide variety for a complex lifestyle // FEMS Microbiol. Lett. 2018. V. 365(4). https://doi.org/10.1093/femsle/fny012
Davidson A.L., Dassa E., Orelle C., Chen J. Structure, function and evolution of bacterial ATP-binding cassette systems // Microbiol. Mol. Biol. Rev. 2008. V. 72. P. 317.
Higgins C.F. ABC Transporters: From microorganisms to Man // Ann. Rev. Cell Biol. 1992. V. 8. P. 67.
Rees D.C., Johnson E., Lewinson O. ABC transporters: The power to change // Nat. Rev. Mol. Cell Biol. 2009. V. 10. P. 218.
Prindle A., Liu J., Munehiro A., Ly S., Garcia-Ojalvo J., Sitel G.M. Ion channels enable electrical communication in bacterial communities // Nature. 2015. V. 527. P. 59. https://doi.org/10.1038/nature15709
Corrales-Guerrero L., Tai A., Arbel-Goren R., Mariscal V., Flores E., Herrero A., Stavans J. Spatial fluctuations in expression of the heterocyst-differentiation regulatory gene hetR in Anabaena // PLoS Genet. 2015. V. 11: e1005031. https://doi.org/10.1371/journal.pgen.1005031
Flores E., Herrero A., Wolk C.P., Maldener I. Is the periplasm continuous in filamentous multicellular cyanobacteria? // Trends Microbiol. 2006. V. 14. P. 439.
Mariscal V., Herrero A., Flores E. Continuous periplasm in a filamentous, heterocyst-formimg cyanobacterium // Mol. Microbiol. 2007. V. 65. P. 1139.
Wilk L., Strauss M., Rudolf M., Nicolaisen K., Flores E., Kuhlbrandt W., Schief E. Outer membrane continuity and septosome formation between vegetative cells in the filaments of Anabaena sp. strain PCC 7120 // Cell. Microbiol. 2011. V. 13. P. 1744.
Giddings T.H., Staehelin L.A. Plasma membrane architecture of Anabaena cylindrica: occurrence of microplasmodesmata and changes associated with heterocyst development and the cell cycle // Eur. J. Cell Biol. 1978. V. 16. P. 235.
Lehner J., Berendt S., Dörsam B., Pérez R., Forchhammer K., Maldener I. Prokaryotic multicellularity: A nanopore array for bacterial cell communication // FASEB J. 2013. V. 27. P. 2293.
Mariscal V. Cell-Cell joining proteins in heterocyst-forming cyanobacteria // The Cell Biology of Cyanobacteria / Eds. Flores E., Herrero A. UK, Poole: Caister Academic Press, 2014. P. 293.
Omari-Nasser A., Mariscal V., Austin II J.R., Haselkorn R. Requirement of Fra proteins for comminication channels between cells in the filamentous nitrogen-fixing cyanobacterium Anabaena sp. PCC 7120 // Proc. Natl. Acad. Sci. U. S. A. 2015. https://doi.org/10.1073/pnas.1512232112
Giddings T.H., Staehelin L.A. Observation of microplasmodesmata in both heterocyst forming and non- heterocyst forming filamentous cyanobacteria by freeze-fracture electron microscopy // Arch. Microbiol. 1981. V. 129. P. 295.
Mullineaux C.W., Mariscal V., Nenninger A., Khanum H., Herrero A., Flores E., Adams D.G. Mechanism of intercellular molecular exchange in heterocyst-forming cyanobacteria // EMBO J. 2008. V. 27. P. 1299.
Mariscal V., Herrero A., Nenninger A., Mullineaux C.W., Flores E. Functional dissection of the three-domain SepJ protein joining the cells in cyanobaterial trichomes // Mol. Microbiol. 2011. V. 79. P. 1077.
Nurnberg D.J., Mariscal V., Bornikoel J., Nieves-Morion M., Kraub N., Herrero A., Maldener I., Flores E., Mullineaux C.W. Intercellular diffusion of a fluorescent sucrose analog via the septal junctions in a filamentous cyanobacterium // MBio. 2015. V. 6: e02109. https://doi.org/10.1128/mBio.02109-14
Juttner R. 14C-labeled metabolites in heterocysts and vegetative cells of Anabaena cylindrica filaments and their presumptive function as transport vehicles of organic carbon and nitrogen // J. Bacteriol. 1983. V. 155. P. 628.
Cumino A.C., Marcozzi C., Barreiro R., Salerno G.L. Carbon cycling in Anabaena sp. PCC 7120. Sucrose synthesis in the heterocysts and possible role in nitrogen fixation // Plant Physiol. 2007. V. 143. P. 1385.
Lopez-Igual R., Flores E., Herrero A. Inactivation of a heterocyst-specific invertase indicates a principal role of sucrose catabolism in heterocysts of Anabaena sp. // J. Bacteriol. 2010. V. 192. P. 5526.
Vargas W.A., Nishi C.N., Giarrocco L.E., Salerno G.L. Differential roles of alkaline/neutral invertases in Nostoc sp. PCC 7120: Inv-B isoform is essential for diazotrophic growth // Planta. 2011. V. 233. P. 153.
Hegazi M., Piotukh K., Mattow J., Deutzmann R., Volkmer-Engert R., Lockau W. Isoaspartyl dipeptidase activity of plant-type asparaginases // Biochem. J. 2002. V. 364. P. 129.
Burnat M. Schleiff E., Flores E. Cell envelope components influencing filament length in the heterocyst-forming cyanobacterium Anabaena sp. strain PCC 7120 // J. Bacteriol. 2014. V. 196. P. 4026. https://doi.org/10.1128/JB.02128-14
Merino-Puerto V., Mariscal V., Mullineaux C.W., Herrero A., Flores E. Fra proteins influencing filament integrity, diazotrophy and localization of septal protein SepJ in the heterocyst-forming cyanobacterium Anabaena sp. // Mol. Microbiol. 2010. V. 75. P. 1159.
Merino-Puerto V., Schwarz H., Maldener I., Mariscal V., Mullineaux C.W., Herrero A., Flores E. FraC/FraD-dependent intercellular moleculare exchange in the filaments of heterocyst-forming cyanobacterium Anabaena sp. // Mol. Microbiol. 2011. V. 82. P. 87.
Flores E., Nieves-Morion M., Mullineaux C.W. Cyanobacterial septal junctions: properties and regulation // Life. 2019. V. 9. P. 1. https://doi.org/10.3390/life9010001
Picossi S., Montesinos M.L., Pernil R. Lichtlé C., Herrero A., Flores E. ABC-type neutral amino acid permease N-I is required for optimal diazotrophic growth and is repressed in the heterocysts of Anabaena sp. strain PCC 7120 // Mol. Microbiol. 2005. V. 57. P. 1582.
Pernil R., Picossi S., Mariscal V., Herrero A., Flores E. ABC-type amino acid uptake transporters Bgt and N-II of Anabaena sp. strain PCC 7120 share an ATPase subunit and are expressed in vegetative cells and heterocysts // Mol. Microbiol. 2008. V. 67. P. 1067.
Nicolaisen K., Mariscal V., Bredemeier R., Pernil R., Moslavac S., Lopez-Igual R., Maldener I., Herrero A., Schleiff F., Flores E. The outer membrane of a heterocyst-forming cyanobacterium is a permeability barrier for uptake of metabolites that are exchanged between cells // Mol. Microbiol. 2009. V. 74. P. 58.
Hahn A., Schleiff E. The cell envelope // The Cell Biology of Cyanobacteria / Eds. Flores E., Herrero A. Norfolk, UK: Caister Academic Press, 2014. P. 29.
Nicolaisen K., Mariscal V., Bredemeier R., Pernil R., Moslavac S., López-Igual R., Maldener I., Herrero A., Schleiff E., Flores E. The outer membrane of a heterocyst-forming cyanobacterium is a permeable barrier for uptake of metabolites that are exchanged between cells // Mol. Microbiol. 2009. V. 74. P. 58.
Pernil R., Picossi S., Herrero A., Flores E., Mariscal V. Amino acid transporters and release of hydrophobic amino acids in the heterocyst-forming cyanobacterium Anabaena sp. strain PCC 7120 // Life. 2015. V. 5. P. 1282.
Frain K.M., Gangl D., Jones A., Zedler J.A.Z., Robinson C. Protein translocation and thylakoid biogenesis in cyanobacteria // Biochim. Biophys. Acta. 2016. V. 1857. P. 266.
Khaytan B., Meeks J., Risser D. Evidence that a modified type IV pilus-like system powers gliding motility and polysaccharide secretion in filamentous cyanobacteria // Mol. Microbiol. 2015. V. 98. P. 1021.
Flores E., Herrero A. Compartmentalized function through cell differentiation in filamentous cyanobacteria // Nat. Rev. Microbiol. 2010. V. 8. P. 39.
Camargo S., Picossi S., Corrales-Guerrero L., Valladares A., Arévalo S., Herrero A. ZipN is an essential FtsZ membrane tether and contributes to the septal localization of SepJ in the filamentous cyanobacterium Anabaena // Sci. Rep. 2019. V. 9: e2744. https://doi.org/10.1038/s41598-019-39336-615
Flores E., Picossi S., Valladares A., Herrero A. Transcriptional regulation of development in heterocyst forming cyanobacteria // Biochim. Biophys. Acta. 2018. https://doi.org/10.1016/j.bbagrm.2018.04.006
Yoon H.-S., Golden J.W. Heterocyst pattern formation controlled by a diffusible peptide // Science. 1998. V. 282. P. 935.
Callahan S.M., Buikema W.J. The role of HetN in maintenance of the heterocyst pattern in Anabaena sp. PCC 7120 // Mol. Microbiol. 2001. V. 40. P. 941. https://doi.org/10.1046/j.1365-2958.2001.02437.x
Corrales-Guerrero L., Mariscal V., Flores E., Herrero A. Functional dissection and evidence for intercellular transfer of the heterocyst-differentiation PatS morphogen // Mol. Microbiol. 2013. V. 88. P. 1093. https://doi.org/10.1111/mmi.12244
Plominsky A.M., Delherbe N., Mandakovic D., Riquelme B., Gonzales K., Bergman B., Mariscal V., Vasquez M. Intercellular transfer along the trichomes terminal heterocyst forming cyanobacterium Cylindrosoermopsis raciborskii CS-505 // FEMS Microbiol. Lett. 2015. V. 362: fnu009. https://doi.org/10.1093/femsle/fnu009
Thomas J., Meeks J.C., Wolk C.P., Shaffer P.W., Austin C.M. Formation of glutamine from [13N] ammonia, [13N] dinitrigen, and [14C] glutamate by heterocysts isolated from Anabaena cylindrical // J. Bacteriol. 1977. V. 129. P. 1545.
Hodgkin A.L., Rushton W.A.H. The electrical constants of a crustacean nerve fibre // Proc. R. Soc. London. 1946. Ser. B. V. 133. P. 144.
Асланиди К.Б., Потапова Т.В., Шалапенок А.А. Метод регистрации фотоэлектрических характеристик элонгированных одно- и многоклеточных микрообъектов // Приборы и лабораторное оборудование для научных исследований по новым направлениям биологии и биотехнологии. Пущино, 1987. С. 100–104.
Aslanidi K.B., Shalapjenok A.A. Energetics of local cell-to-cell interactions in phototrophic organisms // Intercellular Communication: Proceedings in Nonlinear Science / Ed. F. Bukauskas. Manchester: Univ Press, 1991. P. 12.
Aslanidi K.B. Spectral measurements of the functional heterogeneity of cells and their organelles // Biophysics. 2015. V. 60. P. 85.
Magnuson A. Heterocyst thylakoid bioenergetics // Life. 2019. V. 9. № 13. https://doi.org/10.3390/life9010013
Chapman A.G., Atkinson D.E. Adenine nucleotide concentrations and turnover rates. Their correlation with biological activity in bacteria and yeast // Adv. Microb. Physiol. 1977. V. 15. P. 253.
Loewenstein W.R. Cell Individuality and Connectivity, an Evolutionary Compromise // Individuality and Determinism / Ed. S.W. Fox. Plenum Publ. Corp. 1984. P. 77.
Асланиди К.Б., Потапова Т.В., Чайлахян Л.М. Транспорт энергии через высокопроницаемые контактные мембраны // Биол. мембраны. 1988. Т. 5. С. 613.
Bonner J.T. The origin of multicellularity // Integr. Biol. 1998. V. 1. P. 28.
Carroll S.B. Chance and necessity: the evolution of morphological complexity and diversity // Nature. 2011. V. 409. P. 1102.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


