Физиология растений, 2020, T. 67, № 1, стр. 35-49
Нитратный сигналинг в растениях. Механизмы реализации
С. Ф. Измайлов a, *, А. В. Никитин a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: sf.izmailov@list.ru
Поступила в редакцию 11.03.2019
После доработки 30.04.2019
Принята к публикации 16.05.2019
Аннотация
В обзоре рассматриваются механизмы нитратного сигналинга, включающие его сенсинг трансцепторами, локализованными в плазмалемме, внутриклеточную передачу и усиление сигнала каскадом посредников, а также регуляцию экспрессии генов-мишеней и межорганную трансдукцию при участии основных фитогормонов с учетом пространственной разобщенности их биосинтеза в целом растении. Обсуждается вопрос о вкладе сигналинга в C/N-баланс организма, где задействованы ключевые реакции углеводного и азотного обмена.
ВВЕДЕНИЕ
Ранее нами сообщалось, что нитрат в растениях является не только одним из основных источников азотного питания, но также выполняет другую важную роль ‒ сигнальную [1]. Он регулирует активность транспортеров, обеспечивающих его сенсинг, поглощение, транспорт на далекие расстояния и запасание в различных органах. Кроме того, благодаря такой регуляции контролируется активность ферментов, ответственных за усвоение нитратного и аммонийного азота, превращение различных аминокислот, а также фотосинтетическая ассимиляция СО2 и дальнейшая подготовка С-продуктов, необходимых для взаимодействия С- и N-метаболизма. Тем самым создается сигнальный каскад в общем обмене веществ, который в конечном итоге обеспечивает физиологическую целостность растительного организма, направленную на реализацию продукционного процесса. Развитие этого тезиса на примере расшифровки механизмов нитратного сигналинга в растениях представляет цель настоящего обзора.
РЕЦЕПТОРЫ
Интегральные белки, локализованные в плазмалемме, могут одновременно выполнять сенсорную и транспортную функции. Такое объединение функций экспериментально подтверждено, а сами рецепторы и транспортеры получили наименование “transceptors” [2]. Широкий круг трансцепторов нитрата у растений объясняется их эволюцией в условиях нестабильной обеспеченности нитратом.
Наиболее исследованным трансцептором нитрата является NRT1.1 у Arabidopsis thaliana (L.) Heynh. Вероятно, он же и самый универсальный среди них ввиду локализации на плазмалемме разнообразных типов клеток и возможности регулировать сродство к нитрату в широких пределах. Структура NRT1.1 включает в себя 12 трансмембранных α-спиралей, образующих карман для субстрата [3]. С использованием точечных мутаций показано, что для специфичного связывания указанным белком нитрата критичен остаток гистидина H356 [4]. У гомолога NRT1.1 – белка Zm-NPF6.6 кукурузы Zea mays L. в узнавании субстрата также участвует остаток гистидина, локализованный в положении 362 [5]. Его замена на тирозин приводила к потере транспортной активности. У того же объекта мутация с заменой тирозина в положении 370 на гистидин в другом гомологе NRT1.1 – Zm-NPF6.4, узнающем хлорид, превращала его в транспортер нитрата с высоким сродством. Следовательно, гистидин имеет важное значение для узнавания нитрат-иона.
В настоящее время активно исследуется характер перестроек молекулы NRT1.1, запускаемых при связывании нитрата. Узнавание субстрата центрами связывания высокого сродства, по-видимому, вызывает их конформационную перестройку и аллостерическое взаимодействие с сайтом автофосфорилирования, далее происходящего по остатку треонина Thr101 [6]. Такое фосфорилирование блокируется при насыщении субстратом и центров связывания низкого сродства. Методами рентгеноструктурного анализа, исследования флуоресцентного резонансного переноса энергии и точечного мутагенеза показано, что фосфорилирование белка NRT1.1 вызывает диссоциацию его димеров и увеличение конформационной лабильности мономеров, облегчающее высокоаффинное связывание нитрата [4, 7]. Наряду с этим, в мономерной форме трансцептора диссоциирует центр низкоаффинного связывания, образованный остатками гистидина 356 и глутаминовой кислоты 476 одной субъединицы и треонина 48, лейцина 49 ‒ другой [7]. Димерная и мономерная формы NRT1.1 различаются не только по сродству к субстрату, но и характеру взаимодействия с последующими звеньями передачи сигнала, регулируемого конформацией цитозольного N-терминального домена. У димерной формы с участием обеих субъединиц образуется петля, а у мономерной она диссоциирует и приобретает высокую лабильность [7].
Таким образом, можно констатировать, что в настоящее время экспериментальная расшифровка механизма сенсинга нитрата его универсальным трансцептором NRT1.1 продвинулась довольно глубоко. В отношении других нитратных транспортеров получены лишь первые свидетельства возможной рецепторной роли. Они вытекают из фактов нарушения у нуль-мутантов по соответствующим белкам различных реакций на нитрат. В этой области открывается широкое поле для поиска, поскольку становится очевидным, что транспортеры с сенсорной функцией ‒ закономерность, а не исключение.
ВНУТРИКЛЕТОЧНАЯ ПЕРЕДАЧА СИГНАЛА
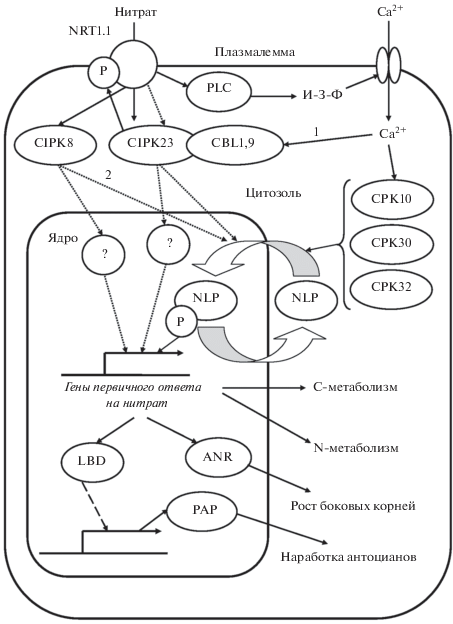
Пути внутриклеточной передачи нитратного сигнала включают в себя действие протеинкиназ на факторы транскрипции, которые индуцируют либо репрессируют различные гены. На обеих указанных стадиях трансдукции происходит усиление сигнала за счет взаимодействия одной активной молекулы белка со множеством молекул-мишеней, тем самым реализуется принцип ответа “все или ничего”. Помимо основных указанных звеньев сигнальной трансдукции, имеет место и целый ряд вспомогательных, что позволяет модифицировать ответ на нитрат в зависимости от других факторов среды, а также расширить круг мишеней и уровней регуляции.
Протеинкиназный каскад
Первые исследования механизма передачи нитратного сигнала были проведены на отделенных листьях злаков с применением ингибиторного анализа. Это позволило выявить участие в реализации эффектов нитрата основных внутриклеточных мессенджеров – протеинкиназ. На пшенице Triticum aestivum L. показаны активация ими ФЕП-карбоксилазы и ингибирование – сахарозофосфатсинтазы [8]. У кукурузы Zea mays L. индукция нитратом стартовых ферментов N-метаболизма была опосредована не только протеинкиназами, но и протеинфосфатазами [9]. Последующие опыты с клонированием генов и получение широкого набора дефицитных по различным регуляторным белкам мутантов Arabidopsis обогатили представления о путях внутриклеточной передачи нитратного сигнала. В частности, с использованием нуль-мутантов cipk8 было показано участие протеинкиназы CIPK8 в индукции 25 мМ нитратом генов транспортеров нитрата NRT1.1, NRT2.1, двух изоформ нитратредуктазы (НР) ‒ NIA1, NIA2, нитритредуктазы NIR, глутаминсинтетазы GLN2, глюкозо-6-фосфатдегидрогеназы G6PDH3 и др. [10]. Здесь же показано участие CIPK8 в нитратзависимом торможении роста главного корня. У тройных мутантов по другим протеинкиназам ‒ cpk10 cpk30 cpk32 ‒ не проявлялась ростовая реакция побегов и корней на нитрат, что также предполагает их роль в передаче нитратного сигнала [11]. С применением флуоресцентной метки показано, что активированные протеинкиназы CPK10, 30, 32 способны мигрировать из цитозоля внутрь ядра, где локализованы их мишени. Все указанные протеинкиназы активны при концентрациях нитрата порядка 1‒5 мМ и более. Кроме того, при отмеченных концентрациях происходила интенсивная наработка АМФ, активирующего протеинкиназу AMPKα1 [12].
Протеинкиназа CIPK23, фосфорилирующая NRT1.1 при концентрациях нитрата порядка 0.1‒0.5 мМ, сама индуцируется им. В соответствии с этим экспрессия гена CIPK23 понижена у мутантов chl1, дефектных по NRT1.1 [10]. В исследованиях, проведенных на нуль-мутантах cipk23 Arabidopsis, было показано увеличение экспрессии гена транспортера высокого сродства NRT2.1, обычно индуцируемого при азотном голодании, что позволило сделать вывод о негативной регуляции белком CIPK23 реакций на дефицит нитрата [13]. В других опытах оверэкспрессия CIPK23 блокировала ответы на повышенный уровень нитрата [14]. Не ясно, происходит ли это вследствие действия активной протеинкиназы на различные мишени, либо только на NRT1.1 с последующим нарушением активации других эффекторных белков, таких как CIPK8, 10, 30, 32. Все это говорит о том, что вопрос о возможном вкладе протеинкиназы CIPK23 в передачу сигнала нитрата при разных диапазонах его концентраций остается открытым.
Факторы транскрипции
На основе идентификации специфических последовательностей у Arabidopsis, характерных для промоторов нитратиндуцибельных генов, можно предположить наличие факторов транскрипции, специфичных для нитратного сигналинга [15]. Они были экспериментально выявлены, а узнаваемые ими участки промоторов получили название цис-элементов NRE (nitrate-responsive cis-element).
Первым был найден фактор транскрипции ANR1 Arabidopsis, локализованный в апексах боковых корней и стимулирующий рост последних в обогащенных нитратом участках почвы [16]. Указанный белок отсутствовал в формирующихся корневых примордиях [17]. Выявлена молекулярная сеть из целого ряда MADS-белков, в том числе ANR1, которые входят в единый каскад нитратного сигналинга, регулирующего координированный рост главного и боковых корней [17]. Гомолог ANR1 с аналогичной функцией обнаружен у риса Oryza sativa L. [18].
У Arabidopsis показана репрессия 7.5−15 мМ нитратом генов, кодирующих белки PAP1, PAP2, GL3 и входящие в комплекс с ними другие факторы транскрипции ‒ CPC, ETC3/CPL3 [19]. Указанные белки совместно индуцируют гены ключевых ферментов пути биосинтеза антоцианов: халконсинтазы CHS, флавонолсинтазы FLS1, дигидрофлаванолредуктазы DFR, антоцианидинсинтазы ANS. У того же объекта 3−10 мМ нитрат индуцировал гены LBD37, LBD38 и LBD39, кодирующие репрессоры генов вышеупомянутых белков PAP1 и PAP2. Параллельно с применением ДНК-микрочипов показано, что белки LBD37 и LBD38 ответственны за репрессию нитратом почти 200 генов, различающихся функциональной спецификой [20]. В числе кодируемых ими белков – транспортеры NRT2.1, NRT2.2, NRT2.5, NRT3.1, глутаминсинтетаза GLN1.4, глюкозо-6-фосфатдегидрогеназа G6PD2, факторы транскрипции, участвующие в дальнейшей передаче нитратного сигнала ‒ WRKY38, NF-YA10, NAC55 и ряд протеинкиназ, фосфорилирующих глутаматный рецептор GLR1,2. Также показана связь с оверэкспрессией генов LBD37, LBD38 и LBD39 целого ряда изменений, таких как уменьшение содержания внутриклеточного нитрата, ряда аминокислот и амидов, активности НР при одновременном накоплении крахмала. Кроме того, активизировалось ветвление побегов у основания надземной части.
Белки NLP ‒ одни из основных факторов транскрипции в реализации действия 3−5 мМ нитрата. На примере Arabidopsis показана активация их протеинкиназами, миграция в ядро и узнавание последовательностей NRE в промоторах широкого круга генов первичного ответа на нитрат [11, 21]. Среди последних гены не только транспортеров ‒ NRT1.1, NRT2.1, НР ‒ NIA1, NIA2, нитритредуктазы ‒ NIR1, глутаминсинтетазы ‒ GS2, ФЕП-карбоксилазы ‒ AtPPC1-AtPPC3, но и специфических белков, входящих в каскад трансдукции нитратного сигнала ‒ ANR1, LBD37-LBD39, NLA, AFB3 [22]. Такая полифункциональность белков семейства NLP объясняет их участие в реализации как биохимических, так и морфогенетических эффектов нитрата. NLP7 стимулировал рост корневой системы, NLP8 ‒ прорастание семян [22, 23]. При использовании химерных белков на основе NLP, содержащих репрессорный домен, было подавлено конститутивное нарастание листьев и цветоноса, как оказалось, также потенциально регулируемое нитратом [21].
Найдены репрессоры, индуцируемые нитратом в высокой, порядка 50 мМ, концентрации. Это белок CHO1, подавляющий прорастание и рост сеянцев Arabidopsis [24]. У риса выявлен другой репрессор, NIGT1, узнающий нуклеотидные последовательности ‒ GAATC или GAATATTC ‒ в промоторах ряда генов, в том числе определяющих синтез хлорофилла [25]. Такого рода белки участвуют, скорее всего, в реакции на избыточный уровень нитрата как стрессовый фактор.
Список известных факторов транскрипции, вовлеченных в трансдукцию нитратного сигнала, продолжает расширяться. У Arabidopsis обнаружен белок TCP20, который вызывал локальное ветвление корней при наличии 5 мМ нитрата в среде [26]. Комплекс TCP20 с NLP6/7 в отсутствие нитрата мигрировал в ядро, где поддерживал на фоновом уровне экспрессию генов трансцептора нитрата NRT1.1, НР NIA1 и NIA2, а также гена циклинзависимой протеинкиназы CYCB1,1, вовлеченной в регуляцию клеточного цикла в меристеме корня [27]. Выявлена индукция нитратом генов TGA1, TGA4 и далее NRT2.1, NRT2.2, в итоге приводящая к стимуляции поглощения указанного иона, роста боковых корней и корневых волосков [28, 29]. Скорее всего, этот перечень не исчерпан.
Проведенный краткий анализ данных позволяет сделать вывод, что наряду с NLP-факторами транскрипции, входящими в первичный каскад ответа на нитрат, существуют и другие факторы, которые индуцируются или репрессируются белками NLP и входят во вторичные (ANR, LBD) или еще более отдаленные (PAP, GL, NAC, NF-YA, WRKY) сигнальные каскады. В числе их мишеней и гены, кодирующие трансцепторы нитрата, что увеличивает чувствительность клетки к данному иону.
Убиквитин-протеасомная система
Наряду с активацией или ингибированием уже имеющихся ферментов и экспрессией генов-мишеней важное значение в реализации нитратного сигналинга имеет регуляция стабильности белков с участием убиквитин-протеасомной системы. Одним из ее компонентов, задействованных в нитратзависимых посттрансляционных процессах, является индуцируемая с участием белков NLP убиквитинлигаза NLA. С применением нуль-мутантов Arabidopsis nla показана ее необходимость для ответов на 3 мМ нитрат против 10 мМ. В частности, фенотип nla в указанных дефицитных условиях отличался ранним старением, низким уровнем антоцианов и высоким ‒ лигнина [30]. Как выяснилось, белок NLA локализован в ситовидных трубках и клетках-спутниках, где непосредственно взаимодействует с транспортером NRT1.7, запуская его деградацию, что приводит к подавлению флоэмной реутилизации нитрата из зрелых листьев в молодые и в итоге ‒ к сохранению интенсивного фотосинтеза у первых из них [31]. Полиморфизм связанных с NLA фенотипических особенностей свидетельствует о разнообразии белков-мишеней данной убиквитинлигазы.
Взаимодействие с кальциевой сигнальной системой
В последние годы активно исследуется участие в механизме передачи сигнала нитрата такого вторичного мессенджера различных сигнальных каскадов, как кальций, а также активируемых им регуляторных белков. В концентрации 5 мМ нитрат с участием вышеупомянутого трансцептора NRT1.1 вызывал в корнях Arabidopsis активацию фосфолипазы С, увеличение уровня инозиттрифосфата и как следствие ‒ активацию кальциевых каналов [32]. Это приводило к росту в цитозоле концентрации кальция. В свою очередь, последний активировал протеинкиназы CPK10, 30, 32 [10]. В итоге происходило нитратзависимое фосфорилирование белка NLP7 и последующая регуляция транскрипции широкого круга вышеупомянутых генов-мишеней [10, 32]. Как отражение такого рода связей нитратного и кальциевого сигналов, антагонисты кальция нарушали индукцию нитратом транспортеров нитрата и аминокислот, ферментов азотного и углеводного метаболизма, факторов транскрипции, а также нитратзависимые рост и позеленение семядолей и настоящих листьев [10].
В передаче нитратного сигнала могут быть задействованы разнородные сенсоры кальция, например, кальцийнейрин-В-подобные белки (CBL), участие которых охарактеризовано у арабидопсиса. При отсутствии нитрата в среде имела место индукция CBL7, необходимая для экспрессии генов, кодирующих транспортеры высокого сродства ‒ NRT2.4 и NRT2.5 [33]. В случае дефицита нитрата CBL8 активировал протеинкиназы CIPK7, CIPK12 и CIPK14, регулирующие C/N-сигналинг, а CBL1 и CBL9 активировали CIPK23 [34, 35]. CIPK8 также относился к числу мишеней CBL [10]. У мутантов cbl7 при отсутствии нитрата в среде рост корневой системы и накопление нитрата были угнетены сильнее, чем у дикого типа [33].
NО как посредник в передаче сигнала
С использованием дефектных по НР мутантов доказана независимость большинства сигнальных эффектов нитрата от наработки его метаболических производных ‒ нитрита, аммония, глутамата и др. [36]. Известен самостоятельный информационный агент ‒ монооксид азота (NО), у растений специфически образуемый из нитрата неэнзиматическим либо энзиматическим путем и вызывающий целый ряд нитратзависимых реакций [37]. По современным представлениям, важнейший фермент, нарабатывающий NО у растений ‒ НР, тогда как NО-синтаза, субстратом которой является аргинин, практически отсутствует у высших их представителей [37, 38]. У табака Nicotiana tabacum L. скорость ферментативной наработки NО на плазмалемме клеток ризодермы зависела от уровня нитрата в среде и вследствие этого сам оксид азота являлся своего рода индикатором нитратообеспеченности [39].
У мутантов Arabidopsis nia1, nia2 вследствие дефицита NО было нарушено закрывание устьиц [40]. У растений дикого типа при оптимальном уровне NО стимулировал рост и ветвление корней, активировал транспортеры нитрата и НР. При концентрации нитрата порядка 5 мМ в среде или применении экзогенных доноров оксида азота, а также у мутантов nox1, отличающихся высоким уровнем эндогенного оксида азота, ввиду повышения его эндогенного уровня достигалось ингибирование роста корней, нитраттранспортной и нитратвосстановительной активностей [41, 42]. Отсюда можно полагать, что NО ‒ один из возможных мессенджеров в регуляции нитратом собственного гомеостаза в растениях.
Оксид азота регулирует широкий круг процессов, прямо не связанных с усвоением нитрата. В частности, прорастание семян и цветение. У мутантов Arabidopsis nos1, характеризуемых низким уровнем NО, зацветание было раньше, чем у дикого типа, тогда как у nox1 наступало позднее [41]. Следовательно, указанные процессы также могут регулироваться нитратом как донором оксида азота.
Таким образом, в настоящее время выявлены разнообразные участники сигнальных каскадов, дифференцированно вовлеченные в реализацию ответов на низкий, оптимальный и сверхоптимальный уровни нитрата. Представление об этом дает схема на рис. 1, где центральную роль в регуляции ответов на нитрат имеет каскад трансдукции сигнала, включающий трансцепторы на плазмалемме и далее низкомолекулярные вторичные мессенджеры ‒ инозиттрифосфат, кальций, и вторичные эффекторные белки, такие как протеинкиназы, кальцийнейрин-В-подобные белки, факторы транскрипции, убиквитинлигазы. Индукцию нитратом собственных трансцепторов можно рассматривать как способ усиления исходного сигнала, а вышеупомянутую нитратзависимую миграцию активированных протеинкиназ в ядро ‒ как фундамент своего рода “запоминания” текущего уровня нитрата в окружающей растительную клетку среде. Однако молекулярным и клеточным уровнями расшифровка механизма передачи нитратного сигнала не ограничивается. Она выходит на межклеточный и межорганный уровни, где важную роль выполняют другие интермедиаты.
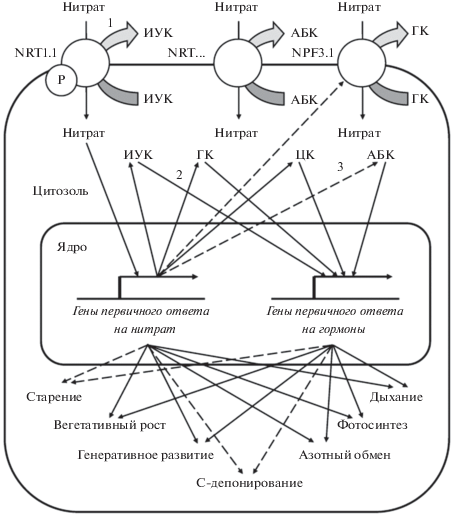
ГОРМОНЫ КАК МЕЖОРГАННЫЕ ПОСРЕДНИКИ
Роль нитрата как сигнального агента в индукции гормональной активности проявляется уже при прорастании семян и далее поддерживается на протяжении всего онтогенеза, включая формирование генеративных органов [43]. Особенно важно их действие как межорганных посредников в передаче нитратного сигнала в тех случаях, когда указанный ион восстанавливается преимущественно в корнях и практически не поступает по ксилеме в надземные органы. Однако в связи с эффективностью гормонов как дальнодействующих информационных агентов такая системная регуляция реализуется и тогда, когда имеет место ксилемный ток нитрата, оказывающего локальное внутриорганное действие.
Цитокинины
Еще в 1990-х гг. в корнях ячменя Hordeum vulgare L. выявлено быстрое (часы) накопление зеатинрибозида при локальном действии нитрата [44]. Далее у Arabidopsis и кукурузы было показано позитивное действие нитрата на наработку производных изопентениладенина в корнях с последующим их транспортом в побеги и реализацией специфических эффектов: индукции множества генов первичного ответа группы ARR, а также WUS, поддерживающего пролиферацию клеток в апикальной меристеме побега, развития хлоропластов, стимуляции фотосинтеза, задержки старения листьев [36, 45‒47]. Наряду с передачей информации о нитратном статусе в побег цитокинины опосредуют действие нитрата на корневую систему, например, стимулируя ее ветвление [48].
У Arabidopsis 50 мМ нитрат вызывал наработку цитокининов, индуцируя аденозинфосфат-изопентенилтрансферазы, прежде всего, AtIPT3 [49]. Соответствующая изоформа локализована в пластидах клеток-спутников флоэмы не только корней, но и побегов. Соотношение нитратзависимого синтеза цитокининов в указанных органах имеет видовую специфику. У яблони Malus hupehensis (Pamp.) Rehder нитрат индуцировал аденозинфосфат-изопентенилтрансферазу при локальном действии на листья, а у томата Lycopersicon esculentum L. ‒ только в корнях [50, 51]. Но такое заключение, скорее всего, уместно только при строго определенных условиях подкормки растений нитратом.
Ауксины
Показана регуляция нитратом потока ИУК как на ближние, так и на дальние расстояния. В первом случае перенос ауксина осуществляет нитратный трансцептор ‒ NRT1.1. С его участием у Arabidopsis 0.25‒0.5 мМ нитрат стимулировал экспорт ИУК из клеток корневых примордиев, а 1‒10 мМ ‒ подавлял [13, 52]. В последнем случае накапливающийся ауксин усиливал рост зачатков боковых корней, а также индуцировал сам NRT1.1 [53]. Поскольку NRT1.1 локализован, прежде всего, в зачатках различных вегетативных и генеративных органов [54], то можно полагать, что опосредованный ауксином нитратный сигналинг регулирует не только ветвление корней, но и формирование зачатков побегов и цветков.
У кукурузы с применением ингибитора транспорта ауксина ‒ трийодбензойной кислоты ‒ показана стимуляция 1 мМ и угнетение 0.5 мМ нитратом нисходящего тока 14С-ИУК из побегов в корни [55, 56]. Но участвующие в нитратзависимом межорганном транспорте ауксина белки до сих пор не охарактеризованы. В широком диапазоне концентраций нитрата ‒ 0.01‒50 мМ наблюдалась смена стимуляции и подавления рост боковых корней Arabidopsis с одинаковой спецификой у дикого типа и мутантов aux1-7 и eir1-1/atpin2, дефектных по классическим транспортерам ИУК [57]. Складывается впечатление, что транспортная активность NRT1.1 по отношению к ИУК является основой нитратзависимого перераспределения ауксина в растении как на органно-тканевом, так и организменном уровне.
Нитрат действует не только на транспорт, но и на передачу сигнала ауксинов. У Arabidopsis 5 мМ ион с участием вышеупомянутого первичного фактора транскрипции ‒ белка NLP7 ‒ индуцировал ген рецептора ИУК – AFB3 [22, 58]. В дальнейшем его транскрипт деградировал с участием аммоний- и глутаматиндуцибельной микроРНК miR393 [58]. Мишенью указанного рецептора ИУК AFB3 является специфический для клеток перицикла транскрипционный фактор ‒ белок NAC4, активизирующий ветвление корней [59]. Кроме того, на отделенных листьях Arabidopsis 50 мМ нитрат за счет активации NLP индуцировал ген белка BTB-семейства BT2, способного неизвестным еще путем усиливать действие ауксина и вследствие этого рост боковых корней [60, 61].
Гиббереллины
Участие данных гормонов в межорганной передаче нитратного сигнала мало исследовано. У Arabidopsis 1 мМ нитрат индуцировал энт-кауренсинтазу GA1, стартовый фермент биосинтеза гиббереллинов, тогда как 35 мМ ион ‒ репрессировал [62]. Соответственно ускорялось или тормозилось цветение. В семенах гулявника Sisymbrium officinale (L.) Scop. 20 мМ нитрат индуцировал ген гиббереллин-20-оксидазы SoGA20ox6, необходимой для наработки активных форм гиббереллинов, и репрессировал гены инактивирующих их оксидаз SoGA3ox и SoGA2ox [63]. Можно предположить, что оптимальные для роста уровни нитрата увеличивают наработку гиббереллинов, в свою очередь, вносящих свой вклад в итоговое ростстимулирующее действие.
Выявлено, что в транспорте гиббереллинов участвует белок NPF3.1, входящий в семейство транспортеров нитрата низкого сродства. Он локализован в разных органах Arabidopsis. В концентрации 0.25 мМ нитрат индуцировал указанный белок, а 1‒5 мМ ‒ репрессировал. Одним из последствий такой регуляции была активизация роста гипокотиля 1 мМ нитратом [64]. Вероятно, такого рода эффект связан с локальным накоплением гиббереллинов при снижении их оттока.
Абсцизовая кислота (АБК)
Показано, что 10 мМ нитрат стимулировал прорастание семян Arabidopsis за счет индукции АБК-8'-гидроксилазы CYP707A и деградации АБК. У мутантов cyp707a2-1 такой механизм был неактивен [65]. Аналогичные результаты были получены и у гулявника с использованием ингибитора белка CYP707A ‒ диниконазола [63]. Кроме того, вышеупомянутая мишень позитивного нитратного сигналинга ‒ белок BT2 ‒ подавлял эффект АБК при прорастании семян Arabidopsis [60]. Антагонизм действия оптимальных концентраций нитрата и АБК проявлялся как на уровне метаболизма гормона, так и передачи его сигнала.
Были обнаружены и факты нитратзависимой наработки АБК. Так, в эндодермисе и покоящемся центре корней Arabidopsis 10 мМ нитрат индуцировал ген β-глюкозидазы 1, гидролизующей коньюгаты АБК ‒ BG1. Как оказалось, АБК способна участвовать в позитивном нитратном сигналинге, индуцируя НР и нитритредуктазу, регулируя архитектонику корневой системы, а также стимулируя фосфорилирование транспортера NRT1.1 [66].
Вопрос о природе различий регуляции нитратом метаболизма АБК остается открытым. Можно предположить, что речь идет о концентрационной или органно-тканевой специфике. Однако при прорастании гулявника 20 мМ нитрат индуцировал не только ген CYP707A, но и гены диоксигеназ цис-эпоксикаротеноидов SoNCED6 и SoNCED9, участвующие в синтезе АБК, а также ген SoABI5, необходимый для ее рецепции [67]. Физиологическое значение такого рода примеров остается не выясненным. Возможно, некоторые звенья запускаемого нитратом сигнального каскада, интерпретируемые как позитивные регуляторы наработки и действия АБК, на самом деле необходимы для иных процессов.
Этилен
У Arabidopsis выявлено накопление этилена при увеличении концентрации нитрата от 0.1 до 10 мМ или, напротив, переходе к его дефициту (0.2 мМ после 10 мМ) [68]. Уровень гормона быстро нарастал до максимума, после чего падал до некоторого плато как при неспецифических стрессовых реакциях. Оптимизация нитратного питания пшеницы Triticum aestivum L. снижала уровень этилена. В пользу сигнального действия нитрата на его метаболизм свидетельствует сходство эффектов 0.1 и 5 мМ иона, наблюдаемое на фоне аммонийного питания [69].
Механизм участия этилена в каскаде передачи нитратного сигнала начинает проясняться. Так, у Arabidopsis сенсинг 0.2 мМ нитрата белком NRT2.1 запускал накопление указанного гормона. В дальнейшем этилен индуцировал гены EIN3, EIL1, кодирующие специфичные для передачи сигнала указанного гормона факторы транскрипции, и репрессировал ген NRT2.1 [70]. В результате имела место отрицательная обратная связь, необходимая для гормонального гомеостаза. С использованием мутантов arm Arabidopsis, дефектных по хитиназоподобному белку CTL1, показано его участие в регуляции нитратом уровня этилена [71].
Таким образом, вовлечение в реализацию специфических эффектов нитрата практически всех основных фитогормонов становится очевидным. Как следует из рис. 2, наряду с самим ${\text{NO}}_{3}^{ - }$ они осуществляют межорганную передачу сигнала и координируют ответные реакции на уровне целого организма. Действие нитрата на метаболизм гормонов и их сенсинг можно рассматривать как важный этап дальнейшей передачи сигнала.
ВЗАИМОДЕЙСТВИЕ С УГЛЕВОДНЫМ СИГНАЛОМ
Свет
Наряду с основными источниками азота растворимые углеводы представляют собой другой важнейший класс исходных субстратов метаболизма, поступающих в клетку с одновременным актом сенсинга, запускающим широкий круг адаптивных реакций [2]. Сопряжение азотного и углеродного обмена предполагает тесную координацию сигнальных эффектов нитрата и углеводов. При этом необходимо различать индукцию сигналов, исходящих от самих углеводов и от действия собственно света, у которого есть свои специфические механизмы сигнального воздействия на не менее сложную систему посредников, приводящую к физиологическим эффектам. В частности, в последние годы накапливаются примеры действия нитрата на светозависимые сигнальные каскады, среди которых отметим два случая. У Arabidopsis 80−120 мМ нитрат вызывал накопление вторичного мессенджера ‒ АМФ, далее активацию протеинкиназы AMPKα1, фосфорилирование ею фоторецепторного белка криптохрома CRY1 и его убиквитин-протеасомную деградацию, что нарушало фотопериодическую индукцию зацветания [12, 72]. При светозависимом прорастании турионов многокоренника Spirodela polyrhiza (L.) Schleiden 10 мМ нитрат усиливал передачу сигнала от фитохрома к глюкан-вода-дикиназе, запуская ее автофосфорилирование с последующим фосфорилированием крахмала и увеличением его сродства к α-амилазе, что запускало утилизацию указанного запасного полисахарида в весенний период [73].
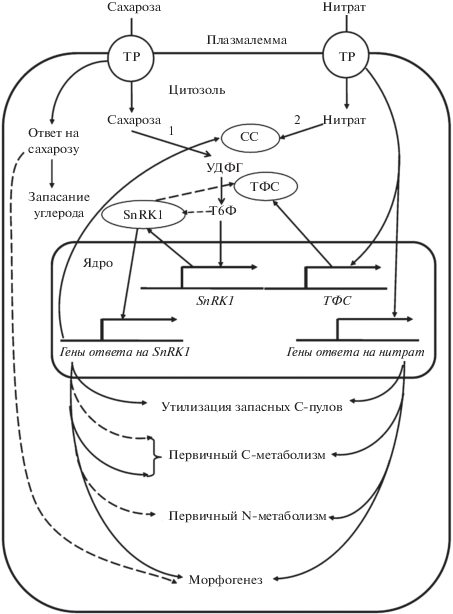
Тесная координация сигнальных эффектов нитрата и углеводов зависит от уровня обеспеченности клетки этими субстратами и включает в себя разные механизмы реализации. Их суммация представлена на рис. 3. Видно, что существуют общие для нитрата и сахарозы сигнальные пути, включающие трегалозо-6-фосфат и протеинкиназу SnRK1. Перейдем к их рассмотрению.
Рис. 3.
Взаимодействие нитратного и углеводного сигналов. СС – сахарозосинтаза, Т6Ф – трегалозо-6-фосфат, ТР – трансцепторы нитрата и сахарозы, ТФС – трегалозо-6-фосфатсинтаза, УДФГ – УДФ-глюкоза. Стрелки: 1 – метаболические пути, 2 – позитивное и 3 – негативное сигнальное действие нитрата или углеводов.
Сахароза и глюкоза
На средах с 300 мМ глюкозой и 0.1−0.6 мМ нитратом у Arabidopsis происходит активация трех ключевых протеинкиназ, регулирующих C/N-сигналинг ‒ CIPK7, CIPK12 и CIPK14. Одной из активируемых ими мишеней была убиквитинлигаза ATL31. У мутантов с нарушением ее связывания другими белками в указанных условиях проявлялись ингибирование роста и антоцианоз сеянцев, тогда как при оверэкспрессии гена нормального варианта убиквитинлигазы развивалась зеленая окраска семядолей [34]. Избыток СО2 и дефицит азота также индуцировали убиквитинлигазы ATL31 и ATL6, у мутантов по которым нарушены ответы на дефицит нитрата [74]. CIPK7, CIPK12 и CIPK14 фосфорилировали ATL31 с участием ионов кальция, что приводило к связыванию указанной убиквитинлигазы с регуляторными 14-3-3-белками и деградации последних [34]. Как 50 мМ нитрат, так и 5% глюкоза индуцировали CHO1, кодирующий фактор транскрипции [24]. В противоположность нитрату сахароза и глюкоза репрессировали ген BT2, что усиливало ростингибирующие эффекты АБК [60]. Как видно из рис. 3, сахароза не только ингибирует рост растения, но и запускает накопление запасного крахмала.
Трегалозный шунт
На широком выборе объектов показано, что трегалоза ‒ распространенный дисахарид, нарабатываемый трегалозо-6-фосфатсинтазой (ТФС) и трегалозо-6-фосфатфосфатазой, а мутанты и трансформанты по гену ТФС отличаются множественными фенотипическими изменениями, что легло в основу представления о сигнальном действии интермедиатов трегалозного шунта [75]. Трегалозо-6-фосфат ‒ маркер обеспеченности растений фотоассимилятами, регулирующий рост и С-метаболизм [76]. С использованием ДНК-микрочипов и мутантов по белку ТФС tps1 показано позитивное действие трегалозо-6-фосфата на морфогенетические признаки ‒ поддержание объема апикальной меристемы, вегетативный рост, цветение, формирование семян и эмбриогенез. В метаболическом плане это выражалось в экспрессии белков клеточной стенки, таких как УДФ-глюкозо-4-эпимераза, β-экспансин, ксилоглюкан-эндотрансглюкозилаза, пектатлиаза, лакказа, а также ферментов первичного обмена ‒ α-амилазы, сахарозофосфатсинтазы, сахарозосинтазы (СС), щелочной инвертазы, фосфоглюкомутазы, фосфоглицератмутазы, цитратсинтазы при репрессии ФЕП-карбоксикиназы, фермента глюконеогенеза [77–79]. Примечательно, что уже 0.25 мМ нитрат, индуцируя ТФС, подобно трегалозо-6-фосфату запускал по приведенной выше схеме утилизацию запасных форм углерода ‒ сахарозы и крахмала, интенсификацию первичного метаболизма и морфогенетических процессов [80].
При избытке растворимых углеводов и том же дефиците нитрата показано накопление трегалозо-6-фосфата до уровня, вызывающего торможение роста и старение растения [76, 81]. Такой антагонизм нитратного и углеводного сигналов связан с преобладанием катаболических реакций при сверхоптимальном уровне трегалозо-6-фосфата [82]. Напротив, у мутантов по ТФС морфогенез заторможен из-за недостаточного обеспечения энергией.
Протеинкиназы SnRK
Протеинкиназы SnRK (“SNF1-related protein kinase”) были найдены у растений как гомологи белка SNF1 (“sucrose nonfermenting”) дрожжей [83]. Мутанты последних snf1 не изменяли экспрессию генов, кодирующих ключевые ферменты С-метаболизма, в ответ на глюкозу [84]. SnRK1 у растений также является важным регулятором обмена, ингибирующим НР, сахарозофосфатсинтазу, АДФ-глюкозопирофосфорилазу, фруктозо-1,6-бисфосфатазу, ТФС, 3-окси-3-метилглутарил-КоА-редуктазу шпината Spinacia oleracea L. и арабидопсиса, но активирующим пируваткиназу картофеля Solanum tuberosum L. [85–89]. Кроме того, SnRK1 индуцировала СС картофеля и α‑амилазу пшеницы Triticum aestivum L. [90, 91]. На примере Arabidopsis и гороха посевного Pisum sativum L. показана необходимость SnRK1 для поддержания меристемы и дифференциации тканей, роста гипокотиля и корня, развития семядолей и настоящих листьев, задержки преждевременного старения листьев, формирования пыльцы, созревания семян [92, 93].
У Arabidopsis выявлено 50% ингибирование фермента SnRK1 5.4 мкМ трегалозо-6-фосфатом, вносившее основной вклад в вышеописанные транскрипционные эффекты последнего и в результате ‒ стимуляцию биосинтеза [79]. Несмотря на это, у мутантов Arabidopsis tps1 имела место репрессия гена SnRK1 [78]. Это свидетельствует в пользу предположения, согласно которому субмикромолярные уровни трегалозо-6-фосфата, индуцируя ген SnRK1, тем самым активизируют катаболизм, закладывая энергетическую основу для интенсивного морфогенеза. Однако при дальнейшем накоплении указанного углевода активность белка SnRK1 поддерживается на оптимально низком уровне, не нарушающем баланс между наработкой структурных компонентов клетки и энергетическим обменом. При избытке трегалозо-6-фосфата вероятна сверхоптимальная экспрессия гена SnRK1, что и приводит к нарушению морфогенеза.
У огурца Cucumis sativus L. 7−11 мМ нитрат подавлял транскрипцию новообнаруженного гена SnRK [94]. Такой результат проливает свет на физиологическую основу конвергенции целого ряда эффектов нитрата и ранее известного ингибитора белка SnRK1 ‒ трегалозо-6-фосфата.
Сахарозосинтаза (СС)
Нами выявлено позитивное действие нитрата на активность ключевого фермента метаболизма сахарозы СС в корнях и гипокотилях гороха посевного [95, 96]. Можно предположить двоякую роль такого эффекта в регуляции уровня трегалозо-6-фосфата. С одной стороны, СС обеспечивает трегалозный шунт субстратом ‒ УДФ-глюкозой, с другой − способна минимизировать соотношение C : N в тканях растения. Кроме того, УДФ-глюкоза утилизируется при наработке не только трегалозо-6-фосфата, но и целого ряда других соединений, прежде всего, структурных полисахаридов [97]. Это означает, что уже на субстратном уровне заложен антагонизм между накоплением избытка трегалозо-6-фосфата и интенсивным новообразованием фитомассы.
Возникает вопрос, является ли СС непосредственной мишенью нитрата либо позитивный эффект последнего связан с индукцией ТФС и действием трегалозо-6-фосфата. Нами показана активация СС нитратом в реакционной смеси [95]. Вероятно, подобного рода эффект является первичным звеном в регуляции нитратом наработки УДФ-глюкозы и далее активизации трегалозного шунта, регулирующего широкий круг физиологических процессов. В таком случае вышеупомянутая индукция СС трегалозо-6-фосфатом может быть одним из звеньев усиления нитратного сигнала. В совокупности взаимосвязь СС, ТФС и SnRK1 расширяет возможности реализации комбинированного ответа клетки на нитрат и сахарозу (рис. 3).
Рассматривая СС как ключевое звено углеводно-нитратного сигналинга, необходимо заметить, что в настоящее время получены доказательства ее участия не только в метаболизме сахарозы, но и ряде сигнальных процессов. Так, у Arabidopsis имела место индукция одной из изоформ СС (SUS4) различными факторами, запускающими цветение, что связано с индукцией гена FT [98]. Последний, в свою очередь, запускал весь каскад процессов генеративного развития. Кроме того, СС может иметь и исключительно сигнальные функции. Такова изоформа СС из митохондрий кукурузы, взаимодействующая с потенциалзависимыми ионными каналами и регулирующая трансмембранные ионные потоки при гипоксии [99]. Следовательно, нитрат как позитивный регулятор СС является возможной альтернативой классическим индукторам ряда процессов, обычно не связываемых с высокой обеспеченностью растений азотом. Так ли это, должны выявить предстоящие исследования.
Таким образом, тесная интеграция нитратного и углеводного сигналов очевидна. Применение ДНК-микрочипов показало широкую распространенность ее примеров. У Arabidopsis 78% генов, индуцируемых нитратом, и 83% – углеводами, регулируется C/N-балансом [100].
ЗАКЛЮЧЕНИЕ
Нитрат является одним из основных сигнальных агентов, регулирующих широкий круг физиологических процессов с участием различных вторичных мессенджеров и эффекторных белков. Их полиморфизм, как и большой набор рецепторов, определяет возможность дифференцированных реакций на различные уровни указанного источника азота. Наряду с распространенными способами сигнальной трансдукции (участие протеинкиназного каскада, факторов транскрипции, специфической деградации белков, гормональной передачи на межорганном уровне) нитрат задействует и ранее малоисследованные, такие как усиление сигнала за счет индукции собственных трансцепторов. Возможно, некоторые из ферментов, активируемых нитратом, являются и его альтернативными сенсорами. Высокая значимость нитрата как основного источника азота определяет его взаимодействие с другими основополагающими экзогенными (свет) и эндогенными (углеводы, фитогормоны) сигнальными агентами. Можно ожидать, что число примеров такого рода будет множиться. Интеграция разнородных сигнальных каскадов позволяет растению координировать реакции не только на нитрат, но и на другие лимитирующие рост факторы среды в контексте возрастного состояния и продукционного процесса.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит описания каких-либо экспериментов с участием людей и животных в качестве объектов исследований.
Список литературы
Измайлов С.Ф., Никитин А.В., Родионов В.А. Нитратный сигналинг в растениях: введение в проблему // Физиология растений. 2018. Т. 65. С. 256.
Steyfkens F., Zhang Z., Van Zeebroeck G., Thevelein J.M. Multiple transceptors for macro- and micro-nutrients control diverse cellular properties through the PKA pathway in yeast: A paradigm for the rapidly expanding world of eukaryotic nutrient transceptors up to those in human cells // Front Pharmacol. 2018. V. 13: 191. https://doi.org/10.3389/fphar.2018.00191
Tsay Y.F. Plant science: How to switch affinity // Nature. 2014. V. 507. P. 44.
Parker J.L., Newstead S. Molecular basis of nitrate uptake by the plant nitrate transporter NRT1.1 // Nature. 2014. V. 507. P. 68.
Wen Z., Tyerman S.D., Dechorgnat J., Ovchinnikova E., Dhugga K.S., Kaiser B.N. Maize NPF6 proteins are homologs of Arabidopsis CHL1 that are selective for both nitrate and chloride // Plant Cell. 2017. V. 29. P. 2581.
Rashid M., Bera S., Medvinsky A.B., Sun G.-Q., Li B.-L., Chakraborty A. Adaptive regulation of nitrate transceptor NRT1.1 in fluctuating soil nitrate conditions // iSci. 2018. V. 2. P. 41.
Sun J., Bankston J.R., Payandeh J., Hinds T.R., Zagotta W.N., Zheng N. Crystal structure of the plant dual-affinity nitrate transporter NRT1.1 // Nature. 2014. V. 507. P. 73.
Champigny M.L., Foyer C. Nitrate activation of cytosolic protein kinases diverts photosynthetic carbon from sucrose to amino acid biosynthesis: basis for a new concept // Plant Physiol. 1992. V. 100. P. 7.
Sakakibara H., Kobayashi K., Deji A. Sugiyama T. Partial characterization of the signaling pathway for the nitrate-dependent expression of genes for nitrogen-assimilatory enzymes using detached maize leaves // Plant Cell Physiol. 1997. V. 38. P. 837.
Hu H.-C., Wang Y.-Y., Tsay Y.-F. AtCIPK8, a CBL-interacting protein kinase, regulates the low-affinity phase of the primary nitrate response // Plant J. 2009. V. 57. P. 264.
Liu K.H., Niu Y., Konishi M., Wu Y., Du H., Sun Chung H., Li L., Boudsocq M., McCormack M., Maekawa S., Ishida T., Zhang C., Shokat K., Yanagisawa S., Sheen J. Discovery of nitrate-CPK-NLP signalling in central nutrient-growth networks // Nature. 2017a. V. 545. P. 311.
Yuan S., Zhang Z.W., Zheng C., Zhao Z.Y., Wang Y., Feng L.Y., Niu G., Wang C.Q., Wang J.H., Feng H., Xu F., Bao F., Hu Y., Cao Y., Ma L., et al. Arabidopsis cryptochrome 1 functions in nitrogen regulation of flowering // PNAS. 2016. V. 113. P. 7661.
Gojon A., Krouk G., Perrine-Walker F., Laugier E. Nitrate transceptor(s) in plants // J. Exp. Bot. 2011. V. 62. P. 2299.
Wang C., Zhang W., Li Z., Li Z., Bi Y., Crawford N.M., Wang Y. FIP1 plays an important role in nitrate signaling and regulates CIPK8 and CIPK23 expression in Arabidopsis // Front. Plant Sci. 2018. V. 9: 593. https://doi.org/10.3389/fpls.2018.00593
Konishi M., Yanagisawa S. Roles of the transcriptional regulation mediated by the nitrate-responsive cis-element in higher plants // Biochem. Biophys. Res. Comm. 2011. V. 411. P. 708.
Zhang H., Forde B.G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture // Sci. 1998. V. 279. P. 407.
Gan Y., Bernreiter A., Filleur S., Abram B., Forde B.G. Overexpressing the ANR1 MADS-box gene in transgenic plants provides new insights into its role in the nitrate regulation of root development // Plant Cell Physiol. 2012. V. 53. P. 1003.
Yu C., Liu Y., Zhang A., Su S., Yan A., Huang L., Ali I., Liu Y., Forde B.G., Gan Y. MADS-box transcription factor OsMADS25 regulates root development through affection of nitrate accumulation in rice // PLoS ONE. 2015. V. 10: e0135196. https://doi.org/10.1371/journal.pone.0135196
Nemie-Feyissa D., Olafsdottir S.M., Heidari B., Lillo C. Nitrogen depletion and small R3-MYB transcription factors affecting anthocyanin accumulation in Arabidopsis leaves // Phytochem. 2014. V. 98. P. 34.
Rubin G., Tohge T., Matsuda F., Saito K., Scheible W.-R. Members of the LBD family of transcription factors repress anthocyanin synthesis and affect additional nitrogen responses in Arabidopsis // Plant Cell. 2009. V. 21. P. 3567.
Konishi M., Yanagisawa S. Arabidopsis NIN-like transcription factors have a central role in nitrate signalling // Nat. Commun. 2013. V. 4: 1617. https://doi.org/10.1038/ncomms2621
Yu L.-H., Wu J., Tang H., Yuan Y., Wang S.-M., Wang Y.-P., Zhu Q.-S., Li S.-G., Xiang C.-B. Overexpression of Arabidopsis NLP7 improves plant growth under both nitrogen-limiting and -sufficient conditions by enhancing nitrogen and carbon assimilation // Sci. Rep. 2016. V. 6: 27795. https://doi.org/10.1038/srep27795
Yan D., Easwaran V., Chau V., Okamoto M., Ierullo M., Kimura M., Endo A., Yano R., Pasha A., Gong Y., Bi Y.-M., Provart N., Guttman D., Krapp A., Rothstein S.J., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis // Nat. Commun. 2016. V. 7: 13179. https://doi.org/10.1038/ncomms13179
Yamagishi K., Tatematsu K., Yano R., Preston J., Kitamura S., Takahashi H., McCourt P., Kamiya Y., Nambara E. CHOTTO1, a double AP2 domain protein of Arabidopsis thaliana, regulates germination and seedling growth under excess supply of glucose and nitrate // Plant Cell Physiol. 2009. V. 50. P. 330.
Sawaki N., Tsujimoto R., Shigyo M., Konishi M., Toki S., Fujiwara T., Yanagisawa S. A nitrate-inducible GARP family gene encodes an auto-repressible transcriptional repressor in rice // Plant Cell Physiol. 2013. V. 54. P. 506.
Guan P., Wang R., Nacry P., Breton G., Kay S.A., Pruneda-Paz J.L., Davani A., Crawford N.M. Nitrate foraging by Arabidopsis roots is mediated by the transcription factor TCP20 through the systemic signaling pathway // PNAS. 2014. V. 111. P. 15267.
Guan P., Ripoll J.-J., Wang R., Vuong L., Bailey-Steinitz L.J., Ye D., Crawford N.M. Interacting TCP and NLP transcription factors control plant responses to nitrate availability // PNAS. 2017. V. 114. P. 2419.
Alvarez J.M., Riveras E., Vidal E.A., Gras D.E., Contreras-López O., Tamayo K.P., Aceituno F., Gómez I., Ruffel S., Lejay L., Jordana X., Gutiérrez R.A. Systems approach identifies TGA1 and TGA4 transcription factors as important regulatory components of the nitrate response of Arabidopsis thaliana roots // Plant J. 2014. V. 80. P. 1.
Canales J., Contreras-López O., Alvarez J.M., Gutiérrez R.A. Nitrate induction of root hair density is mediated by TGA1/TGA4 and CPC transcription factors in Arabidopsis thaliana // Plant J. 2017. V. 92. P. 305.
Peng M., Hudson D., Schofield A., Tsao R., Yang R., Gu R., Bi Y.-M., Rothstein S.J. Adaptation of Arabidopsis to nitrogen limitation involves induction of anthocyanin synthesis which is controlled by the NLA gene // J. Exp. Bot. 2008a. V. 59. P. 2933.
Liu W., Sun Q., Wang K., Du Q., Li W.-X. Nitrogen Limitation Adaptation (NLA) is involved in source-to-sink remobilization of nitrate by mediating the degradation of NRT1.7 in Arabidopsis // New Phytol. 2017в. V. 214. P. 734.
Riveras E., Alvarez J.M., Vidal E.A., Oses C., Vega A., Gutiérrez R.A. The calcium ion is a second messenger in the nitrate signaling pathway of Arabidopsis // Plant Physiol. 2015. V. 169. P. 1397.
Ma Q., Tang R.J., Zheng X.J., Wang S.M., Luan S. The calcium sensor CBL7 modulates plant responses to low nitrate in Arabidopsis // Biochem. Biophys. Res. Commun. 2015. V. 468. P. 59.
Yasuda S., Aoyama S., Hasegawa Y., Sato T., Yamaguchi J. Arabidopsis CBL-interacting protein kinases regulate carbon/nitrogen-nutrient response by phosphorylating ubiquitin ligase ATL31 // Mol. Plant. 2017. V. 10. P. 605.
Straub T., Ludewig U., Neuhäuser B. The kinase CIPK23 inhibits ammonium transport in Arabidopsis thaliana // Plant Cell. 2017. V. 29. P. 409.
Wang R., Tischner R., Gutierrez R.A., Hoffman M., Xing X., Chen M., Coruzzi G., Crawford N.M. Genomic analysis of the nitrate response using a nitrate reductase-null mutant of Arabidopsis // Plant Physiol. 2004. V. 136. P. 2512.
Chamizo-Ampudia A., Sanz-Luque E., Llamas A., Galvan A., Fernandez E. Nitrate reductase regulates plant nitric oxide homeostasis // Trends Plant Sci. 2017. V. 22. P. 163.
Santolini J., Andre F., Jeandroz S., Wendehenne D. Nitric oxide synthase in plants: Where do we stand? // Nitric Oxide. 2017. V. 63. P. 30.
Stöhr C., Stremlau S. Formation and possible roles of nitric oxide in plant roots // J. Exp. Bot. 2006. V. 57. P. 463.
Desikan R., Griffiths R., Hancock J., Neill S. A new role for an old enzyme: Nitrate reductase mediated nitric oxide generation is required for abscisic acid-induced stomatal closure in Arabidopsis thaliana // PNAS. 2002. V. 99. P. 16314.
He Y., Tang R.H., Hao Y., Stevens R.D., Cook C.W., Ahn S.M., Jing L., Yang Z., Chen L., Guo F., Fiorani F., Jackson R.B., Crawford N.M., Pei Z.M. Nitric oxide represses the Arabidopsis floral transition // Science. 2004. V. 305. P. 1968.
Sun H., Tao J., Zhao Q., Xu G., Zhang Y. Multiple roles of nitric oxide in root development and nitrogen uptake // Plant Signal Behav. 2017. V. 12: e1274480. https://doi.org/10.1080/15592324.2016.1274480
Fredes I., Moreno S., Dıaz F.P., Gutierrez R.A. Nitrate signaling and the control of Arabidopsis growth and development // Curr. Opin. Plant Biol. 2019. V. 47. P. 112.
Samuelson M.E., Larsson C.-M. Nitrate regulation of zeatin riboside levels in barley roots: effects of inhibitors of N assimilation and comparison with ammonium // Plant Sci. 1993. V. 93. P. 77.
Sakakibara H. Nitrate-specific and cytokinin-mediated nitrogen signaling pathways in plants // J. Plant Res. 2003. V. 116. P. 253.
Ruffel S., Poitout A., Krouk G., Coruzzi G.M., Lacombe B. Long-distance nitrate signaling displays cytokinin dependent and independent branches // J. Integr. Plant Biol. 2016. V. 58. P. 226.
Landrein B., Formosa-Jordan P., Malivert A., Schuster C., Melnyk C.W., Yang W., Turnbull C., Meyerowitz E.M., Locke J.C.W., Jönsson H. Nitrate modulates stem cell dynamics in Arabidopsis shoot meristems through cytokinins // PNAS. 2018. V. 115. P. 1382.
Tian Q., Chen F., Zhang F., Mi G. Possible involvement of cytokinin in nitrate-mediated root growth in maize // Plant and Soil. 2005. V. 277. P. 185.
Takei K., Ueda N., Aoki K., Kuromori T., Hirayama T., Shinozaki K., Yamaya T., Sakakibara H. AtIPT3 is a key determinant of nitrate-dependent cytokinin biosynthesis in Arabidopsis // Plant Cell Physiol. 2004. V. 45. P. 1053.
Rahayu Y.S., Walch-Liu P., Neumann G., Römheld V., von Wirén N., Bangerth F. Root-derived cytokinins as long-distance signals for ${\text{NO}}_{3}^{ - }$-induced stimulation of leaf growth // J. Exp. Bot. 2005. V. 56. P. 1143.
Peng J., Peng F., Zhu C., Wei S. Molecular cloning of a putative gene encoding isopentenyltransferase from pingyitiancha (Malus hupehensis) and characterization of its response to nitrate // Tree Physiol. 2008в. V. 28. P. 899.
Krouk G., Lacombe B., Bielach A., Perrine-Walker F., Malinska K., Mounier E., Hoyerova K., Tillard P., Leon S., Ljung K., Zazimalova E., Benkova E., Nacry P., Gojon A. Nitrate-regulated auxin transport by NRT1.1 defines a mechanism for nutrient sensing in plants // Dev. Cell. 2010. V. 18. P. 927.
Guo F.Q., Wang R., Crawford N.M. The Arabidopsis dual-affinity nitrate transporter gene AtNRT1.1 (CHL1) is regulated by auxin in both shoots and roots // J. Exp. Bot. 2002. V. 53. P. 835.
Guo F.-Q., Wang R., Chen M., Crawford N.M. The Arabidopsis dual-affinity nitrate transporter gene AtNRT1.1 (CHL1) is activated and functions in nascent organ development during vegetative and reproductive growth // Plant Cell. 2001. V. 13. P. 1761.
Guo Y., Chen F., Zhang F., Mi G. Auxin transport from shoot to root is involved in the response of lateral root growth to localized supply of nitrate in maize // Plant Sci. 2005. V. 169. P. 894.
Liu J., An X., Cheng L., Chen F., Bao J., Yuan L., Zhang F., Mi G. Auxin transport in maize roots in response to localized nitrate supply // Ann. Bot. 2010. V. 106. P. 1019.
Bao J., Chen F., Gu R., Wang G., Zhang F., Mi G. Lateral root development of two Arabidopsis auxin transport mutants, aux1-7 and eir1-1, in response to nitrate supplies // Plant Sci. 2007. V. 173. P. 417.
Vidal E.A., Araus V., Lu C., Parry G., Green P.J., Coruzzi G.M., Gutiérrez R.A. Nitrate-responsive miR393/AFB3 regulatory module controls root system architecture in Arabidopsis thaliana // PNAS. 2010. V.107. P. 4477.
Vidal E.A., Álvarez J.M., Gutiérrez R.A. Nitrate regulation of AFB3 and NAC4 gene expression in Arabidopsis roots depends on NRT1.1 nitrate transport function // Plant Signal. Behavior. 2014. V. 9: e28501. https://doi.org/10.4161/psb.28501
Mandadi K.K., Misra A., Ren S., McKnight T.D. BT2, a BTB protein, mediates multiple responses to nutrients, stresses, and hormones in Arabidopsis // Plant Physiol. 2009. V. 150. P. 1930.
Sato T., Maekawa S., Konishi M., Yoshioka N., Sasaki Y., Maeda H., Ishida T., Kato Y., Yamaguchi J., Yanagisawa S. Direct transcriptional activation of BT genes by NLP transcription factors is a key component of the nitrate response in Arabidopsis // Biochem. Biophys. Res. Comm. 2017. V. 483. P. 380.
Liu T., Li Y., Ren J., Qian Y., Yang X., Duan W., Hou X. Nitrate or NaCl regulates floral induction in Arabidopsis thaliana // Biol. 2013. V. 68. P. 215.
Carrillo-Barral N., Matilla A.J., Rodríguez-Gacio M. del C., Iglesias-Fernández R. Nitrate affects sensu-stricto germination of after-ripened Sisymbrium officinale seeds by modifying expression of SoNCED5, SoCYP707A2 and SoGA3ox2 genes // Plant Sci. 2014. V. 217‒218. P. 99.
David L.C., Berquin P., Kanno Y., Seo M., Daniel-Vedele F., Ferrario-Méry S. N availability modulates the role of NPF3.1, a gibberellin transporter, in GA-mediated phenotypes in Arabidopsis // Planta. 2016. V. 244. P. 1315.
Matakiadis T., Alboresi A., Jikumaru Y., Tatematsu K., Pichon O., Renou J.P., Kamiya Y., Nambara E., Truong H.N. The Arabidopsis abscisic acid catabolic gene CYP707A2 plays a key role in nitrate control of seed dormancy // Plant Physiol. 2009. V. 149. P. 949.
Harris J.M., Ondzighi-Assoume C.A. Environmental nitrate signals through abscisic acid in the root tip // Plant Signal. Behavior. 2017. V. 12: e1273303. https://doi.org/10.1080/15592324.2016.1273303
Carrillo-Barral N., Matilla A.J., Iglesias-Fernández R., Del Carmen Rodríguez-Gacio M. Nitrate-induced early transcriptional changes during imbibition in non-after-ripened Sisymbrium officinale seeds // Physiol. Plant. 2013. V. 148. P. 560.
Tian Q.-Y., Sun P., Zhang W.-H. Ethylene is involved in nitrate-dependent root growth and branching in Arabidopsis thaliana // New Phytol. 2009. V. 184. P. 918.
Garnica M., Houdusse F., Claude Yvin J., Garcia-Mina J.M. Nitrate supply induces changes in polyamine content and ethylene production in wheat plants grown with ammonium // J. Plant Physiol. 2009. V. 166. P. 363.
Zheng D., Han X., An Y.I., Guo H., Xia X., Yin W. The nitrate transporter NRT2.1 functions in the ethylene response to nitrate deficiency in Arabidopsis // Plant Cell Environ. 2013. V. 36. P. 1328.
Hermans C., Porco S., Vandenbussche F., Gille S., De Pessemier J., Van Der Straeten D., Verbruggen N., Bush D.R. Dissecting the role of CHITINASE-LIKE1 in nitrate-dependent changes in root architecture // Plant Physiol. 2011. V. 157. P. 1313.
Zhou Y.H., Zhang Z.W., Zheng C., Yuan S., He Y. Nitrogen regulates CRY1 phosphorylation and circadian clock input pathways // Plant Signal. Behav. 2016. V. 11: e1219830. https://doi.org/10.1080/15592324.2016.1219830
Appenroth K.J., Ziegler P. Light-induced degradation of storage starch in turions of Spirodela polyrhiza depends on nitrate // Plant Cell Environ. 2008. V. 31. P. 1460.
Maekawa S., Sato T., Asada Y., Yasuda S., Yoshida M., Chiba Y., Yamaguchi J. The Arabidopsis ubiquitin ligases ATL31 and ATL6 control the defense response as well as the carbon/nitrogen response // Plant Mol. Biol. 2012. V. 79. P. 217.
Lunn J.E., Delorge I., Figueroa C.M., Van Dijck P., Stitt M. Trehalose metabolism in plants // Plant J. 2014. V. 79. P. 544.
Nunes C., O’Hara L.E., Primavesi L.F., Delatte T.L., Schluepmann H., Somsen G.W., Silva A.B., Fevereiro P.S., Wingler A., Paul M.J. The trehalose 6-phosphate/SnRK1 signaling pathway primes growth recovery following relief of sink limitation // Plant Physiol. 2013a. V. 162. P. 1720.
van Dijken A.J.H., Schluepmann H., Smeekens S.C.M. Arabidopsis trehalose-6-phosphate synthase 1 is essential for normal vegetative growth and transition to flowering// Plant Physiol. 2004. V. 135. P. 969.
Gómez L.D., Baud S., Gilday A., Li Y., Graham I.A. Delayed embryo development in the ARABIDOPSIS TREHALOSE-6-PHOSPHATE SYNTHASE 1 mutant is associated with altered cell wall structure, decreased cell division and starch accumulation // Plant J. 2006. V. 46. P. 69.
Zhang Y., Primavesi L.F., Jhurreea D., Andralojc P.J., Mitchell R.A.C., Powers S.J., Schluepmann H., Delatte Th., Wingler A., Paul M.J. Inhibition of SNF1-related protein kinase1 activity and regulation of metabolic pathways by trehalose-6-phosphate // Plant Physiol. 2009. V. 149. P. 1860.
Wang R., Okamoto M., Xing X., Crawford N.M. Microarray analysis of the nitrate response in Arabidopsis roots and shoots reveals over 1,000 rapidly responding genes and new linkages to glucose, trehalose-6-phosphate, iron, and sulfate metabolism // Plant Physiol. 2003. V. 132. P. 556.
Wingler A., Delatte Th.L., O’Hara L.E., Primavesi L.F., Jhurreea D., Paul M.J., Schluepmann H. Trehalose 6-phosphate is required for the onset of leaf senescence associated with high carbon availability // Plant Physiol. 2012. V. 158. P. 1241.
Schluepmann H., Berke L., Sanchez-Perez G.F. Metabolism control over growth: a case for trehalose-6-phosphate in plants // J. Exp. Bot. 2012. V. 63. P. 3379.
Alderson A., Sabelli P.A., Dickinson J.R., Cole D., Richardson M., Kreis M., Shewry P.R., Halford N.G. Complementation of snf1, a mutation affecting global regulation of carbon metabolism in yeast, by a plant protein kinase cDNA // PNAS. 1991. V. 88. P. 8602.
Celenza J.L., Carlson M. A yeast gene that is essential for release from glucose repression encodes a protein kinase // Science. 1986. V. 233. P. 1175.
Sugden C., Donaghy P.G., Halford N.G., Hardie D.G. Two SNF1-related protein kinases from spinach leaf phosphorylate and inactivate 3-hydroxy-3-methylglutaryl-coenzyme A reductase, nitrate reductase, and sucrose phosphate synthase in vitro // Plant Physiol. 1999. V. 120. P. 257.
Kulma A., Villadsen D., Campbell D.G., Meek S.E., Harthill J.E., Nielsen T.H., Mackintosh C. Phosphorylation and 14-3-3 binding of Arabidopsis 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase // Plant J. 2004. V. 37. P. 654.
Harthill J.E., Meek S.E., Morrice N., Peggie M.W., Borch J., Wong B.H., Mackintosh C. Phosphorylation and 14-3-3 binding of Arabidopsis trehalose-phosphate synthase 5 in response to 2-deoxyglucose // Plant J. 2006. V. 47. P. 211.
Jossier M., Bouly J.P., Meimoun P., Arjmand A., Lessard P., Hawley S., Grahame H.D., Thomas M. SnRK1 (SNF1-related kinase 1) has a central role in sugar and ABA signalling in Arabidopsis thaliana // Plant J. 2009. V. 59. P. 316.
Beczner F., Dancs G., Sós-Hegedus A., Antal F., Bánfalvi Zs. Interaction between SNF1-related kinases and a cytosolic pyruvate kinase of potato // J. Plant Physiol. 2010. V. 167. P. 1046.
Purcell P.C., Smith A.M., Halford N.G. Antisense expression of a sucrose non-fermenting-1-related protein kinase sequence in potato results in decreased expression of sucrose synthase in tubers and loss of sucrose-inducibility of sucrose synthase transcripts in leaves // Plant J. 1998. V. 14. P. 195.
Laurie S., McKibbin R.S., Halford N.G. Antisense SNF1-related (SnRK1) protein kinase gene represses transient activity of an α-amylase (α-Amy2) gene promoter in cultured wheat embryos // J. Exp. Bot. 2003. V. 54. P. 739.
Radchuk R., Emery R.J., Weier D., Vigeolas H., Geigenberger P., Lunn J.E., Feil R., Weschke W., Weber H. Sucrose non-fermenting kinase 1 (SnRK1) coordinates metabolic and hormonal signals during pea cotyledon growth and differentiation // Plant J. 2010. V. 61. P. 324.
Cho Y.H., Hong J.W., Kim E.C., Yoo S.D. Regulatory functions of SnRK1 in stress-responsive gene expression and in plant growth and development // Plant Physiol. 2012. V. 158. P. 1955.
He H.-M., Qin Zh.-W., Feng Zh., Wu T. Cloning and expression analysis of sucrose non-fermenting-1 related protein kinase (SnRK) in Cucumis sativus L. under low nitrogen conditions // J. Northeast Agricult. Univ. (Engl. ed.). 2013. V. 20. P. 1.
Брускова Р.К., Никитин А.В., Сацкая М.В., Измайлов С.Ф. Действие нитрата на активность сахарозосинтазы растений гороха // Физиология растений. 2009. Т. 56. С. 85.
Никитин А.В., Измайлов С.Ф. Ферменты диссимиляции сахарозы как мишени действия нитрата в раннем онтогенезе гороха посевного // Физиология растений. 2016. Т. 63. С. 159.
Kleczkowski L.A., Kunz S., Wilczynska M. Mechanisms of UDP-glucose synthesis in plants // Crit. Rev. Plant Sci. 2010. V. 29. P. 191.
Seo P.J., Ryu J., Kang S.K., Park Ch.-M. Modulation of sugar metabolism by an INDETERMINATE DOMAIN transcription factor contributes to photoperiodic flowering in Arabidopsis // Plant J. 2011. V. 65. P. 418.
Subbaiah C.C., Palaniappan A., Duncan K., Rhoads D.M., Huber S.C., Sachs M.M. Mitochondrial localization and putative signaling function of sucrose synthase in maize // J. Biol. Chem. 2006. V. 281. P. 15625.
Gutiérrez R.A., Lejay L.V., Dean A., Chiaromonte F., Shasha D.E., Coruzzi G.M. Qualitative network models and genome-wide expression data define carbon/nitrogen-responsive molecular machines in Arabidopsis // Gen. Biol. 2007. V. 8: R7. https://doi.org/10.1186/gb-2007-8-1-r7
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений