Физиология растений, 2020, T. 67, № 2, стр. 188-195
Активность дыхательных путей в культуре клеток диоскореи при действии фуростаноловых гликозидов
Л. А. Волкова a, *, В. В. Урманцева a, А. Г. Клюшин a, А. Б. Бургутин a, А. М. Носов a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: la-volkova@yandex.ru
Поступила в редакцию 04.02.2019
После доработки 23.05.2019
Принята к публикации 24.05.2019
Аннотация
Показана роль фуростаноловых гликозидов (ФГ) в интенсификации основных метаболических процессов в культуре клеток диоскореи. Действия ФГ сопровождались изменениями в сложной системе внутриклеточных ферментативных реакций. Об этом свидетельствует повышение активности ферментов гликолитического пути окисления глюкозы – гексокиназы, фруктозо-1,6-дифосфат альдолазы, МДГ-комплекса – оксидоредуктазной НАД ∙ Н/НАД-малатдегидрогеназы, декарбоксилирующей НАДФ-малатдегидрогеназы (малик-энзим) а также увеличение интенсивности митохондриального дыхания, которое сопровождалось изменением активности альтернативного пути дыхания. В лаг-фазе цикла роста клеток ФГ были способны ориентировать превращение глюкозы по гликолитическому пути, о чем свидетельствует снижение активности глюкозо-6-фосфатдегидрогеназы и повышение активности гексокиназы. Использование ингибитора НАДФ ∙ Н-оксидазы дифенилиодониум хлорида показало, что ингибирование НАДФ ∙ Н-оксидазы приводило к снижению активности ключевых ферментов гликолиза и пентозофосфатного пути окисления глюкозы. Воздействию ФГ сопутствовало увеличение активности альдолазы, приводящее к повышению количества ее продукта – 3-фосфоглицеринового альдегида, что может быть объяснением наблюдаемого ранее увеличения активности альдегидутилизирующих ферментов, приводящих к снижению исходного уровня ПОЛ. Показано модулирующее действие ФГ на активность ферментов гликолитического пути окисления сахаров, которое проявлялось в повышении активности исследуемых ферментов в лаг- и экспоненциальную фазы роста клеток и отсутствие эффекта ФГ в стационарную фазу. Кратковременная экспозиция ФГ приводила к усилению интенсивности общего митохондриального дыхания в клетках диоскореи. Ингибиторный анализ показал, что в лаг-фазу преобладал цитохромный путь дыхания, а в остальные фазы цикла роста клеток его вклад был существенно ниже. На скорость цитохромного пути окисления ФГ не оказывали влияние, однако способствовали увеличению потенциальной активности альтернативной оксидазы (АО) в лаг- и экспоненциальную фазы цикла роста. Обсуждается увеличение активности АО при действии ФГ, которое может быть направлено на поддержание баланса между углеводным метаболизмом и скоростью электронного транспорта.
ВВЕДЕНИЕ
В предыдущих исследованиях нами было показано адаптивное действие фуростаноловых гликозидов (ФГ) в условиях абиотического стресса, как на культуре клеток, так и на растениях [1–4]. Результаты работ свидетельствовали, что в условиях окислительного стресса ФГ способствовали усилению комплексной защиты от стрессоров. В результате сдерживания процесса деградации при действии ФГ снижение жизнеспособности клеток в условиях стресса было существенно ниже по сравнению с исходными клетками.
В одной из работ при действии экзогенных ФГ нами было показано снижение вторичных продуктов перекисного окисления липидов ниже исходного уровня [4]. Снижение темпа липопероксидации могло зависеть от состояния внутриклеточных систем утилизации альдегидов, для этого в клетках существует особая ферментативная система. Ее основными компонентами являются альдегиддегидрогеназы, альдегидредуктазы и изоферменты глутатион-S-трансферазы [5, 6]. В результате действия ФГ мы наблюдали существенное повышение активности альдегидутилизирующих ферментов, а именно – альдегиддегидрогеназы и альдегидредуктазы. [4]. Анализируя полученные результаты, мы обратили внимание на кажущееся противоречие, которое заключалось в том, что повышению активности альдегидутилизирующих ферментов не предшествовало увеличение вторичных продуктов перекисного окисления липидов, основным из которых является малоновый диальдегид, являющейся субстратом данных ферментов. Несмотря на разное время воздействия ФГ, зафиксировать подъем уровня перекисного окисления липидов не удалось. Мы предположили, что одной из причин увеличения активности альдегидутилизирующих ферментов могла быть активация дыхательных путей, в которых образуются субстраты этих ферментов, например, 3-фосфоглицериновый альдегид. Повышение количества последнего могло приводить к увеличению активности альдегидредуктазы и альдегиддегидрогеназы, представляющие собой НАД ∙ Н/НАД – зависимое семейство ферментов и имеющие различную внутриклеточную локализацию [7].
В литературе встречаются работы, в которых рассматривались изменения в дыхательных путях растительных клеток при действии биогенных элиситоров [8]. По мнению авторов, глюкозо-6-фосфатдегидрогеназа (Г-6-ФДГ), ключевой фермент пентозофосфатного пути, является одним из основных поставщиков НАДФ ∙ Н, необходимого для работы НАДФ ∙ Н-оксидазы. Мы предположили, что изменение активности НАДФ ∙ Н-оксидазы в свою очередь может отражаться на активности Г-6-ФДГ и гексокиназы (ГК). В работе [9] нами было показано, что при экзогенном действии ФГ способствуют повышению активности НАДФ ∙ Н-оксидазы, что предполагает возможное участие ФГ в регуляции активности Г-6-ФДГ и ГК. Помимо гликолиза и пентозофосфатного пути, представлял интерес определить влияние ФГ на общую интенсивность дыхания клеток, а также активность различных путей митохондриального окисления, которые являются важными характеристиками, демонстрирующими действие ФГ на функционирование митохондрий в клетках диоскореи.
В предыдущих работах эффекты ФГ рассматривались при продолжительных экспозициях. Особый интерес представляет также изучение эффектов ФГ в первые минуты, при которых изменения, скорее всего, происходят в функционировании уже существующих физиологических систем. Эти предшествующие изменения могут определять адаптивный ответ клеток в начальный период стрессового ответа.
В связи с вышесказанным, целью нашего исследования являлось изучение активности ряда ферментов гликолитического и пентозофосфатного путей метаболизма углеводов, а также дыхательной активности митохондрий клеток диоскореи в цикле роста при малых экспозициях ФГ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проведены на суспензионной культуре клеток диоскореи (Dioscorea deltoidea Wall), штамм ИФР ДМ 0.5, депонированной во всероссийской коллекции клеточных культур ВКККР № 5 в условиях выращивания, как описано в работе Волковой с соавт. [3].
Применение ФГ и ингибиторов ферментов. Использовали фракцию ФГ, выделенную из водного экстракта лиофильно высушенной культуры клеток Dioscorea deltoidea Wall штамм ИФР ДМ-0.5, представляющую собой смесь ФГ – дельтозида и протодиосцина, в соотношении 2 : 3 с уровнем очистки 85% [2]. В экспериментах использовали ФГ при коротких экспозициях (5–7 минут) в концентрации 10–5 М как в работе на культуре клеток картофеля [1], где были применены разные концентрации ФГ. В качестве ингибитора НАДФ ∙ Н-оксидазы был использован дифенилиодониум хлорид (ДФИ, 50 мкМ, 30 мин) [9], с которым проводилась инкубация с клетками, а затем инкубация с ФГ.
Определение активности ферментов проводили после гомогенизации клеток в 0.1 М трис-НС1-буфере (рН 7.5) и последующего центрифугирования при 7000 g в течение 10 минут. В определяемой пробе в зависимости от фазы цикла роста клеток, имеющих разную плотность, количество белка составляло 25–70 мкг. Активность ферментов определяли спектрофотометрическим методом по скорости расходования или увеличения НАД ∙ Н при 340 нм согласно [10] с некоторыми модификациями. Для расчетов активности ферментов использовали коэффициент экстинкции, равный 6.22 × 106 (М см)–1 [11]. Активность выражали в нмоль/(мин мг белка).
Активность глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ, КФ 1.1.1.49) определяли по увеличению светопоглощения при восстановлении НАДФ в среде, содержащей 80 мМ трис-НС1 (рН 7.5), 5 мМ MgSO4, 2 мМ глюкозо-6-фосфат, 0.2 мМ НАДФ.
Активность гексокиназы (ГК, КФ 2.7.1.1) определяли в сопряженной реакции с глюкозо-6-фосфатдегидрогеназой по увеличению светопоглощения при восстановлении НАДФ в среде следующего состава: 50 мМ трис-НС1 (рН 7.5), 5 мМ MgSO4, 1 мМ глюкозы, 2.5 мМ АТФ, 0.7 Е активности глюкозо-6-фосфатдегидрогеназы, 0.2 мМ НАДФ.
Активность фруктозо-1,6-дифосфат альдолазы (АЛ, КФ 4.1.2.13) определяли в сопряженной реакции с глицерол-3-фосфатдегидрогеназой (КФ 1.1.1.8) по скорости образования фосфотриоз. В основу метода положено восстановление диоксиацетонфосфата глицерол-3-фосфатдегидрогеназой (КФ 1.1.1.8) с одновременным окислением НАД ∙ Н. Активность рассчитывали, используя среднюю скорость окисления НАД ∙ Н за первые 3 мин после начала реакции. Состав реакционной смеси содержал: 50 мМ трис-НС1 (рН 7.5), 5 мМ фруктозо-1,6-дифосфат, 1.05 Е глицерол-3-фосфатдегидрогеназа (КФ 1.1.1.8), 0.2 мМ НАД ∙ Н.
Активность НАД∙Н-малатдегидрогеназы (НАД ∙ Н-МДГ, КФ 1.1.1.37) определяли по скорости расходования НАД ∙ Н в среде следующего состава: 80 мМ трис-НС1 (рН 7.5), 2 мМ оксалоацетат, 5 мМ MgSO4, 0.2 мМ НАД ∙ Н. Активность рассчитывали, используя среднюю скорость окисления НАД ∙ Н за первые 3 мин после начала реакции.
Активность НАД-малатдегидрогеназы (НАД-МДГ, КФ 1.1.1.37) определяли по скорости восстановления НАД в среде следующего состава: 80 мМ трис-НС1 (рН 8), 2 мМ малат, 5 мМ MgSO4, 0.2 мМ НАД. Активность рассчитывали, используя среднюю скорость светопоглощения при 340 нм за первые 3 мин после начала реакции.
Активность декарбоксилирующей НАДФ-малатдегидрогеназы (малик-энзим, КФ 1.1.1.40) определяли по скорости восстановления НАДФ в среде следующего состава: 80 мМ трис-НС1 (рН 7.5), 5 мМ MgSO4, 5 мМ малат, 0.2 мМ НАДФ. Активность рассчитывали, используя среднюю скорость светопоглощения при 340 нм за первые 3 мин после начала реакции.
Общее количество белка определяли по методу Lowry с соавт. [12].
Определение доли различных путей дыхательного обмена в общем процессе поглощения кислорода клетками диоскореи производили амперометрическим методом с использованием pO2 электрода типа InPro6800/12/120 (“Mettler Toledo”, Швейцария). Показания фиксировались непрерывно с частотой 1 раз в 5 секунд системой на основе персонального компьютера, оборудованного программным обеспечением “Owen Process Manager v1.2” и измерителя-регулятора ТРМ-202. Показания датчика преобразовывались конвертером Меттлер Толедо “O2 4050e” в стандартный токовый сигнал 4–20 мА, что соответствовало 0–100% растворенного кислорода в измеряемой среде. За 100% была принята растворимость атмосферного кислорода в 3% растворе сахарозы (220 нмоль/мл). Дыхание исследовали в присутствии различных ингибиторов цитохромного и альтернативного путей транспорта электронов. Расчет скоростей дыхательных путей проводили в абсолютных (нмоль О2) и в относительных (% от общего дыхания, % снижения) величинах. Оптимальные концентрации ингибиторов, достаточные для полного подавления соответствующих оксидаз, были определены в предварительных опытах. Вклад цитохромного пути рассчитывали как дыхание, ингибируемое антимицином А (АА, 20 мкМ) или азидом натрия (NaN3, 500 мкМ). Потенциальную активность альтернативной оксидазы (АО) определяли по степени чувствительности дыхания клеток к салицилгидроксамовой кислоте (СГК, 16 мМ) в присутствии АА.
Статистическую обработку данных проводили по общепринятым методикам с использованием программ статистического пакета Excel (MS Office 2007). Все эксперименты проводили в трехкратной повторности. Достоверность различий оценивали по критерию Стьюдента при уровне значимости P ≤ 0.05.
РЕЗУЛЬТАТЫ
Активность глюкозо-6-фосфатдегидрогеназы
В цикле роста в двух фазах (лаг-фазе и фазе экспоненциального роста) значения уровней активности Г-6-ФДГ – ключевого фермента окислительного звена пентозофосфатного пути были близкими и достаточно высокими, существенное снижение его активности наблюдалось лишь в стационарной фазе. При действии ФГ результаты определения динамики активности фермента показало (рис. 1), что ФГ способствуют снижению активности на 19% в лаг-фазе, а в остальных фазах роста клеток заметного действия ФГ не наблюдалось.
Рис. 1.
Активность глюкозо-6-фосфатдегидрогеназы при действии фуростаноловых гликозидов (ФГ) на культуру клеток диоскореи в разные фазы цикла роста. 1 – контроль, 2 – действие ФГ. Различия между контролем и опытом в лаг-фазу (на 2 сутки) достоверны при *P ≤ 0.05. На 7 и 14 сутки (экспоненциальная фаза и фаза стационара соответственно) различия между контролем и опытом не достоверны при *P ≤ 0.05.

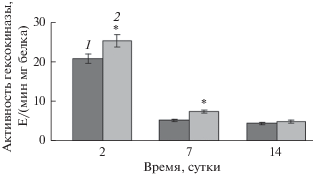
Активность гексокиназы
ГК является ключевым ферментом гликолитического пути окисления глюкозы путем образования фосфорилированных производных, которые образуются в начале обмена сахаров. В отличие от Г-6-ФДГ, ГК при действии ФГ повышала свою активность в двух фазах цикла роста клеток: в лаг-фазу – на 22% и в экспоненциальную – на 41% по сравнению с контролем. (рис. 2). Отличие от Г-6-ФДГ также состояло и в динамике изменения активности в контрольном варианте. В стадию экспоненциального роста (7 сутки) фиксировали резкое снижение активности ГК, в отличие от Г-6-ФДГ, активность которой существенно снижалась только на 14 сутки.
Рис. 2.
Активность гексокиназы при действии фуростаноловых гликозидов (ФГ) на культуру клеток диоскореи в разные фазы цикла роста. 1 – контроль; 2 – действие ФГ. Различия между контролем и опытом на 2 и 7 сутки (лаг- и экспоненциальная фазы роста соответственно) достоверны при *P ≤ 0.05, в стационарной фазе (на 14 сутки) – не достоверны.
Активность глюкозо-6-фосфатдегидрогеназы и гексокиназы при действии ФГ и ингибитора НАДФ · Н-оксидазы
В результате применения ингибитора НАДФ ∙ Н-оксидазы ДФИ в лаг-фазу (рис. 3), фиксировали снижение более чем на 20% активности Г-6-ФДГ и несколько меньше ГК. В условиях действия ДФИ ФГ не влияли на уровни активности изучаемых ферментов, они оставались как в варианте с одним ДФИ.
Рис. 3.
Активность глюкозо-6-фосфатдегидрогеназы и гексокиназы в клетках диоскореи при действии фуростаноловых гликозидов (ФГ) и ингибитора НАДФ∙Н-оксидазы дифенилиодониума хлорида (ДФИ). 1 – Глюкозо-6-фосфатдегидрогеназа; 2 – гексокиназа. Различия между контролем (без ФГ) и опытом достоверны при *P ≤ 0.05. Различия между контролем (без ДФИ) и опытом достоверны при *P ≤ 0.05. Различия между контролем (ДФИ) и опытом (ДФИ + + ФГ) недостоверны при *P ≤ 0.05. Активность ферментов измерялась в лаг-фазу (на 2 сутки).

Активность фруктозо-1,6-дифосфат альдолазы
Изучение в цикле роста активности АЛ (рис. 4), катализирующей реакцию расщепления фруктозо-1,6-дифосфат на триозы – 3-фосфоглицериновый альдегид и фосфодиоксиацетон, показало, что изменение активности фермента происходило аналогично изменению активности гексокиназы. Активность АЛ при действии ФГ также возрастала в двух фазах цикла роста (лаг-фазе и экспоненциальной) на 20 и 40% соответственно.
Рис. 4.
Активность фруктозо-1,6-дифосфатальдолазы при действии фуростаноловых гликозидов (ФГ) на культуру клеток диоскореи в разные фазы цикла роста. 1 – Контроль; 2 – действие ФГ. Различия между контролем (без ФГ) и опытом на 2 и 7 сутки (лаг- и экспоненциальная фазы роста соответственно) достоверны при *Р ≤ 0.05, в стационарной фазе (на 14 сутки) – не достоверны.

Активность ферментов малатдегидрогеназного комплекса
Результат исследования динамики активности оксидоредуктазной НАД ∙ Н-МДГ (рис. 5а), катализирующей восстановление оксалоацетата в малат, показал отсутствие достоверного изменения НАД ∙ Н-МДГ при действии ФГ в течение цикла роста.
Рис. 5.
Активность НАД ∙ Н-малатдегидрогеназы (а), НАД-малатдегидрогеназы (б) и НАДФ-малатдегидрогеназы (малик-энзима) (в) при действии фуростаноловых гликозидов (ФГ) на культуру клеток диоскореи в разные фазы цикла роста. 1 – контроль; 2 – действие ФГ. МДГ – малатдегидрогеназа. (а) – Различия между контролем (без ФГ) и опытом во всех фазах цикла роста клеток недостоверны при *Р ≤ 0.05; (б) – различия между контролем (без ФГ) и опытом на 2 и 7 сутки (лаг- и экспоненциальная фазы роста соответственно) достоверны при *Р ≤ 0.05, в стационарной фазе (на 14 сутки) – не достоверны; (в) – различия между контролем (без ФГ) и опытом на 7 сутки (лаг-фаза) достоверны при *Р ≤ 0.05, в стационарной фазе (14 сутки) – не достоверны.

Активность НАД-МДГ, катализирующая окисление малата в оксалоацетат (рис. 5б), при действии ФГ повышалась в двух фазах цикла роста, особенно в экспоненциальную фазу (на 42%).
Изучение динамики активности декарбоксилирующей НАДФ-МДГ (малик энзим), катализирующей реакции превращения малата в пируват (рис. 5в), показало, что в экспоненциальную фазу роста клеток на 7 сутки ФГ способствовали повышению активности фермента на более чем 40% по сравнению с контролем, однако, в стационарной фазе эффект ФГ не наблюдался. В лаг-фазе (2 сутки) активность НАДФ-МЭ как в контроле, так и при действии ФГ была либо низка, либо совсем не обнаруживалась.
Определение доли различных путей дыхательного обмена
При исследовании общего митохондриального дыхания (рис. 6а), когда часть клеток была пересажена в свежую питательную среду, в лаг-фазу наблюдался всплеск интенсивности дыхания, которая к фазе экспоненциального роста (7 сутки) значительно снизилась. На 14 сутки фиксировали дальнейшее снижение поглощения О2, однако оно не носило резкий характер. Результаты экспериментов по изучению влияния ФГ на общую интенсивность митохондриального дыхания показали усиление поглощения О2 по отношению к контролю в основном в двух фазах цикла роста (лаг-фазе и экспоненциальной) на 18 и 27% соответственно.
Рис. 6.
Активность митохондриального дыхания при действии фуростаноловых гликозидов (ФГ) на культуру клеток диоскореи в разные фазы роста. (а) – Общая интенсивность дыхания. 1 – контроль, 2 – действие ФГ. Различия между контролем (без ФГ) и опытом на 2 и 7 сутки (лаг- и экспоненциальная фазы соответственно) достоверны при *Р ≤ 0.05, в стационарной фазе (на 14 сутки) – не достоверны. (б) – Скорость поглощения О2 (% от контроля) в присутствии ингибиторов – антимицина А (АА) и азида натрия (NaN3). 1 – АА, 2 – ФГ + АА, 3 – NaN3, 4 – ФГ + NaN3. Различия между контролем (АА и NaN3) и опытом (при действии ФГ) во всех фазах цикла роста клеток недостоверны при *Р ≤ 0.05. (в) – Скорость поглощения О2 (% снижения) при действии СГК в присутствии АА. 1 – АА + СГК, 2 – ФГ + АА + СГК. Различия между контролем (АА + СГК) и опытом (ФГ + + АА + СГК) на 2 и 7 сутки (лаг- и экспоненциальная фазы соответственно) достоверны при *Р ≤ 0.05, в стационарной фазе (на 14 сутки) – не достоверны.

Применение ингибиторного анализа, показало, что на 2 сутки преобладал цитохромный путь дыхания (значительное ингибирование АА и NaN3), а в остальные фазы цикла роста его вклад в общее дыхание был значительно ниже. Во всех фазах цикла роста на цитохромный путь заметного действия ФГ не зафиксировано (рис. 6б).
Результаты изучения потенциальной активности АО показали ее высокую активность в экспоненциальную и стационарную фазу цикла роста клеток (рис. 6в), а в лаг-фазе ее активность была значительно ниже. ФГ способствовали увеличению активности АО в основном в двух фазах цикла роста – лаг- и экспоненциальной фазах.
ОБСУЖДЕНИЕ
На основании полученных данных, мы пришли к представлению о значимой роли ФГ в интенсификации основных метаболических процессов в клетках диоскореи. Об этом свидетельствует индукция гликолитического пути окисления глюкозы и повышение интенсивности митохондриального дыхания, которое сопровождалось изменением активности альтернативного пути дыхательной активности. Интенсификация функционирования гликолитического цикла обуславливает увеличение промежуточных метаболитов, играющих важную роль в сопряжении метаболических процессов разных компартментов клетки [13].
Как известно, первые этапы дыхания протекают в цитоплазме в пентозофосфатном и гликолитическом путях. Первый участок регуляции гликолиза находится на уровне гексокиназной реакции, осуществляющей фосфорилирование глюкозы с образованием глюкозо-6-фосфата. Наблюдаемая интенсификация активности ГК в двух фазах цикла роста клеток (лаг-фаза и экспоненциальная) при сопутствующем снижении активности Г-6-ФДГ в лаг-фазе (рис. 2) свидетельствует о способности ФГ ориентировать превращение глюкозы по гликолитическому, в отличие от пентозофосфатного пути (рис. 1). Наблюдаемые изменения активности ключевых лимитирующих ферментов пентозофосфатного и гликолитического путей окисления глюкозы в лаг-фазе, могут быть связаны с тем, что на начальных этапах роста, когда клеткам необходима энергия и метаболиты для роста и новообразования биомассы, возрастает потребность в АТФ и восстановленных форм НАД. Поскольку пентозофосфатный путь связан с гликолизом посредством глюкозо-6-фосфата, фруктозо-6-фосфата и 3-фосфоглицеринового альдегида, имеется возможность переключения с одного пути дыхания на другой.
Субстрат НАДФ ∙ Н-оксидазы – НАДФН образуется в цитозоле в основном в восстановительном пентозофосфатном цикле. Ингибирование НАДФ ∙ Н-оксидазы с помощью дифенилиодониум хлорида в свою очередь приводило к снижению исходного уровня активности Г-6-ФДГ и ГК более чем на 20 и 18% соответственно (рис. 3), что может свидетельствовать о связи НАДФ ∙ Н-оксидазы с работой ключевых ферментов гликолиза и пентозофосфатного пути окисления глюкозы – Г-6-ФДГ и ГК. Отсутствие эффекта ФГ в условиях действия дифенилиодониум хлорида подтверждает роль ФГ пускового механизма, приводящего к активации НАДФ ∙ Н-оксидазы, показанной нами в работе [9].
Фруктозо-1,6-дифосфат альдолаза – следующий фермент, активность которого мы изучали в цикле роста, катализирует реакцию расщепления фруктозо-1,6-дифосфат на триозы – 3-фосфоглицериновый альдегид и фосфодиоксиацетон, который изомеризуется в 3-фосфоглицериновый альдегид. Субстрат АЛ – фруктозо-1,6-дифосфат является регуляторной молекулой, которая активирует гликолиз. Повышение активности АЛ (рис. 4) в лаг-фазе (на 20%) и экспоненциальной фазе (на 40%) соответствует повышению количества ее продукта – 3-фосфоглицеринового альдегида, что может быть объяснением наблюдаемого ранее увеличения активности альдегидутилизирующих ферментов, в свою очередь приводящих к снижению исходного уровня ПОЛ. Следует обратить внимание на тот факт, что в конце цикла роста активность ферментов пентозофосфатного и гликолитического путей снижалась в разной степени, а именно активность Г-6-ФДГ снижалась в 2.6, а ГК и АЛ – в 1.5 раза, что может свидетельствовать о необходимости сохранения гликолитического пути дыхания.
Ферменты малатдегидрогеназного комплекса определяют интенсивность анаэробного и аэробного дыхания. МДГ-комплекс работает как в цитозоле, так и в митохондриях [14] и представлен четырьмя дегидрогеназами, две из них обладают оксидоредуктазной активностью, а две другие – декарбоксилирующей (малик-энзим) [15, 16]. Анализ динамики активности оксидоредуктазных НАД ∙ Н-МДГ (рис. 5а) и НАД-МДГ (рис. 5б) выявил эффект ФГ в реакциях НАД-МДГ, катализирующей окисление малата в оксалоацетат. При действии ФГ фермент увеличивал активность в двух фазах цикла роста клеток, особенно в экспоненциальную фазу (более 40%). Недостоверные изменения активности НАД ∙ Н-МДГ при действии ФГ могут быть связаны с достаточно большим пулом свободного НАД ∙ Н в клетке. Реакции с участием НАД ∙ Н- и НАД-МДГ обратимы, однако в цикле Кребса, как правило, реакция идет в сторону образования оксалоацетата. Митохондриальная изоформа НАД-энзима, катализируя один из участков цикла трикарбоновых кислот, участвует в поддержании энергетического баланса, поставляя восстановленную форму пиридиннуклеотида в дыхательную цепь митохондрий. Цитоплазматические формы НАД-МДГ, скорее всего, отвечают за интенсификацию метаболизма малата, в частности, усиление синтеза оксалоацетата [11, 15]
Оксалоацетат, участвующий в переносе восстановительных эквивалентов через митохондриальную мембрану с помощью малат/оксалоацетатного челнока, способствует активной регуляции соотношения окисленных и восстановленных форм НАД в митохондриальном и цитозольном компартментах [17]. Кроме того, оксалоацетат и малат участвуют в реакциях переаминирования с образованием аспарагина и аланина. Аминокислоты, образуемые в результате этих реакций, играют значительную роль в осморегуляции клеток [18]. Мы наблюдали повышение выживаемости клеток диоскореи на 30% при действии ФГ в условиях осмотического стресса (данные не представлены). Повышение осмоустойчивости клеток могло быть связано с увеличением количества оксалоацетата в результате усиления активности НАД-МДГ при действии ФГ.
Уменьшение активности оксидоредуктазной МДГ в конце цикла роста сопровождалось повышенной интенсивностью работы цитозольного НАДФ-малик-энзима (рис. 5в). Утилизация малата с помощью малик-энзимов позволяет клеткам снизить зависимость от гликолиза при синтезе энергии и углеродных скелетов в неблагоприятных условиях, например, при исчерпании питательных веществ в среде выращивания. Увеличение активности малик-энзима при действии ФГ в экспоненциальную фазу могло активировать метаболические процессы в клетках, тем самым способствуя формированию адаптационных механизмов при воздействии стрессовых факторов. Кроме того, усиление декарбоксилирования малата может предотвратить значительное закисление цитоплазмы. В стационарной фазе, когда клетки переходят в более экономный режим функционирования, эффект ФГ не фиксировали. Таким образом, проявлялось модулирующее действие ФГ на активность ферментов гликолитического пути окисления сахаров, которое свидетельствует о способности ФГ оказывать влияние на приспособление энергетической системы клетки в зависимости от изменений внешней среды.
Анализ активности митохондриального дыхания в цикле роста клеток показал высокую его интенсивность в лаг-фазу (2 сутки), вероятно, связанного со сменой условий выращивания клеток диоскореи при пересадки их на свежую питательную среду. Применение ингибиторов цитохромного пути АА и NaN3 показало, (рис. 6б) что на 2 сутки в лаг-фазе дыхание проявляло высокую чувствительность к ингибиторам цитохромного пути, что указывает на преобладание цитохромного пути дыхания, при этом уровень свободных сахаров в среде и клетках был максимально высоким (данные не представлены). Известна положительная линейная корреляция между активностью цитохромного пути и содержанием растворимых сахаров в растительных клетках [19]. В этот период (лаг-фаза, 2 сутки) в работе [9] на клетках диоскореи мы наблюдали всплеск уровня супероксида, который затем снижался в экспоненциальную фазу, что соответствовало активации цитохромного пути в лаг-фазу с последующим его снижением в остальные фазы роста, показанной в данной работе. На скорость цитохромного пути окисления ФГ влияние не оказывали.
Известно, что характерной особенностью митохондрий высших растений является способность переноса электронов с пула убихинона на О2 с образованием Н2О через альтернативную оксидазу (АО). Этот путь устойчив к действию цианида, NaN3 и СО, но ингибируется СГК. При действии АА электроннотранспортная цепь до III комплекса находится в восстановленном состоянии, а за ним – в окисленном, растет время жизни восстановленного убихинона, электронная цепь становится перевосстановленой и как следствие накапливаются АФК. Для контроля уровня АФК митохондрии содержат систему антиоксидантных ферментов и других механизмов, одним из которых является повышение активности АО [19, 20]. Альтернативный путь дыхания осуществляет, предположительно, одну из основных функций в поддержании метаболического и сигнального гомеостаза в условиях стресса [21]. В экспоненциальную фазу роста наблюдается высокая активность АО и снижение цитохромного пути, которое отразилось на уровне общего дыхания. Повышение активности АО в эту фазу, по всей видимости, направлено на сохранение метаболизма углерода в митохондриях при высоком отношении АТФ/АДФ и использовании электронов, чтобы предотвратить слишком восстановленное состояние мтЭТЦ, которое может привести к образованию АФК. Взаимосвязь ростовых процессов в цикле роста клеток диоскореи с дыхательным метаболизмом является сложной. Соотношения разных путей митохондриального дыхания в цикле роста клеток диоскореи не является общей закономерностью. Согласно данным авторов [22 ] , большие различия в дыхании свойственны культурам клеток разных видов растений.
В нашей работе на клетках диоскореи ФГ способствовали увеличению потенциальной активности АО в основном в лаг- и экспоненциальной фазах роста клеток, что отразилось на общей скорости поглощения кислорода в эти фазы (рис. 6а, в). Повышение потенциальной активности АО при действии ФГ может быть связано с интенсификацией активности ферментов МДГ-комплекса, а также других ферментов гликолиза, приводящее к увеличению восстановленности убихинона. Можно предположить, что повышение активности АО при действии ФГ направлено на поддержание баланса между углеводным метаболизмом и скоростью электронного транспорта и состоит в использовании электронов для предотвращения возможной перевосстановленности электроннотранспортной цепи митохондрий.
Таким образом, в ходе наших исследований в первые минуты действия ФГ были выявлены множественные изменения на физиолого-биохимическом уровне. Результаты настоящей работы позволяют приблизиться к пониманию того, каким образом ФГ могут принимать участие в процессе дыхания.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Волкова Л.А., Маевская С.Н., Бургутин А.Б., Носов А.М. Влияние экзогенных стероидных гликозидов на культивируемые клетки картофеля при окислительном стрессе // Физиология растений. 2007. Т. 54. С. 722.
Васильева И.С. Ванюшкин С.А., Зиновьева С.В., Удалова Ж.В., Волкова Л.А., Носов А.М., Пасешниченко В.А. Адаптогенное действие фурастаноловых гликозидов Dioscorea deltoidea Wall на окислительные процессы растений томатов в условиях биотического стресса // Прикл. биохимия и микробиология. 2005. Т. 41. С. 347.
Волкова Л.А., Урманцева В.В., Бургутин А.Б., Маевская С.Н., Носов А.М. Стимулирование защитных реакций у растений картофеля in vitro c помощью экзогенных стероидных гликозидов в условиях абиотического стресса // Физиология растений. 2011. Т. 58. С. 766.
Волкова Л.А, Урманцева В.В, Бургутин А.Б., Носов А.М. Чувствительность антиоксидантного статуса растительных клеток к действию фуростаноловых гликозидов // Физиология растений. 2016. Т. 63. С. 804.
Davydov V.V., Dobaeva N.M., Bozhkov A.I. Possible role of aldehyde’s scavenger enzymes during aging // Exp. Gerontol. 2004. V. 39. P. 11.
Hayes J.D., Flanagan J.U., Jowsey I.R. Glutathione transferases // Annu. Rev. Pharmacol. Toxicol. 2005. V. 45. P. 51.
Ли Н.Г., Осаковский B.Л. Альдегиддегидрогеназа хлоропластов листьев высших растений // Сибирский биологический журнал. 1991. Вып. 2. С. 20.
Pugin A., Frachisse J.M., Tavernier E., Bligny R., Gout E., Douce R., Guern J. Early events induced by the elicitor cryptogein in tobacco cells: Involvement of a plasma membrane NADPH oxidase and activation of glycolysis and the pentose phosphate pathway // Plant Cell. 1997. V. 9. P. 2077.
Волкова Л.А., Урманцева В.В., Бургутин А.Б., Носов А.М. Особенности элиситорного действия фуростаноловых гликозидов на культивируемые клетки диоскореи // Физиология растений. 2018. Вып. 3. Т. 65. С. 215.
Современные проблемы биохимии. Методы исследований / Под ред. Чиркина А.А. Минск: Высшая школа. 2013. 491 с.
Su P.-H., Lin C.-H. Metabolic responses of Luffa roots to long-term flooding // J. Plant Physiol. 1996. V. 148. P. 735.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with Folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265.
Yang N.S., Scandalios J.G. Purifi cation and biochemical properties of genetically defined malate dehydrogenase in maize // Arch. Biochem. Biophys. 1974. V. 161. P. 335.
Huang J., Niazi A.K., Young D., Rosado L.A., Vertommen D., Bodra N., Abdelgawwad M.R., Vignols F., Wei B., Wahni K., Bashandy T., Bariat L., Van Breusegem F., Messens J., Reichheld J.P. Self-protection of cytosolic malate dehydrogenase against oxidative stress in Arabidopsis // J. Exp. Bot. 2018. V. 69. P. 3491.
Chang G.G., Tong L. Structure and function of malic enzymes, a new class of oxidative decarboxylases // Biochemistry. 2003. V. 42. №. 44. P. 12721.
Scheibe R. Malate valves to balance cellular energy supply // Physiologia Plantarum. 2004. V.120. P. 21.
Noguchi K., Yoshida K. Interaction between photosynthesis and respiration in illuminated leaves // Mitochondrion. 2008. V. 8. P. 87.
Lokhande V.H., Suprasanna P. Prospects of halophytes in understanding and managing abiotic stress tolerance // Environmental adaptations and Stress Tolerance of Plants in the Era of Climate Change / Eds. P. Ahmad, M.N.V. Prasad. Springer Science + Business Media, LLC, 2012. P. 29.
Гармаш Е.В., Малышев Р.В., Шелякин М.А., Головко Т.К. Активность дыхательных путей и фонд неструктурных углеводов в листе зеленеющих проростков яровой пшеницы // Физиология растений. 2014. Т. 61. С. 160.
Rhoads D.M., Umbach A.L., Subbaiah C.C., Siedow J.N. Mitochondrial reactive oxygen species, contribution to oxidative stress and interorganellar signaling // Plant Physiol. 2006. V. 141. P. 357.
Vanlerberghe G.C., Cvetkovska M., Wang J. Is the maintanence of homeostatic mitochondrial signaling during stress a physiological role for alternative oxidase? // Physiol. Plant. 2009. V. 137. P. 392.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


