Физиология растений, 2020, T. 67, № 2, стр. 177-187
Влияние щелочности и кислотности корневой среды на состояние защитных систем Triticum aestivum L. и Secale cereale L.
О. А. Четина a, *, К. И. Боталова a, **, Р. В. Кайгородов a, ***
a Федеральное бюджетное образовательное учреждение высшего образования
Пермский государственный национальный исследовательский университет
Пермь, Россия
* E-mail: chetoks@gmail.com
** E-mail: chetoks@gmail.com
*** E-mail: chetoks@gmail.com
Поступила в редакцию 22.01.2019
После доработки 30.04.2019
Принята к публикации 21.05.2019
Аннотация
Исследована динамика активности пероксидаз, содержания пероксида водорода, пролина, флавоноидов и органических кислот (щавелевой, янтарной, яблочной и лимонной) в листьях пшеницы яровой и ржи озимой в начальной стадии щелочного (рН 10) и кислотного (рН 3) стрессов. Полученные результаты обсуждались на основе теории окислительного стресса и механизмов рН-стата клетки. Установлена активизация редокс-процессов, которая проявилась в усиленной динамике содержания пероксида водорода и повышенной пероксидазной активности. Мобилизация защитных систем растений отчетливо выражена в накоплении низкомолекулярных полифункциональных соединений, таких как пролин и флавоноиды. Одновременно адаптационная направленность процессов различалась по вариантам опыта; на фоне кислой среды в листьях пшеницы аккумулировался пролин, а при щелочной среде – преимущественно накапливались флавоноиды. Рожь при изменении рН корневой среды отличалась усиленной активностью пероксидаз и аккумуляцией пролина, по сравнению с пшеницей. Прослежена относительно устойчивая в течение суток тенденция к уменьшению суммы яблочной, лимонной и янтарной кислот; в листьях ржи она выражена в условиях кислой и щелочной среды, а в пшенице – на фоне кислой среды. Наблюдаемое изменение в содержании кислот – участников цикла Кребса рассматривается как проявление механизма рН-стата.
ВВЕДЕНИЕ
Актуальность проблемы устойчивости растений к разной реакции почвенной среды связана не только с существованием кислых и щелочных почв, малопригодных для возделывания сельскохозяйственных растений. Изменение реакции почвы – это распространенное последствие агрогенной и техногенной деятельности человека. В связи с этим, щелочной и кислотный стресс растений остаются в центре внимания современных исследований. У проростков пшеницы, выращиваемых на кислых (рН 4.0) и щелочных (рН 8.5) питательных растворах, прослежена генерация избытка активных форм кислорода (АФК) и усиление перекисного окисления липидов [1]. Щелочное воздействие служит дополнительным неблагоприятным фактором при засолении почв Na2CO3, NaHCO3; отмечают, что щелочной стресс у растений проявляется сильнее солевого стресса [2, 3]. При щелочной реакции корневой среды у растений нарушалась проницаемость мембран, равновесие между поглощенными Na+ и К+; одновременно отмечено накопление осмолитов, усиление активности антиоксидантной системы растений [4–6]. Перекисное окисление липидов в корнях огурца усиливалось при низком рН корневой среды [7]. В обзорной работе по устойчивости растений к кислым почвам [8] отмечено, что токсичность преимущественно связывают с избытком подвижного алюминия. В кислых почвах эффект токсичности алюминия и протонов разделить практически невозможно, поэтому отдельный кислотный стресс остается не в полной мере оцененным. По мнению ряда исследователей [1, 8], в кислых (или щелочных) условиях корневой среды эффективность процессов поддержки рН цитоплазмы может уменьшиться.
Сейчас все более очевидно, что в основе адаптации и кросс-адаптации растений к неблагоприятным условиям находится эффективное функционирование антиоксидантной защитной системы. Активизация системы антиоксидантной защиты выражена в мобилизации ферментов и низкомолекулярных антиоксидантов, роль которых заключается в «гашении» избытка АФК и прерывании процессов свободно радикального окисления. Общие закономерности ответных реакций проявляются также в стресс-индуцированном накоплении низкомолекулярных протекторных соединений (пролина, фенольных соединений, органических кислот, растворимых сахаров, каротиноидов и др.) [9–11].
Исходя из современных представлений, для растительной клетки характерна многокомпонентная система регулирования цитоплазматического рН, в основе которой находятся биофизические и биохимические процессы. Величина стационарного значения рН цитозоля определяется рН-чувствительными процессами карбоксилирования и декарбоксилирования органических кислот, в ходе которых продуцируется или потребляется протон. Увеличение пула некоторых органических кислот у пшеницы и подсолнечника рассматривают в качестве адаптивной реакции к щелочности корневой среды [4, 12]. По мнению ряда исследователей, в условиях стресса определенный вклад в поддержание метаболизма растений [13] и лишайников [14] вносит переход на альтернативный путь дыхания. В энергетически затратных рН-регулирующих реакциях альтернативного гликолиза рН-чувствительные энзимы переключают системы с продуцирования протонов на потребление Н+ [15, 16].
Цель данной работы – проследить влияние щелочной и кислой реакции корневой среды на состояние защитных систем в листьях пшеницы яровой (Triticum aestivum L.) и ржи озимой (Secale cereale L.). В задачи исследований входило изучение динамики содержания пероксида водорода, пероксидазной активности, содержания пролина, флавоноидов и некоторых органических кислот в листьях пшеницы яровой и ржи озимой при подкислении (рН 3) и подщелачивании (рН 10) корневой среды.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали пшеницу мягкую яровую (Triticum aestivum) сорта Горноуральский и рожь посевную (Secale cereale) сорта Фаленская 4.
Предварительно замоченные семена злаков высадили в умеренно увлажненный вермикулит (влажность 50%) в контейнеры размером 16 × 12 × 7 см. Растения в течение 5 дней выращивали при температуре 25°С и длине светового дня – 18 часов. На шестой день на корневую среду растений воздействовали стресс-фактором – кислым или щелочным раствором, контрольный вариант поливали дистиллированной водой. Кислую среду раствора (рН 3) создавали уксусной кислотой, щелочной раствор (pH 10) – глицин NaOH буфером. Внесенные растворы отличались по активности Н+. Из эксперимента исключили питательные растворы, т.к. при изменении реакции среды в них может произойти осаждение солей, и, следовательно, условия в опытных вариантах станут не выравненными. Вермикулит устойчив к кислотным и щелочным воздействиям, поэтому в течение 24 ч наблюдений не будет служить заметным источником минеральных веществ. В составе щелочного буфера присутствует Na+, но при заданной концентрации его токсическим и осмотическим влиянием решили пренебречь. Органические компоненты применяемых растворов представлена веществами, которые продуцируются растениями. Реакцию среды в вермикулите контролировали путем измерения на иономере в течение двух суток; через 24 ч она оставалась устойчивой, через 48 ч кислотность и щелочность среды изменилась на 0.5 рН. Отбор растительных проб провели через 0.5, 1, 2, 3, 4 и 24 ч после изменения рН.
Для определения содержания пероксида водорода и пероксидазной активности в зеленой массе растений были проведены паралельно две серии экспериментов. Биологические пробы отбирали равномерно по всей площади контейнера. Пробу составляли из 12 растений, измельчали вручную, затем из нее брали навеску.
Для определения пролина, флавоноидов и органических кислот в сухом материале была проведена отдельная серия экспериментов в 36 контейнерах. После воздействия кислых и щелочных растворов в каждый срок учета (0.5, 1, 2, 3, 4 и 24 ч) проводили сбор всей растительной массы контейнера, фиксировали при температуре 105°С и досушивали при 60°С. Из сухой массы отбирали от 5 до 20 растений (в зависимости от метода), растирали и брали навеску.
Содержание пероксида определили ферротиоцианатным методом [17] на фотоэлектроколориметре (“КФК-3”, Россия). Активность пероксидаз изучили по методу А.Н. Бояркина, который основан на определении скорости окисления бензидина до образования синего продукта окисления определенной концентрации, заранее устанавливаемой на фотоэлектроколориметре. Определенную концентрацию синего продукта окисления бензидина создавали путем добавления в растительный экстракт пероксида водорода. Результаты расчетов (условные единицы) показывают изменение оптической плотности раствора за 1 с на 1 г сырой массы.
Количество пролина определяли по методу Bates с соавт. [18] на спектрофотометре (“СФ‑2000”, Россия).
Флавоноиды извлекали 70% раствором этанола; суммарное их содержание установили методом спектрофотометрии продуктов взаимодействия с 5% спиртовым раствором AlCl3 при длине волны 415 нм. Водный экстракт органических кислот исследовали методом обращенно-фазовой высокоэффективной жидкостной хроматографии с ультрафиолетовой детекцией на хроматографе (Dionex, Ultimate 3000, “Thermo Scientific”, США). Тип колонки: “Polar Advantage II C18” 2.1 × 150 мм, 3 мкм, 120 Ǻ. Подвижная фаза: элюент А – фосфатный буфер рН 2.5, 20 мМ, элюент Б – ацетонирил ОСЧ сорт 0, скорость потока 0.19 мл/мин, режим элюирования градиентный: 0 – 3.0 мин элюент Б 5%; 3.0 – 3.5 мин элюент Б до 10%; 3.5 – 6.5 мин элюент Б 10%; 6.5 – 7.5 мин элюент Б до 25%; 7.5 – 10 мин элюент Б 25%; 10 – 12 мин элюент Б до 5%. Объем ввода пробы 20 мкл. Детекция при длине волны 263 нм.
Отдельная серия опытов проведена для оценки влияния стресса на высоту и массу растений, которые замеряли по вариантам опыта в 30-кратной повторности через 24 и 48 ч после изменения рН корневой среды; значимость различий между вариантами оценили с помощью критерия Стьюдента (P < 0.05).
Скорость роста растений (см/24 ч) в первые (∆h1) и во вторые (∆h2) сутки рассчитывали по формулам:
где h0– масса растений перед изменением реакции корневой среды, h24 – масса растений через 24 ч, h48 – масса растений через 48 ч.
Скорость прироста массы растений (мг/24 ч) в первые (∆m1) и во вторые (∆m2) сутки рассчитывали по формулам:
где m0– масса растений перед изменением реакции корневой среды, m24– масса растений через 24 ч, m48– масса растений через 48 ч.
Скорость роста (см/24 ч) и скорость прироста массы (мг/24 ч) демонстрируют изменение показателей состояния растений за каждые сутки наблюдений. Ускорение роста (см/24 ч) и ускорение прироста массы (мг/24 ч) рассчитывали, соответственно, по формулам:
Ускорение роста (прироста массы) во вторые сутки по сравнению с первыми сутками демонстрировало возможность (или неспособность) растений адаптироваться к изменению рН корневой среды.
Биологическая и аналитическая повторности определения показателей – трехкратные. Сравнение выборок проводили дисперсионным методом (ANOVA); значимыми считали различия между сравниваемыми средними величинами с доверительной вероятностью 95% и выше (Р < 0.05). На рисунках приведены средние арифметические значения трех биологических повторностей и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Выбор объектов связан с культивированием растений в разных почвенно-климатических условиях. Пшеницу возделывают в семиаридном климате на нейтральных (черноземы) и щелочных (каштановые, солонцоватые) почвах. Рожь выращивают в условиях влажного умеренного климата в зоне распространения кислых почв (дерново-подзолистые, серые).
Влияние рН на высоту и массу растений пшеницы
Через 24 ч в обоих вариантах изменения рН высота пшеницы была ниже на 3% относительно контроля (табл. 1). Через 48 ч между растениями в вариантах со щелочной средой и контролем не было значимых различий, но при кислой среде растения были на 8% ниже. Масса растений в условиях щелочной среды через 24 ч не отличалась от контрольных растений, однако через 48 ч она превысила контрольный показатель на 10%. При кислой корневой среде через 24 ч масса растений была ниже на 5%, а через 48 ч в этом варианте не было значимых различий с контролем.
Таблица 1.
Изменение высоты (см) и массы (мг) растений пшеницы после воздействия щелочным (рН 10) и кислым (рН 3) растворами
| Вариант | $\frac{{{\text{Высота}}\,\,(h)}}{{{\text{скорость}}\,\,{\text{роста}}\,\,(\Delta h)}}$ | Ускорение роста, см/24 ч | $\frac{{{\text{Масса}}\,\,(m)}}{{{\text{скорость}}\,\,{\text{прироста }}(\Delta m)}}$ | Ускорение прироста массы, мг/24 ч | ||
|---|---|---|---|---|---|---|
| $\frac{{{{h}_{{24}}}}}{{\Delta {{h}_{{24}}}}}$ | $\frac{{{{h}_{{48}}}}}{{\Delta {{h}_{{48}}}}}$ | $\frac{{{{m}_{{24}}}}}{{\Delta {{m}_{{24}}}}}$ | $\frac{{{{m}_{{48}}}}}{{\Delta {{m}_{{48}}}}}$ | |||
| Контроль | $\frac{{13.4}}{{0.6}}$ | $\frac{{16.4}}{{3.0}}$ | 2.42 | $\frac{{58}}{{3.0}}$ | $\frac{{61}}{{3.0}}$ | 0 |
| рН 10 | $\frac{{13.0{\text{*}}}}{{0.2}}$ | $\frac{{16.1}}{{3.1}}$ | 2.99 | $\frac{{57}}{{2.0}}$ | $\frac{{67{\text{*}}}}{{10.0}}$ | 8.0 |
| рН 3 | $\frac{{13.0{\text{*}}}}{{0.2}}$ | $\frac{{15.7{\text{*}}}}{{2.7}}$ | 2.50 | $\frac{{55{\text{*}}}}{0}$ | $\frac{{60}}{{5.0}}$ | 5.0 |
Примечание. h24– высота растений через 24 ч (см), h48– высота растений через 48 ч (см); ∆h24– cкорость роста в первые сутки (см/24 ч), ∆h48– cкорость роста во вторые сутки (см/48 ч); m24– масса растений через 24 ч (мг), m48– масса растений через 48 ч (мг); ∆m1– скорость прироста массы в первые сутки (мг/24 ч), ∆m2 – скорость прироста массы во вторые сутки (мг/48 ч). * − Значимые различия показателей, выявленные с помощью критерия Стьюдента, при уровне P < 0.05.
У растений пшеницы во всех вариантах опыта в первые сутки наблюдений отмечена низкая скорость роста, в течение вторых суток она возросла в несколько раз (табл. 1). После внесения в корневую среду кислого и щелочного растворов в течение 24 ч скорость роста пшеницы снизилась в 3 раза по сравнению с контрольными растениями; во вторые сутки скорость роста восстановилась, но в условиях кислой корневой среды оставалась несколько ниже, чем в контроле.
Под воздействием щелочного раствора через 24 ч скорость прироста массы снизилась на 33% относительно контрольной величины, а под влиянием кислого раствора рост пшеницы практически прекратился. В течение вторых суток в условиях щелочной корневой среды скорость прироста массы растений превысила скорость увеличения массы в варианте контроля более чем в 3 раза. В отличие от контрольных растений, у которых не наблюдали ускорения прироста массы во вторые сутки по сравнению с первыми, при щелочной среде отмечено значительное ускорение прироста массы. По-видимому, при незначительном изменении высоты увеличение массы растений в этом варианте происходило за счет накопления воды в листьях. При кислой корневой среде скорость и ускорение прироста массы во вторые сутки наблюдений также превысили контрольные значения.
Влияние рН на высоту и массу растений ржи
Через 24 ч после внесения в корневую среду щелочного раствора высота растений была ниже на 5%, через 48 ч – на 8% по сравнению с контролем (табл. 2). При кислой корневой среде через 24 ч растения по высоте не отличались от контрольных растений, но через 48 ч были ниже на 8%. Масса растений ржи через 24 ч в вариантах со щелочной и кислой средой не имела статистически значимых различий с контролем; но через 48 ч масса растений была ниже на 14–15%.
Таблица 2.
Изменение высоты (см) и массы (мг) растений ржи после воздействия щелочным (рН 10) и кислым (рН 3) растворами
| Вариант | $\frac{{{\text{Высота}}\,\,(h)}}{{{\text{скорость}}\,\,{\text{роста}}\,\,(\Delta h)}}$ | Ускорение роста, см/24 ч | $\frac{{{\text{Масса}}\,\,(m)}}{{{\text{скорость}}\,\,{\text{прироста }}(\Delta m)}}$ | Ускорение прироста массы, мг/24 ч | ||
|---|---|---|---|---|---|---|
| $\frac{{{{h}_{{24}}}}}{{\Delta {{h}_{{24}}}}}$ | $\frac{{{{h}_{{48}}}}}{{\Delta {{h}_{{48}}}}}$ | $\frac{{{{m}_{{24}}}}}{{\Delta {{m}_{{24}}}}}$ | $\frac{{{{m}_{{48}}}}}{{\Delta {{m}_{{48}}}}}$ | |||
| Контроль | $\frac{{12.9}}{{0.7}}$ | $\frac{{14.0}}{{1.1}}$ | 0.36 | $\frac{{53}}{{2.0}}$ | $\frac{{59}}{{6.0}}$ | 4.0 |
| рН 10 | $\frac{{12.2{\text{*}}}}{0}$ | $\frac{{{\text{12}}{\text{.9*}}}}{{0.7}}$ | 0.66 | $\frac{{48}}{{ - 3.0}}$ | $\frac{{{\text{50*}}}}{{2.0}}$ | 5.0 |
| рН 3 | $\frac{{12.8}}{{0.6}}$ | $\frac{{{\text{12}}{\text{.8*}}}}{0}$ | –0.58 | $\frac{{58}}{{7.0}}$ | $\frac{{{\text{51*}}}}{{ - 7.0}}$ | –14.0 |
Примечание. h24– высота растений через 24 ч (см), h48– высота растений через 48 ч (см); ∆h24– cкорость роста в первые сутки (см/24 ч), ∆h48– cкорость роста во вторые сутки (см/48 ч); m24– масса растений через 24 ч (мг), m48– масса растений через 48 ч (мг); ∆m1– скорость прироста массы в первые сутки (мг/24 ч), ∆m2 – скорость прироста массы во вторые сутки (мг/48 ч). * − Значимые различия показателей, выявленные с помощью критерия Стьюдента, при уровне P < 0.05.
При внесении щелочи в корневую среду в первые сутки рост растений прекратился, во вторые сутки скорость роста была ниже, чем у контроля. Ускорение роста во вторые сутки в этом варианте было выше, чем у контрольных растений, что свидетельствует о развитии адаптационных процессов (табл. 2). Под влиянием кислого раствора скорость роста растений замедлилась в первые сутки, в течение вторых суток она упала до нуля, а ускорение роста достигло отрицательной величины.
В течение первых суток после внесения щелочного раствора в корневую среду скорость прироста массы растений ржи была отрицательной величиной (табл. 2). Во вторые сутки, несмотря на некоторое увеличение массы, скорость прироста была все же меньше в 3 раза, чем у контроля. Ускорение прироста массы в варианте со щелочной средой во вторые сутки несколько превысило контрольную величину. В результате воздействия кислым раствором через 24 ч растения имели положительную скорость прироста массы, но через 48 ч она становилась отрицательной величиной. Соответственно, и ускорение прироста массы растений во вторые сутки было отрицательным, по сравнению с первыми сутками.
Динамика содержания пероксида водорода при изменении рН корневой среды
В контрольном варианте опыта количество перокcида водорода в листьях пшеницы было относительно постоянным (рис. 1а). В условиях щелочного стресса содержание пероксида в растениях существенно колебалось. В первые часы наблюдений, как правило, его количество было заметно выше, чем в контрольных растениях; но через 24 ч различия становились статистически незначимыми. Еще в большей степени изменения в содержании Н2О2 происходили в условиях кислой корневой среды; его содержание в первые 2 часа было повышенным, а затем снизилось относительно контрольных значений. Разница в содержании Н2О2 в листьях особенно заметной была через 1–4 ч после добавления кислых и щелочных растворов в корневую среду.
Рис. 1.
Динамика содержания пероксида водорода в листьях пшеницы (а), ржи (б). 1 – контроль, 2 – рН 10, 3 – рН 3.
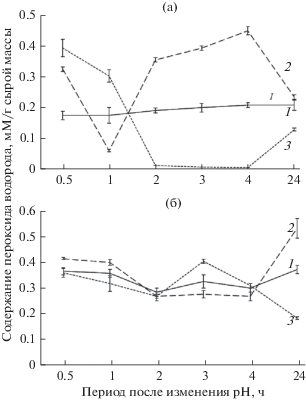
У ржи в контрольном варианте колебания в содержании пероксида водорода были значительнее, чем у пшеницы (рис. 1а). На фоне воздействия щелочным раствором количество Н2О2 в первые часы не отличалось относительно растений в контрольном варианте и существенно повысилось только через 24 ч. При кислом стрессе увеличение содержания Н2О2 отмечено через 3 ч, но в последующем его количество снизилось и через 24 ч было в 2 раза ниже контрольного уровня.
В первые часы наблюдений в листьях ржи в условиях низкой и высокой рН корневой среды не прослеживаются существенные отличия в содержании Н2О2. Но затем через 3 ч содержание пероксида водорода в условиях кислой среды стало выше контрольного уровня, а при щелочной, напротив, – ниже. Наибольшие различия между вариантами с разной реакцией наблюдались через 24 ч: в условиях кислой среды Н2О2 было существенно меньше, чем в растениях контрольного варианта, а при щелочной среде – больше. Вероятно, в листьях ржи в отличие от пшеницы повышенная активность редокс-процессов сохранилась через сутки после изменения реакции корневой среды, что отражено в существенном отклонении содержания АФК от контрольных значений.
Динамика пероксидазной активности при изменении рН корневой среды
За период наблюдений пероксидазная активность в листьях пшеницы в контрольном варианте опыта относительно мало изменялась (рис. 2а). В результате щелочного стресса активность ферментов значимо повышалась в первые 4 часа наблюдений, но через сутки она снизилась, приближаясь к пероксидазной активности в контрольных растениях. Тенденция к повышению активности ферментов в растениях первоначально прослежена и при кислом стрессе, но затем различия с растениями на контрольном варианте стали не значимыми (4 и 24 ч). Таким образом, в листьях пшеницы через сутки после изменения рН корневой среды оба показателя редокс-активности (пероксид водорода и пероксидазная активность) не отличались от этих показателей в контрольных растениях.
Рис. 2.
Динамика пероксидазной активности в листьях пшеницы (а), ржи (б). 1 – контроль, 2 – рН 10, 3 – рН 3.
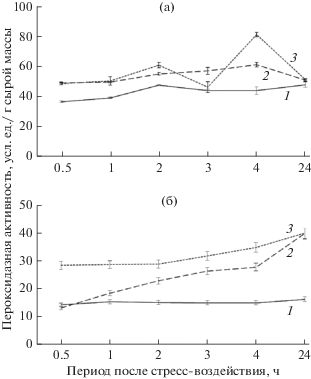
В листьях ржи в контрольном варианте активность пероксидаз была заметно ниже, чем у пшеницы. После внесения кислого и щелочного растворов в корневую среду прослежена общая тенденция к повышению активности ферментов (рис. 2б). В условиях щелочной корневой среды в первые часы (0.5 и 1 ч) существенных различий с контрольным вариантом не выявлено, но позднее активность пероксидаз резко возросла. При кислом стрессе во все сроки наблюдений в растениях была наибольшая пероксидазная активность. В отличие от пшеницы, у ржи через сутки в обоих вариантах изменения рН активность ферментов была одинаково высокой, в 2 раза превышая контрольный уровень.
Динамика содержания пролина при изменении рН корневой среды
В листьях пшеницы в контрольном варианте опыта количество пролина было относительно постоянным, при внесении щелочи в корневую среду его содержание существенно снижалось (рис. 3а). В условиях кислой среды, напротив, происходила аккумуляция пролина в листьях растений. Эти различия в содержании пролина в листьях пшеницы при щелочном и кислотном стрессе сохранились и через сутки.
Рис. 3.
Динамика содержания пролина в листьях пшеницы (а), ржи (б). 1 – контроль, 2 – рН 10, 3 – рН 3.
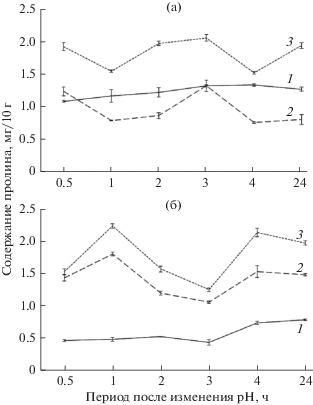
В контрольном варианте опыта рожь характеризовалась пониженным содержанием пролина по сравнению с пшеницей (рис. 3б). Под воздействием щелочного и кислого растворов наблюдалось накопление пролина в листьях во все сроки наблюдений. Повышенная аккумуляция пролина в условиях стресса сохранялась и через сутки и была более выражена в условиях кислой корневой среды.
Динамика содержания флавоноидов при изменении рН корневой среды
При изменении рН корневой среды в листьях пшеницы наблюдали накопление флавоноидов. При щелочном стрессе это повышение содержания было значимым во все сроки наблюдений. При кислом стрессе существенное накопление флавоноидов отмечено только в течение первого часа (0.5 и 1 ч). Таким образом, если в листьях пшеницы содержание пролина было выше в условиях кислой среды, то флавоноиды, как правило, аккумулировались при щелочной среде (рис. 4а). По ответной реакции пшеницы можно предполагать о разных адаптивных реакциях растений при кислом и щелочном стрессах.
Рис. 4.
Динамика содержания флавоноидов в листьях пшеницы (а), ржи (б). 1 – контроль, 2 – рН 10, 3 – рН 3.

В листьях ржи накопление флавоноидов отмечено сразу после внесения в корневую среду кислого и щелочного растворов (рис. 4б), но позднее их содержание снижалось и через 24 ч уже не отличалось от содержания в растениях в контрольном варианте.
Влияние рН на содержание органических кислот в листьях пшеницы
В листьях пшеницы отмечено наименьшее содержание щавелевой кислоты, незначительно повышенное количество лимонной и янтарной кислот и наибольшая аккумуляция яблочной кислоты (табл. 3). Изменение рН корневой среды не оказало существенного воздействия на количество щавелевой кислоты в пшенице. Содержание остальных кислот изменилось неоднозначно. В условиях щелочной среды отмечено существенное накопление лимонной кислоты (3 и 24 ч); прослежена тенденция к снижению содержания яблочной (24 ч) и янтарной кислот (0.5 и 24 ч). В условиях кислой среды содержание органических кислот в листьях только уменьшалось; у лимонной кислоты эти изменения были значимыми во все сроки наблюдений, у яблочной кислоты – через 0.5 и 24 ч, а у янтарной – 0.5 и 3 ч после изменения рН корневой среды.
Таблица 3.
Содержание органических кислот в листьях пшеницы, мг/1 г сухой массы
| Период после изменения рН, ч |
Щавелевая кислота | Яблочная кислота | Лимонная кислота | Янтарная кислота | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| контроль | рН 10 | рН 3 | контроль | рН 10 | рН 3 | контроль | рН 10 | рН 3 | контроль | рН 10 | рН 3 | |
| 0.5 | 8.9 | 9.9 | 9.0 | 271.3 | 250.3 | 239.7* | 86.7 | 86.0 | 52.9* | 64.8 | 35.7* | 36.9* |
| 3 | 9.1 | 8.8 | 9.0 | 259.9 | 281.9 | 265.4 | 44.2 | 84.7* | 21.3* | 35.1 | 24.6 | 18.4* |
| 24 | 10.2 | 8.2 | 8.9 | 292.1 | 258.8* | 258.6* | 32.9 | 75.5* | 14.9* | 47.1 | 30.9* | 46.7 |
Суммарное содержание исследуемых кислот в листьях пшеницы изменялось в условиях разного уровня рН корневой среды. Через 0.5 ч после внесения щелочного раствора общее количество органических кислот было понижено на 11% относительно их содержания в растениях в контрольном варианте (рис. 5). Через 3 часа суммарное количество кислот было повышено на 15%, но через сутки оно снизилось до уровня контрольных значений. В условиях кислой корневой среды во все сроки наблюдений общее содержание органических кислот было понижено на 10–22%.
Влияние рН на содержание органических кислот в листьях ржи
По сравнению с пшеницей, в листьях ржи содержалось незначительно меньше яблочной кислоты, одновременно повышена концентрация остальных кислот (табл. 4). В условиях щелочного стресса произошло существенное снижение содержания лимонной (0.5 и 24 ч) и янтарной кислот (0.5 и 3 ч). В условиях кислого стресса у ржи за весь период наблюдений прослежено снижение количества щавелевой кислоты. Содержание лимонной кислоты на этом варианте уменьшилось через 0.5 ч после изменения рН; в последующие сроки эта тенденция сохранилась, однако различия с контролем были незначимыми при данном объеме выборки. В содержании яблочной кислоты в листьях ржи при кислой корневой среде существенных изменений не установлено. Некоторая тенденция к снижению количества янтарной кислоты оказалась статистически незначимой при данном объеме выборки.
Таблица 4.
Содержание органических кислот в листьях ржи, мг/1 г сухой массы
| Период после изменения рН, ч |
Щавелевая кислота | Яблочная кислота | Лимонная кислота | Янтарная кислота | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| контроль | рН 10 | рН 3 | контроль | рН 10 | рН 3 | контроль | рН 10 | рН 3 | контроль | рН 10 | рН 3 | |
| 0.5 | 12.4 | 9.3 | 5.9* | 183.0 | 217.7 | 222.8 | 111.2 | 58.2* | 64.3* | 97.7 | 29.3* | 64.1 |
| 3 | 14.6 | 11.0 | 11.0* | 211.3 | 188.6 | 216.7 | 154.2 | 127.0 | 136.4 | 112.2 | 80.0 * | 99.1 |
| 24 | 11.2 | 9.3 | 7.4* | 240.1 | 201.1 | 220.2 | 97.1 | 35.3* | 81.0 | 74.0 | 50.8 | 66.6 |
Суммарное количество четырех органических кислот в листьях ржи при изменении рН корневой среды только уменьшалось (рис. 6). В условиях щелочного стресса снижение их суммы составило в разные сроки наблюдений от 17 до 30%. При кислом стрессе уменьшение общего количества органических кислот было существенным лишь в первый срок наблюдений; позднее отличия от суммы кислот в растениях в контрольном варианте оказались статистически незначимыми при данном объеме выборки.
ОБСУЖДЕНИЕ
В динамике изменения высоты и массы растений в течение двух суток после внесения кислого и щелочного растворов отмечены торможение роста и колебания массы растений. При незначительном приросте пшеницы увеличение массы происходило, по-видимому, за счет накопления воды в листьях, этому могло способствовать отмеченная аккумуляция низкомолекулярных осмолитов (пролин, флавоноиды, лимонная кислота). Масса растений ржи в условиях кислой корневой среды за 24 ч также заметно возросла, но в течение следующих суток понизилась, вероятно, из-за потери части воды. Потеря воды растениями в условиях сильнокислой корневой среды, возможно, обусловлена нарушением функций корневой системы; в экспериментах с разными растениями при кислотном стрессе наблюдали уменьшение массы и длины корней, нарушения структуры и функций корневых клеток [8, 19].
При кислотном стрессе у обоих злаков скорость роста и скорость прироста массы были ниже, по сравнению со щелочным стрессом. Адаптация пшеницы в обоих вариантах изменения рН корневой среды происходила быстрее, чем у ржи, что подтверждено ускорением роста и ускорением прироста массы во вторые сутки наблюдений.
При смене реакции корневой среды нами отмечена значительная изменчивость в содержании пероксида водорода в листьях злаках. Увеличение концентрации Н2О2 сменялось снижением относительно контрольных величин, что особенно характерно для пшеницы в условиях кислой корневой среды (рис. 1). Эти колебания концентрации Н2О2 с отклонениями в обе стороны от контрольного уровня выполняют, по-видимому, сигнальное значение, т.к. с количеством АФК функционально связана активность антиоксидантов, а повышение концентрации АФК, как правило, кратковременное и локальное [5, 10, 11].
В исследуемых растениях, находящихся в состоянии щелочного и кислотного стрессов, прослежено усиление пероксидазной активности, направленное, по-видимому, на устранение избытка АФК. Имеются сведения о том, что подкисление почвы способствовало активизации антиоксидантной защиты в корнях сои [20]. Под воздействием кислой реакции в корнях лотоса усилилась активность пероксидаз [21]. Стресс, вызванный воздействием щелочных солей в течение 25 дней, сопровождался усилением активности ферментов антиоксидантной защиты – каталазы, супероксиддисмутазы, пероксидаз в листьях кукурузы [6].
В отдельных вариантах нашего эксперимента активность ферментов повышалась уже через 0.5 ч после изменения рН (рис. 2), возможно, настолько быстрая реакция связана с наличием запасного пула ферментов в мембранах и клеточных стенках. При воздействии стрессовых факторов пероксидазы клеточной стенки легко отделяются и участвуют в редокс-регуляции [22]. В некоторые временные интервалы нами отмечено одновременное накопление Н2О2 и повышение активности пероксидаз. По-видимому, динамика содержания Н2О2 и активности ферментов отразила общее усиление процессов редокс-регуляции в связи с поступлением в надземные органы растворов, несбалансированных по содержанию Н+ и ОН–. По мнению Ф.В. Минибаевой и Л.Х. Гордон [22] мобильные формы пероксидаз через синтез супероксида и пероксида водорода инициируют ответную реакцию растений на воздействие неблагоприятного фактора среды.
В изменениях пероксидазной активности у злаков проявились некоторые различия. Через сутки после стресса у пшеницы этот показатель редокс-активности приблизился к контрольным значениям, в то время как в листьях ржи активность ферментов оставалась высокой. Bhuyan с соавт. [1] проследили повышенную активность ферментов антиоксидантной защиты в пшенице на третьи сутки после изменения рН корневой среды. Возможно, наблюдаемые нами колебания количества Н2О2 и активности пероксидаз отразили каскадный характер развития окислительно-восстановительных процессов в растениях, который проявляется не только в начальной стадии стресса, но и во все время действия неблагоприятной реакции корневой среды.
Пролин может участвовать в регуляции рН цитоплазмы [23]. Наши данные по накоплению пролина в листьях злаков, вызванные изменением рН корневой среды, соответствуют сведениям об его участии в адаптации культурных растений к кислотным и щелочным воздействиям. Отмечали накопление пролина в листьях проростков пшеницы, выращиваемых в течение 15 дней в условиях щелочной корневой среды [5]. В листьях подсолнечника пролин концентрировался, как при солевом, так и при щелочном стрессе [4]. Повышение содержания пролина в растениях риса прослежено при щелочном стрессе [3]. Имитация кислотного дождя способствовала накоплению пролина в листьях томатов [24]. По Bhuyan с соавт. [1] аккумуляция пролина в проростках пшеницы при кислотном и щелочном стрессах могла обеспечить защиту от окислительного повреждения и поддержать водный баланс растений.
В нашем эксперименте отличительной особенностью щелочного стресса у пшеницы было отсутствие концентрации пролина в листьях в течение суток, возможно, его многофункциональные способности будут использованы на последующих стадиях адаптации пшеницы. Напротив, существенное накопление пролина в пшенице на ранних стадиях кислотного стресса, по-видимому, имеет протекторное значение.
В листьях ржи увеличение количества пролина отмечено при обоих видах стресса, при этом его содержание возрастало в несколько раз относительно контроля. Аккумуляция пролина при негативных воздействиях может индуцироваться как за счет активного синтеза, так и в результате восстановления из окисленной формы [1, 25].
В неблагоприятных условиях флавоноиды в растениях выполняют определенную защитную роль; благодаря химической природе они способны вступать в реакции перекисного окисления [26, 27]. По нашим данным, у пшеницы в условиях щелочной корневой среды аккумуляция этих соединений была отмечена во все сроки наблюдений. Но при кислой среде, когда в листьях накапливался многофункциональный протектор – пролин, существенное увеличение количества флавоноидов наблюдали лишь в отдельные сроки. Ответная реакция ржи в первый час после изменения рН корневой среды проявилась в двукратном увеличении содержания флавоноидов в листьях, но в последующем, по-видимому, их значение в адаптационном процессе уменьшалось.
В результате изменения реакции корневой среды в растениях предположительно должны активизироваться механизмы биохимического рН-стата, в которых определенную роль играют превращения органических кислот, сопровождающиеся выделением или поглощением протонов. По нашим наблюдениям, в листьях ржи при кислотном стрессе содержание щавелевой кислоты снизилось. Изменения в концентрации щавелевой кислоты, как и других органических кислот, могут быть связаны с рН-чувствительными реакциями карбоксилирования-декарбоксилирования [13, 16].
Прослеженная нами тенденция к уменьшению суммарного содержания органических кислот в листьях злаков при стрессе в отдельные временные интервалы может быть следствием нарушения окислительного дыхания. В экспериментальных работах отмечали подавление гликолиза при щелочном и солевом стрессах растений [5, 28]. Яблочная, лимонная и янтарная кислоты являются участницами цикла Кребса, и изменение их содержания, по-видимому, обусловлено перестройкой гликолиза. Уникальность альтернативного пути дыхания у растений заключается именно с его участием в рН-стате [13, 15]. Наблюдаемое нами уменьшение общей суммы карбоновых кислот в листьях пшеницы в течение суток при кислотном стрессе может быть вызвано перестройкой гликолиза и направлено на снижение производства Н+.
Специфической оказалась ответная реакция пшеницы на щелочность корневой среды, выраженная в аккумуляции лимонной кислоты. Накопление лимонной и других органических кислот в корнях пшеницы при щелочном стрессе связывают с повышением продуктивности цикла Кребса [5]. При воздействии щелочных солей в проростках пшеницы прослежено накопление органических кислот, направленное на восстановление осмотического и ионного балансов внутри растительных клеток [29]. Аккумуляция цитрата, малата, оксалата наблюдали в листьях подсолнечника под воздействием смеси нейтральных и щелочных солей натрия. Эти изменения в метаболизме органических кислот предложено рассматривать в качестве важнейшего адаптивного ответа растений при щелочном стрессе [12].
В нашем эксперименте аккумуляция лимонной кислоты, возможно, направлена также на создание градиента водного потенциала, т.к. через сутки после повышения рН корневой среды значительно возросла сырая масса растений пшеницы. По данным Чжоу и Юй [30], при засолении корневой среды органические кислоты поддерживали низкий водный потенциал в корнях и листьях проростков Vetiveria zizanioides L. При воздействии щелочных солей на подсолнечник основными осмолитами, наряду с К+ и сахарами, были органические кислоты [12].
В совокупности полученные данные свидетельствуют о том, что в начальной стадии щелочного и кислотного стрессов общий ответ растений проявился в усилении редокс-процессов, в том числе, в повышении активности пероксидаз, а также в накоплении некоторых полифункциональных соединений. При щелочном стрессе растения отличались по уровню аккумуляции низкомолекулярных соединений: в листьях пшеницы накапливались флавоноиды и лимонная кислота, а в листьях ржи – пролин и, в меньшей степени, флавоноиды. При кислотном стрессе в листьях злаков отмечена тенденция к снижению содержания ряда органических кислот – участников цикла Кребса, что может быть связано с переходом на альтернативный путь дыхания. Эффективность адаптивных процессов у пшеницы в обоих вариантах изменения рН корневой среды была выше, чем у ржи, что подтверждено восстановлением скоростей роста и прироста массы во вторые сутки наблюдений по сравнению с первыми.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Bhuyan M.H.M.B., Hasanuzzaman M., Mahmud J.A., Hossain M., Bhuiyan T.F., Fujita M. Morphophysiological and biochemical responses of Triticum aestivum L. to extreme pH: Coordinated actions of antioxidant defense and glyoxalase systems // Plants. 2019. P. 24. https://doi.org/10.3390/plants8010024
Liu J., Guo Q., Shi D.C. Seed germination, seedling survival, and physiological response of sunflowers under saline and alkaline conditions // Photosynthetica. 2010. V. 48. P. 278.
Lv B.S., Li X.W., Ma H.Y., Sun Y., Wei L.X., Jiang C.J., Liang Z.W. Differences in growth and physiology of rice in response to different saline-alkaline stress factors // Agron. J. 2013. V. 105. P. 1119. https://doi.org/10.2134/agronj2013.0017
Shi D., Sheng Y. Effect of various salt-alkaline mixed stress conditions on sunflower seedlings and analysis of their stress factors // Environ. Exp. Bot. V. 54. P. 8. https://doi.org/10.1016/j.envexpbot.2004.05.003
Guo R., Yang Z., Li F., Yan C., Zhong X., Liu Q., Xia X., Li H., Zhao L. Comparative metabolic reponses and adaptive strategies of wheat (Triticum aestivum) to salt and alkali stress // BMC Plant Biol. 2015. P. 170. https://doi.org/10.1186/s12870-015-0546-x
Latef A.A.A., Tran L.S. Impacts of priming with silicon on the growth and tolerance of maize plants to alkaline stress // Front. Plant Sci. 2016. V. 7. P. 243. https://doi.org/10.3389/fpls.2016.00243
Shi Q.H., Zhu Z.J., LI J., Qian Q.Q. Combined effects of excess Mn and low pH on oxidative stress and antioxidant enzymes in cucumber roots // Agric. Sci. China. 2006. V. 5. P. 767. https://doi.org/10.1016/S1671-2927(06)60122-3
Shavrukov Y., Hirai Y. Good and bad protons: genetic aspects of acidity stress responses in plants // J. Exp. Bot. 2016. V. 67. P. 15. https://doi.org/10.1093/jxb/erv437
Szabados L., Savoure A. Proline: a multifunctional amino acid // Trends Plant Sci. 2009. V. 15. P. 89. https://doi.org/10.1016/j.tplants.2009.11.009
Demidchik V. Mechanisms of oxidative stress in plants: from classical chemistry to cell biology // Environ. Exp. Bot. 2015. V. 109. P. 212. https://doi.org/10.1016/j.envexpbot.2014.06.021
Noctor G., Lelarge-Trouverie C., Mhamdi A. The metabolomics of oxidative stress // Phytochemistry. 2015. V. 112. P. 33. https://doi.org/10.1016/j.phytochem.2014.09.002
Liu J., Shi D.-C. Photosynthesis, chlorophyll fluorescence, inorganic ion and organic acid accumulations of sunflower in responses to salt and salt-alkaline mixed stress // Photosynthetica. 2010. V. 48. P. 127.
Van Dongen J.T., Gupta K.J., Ramirez-Aguilar S.J., Nunes-Nesi A., Fernie A.R. Regulation of respiration in plants: a role for alternative metabolic pathways // J. Plant Physiol. 2011. V. 168. P. 1434. https://doi.org/10.1016/j.jplph.2010.11.004
Шелякин М.А., Захожий И.Г., Головко Т.К. Изменение дыхания и соотношения дыхательных путей при адаптации лишайников к действию УФ-В радиации // Известия Уфимского научного центра. 2018. № 3 (5). С. 100.
Sakano K. Revision of biochemical pH-stat: Involvement of alternative pathway metabolism // Plant Cell Physiol. 1998. V. 3. P. 466. https://doi.org/10.1093/oxfordjournals.pcp.a029393
Reid R.J., Smith F.A. The cytoplasmic pH stat // Handbook of plant growth: pH as the master variable in plant growth. New York. 2002. P. 49.
Sagisaka S. The occurrence of peroxide in a perennial plant, Populus gelrica // Plant Physiol. 1976. V. 57. P. 308. https://doi.org/10.1104/pp.57.2.308
Bates L., Waldren P.P., Teare J.D. Rapid determination of proline of water stress studies // Plant Soil. 1973. V. 39. P. 205.
Kobayashi Y., Watanabe T., Shaff J.E., Ohta H., Kochian L.V., Wagatsuma T., Kinraide T.B., Koyama H. Molecular and physiological analysis of Al3+ and H+ rhizotoxicities at moderately acidic conditions // Plant Physiol. 2013. V. 163. P. 180. https://doi.org/10.1104/pp.113.222893
Wang L., Zhou Q., Wang Q., Huang X. Combined effect of soil acidification and lead ion on antioxidant system in soybean roots // Chem. Ecol. 2014. V 31. P. 123. https://doi.org/10.1080/02757540.2014.917176
Zelinovf V., Mistrik I., Paove-Balang P., Tamas L. Peroxidase activity against guaiacol, NADH, chlorogenic acid, ferulic acid and coniferyl alcohol in root tips of Lotus japonicus and L. corniculatus grown under low pH and aluminium stress // Biologia. 2010. V. 65. P. 279.
Минибаева Ф.В., Гордон Л.Х. Продукция супероксида и активность внеклеточной пероксидазы в растительных тканях при стрессе // Физиология растений. 2003. Т. 50. С. 459.
Zhu J.K. Plant salt tolerance // Trends Plant Sci. 2001. V. 6. P. 66. https://doi.org/10.1016/S1360-1385(00)01838-0
Tomar P. Estimation of some biochemical parameters in Lycopersicon lycopersicum (L.) cv. Damyanti in response to acid rain // Voyager. 2018. V. 9. P. 34.
Krishnan N., Dickman M.B., Becker D.F. Proline modulates the Intracellular redox environment and protects mammalian cells against oxidative stress // Free Radic. Biol. Med. 2008. V. 44. P. 671. https://doi.org/10.1016/j.freeradbiomed.2007.10.054
Aslam R., Bostan N., Nabgha-e-Amen M.M., Safdar W. A critical review on halophytes: salt tolerant plants // J. Medical Plant Res. 2011. V. 5. P. 7108. https://doi.org/10.5897/JMPRX11.006
Matysik J., Alia, Bhalu B., Mohanty P. Molecular mechanisms of quenching of reactive oxygen species by proline under stress in plants // Curr. Sci. 2002. V. 82. P. 525.
Olmos E., Hellin E. Mechanisms of salt tolerance in a cell line of Pisum sativum: biochemical and physiological aspects // Plant Sci. 1996. V. 120. P. 37. https://doi.org/10.1016/S0168-9452(96)04483-4
Guo R, Shi L., Ding X., Hu Y., Tian S., Yan D., Shao S., Gao Y., Liu R., Yang Y. Effects of saline and alkaline stress on germination, seedling growth, and ion balance in wheat // Agron. J. 2010. V. 102. P. 1252.
Чжоу К., Юй В.Дж. Накопление неорганических и органических осмолитов и их роль в осмотической регуляции у проростков Vetiveria zizanioides при действии NaCl // Физиология растений. 2009. Т. 56. С. 751.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений




