Физиология растений, 2020, T. 67, № 2, стр. 115-129
Аскорбат в апопласте: метаболизм и функции
Е. И. Шарова a, *, С. С. Медведев a, В. В. Демидчик b
a Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
b Белорусский государственный университет
Минск, Беларусь
* E-mail: elenasharova@mail.ru
Поступила в редакцию 03.07.2019
После доработки 17.07.2019
Принята к публикации 17.07.2019
Аннотация
Аскорбиновая кислота (АК) – один из наиболее важных антиоксидантов и редокс-активных веществ растений, содержащихся в апопласте. Она может поступать в виде аскорбат-аниона в клеточную стенку через анионные каналы, где в дальнейшем окисляется до дегидроаскорбиновой кислоты (ДАК) и в такой форме обратно переносится в цитоплазму в результате функционирования пока еще неидентифицированных транспортеров. В апопласте АК подвергается как ферментативному, так и неферментативному окислению, участвуя в антиоксидантных и прооксидантных процессах: детоксикации О3, генерации гидроксильных и восстановлении феноксильных радикалов и др. Промежуточный продукт окисления АК в апопласте – монодегидроаскорбиновая кислота (МДАК) – служит внеклеточным акцептором электронов для ряда локализованных в плазматической мембране (ПМ) редокс-цепей. В процессы клеточной сигнализации могут потенциально вовлекаться все три формы аскорбата – АК, ДАК и МДАК. Выделяясь из клетки по анионным каналам при деполяризации ПМ, АК может стимулировать образование гидроксил-радикалов, активирующих Са2+-проницаемые каналы, и тем самым запускать процессы Са2+-сигнализации. Благодаря способности генерировать гидроксильные и восстанавливать феноксильные радикалы, АК влияет на растяжимость клеточных стенок и процессы роста растяжением. Восстанавливая Fe3+ до хорошо растворимой транспортной формы Fe2+, АК участвует в усвоении железа клетками корня. Апопластная АК также играет важную роль в ряде других процессов и потенциально является уникальной сигнально-регуляторной молекулой, функционирующей в клеточных стенках растений.
ВВЕДЕНИЕ
Апопласт является своего рода матриксом, или внутренней средой, растительного организма, объединяющей клетки, ткани и органы в единое целое. В корне апопласт создает путь транспорта воды и минеральных веществ, а также обеспечивает среду для взаимодействия с почвенными абиотическими и биотическими факторами. Апопласт находится на пути внешних воздействий и часто является их первичной мишенью в растении. Протекающие в апопласте гидролитические и окислительно-восстановительные процессы регулируют ответные реакции на стрессоры, а также растяжимость клеточных стенок, от которой зависит скорость роста клеток растений.
По сравнению с цитоплазмой, апопласт беден восстановителями, в нем низок уровень глутатиона и практически отсутствует НАД(Ф)·Н [1]. Аскорбиновая кислота (АК) и фенолы – наиболее сильные восстановители, обнаруженные в клеточных стенках [1]. Уровень АК в апопласте существенно ниже, чем в других компартментах растительной клетки. Тем не менее, в последние годы апопластная АК привлекает все большее внимание исследователей, поскольку она вовлекается в такие фундаментальные процессы, как восстановление переходных металлов (главным образом, Fe3+, Cu2+ и Mn3+), поддержание фенолов в восстановленном состоянии, утилизацию О3 и H2O2, сигнальные процессы.
В апопласте, в отличие от цитоплазмы, преобладает дегидроаскорбиновая кислота (ДАК) – продукт обратимого окисления АК. Она способна реагировать с амино- и тиольными группами белков [2, с. 276]. Клетки растений эффективно закачивают ДАК обратно в цитоплазму, где эта молекула восстанавливается до АК [3, 4]. В последние годы также показано, что в апопласте может происходить дальнейшее окислительное разложение ДАК, приводящее к образованию широкого круга соединений, функции которых мало изучены [5].
Роль различных форм аскорбата в апопласте активно исследуется последние 50–60 лет. В разные периоды в центре внимания оказывались следующие аспекты их активности: регуляция окисления фенолов, генерация гидроксильного радикала (НО•) и биологически активных продуктов распада ДАК, детоксикация О3 и H2O2, участие в усвоении железа и работе цитохром-зависимых редокс-цепей плазматической мембраны (ПМ), регуляция кислородного баланса, сигнальные функции.
Цель обзора – обобщение и анализ новых и общепризнанных данных о метаболизме и функциях аскорбата в апопласте.
ЭНЕРГЕТИЧЕСКИЕ АСПЕКТЫ ТРАНСПОРТА АСКОРБАТА ЧЕРЕЗ БИОМЕМБРАНЫ
Синтезируясь изначально в межмембранном пространстве митохондрий [6], АК начинает свой путь в клетке с пересечения эндомембран. Для попадания в апопласт АК преодолевает ПМ. Последний процесс, вероятно, не требует затрат энергии, так как отрицательная разница электрических потенциалов на ПМ способствует пассивному выходу аскорбат-аниона [7]. Перераспределение аскорбата в тканях и его дальний транспорт сопряжены с энергетическими затратами. Они требуют загрузки аскорбата из апопласта в клетку, что, возможно, как и у животных, происходит в результате использования энергии электрохимического градиента катионов. Ниже обсуждаются ключевые механизмы транспорта аскорбата в клетках животных и растений, работа которых позволяет тонко регулировать уровни этого редокс-активного метаболита во внутри- и внеклеточном пространстве.
ТРАНСПОРТ В КЛЕТКАХ ЖИВОТНЫХ
Концентрация АК в цитоплазме большинства клеток животных находится в диапазоне 0.5–4 мМ. В плазме крови она значительно ниже – 40–60 µМ [8]. Это связано с тем, что у животных, как и у растений, большая часть АК окисляется во внеклеточном пространстве, которое беднее антиоксидантами, чем внутриклеточная среда. В клетках млекопитающих описано несколько переносчиков, позволяющих АК и ДАК пересекать ПМ [9, 10].
Трансмембранный перенос ДАК в клетку осуществляется глюкозными транспортерами GLUT (GLUcose Transporter) с константой Михаэлиса в субмиллимолярном диапазоне активности (0.2–0.5 мМ) [11]. Это указывает на достаточно высокий уровень ДАК во внеклеточном пространстве у животных. Кристаллическая структура GLUT была выявлена недавно, и на ее основе предложена модель работы транспортной системы глюкозы и аскорбата у животных [11]. GLUT состоит из 12 трансмембранных доменов, собранных по шесть в два макродомена и соединенных в цитоплазматической части связкой ICH (IntraCellular Helical bundle). GLUT может транспортировать ДАК только из области его высокой химической активности в область низкой, например, из внеклеточной среды в цитоплазму. GLUT экспонирует открытый сайт связывания субстрата на наружной стороне ПМ. Когда субстрат (ДАК или глюкоза) присоединяется к седьмому трансмембранному домену (ТМ7), происходит внутримолекулярная перестройка и закрывание сайта связывания субстрата при одновременном растяжении ICH и открывании поры на внутренней стороне ПМ. По своей сути этот субстрат-регулируемый поток не зависит от мембранного потенциала. Концентрация глюкозы или ДАК в цитоплазме значительно ниже, чем снаружи клетки, что способствует их отсоединению от ТМ7 и диффузии внутри клетки.
Высокоаффинное поглощение АК из тканевых жидкостей у человека и млекопитающих происходит при участии аскорбатных транспортеров Sodium Vitamin C Transporters (SVCT) с константой Михаэлиса около 20–50 мкМ [10]. Это предполагает относительно небольшие уровни внеклеточной АК в тканях животных (вероятно, субмиллимолярные). SVCT кодируются генами семейства Solute Carrier 23 (SLC23), относящегося к суперсемейству Nucleobase Ascorbate Transporters (NAT). NAT выявлены у бактерий, грибов, растений и млекопитающих. Они осуществляют транспорт азотистых оснований или аскорбата, сопряженный с котранспортом Na+ или Н+. SVCT1 и SVCT2 котранспортируют в клетки АК и Na+ в стехиометрии 1 : 2. В качестве источника энергии при поглощении АК используется разность электрохимических потенциалов Na+ на плазматической мембране, создаваемая работой Na+/K+-АТФаз. В результате активности SVCT2 в нейронах мозга концентрация АК может достигать 10 мМ, стократно превышая концентрацию в крови.
Известно несколько путей выхода АК из клеток млекопитающих [9]. Среди них наиболее изученным является выход по анионным каналам VRAC (Volume-Regulated Anion Channels), кодируемым недавно открытым семейством генов LRRC8 (Leucine Rich Repeat Containing 8) [12]. К настоящему времени имеется лишь физиологическое доказательство того, что VRAC катализируют процесс выхода АК из клеток, а именно: показан перенос АК в условиях доминирующей активности данных систем и его ингибирование блокаторами VRAC [10]. Кроме вышеописанных, предложен ряд других механизмов транспорта аскорбата в клетках животных, например, его перенос в результате активности Ca2+-зависимых анионных каналов, через щелевые контакты, а также путем экзоцитоза аскорбат-содержащих везикул [9].
ТРАНСПОРТ ЧЕРЕЗ МЕМБРАНЫ РАСТЕНИЙ
У растений содержание АК в клеточных компартментах может достигать десятков мМ, а в апопласте – 0.3–1 мМ [6], что почти на порядок больше, чем у животных. При этом соотношение уровней экзогенного и эндогенного аскорбата у растений и животных примерно одинаково. В этой связи для растений можно ожидать схожие, по крайней мере, физиологически, механизмы транспорта АК и ДАК. Данная область является высокоперспективной для будущей разработки, так как гены, кодирующие транспортеры АК и ДАК у растений, пока не идентифицированы.
В обзоре Horemans с соавт. [13] суммированы основные результаты исследований 1960–90 гг. по транспорту АК и ДАК, в которых использовались протопласты и везикулы ПМ, полученные из разных видов растений. Сделан вывод, что растительные клетки преимущественно поглощают ДАК, и выдвинуто предположение, согласно которому гексозные транспортеры, схожие с GLUT животных, не участвуют в поглощении ДАК у растений, поскольку данный процесс конкурентно не ингибируется глюкозой. Эффективное поглощение ДАК продемонстрировано в корнях люпина и лука [4], листьях березы [14] и клетках суспензионной культуры арабидопсиса [15]. Примечательно, что инкубация корней с ДАК (1 мМ) не изменяла ее содержания в клетках, но вызывала двукратное повышение содержания АК [4]. Таким образом, у растений, как и у животных, поглощение ДАК приводило к ее быстрому восстановлению.
Некоторые работы показывают, что АК поглощается растительными клетками намного хуже, чем ДАК [14], или вовсе не поглощается [15]. Об отсутствии у растений поглощения АК клетками из апопласта свидетельствуют также результаты изучения особенностей растительных NAT. Показано, что NAT растений не транспортируют АК в диапазоне физиологических концентраций, как SVCT человека, а осуществляют котранспорт азотистых оснований и H+, подобно NAT транспортерам грибов [16].
Пути выхода АК из растительных клеток также изучены недостаточно. Недавно с использованием спектроскопии ЭПР и техники пэтч-кламп было продемонстрировано, что АК может выходить из клеток корня арабидопсиса через анионные каналы, схожие по своим свойствам с уникальными для растений ионными каналами для малата – ALuminum-activated Malate Transporters (ALMT) [7]. ALMT – крупное семейство анионных каналов, обильно экспрессирующееся (14 генов у арабидопсиса) во всех тканях и органах растения [17]. Токи аскорбата имели типичные для ALMT свойства: отсутствие потенциал- и время-зависимости, ингибирование антрацен-9-карбоновой кислотой [7]. По своим характеристикам аскорбатный ток не отличался от малатного и напоминал токи по каналам LRRC8 животных. Обнаружена высокая селективность к АК по сравнению со схожей по структуре молекулой глюконата. С учетом широкого распространения ALMT-каналов в мембранах растительной клетки, они могут играть роль основного транспортера, обеспечивающего выход АК из клеток растений в апопласт (рис. 1). Поступление АК в апопласт по ALMT-каналам может индуцироваться Са2+-зависимой деполяризацией и выходом К+ через наружу-выпрямляющие калиевые каналы GORK (Guard cell Outwardly Rectifying K+ channel) [18, 19]. По-видимому, таким способом каналы ALMT и GORK при стрессе обеспечивают симпорт в апопласт аниона АК и катиона K+. Предполагается, что выход аскорбата через ALMT-каналы приводит к изменению редокс-статуса апопласта, генерации гидроксильного радикала и активации катионных каналов (кальциевых и GORK) [7]. Поступление в клетки ионов Са2+ запускает работу кальциевой сигнальной системы и адаптивные реакции, связанные со стрессоустойчивостью [20].
Рис. 1.
Системы, вовлеченные в транспорт и сигнальные функции аскорбата в плазматической мембране клеток высших растений. АК – аскорбиновая кислота; ДАК – дегидроаскорбиновая кислота; ПМ – плазматическая мембрана; ALMT, GORK, GLR – анионные, калиевые, глутамат-активируемые каналы, соответственно; CNGC – каналы, активируемые циклическими нуклеотидами.
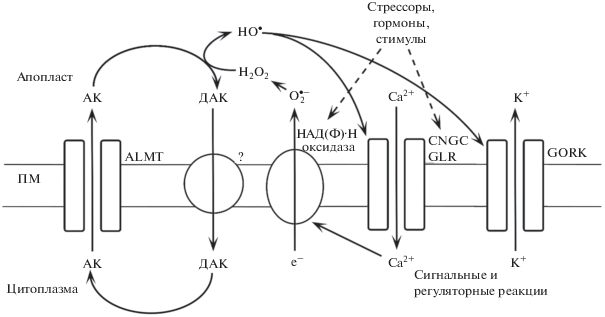
Подтверждением предложенного механизма является ряд данных, показывающих, что повышение уровня АФК в апопласте приводит к усилению выхода АК из клеток растений. Так, периодическая обработка озоном (О3) через несколько дней увеличивала содержание АК и ДАК в апопласте листьев многих растений [21]. Пероксид водорода (1 мМ), внесенный в культуральную среду суспензии клеток розы, уже через 1 мин вызывал повышение содержания в ней АК и ДАК [22]. Засоление приводило к очень быстрому увеличению уровня МДАК в апопласте корней арабидопсиса [7]. Этот эффект сопровождался мощным выбросом К+. Таким образом, выход из клеток АК может происходить по механизму балансировки потока К+ и других электролитов [18, 23]. Способность клеток растений регулировать выделение АК используется развивающимися зародышами для восстановления и поглощения железа из жидкого эндосперма [24].
Таким образом, клетки растений, как и животных, преимущественно поглощают ДАК и выделяют АК. Первый процесс, по-видимому, осуществляется транспортерами по механизму облегченной диффузии, второй – через ионные каналы. Несомненно, что транспорт АК и ДАК через ПМ в растительном организме тонко регулируется и контролируется, однако механизмы такой регуляции остаются пока неизученными.
УЧАСТИЕ В РАБОТЕ РЕДОКС-ЦЕПЕЙ ПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ
Потенциально важной, но малоизученной функцией апопластного аскорбата является участие в работе в редокс-цепей ПМ, передающих электроны от цитоплазматических доноров на апопластные акцепторы. Активность этих редокс-цепей может служить еще одним способом, с помощью которого происходит пополнение пула восстановленного аскорбата в апопласте. Значительная часть редокс-компонентов ПМ представлена цитохромами b561 (Cyt b561) [25]. В восстановленном состоянии они имеют характерный пик абсорбции света при 561 нм. Донором электронов для Cyt b561 служит цитоплазматическая АК, а акцепторами – МДАК либо хелатированное Fe3+, находящиеся на внешней стороне ПМ (рис. 2а). Суперсемейство Cyt b561 представлено белками семейств CYB561, CYBDOM и DOMON.
Рис. 2.
Участие апопластного аскорбата в работе электрон-транспортных цепей плазмалеммы (а), регуляции растяжимости клеточных стенок (б) и детоксикации озона (в). АК – аскорбиновая кислота; ДАК – дегидроаскорбиновая кислота; МДАК – монодегидроаскорбиновая кислота; ПМ – плазматическая мембрана; ПО – гваяколпероксидаза; CYB561, CYBDOM, AIR12 – мембранные белки, имеющие в своем составе гем b561, восстанавливаемый АК; NQR – НАД(Ф)·Н-хинон-редуктаза; PhOH и PhO• – фенольное соединение и феноксильный радикал, соответственно; QH2, QH•, Q – нафтодиол, семинафтохинон и нафтохинон, соответственно.

В семейство CYB561 входят мембранные белки c шестью трансмембранными α-доменами, из которых 4 домена участвуют в связывании двух гемов за счет четырех консервативных остатков гистидина и формируют консервативный гемовый домен CYB561. Кристаллографический анализ CYB561B2 арабидопсиса показал, что данный белок образует в мембране гомодимер [26]. АК и МДАК специфически связываются в катионных “карманах”, расположенных, соответственно, на внутренней и внешней сторонах мембраны. Белки CYB561 обнаружены в тонопласте, мембранах пластид и в ПМ [25]. Показано, что локализованный в ПМ клеток фасоли CYB561 переносит электроны от цитоплазматической АК на апопластную МДАК [25].
Значительно шире, чем CYB561, у растений представлены белки семейства CYBDOM, которые помимо консервативного CYB561 домена на N-конце полипептидной цепи имеют гидрофильный и сильно гликозилированный DOMON домен [27]. Он находится на обращенной в клеточную стенку поверхности ПМ и состоит из β-структур, которые формируют β-сэндвич укладку и удерживают один гем b561 за счет консервативных остатков гистидина и метионина. Показано, что CYBDOM сои осуществляют трансмембранный ток электронов от цитоплазматической АК на апопластное Fe3+ [27].
Среди белков суперсемейства Cyt b561 в ПМ растений количественно преобладают белки AIR12 (Auxin-Induced in Root culture). Ортологи AIR12 описаны у многих растений и подробно изучены у сои и фасоли [28]. Эти консервативные белки имеют сигнальный N-пептид, адресующий их в секреторный путь. Они локализованы на внешней стороне ПМ и заякорены в ней с помощью GPI (Glycosyl Phosphatidyl Inositol) на С-конце полипептидной цепи. AIR12 относится к DOMON семейству белков, состоящих только из гидрофильного DOMON домена. АК восстанавливает AIR12, что приводит к усилению полосы абсорбции света при 561 нм. МДАК окисляет AIR12, вызывая исчезновение этой полосы.
Функции AIR12 остаются малоизученными. Установлено, что AIR12 может принимать электроны не только от АК, но и от нафтодиолов [29]. Поэтому AIR12 может входить в состав трансмембранной цепи переноса электронов, включающей НАД(Ф)·Н-хинон-редуктазу (NQR) и нафтохиноны/нафтодиолы (рис. 2а). NQR обнаружены в ПМ многих видов растений [30]. Эти флавопротеины локализованы на внутренней стороне ПМ. NQR в присутствии НАД(Ф)·Н и нафтохинонов способны генерировать ${\text{О}}_{2}^{{\centerdot - }}.$ Электрон-транспортная цепь, включающая NQR, нафтохиноны группы витамина К (филлохинон, менахинон-4) и AIR12, функционирует, по-видимому, как НАД(Ф)·Н-оксидаза, генерируя ${\text{О}}_{2}^{{\centerdot - }}$ на поверхности клеток, либо как монодегидроаскорбат-редуктаза, которая восстанавливает апопластную МДАК [29].
Таким образом, выявленные в ПМ электрон-транспортные цепи переносят электроны от цитоплазматических АК и НАД(Ф)·Н на локализованные в апопласте О2, Fe3+ и МДАК. Редокс-цепи, в которые входят цитохромы b561, вносят существенный вклад в баланс ДАК/АК клеточных стенок.
СПОНТАННОЕ ОКИСЛЕНИЕ
В живых клетках АК окисляется ферментативно и неферментативно (спонтанно). Клеточная стенка представляет собой окислительный компартмент клетки, в котором процессы окисления преобладают над процессами восстановления, а гомеостаз поддерживается благодаря постоянному притоку восстановителей из цитоплазмы. Поэтому в апопласте особенно активно протекает спонтанное окисление АК. Оно происходит под действием не только АФК, но даже растворенного в апопластной жидкости О2. Окисление АК молекулярным кислородом занимает минуты в присутствии переходных металлов (Cu2+ и Fe3+) и часы – в их отсутствие [31]. В ряде случаев этот процесс усиливает окислительный стресс, так как в данной реакции образуется небольшое количество Н2О2: АК + О2 → МДАК + Н2О2 [32, 33]. Интенсивность и роль этого процесса в интактном апопласте сложно оценить ввиду недостаточной изученности как уровня каталитически-активных переходных металлов, так и динамики растворенного кислорода.
АК в апопласте может восстанавливать переходные металлы. Это исключительно важная реакция, так как она стимулирует т. н. фентон-подобные реакции: Fe2+/Cu+ + Н2О2 → Fe3+/Cu2+ + НО• + НО– [32, 34, 35]. Данная реакция может приводить к интенсивному образованию НО• в апопласте, особенно в условиях гиперпродукции Н2О2 в ответ на стрессовые воздействия [18, 35]. В упрощенной форме уравнение неферментативных реакций взаимодействия АК и Н2О2 в присутствии ионов Cu2+ или Fe3+ можно представить следующим образом: АК + Н2О2 → ДАК + НО• + НО–. Образование НО• в этой реакции доказано методом ЭПР [18].
Первичный продукт окисления АК – МДАК – вступает в неферментативную реакцию диспропорционирования: 2МДАК ⇆ АК + ДАК. Равновесие этой реакции сильно сдвинуто вправо [36, 37]. Таким образом, в аэрируемой смеси АК и ДАК всегда присутствует МДАК, но в низкой в концентрации (0.1 мкМ МДАК на 1 мМ АК и ДАК). МДАК представляет собой один из наиболее долгоживущих радикалов, обнаруженных в живых системах [2, с. 159], однако роль прямых взаимодействий МДАК с другими радикалами и молекулами изучена крайне слабо.
Таким образом, при неферментативном и ферментативном окислении АК в клеточных стенках происходит накопление ДАК. Внутри клеток ДАК не накапливается. Там поддерживается высокий редокс-статус аскорбата (80–90%) благодаря активности редуктаз МДАК и ДАК, а также из-за того, что в слабощелочной среде цитоплазмы (рH 7.2–7.4) ДАК быстро и необратимо гидролизуется (делактонизируется) до дикетогулоновой кислоты с периодом полураспада 8–9 мин [38]. О накоплении ДАК в вакуолях, которые имеют низкие значения рН, известно крайне мало. Тем не менее, существуют сведения, что уровень ДАК в вакуоли не превышает 0.1–0.2 мМ, в то время как АК в этом компартменте представлена в более высокой концентрации [39]. В условиях клеточной стенки (рН 5.0–6.5) ДАК относительно стабильна, и ее декомпозиция занимает несколько часов [4, 14]. Тем не менее, даже в кислой среде ДАК подвержена дальнейшему окислению, приводящему к разрыву углеродного скелета. В результате окисления ДАК в тканях растений накапливаются оксалат, L-треонат и их эфиры [40].
Интермедиаты окисления ДАК подробно изучены в серии работ Fry с соавт. [5, 33, 41, 42]. Распад ДАК не обязательно начинается с делактонизации. У растений идентифицирован циклический оксалил-L-треонолактон – продукт прямого окисления ДАК, сопровождающегося разрывом углеродного скелета. ДАК и продукты ее распада содержат химически активные карбонильные группы (С=О). Некоторые из этих соединений участвуют в генерации/утилизации АФК, в сигналинге, вызывают модификации белков, восстанавливают феноксильные радикалы. Например, неидентифицированный продукт распада дикетогулоновой кислоты вызывал, подобно АК, лаг-фазу в реакции окисления фенолов пероксидазой [5]. Имеются работы, показывающие, что продукты окисления АК могут напрямую участвовать в карбонилировании и гликировании белков [6, 43].
Окислению с разрывом углеродного скелета подвержена не только ДАК, но и АК. Это может происходить под действием озона или синглетного кислорода [44]. Озонолиз двойной связи приводит к распаду АК. Кроме треоновой и щавелевой кислот, продуктами этого распада являются обладающие высокой химической активностью перокситреоновая и пероксищавелевая кислоты. Под действием синглетного кислорода образуется химически активный пероксикетон АК, который спонтанно гидролизуется, превращаясь в ДАК и Н2О2.
ДАК давно привлекла внимание исследователей как вещество с высокой химической активностью [45]. Известно, что ДАК может восстанавливаться тиольными соединениями, например, дитиотрейтолом, что даже положено в основу широко распространенного метода ее определения [46]. ДАК может неферментативно реагировать с восстановленным глутатионом; данный процесс может также катализироваться ДАК-редуктазой и глутаредоксинами [6]. Обработка растительных и животных клеток ДАК (0.3–1 мМ) оказывает сильное действие на редокс-статус клеток, так как ДАК, поглощаясь в клетки, восстанавливается, вызывая снижение пула восстановленного глутатиона [3, 4, 47].
Благодаря способности окислять SH-группы белков ДАК играет важную роль в фолдинге новосинтезированных белков, происходящем в полости эндоплазматической сети [48]. Эта роль связана с функционированием PDI (Protein Disulfide Isomerase) – фолдазы, формирующей дисульфидные мостики в белках. Роль ДАК заключается в регенерации (реокислении) PDI, необходимом для ее вступления в новый цикл окисления SH-групп белков. Предполагается, что апопластная ДАК может участвовать в редокс-сигналинге, основанном на обратимом окислении тиольных групп белков [49, 50].
ДАК и особенно продукты ее декомпозиции способны инактивировать белки, реагируя с остатками лизина, аргинина и цистеина [2, с. 276]. Наиболее детально исследовано S-аскорбилирование – образование аддукта SH-групп остатков цистеина с продуктом декомпозиции ДАК [43]. S-аскорбилирование, так же, как и неэнзиматическое гликирование белков гексозами и продуктами их окисления, ведет к накоплению AGE (Advanced Glycation End products), с которыми у человека связаны тяжелые функциональные нарушения.
ОКИСЛЕНИЕ ГЕМОВЫМИ ПЕРОКСИДАЗАМИ III КЛАССА
В клеточных стенках широко представлены гемовые пероксидазы III класса, или гваяколпероксидазы (ПО), окисляющие фенольные соединения. Это типичные белки клеточных стенок: они имеют сигнальный N-пептид, гликозилированы, SH-группы остатков цистеина в их составе замкнуты в дисульфидные мостики [51, 52]. Известно, что активность ПО подавляется даже низкими концентрациями АК (10–50 мкМ). Механизм этого подавления состоит в восстановлении феноксильных радикалов (PhO•) – продуктов пероксидазного окисления фенолов (PhOH): PhOH + H2O2 → PhO• + H2O; PhO• + АК → → PhOH + МДАК. Этот механизм доказан посредством регистрации методом ЭПР динамики PhO• и МДАК в реакционной среде [53]. Предполагается, что не только АК, но и МДАК может восстанавливать PhO•: PhO• + МДАК → PhOH + ДАК [53]. Восстанавливать PhO• способны и продукты декомпозиции ДАК [5].
Таким образом, ПО в присутствии фенолов активно окисляют АК в апопласте. Показано, что окисление фенолов начинается после почти полного окисления АК [53, 54], поэтому подавляющий эффект АК обычно выражается в возникновении лаг-фазы в реакции окисления фенолов пероксидазами. Кроме того, АК может снижать скорость этой реакции. АК подавляет окисление пероксидазами не только гваякола, но и тех фенолов, которые накапливаются в клеточных стенках: кониферилового спирта, кофейной, феруловой и хлорогеновой кислот, рутина [53–57].
Влияние АК на окисление фенолов зависит от локализации ПО. АК эффективно подавляет ПО, экстрагируемые из клеточных стенок, а также связанные с ПМ, например, ПО фракции ПМ корней кукурузы [54]. АК значительно слабее влияет на гваякол-пероксидазную активность, прочно связанную с клеточными стенками [55, 57]. Можно предположить, что реакции, осуществляемые этими ПО, менее доступны для подавления АК из-за потенциала Доннана катионобменных групп клеточных стенок, создающего пространство исключения анионов, к которым относится и АК.
ОКИСЛЕНИЕ АСКОРБАТПЕРОКСИДАЗАМИ
Аскорбатпероксидазы (АПО), принадлежащие к I классу гемовых пероксидаз, высокоспецифичны к АК. Данные ферменты инактивируются, если концентрация АК в среде падает ниже микромолярного уровня [58]. Инактивация происходит в результате того, что в отсутствие АК фермент, перешедший под действием Н2О2 в форму соединения I, подвергается дальнейшему и уже необратимому окислению даже наномолярными концентрациями Н2О2. Существует ряд свидетельств того, что АПО присутствуют в клеточной стенке. Протеомный анализ выявил АПО в клеточных стенках корней кукурузы [59]. Активность АПО, ингибируемая р-хлормеркурибензоатом, выявлена в клеточных стенках листьев и междоузлий гороха [60, 61], стеблей пшеницы [57], листьев тыквы и подсолнечника [62, 63], корней лука [64] и веток тополя [65].
В отличие от ПО, сосредоточенных в клеточных стенках, активность АПО в этом компартменте редко превышает 1–5% внутриклеточной [57, 61, 64]. Электрофоретическое фракционирование АПО, обнаруженной в клеточных стенках листьев подсолнечника [63] и междоузлий гороха [61], показало ее идентичность одной из цитоплазматических форм АПО. Тем не менее, есть основания считать, что АПО оказывается в клеточной стенке не вследствие цитоплазматического загрязнения, но, возможно, используя пути неклассической секреции. Помимо отмеченной выше частоты обнаружения АПО в клеточных стенках, на это указывает то, что изменения активности АПО в клеточных стенках под действием тех или иных факторов отличаются от изменений активности внутриклеточных АПО. Например, под действием озона в молодых листьях тыквы в 3 раза повышалась активность АПО в апопласте, тогда как внутри клеток она возрастала только на 30% [62]. В листьях подсолнечника АПО апопласта под действием озона возрастала в 2.5 раза, а внутри клеток – в 1.5 [63].
Сильно и независимо от внутриклеточной изменяется активность АПО апопласта в онтогенезе. Обычно ее, в отличие от ПО, гораздо больше в апопласте молодых, растущих тканей, чем в дифференцированных [57, 61], что дало основание утверждать об обратной корреляции активности ПО и АПО в клеточных стенках [60]. Предполагается, что АПО отнимает Н2О2 у ПО, так как имеет большее сродство к Н2О2: у АПО, выделенной из апопласта междоузлий гороха, Km для Н2О2 составляла 1.5 мкМ, тогда как у ПО – примерно 200–300 мкМ [61]. Таким образом, ПО клеточной стенки в присутствии АПО и AК лишены возможности окислять фенолы. Однако нельзя не отметить, что это обобщение не имеет широкого экспериментального подтверждения. Кроме того, существуют данные, ему противоречащие. Например, в ходе дифференцировки корней лука наблюдалось не снижение, а многократное увеличение активности АПО в апопласте [64].
ОКИСЛЕНИЕ АСКОРБАТОКСИДАЗОЙ
Аскорбатоксидаза (АО) – локализованный в клеточной стенке фермент, относящийся к суперсемейству мультимедных оксидаз [66]. Это гликозилированный гомодимер. Каждый мономер АО содержит 4 Cu2+. АО осуществляет следующую реакцию: АК + О2 → МДАК + Н2О (рНopt 5.5–6.0). АО имеет высокое сродство к АК, но также может окислять ИУК и некоторые фенолы. Она обнаружена у многих растений: ячменя, риса, кукурузы, гороха, люцерны, сои, винограда, арабидопсиса, тополя, томата, лотоса [50]. АО сосредоточена в молодых тканях. Например, ее много в зоне растяжения корней кукурузы [67], у делящихся и растягивающихся клеток суспензионной культуры табака BY-2 [68], в растягивающихся плодах и листьях кабачка [45]. Экспрессия генов АО активируется ауксином [66] и возрастает при освещении [69].
С использованием трансгенных растений табака показано, что многократное увеличение активности АО мало отражается на балансе аскорбата внутри клеток [70, 71]. При этом в апопласте листьев табака происходил существенный сдвиг аскорбатного баланса: суммарное содержание аскорбата (АК + ДАК) повышалось в 2.5 раза, а редокс-статус (АК/(АК + ДАК), %) снижался от 40 (растения дикого типа) до 3%.
Начиная с 1950-х гг. обсуждаются две основные функции АО: 1) регуляция роста клеток; 2) регуляция кислородного баланса. Предположение об участии АО в регуляции растяжения клеток в значительной степени базируется на положительной корреляции скорости роста клеток и активности АО в клеточных стенках, о чем упоминалось выше. Однако эта корреляция наблюдается не всегда. Например, в корне кукурузы [67] и в зоне роста эпикотилей гороха [61] клетки, завершившие растяжение, сохраняли высокую АО активность. Использование трансгенных растений с измененным уровнем экспрессии генов АО также не выявило однозначной связи активности АО и скорости роста клеток. Так, сверхэкспрессия гена АО тыквы в клетках суспензионной культуры табака не привела к ускорению растяжения клеток, хотя ускорила растяжение полученных из этих клеток протопластов в среде, содержащей маннит [70]. По-видимому, повышенная активность АО вызвала увеличение осмотического давления внутри клеток.
Очень подробно исследованы последствия экспрессии гена тыквенной и огуречной АО в sense и antisense ориентации в растениях табака [71–75]. Многократное увеличение активности АО либо не влияло на рост растений [72], либо усиливало рост побегов, не затрагивая роста корней [73]. У растений с высокой активностью АО изменялась экспрессия многих генов, нарушался суточный ритм экспрессии генов [73]. У таких растений не наблюдалось ростовой реакции на обработку ауксином, возрастала чувствительность к фитопатогенам [73] и озону [72], снижалась отверстость устьиц [74], происходило существенное замедление распада хлорофилла в темноте у отсеченных листьев [75]. Совокупность приведенных данных показывает, что связь активности АО со скоростью роста не прямая, но опосредованная цепью разнообразных процессов и, в целом, остается непонятной.
Участие АО в поддержании кислородного баланса доказано опытами, проведенными на растениях кабачка [69]. У этих растений активность АО имела ярко выраженный суточный ритм, постепенно возрастала в светлое время суток и снижалась в темноте. Авторы предположили, что светозависимое увеличение активности АО опосредовано накоплением О2 в тканях в процессе фотосинтеза. Они доказали это, индуцировав активность АО в условиях гипероксии и снизив ее посредством гипоксии. Подтверждением данной функции может быть также то, что АО многократно возрастала в процессе развития азотфиксирующих клубеньков на корнях лотоса, инокулированного Mesorhizobium loti [76]. Предполагается, что АО в клубеньках создает барьер для диффузии О2 внутрь клубенька, где сосредоточена нитрогеназная активность.
УЧАСТИЕ В РЕГУЛЯЦИИ РОСТА РАСТЕНИЙ
Одной из вероятных функций апопластного пула аскорбата является регуляция деления и растяжения клеток. Она базируется на следующих группах доказательств: 1) эффектах экзогенной обработки АК и ДАК на рост растений; 2) корреляции активности АО в клеточных стенках и скорости роста; 3) корреляции содержания АК и ДАК в апопласте и скорости роста; 4) отзывчивости содержания апопластного аскорбата на индукторы и ингибиторы роста растений.
Обработка растений АК/ДАК a priori не может дать однозначного ответа о функциях аскорбата в апопласте, так как АК быстро окисляется, а ДАК быстро поглощается клетками. Тем не менее, результаты таких обработок часто интерпретируются с привлечением данных о влиянии АК/ДАК на процессы, происходящие в клеточных стенках. Большинство таких исследований проведено на корнях. В 1990-х гг. сотрудники университета Кордовы изучили действие АК и ДАК на рост корней лука. Они показали, что за 15–20 ч ДАК (1 мМ) тормозит, а АК (1 мМ) стимулирует удлинение корней [37, 55]. Наиболее сильный стимулирующий эффект на рост оказывала эквимолярная смесь АК и ДАК [37]. В этой смеси уже через 1 ч наблюдалось увеличение митотического индекса у примордиев корней лука, а также возрастание размеров делящихся клеток [36]. В экспериментах Lee с соавт. [77], выполненных на растениях арабидопсиса, была изучена концентрационная зависимость эффекта ДАК и АК на рост. Было показано, что АК в зависимости от концентрации усиливает (10–100 мкМ) или тормозит (1–10 мМ) рост корней. При этом ДАК тормозила рост уже в концентрации 10 мкМ [77]. В наших опытах также было показано, что обработка АК в низких концентрациях (30 мкМ) стимулирует, а в высоких (300 мкМ) сильно подавляет рост клеток корня арабидопсиса в зоне растяжения [78]. Примечательно, что эффект АК (300 мкМ) на рост корня арабидопсиса может зависеть от уровня фосфатного питания. При высоких концентрациях фосфатов (1 мМ) АК тормозила, а при низких (1 μМ) усиливала рост [79]. Похожие эффекты были получены на растениях люпина: галактонолактон (1 мМ), который является предшественником биосинтеза АК, усиливал, а ДАК (1 мМ) тормозила рост корней. При этом ДАК через 24 ч снижала митотический индекс в апексе корней [4]. В культуре клеток табака BY-2 галактонолактон (3 мМ) также стимулировал деление и рост клеток, а ДАК (0.3 мМ) – тормозила [3].
Обработка корней арабидопсиса галактонолактоном вызывала размывание пика ауксина, сконцентрированного у контрольных образцов в области покоящегося центра и инициалей колумеллы [49]. Подобный эффект был зарегистрирован и при обработке корней арабидопсиса АК в рост-стимулирующей концентрации 0.1 мМ [77]. Обработка корней ДАК приводила к исчезновению пика ауксина в апексе корня [49].
Таким образом, аскорбат необходим для деления и растяжения клеток корня. Он поддерживает структуру апикальной меристемы с пиком ИУК и клеточный цикл. Одним из способов влияния на деление клеток является участие АК в гидроксилировании пролина, необходимом для созревания обогащенных оксипролином белков (HPRP) клеточных стенок [6].
Сильное активирующее действие на рост и корней, и побегов оказывала экзогенная обработка АК в сочетании с CuCl2 или FeCl3. Смесь АК (1 мМ) и Cu2+ (40 нМ) усиливала рост корней лука [37]. Смесь АК и Н2О2 в миллимолярных концентрациях после предобработки CuCl2 (или FeCl3) вызывала резкое увеличение растяжимости клеточных стенок и стимуляцию роста растяжением клеток у колеоптилей кукурузы, гипокотилей огурца, сои, подсолнечника и сосны [80]. Очевидно, что в этих случаях АК способствовала протеканию реакций Хабера-Вайса, генерирующих гидроксил-радикал.
Изучение взаимосвязи между содержанием аскорбата в апопласте и ростом корней затруднено из-за проблем с выделением и анализом апопластного раствора из зон корня, обладающих разной скоростью роста. Отсутствуют работы, в которых было бы отдельно определено содержание апопластного аскорбата в зоне деления и разных участках зоны растяжения корней высших растений. В работе Liso с соавт. [81] гистохимическим методом показано, что в кончиках корней тыквы АК сконцентрирована на границе ПМ и клеточной стенки, а также вокруг ядерной мембраны и в ядрышке. Однако при этом имеется большое количество указаний на то, что АК достаточна мобильна и свободно передвигается в клетке [6]. У корней лука было показано, что в апопласте 2-сантиметрового апикального сегмента существенно меньше АК и ДАК, а также ниже отношение АК/ДАК, чем в сегментах, удаленных от апекса [64]. В корнях ячменя, напротив, отношение АК/ДАК было вдвое выше в апопласте верхушечного сегмента, чем у сегмента, завершающего растяжение [82]. О положительной связи скорости роста корней с содержанием аскорбата в апопласте свидетельствуют данные, полученные на стрессированных корнях вигны [83]. В условиях засухи рост первичного корня вигны ускорялся и повышалось содержание суммарного аскорбата в апопласте. Под действием засоления рост тормозился и снижалось содержание суммарного аскорбата в апопласте.
Большинство работ по изучению корреляции между содержанием АК и ДАК в апопласте и ростом проведено на побегах. Исследования, проведенные на гипокотилях сосны [56], эпикотилях гороха [61] и мезокотилях кукурузы [84], показали, что в зонах роста осевых органов происходит базипетальное снижение суммарного содержания АК и ДАК, но особенно сильно снижается степень восстановленности аскорбата. Однако данные, полученные на листьях разного возраста, не выявили какой-либо закономерности [62, 85–88] (табл. 1).
Таблица 1.
Содержание аскорбиновой и дегидроаскорбиновой кислот в апопласте листьев разного возраста
| Вид растения | Содержание в нмоль/г сырой массы, молодые/растущие листья → зрелые/стареющие листья |
Ссылка | |||
|---|---|---|---|---|---|
| АК | ДАК | АК + ДАК | АК/(АК + ДАК), % | ||
| Тыква | 4 → 25 | 20 → 18 | 24 → 42 | 17 → 58 | [62] |
| Табак | 15 → 0 | 70 → 30 | 85 → 30 | 18 → 0 | [85] |
| Соя | 5–10 → 5–30 | 250–400 → 50–60 | – | 2–3 → 5–35 | [86] |
| Пшеница | 30 → 40 | 20 → 50 | 50 → 90 | 70 → 35 | [87] |
| Подсолнечник | 1.5 → 0.2 | – | – | – | [88] |
Таким образом, несмотря на некоторую противоречивость сведений, в целом они позволяют заключить, что для быстро растущих клеток характерно более высокое содержание АК и ДАК и более высокая степень восстановленности аскорбата в апопласте.
Lin и Varner [45], основываясь на собственных и литературных данных о высокой активности АО в быстро растущих тканях, предположили, что особую роль в регуляции роста играет ДАК, накапливающаяся в клеточных стенках под действием АО. Убедительные результаты в поддержку этого предположения были получены при изучении последствий снижения и повышения активности АО у трансгенных растений табака [70, 71], а также в экспериментах на удлиняющихся сегментах эпикотилей вигны [89, 90]. Было показано, что ИУК и фузикокцин, стимулируя удлинение сегментов, замедляют происходящее после нарезания снижение содержания ДАК в апопласте, ускоряют падение АК и таким образом снижают степень восстановленности апопластного аскорбата. Торможение удлинения отрезков под действием АБК сопровождается падением АК до нуля и снижением в два раза содержания ДАК. Торможение удлинения отрезков под действием света также сопровождается значительным снижением концентрации ДАК, но при этом происходит возрастание содержания АК и степени восстановленности аскорбата. Таким образом, была обнаружена корреляция содержания суммарного аскорбата в апопласте и скорости удлинения эпикотилей вигны.
Можно заключить, что апопластный аскорбат участвует в регуляции роста клеток и органов растений (рис. 2б), однако мнения относительно механизма этого участия неоднозначны. Хорошо проработана идея о том, что апопластная АК поддерживает рост, ингибируя окисление фенолов клеточных стенок пероксидазами, хотя и не всегда наблюдается корреляция между содержанием АК в апопласте и скоростью роста. Прооксидантное действие АК, приводящее к увеличению растяжимости клеточных стенок in vitro, недостаточно обосновано in vivo. В наших работах на мезокотилях кукурузы показано, что условия для проявления этой активности наилучшие в апопласте быстро удлиняющегося сегмента, так как в нем содержится значительно больше и аскорбата, и Н2О2, чем апопласте сегмента, завершающего растяжение [84, 91]. Роль апопластной МДАК в регуляции роста заслуживает внимания в свете достижений последних лет в области изучения электрон-транспортных цепей ПМ, в которых МДАК выступает одним из акцепторов электронов. Кроме того, уровень МДАК может очень быстро возрастать во внеклеточном пространстве в ходе некоторых физиологических реакций [7]. Наконец, апопластная ДАК, благодаря способности взаимодействовать с SH и NH2 группами белков, может участвовать в регуляции активности белков, а также выполнять сигнальную функцию, гипотетически контролируя ростовые процессы. Однако роль ДАК остается наименее понятной, так как до сих пор в клеточных стенках не найдены мишени ее химической или сигнальной активности. Такими мишенями потенциально могут служить Са2+-проницаемые катионные каналы, активация которых была недавно продемонстрирована при обработке аскорбатом интактных корней арабидопсиса [7].
УЧАСТИЕ В УСВОЕНИИ ЖЕЛЕЗА
Железо находится в почве в форме нерастворимых оксидов и солей Fe3+ и Fe4+. Большинство растений, за исключением злаков, поглощают железо с помощью IRT (Iron-Regulated Transporter), переносящих Fe2+ [92]. Таким образом, усвоению железа предшествует его восстановление, а восстановлению – растворение. Растворение Fe3+ происходит за счет ацидофицирующей активности H+-помпы, а также выделения в ризосферу цитрата, малата или фитосидерофоров. Трехвалентное железо в составе комплексов восстанавливается до Fe2+ с помощью Fe(III)-хелат-редуктаз, таких как НАД(Ф)·Н -зависимые белки FRO (Ferric Reduction Oxidases), локализованные в ПМ [93].
АК легко восстанавливает Fe3+ до Fe2+. У человека детально обоснована роль АК в поглощении железа клетками, в котором, как и у растений, участвуют Fe2+-специфичные транспортеры [94]. Восстановление железа осуществляется мембранными Cyt b561, использующими цитоплазматическую АК, а также с помощью экстраклеточной АК. Поэтому выделение АК в полость пищеварительного тракта способствует поглощению железа.
Роль экстраклеточной (апопластной) АК в аккумуляции железа недавно была продемонстрирована у формирующихся семян гороха и арабидопсиса [24]. Развивающиеся зародыши секретировали АК в окружающий их жидкий эндосперм и восстанавливали таким способом ионы Fe3+, находящиеся в комплексах с цитратом и малатом, до Fe2+.
РОЛЬ В ЗАЩИТНЫХ РЕАКЦИЯХ И СТРЕСС-СИГНАЛИНГЕ
Клеточная стенка первой принимает на себя воздействие внешних стрессоров. В ответ на стресс-факторы абиотической и биотической природы в клеточной стенке в результате работы НАДФ∙Н-оксидаз ПМ и ПО генерируются большие количества АФК, запускающие реакции окислительного взрыва, редокс-сигнальные явления, процессы лигнификации, суберинизации и инсолюбилизации экстенсина [35]. Роль аскорбата в этих реакциях остается малоизученной, хотя потенциально АК способна участвовать в генерации НО•, катализируемой переходными металлами, и, соответственно, интенсифицировать редокс-зависимые явления в апопласте (рис. 1, 2).
Под действием окислителей клеточная стенка может проявлять свой защитный восстановительный потенциал, частью которого является АК. Среди таких защитных реакций наиболее изучена реакция на озон, который как сильнейший окислитель напрямую поражает растения. Он проникает в клетки растений через устьица (рис. 2в). В апопласте при контакте с водой происходит декомпозиция О3 с образованием 1О2, Н2О2, ${\text{О}}_{2}^{{\centerdot - }}$ и НО•. В присутствии фенолов и АК скорость декомпозиции О3 увеличивается [95]. АК напрямую реагирует с О3: АК + О3 → ДАК + Н2О + О2. В процессе реакции происходит эпоксидация либо озонолиз ендиольного фрагмента молекулы АК [44]. Эпоксидация обычно завершается образованием ДАК и выделением эпоксидного кислорода в форме воды. Озонолиз приводит к формированию пероксипродуктов окислительного распада АК: пероксищавелевой и перокситреоновой кислот [44]. Кроме того, взаимодействие АК с О3 сопровождается образованием 1О2, который напрямую неферментативно окисляет АК. Продуктами этой реакции являются пероксикетоны, ДАК и Н2О2. Таким образом, в результате взаимодействия АК с О3 происходит не только детоксикация О3, но и образование серии АФК: 1О2, Н2О2, пероксикислот.
Имеются данные, показывающие, что апопластный аскорбат защищает растения от поражения О3. Мутант Atvtc1 с низким содержанием АК был гиперчувствителен к О3 [96]. Повышенную чувствительность к О3 проявляли трансгенные растения табака с пониженным уровнем АК в апопласте вследствие высокой активности АО [71]. О роли апопластного аскорбата в детоксикации О3 свидетельствует также корреляция между содержанием АК и ДАК в апопласте листьев и устойчивостью к О3 у разных видов и сортов: у сортов сои [86] и озимой пшеницы [87], у ряда дикорастущих трав [97], у табака и тополя [98].
Тем не менее, среди описанных закономерностей имеется ряд исключений. Например, в апопласте листьев арабидопсиса оказалось очень мало аскорбата и не наблюдалось никаких изменений в содержании АК и ДАК под действием О3 [99]. Подсчеты и определение суммарной восстановительной способности FRAP (Ferric Reducing Antioxidant Power) показали, что АК может отвечать лишь за часть процесса детоксикации О3 в апопласте. В этом процессе, очевидно, участвуют также и другие редуктанты, в первую очередь, фенолы [86, 97–99]. Важное значение в защите от озона придается возможной сигнальной роли апопластного аскорбата [21, 44, 95]. Эту функцию, в частности, могут выполнять пероксипродукты окисления АК озоном.
Роль аскорбата в защитных реакциях в ответ на стрессовые воздействия может быть шире, чем устранение О3. Недавно были получены данные, показывающие, что экзогенная АК в физиологических концентрациях (0.03–3 мМ) индуцирует быстроразвивающийся НО•-зависимый вход ионов Са2+ в цитоплазму клеток корня арабидопсиса [7], т.е. воздействует на важнейшую сигнально-регуляторную систему растительной клетки [100]. Это позволяет предположить, что АК может вовлекаться в такие Са2+-зависимые процессы, как адаптация к стрессорам и иммунный ответ, контроль роста и дифференцировки, кодирование гормональных сигналов и гравитропизм, автофагия и запрограммированная клеточная гибель [100]. Соответственно, внеклеточный аскорбат может выступать в роли исключительно важной сигнальной молекулы, играющей центральную роль в контроле и/или тонкой настройке редокс- и Са2+-индуцируемых феноменов защитного и общерегуляторного характера. Кроме того, вовлечение АФК в передачу дальних Са2+-сигналов в растениях предполагает потенциальное участие в ней аскорбата [19, 100]. Весьма вероятно, что аскорбат может выделяться через каналы ALMT при стрессе, вызывать активацию Са2+-сигналов в соседней клетке, что приводит к деполяризации и высвобождению аскорбата из соседней клетки, способствуя распространению АФК/Са2+-сигналов в тканях растений.
ЗАКЛЮЧЕНИЕ
Несмотря на многочисленные работы и многолетние усилия, функции АК и ДАК в апопласте недостаточно понятны. До сих пор неизвестно, какие системы активного транспорта ПМ катализируют вход в клетки ДАК и АК. Тем не менее, выяснен путь выхода аскорбата из растительной клетки в апопласт: это явление опосредуется работой анионных каналов ПМ, по своим характеристикам относящихся к малат-проницаемым каналам ALMT. Остаются практически неизученными механизмы контроля/регуляции явлений транспорта и перераспределения АК в растении.
В апопласте очень надежно регистрируются значительные количества ДАК. Однако во многих случаях можно усомниться в данных о содержании АК. Это связано с тем, что концентрация АК в апопласте в десятки раз ниже, чем в цитоплазме, и таким образом сопоставима с обычно достигаемым уровнем цитоплазматического загрязнения выделяемой апопластной фракции. Поэтому очевидно, что прогресс в исследованиях функций АК в апопласте зависит от разработки более надежных методов ее детекции. Одной из актуальных тем фундаментальной биохимии является выяснение роли ДАК в регуляции активности белков. Концентрация ДАК в апопласте достаточно высока, и ДАК потенциально может влиять на белки клеточных стенок и ПМ. Однако дальше общих рассуждений исследования этого вопроса пока не продвинулись. В настоящее время наиболее активно изучается роль апопластного аскорбата в работе редокс-цепей ПМ и усвоении железа. Выявлена неожиданная роль аскорбата в качестве сигнального агента, индуцирующего временное повышение уровня цитоплазматической активности Са2+. Следовательно, в ближайшее время можно ожидать прорыва именно в этих направлениях исследований.
Работа поддержана грантом Российского фонда фундаментальных исследований (проект № 17-04-00862).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Шарова Е.И., Медведев С.С. Редокс-реакции в апопласте растущих клеток // Физиология растений. 2017. Т. 64. С. 3.
Halliwell B., Gutteridge J.M.C. Free Radicals in Biology and Medicine. Oxford: Oxford University Press, 2015. 896 p.
de Pinto M. C., Francis D., De Gara L. The redox state of the ascorbate-dehydroascorbate pair as a specific sensor of cell division in tobacco BY-2 cells // Protoplasma. 1999. V. 209. P. 90.
Paciolla C., De Tullio M.C., Chiappetta A., Innocenti A.M., Bitonti M.B., Liso R., Arrigoni O. Short- and long-term effects of dehydroascorbate in Lupinus albus and Allium cepa roots // Plant Cell Physiol. 2001. V. 42. P.857.
Kärkönen A., Dewhirst R.A., Mackay C.L., Fry S.C. Metabolites of 2,3-diketogulonate delay peroxidase action and induce non-enzymic H2O2 generation: Potential roles in the plant cell wall // Arch. Biochem. Biophys. 2017. V. 620. P. 12.
Smirnoff N. Ascorbic acid metabolism and functions: A comparison of plants and animals // Free Radic. Biol. Med. 2018. V. 122. P. 116.
Makavitskaya M., Svistunenko D., Navaselsky I., Hryvusevich P., Mackievic V., Rabadanova C., Tyutereva E., Samokhina V., Straltsova D., Sokolik A., Voitsekhovskaja O., Demidchik V. Novel roles of ascorbate in plants: Induction of cytosolic Ca2+ signals and efflux from cells via anion channels // J. Exp. Bot. 2018. V. 69. P. 3477.
May J.M. The SLC23 family of ascorbate transporters: ensuring that you get and keep your daily dose of vitamin C // Br. J. Pharmacol. 2011. V. 164. P. 1793.
Corti A., Casini A. F., Pompella A. Cellular pathways for transport and efflux of ascorbate and dehydroascorbate // Arch. Biochem. Biophys. 2010. V. 500. P. 107.
May J.M., Qu Z.C. Ascorbic acid efflux from human brain microvascular pericytes: role of re-uptake // Biofactors. 2015. V. 41. P. 330.
Deng D., Xu C., Sun P., Wu J., Yan C., Hu M., Yan N. Crystal structure of the human glucose transporter GLUT1 // Nature. 2014. V. 510. P. 121.
Jentsch T.J., Lutter D., Planells-Cases R., Ullrich F., Voss F.K. VRAC: molecular identification as LRRC8 heteromers with differential functions // Pflugers Arch. 2016. V. 468. P. 385.
Horemans N., Foyer C.H., Asard H. Transport and action of ascorbate at the plant plasma membrane // Trends Plant Sci. 2000. V. 5. P. 263.
Kollist H., Moldau H., Oksanen E., Vapaavuori E. Ascorbate transport from the apoplast to the symplast in intact leaves // Physiol. Plant. 2001. V. 113. P. 377.
Horemans N., Szarka A., De Bock M., Raeymaekers T., Potters G., Levine M., Banhégyi G., Guisez Y. Dehydroascorbate and glucose are taken up into Arabidopsis thaliana cell cultures by two distinct mechanisms // FEBS Letters. 2008. V. 582. P. 2714.
Kourkoulou A, Pittis A.A, Diallinas G. Evolution of substrate specificity in the Nucleobase-Ascorbate Transporter (NAT) protein family // Microb. Cell. 2018. V. 5. P. 280.
Sharma T., Dreyer I., Kochian L., Piñeros M.A. The ALMT family of organic acid transporters in plants and their involvement in detoxification and nutrient security // Front. Plant Sci. 2016. V. 7: e1488. https://doi.org/10.3389/fpls.2016.01488
Demidchik V., Cuin T.A., Svistunenko D., Smith S.J., Miller A.J., Shabala S., Sokolik A., Yurin V. Arabidopsis root K+ efflux conductance activated by hydroxyl radicals: single-channel properties, genetic basis and involvement in stress-induced cell death // J. Cell. Sci. 2010. V. 123. P. 1468.
Demidchik V. ROS-activated ion channels in plants: Biophysical characteristics, physiological functions and molecular nature // Int. J. Mol. Sci. 2018. V. 19: e1263. https://doi.org/10.3390/ijms19041263
Медведев С.С. Принципы формирования и распространения кальциевого сигнала в растительной клетке // Физиология растений. 2018. Т. 65. С. 403.
Castagna A., Ranieri A. Detoxification and repair process of ozone injury: From O3 uptake to gene expression adjustment // Environ. Pollut. 2009. V. 157. P. 1461.
Parsons H.T., Fry S.C. Reactive oxygen species-induced release of intracellular ascorbate in plant cell-suspension cultures and evidence for pulsing of net release rate // New Phytol. 2010. V. 187. P. 332.
Demidchik V., Straltsova D., Medvedev S.S., Pozhvanov G.A., Sokolik A., Yurin V. Stress-induced electrolyte leakage: ion-channel mechanism and potential roles in programmed cell death and metabolic adjustment // J. Exp. Bot. 2014. V. 65. P. 1259.
Grillet L., Ouerdane L., Flis P., Hoang M.T.T., Isaure M-P., Lobinski R., Curie C., Mari S. Ascorbate efflux as a new strategy for iron reduction and transport in plants // J. Biol. Chem. 2014. V. 289. P. 2515.
Asard H., Barbaro R., Trost P., Berczi A. Cytochromes b561: Ascorbate-mediated trans-membrane electron transport // Antioxid. Redox Signal. 2013. V. 19. P. 1026.
Lu P., Ma D., Yan C., Gong X., Du M., Shi Y. Structure and mechanism of a eukaryotic transmembrane ascorbate-dependent oxidoreductase // Proc. Natl Acad. Sci. U.S.A. 2014. V. 111. P. 1813.
Picco C., Scholz-Starke J., Festa M., Costa A., Sparla F., Trost P., Carpaneto A. Direct recording of trans-plasma membrane electron currents mediated by a member of the cytochrome b561 family of soybean // Plant Physiol. 2015. V. 169. P. 986.
Preger V., Tango N., Marchand C., Lemaire S.D., Carbonera D., Di Valentin M., Costa A., Pupillo P., Trost P. Auxin-responsive genes AIR12 code for a new family of plasma membrane b-type cytochromes specific to flowering plants // Plant Physiol. 2009. V. 150. P. 606.
Biniek C., Heyno E., Kruk J., Sparla F., Trost P., Krieger-Liszkay A. Role of the NAD(P)H quinone oxidoreductase NQR and the cytochrome b AIR12 in controlling superoxide generation at the plasma membrane // Planta. 2017. V. 245. P. 807.
Lüthje S., Möller B., Perrineau F.C., Wöltje K. Plasma membrane electron pathways and oxidative stress // Antioxid. Redox Signal. 2013. V. 18. P. 2163.
Miyake N., Kim M., Kurata T. Formation mechanism of monodehydro-L-ascorbic acid and superoxide anion in the autoxidation of L-ascorbic acid // Biosci., Biotechnol., Biochem. 1997. V. 61. P. 1693.
Fry S.C. Primary cell wall metabolism: tracking the careers of wall polymers in living plant cells // New Phytol. 2004. V. 161. P. 641.
Green M.A., Fry S.C. Apoplastic degradation of ascorbate: Novel enzymes and metabolites permeating the plant cell wall // Plant Biosyst. 2005. V. 139. P. 2.
Fry S.C., Miller J.G., Dumville J.C. A proposed role for copper ions in cell wall loosening // Plant Soil. 2002. V. 247. P. 57.
Demidchik V. Mechanisms of oxidative stress in plants: From classical chemistry to cell biology // Environ. Exp. Bot. 2015. V. 109. P. 212.
De Cabo R.C., Gonzalez-Reyes J.A., Navas P. The onset of cell proliferation is stimulated by ascorbate free radical in onion root primordia // Biol. Cell. 1993. V. 77. P. 231.
González-Reyes J.A., Alcaín F.J., Caler J.A., Serrano A., Córdoba F., Navas P. Relationship between apoplastic ascorbate regeneration and the stimulation of root growth in Allium cepa L. // Plant Sci. 1994. V. 100. P. 23.
Van Duijn M.M., Van der Zee J., VanSteveninck J., Van den Broek P.J.A. Ascorbate stimulates ferricyanide reduction in HL-60 cells through a mechanism distinct from the NADH-dependent plasma membrane reductase // J. Biol. Chem. 1998. V. 273. P. 13415.
Ferreres F., Figueiredo R., Bettencourt S., Carqueijeiro I., Oliveira J., Gil-Izquierdo A., Pereira D.M., Valentão P., Andrade P.B., Duarte P., Barceló A.R., Sottomayor M. Identification of phenolic compounds in isolated vacuoles of the medicinal plant Catharanthus roseus and their interaction with vacuolar class III peroxidase: an H2O2 affair? // J. Exp. Bot. 2011. V. P. 2841.
Truffault V., Fry S.C., Stevens R.G., Gautier H. Ascorbate degradation in tomato leads to accumulation of oxalate, threonate and oxalyl threonate // Plant J. 2017. V. 89. P. 996.
Parsons H.T., Fry S.C. Oxidation of dehydroascorbic acid and 2,3-diketogulonate under plant apoplastic conditions // Phytochemistry. 2012. V. 75. P. 41.
Dewhirst R.A., Fry S.C. The oxidation of dehydroascorbic acid and 2,3-diketogulonate by distinct reactive oxygen species // Biochem. J. 2018. V. 475. P. 3451.
Flandrin A., Allouche S., Rolland Y., McDuff F.-O., Wagner J.R., Klarskov K. Characterization of dehydroascorbate mediated modification of glutaredoxin by mass spectrometry // J. Mass Spectrom. 2015. V. 50. P. 1358.
Sandermann H. Ecotoxicology of ozone: Bioactivation of extracellular ascorbate // Biochem. Biophys. Res. Comm. 2008. V. 366. P. 271.
Lin L.-S., Varner J.E. Expression of ascorbic acid oxidase in zucchini squash (Cucurbita pepo L.) // Plant Physiol. 1991. V. 96, P. 159.
Ueda Y., Wu L., Frei M. A critical comparison of two high-throughput ascorbate analyses methods for plant samples // Plant Physiol. Biochem. 2013. V. 70. P. 418.
Cisternas P., Silva-Alvarez C., Martínez F., Fernandez E., Ferrada L., Oyarce K., Salazar K., Bolaños J.P., Nualart F. The oxidized form of vitamin C, dehydroascorbic acid, regulates neuronal energy metabolism // J. Neurochem. 2014. V. 129. P. 663.
Szarka A., Lőrincz T. The role of ascorbate in protein folding // Protoplasma. 2014. V. 251. P. 489.
De Tullio M.C., Jiang K., Feldman L.J. Redox regulation of root apical meristem organization: Connecting root development to its environment // Plant Physiol. Biochem. 2010. V. 48. P. 328.
De Tullio M., Guether M., Balestrini R. Ascorbate oxidase is the potential conductor of a symphony of signaling pathways // Plant Signal. Behav. 2013. V. 8: e23213. https://doi.org/10.4161/psb.23213
Francoz E., Ranocha P., Nguyen-Kim H., Jamet E., Burlat V., Dunand C. Roles of cell wall peroxidases in plant development // Phytochemistry. 2015. V. 112. P. 15.
Moural T.W., Lewis K.M., Barnaba C., Zhu F., Palmer N.A., Sarath G., Scully E.D., Jones J. P., Sattler S.E., Kang C. Characterization of Class III Peroxidases from Switchgrass // Plant Physiol. 2017. V. 173. P. 417.
Takahama U., Oniki T. A peroxidase/phenolics/ascorbate system can scavenge hydrogen peroxide in plant cells // Physiol. Plant. 1997. V. 101. P. 845.
Šukalović V.H.T., Vuletić M., Vučinić Ž. Plasma membrane-bound phenolic peroxidase of maize roots: in vitro regulation of activity with NADH and ascorbate // Plant Sci. 2003. V. 165. P. 1429.
Córdoba-Pedregosa M.C., González-Reyes J.A., Cañadillas M.S., Navas P., Córdoba F. Role of apoplastic and cell-wall peroxidases on the stimulation of root elongation by ascorbate // Plant Physiol. 1996. V. 112. P. 1119.
Sánchez M., Queijeiro E., Revilla G., Zarra I. Changes in ascorbic acid levels in apoplastic fluid during growth of pine hypocotyls. Effect on peroxidase activities associated with cell walls // Physiol. Plant. 1997. V. 101. P. 815.
Padu E. Apoplastic peroxidases, ascorbate and lignification in relation to nitrate supply in wheat stem // J. Plant Physiol. 1999. V. 154. P. 576.
Miyake C., Asada K. Inactivation mechanism of ascorbate peroxidase at low concentrations of ascorbate; hydrogen peroxide decomposes compound I of ascorbate peroxidase // Plant Cell Physiol. 1996. V. 37. P. 423.
Zhu J., Alvarez S., Marsh E.L., LeNoble M.E., Cho I.-J., Sivaguru M., Chen S., Nguyen H.T., Wu Y., Schachtman D.P., Sharp R.E. Cell wall proteome in the maize primary root elongation zone. II. Region-specific changes in water soluble and lightly ionically bound proteins under water deficit // Plant Physiol. 2007. V. 145. P. 1533.
De Gara L. Class III peroxidases and ascorbate metabolism in plants // Phytochem. Rev. 2004. V. 3. P. 195.
de Pinto M.C., De Gara L. Changes in the ascorbate metabolism of apoplastic and symplastic spaces are associated with cell differentiation // J. Exp. Bot. 2004. V. 55. P. 2559.
Ranieri A., D’Urso G., Nali C., Lorenzini G., Soldatini G.F. Ozone stimulates apoplastic antioxidant systems in pumpkin leaves // Physiol. Plant. 1996. V. 97. P. 381.
Ranieri A., Castagna A., Soldatini G.F. Differential stimulation of ascorbate peroxidase isoforms by ozone exposure in sunflower plants // J. Plant Physiol. 2000. V. 156. P. 266.
Córdoba-Pedregosa M.C., Córdoba F., Villalba J.M., González-Reyes J.A. Zonal changes in ascorbate and hydrogen peroxide contents, peroxidase, and ascorbate-related enzyme activities in onion roots // Plant Physiol. 2003. V. 131. P. 697.
Ros-Barceló A., Gómez-Ros L.V., Ferrer M.A., Hernández J.A. The apoplastic antioxidant enzymatic system in the wood-forming tissues of trees // Trees – Struct. Funct. 2006. V. 20. P. 145.
Stevens R., Truffault V., Baldet P., Gautier H. Ascorbate oxidase in plant growth, development, and stress tolerance // In: Ascorbic Acid in Plant Growth, Development and Stress Tolerance / Eds. Hossain M.A., Munné-Bosch S., Burritt D.J., Diaz-Vivancos P., Fujita M., Lorence A. Cham, Switzerland: Springer Int. Publ., 2017. P. 273.
Mertz D. Distribution and cellular localization of ascorbic acid oxidase in the maize root tip // Am. J. Bot. 1961. V. 48. P. 405.
Kato N., Esaka M. Changes in ascorbate oxidase gene expression and ascorbate levels in cell division and cell elongation in tobacco cells // Physiol. Plant. 1999. V. 105. P. 321.
De Tullio M. C., Ciraci S., Liso R., Arrigoni O. Ascorbic acid oxidase is dynamically regulated by light and oxygen. A tool for oxygen management in plants? // J. Plant Physiol. 2007. V. 164. P. 39.
Kato N., Esaka M. Expansion of transgenic tobacco protoplasts expressing pumpkin ascorbate oxidase is more rapid than that of wild-type protoplasts // Planta. 2000. V. 210. P. 1018.
Pignocchi C., Foyer C.H. Apoplastic ascorbate metabolism and its role in the regulation of cell signalling // Curr. Opin. Plant Biol. 2003. V. 6. P. 379.
Sanmartin M., Drogoudi P.D., Lyons T., Pateraki I., Barnes J., Kanellis A.K. Over-expression of ascorbate oxidase in the apoplast of transgenic tobacco results in altered ascorbate and glutathione redox states and increased sensitivity to ozone // Planta. 2003. V. 216. P. 918.
Pignocchi C., Kiddle G., Hernández I., Foster S.J., Asensi A., Taybi T., Barnes J., Foyer C.H. Ascorbate oxidase-dependent changes in the redox state of the apoplast modulate gene transcript accumulation leading to modified hormone signaling and orchestration of defense processes in tobacco // Plant Physiol. 2006. V. 141. P. 423.
Fotopoulos V., De Tullio M.C., Barnes J., Kanellis A.K. Altered stomatal dynamics in ascorbate oxidase over-expressing tobacco plants suggest a role for dehydroascorbate signalling // J. Exp. Bot. 2008. V. 59. P. 729.
Fotopoulos V., Kanellis A.K. Altered apoplastic ascorbate redox state in tobacco plants via ascorbate oxidase overexpression results in delayed dark-induced senescence in detached leaves // Plant Physiol. Biochem. 2013. V. 73. P. 154.
Balestrini R., Ott T., Güther M., Bonfante P., Udvardi M.K., De Tullio M.C. Ascorbate oxidase: The unexpected involvement of a 'wasteful enzyme' in the symbioses with nitrogen-fixing bacteria and arbuscular mycorrhizal fungi // Plant Physiol. Biochem. 2012. V. 59. P. 71.
Lee Y., Park C.H., Kim A.R., Chang S.C., Kim S.-H., Lee W.S., Kim S.-K. The effect of ascorbic acid and dehydroascorbic acid on the root gravitropic response in Arabidopsis thaliana // Plant Physiol. Biochem. 2011. V. 49. P. 909.
Li X., Makavitskaya M., Samokhina V., Mackievic V., Navaselsky I., Hryvusevich P., Smolikova G., Medvedev S., Shabala S., Yu M., Demidchik V. Effects of exogenously-applied L-ascorbic acid on root expansive growth and viability of the border-like cells // Plant Signal Behav. 2018. V. 13: e1514895. https://doi.org/10.1080/15592324.2018.1514895
Tyburski J., Dunajska-Ordak K., Skorupa M., Tretyn A. Role of ascorbate in the regulation of the Arabidopsis thaliana root growth by phosphate availability // J. Bot. 2012. V. 2012: e580342. https://doi.org/10.1155/2012/580342
Schopfer P. Hydroxyl radical-induced cell wall loosening in vitro and in vivo: implications for the control of elongation growth // Plant J. 2001. V. 28. P. 679.
Liso R., De Tullio M.C., Ciraci S., Balestrini R., La Rocca N., Bruno L., Chiappetta A., Bitonti M.B., Bonfante P., Arrigoni O. Localization of ascorbic acid, ascorbic acid oxidase, and glutathione in roots of Cucurbita maxima L. // J. Exp. Bot. 2004. V. 55. P. 2589.
Bočová B., Mistrík I., Pavlovkin J., Tamás L. Cadmium disrupts apoplastic ascorbate redox status in barley root tips // Acta Physiol. Plant. 2012. V. 34. P. 2297.
Maia J.M., Voigt E.L., Ferreira-Silva S.L., Fontenele A.V., Macedo C.E.C., Silveira J.A.G. Differences in cowpea root growth triggered by salinity and dehydration are associated with oxidative modulation involving types I and III peroxidases and apoplastic ascorbate // J. Plant Growth Regul. 2013. V. 32. P. 376.
Sharova E., Romanova A. Ascorbate in the apoplast of elongating plant cells // Biol. Comm. 2018. V. 63. P. 77.
Takahama U., Hirotsu M., Oniki T. Age-dependent changes in levels of ascorbic acid and chlorogenic acid, and activities of peroxidase and superoxide dismutase in the apoplast of tobacco leaves: Mechanism of the oxidation of chlorogenic acid in the apoplast // Plant Cell Physiol. 1999. V. 40. P. 716.
Cheng F.-Y., Burkey K.O., Robinson J. M., Booker F.L. Leaf extracellular ascorbate in relation to O3 tolerance of two soybean cultivars // Environ. Pollut. 2007. V. 150. P. 355.
Feng Z., Pang J., Nouchi I., Kobayashi K., Yamakawa T., Zhu J. Apoplastic ascorbate contributes to the differential ozone sensitivity in two varieties of winter wheat under fully open-air field conditions // Environ. Pollut. 2010. V. 158. P. 3539.
Pinedo M., Lechner L., Creus C., Simontacchi M., Aguirrezaba L. Endogenous ascorbate restrains apoplastic peroxidase activity during sunflower leaf development // Plant Biol. 2013. V. 15. P. 60.
Takahama U. Changes induced by abscisic acid and light in the redox state of ascorbate in the apoplast of epicotyls of Vigna angularis // Plant Cell Physiol. 1994. V. 35. P. 975.
Takahama U. Effects of fusicoccin and indole-3-acetic acid on the levels of ascorbic acid and dehydroascorbic acid in the apoplast during elongation of epicotyl segments of Vigna angularis // Physiol. Plant. 1996. V. 98. P. 731.
Шарова Е.И., Билова Т.Е., Медведев С.С. Аксиальное изменение свойств апопласта в зоне растяжения мезокотиля кукурузы // Физиология растений. 2012. Т. 59. С. 610.
Jeong J., Merkovich A., Clyne M., Connolly E.L. Directing iron transport in dicots: regulation of iron acquisition and translocation // Curr. Opin. Plant Biol. 2017. V. 39. P. 106.
Chen Y.-T., Wang Y., Yeh K.-C. Role of root exudates in metal acquisition and tolerance // Curr. Opin. Plant Biol. 2017. V. 39. P. 66.
Lane D.J.R., Lawen A. Ascorbate and plasma membrane electron transport – Enzymes vs. efflux // Free Radic. Biol. Med. 2009. V. 47. P. 485.
Vainonen J.P., Kangasjärvi J. Plant signalling in acute ozone exposure // Plant Cell Environ. 2015. V. 38. P. 240.
Conklin P.L., Barth C. Ascorbic acid, a familiar small molecule intertwined in the response of plants to ozone, pathogens, and the onset of senescence // Plant Cell Environ. 2004. V. 27. P. 959.
Burkey K.O., Neufeld H.S., Souza L., Chappelka A.H., Davison A.W. Seasonal profiles of leaf ascorbic acid content and redox state in ozone-sensitive wildflowers // Environ. Pollut. 2006. V. 143. P. 427.
Dai L., Feng Z., Pan X., Xu Y., Li P., Lefohn A.S., Harmens H., Kobayashi K. Increase of apoplastic ascorbate induced by ozone is insufficient to remove the negative effects in tobacco, soybean and poplar // Environ. Pollut. 2019. V. 245. P. 380.
Booker F.L., Burkey K.O., Jones A.M. Re-evaluating the role of ascorbic acid and phenolic glycosides in ozone scavenging in the leaf apoplast of Arabidopsis thaliana L. // Plant Cell Environ. 2012. V. 35. P. 1456.
Demidchik V., Shabala S., Isayenkov S., Cuin T.A., Pottosin I. Calcium transport across plant membranes: a mechanistic basis and roles in the plant physiology // New Phytol. 2018. V. 220. P. 49.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


