Физиология растений, 2020, T. 67, № 2, стр. 130-140
Дегидрины в ортодоксальных и рекальцитрантных семенах
М. И. Азаркович *
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: m-azarkovich@mail.ru
Поступила в редакцию 04.07.2019
После доработки 31.07.2019
Принята к публикации 31.07.2019
Аннотация
Дегидрины представляют собой сложное семейство гидрофильных термоустойчивых белков с недостаточно хорошо изученными свойствами и функциями. Они накапливаются в тканях растения в ответ на любой внешний стимул, который приводит к обезвоживанию клетки. Такие стимулы могут возникать при засухе, солевом стрессе, воздействии низких температур, в ответ на обработку гормонами, а также в процессе созревания семян. Дегидрины идентифицированы в клетках цианобактерий, в тканях голо- и покрытосеменных растений, в травянистых и древесных видах, в вегетативных органах, в различных тканях зародышей семян. Они рассматриваются как ключевой элемент устойчивости или толерантности к дегидратации. Семена растений представляют особый интерес для исследования этой группы белков. В устойчивых к дегидратации ортодоксальных семенах дегидрины синтезируются и накапливаются на заключительных этапах созревания, которое сопровождается высыханием семян. Рекальцитрантные (неустойчивые к дегидратации) семена не высыхают при созревании, сохраняя в зрелом состоянии высокую влажность и активный метаболизм. Рекальцитрантные семена способны продуцировать дегидрины, но при этом остаются чувствительными к потере воды и не могут противостоять глубокому обезвоживанию, как это делают семена ортодоксального типа. В обзоре рассматриваются основные свойства и функции дегидринов, их структура и классификация, распространение, внутриклеточная локализация; на основании литературных и собственных экспериментальных данных обсуждается роль дегидринов в рекальцитрантных семенах.
ПРИЧИНЫ ДЕГИДРАТАЦИИ РАСТЕНИЙ
Вода является главным компонентом всего живого, составляющим около 90% сырого веса у большинства травянистых растений. Снижение содержания воды ниже этого уровня приводит к изменениям или повреждениям многих метаболических процессов.
Существует несколько внешних причин, приводящих к дефициту воды у растений. Дегидратация клеток наблюдается при водном, осмотическом (например, солевом) стрессе [1]; при холодовом стрессе в результате снижения физиологической активности корней [2, с. 34−35], а также из-за выхода воды из клеток в межклетники [1, 2, с. 89, 94−95] при температуре замерзания. И, наконец, в ортодоксальных семенах (т.е., устойчивых к дегидратации) высыхание зародыша является нормальной частью процесса созревания [3, с. 60−67, 69−73]. На основе сходства проявлений на клеточном уровне различных внешних стрессов, включающих засуху и замораживание, а также явления перекрестной адаптации, когда один стресс может защитить от другого, было выдвинуто положение о том, что растения могут обладать общими механизмами устойчивости к любому стрессу, который приводит к обезвоживанию протопласта [4, 5].
На биохимическом уровне ответ растений на обезвоживающий стресс проявляется в накоплении “замещающих веществ”, экспрессии генов, изменении активности ферментов и биосинтезе абсцизовой кислоты (АБК). Изменения в экспрессии генов касаются сигнал-передающих белков, протеаз и их ингибиторов, белков клеточных стенок, цитоскелета, ДНК-связывающих белков, ферментов липидного и углеводного обмена, биосинтеза “замещающих” растворимых веществ и различных белков с неизвестными функциями, включая белки позднего эмбриогенеза, или LEA-белки [3, с. 64; 4, 6].
Таким образом, в результате действия многих внешних стрессов клетки растений претерпевают дегидратацию, вследствие чего создаются условия для универсального ответа в виде накопления у различных растений сходных стресс-индуцируемых белков.
ЧТО ТАКОЕ LEA-БЕЛКИ И ДЕГИДРИНЫ?
Преобладающие белки позднего эмбриогенеза, или LEA-белки (от англ.: Late Embryogenesis Abundant), были впервые идентифицированы Dure с соавт. [7] при исследовании изменений или сдвигов популяции белков и мРНК в семядолях семян хлопчатника в процессе созревания. Были описаны 18 различающихся между собой семейств белков с разными, а иногда и неизвестными свойствами и функциями [7]. Большинство семейств LEA-белков были позже идентифицированы во многих других растительных системах. В настоящее время считается, что все семейства LEA-белков могут продуцироваться во всех растениях [8–10]. По мнению авторов многих обзоров по LEA-белкам, ученые уже находятся на уровне понимания биохимии этих белков, но еще далеки от понимания их функций [9, 11, 12]. Несмотря на гетерогенность на уровне белков, общим свойством LEA-транскриптов является их координированное накопление во время фазы дегидратации в созревающих семенах и других частях растений, подвергающихся обезвоживанию.
К наиболее многочисленной и исследованной группе среди индуцируемых обезвоживанием водорастворимых белков относятся дегидрины. Термин “дегидрины” (англ.: dehydrins – dehydration induced) был предложен для обозначения D-11 семейства или II–группы LEA-белков [13]. LEA-белки и дегидрины индуцируются в ответ на осмотический, холодовой, солевой стрессы, а также на обработку АБК [14–17]. Одним из первых дегидринов, описанных в семенах, был D-11 – белок, накапливающийся в зародышах хлопчатника [18]. В семенах дегидрины назвали также RAB-белками (от англ.: Responsive to Abscisic Acid) [14, 19]. Обнаружение дегидринов у цианобактерий [20] говорит о древности этих белков, а также указывает на их важность для клеток растений, в которых дегидрины сохраняются в процессе эволюции.
Все дегидрины представляют собой гидрофильные, богатые глицином водорастворимые белки, устойчивые к тепловой денатурации. Дегидрины обогащены глицином и полярными аминокислотами, но содержат мало гидрофобных неполярных аминокислот. Дегидрины различаются по своим размерам. Их молекулярные массы, оцениваемые по SDS-электрофорезу, варьируют от 9 кД для дегидрина риса WCI–24 [21] до 200 кД для дегидринов пшеницы WSC200 [22]. Некоторые авторы считают, что оценка по SDS-электрофорезу дает завышенные размеры молекулярных масс, так как термостабильные дегидрины являются структурно неупорядоченными белками (англ.: Intrinsically Disodered Proteins – IDPs) [23, 24] и имеют больший гидродинамический радиус, чем глобулярные белки, что замедляет их движение при миграции в ПААГ (аномальная миграция).
Дегидрины обладают рядом специфических структурных особенностей, которые легли в основу их классификации. Первые данные о полной аминокислотной последовательности были получены для дегидрина риса RAB-21 [15], а также D-11 хлопчатника [18]. В результате полного секвенирования многих дегидринов составлено представление о распространении этих белков и возможности их классификации. Установлено, что по своей аминокислотной последовательности дегидрины не имеют сходства ни с одним из исследованных ферментов.
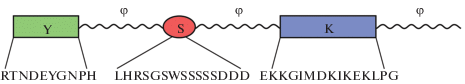
Для дегидринов характерно наличие высококонсервативной лизин-богатой консенсусной последовательности из 15 аминокислот – EKKGIMDKIK-EKLPG, которая для удобства обозначается как К-сегмент [16, 25]. Число К-сегментов варьирует от 1 до 11 копий в исследованных образцах дегидринов. Предполагается, что при уменьшении оводненности К-сегмент дегидринов может участвовать в образовании амфифильной α-спирали. При этом отрицательно заряженные аминокислоты (с кислым pI), такие как аспарагиновая кислота (D) и фенилаланин (F), лежат на одной стороне спирали, гидрофобные (неполярные, такие, как изолейцин (I) и лейцин (L)) лежат на противоположной стороне, а положительно заряженные (с щелочным pI – лизин (K) и аргинин (R)) – в интерфазе между полярными и неполярными аминокислотами [26]. Таким образом, роль К-сегмента может сводиться к образованию гидрофобных взаимодействий дегидринов с частично денатурировавшими белками цитоплазмы или мембран. К-сегмент присутствует во всех исследованных дегидринах, и в настоящее время белки, содержащие К-сегмент, относят к дегидринам [8]. Именно этот мотив, общий для всех дегидринов, был использован для получения антител на дегидрины [8, 11, 25].
Многие дегидрины содержат цепочку сериновых остатков, от 4 до 10, являющихся частью консервативной последовательности LHRSGS4-10(E/D)3, обозначаемой как S-сегмент [6, 8, 11]. Еще одна консервативная последовательность аминокислот (V/T)DEYNP, или Y-сегмент, находится вблизи N-концевого участка большинства дегидринов. Тирозин-богатый Y-сегмент имеет значительный участок последовательности, родственной нуклеотид-связывающему участку белков-шаперонов растений и бактерий [6]. Обозначение “YSK” было использовано для описания различных типов дегидринов, которые различаются количеством копий указанных сегментов (рис. 1). Таким образом, можно выделить 5 типов дегидринов: Kn, SKn, KnS, YmKn, YmSKn.
Большинство исследованных дегидринов относится к типу YnSK2 (n = 1–3). Этот тип дегидринов индуцируется дегидратацией клеток [23]. Дегидрины Kn-типа содержат от одной до одиннадцати копий K-сегмента, не содержат Y- и S-сегментов и строго индуцируются холодом [23]. Тип KnS содержит K-сегмент в количестве 1–3. Дегидрины этого типа индуцируются как холодом, так и дегидратацией [23].
Биоинформатическими методами было идентифицировано 426 дегидриновых последовательностей в 53 геномах покрытосеменных и 3 геномах голосеменных растений [27]. Было показано, что покрытосеменные содержат все пять типов дегидринов (Kn, SKn, KnS, YmKn, YmSKn), тогда как голосеменные – только Kn- и SKn-типы. Авторы предполагают, что древние дегидрины семенных растений содержали только Kn- и SKn-мотивы, а дегидрины, содержащие Y-сегмент, появились впервые у покрытосеменных растений [27].
Все аминокислотные последовательности между Y-, S-, и K-сегментами называют Φ-сегментом [23]. Длина и аминокислотный состав Φ-сегментов значительно варьируют. Φ-сегменты обогащены глицином (17% от общих аминокислотных остатков Φ-сегментов), глутаминовой кислотой (11%), треонином (10%), тогда как фенилаланин, цистеин и триптофан в сумме составляют менее 2% [23]. По-видимому, именно гибкость Φ-сегментов позволяет молекулам дегидринов более тесно взаимодействовать с различными белковыми молекулами и защищать их от абиотических стрессов [23, 26]. Многие дегидрины содержат повторы гистидиновых остатков для контроля гомодимеризации [28, 29], а также заряженные сегменты, участвующие в переносе молекулы дегидрина в ядро и связывании с ДНК [30, 31].
В последнее время выделяют еще один 11-членный консервативный мотив DRGLFDFLGKK, характерный для хвойных и многих покрытосеменных растений [32]. По двум центральным остаткам фенилаланина этот мотив предлагается называть F-сегментом. Соответственно, SKn-дегидрины предлагается классифицировать как FSKn-дегидрины [32]. Следует отметить, что у покрытосеменных обнаруживаются как SKn-, так и FSKn-дегидрины, в то время как у голосеменных SKn-дегидрины отсутствуют, присутствуют только FSKn [32].
Результаты субклеточного фракционирования и иммунолокализации показывают присутствие дегидринов практически во всех клеточных компартментах: цитоплазме, ядре [32], вакуоли, хлоропластах, митохондриях, эндоплазматическом ретикулуме, плазматической мембране [19, 24, 33–35]. Установлено, что переходу дегидринов из цитоплазмы в ядро способствует фосфорилирование S-сегмента его молекулы казеинкиназой 2 [36, 37]. В семенах араукарии (Araucaria angustifolia) дегидрины обнаружены с помощью иммуноблоттинга и иммунолокализации in situ во всех тканях зародышевых осей и семядолей, причем наибольшая концентрация дегидринов наблюдалась в клетках стеблевой апикальной меристемы [38]. Дегидрины были найдены в ядрах, белковых телах, микротельцах (предположительно, пероксисомах) – предполагается, что такое широкое распределение дегидринов по всей клетке способствует их универсальному защитному действию на клеточном уровне [38].
В настоящее время хорошо известно, что в нативном состоянии дегидрины не имеют упорядоченной вторичной структуры и находятся в развернутой (“unfolded”) форме [6, 9, 11, 23, 39–41]. Эта структурная особенность может объяснять главные свойства дегидринов – их значительную термоустойчивость и высокотемпературную растворимость, поскольку термокоагуляция происходит в результате внутримолекулярных взаимодействий между гидрофобными участками белка.
Ferreira с соавт. [42] показали, что дегидрины оказывают влияние на такие свойства воды, как образование диполей/поляризация; способность быть донором водородных связей, подкисляя среду, и способность акцептировать водородные связи, подщелачивая среду. Авторы предполагают, что изменение указанных свойств воды как растворителя может вносить вклад в механизмы защитного действия этих белков. По сравнению с полиэтиленгликолем (ПЭГ), дегидрины более эффективно изменяют способность больших масс воды образовывать водородные связи, чтобы предотвратить денатурацию ферментов. Этим объясняют, почему дегидрины восстанавливают больше ферментативной активности, чем ПЭГ [42].
Ранее было постулировано, что гидрофильные белки обеспечивают стабилизацию коллоидных структур протопласта и предохраняют их от повреждений, вызываемых дегидратацией [43]. В настоящее время существует гипотеза, что дегидрины, чрезвычайно гидрофильные белки, принимают участие в стабилизации цитоплазмы при дегидратации через стабилизацию макромолекул [26]. Гидратированные гидрофильные участки образуют водные оболочки, которые обеспечивают сохранность нативной структуры белков или ингибируют их дальнейшую денатурацию при дегидратации [24, 26, 44]. Дегидрины также могут непосредственно реагировать с частично денатурировавшими белками, вовлекая во взаимодействие гидрофобные участки К-сегмента [44, 45]. Вполне возможно, что дегидрины обеспечивают физическую границу между экспонированным и гидрофобным участками белков и предотвращают тем самым их денатурацию. Рабочая гипотеза сводится к тому, что дегидрины являются солюбилизирующими агентами со свойствами детергентов и шаперонов [46].
К настоящему времени накоплен большой массив экспериментальных данных о роли дегидринов в устойчивости растений к различным стрессовым воздействиям. Некоторые свойства и функции дегидринов приведены в таблице (табл. 1). Интересно отметить, что такие функции дегидринов, как связывание с мембранами (SK3-дегидрин пшеницы WCOR410), криозащита лактатдегидрогеназы (К9-дегидрин ячменя P80/DHN5; Y2K9-дегидрин персика РСА60; SK3-дегидрин мандарина CuCOR19), защита от свободных радикалов (SK3-дегидрин мандарина CuCOR19), связывание ионов металлов (SK2-дегидрин мандарина CuCOR15), фенотипически проявляются как устойчивость растений к холодовому стрессу [26].
Таблица 1.
Некоторые свойства дегидринов, доказанные экспериментально
| Свойство | Растение | Ссылка | Примечание |
|---|---|---|---|
| Связывание К-сегмента с фосфолипидными везикулами, защита клеточных мембран | Кукуруза (Zea mays) | [47, 48] | |
| Связывание с ДНК и РНК в присутствии ионов Zn2+ | Мандарин (Citrus unshiu) | [36] | Дегидрины могут защищать нуклеиновые кислоты в растительных клетках во время созревания семян и при различных стрессах |
| Стабилизация цитоскелета | Теллунгиелла солонцовая (Thellungiella salsuginea) | [49] | Фосфорилированные по S-сегменту дегидрины могут полимеризовать актиновые филаменты, стабилизируя цитоскелет в стрессовых условиях |
| Предотвращение денатурации белков, защита (криозащита) ферментов | Персик (Prunus persica), Мандарин (Citrus unshiu), |
[50] | Дегидрин RAB17 из сухих зародышей кукурузы защищает белки от агрегации под действием теплового стресса |
| Кукуруза (Zea mays), | [51] | ||
| Пшеница (Triticuv aestivum), | [10] | ||
| Ячмень (Hordeum vulgare) | [53] | ||
| Обезвреживание свободных радикалов/активных форм кислорода | Мандарин (Citrus unshiu) | [54] | |
| Связывание ионов Ca, Ni, Cu, Fe, Co, Zn | Мандарин (Citrus unshiu), Арабидопсис (Arabidopsis) |
[54] [55] |
Большое число His-остатков, способных образовывать His-His-пары с сильной металлосвязывающей активностью |
Авторы многих обзоров подчеркивают многофункциональность дегидринов [10, 19, 23, 26, 35, 40, 43–45], которая объясняется отсутствием у них упорядоченной структуры, причем в зависимости от конкретного стрессового фактора или соответствующих лигандов конформация белка (образование альфа-спиралей, например) изменяется, что изменяет функции белка (“moonlighting”) [26, 44].
Универсальная роль дегидринов в защитном ответе растений также обусловлена наличием в промоторах их генов cis-элементов, таких как ABRE (от англ.: Abscisic Acid-Responsive Elements), DRE (от англ.: Dehydration-Responsive Elements), LTRE (от англ.: Low Temperature-Responsive Elements), CRT(C-repeat)-элементов, участвующих в ответах на стрессы [56]. Причем эти cis-элементы могут присутствовать в промоторах как по отдельности, так и вместе [57, 58].
ДЕГИДРИНЫ В ОРТОДОКСАЛЬНЫХ И РЕКАЛЬЦИТРАНТНЫХ СЕМЕНАХ
Из всего рассмотренного выше можно заключить, что дегидрины представляют собой сложное семейство белков с недостаточно хорошо изученными свойствами и функциями. Они накапливаются в тканях растения в ответ на любой внешний стимул, который приводит к обезвоживанию клетки.
С этой точки зрения особый интерес для исследования представляют семена растений. Процесс созревания многих видов семян сопровождается глубоким обезвоживанием, когда влажность снижается до 10% (от сырого веса) при сохранении жизнеспособности зародыша. Такие семена относят к ортодоксальному типу [59]. Обезвоживание ортодоксальных семян при созревании генетически детерминировано, в это время экспрессируются специфические гены (Lea), многие из которых индуцируются АБК [14, 60, 61]. В литературе рассматриваются 3 главные защитные системы, связанные с устойчивостью ортодоксальных семян к высыханию: 1) накопление невосстанавливающих (“non-reducing”) сахаров; 2) LEA-белки, которые индуцируются АБК; 3) способность предотвращать, выдерживать или восстанавливать повреждения, вызванные свободными радикалами [3, с. 61–65].
Дегидрины накапливаются в ортодоксальных семенах при созревании, и это коррелирует с выработкой устойчивости к дегидратации [60, 62]. Так, накопление 35 кД дегидрина в семенах вигны (Vigna uniguiculata) совпадает с началом высыхания семян [62]. В семенах гороха (Pisum sativum) различных генотипов, различающихся по устойчивости к стрессам, охарактеризован ген PsDhn1, кодирующий дегидрин Y2K2-типа с молекулярной массой 21 кД. При этом в семядолях исследуемых семян обнаружен (с помощью иммуноблоттинга) еще один дегидрин с массой 29 кД [63]. При исследовании прорастания семян шпината (Spinacia oleracea) было показано, что дегидрин САР85 накапливался в набухающих семенах при их подсушивании (“осмопрайминг”). При осмопрайминге в семенах накапливаются также дегидрин-подобные белки с молекулярными массами 19, 26 и 30 кД, при этом семена становятся более устойчивыми к абиотическим стрессам [64]. Ген FsDhn1 из семян бука европейского (Fagus silvatica) индуцировался АБК и экспрессировался, когда семена искусственно высушивали [65]. Дегидрин CuCOR15, белок, индуцируемый холодом в семенах мандарина уншиу (Citrus unshiu), или японского мандарина, мог связываться с ДНК и РНК в присутствии ионов цинка. Авторы предполагают, что дегидрин может защищать нуклеиновые кислоты в клетках семян при созревании и ответе на стрессы [36].
Из 10 дегидринов арабидопсиса 5 экспрессируются в семенах: At2g21490 (LEA14; K2SY2); At4g39130 (LEA45; KY); At3g 50970 (XERO2, LTI30; K6); At3g 50980 (XERO1; K2S); At5g 66400 (RAB18; K2SY2) [66]. При прорастании семян дегидрины исчезают, что коррелирует с утратой устойчивости к дегидратации у проросших семян [67]. Soares с соавт. [68] показали, что при прорастании семян аденантеры павлиньей (Adenanthera pavonina) уменьшается фракция термостабильных белков, и именно это может быть причиной потери прорастающими семенами устойчивости к высыханию [68].
Помимо семян ортодоксального типа, существует тип семян, не обладающих устойчивостью к высыханию. Такие семена после созревания сохраняют высокую влажность (более 50% от сырого веса), и снижение ее уровня приводит к потере жизнеспособности семян. Эти семена относятся к рекальцитрантному типу [59]. Рекальцитрантные семена различаются по устойчивости к высыханию в широких пределах [69]. Например, семена клена сахарного (Acer saccharum) более чувствительны к дегидратации, чем семена клена остролистного (A. platanoides) [70].
Поскольку дегидрины рассматриваются как ключевой элемент устойчивости или толерантности к дегидратации, было высказано предположение, что отсутствие устойчивости к высыханию у рекальцитрантных семян является следствием отсутствия в них дегидринов. Действительно, в одной из первых работ, выполненных на рекальцитрантных семенах мангрового дерева авиценнии морской (Аviсеnniа mаrinа), было показано, что термостабильные LЕA–белки, частью которых являются дегидрины, не синтезируются на поздних стадиях созревания [71]. Однако, позже дегидрины были обнаружены в рекальцитрантных семенах дикого риса (Zizаniа раlustris) [72]. В дальнейшем дегидрины были идентифицированы методом иммуноблоттинга в осях и семядолях ряда рекальцитрантных семян древесных растений – дуба (Quercus), каштана европейского (Castanea sativa), каштана конского (Aesculus hippocastanum), некоторых видов клена (Acer) [73–75]. Четыре главных дегидрина, с молекулярными массами 12, 20, 32 и 56 кД, были идентифицированы в семенах дуба при созревании, опадении с деревьев и после влажного хранения [74]. Таким образом, предположение о том, что чувствительность к высыханию у рекальцитрантных семян является следствием отсутствия у них дегидринов, не получило подтверждения. Однако нельзя исключить того, что отсутствие или недостаточное количество какого-то одного из дегидринов может повлечь за собой неспособность рекальцитрантных семян противостоять высыханию, т.к. функции отдельных дегидринов пока остаются неизвестными, а механизм устойчивости к полному высыханию у ортодоксальных семян еще не вполне ясен. Таким образом, очевидно, что одного присутствия дегидринов в рекальцитрантных семенах недостаточно для выработки устойчивости к высыханию. С другой стороны, вполне возможно, что полное отсутствие дегидринов в семени предполагает их неспособность противостоять дегидратации. В связи с этим возникает вопрос о роли дегидринов в рекальцитрантных семенах и возможности существования семян, не содержащих дегидрины.
Исследования, проведенные на рекальцитрантных семенах 16 видов древесных растений, различающихся по систематическому положению, происхождению и условиям обитания, показали, что дегидрины присутствуют во многих из них. Однако в семенах растений влажных тропиков дегидрины не были обнаружены [76]. Это было первое сообщение о возможности существования семян, в которых дегидрины отсутствовали.
Подсушивание (или дегидратация) свежих зародышей рекальцитрантных семян баррингтонии (Barringtonia), в которых дегидрины не были обнаружены, приводило к индукции двух дегидринов с молекулярными массами 16 и 43 кД. А в зародышах авиценнии морской, или черного мангра (Avicennia marina) – мангрового дерева, также обитающего во влажных тропиках и не содержащего дегидрины в семенах, такого ответа на дегидратацию не было [76]. Рекальцитрантные семена заметно различались по числу и размерам обнаруженных в них дегидринов. В зародышевых осях семян австралийского каштана (Castanospermum australe) (среда обитания – тропический лес) были идентифицированы 2 дегидрина с молекулярными массами 50 и 60 кД. В осях семян чая (Camellia sinensis) (умеренно-тропический климат) присутствовал один дегидрин с молекулярной массой 40 кД. Три дегидрина с молекулярными массами 12, 14, 18 кД и 23, 30, 35–55 кД выявлены в осях семян каштана конского Aesculum hippocastanum (умеренно-холодный климат). В осях каштана европейского Castanea sativa (умеренно-холодный климат) обнаружено 2 дегидрина с молекулярными массами 46 и 180 кД [76].
Как уже отмечалось, низкие температуры и обезвоживание вызывают сходные повреждения в вегетативных тканях растений и индуцируют экспрессию дегидриновых генов [16, 17, 19]. Накопление дегидринов способствует выработке устойчивости или толерантности не только к осмотическому, но и низкотемпературному стрессу. Результаты, полученные при анализе дегидринов в рекальцитрантных семенах, позволили авторам выдвинуть предположение, что продуцирование дегидринов в этих семенах может быть вызвано понижением температур в тот или иной период их развития [76]. Действительно, девять видов растений, в семенах которых не удалось обнаружить дегидрины, являлись обитателями влажных тропиков и их семена никогда не подвергались холодовому стрессу. Семь других видов, в семенах которых присутствовали дегидрины, обитали в умеренно-теплом и умеренно-холодном климате, и их семена в той или иной степени подвергались действию низких температур в процессе развития [76]. По всей видимости, дегидрины в рекальцитрантных семенах обеспечивают защиту клеточных структур от повреждений, вызванных низкотемпературным стрессом.
Известно, что АБК связана с преодолением растением внешних стрессов и индуцирует накопление дегидринов [14, 15, 77]. Интересно отметить, что все виды рассматриваемых семян [76], у которых отсутствовали дегидрины, имели низкое содержание АБК (меньше 50 нг/г сухого веса). У других видов, где дегидрины присутствовали, содержание АБК было сравнительно высоким (более 250 нг/г сухого веса), принудительное обезвоживание или подсушивание семян, не содержащих дегидрины, приводило к их накоплению и повышению содержания АБК [76]. В рекальцитрантных семенах тропических видов австралийского каштана Castanospermum australe и трихилии (красного дерева) Trichilia dregeana содержание и состав дегидринов менялись в ходе созревания семян, как и чувствительность к АБК [78].
Результаты анализа рекальцитрантных семян указывают также на то, что присутствие или отсутствие дегидринов (и их размеры) не связано с эволюционным статусом семейств растений, семена которых были исследованы [76]. Так, дегидрин-подобные белки присутствовали в семенах эволюционно-примитивного вида араукарии бразильской (Araucaria angustifolia) [38, 76], в то время как в семенах более эволюционно продвинутого вида авиценнии морской (Avicennia marina) дегидрины не выявлялись [76], но позднее все-таки были обнаружены, причем в листьях их накопление вызывалось только осмотическим стрессом, а в корнях еще и солевым [79].
Как уже отмечалось, дегидрины представляют собой чрезвычайно устойчивые к тепловой денатурации белки [6, 44]. В рекальцитрантных семенах каштана конского (Aesculus hippocastanum L.) термостабильные белки составляют около 30% растворимых белков цитозоля в зародышевых осях и более 80% – в семядолях [80, 81].
Полученные нами [75] для семян каштана конского результаты показали, что во фракции термостабильных белков действительно присутствуют дегидрин-подобные белки, что подтверждает данные других исследователей. Во всех случаях дегидрин-подобные белки выявлялись в виде одной яркой полосы в зоне молекулярных масс около 50 кД [74]. Низкомолекулярные термостабильные белки (25 кД и ниже 16 кД), которыми богата исследуемая фракция, не давали иммунологической реакции на дегидрины. В этом отношении полученные нами результаты отличаются от имеющихся в литературе [73, 76].
Дегидрины были обнаружены нами во всех частях зародыша: в клетках осевых органов, запасающей паренхимы семядолей и черешков семядольных листьев, что указывает на отсутствие тканевой специфичности в распределении этих белков в семенах конского каштана. Однако относительное содержание дегидринов в разных частях зародыша было различным: максимальный дегидриновый сигнал давали зародышевые оси, минимальный – семядоли [75].
Дегидрины выявлялись среди термостабильных белков на протяжении всей стратификации семян, определялись также в наклюнувшихся семенах. При наклевывании семян уменьшалась не только сама фракция термостабильных белков, но и относительное содержание в ней дегидринов. Неожиданным и пока труднообъяснимым оказался тот факт, что в незрелых семенах, еще не опавших с дерева, обнаружить дегидрины не удалось. При искусственном проращивании изолированных зародышевых осей дегидрины исчезали, как и при прорастании целых семян. Если рост изолированных осей ингибировался экзогенной АБК, то дегидрины сохранялись в белковом спектре. Пока нет прямых экспериментальных данных о том, задерживает ли АБК утилизацию дегидрина, или индуцирует его синтез de novo [75].
При анализе суммарных белков гомогената семян каштана конского помимо 50 кД термостабильного дегидрина анти-дегидриновые антитела выявили еще один компонент с молекулярной массой около 80 кД, который локализован во фракции неустойчивых к тепловой денатурации белков, вследствие чего и назван нами дегидрин-подобным белком [75]. Обнаружение термолабильного дегидрин-подобного белка – довольно редкий случай. Farias-Soares с соавт. [38] обнаружили два термолабильных дегидрина с молекулярными массами 16 и 35 кД в осях и семядолях семян араукарии (Araucaria angustifolia), еще один термолабильный дегидрин (10 кД) был найден только в семядолях [38]. Таким образом, рекальцитрантные семена многих видов растений, подобно ортодоксальным семенам, способны продуцировать дегидрины, но при этом остаются чувствительными к потере воды и не могут противостоять глубокому обезвоживанию, как это делают семена ортодоксального типа.
Авторы двух обзоров по дегидринам в ортодоксальных и рекальцитрантных семенах [82, 83] жестко привязывают появление дегидринов в семенах при созревании к процессу высыхания семян. Ортодоксальные семена синтезируют и накапливают дегидрины при высыхании (maturation drying), дегидрины присутствуют в сухих семенах при хранении, в сухом состоянии семена могут храниться годами, не теряя жизнеспособности. “Типичные” (по мнению авторов) рекальцитрантные семена, такие как авиценния (Avicennia), бругиера (Bruguiera) из-за отсутствия генетически детерминированного высыхания не накапливают дегидрины в процессе эмбриогенеза, дегидрины в них не появляются и при хранении – если семена высыхают, они погибают [82, 83]. Авторы также выделяют “атипичные” рекальцитрантные семена (камелия Camellia, каштан Castanea, эвтерпа Euterpe, дуб Quercus), которые в конце эмбриогенеза претерпевают ограниченную дегидратацию и накапливают небольшое (по сравнению с ортодоксальными семенами) количество дегидринов. Такие семена могут храниться несколько месяцев (дегидрины при этом сохраняются), но в результате все равно погибают. Интермедиантные [84] семена (кофе Coffea, баррингтония Barringtonia) не синтезируют дегидрины в конце эмбриогенеза, но при хранении и частичном высыхании дегидрины в них появляются [82, 83], семена выживают.
Нельзя не согласиться с авторами [82, 83], что рекальцитрантность – такое же эволюционное приспособление к жизни в жарких влажных тропиках (где семени нужно как можно быстрее прорасти, чтобы уберечься от плесневых грибов, патогенных бактерий и т.п.), как и устойчивость к высыханию у ортодоксальных семян видов умеренного и холодного климата со сменой времен года (где прорастание в неблагоприятных для роста проростка климатических условиях приведет к его гибели). Однако авторы не видят разницы между реакцией клеток листа на засуху и высыханием семян в конце созревания [82, 83]. Следует заметить, что для листа засуха наступает неожиданно, а высыхание ортодоксальных семян определено генетически, влажность семян в конце созревания снижается даже внутри сочных плодов [85]. Транскрипты дегидринов появляются в ортодоксальных семенах в середине созревания, когда влажность семян еще высока [3, с. 64; 14]. Кроме того, имеются указания о конститутивном характере синтеза некоторых дегидринов в плодах и семенах [86]. Так, в листьях, плодах и семенах фасоли два дегидрина (73 и 82 кД) синтезировались конститутивно, при созревании семян их синтез усиливался. Три других дегидрина (22, 36 и 63 кД) экспрессировались в конце созревания семян, причем независимо от того, подвергались ли растения искусственной засухе, или нет [86]. Вполне возможно, что условия созревания семян (сумма температур, количество осадков) могут индуцировать экспрессию генов дегидринов, но одних только дегидринов, как уже отмечалось, недостаточно для устойчивости семян к обезвоживанию.
Следует признать, что, несмотря на множество работ по изучению роли дегидринов в растениях и, в частности, в семенах, многие аспекты функционирования этих белков еще предстоит выяснить. Перспективным представляются исследования близкородственных видов, имеющих ортодоксальные и рекальцитрантные семена [60, 87]. Причем анализ чувствительных к обезвоживанию рекальцитрантных семян может быть более полезен для выявления функций дегидринов.
При исследовании трех видов клена (Acer), имеющих ортодоксальные и рекальцитрантные семена, было обнаружено, что три дегидрина (23, 35 и 46 кД) присутствовали в зрелых и подсушенных семенах обоих типов [87]: в ортодоксальных семенах клена остролистного (A. platanoides), в рекальцитрантных семенах клена белого, или явора (A. pseudoplatanus) и клена сахарного (A. saccharum). В зародышевых осях семян содержание дегидринов было больше, чем в семядолях. В ортодоксальных семенах A. рlatanoides содержание дегидринов возрастало при снижении влажности семян. Содержание дегидринов и их компонентный состав в рекальцитрантных семенах клена белого и клена сахарного различались в разные годы, причем выявить, что важнее – генетический потенциал или внешние условия, в которых созревали семена, пока не представляется возможным [87].
Группой французских исследователей [60] был охарактеризован термостабильный протеом рекальцитрантных семян австралийского каштана (Castanospermum australe), тропического древесного вида, произрастающего в восточной части Австралии, а также в Южной Африке. C. australe филогенетически близок (относится к тому же подсемейству) к модельному бобовому растению люцерне усеченной (Medicago truncatula), имеющему ортодоксальные семена, что позволяет сравнивать их белки, хотя геном C. australe пока не секвенирован. Термостабильные LEA-белки M. truncatula были подробно охарактеризованы ранее [88, 89], причем были найдены белки, связанные с устойчивостью к дегидратации. При сравнении бобовых с ортодоксальными (M. truncatula) и рекальцитрантными (C. australe) семенами [60] были обнаружены 12 LEA-генов (из 16 гомологов), полипептиды которых отсутствовали или их содержание было сильно снижено в рекальцитрантных семенах C. australe. При этом другие дегидрины, индуцируемые осмотическим стрессом и не являвшиеся специфичными для семян, накапливались в рекальцитрантных семенах даже в больших количествах, чем в ортодоксальных. Авторы охарактеризовали также мутант M. truncatula по гену ABI3 (англ.: Abscisic Acid Insensitive 3). Зрелые семена Mtabi3 были чувствительны к обезвоживанию, и в их протеоме были сильно редуцированы те же LEA-белки, которые отсутствовали или были подавлены в семядолях рекальцитрантных семян Castanospermum australe [60]. Авторы обсуждают возможные пути и механизмы регуляции накопления LEA-белков, важных для устойчивости к обезвоживанию.
ЗАКЛЮЧЕНИЕ
Когда миллионы лет назад растения заселяли сушу, им пришлось выработать широкий спектр адаптивных приспособлений к различным абиотическим стрессам. Так как многие из этих стрессов приводят к дегидратации клеток, термостабильные стресс-индуцируемые белки, уже имевшиеся у цианобактерий [20], очень пригодились для выживания в новых условиях.
Обезвоживание, то есть удаление воды из клеток, вызывает необратимые изменения, приводящие к агрегации макромолекул. Накапливающиеся в семенах при созревании белки позднего эмбриогенеза (LEA-белки), в частности, дегидрины, помогают предотвратить агрегацию клеточных белков при прогрессирующем обезвоживании. Предполагаемый механизм действия дегидринов включает аминокислоты Φ-сегмента, который важен для поддержания развернутой (неупорядоченной) структуры молекул термостабильных гидрофильных дегидринов, что позволяет им функционировать как молекулярные щиты и предотвращать взаимодействие частично денатурированных молекул белков друг с другом.
Семена высших растений предназначены для хранения (и сохранения генетического материала) и имеют специфические, очень мощные механизмы устойчивости к высыханию и выживанию в воздушно-сухом состоянии. Что касается неустойчивых к высыханию рекальцитрантных семян, то дегидрины в них помогают при солевом стрессе, как это описано для тропических мангровых [79], или при низкотемпературном, как это предполагается для рекальцитрантных семян древесных растений умеренного климата, таких как дуб черешчатый [73, 74], каштан конский [73, 75]. Именно гидрофильные дегидрины и другие LEA-белки могут не только предохранять клеточные структуры зародыша от существенной потери влаги (что является для рекальцитрантных семян смертельным), но и могут обеспечивать устойчивость высокооводненных семян к длительному холодовому стрессу под снегом в зимних условиях средней полосы.
Автор заявляет об отсутствии конфликта интересов. Настоящий обзор не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Palta J.P. Stress interactions at the cellular and membrane levels // Hort. Sci. 1990. V. 25. № 11. P. 1377.
Levitt J. Responses of plants to environmental stresses. 2nd Edition. Vol. 1. Chilling, freezing and high temperature stresses. 1980. N.Y.: Academic Press. 510 p.
Bewley D.J., Bradford K.J., Hilhorst H.W.M., Nonogaki H. Seeds. Physiology of Development, Germination and Dormancy. Third Edition. 2013. N.Y., Heidelberg, Dordrecht, London: Springer. 392 p.
Bray E.A. Molecular responses to water deficit // Plant Physiol. 1993. V. 103. P. 1035.
Beck E.H., Fettig S., Knake C., Hartig K., Bhattarai T. Specific and unspecific responses of plants to cold and drought stress // J. Biosci. 2007. V. 32. P. 501.
Close T.J. Dehydrins: emergence of a biochemical role of a family of plant dehydration proteins // Physiol. Plant. 1996. V. 97. P. 795.
Dure L. III, Greenway S.C., Galau G.A. Developmental biochemistry of cottonseed embryogenesis and germination – changing messenger ribonucleic acid population as shown by in vitro and in vivo protein synthesis // Biochem. 1981. V. 20. P. 4162.
Аллагулова Ч.Р., Гималов Ф.Р., Шакирова Ф.М., Вахитов В.А. Дегидрины растений: их структура и предполагаемые функции // Биохимия. 2003. Т. 68. С. 1157.
Battaglia M., Olvera-Carrillo Y., Garciarrubio A., Campos F., Covarrubias A.A. The enigmatic LEA proteins and other hydrophillins // Plant Physiol. 2008. V. 148. P. 6. https://doi.org/10.1104/pp.108.120725
Amara I., Zaidi I., Masmoudi K., Ludevid M.D., Pagès M., Goday A., Brini F. Insights into late embryogenesis abundant (LEA) proteins in plants: from structure to the functions // Am. J. Plant Sci. 2014. V. 5. P. 3440. https://doi.org/10.4236/ajps.2014.522360
Rorat T. Plant dehydrins – tissue location, structure and function // Cell Mol. Biol. Lett. 2006. V. 11. P. 536. https://doi.org/0.2478/s11658-006-0044-0
Tunnacliffe A. and Wise M.J. The continuing conundrum of the LEA proteins // Naturwissenschaften. 2007. V. 94. P. 791.
Close T.J., Kortt A.A., Chandler P.M. A cDNA-based comparison of dehydration-induced proteins (dehydrins) in barley and corn // Plant Mol. Biol. 1989. V. 13. P. 95.
Galau G.H., Huges D.W., Dure L. III. Abscisic acid induction of cloned cotton late embryogenesis-abundant (LEA) mRNAs // Plant Mol. Biol. 1986. V. 7. P. 150.
Mundy J., Chua N.-H. Abscisic acid and water-stress induce the expression of a novel rice gene // EMBO J. 1988. V. 7. P. 2279.
Close T.J. Dehydrins: a commonality in the response of plants to dehydration and low temperature // Physiol. Plant. 1997. V. 100. P. 291. https://doi.org/10.1111/j.1399-3054.1997.tb.04785.x
Шакирова Ф.М., Аллагулова Ч.Р., Безрукова М.В., Авальбаев А.М., Гималов Ф.Р. Роль эндогенной АБК в индуцируемой холодом экспрессии TADHN гена дегидрина в проростках пшеницы // Физиология растений. 2009. Т. 56. С. 796.
Baker J., Steele C., Dure L. III. Sequence and characterization of 6 LEA proteins and their genes from cotton // Seed Sci. Res. 1988. V. 5. P. 185.
Borovskii G.B., Stupnikova I.V., Antipina A.I., Vladimirova S.V., Voinikov V.K. Accumulation of dehydrin-like proteins in the mitochondria of cereals in response to cold, freezing, drought and ABA treatment // BMC Plant Biol. 2002. V. 2. P. 5.
Close T.J., Lammers P.J. An osmotic stress protein of cyanobacteria is immunologically related to plant dehydrins // Plant Physiol. 1993. V. 101. P. 773.
Takahashi R., Joshee N., Kitagawa Y. Induction of chilling resistance by water stress, and cDNA sequence analysis and expression of water stress-regulated genes in rice // Plant Mol. Biol. 1994. V. 26. P. 339.
Ouelett F., Houde M., Sarhan F. Purification, characterization and cDNA cloning of the 200 kDa protein induced by cold acclimation in wheat // Plant Cell Physiol. 1993. V. 34. P. 59.
Graether S.P., Boddington K.F. Disorder and function: a review of the dehydrin protein family // Front. Plant Sci. 2014. V. 5. Art. 1. https://doi.org/10.3389/fpls.2014.00576
Clarke M.W., Boddington K.F., Warnica J.M., Atkinson J., McKenna S., Madge J., Barker C.H., Graether S.P. Structural and functional insights into the cryoprotection of membranes by the intrinsically disordered dehydrins // J. Biol. Chem. 2015. V. 290. № 45. P. 26900.
Close T.J., Fenton R.D., Moonan F. A view of plant dehydrins using antibodies specific to the carboxy terminal peptide // Plant Mol. Biol. 1993. V. 23. P. 279.
Hanin M., Brini F., Ebel C., Toda Y., Takeda S., Masmoudi K. Plant dehydrins and stress tolerance // Plant Signaling Behav. 2011. V. 6. P. 1503. https://doi.org/10.4161/psb.6.10.17088
Riley A.C., Ashlock D.A., Graether S.P. Evolution of the modular, disordered stress proteins known as dehydrins // PLoS ONE. 2019. V. 14: e0211813. https://doi.org/10.1371/journal.pone.0211813
Hernandez-Sanchez I.E., Martynowicz D.M., Rodriguez-Hernandez A.A., Perez-Morales M.B., Graether S.P., Jimenez-Bremont J.F. A dehydrin-dehydrin interaction: the case of SK3 from Opuntia streptacantha // Front Plant Sci. 2014. V. 5. Art. 520.
Eriksson S., Eremina N., Barth A., Danielsson J., Harryson P. Membrane-induced folding of the plant stress dehydrin Lti30 // Plant Physiology. 2016. V. 171. P. 932.
Rosales R., Romero I., Escribano M.I., Merodio C., Sanchez-Ballesta M.T. The crucial role of F- and K-segments in the in vitro functionality of Vitis vinifera dehydrin DHN1a // Phytochemistry. 2014. V. 108. P. 17.
Hernandez-Sanchez I.E., Maruri-Lopez I., Ferrando A., Carbonelly J., Graether S.P., Jimenez-Bremont J.F. Nuclear localization of the dehydrin OpsDHN1 is determined by histidine-rich motif // Front. Plant Sci. 2015. V. 6. Art. 702.
Strimbeck G.R. Hiding in plain sight: The F segment and other conserved features of seed plant SKn dehydrins // Planta. 2017. V. 245. P. 1061. https://doi.org/10.1007/s00425-017-2679-7
Yang W., Zhang L., Lv H., Li H., Zhang Y., Xu Y., Yu J. The K-segment of wheat dehydrin WZY2 are essential for its protective functions under temperature stress // Front. Plant Sci. 2015. V. 6. Art. 406
Kalemba E.M., Litkowiec M. Functional characterization of a dehydrin protein from Fagus silvatica seeds using experimental and in silico approaches // Plant Physiol. Biochem. 2015. V. 97. P. 246.
Yu Zh., Wang X., Zhang L. Structural and functional dynamics of dehydrins: a plant protector protein under abiotic stress // Int. J. Mol. Sci. 2018. V. 19. P. 1. https://doi.org/10.3390/ijms19113420
Hara M., Shinoda Y., Tanaka Y., Kuboi T. DNA binding of citrus dehydrin promoted by zinc ion // Plant Cell Environ. 2009. V. 32. P. 532. https://doi.org/10.1111/j.1365-3040.2009.01947.x
Alsheikh M.K., Heyen B.J., Randal S.K. Ion binding properties of the dehydrin ERD14 are dependent upon phosphorilation // J. Biol. Chem. 2003. V. 278. P. 40882.
Farias-Soares F.L., Burrieza H.P., Steiner N., Maldonado S., Guerra M.P. Immunoanalysis of dehydrins in A-raucaria angustifolia embryos // Protoplasma. 2013. V. 250. P. 911. https://doi.org/10.1007/s00709-012-0474-7
Kalemba E.M., Pukacka S. Possible role of LEA proteins and sHSPs in seed protection: a short review // Biol. Lett. 2007. V. 44. P. 3.
Hara M. The multifunctionality of dehydrins // Plant Signaling Behav. 2010. V. 5. P. 503.
Abedini R., GhaneGolmohammadi F., PishkamRad R., Pourabed E., Jafarnezhad A., Shobbar Z.-S., Shahbazi M. Plant dehydrins: shedding light on structure and expression patterns of dehydrin gene family in barley // J. Plant Res. 2017. V. 130. P. 747. https://doi.org/10.1007/s10265-017-0941-5
Ferreira L.A., Walezyk Mooradally A., Zaslavsky B., Uversky V.N., Graether S.P. Effect of an intrinsically disordered plant stress protein on the properties of water // Biophys. J. 2018. V. 115. № 6. P. 1696. https://doi.org/10.1016/j.bpj.2018.09.014
Chakrabortee S., Boschetti C., Walton L.J., Sarkar S., Rubinsztein D.C., Tunnacliffe A. Hydrophilic protein associated with desiccation tolerance exhibits broad protein stabilization function // PNAS. 2007. V. 104. P. 18073. https://doi.org/10.1073/pnas.0706964104
Kosová K., Prášil I.T., Vitámvás P. Role of dehydrins in plant stress response / Handbook of Plant and Crop Stress, Third Edition / Ed. M. Pessaracli. CRC Press (Bosa Raton–London–New York). 2010. P. 239.
Liu Y., Song Q., Li D., Yang X., Li D. Multifunctional roles of plant dehydrins in response to environmental stress // Front. Plant Sci. 2017. V. 8. Art. 1018. https://doi.org/10.3389/flps.2017.01018
Kovacs D., Kalmar E., Torok Z., Tompa P. Chaperon activity of ERD10 and ERD14, two disordered stress-related plant proteins // Plant Physiol. 2008. V. 147. P. 381. https://doi.org/10.1104/pp.108.118208
Koag M.Ch., Wilkens S., Fenton R.D., Resnik J., Vo E., Close T.J. The K-segment of maize DHN1 mediates binding to anionic phospholipid vesicles and concomitant structural changes // Plant Physiol. 2009. V. 150. P. 1503.
Eriksson S.K., Kutzer M., Procek J., Gröbner G., Harryson P. Tunable membrane binding of the intrinsically disordered dehydrin Lti30, a cold-induced plant stress protein // Plant Cell. 2011. V. 23. P. 2391.
Rahman L.N., Bamm V.V., Voyer J.A.M., Smith G.S.T., Chen L., Yaish M.W., Moffatt B.A., Dutcher J.R., Harauz G. Zinc induces disorder-to-order transitions in free and membrane-associated Thellungiella salsuginea dehydrins TsDHN-1 and TsDHN-2: a solution CD and solid-state ATR-FTIR study // Amino Acids. 2011. V. 40. P. 1485. https://doi.org/10.1007/s00726-010-0759-0
Wisniewski M., Webb R., Balsamo R., Close T.J., Yu X.M., Griffith M. Purification, immunolocalization, cryoprotective, and antifreeze activity of PCA60: a dehydrin from peach (Prunus persica) // Physiol. Plant. 1999. V. 105. P. 600. https://doi.org/10.1034/j.1399-3054.105402.x
Amara I., Odena A., Oliveira E., Moreno A., Masmoudi Kh., Pagés M., Goday A. Insights into maize LEA proteins: from proteomics to functional approaches // Plant Cell Physiol. 2012. V. 53. P. 312. https://doi.org/10.1093/pcp/pcr183
Kosová K., Vitámvás P., Prášilová P., Prášil I.T. Accumulation of WCS120 and DHN5 proteins in differently frost-tolerant wheat and barley cultivars grown under a broad temperature scale // Biol. Plant. 2013. V. 57. P. 105.
Kosová K., Vitámvás P., Prášil I.T. Wheat and barley dehydrins under cold, drought and salinity – what can LEA-II proteins tell us about plant stress response? // Front. Plant Sci. 2014. V. 5. Art. 343. https://doi.org/10.3389/fpls.2014.00343
Hara M., Kondo M., Kato T. A KS-type dehydrin and its related domains reduce Cu-promoted radical generation and the histidine residues contribute to the radical-reducing activities // J. Exp. Bot. 2013. V. 64. P. 1615.
Svensson J., Palva E.T., Welin B. Purification of recombinant Arabidopsis thaliana dehydrins by metal ion affinity chromatography // Protein Exp. Purif. 2000. V. 20. P. 169.
Liu Q., Kasuga M., Sakuma Y., Abe H., Miura S., Yamaguchi-Shinozaki K., Shinozaki K. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought- and low-temperature-responsive gene expression, respectively, in Arabidopsis // The Plant Cell. 1998. V. 10. P. 1391.
Chung S., Parish R.W. Combinatorial interactions of multiple cis-elements regulating the induction of the Arabidopsis XERO2 dehydrin gene by abscisic acid and cold // Plant J. 2008. V. 54. P. 15.
Yu Zh., Wang X., Zhang L. Structural and functional dynamics of dehydrins: a plant protector protein under abiotic stress // Int. J. Mol. Sci. 2018. V. 19. № 3420. P. 1. https://doi.org/10.3390/ijms19113420
Roberts E.H. Predicting the storage life of seeds // Seed Sci. Technol. 1973. V. 1. P. 499.
Delahaie J., Hundertmark M., Bove J., Leprince O., Rogniaux H., Buitink J. LEA polypeptide profiling of recalcitrant and orthodox legume seeds reveals ABI3-regulated LEA protein abundance linked to desiccation tolerance // J. Exp. Bot. 2013. V. 64. P. 4559. https://doi.org/10.1093/jxb/ert274
Hanana M., Daldoul S., Fouquet R., Deluc L., Leon C., Hoefer M., Barrieu F., Ghorbel A. Identification and characterization of seed-specific grapevine dehydrin involved in abiotic stress response within tolerant varieties // Turkish J. Bot. 2014. V. 38. P. 1157.
Ismail A.M., Hall A.E., Close T.J. Purification and partial characterization of a dehydrin involved in chilling tolerance during seedling emergence of cowpea // Plant Physiol. 1999. V. 120. P. 237.
Haider A. Characterization and expression of dehydrins in wild Egyptian pea (Pisum sativum L.) // African J. Biotech. 2012. V. 11. № 55. P. 11789.
Chen K., Fessehaieb A., Arora R. Dehydrin metabolism is altered during seed osmopriming and subsequent germination under chilling and desiccation in Spinacia oleracea L. cv. Bloomsdale: Possible role in stress tolerance // Plant Sci. 2012. V. 183. P. 27.
Jiménez J.A., Alonso-Ramírez A., Nicolás C. Two cDNA clones (FsDhn1 and FsClo1) up-regulated by ABA are involved in drought responses in Fagus silvatica L. seeds // J. Plant Physiol. 2008. V. 165. № 17. P. 1798.
Leprince O., Pellizzaro A., Berriri S., Buitink J. Late seed maturation: drying without dying // J. Exp. Bot. 2017. V. 68. P. 827. https://doi.org/10.1093/jxb/erw363
Kermode A.R., Finch-Savage W.E. Desiccation sensitivity in orthodox and recalcitrant seeds in relation to development / In: Desiccation and Survival in Plants: Drying without Dying (Black M. and Pritchard H.W., eds). CABI Publishing. 2002. P. 149.
Soares G.C.M., Dias D.C.F.S. Faria J.M.R., Borges E.E.L. Physiological and biochemical changes during the loss of desiccation tolerance in germinating Adenanthera pavonina L. seeds. // Anais da Academia Brasileira de Ciências (Ann. Brazilian Acad. Sci.). 2015. V. 87. P. 2001.
Berjak P., Pammenter N.W. Recalcitrance is not an all-or-nothing situation // Seed Sci. Res. 1994. V. 4. P. 263.
Pukacka S., Ratajczak E. Antioxidative response of ascorbateglutathione pathway enzymes and metabolites to desiccation of recalcitrant Acer saccharinum seeds // J. Plant Physiol. 2006. V. 163. P. 1259.
Farrant J.M., Berjak P., Pammenter N.W. Proteins in development and germination of a desiccation sensitive (recalcitrant seed) species // Plant Growth Regul. 1992. V. 11. P. 257.
Bradford K.J., Chandler P.M. Expression of “dehydrin-like” proteins in embryos and seedlings of Zizania palustris and Oryza sativa during dehydration // Plant Physiol. 1992. V. 93. P. 488.
Finch-Savage W.E., Pramanik S.K., Bewly J.D. The expression of dehydrin proteins in desiccation-sensitive (recalcitrant) seeds of temperate trees // Planta. 1994. V. 193. P. 478.
Šunderlíková V., Salaj J., Kopecky D., Salaj T., Wilhem E., Marušíková I. Dehydrin genes and their expression in recalcitrant oak (Quercus robur) embryos // Plant Cell Rep. 2009. V. 28. P. 1011. https://doi.org/10.1007/s00299-009-0710-6
Гумилевская Н.А., Азаркович М.И. Идентификация и характеристика дегидринов в рекальцитрантных семенах конского каштана // Физиология растений. 2010. Т. 57. С. 918.
Farrant J.M., Pammenter N.W., Berjak P., Farnsworth E.J., Vertucci C.W. Presence of dehydrin-like proteins and level of abscisic acid in recalcitrant (desiccation sensitive) seeds may be related to habitat // Seed Sci. Res. 1996. V. 6. P. 175.
Talanova V.V., Titov A.F. Endogenous abscisic-acid content in cucumber leaves under the influence of unfavorable temperature and salinity // J. Exp. Bot. 1994. V. 45. P. 1031. https://doi.org/10.1093/jxb/45.7.1031
Han B., Berjak P., Pammenter N., Farrant J., Kermode A.R. The recalcitrant plant species, Castanospermum australe and Trichilia dregeana, differ in their ability to produce dehydrin-related polypeptides during seed maturation and in response to ABA or water-deficit-related stresses // J. Exp. Bot. 1997. V. 48. P. 1717.
Mehta P.A., Rebala K.C., Venkataraman G., Parida A. A diurnally regulated dehydrin from Avicennia marina that shows nucleo-cytoplasmic localization and is phosphorylated by casein kinase II in vitro // Plant Physiol. Biochem. 2009. V. 47. P. 701.
Гумилевская Н.А., Азаркович М.И., Комарова М.Е., Обручева Н.В. Белки осевых органов покоящихся и прорастающих семян конского каштана: 1. Общая характеристика белков // Физиология растений. 2001. Т. 48. С. 5.
Азаркович М.И., Гумилевская Н.А. Анализ белков семядолей зрелых семян конского каштана // Физиология растений. 2006. Т. 53. С. 711.
Kleinwächter M., Radwan A., Hara M., Selmar D. Dehydrin expression in seeds: an issue of maturation drying // Front. Plant Sci. 2014. V. 5. Art. 402.
Radwan A., Hara M., Kleinwächter M., Selmar D. Dehydrin expression in seeds and maturation drying: a paradigm change // Plant Biol. 2014. V. 16. P. 853. https://doi.org/10.1111/plb.12228
Ellis R.H., Hong T.D., Roberts E.H. An intermediate category of seed storage behaviour? I. Coffee. // J. Experimental Botany. 1990. V. 41. P. 1167.
Прокофьев А.А. Формирование семян как органов запаса. 27-ое Тимирязевское чтение. М.: Наука, 1968. 52 с.
Castañeda-Saucedo M.C., Córdova-Téllez L., Tapia-Campos E., Delgado-Alvarado A., González-Hernández V.A., Santacruz-Varela A., Loza-Tavera H., García-de-los-Santos G., Vargas-Suárez M. Dehydrins patterns in common bean exposed to drought and watered conditions // Rev. Fitotec. Mex. 2014. V. 37. № 1. P. 59.
Kalemba E.M., Pukacka S. Association of protective proteins with dehydration and desiccation of orthodox and recalcitrant category seeds of three Acer genus species // J. Plant Growth Regul. 2012. V. 31. P. 351. https://doi.org/10.1007/s00344-011-9246-4
Boudet J., Buitink J., Hoekstra F.A., Rogniaux H., Larré C., Satour P., Leprince O. Comparative analysis of the heat stable proteome of radicles of Medicago truncatula seeds during germination identifies late embryogenesis abundant proteins associated with desiccation tolerance // Plant Physiol. 2006. V. 140. P. 1418.
Chatelain E., Hundertmark M., Leprince O., Le Gall S., Satour P., Deligny-Penninck S., Rogniaux H., Buitink J. Temporal profilling of the heat-stable proteome during late maturation of Medicago truncatula seeds identifies a restricted subset of late embryogenesis abundant proteins associated with longevity // Plant Cell Environ. 2012. V. 35. P. 1440.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений