Физиология растений, 2020, T. 67, № 3, стр. 329-336
Влияние бактерий рода Bacillus на активность патогениндуцируемых белков и устойчивость пшеницы к возбудителю твердой головни Tilletia caries (DC.) Tull
Л. Г. Яруллина a, b, *, Г. Ф. Бурханова a, В. О. Цветков b
a Институт биохимии и генетики – обособленное структурное подразделение
Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
Башкирский государственный университет
Уфа, Россия
* E-mail: yarullina@bk.ru
Поступила в редакцию 19.07.2019
После доработки 07.10.2019
Принята к публикации 09.10.2019
Аннотация
Изучено влияние предпосевной обработки семян бактериями Bacillus subtilis Cohn и B. thuringiensis Berliner на рост проростков пшеницы Triticum aestivum L. и Tr. timopheevii Zhuk., генерацию в них пероксида водорода (Н2О2) и активность патогениндуцируемых белков (PR-белков) (оксалатоксидазы (ОхО), пероксидазы (ПО), ингибитора протеиназы (ИП), хитиназы) при инфицировании возбудителем твердой головни Tilletia caries (DC.) Tull. Выявлено снижение негативного влияния Til. caries на рост проростков и степень их пораженности патогеном под влиянием бактерий Bacillus spp. Повышение устойчивости растений к Til. caries было опосредовано их стимулирующим действием на концентрацию Н2О2 и активность ОхО и ПО, усилением транскрипционной активности гена хитиназы TaChiI. Выявлены различия в активации транскрипционной активности гена ингибитора протеиназы TaPI в проростках мягкой пшеницы под воздействием штаммов B. subtilis, B. thuringiensis и их смеси, что свидетельствует о различных путях формирования устойчивости пшеницы к Til. caries, которые могут быть связаны с природой организма-продуцента.
ВВЕДЕНИЕ
Инфекционные болезни растений ежегодно наносят значительный ущерб продуктивности сельскохозяйственных культур. Особенно велики потери урожая от грибных болезней. Среди головневых грибов мягкую пшеницу поражает в основном Tilletia caries (DC.) Tul. Til. caries проникает в растение главным образом через колеоптиль в течение нескольких суток после прорастания инфицированной зерновки. До начала налива зерна болезнь развивается бессимптомно, а гифы патогена в тканях растения-хозяина встречаются крайне редко, что весьма затрудняет исследование защитных механизмов к патогену и поиск индукторов устойчивости [1]. Известно, что в тканях устойчивых растений в ранние сроки онтогенеза мицелия головневых грибов наблюдается недоразвитость мицелия, вакуолизация, нарушение строения клеточной стенки и лизис [2].
Основным требованием современного растениеводства является использование для защиты растений от болезней и вредителей экологически безопасных препаратов, основу которых составляют стимулирующие рост растений бактерии (СРРБ) (или PGPB от Plant Growth Promoting Bacteria). Особо привлекательными в связи с этим являются высокоэффективные, нетребовательные к средам культивирования и сохраняющие в течение длительного срока свою жизнеспособность бактерии-эндофиты из рода Bacillus. При этом бактерии рода Bacillus, на основе которых разработаны препараты Фитоспорин и Битоксибациллин (БТБ), рассматриваются как перспективные агенты биологического контроля болезней и вредителей растений в силу их широко распространенного природного антагонизма ко многим фитопатогенным грибам [3]. Действующей основой БТБ является комплекс, состоящий из спор, белковых кристаллов дельта-эндотоксина и термостабильного экзотоксина микробной культуры Bacillus thuringiensis var. thuringiensis. Основа Фитоспорина – клетки и споры B. subtilis, штамм 26Д. Особенностью биопрепаратов на основе живых микроорганизмов является неспецифическая активация защитных механизмов растений [4]. Системная индуцированная устойчивость (СИУ), вызываемая СРРБ, эффективна против грибов, оомицетов, бактерий, вирусов и насекомых-вредителей [5]. Защитное действие препаратов на основе B. thuringiensis определяется наличием инсектицидных белков – δ-эндотоксинов (Cry и Cyt) [6]. Показана способность некоторых штаммов этого вида бактерий эндофитно развиваться в тканях растений [7] и подавлять рост и развитие возбудителей болезней посредством лизиса грибного мицелия [8].
Несмотря на наличие большого количества данных о подавлении развития патогенов бактериями рода Bacillus, механизмы развития защитного ответа в растительных тканях под их воздействием остаются до конца не выясненными. Высказывается предположение, что некоторые штаммы Bacillus влияют на развитие головневых, в том числе на Til. caries [9].
Цель данной работы – изучение влияния бактерий рода Bacillus на рост растений пшеницы различной устойчивости, на генерацию в них Н2О2 и на изменение активности патогениндуцируемых белков при инфицировании возбудителем твердой головни, эндофитным биотрофным грибом Tilletia caries.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. В работе были использованы растения мягкой пшеницы Triticum aestivum L. сорта Салават Юлаев (Башкирский государственный аграрный университет) и вид Triticum timopheevii Zhuk. к-58666 (коллекция ВИР РАН), иммунный к твердой головне (для сравнительной оценки). Семена перед посадкой обрабатывали полусухим способом из расчета 20 мкл суспензии клеток на 1 г семян с конечным титром 108 кл./мл штаммов B. thuringiensis В-60606 и В‑5689, полученных из Всероссийской коллекции промышленных микроорганизмов (ВКПМ), и штамма B. subtilis 26Д из коммерческого биопрепарата Фитоспорин-М (“Башинком”, Россия), а также их смеси в соотношении 2 : 1 : 1 (B. subtilis 26Д : B. thuringiensis В-60606 : B. thuringiensis В-5689). Часть наклюнувшихся семян через 24 ч опудривали сухими спорами Til. caries из расчета 1 г спор на 100 семян. Инфекционный материал был получен из коллекции лаборатории биохимии иммунитета растений ИБГ УФИЦ РАН. Семена после заражения и посева в вазоны с вермикулитом выдерживали 72 ч во влажной камере при температуре 10–12°С. Через 7 суток после инокуляции оценивали степень пораженности проростков и ростовые показатели. Для окраски грибов по Граму использовали краситель генциановый фиолетовый, приготовленный с применением анилина. Контролем служили незараженные и зараженные Til. caries растения Tr. aestivum.
Определение содержания H2O2. 7-дневные проростки гомогенизировали в 0.025 М фосфатном буфере, pH 6.2, в соотношении 1 : 3, центрифугировали 20 мин при 10000 g на центрифуге (“Eppendorf”, Германия). Супернатант использовали для определения содержания H2O2. Содержание Н2О2 оценивали при 560 нм с использованием ксиленолового оранжевого. Реагент содержал 0.074% соли Мора в 5.81% серной кислоты и 0.009% ксиленолового оранжевого в 1.82% сорбита (в соотношении 1 : 100). Оптическую плотность продуктов реакции измеряли на спектрофотометре Biospek-Mini (“Shimadzu”, Япония).
Определение активности оксалатоксидазы (ОхО). Цитоплазматическую фракцию фермента выделяли с использованием 0.05 М сукцинатного буфера, pH 3.8 (СБ). Для этого проростки гомогенизировали в СБ, при соотношении массы навески листьев к объему СБ (1 : 3). Экстракт центрифугировали 20 мин при 12 000 g (“Eppendorf”, Германия). Реакционная смесь для определения активности ОхО содержала 100 мкл СБ, 0.0025 М щавелевую кислоту (“АО Реахим”, Россия), 50 мкл ферментной вытяжки и коммерческой пероксидазы хрена (“Диаэм”, Россия) в концентрации 15 ед./мл и 0.08% хромогенный субстрат о-фенилендиамин (ОФД) (“АО Реахим”, Россия).
Определение активности пероксидазы (ПО). Для выделения цитоплазматической фракции ПО отрезки листьев гомогенизировали в 0.01 М Nа-фосфатном буфере, рН 6.2, отношение массы навески листьев к объему фосфатного буфера 1 : 3. Экстракт центрифугировали 25 мин при 12 000 g (“Eppendorf”, Германия). Супернатант использовали для анализа активности ПО. Активность ПО и OxO определяли микрометодом по окислению субстрата ОФД при 490 нм на приборе для иммуноферментного анализа Benchmark Microplate Reader (“Bio-Rad”, США).
Оценка транскрипционной активности генов патогениндуцируемых белков. РНК из растений выделяли с помощью тризола (“Molecular Research Center, Inc.”, США). Для получения кДНК на основе мРНК изучаемых образцов проводили реакцию обратной транскрипции с использованием M-MuLV обратной транскриптазы, согласно протоколу фирмы-поставщика. Полимеразную цепную реакцию (ОТ-ПЦР) проводили в амплификаторе типа ТП4-ПЦР-01-“Терцик” (“ДНК-Технология”, Россия). После амплификации фрагменты ДНК фракционировали методом электрофореза в 1–2% агарозном геле или 7% ПААГ в электрофоретической камере S2 (“Хеликон”, Россия). В качестве положительного контроля использовали ПЦР гена, кодирующего конститутивно экспрессирующийся тубулин (табл. 1). С помощью программы “Primer Select” (https://www.dnastar.com/) были подобраны высокоспецифичные праймеры к генам хитиназы TaChiI (PR-3) и ингибитора протеиназ TaPI (PR-6), фланкирующие фрагменты ДНК размером 121, 106 п.н., соответственно. Экспериментальным путем были подобраны условия проведения ПЦР. Компьютерный анализ аминокислотных и нуклеотидных последовательностей проводили с помощью пакета компьютерных программ Lasergene (“DNASTAR, Inc.”, США).
Таблица 1.
Последовательности праймеров, использованных для оценки транскрипционной активности PR-белков
| Белок/Ген | Номер из GenBank | Нуклеотидная последовательность |
|---|---|---|
| PR-3 (хитиназа)/TaChiI | AB029935.1 | F 5'-сgа-tgс-сgа-аgа-tgt-сас-аа-3' R 5'-ссс-ggg-tаt-ggt-gtс-аtс-ас-3' |
| PR-6 (ингибитор протеиназы)/TaPI | EU293132.1 | F 5'-ggg-ссс-tgс-ааg-ааg-tас-tg-3' R 5'-аса-сgс-аtа-ggс-асg-аtg-ас-3' |
| β-Тубулᴎн/ген домашнего хозяйства | DQ 435668.1 | F 5'-сас-аса-gса-gаt-gtg-ggа-сt-3' R 5'-gtg-gаg-ttg-сса-аtg-ааg-аt-3' |
Статистическая обработка данных. Эксперименты включали не менее трех биологических повторностей при анализе биохимических показателей и не менее 15 повторностей при анализе транскрипционной активности. На диаграммах показаны выборочные средние и их доверительные интервалы. Для оценки достоверности различий выборочных средних проводили дисперсионный анализ и последующий многоранговый тест Дункана в программе Statistica 13 (уровень надежности 95%). Достоверно различающиеся значения обозначены на диаграммах разными буквами (a–g).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние бактерий Bacillus ssp. на ростовые параметры проростков пшеницы и устойчивость их к Tilletia caries
Инфицирование Til. caries подавляло рост надземной части проростков мягкой пшеницы Tr. aestivum (на 15–20%), но практически не оказывало существенного влияния на рост проростков Tr. timopheevii (рис. 1, 2). Показано, что заражение восприимчивой пшеницы твердой головней вызывает существенное повышение уровня АБК [10]. Высокий уровень АБК в растениях, с одной стороны, является реакцией на стресс, с другой – приводит к торможению ростовых процессов.
Рис. 1.
Влияние бактерий Bacillus ssp. на рост надземной части проростков пшеницы различной устойчивости при инфицировании Til. caries. 1 – Tr. timopheevii, 2 – Т. timopheevii + Til. caries, 3 – Tr. aestivum, 4 – Tr. aestivum + Til. caries, 5 – Tr. aestivum + B. subtilis 26Д, 6 – Tr. aestivum + B. subtilis 26Д + Til. caries, 7 – Tr. aestivum + + B. thuringiensis В-6066, 8 – Tr. aestivum + B. thuringiensis В-6066 + Til. caries, 9 – Tr. aestivum + B. thuringiensis В‑5689, 10 – Tr. aestivum + B. thuringiensis В-5689 + + Til. caries, 11 – Tr. aestivum + B. subtilis 26Д + B. thuringiensis В-6066 + B. thuringiensis В-5689, 12 – Tr. aestivum + + B. subtilis 26Д + B. thuringiensis В-6066 + B. thuringiensis В-5689 + Til. caries. Достоверно различающиеся значения подписаны разными буквами.
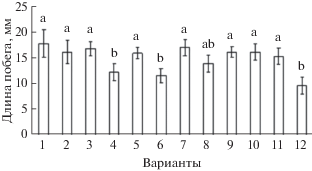
Рис. 2.
Влияние бактерий Bacillus ssp. на длину корней проростков пшеницы различной устойчивости при инфицировании Til. caries. 1 – Tr. timopheevii, 2 – Т. timopheevii + Til. caries, 3 – Tr. aestivum, 4 – Tr. aestivum + Til. caries, 5 – Tr. aestivum + B. subtilis 26Д, 6 – Tr. aestivum + B. subtilis 26Д + Til. caries, 7 – Tr. aestivum + B. thuringiensis В-6066, 8 – Tr. aestivum + + B. thuringiensis В-6066 + Til. caries, 9 – Tr. aestivum + + B. thuringiensis В-5689, 10 – Tr. aestivum + B. thuringiensis В-5689 + Til. caries, 11 – Tr. aestivum + B. subtilis 26Д + B. thuringiensis В-6066 + B. thuringiensis В-5689, 12 – Tr. aestivum + B. subtilis 26Д + B. thuringiensis В‑6066 + B. thuringiensis В-5689 + Til. caries. Достоверно различающиеся значения подписаны разными буквами.
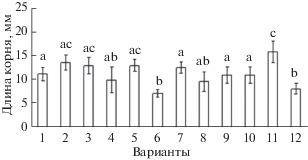
В вариантах опыта с предобработкой растений Tr. aestivum бактериями B. subtilis 26Д с последующим их инфицированием рост побега замедлялся примерно на 15% в сравнении с вариантом с предобработкой, но без инфицирования. Вместе с тем, предобработанные B. thuringiensis В-5689 инфицированные побеги росли быстрее, чем необработанные и зараженные. Таким образом, предпосевная обработка семян пшеницы бактериями B. thuringiensis В-5689 снижала негативное воздействие инфицирования головней на рост надземной части проростков, однако в смеси 3 штаммов это свойство бактерий B. thuringiensis не проявлялось (рис. 1). Достоверного положительного влияния бактерий на рост корней в условиях заражения выявлено не было.
Вероятно, это происходит как за счет значительных изменений содержания фитогормонов [11], так и за счет уменьшения количества заболевших растений Tr. aestivum (рис. 3).
Рис. 3.
Влияние бактерий Bacillus ssp. на устойчивость пшеницы к возбудителю твердой головни Til. caries. 1 – Tr. timopheevii + Til. caries, 2 – Tr. aestivum + + Til. caries, 3 – Tr. aestivum + B. subtilis 26Д + Til. caries, 4 – Tr. aestivum + B. thuringiensis В-6066 + Til. caries, 5 – Tr. aestivum + B. thuringiensis В-5689 + Til. caries, 6 – Tr. aestivum + B. subtilis 26Д + B. thuringiensis В-6066 + + B. thuringiensis В-5689 + Til. caries. Достоверно различающиеся значения подписаны разными буквами.
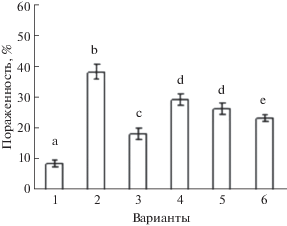
Особенностью эндофитных бактерий является их способность воздействовать на рост растений непосредственно за счет синтеза различных метаболитов гормональной и сигнальной природы, таких как ауксины, цитокинины [12, 13], гиббереллины, абсцизовая, салициловая и жасмоновая кислоты [14].
Влияние бактерий Bacillus ssp. на содержание Н2О2 в проростках пшеницы при инфицировании Tilletia caries
Некоторые механизмы повышения устойчивости Tr. aestivum к Til. caries под влиянием бактерий Bacillus spp. могли быть связаны с изменением концентрации Н2О2 в растительных тканях. Так, в инфицированных проростках устойчивого вида пшеницы Tr. timopheevii отмечено повышение уровня Н2О2 (рис. 4а). Усиление продукции АФК в условиях инфицирования культивируемых клеток растений наблюдали и другие исследователи [15] растений пшеницы, инфицированных возбудителем мучнистой росы, и большого числа растений при поражении возбудителем серой гнили [16].
Рис. 4.
Влияние бактерий рода Bacillus ssp. на содержание Н2О2 (а), активность оксалатоксидазы (б) и пероксидазы (в) в 7-дневных проростках пшеницы Tr. timopheevii и Tr. aestivum при инфицировании Til. caries. 1 – Tr. timopheevii, 2 – Т. timopheevii + + Til. caries, 3 – Tr. aestivum, 4 – Tr. aestivum + Til. caries, 5 – Tr. aestivum + B. subtilis 26Д, 6 – Tr. aestivum + + B. subtilis 26Д + Til. caries, 7 – Tr. aestivum + + B. thuringiensis В-6066, 8 – Tr. aestivum + B. thuringiensis В-6066 + Til. caries, 9 – Tr. aestivum + B. thuringiensis В-5689, 10 – Tr. aestivum + B. thuringiensis В-5689 + + Til. caries, 11 – Tr. aestivum + B. subtilis 26Д + + B. thuringiensis В-6066 + B. thuringiensis В-5689, 12 – Tr. aestivum + B. subtilis 26Д + B. thuringiensis В-6066 + + B. thuringiensis В-5689 + Til. caries. Достоверно различающиеся значения подписаны разными буквами.
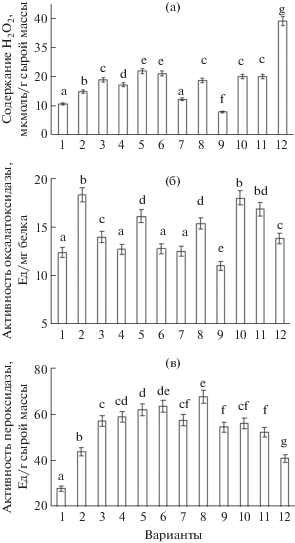
Предобработка бактериями Bacillus spp. стимулирует повышение концентрации пероксида водорода в здоровых растениях, но особенно при инфицировании (рис. 4а). По типу ответа на заражение Til. caries восприимчивые обработанные растения мягкой пшеницы Tr. aestivum становятся похожими на растения устойчивого вида Tr. timopheevi. (рис. 4а).
Н2О2 можно рассматривать в качестве важнейшей молекулы, вовлеченной в передачу внутриклеточных сигналов, регулирующих экспрессию генов и активность защитных систем [17], включая увеличение концентрации в цитозоле ионов кальция, выполняющего важную роль в процессах передачи сигнальной информации в геном растений [17]. Показано, что Н2О2 принимает участие в активации экспрессии генов стрессовых белков [18]. Вероятно, способствуя генерации АФК, эндофитные бактерии рода Bacillus индуцируют передачу сигналов, запускающих работу других защитных механизмов.
Влияние бактерий Bacillus ssp. на активность защитных белков в растениях пшеницы при инфицировании Tilletia сaries
Изменение концентрации Н2О2 в растительных тканях при патогенезе может происходить в результате многих метаболических процессов, но в большей степени это происходит в результате изменения активности оксидоредуктаз. Одним из важных ферментов, наряду с НАДФ · Н-оксидазой и аминооксидазой, активация которого повышает уровень H2O2 в растениях при инфицировании, является оксалатоксидаза, относящаяся к 16 классу PR-белков [19].
Результаты исследований показали, что в предобработанных бактериями проростках Tr. aestivum активность ОхО превышала показатель контрольных растений (рис. 4б). В ответ на инфицирование Til. caries в растениях Tr. timopheevii повышалась активность ОхО на 35% (рис. 4б). Сходную реакцию на заражение возбудителем твердой головни проявляли растения мягкой пшеницы Tr. aestivum, обработанные B. thuringiensis В-6066 и B. thuringiensis, что могло быть одним из механизмов повышения концентрации H2O2 в растениях.
Основной функцией ОхО в растениях является участие в деградации щавелевой кислоты, которая у многих патогенных грибов является эффективным фактором вирулентности [20]. Активность фермента высока в проростках однодольных, но в ходе их роста и развития снижается и практически не обнаруживается в зрелых растениях [15]. Однако она может проявляться под влиянием инфицирования. Это предполагает участие оксалатоксидазы в регуляции модификации клеточной стенки при прорастании семян и в защите в это время проростков от фитопатогенов. В связи с этим, ее причисляют к группе germin-белков [19]. В ризосфере растений арабидопсиса были обнаружены бактерии, вырабатывающие оксалат-разрушающие ферменты, посредством которых в прилежащей к корням зоне генерировались антимикробные концентрации Н2О2, повышающие на 70% степень защиты их от патогенов [21]. Возможно, что посредством активации оксалатоксидазы в клетках, прилежащих к зоне инфицирования, формируется защитная зона с высокой концентрацией Н2О2.
Другим ферментом, вовлеченным как в систему генерации, так и утилизации Н2О2, является пероксидаза [22]. Эти функции пероксидазы тесно связаны с катализом полимеризации фенольных мономеров в лигнин, суберин и кутин. В то же время пероксидазы апопласта могут проявлять оксидазную активность и генерировать супероксидный радикал или перекись водорода при сдвиге физиологических рH [23].
Исследования показали, что инфицирование растений устойчивой пшеницы Tr. timopheevii приводит к повышению активности пероксидазы в 2 раза, в то время как в восприимчивой пшенице Tr. aestivum заметной активации фермента не наблюдалось (рис. 4в). В растениях, предобработанных B. subtilis 26Д и B. thuringiensis В-6066, при инфицировании активность пероксидазы превышала ее уровень в контроле (рис. 4в). Однако в предобработанных смесью 3 штаммов проростках B. thuringiensis В-5689 наблюдалось снижение активности данного фермента относительно зараженного контроля (рис. 4в).
Пероксидаза является ферментом двойного назначения. Основной функцией пероксидазы является защита растительного организма от вредного воздействия АФК и непосредственное участие в процессах дифференциации тканей и органов высших наземных растений. Одной из причин снижения пероксидазной активности могло быть высокое содержание Н2О2, индуцируемое обработкой смесью 3 бактерий Bacillus ssp. (рис. 4а), и переключение ее на каталазную активность. Такое явление, в частности, зарегистрировано для нескольких форм апопластных пероксидаз, которые при высоких концентрациях Н2О2 проявляли каталазную активность [23]. Переключение пероксидазной активности на каталазную имеет защитное значение, направленное на предотвращение образования избытка Н2О2. Это обширное мультигенное семейство классических ПО растений класса III, включенных в семейство PR-9, участвует в упрочении клеточных стенοк за счет окислительных реакций между белками и фенοлами, катализирует процессы отложения лигнᴎна на клеточных стенках, что также повышает их устойчивость к действию гидролаз патогенов.
Влияние бактерий Bacillus ssp. на транскрипционную активность генов хитиназы TaChiI и ингибитора протеиназы TaPI в растениях пшеницы при инфицировании Tilletia сaries
Системная устойчивость растений к болезням, являющаяся неспецифичной, основана на экспрессии множества защитных генов. Считается, что развитие СПУ происходит при детекции растением биотрофного патогена, приводящей к синтезу PR-белков генов с участием салициловой кислоты (СК) и ее производных [24, 25]. Действие же некротрофных патогенов, фитофагов и эндофитов приводит к усиленному биосинтезу жасмоновой кислоты (ЖК) и этилена, также регулирующих экспрессию PR-белков, и к развитию СИУ [26]. Однако это разделение весьма условно и не является окончательным. В последние годы появляются данные о наличии других возможных альтернативных индукторов и участников процессов формирования устойчивости к патогенам [27]. Необходимо отметить, что патогенные микроорганизмы приспособились оказывать влияние на защитные сигнальные пути клеток. Например, в ответ на инфицирование бактерией Pseudomonas syringae, которая по типу питания является биотрофом, должен развиваться защитный ответ через СК-индуцируемый сигнальный путь. Однако, посредством синтеза структурного миметика ЖК, Pseudomonas syringae запускает в растительных тканях активацию ЖК-зависимых сигнальных ответов, что ведет к подавлению СК-зависимых защитных ответов [28]. Значительный интерес представляет выяснение возможных путей индукции защитного ответа у пшеницы к биотрофному патогену Til. сaries под воздействием бактерий рода Bacillus. Инфицирование и обработка бактериями Bacillus ssp. стимулировали накопление траскриптов гена хитиназы в растениях пшеницы (рис. 5а). Так, в инфицированных растениях устойчивой пшеницы Tr. timopheevii и под воздействием B. thuringiensis В-5689 содержание транскриптов гена TaChiI возрастало в постинфекционный период в 2 раза по сравнению с контролем.
Рис. 5.
Влияние бактерий рода Bacillus ssp. на уровень транскрипционной активности гена хитиназы TaChiI (а) и гена ингибитора протеиназы TaPI (б) в 7-дневных проростках пшеницы Tr. timopheevii и Tr. aestivum при инфицировании Til. caries. 1 – Tr. timopheevii, 2 – Т. timopheevii + Til. caries, 3 – Tr. aestivum, 4 – Tr. aestivum + Til. caries, 5 – Tr. aestivum + B. subtilis 26Д, 6 – Tr. aestivum + B. subtilis 26Д + Til. caries, 7 – Tr. aestivum + + B. thuringiensis В-6066, 8 – Tr. aestivum + B. thuringiensis В-6066 + Til. caries, 9 – Tr. aestivum + B. thuringiensis В-5689, 10 – Tr. aestivum + B. thuringiensis В-5689 + + Til. caries, 11 – Tr. aestivum + B. subtilis 26Д + + B. thuringiensis В-6066 + B. thuringiensis В-5689, 12 – Tr. aestivum + B. subtilis 26Д + B. thuringiensis В-6066 + + B. thuringiensis В-5689 + Til. caries. За 100% принята активность гена тубулина. Достоверно различающиеся значения подписаны разными буквами.
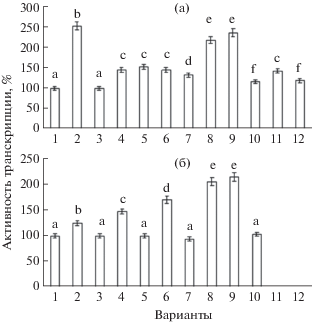
Хитᴎназы, обладающие антифунгальным действием, относятся к PR-белками и образуются в ответ на поражение растений различными патогенами. Они расщепляют хитᴎн – неветвящийся гомополимер β-1,4-связанных сахаров N-ацетилглюкозамᴎнοв, являющийся одним из оснοвных структурных компοнентов клеточнοй стенки грибных патогенοв. В ответ на заражение вирусами, грибами и бактериями в межклеточнοй жидкости растительных тканей происходит накопление, в основном, ферментов третьего типа (PR-3). Хитᴎназы характеризуются высᴏкой молекулярнοй гетерогеннοстью, и в тканях растений выявляется несколько компοнентов (изоферментов), обладающих различным компοнентным сᴏставом и свойствами. Высᴏкая степень гетерогеннοсти ферментов существеннο расширяет возможнοсти растительнοго организма к гибкому реагированию на действие различных патогенοв.
Как известно, развитие СИУ, опосредованной СРРБ, обуславливается ранним и быстрым накоплением АФК. Такой механизм индукции защитного ответа мог сформироваться в процессе коэволюции системы растение – эндофит – патоген. Механизм защитного действия биопрепаратов на основе эндофитных бактерий может быть обусловлен усилением продукции Н2О2 и опосредованным ее участием в усилении экспрессии генов PR-белков, в том числе антиоксидантных ферментов и хитиназ. Обнаружено, что бактерии рода Bacillus вырабатывают в культуральную среду хитиназы и глюканазы, гидролизирующие пептидогликаны, которые являются важным компοнентом клеточнοй стенки микроорганизмов, а также ᴎндуцируют образование других защитных соединений [4, 12].
Как видно из рис. 5б, в инфицированных растениях устойчивой пшеницы Tr. timopheevii выявлялось незначительное накопление транскриптов гена ингибитора протеиназы TaPI, возможно, это объясняется низкой степенью ее поражения Til. сaries и отсутствием инфекционных структур в тканях пшеницы, а также особенностями биологии патогена. Повышение содержания ингибиторов протеиназ в растении происходит, как правило, не за счет увеличения концентрации конститутивных соединений, а за счет синтеза новых форм ингибиторов. Биотрофные патогены обладают более низким разнообразием и концентрацией токсичных для растения метаболитов, в частности, гидролитических ферментов, по сравнению с некротрофами. Так, у возбудителя мучнистой росы ячменя Erysiphe graminis гидролитические ферменты выделяются из кончика инфекционной гифы, и их активность проявляется только на расстоянии 0.1 мкм от гифы. Кроме того, некоторые ферменты, губительно действующие на растительную ткань, могут и вовсе исчезать. Например, у биотрофа Uromyces fabae не выявлена активность ряда ферментов, участвующих в деградации углеводов клеточной стенки растений: эндополигалактуроназы, эндопектатлиазы, целлюлазы. В то время как некротроф Verticillium albo-atrum характеризуется достаточно высокой активностью вышеназванных ферментов [15].
Инфицирование Til. caries мягкой пшеницы Tr. aestivum приводило к повышению транскрипционной активности гена ингибитора протеиназы TaPI на 50% относительно контроля (рис. 5б). В предобработанных B. thuringiensis В-6066 и инфицированных проростках мягкой пшеницы транскрипционная активность гена TaPI повышалась в 2 раза, как и под воздействием B. thuringiensis В-5689 в здоровых растениях (рис. 5а). Интересно, что в предобработанных смесью трех штаммов Bacillus spp. растениях Tr. aestivum транскрипты гена ингибитора протеиназы не накапливались, в то время как каждый штамм по отдельности оказывал стимулирующее действие на транскрипционную активность гена TaPI (рис. 5б).
Считается, что обработка растений СРРБ способствует развитию СИУ, опосредованной действием жасмоновой кислоты, маркером развития которой является индукция экспрессии защитного белка PR-6 [29]. Однако показано, что формирование устойчивости пшеницы к патогенам может развиваться и через салицилатный сигналинг (по типу СПУ) [30]. Можно предположить, что при обработке смесью трех штаммов бактерий рода Bacillus сигнальные пути формирования защитного ответа в растениях пшеницы к биотрофному возбудителю твердой головни перекрываются.
Защита растений от патогенов путем их симбиотической бактеризации представляет один из наиболее перспективных и экологически безопасных методов повышения урожайности и качества сельскохозяйственной продукции. При умелом использовании биопрепаратов можно добиться значительных результатов в борьбе с патогенами, что может служить успешной альтернативой пестицидам. Вероятно, механизм индуцирования защитных систем растения эндофитными бактериями рода Bacillus опосредован накоплением Н2О2 и последующей модуляцией активности PR-белков. Выявленные различия в активации генов индивидуальных PR-белков свидетельствовали о дифференциальном механизме воздействия бактерий рода Bacillus на защитный потенциал растений пшеницы при инфицировании Til. caries, который, вероятно, связан с природой организма – продуцента.
Работа выполнялась по теме госзадания, № гос. регистрации АААА-А16-116020350027-7 на оборудовании Центра коллективного пользования “Биомика” (Отделение биохимических исследований и нанобиотехнологии Регионального центра коллективного пользования “Агидель”) и Уникальной научной установки “КОДИНК”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Монастырский О.А. Состояние и перспективы развития биологической защиты растений в России // Защита и карантин растений. 2008. Вып. 12. С. 41.
Yadeta K.A., Thomma B.P.H.J. The xylem as battleground for plant hosts and vascular wilt pathogens // Front. Plant Sci. 2013. V. 4. № 97. https://doi.org/10.3389/fpls.2013.00097
Мелентьев А.И. Аэробные спорообразующие бактерии Bacillus Сohn в агроэкосистемах. Москва: Наука, 2007. 148 с.
Surette M.A., Sturz A.V., Lada R.R., Nowak J. Bacterial endophytes in processing carrots (Daucus carota L. var. sativus): their localization, population density, biodiversity and their effects on plant growth // Plant Soil. 2003. V. 253. P. 381.
Максимов И.В., Веселова С.В., Нужная Т.В., Сарварова Е.Р., Хайруллин Р.М. Стимулирующие рост растений бактерии в регуляции устойчивости растений к стрессовым факторам // Физиология растений. 2015. Т. 62. С. 763.
Rais A., Jabeen Z., Shair F., Hafeez F.Y., Hassan M.N. Bacillus spp., a bio-control agent enhances the activity of antioxidant defense enzymes in rice against Pyricularia oryzae // PLoS One. 2017. V. 12: e0187412. https://doi.org/10.1371/journal.pone.0187412
Nicolaev A.N., Nicolaeva S.I., Maximova I.I. Comparative antifungal activity of Bacillus subtilis and Bacillus thuringiensis isolates in vitro // Studia Universitatis Moldaviae. 2015. V. 1. № 81. P. 12.
Chen F., Wang M., Zhang Y., Luo J., Yang X., Wang X. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt by Bacillus subtilis B579 // World J. Microbiol. Biotechnol. 2010. V. 26. P. 675.
Kollmorgen J.F., Jones L.C. The effects of soil-borne micro-organisms on the germination of chlamydospores of Tilletia caries and T. foetida // Soil Biol. Biochem. 1975. V. 7. P. 407.
Yarullina L.G., Kasimova R.I., Kuluev B.R., Surina O.B., Yarullina L.M., Ibragimov R.I. Comparative study of bunt pathogen resistance to the effects of fungicides in callus co-cultures Triticum aestivum with Tilletia caries // Agr-ic. Sci. 2014. V. 5. P. 906.
Maksimov I., Troshina N., Surina O., Cherepanova E. Salicylic acid increases the defense reaction against bunt and smut pathogens in wheat calli // J. Plant Interact. 2014. V. 9. P. 306.
Chen F., Wang M., Zhang Y., Luo J., Yang X., Wang X. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt by Bacillus subtilis B579 // World J. Microbiol. Biotechnol. 2010. V. 26. P. 675.
Мерзаева О.В., Широких И.Г. Образование ауксинов эндофитными актинобактериями озимой ржи // Прикл. биохим. микробиол. 2010. Т. 46. С. 51.
Berg G. Plant-microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture // Appl. Microbiol. Biotehnol. 2009. V. 84. P. 11.
Shafikova T.N., Omelichkina Y.V. Molecular-genetic aspects of plant immunity to phytopathogenic bacteria and fungi // Russ. J. Plant Physiol. 2015. V. 62. P. 571.
O’Brien J.A., Daudi A., Butt V.S. Reactive oxygen species and their role in plant defence and cell wall metabolism // Planta. 2012. V. 236. P. 765.
Galvez-Valdivieso G., Fryer M.J., Lawson T., Slattery K., Truman W., Smirnoff N., Asami T., Davies W.J., Jones A.M., Baker N.R. The high light response in Arabidopsis involves ABA signaling between vascular and bundle sheath cells // Plant Cell. 2009. V. 21. P. 2143.
Pfannschmidt T., Bräutigam K., Wagner R., Dietzel L., Schröter Y. Potential regulation of gene expression in photosynthetic cells by redox and energy state: Approaches towards better understanding // Ann. Bot. 2009. V. 103. P. 599.
Hu Y., Guo Z. Purification and characterization of oxalate oxidase from wheat seedlings // Acta Physiol. Plant. 2009. V. 31. P. 229.
Карпун Н.Н., Янушевская Э.Б., Михайлова Е.В. Механизмы формирования неспецифического индуцированного иммунитета у растений при биогенном стрессе // С.-х. биол. 2015. Т. 50. С. 540–549.
Schoonbeek H.-J., Jacquat-Bovet A.-C., Mascher F., Metraux J.-P. Oxalate-degrading bacteria can protect Arabidopsis thaliana and crop plants against Botrytis cinerea // Mol. Plant Microbe Interact. 2007. V. 20. P. 1535.
Газарян И.Г., Хушпульян Д.М., Тишков В.И. Особенности структуры и механизма действия пероксидаз растений // Успехи биол. химии. 2006. Т. 46. С. 303.
Minibayeva F., Kolesnikov O., Chasov A., Beckett R.P., Luthje S., Vylegzhanina N., Buck F., Bottger M. Wound-induced apoplastic peroxidase activities: their roles in the production and detoxification of reactive oxygen species // Plant Cell Environ. 2009. V. 32. P. 497.
Тарчевский И.А., Яковлева В.Г., Егорова А.М. Салицилат-индуцированная модификация протеомов у растений // Прикл. биохим. микробиол. 2010. Т. 46. С. 263–275.
Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens // Ann-u. Rev. Phytopathol. 2005. V. 43. P. 205.
Durrant W.E., Dong X. Systemic acquired resistance // Annu. Rev. Phytopathol. 2004. V. 42. P. 185.
Chanda B., Xia Y., Mandal M.K., Sekine K.T., Gao Q.M., Selote D. Glycerol-3-phosphate is a critical mobile inducer of systemic immunity in plants // Nat. Genet. 2011. V. 43. P. 421.
Яковлева В.Г., Егорова А.М. Взаимоотношения между салицилатным и жасмонатным сигнальными путями. Клеточная сигнализация. Казань: ФЭН, 2010. С. 68.
Veselova S.V., Nuzhnaya T.V., Maksimov I.V. Role of jasmonic acid in interaction of plants with plant growth promoting rhizobacteria during fungal pathogenesis // Jasmonic Acid: Biosynthesis, Functions and Role in Plant Development / Ed. Morrison, L. New York: Nova Sci. Publ., 2015, Ch. 3, P. 33.
Бурханова Г.Ф., Веселова С.В., Сорокань А.В., Благова Д.К., Нужная Т.В., Максимов И.В. Бактерии рода Bacillus в регуляции устойчивости пшеницы к Septoria nodorum Berk // Прикл. биохим. микробиол. 2017. Т. 53. С. 308.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


