Физиология растений, 2020, T. 67, № 3, стр. 319-328
Сезонная динамика липидов и их жирных кислот в почках Betula pendula Roth и Alnus alnobetula subsp. fruticosa (Rupr.) Raus в условиях криолитозоны
В. В. Нохсоров a, *, Л. В. Дударева b, К. А. Петров c
a Федеральное государственное автономное образовательное учреждение высшего образования
Северо-Восточный федеральный университет им. М. К. Аммосова
Якутск, Россия
b Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
c Федеральное государственное бюджетное учреждение науки Институт биологических проблем криолитозоны Сибирского отделения Российской академии наук
Якутск, Россия
* E-mail: vv.nokhsorov@s-vfu.ru
Поступила в редакцию 12.03.2019
После доработки 19.11.2019
Принята к публикации 20.11.2019
Аннотация
Представлены результаты исследований изменения абсолютного и относительного содержания и состава жирных кислот (ЖК), суммарных липидов (СЛ) и фосфолипидов (ФЛ), являющихся структурно-функциональной основой клеточных мембран почек лиственных древесных и кустарниковых растений, в летний и осенне-зимний периоды, произрастающих в условиях криолитозоны Якутии. Установлена важная роль липидного обмена при адаптации к низкой осенней и зимней температуре криолитозоны Якутии. Показано, что содержание фосфатидилхолина (ФХ) в почках у березы повислой (Betula pendula Roth) и ольхи кустарниковой (Alnus alnobetula subsp. fruticosa (Rupr.) Raus) увеличивалось от 9.9 до 23.4 мг/г сухой массы. В составе ЖК липидов почек обоих видов показано высокое содержание ненасыщенных С18:2 и С18:3 ЖК в осенне-зимнем периоде. Биосинтез ЖК липидов в почках лиственных древесно-кустарниковых растений при низкой температуре, по-видимому, контролировался ω3-десатуразой, активность которой вызывала увеличение содержания α-линоленовой кислоты – с 2.9 до 5.7 мг/г в B. pendula и с 1.6 до 4.8 мг/г сухой массы в A. alnobetula subsp. fruticosa. Установлено, что при понижении температуры воздуха повышается коэффициент ненасыщенности (k) от 0.9 до 2.3 у B. pendula и от 1.4 до 1.8 у A. alnobetula subsp. fruticosa. Предполагается, что в осенне-зимние периоды максимальное содержание полиненасыщенных жирных кислот (ПНЖК) в вегетативных почках изученных древесно-кустарниковых растений обусловлено влиянием комплекса климатических факторов криолитозоны, таких как резкий контраст дневных и ночных температур в межсезонье, экстремально низкие значения температуры воздуха в зимний период (до ‒60°С) и сокращение продолжительности светового дня, характерные для этого времени года.
ВВЕДЕНИЕ
Представителями семейства Березовые (Betulaceae Gray), произрастающими на значительной территории в Восточной Сибири и Дальнего Востока России, являются береза повислая (Betula pendula Roth) и ольха кустарниковая (Alnus alnobetula subsp. fruticosa (Rupr.) Raus), граница ареала которых доходит до тундровой зоны субарктики [1]. Особенностями климата Якутии являются сравнительно короткий вегетационный период, экстремально низкие зимние (до –60°С) и высокие летние температуры воздуха (до +38°С), наличие многолетней мерзлоты и дефицит влаги, представляющие собой нерегулируемый абиотический сезонный стрессор. В естественных условиях понижение температуры, как правило, происходит постепенно, давая возможность растению перестроить свой метаболизм для формирования устойчивости к гипотермии [2]. Адаптивные изменения, происходящие в период действия низких закаливающих температур, протекают на всех уровнях структурной организации организма и затрагивают множество физиологических процессов, что обусловливает различные подходы к изучению проблемы устойчивости при гипотермии [3]. В последнее время изучение адаптационной пластичности древесно-кустарниковых видов приобретает особое значение в регионах, расположенных в пограничной зоне произрастания растительности [4]. Ранее при исследовании содержания липидов и жирных кислот (ЖК) в составе фракций в различные фазы развития почек у видов берез B. pendula и B. pubescens Ehrh., произрастающих в условиях Карелии, было показано, что весной (перед распусканием) в почках поддерживался довольно высокий уровень липидов, а при их распускании и формировании листовых пластинок количество суммарных липидов (СЛ) снижалось в 3–4 раза. При этом существенно повышался уровень содержания фосфолипидов (ФЛ) в связи с активным образованием клеточных структур. Было показано, что максимум накопления липидов приходится на осенне-зимний период при подготовке растений к глубокому физиологическому покою у берез, произрастающих в Карелии, поскольку накопление липидов обеспечивает защиту меристематических тканей в зимний период. Кроме того, запас питательных веществ необходим для успешного начала вегетации в весенний период следующего года [5]. Несмотря на то, что Республика Карелия и Республика Саха (Якутия) находятся на одной широте (62° с.ш.), они существенно различаются по климатическим факторам, особенно по температурному режиму. Карелия относится к зоне умеренного континентального климата с переходом к морскому, а Центральная Якутия располагается в условиях резко континентального климата, где многолетняя мерзлота (криолитозона) имеет повсеместное распространение [6]. Кроме того, климат Якутии является самым контрастным по температуре регионом мира с резко изменяющейся в течение года температурой воздуха. Годовая амплитуда температур может здесь составлять до 100°С. Поскольку ткани почек обладают большой чувствительностью к условиям перезимовки, они, в конечном итоге, и определяют выживание древесных организмов в экстремальных условиях произрастания. Поэтому при изучении влияния абиотических факторов на процессы жизнедеятельности древесных и кустарниковых видов, произрастающих в условиях многолетней мерзлоты, важным направлением является изучение влияния экстремально низких температур на липидный обмен у почек.
Как известно, низкотемпературный стресс вызывает изменения физико-химических свойств клеточных мембран. Изучение ультраструктурных перестроек в апикальной меристеме побега у вечнозеленых хвойных растений, возникающих в связи с адаптацией к низким температурам зимнего периода, показало, что происходит изменение расположения хлоропластов, уменьшение объема вакуолей, что способствует уменьшению вероятности образования кристаллов льда в клетке и изменению количества и форм митохондрий [7]. Сохранение целостности клеточных мембран при низких температурах определяется состоянием их компонентов. Большую устойчивость мембран растений связывают, в частности, с качественными и количественными изменениями в составе их липидов, прежде всего ФЛ и ЖК. Так, увеличение содержания ненасыщенных ЖК при гипотермии способствует повышению устойчивости мембран. Это объясняется более рыхлой упаковкой полиненасыщенных жирных кислот (ПНЖК), чем насыщенных в липидном бислое и области контакта ФЛ с белками, что придает мембране большую пластичность, текучесть и гибкость [8–10]. Однако вопросы липидного обмена у древесных и кустарниковых видов при адаптации их к экстремальным условиям произрастания остаются пока недостаточно изученными.
Целью наших исследований являлось изучение сезонной (лето, осень, зима) динамики содержания СЛ, ФЛ, а также ЖК состава суммарных липидов в почках древесных растений B. pendula и A. alnobetula subsp. fruticosa, произрастающих в условиях центральной части Республики Саха (Якутии).
МАТЕРИАЛЫ И МЕТОДЫ
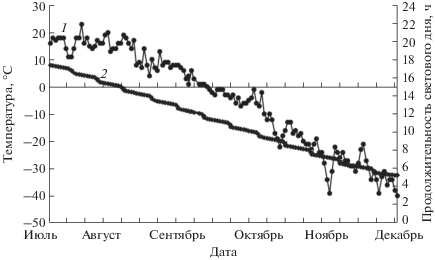
Растительный материал и условия произрастания. В качестве объектов исследования были использованы вегетативные почки березы повислой (Betula pendula) и ольхи кустарниковой (Alnus alnobetula subsp. fruticosa), произрастающих в Центральной Якутии. Почки отбирали со средней хорошо освещаемой части кроны. Сбор полевых материалов осуществляли на постоянных пробных площадях с трех деревьев каждого вида. Древесные и кустарниковые виды произрастают в лесопарковой зоне на территории Ботанического сада Института биологических проблем криолитозоны СО РАН, расположенного на второй надпойменной террасе долины р. Лены в 7 км к западу от г. Якутска (62°15′ с.ш., 129°37′ в.д.). Возраст древесно-кустарниковых растений 15–20 лет. Температуру воздуха на участках произрастания древесных видов регистрировали с помощью термографов DS 1922 LiBitton (“DallasSemiconductor”, США). Интервал между измерениями составил 1 ч. Точность измерения ±0.5°С (рис. 1). Средняя температура воздуха за вегетационный период (май–сентябрь) была около 14°C, сумма осадков – 163 мм. Минимальная температура воздуха в зимний период не опускалась ниже –48°C. Высота снежного покрова в декабре–январе составляла 44–48 см. Погодные условия в годы проведения эксперимента были типичными для Центральной Якутии [см.: https://rp5.ru/Архив_погоды_в_Якутске]. Начало заморозков отмечали в середине третьей декады сентября, устойчивый переход ночной температуры через 0°С – в начале октября.
Рис. 1.
Сезонные изменения температуры воздуха (1) и продолжительности светового дня (2) в Центральной Якутии (62°15′ с.ш., 129°37′ в.д.) в 2014 г. Представлены усредненные данные за сутки (для температуры).
Экстракция и анализ суммарных липидов. Для экстракции липидов навеску растительного материала (0.5 г) фиксировали в жидком азоте и растирали до получения гомогенной массы. Затем добавляли 10 мл смеси хлороформ : метанол (1 : 2 по объему), в которую был добавлен в качестве антиоксиданта ионол (из расчета 0.00125 г на 100 мл смеси хлороформ : метанол), тщательно перемешивали и оставляли на 30 мин до полной диффузии липидов в растворитель. Раствор переносили количественно в делительную воронку через фильтр, трижды промывали ступку и фильтр той же смесью растворителей. Для отделения нелипидных компонентов добавляли воду.
Для анализа суммарных липидов отделяли нижнюю хлороформную фракцию. Хлороформ (осч, стабилизированный 0.005% амилена) из липидного экстракта удаляли под вакуумом с помощью ротационного вакуумного испарителя RVO-64 (“Simax”, Чехия). Для контроля экстрагируемости липидов (%) использовали нонадекановую кислоту (С19:0), добавляя ее известное количество на этапе гомогенизации. Метиловые эфиры ЖК (МЭЖК получали по методу Christie [11]. Дополнительную очистку МЭЖК проводили методом ТСХ на стеклянных пластинках с силикагелем КСКГ (Россия), в качестве подвижной фазы использовали бензол. Для визуализации зоны МЭЖК (Rf= 0.71–0.73) пластинки опрыскивали 10% H2SO4 в MeOH и нагревали в сушильном шкафу при 100°С. Зону МЭЖК удаляли с пластинки шпателем и элюировали с силикагеля (н)-гексаном. Анализ МЭЖК проводили методом ГЖХ с использованием хромато-масс-спектрометра 5973/6890N MSD/DS (“Agilent Technologies”, США). Детектор – квадрупольный масс-спектрометр, способ ионизации – электронный удар, энергия ионизации 70 эВ; анализ проводили в режиме регистрации полного ионного тока.
Для разделения смеси МЭЖК использовали капиллярную колонку HP-INNOWax (“Agilent Technologies”, США) (30 м × 250 мкм × 0.50 мкм) со стационарной фазой (ПЭГ). Газ-носитель – гелий, скорость потока газа – 1 мл/мин. Температура испарителя – 250°С, источника ионов – 230°C, детектора – 150°С; температура линии, соединяющей хроматограф с масс-спектрометром, – 280°С. Диапазон сканирования – 41–450 а. e. м. Объем вводимой пробы – 1 мкл, делитель потока – 5 : 1. Разделение смеси МЭЖК выполняли в изотермическом режиме при 200°С. Для идентификации ЖК использовали библиотеку масс-спектров NIST 08, а также архив масс-спектров МЭЖК Christie [12]. Относительное содержание ЖК определяли методом внутренней нормализации – в весовых процентах (вес. %) от их общего содержания в исследуемом образце с учетом коэффициента отклика ЖК.
Для характеристики степени ненасыщенности липидов использовали коэффициент ненасыщенности (k) и индекс двойной связи (ИДС) [13]:
(1)
$k~ = {{\Sigma {{P}_{{{\text{ненасыщенных}}}}}} \mathord{\left/ {\vphantom {{\Sigma {{P}_{{{\text{ненасыщенных}}}}}} {\Sigma {{P}_{{{\text{насыщенных}}}}}}}} \right. \kern-0em} {\Sigma {{P}_{{{\text{насыщенных}}}}}}},$(2)
${\text{ИДС}} = {{\Sigma {{P}_{j}}{{n}_{j}}} \mathord{\left/ {\vphantom {{\Sigma {{P}_{j}}{{n}_{j}}} {100}}} \right. \kern-0em} {100}},$Активность ацил-липидных мембранных ω9-, ω6- и ω3-десатураз, отвечающих за введение двойных связей в углеводородные цепи олеиновой (С18:1(n-9)), линолевой (С18:2(n-6)) и α-линоленовой (С18:3(n-3)) ЖК, рассчитывали как стеароил- (SDR), олеоил- (ODR) и линолеил- (LDR) десатуразные отношения [14] по формулам:
(3)
${\text{SDR}} = {{\left( {\% {\text{С}}18{\kern 1pt} :{\kern 1pt} 1} \right)} \mathord{\left/ {\vphantom {{\left( {\% {\text{С}}18{\kern 1pt} :{\kern 1pt} 1} \right)} {\left( {\% {\text{С}}18{\kern 1pt} :{\kern 1pt} 0 + \% {\text{С}}18{\kern 1pt} :{\kern 1pt} 1} \right)}}} \right. \kern-0em} {\left( {\% {\text{С}}18{\kern 1pt} :{\kern 1pt} 0 + \% {\text{С}}18{\kern 1pt} :{\kern 1pt} 1} \right)}},$(4)
$\begin{gathered} {\text{ODR}}~ = (\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 2 + {{\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3)} \mathord{\left/ {\vphantom {{\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3)} {(\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 1}}} \right. \kern-0em} {(\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 1}} + \\ + \,\,\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 2 + \% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3), \\ \end{gathered} $(5)
${\text{LDR}}~ = {{(\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3)} \mathord{\left/ {\vphantom {{(\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3)} {(\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 2 + \% {\text{C}}18{\kern 1pt} {\kern 1pt} :{\kern 1pt} 3)}}} \right. \kern-0em} {(\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 2 + \% {\text{C}}18{\kern 1pt} {\kern 1pt} :{\kern 1pt} 3)}},$Количественное определение ФЛ и их разделение на индивидуальные липиды проводили методом двумерной ТСХ с использованием систем растворителей. Первое направление: хлороформ : метанол : бензол : 28% аммиак (водный) в соотношении 65 : 30 : 10 : 6; второе направление: хлороформ : метанол : уксусная кислота : ацетон : бензол : вода, в соотношении 70 : 30 : 4 : 5 : 10 : 1. Для обнаружения и идентификации ФЛ в растительном материале использовали специфические реагенты: для фосфорсодержащих компонентов – молибденовый синий [15], для холин-содержащих липидов – реактив Драгендорфа, приготовленный по методу, описанному Вагнером с соавт. [16], для аминосодержащих липидов – 0.2% раствор нингидрина в ацетоне [17]. Количественное определение содержания ФЛ проводили по методу Васьковского [15].
Статистическая обработка. В таблицах представлены средние данные из 3–6 биологических повторностей и их стандартные отклонения. Статистическую обработку экспериментальных данных осуществляли с использованием пакета статистического анализа в среде Microsoft Office Excel 2010. Статистическую значимость различий сравниваемых средних значений оценивали с помощью t-критерия (P < 0.05).
РЕЗУЛЬТАТЫ
Значения абсолютного содержания СЛ в почках B. pendula и A. alnobetula subsp. fruticosa, соответствующие разным этапам их развития и фазам закаливания, представлены в таблице 1. Почки кустарника A. alnobetula subsp. fruticosa характеризовались в целом большим уровнем СЛ, чем почки B. pendula. Разница между этими видами по содержанию СЛ, в зависимости от месяца, достигала 1.1–1.3 раза, при этом она несколько сглаживалась к осеннему периоду, во время I фазы закаливания, при сокращении фотопериода и установлении низких положительных температур воздуха. В начале августа (05.08) во вновь сформированных почках B. pendula и A. alnobetula subsp. fruticosa отмечалось некоторое падение уровня СЛ по сравнению с июлем в 1.2 раза у обоих изученных видов. В дальнейшем количество СЛ заметно увеличивалось, достигая максимума во время глубокого физиологического покоя (20.09). Наиболее выраженное увеличение фонда СЛ отмечали с августа по сентябрь-октябрь, когда почки находились в I и II фазе закаливания. В это время продолжительность светового дня сократилась с 16.3 до 8.8 ч, а среднесуточная температура воздуха снизилась с 11–12°С до 2.2°С (рис. 1). С наступлением устойчивых отрицательных среднесуточных температур во второй половине октября и выпадением осадков в виде снега, темпы увеличения уровня СЛ замедлялись и оставались практически постоянными до зимнего периода. В целом, высокий уровень содержания суммарных липидов (до 284.1 мг/г сухой массы) в почках двух изученных древесно-кустарниковых видов, по всей вероятности, обеспечивает защиту меристематических тканей в зимний период и запас питательных веществ, необходимый для успешного начала вегетации весной следующего года [5].
Таблица 1.
Сезонные изменения содержания суммарных липидов в почках Betula pendula, Alnus alnobetula subsp. fruticosa
| Даты взятия проб |
Этапы развития; фаза закаливания |
Содержание СЛ, мг/г сухой массы | |
|---|---|---|---|
| Betula pendula | Alnus alnobetula subsp. fruticosa | ||
| 29.07 | Завершение роста побегов | 180.3 ± 6.6 | 233.3 ± 11.2 |
| 05.08 | Завершение роста побегов, вновь сформированные почки | 165.4 ± 7.9 | 204.5 ± 10.1 |
| 20.09 | Глубокий физиологический покой; I фаза закаливания | 266.4 ± 10.9 | 281.2 ± 12.9 |
| 21.10 | Вхождение в вынужденный покой; II фаза закаливания | 275.1 ± 6.7 | 284.1 ± 7.8 |
| 18.11 | Покоящиеся почки | 273.5 ± 5.6 | 285.2 ± 6.3 |
| 09.12 | Вынужденный покой | 278.3 ± 9.6 | 282.4 ± 6.9 |
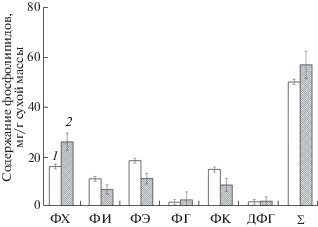
Среди ФЛ (рис. 2) основным является фосфатидилхолин (ФХ), относительное содержание которого во время летне-осенней вегетации увеличивается у B. pendula от 26.5 до 36.2%, у A. alnobetula subsp. fruticosa – от 31.9 до 45.6% от суммы ФЛ, соответственно. Осенью, в период I фазы закаливания, содержание фосфатидилэтаноламина (ФЭ) увеличилось в почках B. pendula в 1.1 раза, а у A. alnobetula subsp. fruticosa снизилось в 1.6 раза по сравнению с летними показателями, что, по-видимому, связано с защитными реакциями растений на неблагоприятные условия среды. Уровень содержания фосфатидилглицерина (ФГ) у A. alnobetula subsp. fruticosa в летне-осенний период оставался неизменным, около 2–3 мг/г сухой массы, что составляет 4.6% от суммы ФЛ. У B. pendula уровень содержания ФГ от лета к осени снижался несущественно и составлял 5.1 мг/г сухой массы. После завершения ростовых процессов с наступлением периода покоя содержание фосфатидной кислоты (ФК) в почках B. pendula увеличивалось в 2.9 раза по сравнению с летними показателями. У A. alnobetula subsp. fruticosa (рис. 3) содержание ФК, наоборот, с наступлением I фазы закаливания снижалось и составляло 8.6 мг/г сухой массы, что соответствовало 15% от суммы ФЛ, что, вероятно, связано с межвидовыми различиями. В течение исследуемого периода в почках лиственных деревьев и кустарников присутствовал дифосфатидилглицерин (ДФГ), абсолютное содержание которого в почках B. pendula в осенний период увеличивалось в 1.4 раза по сравнению с летним сезоном. У A. alnobetula subsp. fruticosa количество ДФГ в летне-осенний период составляло от 1.8 до 2.1 мг/г сухой массы, что соответствовало 3.5–3.7% от суммы ФЛ. В целом, суммарное содержание ФЛ у B. pendula изменялось от летнего к осеннему периоду и увеличивалось в 1.7 раза. Этот показатель для A. alnobetula subsp. fruticosa не имел заметных сезонных различий, что тоже, вероятно, связано с видовыми особенностями липидного обмена. Важным показателем, характеризующим состояние мембран в норме и при стрессе, является соотношение ФХ/ФЭ [18]. При действии закаливающих низких температур воздуха у B. pendula соотношение ФХ/ФЭ повышалось в 2 раза, а у кустарника A. alnobetula subsp. fruticosa этот показатель повышался в 2.3 раза.
Рис. 2.
Летне-осенние изменения содержания индивидуальных фосфолипидов в почках Betula pendula. 1 – лето; 2 – осень. ФХ – фосфатидилхолин; ФИ – фосфатидилинозит; ФЭ – фосфатидилэтаноламин; ФГ – фосфатидилглицерин; ФК – фосфатидная кислота; ДФГ – дифосфатидилглицерин; Σ – сумма фосфолипидов. Приведенные данные представляют среднее ± SD (n = 3).
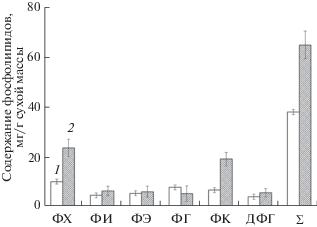
Рис. 3.
Летне-осенние изменения содержания индивидуальных фосфолипидов в почках Alnus fruticosa. 1 – лето; 2 – осень. ФХ – фосфатидилхолин; ФИ – фосфатидилинозит; ФЭ – фосфатидилэтаноламин; ФГ – фосфатидилглицерин; ФК – фосфатидная кислота; ДФГ – дифосфатидилглицерин; Σ – сумма фосфолипидов. Приведенные данные представляют среднее ±SD (n = 3).
При анализе сезонных изменений МЭЖК почек B. pendula, обнаружено довольно большое разнообразие, как насыщенных, так и ненасыщенных с одной или несколькими двойными связями ЖК (табл. 2). В почках B. pendula во время летнего и осеннего периодов идентифицировано 12 и 10 ЖК, а в зимнем периоде 18 ЖК, соответственно. Среди насыщенных ЖК во все сезоны преобладала пальмитиновая кислота С16:0, содержание которой в летний период было выше на 11.8% по сравнению с осенним и на 10.5% – по сравнению с зимним периодом. Среди ненасыщенных ЖК у B. pendula отчетливой динамикой изменений содержания отличались две – линолевая С18:2 и α-линоленовая С18:3. Так, абсолютное и относительное содержание С18:2 выросло, когда почки проходили I фазу закаливания низкими положительными осенними температурами на 1.6 мг/г или 9.0%, а в зимний период, во время вынужденного покоя почек на 3.2 мг/г или 8.6%, соответственно, по сравнению с летними показателями. Абсолютное содержание α-линоленовой кислоты С18:3 в почках березы повышалось с наступлением низких положительных закаливающих температур. Так, у осенних проб ее содержание увеличивалось на 2.2 мг/г сухой массы, относительное содержание – на 12.8% от суммы ЖК, а с наступлением экстремально низких температур в зимний период (средняя температура воздуха –40°С) содержание данной кислоты повышалось на 2.8 мг/г сухой массы или на 7.9% от суммы ЖК по сравнению с летними показателями. Понижение температуры в зимний период вызывает повышение содержания суммы ненасыщенных ЖК на 6.9 мг/г сухой массы или на 18.9% от суммы ЖК. В летний период липиды почек B. pendula характеризовались высоким содержанием насыщенных ЖК на 22.8% больше, чем в осенний период. Все это в совокупности приводит к значительному повышению коэффициента k (табл. 2), что, вероятно, достаточно для формирования морозоустойчивости березы повислой. Сезонные изменения абсолютного и относительного содержания ЖК суммарных липидов и активности соответствующих десатураз отражены в изменениях соответствующих коэффициентов десатурации (SDR, ODR, LDR).
Таблица 2.
Сезонные изменения ЖК-состава суммарных липидов в почках Betula pendula в Центральной Якутии
| Жирные кислоты | Летний период (29.07) | Осенний период (20.09) | Зимний период (09.12) | |||
|---|---|---|---|---|---|---|
| МЭЖК мг/г сухой массы |
% от суммы ЖК | МЭЖК мг/г сухой массы |
% от суммы ЖК | МЭЖК мг/г сухой массы |
% от суммы ЖК | |
| С 12:0 | – | – | – | – | 0.1 ± 0.1 | 0.5 ± 0.1 |
| С 14:0 | 0.2 ± 0.1 | 1.3 ± 0.2 | – | – | 0.2 ± 0.0 | 0.9 ± 0.1 |
| С 15:0 | – | – | – | – | 0.1 ± 0.0 | 0.5 ± 0.0 |
| С 16:0 | 4.9 ± 0.9 | 30.6 ± 1.9 | 3.1 ± 0.3 | 18.8 ± 0.4 | 4.4 ± 0.7 | 20.1 ± 0.4 |
| С 16:1 | 0.2 ± 0.0 | 1.3 ± 0.2 | 0.3 ± 0.0 | 1.8 ± 0.2 | 0.5 ± 0.0 | 2.3 ± 0.2 |
| С 17:0 | – | – | – | – | 0.1 ± 0.0 | 0.5 ± 0.0 |
| С 18:0 | 0.5 ± 0.1 | 3.1 ± 0.2 | 0.6 ± 0.0 | 3.6 ± 0.2 | 0.5 ± 0.0 | 2.3 ± 0.2 |
| С18:1 | 0.7 ± 0.1 | 4.4 ± 0.2 | 0.6 ± 0.1 | 3.6 ± 0.6 | 0.8 ± 0.2 | 3.7 ± 0.3 |
| i-C 18:1 | – | – | – | – | 0.2 ± 0.0 | 0.9 ± 0.1 |
| С18:2 | 3.6 ± 0.4 | 22.5 ± 2.0 | 5.2 ± 0.7 | 31.5 ± 1.8 | 6.8 ± 0.8 | 31.1 ± 3.5 |
| С18:3 | 2.9 ± 0.3 | 18.1 ± 1.9 | 5.1 ± 0.5 | 30.9 ± 1.1 | 5.7 ± 0.8 | 26.0 ± 2.9 |
| С 19:0 | 0.4 ± 0.1 | 2.5 ± 1.6 | 0.6 ± 0.2 | 3.6 ± 0.2 | – | – |
| С 20:0 | 0.3 ± 0.1 | 1.9 ± 0.7 | 0.4 ± 0.1 | 2.4 ± 0.2 | 0.5 ± 0.0 | 2.3 ± 0.4 |
| С 20:1 (11) | – | – | – | – | 0.2 ± 0.0 | 0.9 ± 0.0 |
| С 20:2 (11,13) | – | – | 0.3 ± 0.0 | 1.8 ± 0.2 | 0.1 ± 0.0 | 0.5 ± 0.1 |
| С 21:0 | – | – | 0.3 ± 0.0 | 1.8 ± 0.3 | – | – |
| С 22:0 | 1.6 ± 0.4 | 10.0 ± 1.9 | – | – | 0.9 ± 0.2 | 4.1 ± 0.4 |
| С 22:1 (13) | 0.1 ± 0.0 | 0.6 ± 0.3 | – | – | 0.1 ± 0.0 | 0.5 ± 0.2 |
| С 23:0 | – | – | – | – | 0.1 ± 0.0 | 0.5 ± 0.0 |
| С 24:0 | 0.6 ± 0.2 | 3.8 ± 0.1 | – | – | 0.6 ± 0.2 | 2.7 ± 0.8 |
| Σ | 16.0 ± 3.1 | 100 | 16.5 ± 1.9 | 100 | 21.9 ± 3.3 | 100 |
| Σнасыщенных | 8.5 ± 2.3 | 53.1 ± 4.2 | 5.0 ± 0.7 | 30.5.3 ± 2.5 | 7.5 ± 1.4 | 34.2 ± 0.7 |
| Σненасыщенных | 7.5 ± 1.1 | 46.9 ± 4.2 | 11.5 ± 1.3 | 69.7 ± 2.5 | 14.4 ± 1.9 | 65.8 ± 0.7 |
| k | 0.9 ± 0.2 | 2.3 ± 0.6 | 1.9 ± 0.2 | |||
| ИДС | 1.1 | 1.6 | 1.5 | |||
| SDR | 0.6 ± 0.1 | 0.5 ± 0.1 | 0.6 ± 0.2 | |||
| ODR | 0.9 ± 0.1 | 0.9 ± 0.2 | 0.9 ± 0.1 | |||
| LDR | 0.4 ± 0.0 | 0.5 ± 0.1 | 0.5 ± 0.0 | |||
По сравнению с составом ЖК почек древесных растений B. pubescens и B. pendula var. carelica [19, 20], произрастающих в условиях Карелии, липиды почек B. pendula в условиях Центральной Якутии во все изученные периоды характеризовались более высоким уровнем насыщенности, что, возможно, связано с различиями в условиях произрастания (экстремально низкие температуры, отсутствие оттепелей) в Якутии, и который вносит существенный вклад в липидный обмен. Так, Ветчинниковой с соавт. [4] при изучении ЖК состава мембранных липидов в почках березы повислой в зимне-весенний период в условиях криолитозоны было показано, что в ФЛ и гликолипидах в почках березы повислой ненасыщенные жирные кислоты преобладают над насыщенными. Однако в условиях экстремально низких температур воздуха (–40°С и ниже) были зафиксированы наименьшие значения показателей ИДС ЖК и коэффициента ненасыщенности (k). Подъем отрицательных температур (–20°С и выше) в условиях криолитозоны (в марте) способствовал возрастанию уровня ненасыщенности мембранных липидов [4].
В почках A. alnobetula subsp. frutiсosa в условиях Центральной Якутии было идентифицировано всего 15 ЖК (табл. 3), имеющих более богатый качественный состав осенью (15 ЖК) и зимой (14 ЖК) по сравнению с летним периодом (10 ЖК). Среди насыщенных ЖК суммарных липидов преобладала пальмитиновая кислота С16:0, ее относительное содержание изменялось от 29.3 до 17.6% от суммы ЖК. Уровень стеариновой (С18:0) кислоты в составе липидов почек снижался к концу периода наблюдений (осенне-зимний период) на 1.9 и 2.2 мг/г сухой массы, по сравнению с летним периодом. Снижение уровня стеариновой кислоты, с одной стороны, может быть связано с ее элонгацией с образованием ЖК с очень длинной цепью С20:0 и С22:0, а с другой, – с ее десатурацией стеароил АПБ Δ9 десатуразой с образованием олеиновой (18:1ω9) кислоты [21]. Среди моноеновых ЖК преобладала пальмитолеиновая С16:1, содержание которой достигало максимума в летний период (8.7%). Относительное содержание линолевой кислоты С18:2 увеличилось осенью на 7.3% от суммы ЖК. В почках кустарника A. alnobetula subsp. frutiсosa уровень содержания α‑линоленовой кислоты С18:3 в зимний период повысился на 9% по сравнению с летними показателями. В целом, суммарное содержание ЖК от летнего к осеннему периоду увеличилось на 5.4 мг/г сухой массы, а от летнего к зимнему периоду – на 4.3 мг/г сухой массы. Интересным представляется тот факт, что по мере снижения температуры в составе ЖК суммарных липидов появляется ряд новых минорных ненасыщенных ЖК, в том числе изо-кислот: С16:1(n-7), i-С18:1 и С24:1(Δ15). Присутствие разветвленных изо-ЖК в составе липидов является характерным признаком ЖК липидов хлоропластов в зачаточных листовых пластинках [22]. При действии низких положительных температур содержание α-линоленовой кислоты С18:3 повышалось на 20.5% и достигало 30.9% от суммы ЖК по сравнению с летним периодом. Похожие результаты были получены при изучении почек березы повислой, произрастающей в условиях Карелии. Так, доля триеновых ЖК достигала 33.4% от суммы ЖК [19]. Следует отметить, что в составе липидов ЖК березы повислой и ольхи кустарниковой присутствовали длинноцепочечные ЖК. Поскольку почки этих растений покрыты липким налетом, ЖК с очень длинной цепью могли быть компонентами именно этих липидов [23]. Следует отметить, что в значительных количествах длинноцепочечные ЖК идентифицированы в липидах хвои Pinaceae [24]. Тетраеновые ЖК в липидах почек B. pendula и A. alnobetula subsp. frutiсosa нам обнаружить не удалось. Абсолютное содержание ненасыщенных ЖК в почках ольхи кустарниковой от летнего к осеннему и затем к зимнему периоду возрастало на 3.4 и 2.5 мг/г сухой массы, соответственно.
Таблица 3.
Сезонные изменения ЖК-состава суммарных липидов в почках Alnus alnobetula subsp. fruticosa в Центральной Якутии
| Жирные кислоты | Летний период (29.07) | Осенний период (20.09) | Зимний период (09.12) | |||
|---|---|---|---|---|---|---|
| МЭЖК мг/г сухой массы |
% от суммы ЖК | МЭЖК мг/г сухой массы |
% от суммы ЖК | МЭЖК мг/г сухой массы |
% от суммы ЖК | |
| С 14:0 | 0.1 ± 0.00 | 1.1 ± 0.6 | 0.1 ± 0.0 | 0.7 ± 0.1 | 0.1 ± 0.0 | 0.5 ± 0.1 |
| С 15:0 | – | – | 0.1 ± 0.0 | 0.7 ± 0.3 | 0.1 ± 0.0 | 0.5 ± 0.3 |
| С 16:0 | 2.7 ± 0.3 | 29.3 ± 3.6 | 2.6 ± 0.3 | 17.8 ± 1.6 | 3.2 ± 0.3 | 17.6 ± 1.7 |
| С 16:1 | 0.8 ± 0.1 | 8.7 ± 0.8 | 0.4 ± 0.0 | 2.7 ± 0.6 | 0.4 ± 0.0 | 2.2 ± 0.6 |
| С 16:1 (n-7) | – | – | 0.1 ± 0.0 | 0.7 ± 0.1 | – | – |
| С 17:0 | – | – | 0.1 ± 0.0 | 0.7 ± 0.0 | 0.2 ± 0.0 | 1.1 ± 0.2 |
| С 18:0 | 0.3 ± 0.1 | 3.3 ± 0.8 | 0.2 ± 0.0 | 1.4 ± 0.2 | 0.2 ± 0.0 | 1.1 ± 0.2 |
| С18:1 | 0.2 ± 0.0 | 2.2 ± 0.1 | 0.2 ± 0.1 | 1.4 ± 0.1 | 0.3 ± 0.0 | 1.6 ± 0.2 |
| i-C 18:1 | – | – | 0.2 ± 0.0 | 1.4 ± 0.8 | 0.1 ± 0.0 | 0.5 ± 0.2 |
| С18:2 | 2.8 ± 0.5 | 30.4 ± 1.1 | 5.5 ± 0.1 | 37.7 ± 1.0 | 6.1 ± 0.4 | 33.5 ± 1.3 |
| С18:3 | 1.6 ± 0.4 | 17.4 ± 1.4 | 2.3 ± 0.3 | 15.8 ± 0.4 | 4.8 ± 0.3 | 26.4 ± 0.4 |
| C 20:0 | 0.2 ± 0.1 | 2.2 ± 1.3 | 0.3 ± 0.0 | 2.1 ± 0.4 | 0.3 ± 0.0 | 1.6 ± 0.4 |
| С 22:0 | 0.3 ± 0.0 | 3.3 ± 2.2 | 1.5 ± 0.4 | 10.3 ± 1.3 | 1.5 ± 0.4 | 8.2 ± 0.9 |
| С 24:0 | 0.2 ± 0.0 | 2.2 ± 1.5 | 0.9 ± 0.7 | 6.2 ± 4.4 | 0.8 ± 0.7 | 4.4 ± 0.2 |
| С 24:1 (15) | – | – | 0.1 ± 0.0 | 0.7 ± 0.2 | 0.1 ± 0.0 | 0.5 ± 0.2 |
| Σ | 9.2 ± 1.4 | 100 | 14.6 ± 2.8 | 100 | 13.5 ± 2.9 | 100 |
| Σ насыщенных | 3.8 ± 0.4 | 41.3 ± 2.4 | 5.8 ± 1.5 | 39.7 ± 2.4 | 5.6 ± 1.5 | 35.2 ± 2.0 |
| Σ ненасыщенных | 5.4 ± 1.0 | 58.7 ± 2.4 | 8.8 ± 1.3 | 60.3 ± 2.4 | 7.9 ± 1.4 | 64.8 ± 2.0 |
| k | 1.4 ± 0.2 | 1.5 ± 0.2 | 1.8 ± 0.2 | |||
| ИДС | 1.2 | 1.3 | 1.5 | |||
| SDR | 0.4 ± 0.1 | 0.5 ± 0.1 | 0.6 ± 0.1 | |||
| ODR | 1.0 ± 0.2 | 1.0 ± 0.2 | 1.0 ± 0.2 | |||
| LDR | 0.4 ± 0.1 | 0.3 ± 0.1 | 0.4 ± 0.1 | |||
ОБСУЖДЕНИЕ
Как известно, современная природная среда Центральной Якутии имеет позднеледниковый характер и рассматривается как палеогеографический реликт, сохраняющийся благодаря суровым природно-климатическим условиям. До настоящего времени климат, ландшафты, растительность и почвенный покров здесь имеют позднеледниковые черты. Это проявляется как в характере современного холодного и резко континентального климата, так и в существовании условий жизнедеятельности растений, адаптированных к низкотемпературному стрессу при длительной осенне-зимней гипотермии [2]. Резко континентальный климат мерзлотных экосистем, по всей вероятности, способствовал тому, что в процессе длительной эволюции древесно-кустарниковые растения здесь выработали сложные механизмы биохимической адаптации к экстремально низким температурам, среди которых существенная роль отводится и метаболизму липидов.
Важным этапом перехода от стрессовых факторов первой фазы холодового закаливания к адаптационным реакциям является изменение экспрессии генов, выражающееся в ингибировании тех из них, которые контролируют рост, развитие и функционирование дыхательной электрон-транспортной цепи растений [10]. Из представленных данных в таблицах 1, 2 и 3 следует, что основное увеличение СЛ наблюдается в первой фазе закаливания. Начало накопления липидов в почках древесно-кустарниковых растений – это один из признаков покоящихся клеток меристемы, формирование которых на начальных этапах зависит в основном от снижения фотопериода [25], а затем от понижения температуры воздуха в осенний период. Предполагается также, что повышение содержания липидов и их жирных кислот, в частности ПНЖК, свидетельствует об активации под влиянием низких положительных температур генов (desA, desB), кодирующих синтез соответствующих десатураз [10]. Эти десатуразы участвуют в образовании линолевой и α-линоленовой кислот.
Структурно-функциональная роль и локализация мембранных липидов в клетках, как известно, различаются. Так, ФЛ являются ключевыми компонентами плазмалеммы и других непластидных эндомембран. Результаты исследования показывают неоднозначную картину ответной реакции ФЛ тканей почек морозоустойчивых древесно-кустарниковых растений на сезонное снижение температуры (рис. 1, 2). Формирование криорезистентности живых тканей почек сопровождается активным биосинтезом ФХ с 9.9 мг/г в летний период до 23.4 мг/г сухой массы в осенний период у B. pendula, и c 15.1 до 26.4 мг/г у A. alnobetula subsp. frutiсosa. Такое изменение липидного матрикса клеточных мембран можно рассматривать как типичную адаптивную реакцию на снижение температуры, свойственную различным растительным организмам. Вместе с повышением содержания ФХ были обнаружены также существенные изменения в составе ФЛ. Например, соотношение ФХ к ФЭ увеличивалось с наступлением глубокого физиологического покоя во время I фазы закаливания. Известно, что ФЛ различаются по размеру полярной головки и типу конфигураций ламеллярной (присущей ФХ) и гексагональной фазы (характерной для ФЭ) в липидном бислое [26]. Избыточность гексагональной фазы в биологической мембране, помимо разрыва бислойной структуры, может инициировать образование дополнительных пор и водных каналов и, соответственно, увеличить пассивную диффузию воды через мембраны. То есть изменение таких параметров, как соотношения ФХ/ФЭ, направлены на сохранение упорядоченности и структурированности мембран, необходимых для контроля за проницаемостью и функциональной активностью мембраны [27].
После обнаруженного нами увеличения содержания СЛ, ФЛ, в частности ФХ и соотношения ФХ к ФЭ, мы провели исследование изменения ЖК-состава липидов почек при закаливании к низким температурам криолиозоны Якутии. Из данных таблиц 2 и 3 следует, что повышение содержания ненасыщенных ЖК и понижение среднесуточной температуры воздуха в осенне-зимний период (сентябрь–декабрь) обусловило повышение коэффициента ненасыщенности (k) до 2.3 у B. pendula и до 1.8 у A. alnobetula subsp. fruticosa. Сентябрьское повышение k у Betula pendula было результатом стабильного снижения уровня олеиновой кислоты и увеличения относительного содержания линолевой и α-линоленовой кислот.
Полученные нами данные вполне согласуются с литературными. По результатам исследований Ветчинниковой с соавт. [19, 20], в условиях Республики Карелии в почках B. pendula поддерживался высокий уровень суммы ненасыщенных ЖК (до 89% от суммы ЖК) по сравнению с долей насыщенных ЖК. По данным Морозовой и соавт. [23], абсолютное содержание ЖК почек березы повислой в расчете на 1 г сухой массы достигало зимой (11.01) до 23 мг/г, аналогичные результаты получены нами при анализе почек B. pendula – 21.9 мг/г сухой массы в зимний период.
В осенне-зимние периоды в почках изучаемых видов наблюдалось максимальное содержание ПНЖК (до 62.4% от суммы ЖК у березы повислой и 59.9% у ольхи кустарниковой). В природно-климатических условиях криолитозоны Якутии такой уровень ПНЖК, вероятно, обеспечивает выживание древесных растений к действию низких положительных и экстремально низких отрицательных температур в эти периоды. В липидах почек B. pendula, произрастающих в условиях Карелии, относительное содержание ПНЖК было несколько ниже и достигало до 40.6% от суммы ЖК [23].
Уровень ODR в зачаточных листьях у исследованных растений с сентября по декабрь практически не изменялся и в летне- и осенне-зимний периоды составлял 0.9−1.0, что, возможно, является показателем слабой зависимости десатуразы FAD6 от температуры и освещенности в эти периоды [28].
В условиях криолитозоны период интенсивного роста побегов у березы и ольхи, как и у других древесно-кустарниковых пород, начинается с весеннего распускания почек и заканчивается в основном к первой половине вегетационного периода. В этот период листья на побегах достигают своего максимального развития и заложенные в их пазухах почки проходят фазу предварительного (коррелятивного) покоя по мере усиления иссушающего напряжения факторов внешней среды, затухания вегетативного роста побегов и замыкания апикальной почки на них. Состояние покоя почек углубляется, и они переходят в новое качественное состояние – в фазу глубокого покоя в осенний период. Основное значение данного физиологического состояния в годичном цикле развития растений березы и ольхи заключается в накоплении ими запасных веществ, необходимых для процессов вызревания, закладки генеративных органов, а также для приобретения необходимой устойчивости к неблагоприятным условиям перезимовки и успешной последующей вегетации. Следующий этап в развитии побегов приходится на период устойчивого понижения температуры до 0°C и ниже. Побеги проходят I и II этапы закаливания, и почки постепенно восстанавливают способность к распусканию. В этот период в побегах происходит интенсивное превращение высокомолекулярных запасных веществ в низкомолекулярные защитные метаболиты, главным образом в углеводы, стрессовые белки-дегидрины [2, 4, 6] и, как показано нами, повышается содержание липидных компонентов: СЛ, ФЛ, абсолютное и относительное содержание ненасыщенных ЖК. С прохождением органического покоя почки на побегах еще длительное время не прорастают, так как остаются в состоянии вынужденного покоя, обусловленного наличием во внешней среде неблагоприятных для роста условий. В условиях Центральной Якутии вынужденный покой весьма продолжительный и охватывает у березы повислой и ольхи кустарниковой в среднем 180–185 дней [2].
Известно, что закаливание к гипотермии приводит к повышению содержания ненасыщенных ЖК в клеточных мембранах растений, что, в свою очередь, ведет к снижению температуры фазового перехода и, следовательно, предотвращает образование твердой фазы. Гексагональная форма молекул характерна не для всех липидов, а лишь для тех, которые не способны образовывать бислойные мембраны. Также ЖК могут оказывать влияние на энергетическую активность митохондрий, находясь не в составе мембран, а в свободном состоянии [29].
Таким образом, анализ сезонной динамики липидов и их ЖК почек B. pendula и A. alnobetula subsp. frutiсosa позволяет предположить, что максимальное содержание ПНЖК в осенне-зимние периоды обусловлено влиянием комплекса климатических факторов криолитозоны Якутии, таких как сокращение продолжительности светового дня и экстремально низкие значения температуры воздуха (рис. 1), характерные для этого времени года. В летний период в составе липидов клеточных мембран почек наблюдалось повышенное содержание насыщенных ЖК, что, по всей вероятности, связано с уменьшением активности десатураз. В переходный осенний период сокращение фотопериода, наряду с низкими температурами, являлось стрессовым фактором для клеточных мембран и приводило к повышению как доли ФХ, так и соотношения ФХ к ФЭ, относительного содержания ненасыщенных ЖК и уровня α-линоленовой кислоты в СЛ.
Результаты были получены в рамках выполнения государственного задания Минобрнауки России (FSRG-2020-0019).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Тимофеев П.А. Деревья и кустарники Якутии. Якутск: Бичик, 2003. 64 с.
Петров К.А. Криорезистентность растений: эколого-физиологические и биохимические аспекты. Новосибирск: СО РАН, 2016. 276 с.
Penfield S. Temperature perception and signal transduction in plants // New Phytol. 2008. V. 179. P. 615.
Ветчинникова Л.В., Татаринова Т.Д., Серебрякова О.С., Перк А.А., Пономарев А.Г., Ильинова М.К., Петрова Н.Е., Васильева И.В. Жирнокислотный состав мембранных липидов в почках березы повислой в зимне-весенний период в условиях криолитозоны // Цитология. 2019. Т. 5. С. 412.
Шуляковская Т.А., Ветчинникова Л.В., Канючкова Г.К., Ильинова М.К. Содержание липидов и жирнокислотный состав их фракций в различные фазы развития почек и листьев Betula pendula Roth и В. pubescens Ehrh. // Растительные ресурсы. 2004. Т. 40. С. 69–75.
Татаринова Т.Д., Бубякина В.В., Ветчинникова Л.В., Перк А.А., Пономарев А.Г., Васильева И.В. Стрессовые белки-дегидрины в почках березы в контрастных по климату регионах // Цитология. 2017. Т. 59. С. 156.
Котеева Н.К. Особенности сезонной ритмики ультраструктуры клеток апикальной меристемы побега и мезофилла хвои Pinus sylvestris (Pinaceae) / Бот. журнал. 2002. С. 50.
Трунова Т.И. Растение и низкотемпературный стресс. 64-е Тимирязевское чтение. Москва: Наука, 2007. 54 с.
Чиркова Т.В. Физиологические основы устойчивости растений. Санкт-Петербург: СПбГУ, 2002. 244 с.
Лось Д.А. Десатуразы жирных кислот. Москва: Научный мир, 2014. 486 с.
Christie W.W. Preparation of ester derivatives of fatty acids for chromatographic analysis // Advances in Lipid Methodology – Two / Ed. Christie W.W. Dundee: Oily Press, 1993. P. 69.
Christie W.W. The AOCS lipid library: methyl esters of fatty acids // Archive of Mass Spectra. 2010. http:// li-pidlibrary.aocs.org/ms/arch_me/index.htm
Lyons J.M., Wheaton T.A., Pratt H.R. Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plants // Plant Physiol. 1964. V. 39. P. 262.
Jaworski J.G., Stumpf P.K. Fat metabolism in higher plants. Properties of a soluble stearyl-acyl carrier protein desaturase from maturing Carthamus tinctorius // Arch. Biochem. Biophys. 1974. V. 162. P. 158.
Vaskovsky V.E., Kostetsky J.M., Vasendin E.Y. A universal reagent for phospholipid analysis // J. Chromatogr. 1975. V. 114. P. 129. https://doi.org/10.1016/S0021-9673(00)85249-8
Wagner H., Horhammer L., Wolf P. Dunnschicht chromatographic von phosphatiden and glycolipiden // Biochem. Z. 1961. V. 334. P. 175.
Кейтс М. Техника липидологии. Москва: Мир, 1975. 322 с.
Озолина Н.В., Гурина В.В., Нестеркина И.С., Нурминский В.Н. Динамика содержания фосфолипидов вакуолярной мембраны корнеплодов столовой свеклы при абиотических стрессах // Физиология растений. 2018. Т. 65. С. 358.
Ветчинникова Л.В., Шуляковская Т.А., Канючкова Г.К. Жирнокислотный состав суммарных липидов различных органов Betula pendula Roth и В. pubescens Ehrh., произрастающих в Карелии // Растительные ресурсы. 2000. Т. 36. Вып. 2. С. 85.
Ветчинникова Л.В. Береза: вопросы изменчивости (морфо-физиологические и биохимические аспекты). Москва: Наука, 2004. 183 с.
Ramli U.S., Bakaer D.S., Qunt P.A., Harwood J.L. Control analysis of biosynthesis in tissue culture from oil crops shows that flux control is shared between fatty acid synthesis and lipid assembly // Biochem. J. 2007. V. 364. P. 393.
Mongrad S., Badoc A., Patouille B., Lacomblez C., Chavent M., Cassagne C., Bessoule J.J. Taxonomy of gymnospermae: multivariate analyses of leaf fatty acid composition // Phytochemistry. 2001. V. 58. P. 101.
Морозова И.В., Чернобровкина Н.П., Ильинова М.К., Пчёлкин В.П., Цыдендамдаев В.Д. Содержание и состав жирных кислот суммарных липидов почек Betula pubescens, B. pendula, B. pendula var. carelica // Физиология растений. 2019. Т. 66. С. 146.
Макаренко С.П., Константинов Ю.М., Шмаков В.Н., Коненкина Т.А. Жирнокислотный состав липидов каллусов двух видов сосны Pinus sibirica и Pinus sylvestris // Физиология растений. 2010. Т. 57. С. 790.
Софронова В.Е., Чепалов В.А., Дымова О.В., Головко Т.К. Роль пигментной системы вечнозеленого кустарничка Ephedra monosperma в адаптации к климату Центральной Якутии // Физиология растений. 2014. Т. 61. С. 266.
Wu J., Seliskar D., Gallagher J. The response of plasma membrane lipid composition in callus of the halophyte Spartina patens (Poaceae) to salinity stress // Am. J. Bot. 2005. V. 92. P. 852.
Розенцвет О.А., Нестеров В.Н., Богданова Е.С. Структурные и физиолого-биохимические аспекты солеустойчивости галофитов // Физиология растений. 2017. Т. 64. С. 251.
Martz F., Kivinlemi S., Palva T.E., Sutinen M.L. Contribution of omega-3 fatty acid desaturase and 3-ketoacyl-ACP synthase II (KASII) genes in the modulation of glycerolipid fatty acid composition during cold acclimation in birch leaves // J. Exp. Bot. 2006. V. 57. P. 897.
Дроздов С.Н., Курец В.К. Некоторые аспекты экологической физиологии растений. Петрозаводск: ПетрГУ, 2003. 172 с.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


