Физиология растений, 2020, T. 67, № 4, стр. 438-448
Изменение морфометрических показателей клеток и трихом Arthrospira (Spirulina) platensis при обезвоживании и в период реактивации
И. А. Харчук *
Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр
Институт биологии южных морей им. А.О. Ковалевского Российской академии наук
Севастополь, Россия
* E-mail: seaferm@yandex.ru
Поступила в редакцию 01.04.2019
После доработки 18.10.2019
Принята к публикации 23.10.2019
Аннотация
Разработка методов длительного хранения микроводорослей остается важной и сложной проблемой, решение которой невозможно без изучения процессов, происходящих при де- и регидратации вегетативных клеток. В работе представлены результаты изучения изменения размерных характеристик клеток и трихом спирулины Arthrospira (Spirulina) platensis (Nordstedt) Gomont после обезвоживания и во время реактивации (в динамике), а также процессов, происходящих в них на протяжении реактивации. Были выбраны способы дегидратации, максимально приближенные к естественным. Проведены морфометрические измерения клеток и трихом спирулины в нативном состоянии, во время дегидратации и регидратации. Установлено, что обезвоживание А. platensis сопровождалось статистически значимыми изменениями морфометрических характеристик клеток. При всех способах дегидратации (в термостате при температуре 30, 60°С и на силикагеле в эксикаторе при комнатной температуре 20°С) отмечено уменьшение их размеров, а также удлинение и уплощение. При этом толщина и объем трихом после обезвоживания сокращались в 2 раза. Все процессы, происходящие при реактивации, были прослежены в динамике, начиная с момента увлажнения и до появления молодых нитей. Отмечено относительно быстрое обводнение высушенных клеток и постепенное восстановление их морфометрических характеристик. Среди реактивирующихся трихом были обнаружены такие, в которых хорошо заметно разделение на жизнеспособные участки и необратимо поврежденные. При дифференциальном окрашивании трихом метиленовым синим были выявлены клетки с сильным плазмолизом внутри внешне неповрежденных нитей. Восстановление морфометрических показателей клеток спирулины происходило в течение 24 ч. Данный факт указывает на то, что в обезвоженных культурах после регидратации осуществляется ряд сложнейших биохимических процессов, благодаря которым воссоздается первоначальное физиологическое состояние клеток.
ВВЕДЕНИЕ
В последние годы повысился интерес к методам обезвоживания биомассы микроводорослей и цианобактерий как в качестве подготовки сырья для биотехнологической промышленности [1–3], так и для длительного хранения в жизнеспособном состоянии в коллекционной практике [4, 5]. Следует отметить, что для разных поставленных задач предусмотрены, соответственно, разные способы подготовки сырья. В первом случае необходимо, чтобы качества сырья после обезвоживания были сохранены и легко извлекались при дальнейшей обработке, во втором случае требуется сохранение клеток в жизнеспособном состоянии с целью последующего оживления через какое-то время. Опубликованы расширенные обзоры по методам обезвоживания и подготовки биомассы для дальнейшего биотехнологического применения [1, 2]. Существуют такие способы сушки: лиофильная, вакуумная, конвекторная, распылительная, ротационная, тонкослойная, флеш-сушка, солнечная и т.д. [2, 6]. Все эти методы связаны с большими энергетическими и денежными затратами и низкой эффективностью. Однако методы длительного хранения микроводорослей должны быть разработаны таким образом, чтобы устранить возможное повреждение клеток и ухудшение их качеств, а также сохранить жизнеспособность.
Вызывает интерес сохранение микроорганизмов в состоянии анабиоза. Его можно достичь как при помощи обезвоживания, так и при помощи замораживания. В результате происходит временное замедление или прекращение жизненных процессов в организме под воздействием внешних или внутренних факторов с последующим возвратом их к метаболической активности в физиологически оптимальных условиях культивирования. Наиболее часто используемым методом как в коллекциях культур, так и в промышленности является лиофилизация (сублимационная сушка). Она успешно применяется для сохранения дрожжей и спорулирующих грибов, бактерий [4, 7], для цианобактерий, размножающихся гетероцистами или акинетами (спорами), а также для тех видов, которые способны синтезировать экзополисахариды [4, 6, 8]. Суспензирование клеток с защитным средами перед лиофилизацией значительно повысило количество выживших культур [5, 8]. Для микроводорослей лиофильная сушка была менее успешной, т.к. отмечен низкий уровень жизнеспособности (<1% от первоначальной популяции) и дальнейшее снижение жизнеспособности при длительном хранении [8]. Преимущество данного метода состоит в том, что он исключает загрязнение и заражение во время хранения, а сохраняемые микроорганизмы демонстрируют устойчивую жизнеспособность. Однако установлено, что процесс лиофилизации приводит к отбору наиболее устойчивых клеток в культуре, которые могут и не обладать желаемыми свойствами [9]. При этом требуются инвестиционные затраты и определенные практические навыки от персонала [4]. Следует отметить, что лиофилизация не обеспечивает стопроцентной жизнеспособности сохраняемых клеток микроорганизмов и наивысшее качество сухого продукта.
В состояние холодового анабиоза биологические объекты переводят с помощью криоконсервации, которая осуществляется путем замораживания клеток в различных условиях с последующим их хранением в замороженном состоянии. Известно, что большинство культивируемых цианобактерий и почвенных микроводорослей подлежат криоконсервированию с относительно высокой жизнеспособностью. Многие пресноводные и морские эукариотические водоросли также были криоконсервированы, но с более низким уровнем жизнеспособности после оттаивания. Однако большинство динофлагеллят, криптофитов, синурофитов и рафидофитов не подлежат криоконсервированию. Разработка двухстадийного способа криоконсервирования позволила достичь положительных результатов [5, 10, 11]. Отмечено, что практически все водоросли с большим размером клеток, а также большинство нитчатых штаммов пока не могут быть криоконсервированы. Недостатки метода: 1) при длительном хранении происходят химические повреждения из-за образования свободных радикалов, которые могут повредить нуклеиновые кислоты и со временем повлиять на генетическую стабильность [11]; 2) значительные экономические вложения для приобретения специального оборудования и трудоемкость процесса.
Хранение микроводорослей, переведенных в состояние ангидробиоза путем их обезвоживания, – простой и экономически выгодный способ, потому что не требует специального оборудования, среды для длительного хранения и подготовленного штата сотрудников. Метод перевода микроорганизмов в состояние ангидробиоза прост, при этом риск заражения штаммов и генетического дрейфа, как это возможно при серийном субкультивировании, снижается [12, 13]. Учитывая то, что ангидробиоз – глубокое и длительное торможение метаболизма, обратимое при благоприятных условиях и достаточно распространенное явление в природе, переход клеток в ангидробиотическое состояние, выход из него и восстановление полной жизнедеятельности представляет общебиологический интерес. Исследований по ангидробиозу микроводорослей выполнено крайне мало [14–18]. Основная часть экспериментальных работ проведена на бактериях и дрожжах [9, 19, 20], поэтому разработка методов длительного хранения микроводорослей остается важной и сложной проблемой, решение которой невозможно без изучения процессов, происходящих при де- и регидратации вегетативных клеток.
Цель работы – изучение изменения размерных характеристик клеток и трихом Arthrospira (Spirulina) platensis после обезвоживания и во время реактивации (в динамике).
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служила культура Arthrospira (Spirulina) platensis (Nordstedt) Gomont (штамм IBBS–31) из коллекции отдела биотехнологии и фиторесурсов Института биологии южных морей РАН (ИнБЮМ РАН). Штамм поступил в 1996 г. из Южного научно-исследовательского института рыбного хозяйства и океанографии, (г. Керчь, Крым), где и был идентифицирован. Последние определения штамма с помощью микроскопирования были проведены в Институте биологии южных морей НАНУ в 2006 г. Алисиевич А.В., в 2014 г. – Брянцевой Ю.В.; в ИнБЮМ РАН – в 2018 г. Меметшаевой О.А. Цианобактерии выращивали в режиме накопительного культивирования при постоянном круглосуточном освещении и автоматическом перемешивании с использованием насоса для удаления избытка кислорода из среды и равномерного прогрева всего слоя питательного раствора культуры. Барботировали атмосферным воздухом с общей скоростью подачи 1.42 л/мин, что составляло 0.35 л/(мин л культуры). Интенсивность света на поверхности раствора культуры составляла 10.7 кЛк, измеряли прибором Ю-116 (ПО “Вибратор”, СССР). Температура среды колебалась в диапазоне 20–25°С. В качестве питательной среды для А. platensis использовали среду Заррук [21]. Культиваторами служили стеклянные стаканы объемом 2 л, объем среды в которых составлял 1 л при высоте слоя 14–15 см.
Рост культур регистрировали фотометрическим методом по оптической плотности суспензии водорослей в области 750 нм (D750), измеряемой на спектрофотомере UNICO 2100 (“UNICO”, США) в кюветах с рабочей длиной 5 мм. Для этого ежедневно в одно и то же время объем культуры доводили до первоначального объема водой (для компенсации испарения), суспензию тщательно перемешивали и отбирали по периметру культиватора и в центре несколько проб до общего объема 3 мл. Затем брали среднюю порцию (0.5 мл), а остальную часть возвращали в культиватор.
На стационарной стадии роста трихомы А. platensis концентрировали путем их фильтрации через мельничный газ 100–105 ПЭ. Сконцентрированную культуру А. platensis промывали дистиллированной водой в соотношении 1 : 3 (вода : клетки) для полного отмывания от солей и сохранения клеточных мембран и оболочек. Затем полученную пасту водорослей разделяли на три части и высушивали до воздушно-сухого состояния двумя способами: 1) в термостате при температурах 30 и 60°С; 2) в эксикаторе с силикагелем при комнатной температуре (21–22°С). Продолжительность обезвоживания составила 24 ч. Обезвоженные клетки микроводорослей хранили в герметично закрытых полиэтиленовых упаковках в темноте при температуре 15–20°С. Реактивировали А. platensis при комнатной температуре в чашках Петри средой Заррука (1 : 2).
Выявление живых и мертвых клеток циабактерий осуществляли с помощью светового микроскопа Carl Zeiss (“Axiostar plus”, Германия) методом дифференциального окрашивания клеток метиленовым синим [22]. Одновременно учитывали количество реактивируемых клеток и определяли долю клеток, сохранивших жизнеспособность. Под жизнеспособностью подразумевали способность А. platensis эндогенно поглощать краситель.
Морфологические исследования проводили с использованием растрового электронного микроскопа JSM-6060 LV (“JEOL”, Япония) и светового микроскопа Carl Zeiss (“Axiostar plus”, Германия). Традиционные методы подготовки образцов для сканирующей электронной микроскопии заключаются в химической фиксации препаратов, их обезвоживании в растворах спиртов или ацетона и высушивании различными способами (на воздухе, путем лиофилизации или с помощью метода сушки в критической точке) и последующего напыления препаратов металлом в вакуумной установке [23]. Проведение подобной фиксации приводит к оводнению препарата. Для того чтобы этого избежать, при химической фиксации клеток к дискам-подложкам приклеивали гранулы обезвоженных клеток, высушенных обычным способом. Затем образцы подвергали напылению металлом.
Объемы и площади поверхности микроводорослей рассчитывали по формулам, разработанным Ю.В. Брянцевой [24, 25] с помощью программы Plankton.2. Также вычисляли индекс сферичности (ω) – отношение “минимальной” поверхности объекта, т.е. той, которую он бы имел в форме шара при данном объеме, к реальной поверхности:
где S1 – “минимальная” поверхность, S – реальная поверхность.Методика вычисления индекса ω была следующей [24]: производили математические преобразования (подставляли значение числа π и диаметр вместо радиуса, соответственно, D = R × 2), получали измененную формулу для расчета объема шара:
отсюда находили, что:(3)
$D = {{{\text{ }}{{V}^{{0.333}}}} \mathord{\left/ {\vphantom {{{\text{ }}{{V}^{{0.333}}}} {0.806}}} \right. \kern-0em} {0.806}}.$Объем конкретного объекта был приравнен к объему шара. Подставив это значение в формулу (3), была найдена величина диаметра шара с известным объемом. После этого рассчитывали площадь поверхности шара (“минимальную”) с данным диаметром:
Подставив значения S1 и S в формулу (1), рассчитывали коэффициент ω. После обобщения всех расчетов, была получена следующая формула:
(5)
$\omega = {{4.836{{V}^{{0.667}}}} \mathord{\left/ {\vphantom {{4.836{{V}^{{0.667}}}} S}} \right. \kern-0em} S}.$Индекс ω может быть использован как для оценки состояния сообществ, так и отдельных культур (штаммов) микроводорослей и цианобактерий.
Для оценки размеров клетки и трихом по каждому показателю было произведено не менее 100 промеров. Статистическая обработка данных выполнялась по стандартным программным пакетам для персонального компьютера. Вычисляли среднюю арифметическую, стандартное отклонение, ошибку средней, достоверность различий выборочных средних c помощью парного t‑критерия Сьюдента, где t – значения t-критерия Стьюдента, рассчитанные по экспериментальным данным для зависимых выборок, t05 – теоретические критические значения t-критерия Стьюдента при уровне значимости Р = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфометрические изменения клеток и трихом А. platensis при обезвоживании представлены на рис. 1. Установлено, что обезвоживание А. platensis сопровождалось статистически значимыми изменениями морфометрических характеристик клеток. При всех способах дегидратации отмечено уменьшение размеров клеток, а также их удлинение и уплощение. Дегидратация при температуре 30°С приводила к уменьшению ширины клеток на 28% (t = 7.98 > t05 = 2.04) по сравнению с контрольными образцами (рис. 1). В клетках, дегидратированных при 60°С, ширина уменьшалась на 31% (t = 9.05 > t05 = 2.02). При втором способе обезвоживания ширина клеток в трихомах сокращалась на 25% (t = 7.29 > t05 = 2.02). Длина клеток в сухих трихомах, обезвоженных при 60°С, превышала таковую у контрольных клеток на 22% (t = 2.37 > t05 = 2.05), а при 30°С и на силикагеле при комнатной температуре отмечено ее увеличение на 2–3%; изменение этих параметров было статистически незначимым (t = 0.37 < t05 = 2.04 и t = 0.26 < t05 = 2.05). Толщина и объем трихом после обезвоживания сокращались примерно в 2 раза. Аналогичное уплощение обезвоженных клеток было выявлено и при электронно-микроскопических исследованиях (рис. 2).
Рис. 1.
Изменение размеров клеток и трихом Arthrospira (Spirulina) platensis при обезвоживании. Условия обезвоживания: 30, 60°С и в эксикаторе на силикагеле. (а) – Длина клеток, (б) – ширина клеток, (в) – площадь поверхности клеток, (г) – объем клеток, (д) – длина трихом, (е) – толщина трихом.
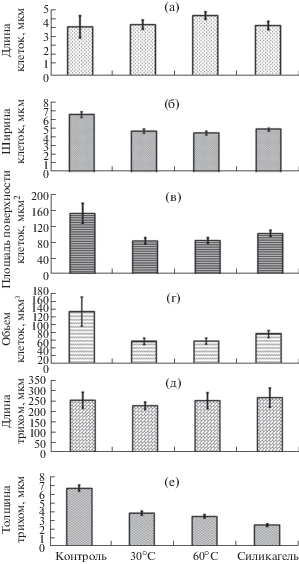
Рис. 2.
Обезвоженные трихомы Arthrospira (Spirulina) platensis. Препараты приготовлены без химической фиксации. Увеличение ×10 000 (а) и ×20 000 (б).

Отмечено статистически достоверное увеличение индекса сферичности формы, максимум которого регистрировался в обезвоженных клетках при 60°С (t = 5.41 > t05 = 2.02), при 30°С (t = 5.25 > > t05 = 2.04) и на силикагеле (t = 3.53 > t05 = 2.02). Во время дегидратации происходило изменение пропорций клеток за счет снижения ширины и увеличения длины, в результате чего клетка по форме приближалась к сфере. Индекс сферичности обезвоженных клеток, независимо от температуры и условий дегидратации, был одинаков и статистически не различался, что указывает на сходные изменения во время обезвоживания.
Исследования, проведенные с помощью сканирующей электронной микроскопии, подтвердили данные, полученные при световой микроскопии. Обезвоживание А. platensis независимо от способа дегидратации приводило к уменьшению размеров клеток и трихом по сравнению с контрольной культурой водорослей. Подобные изменения были отмечены при обезвоживании дрожжей и бактерий [19], микроскопических беспозвоночных животных [7], нематод [7], а также водорослей [18].
Следует отметить, что во время обезвоживания в клетках растений происходил ряд необратимых изменений. Во-первых, недостаток воды вызывал сильное уплотнение “основных” групп фосфолипидов в клеточных мембранах и тилакоидах, что, в свою очередь, приводило к увеличению ван-дер-ваальсовых сил между углеводными цепями [7]. Высушенные при комнатной температуре липиды превращались в гель, а затем при регидратации снова принимали жидкое состояние, но становились проницаемыми, в результате чего нарушалась структурная целостность мембран [7, 26].
Полученные результаты свидетельствуют о статистически достоверных и стойких изменениях клеточной стенки А. platensis, определяющей форму и размер клеток, а также об определенных перестройках, связанных со структурной организацией пептидогликанового компонента клеточной стенки, ответственного за ее ригидность [27]. Перестройки структурно-функциональных свойств клеточной стенки, происходящие в процессе перехода А. platensis в состояние ангидробиоза, по-видимому, определяются нарушениями их молекулярной организации.
После непродолжительного пребывания в состоянии ангидробиоза трихомы А. platensis подлежали реактивации. Данное явление условно разделяют на три этапа: регидратацию (обводнение клеток), репарацию (восстановление внутренних структур) и собственно деление. Изменения размеров клеток и трихом во время их регидратации и репарации представлены на рис. 3. В процессе регидратации (обводнении) отмечено, что через 30 мин после увлажнения ширина клеток, обезвоженных при 30°С, восстанавливалась на 90% (t = = 3.88 > t05 = 2.00), при 60°С – на 88% контрольного образца (t = 4.26 > t05 = 2.02) и не изменялась в течение 24 ч (рис. 3). При втором способе обезвоживания ширина клеток в трихомах через 30 мин после добавления среды достигала 88% контрольного образца (t = 4.49 > t05 = 2.02), после 24 ч – 91% (t = 2.79 > t05 = 2.02).
Рис. 3.
Морфометрические изменения клеток Arthrospira (Spirulina) platensis во время реактивации. Условия предварительного обезвоживания: 30, 60°С и в эксикаторе на силикагеле. (а) – Длина клеток, (б) – ширина клеток, (в) – площадь поверхности клеток, (г) – объем клеток, (д) – длина трихом, (е) – толщина трихом.
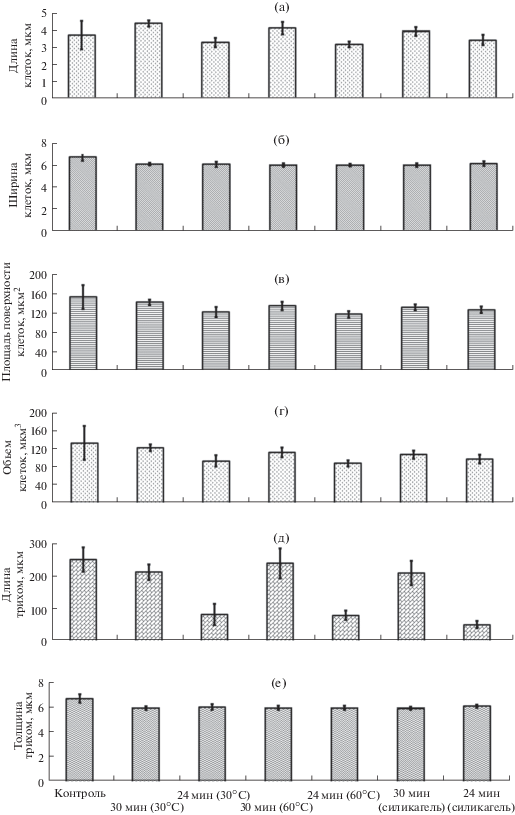
Длина клеток через 30 мин после начала реактивации изменялась следующим образом: при 30°С она увеличилась на 18% (t = 2.38 > t05 = 2.00) по сравнению с контролем, при 60°С – на 11% (t = = 0.99 < t05 = 2.02), в эксикаторе с силикагелем – на 5% (t = 0.66 < t05 = 2.02). По прошествии суток клетки приобретали свою нативную форму и их длины соответствовали 88% (t = 1.66 < t05 = 2.05) контрольного образца у клеток, дегидратированных при 30°С, 85% (t = 1.93 < t05 = 2.00) – при 60°С, 92% (t = 0.82 < t05 = 2.02) – на силикагеле.
В процессе реактивации толщина клеток возрастала в 2 раза независимо от условий дегидратации. После 24 ч реактивации наблюдали уменьшение длины трихом в 3–5 раз при всех способах обезвоживания культур. Объем сухих трихом составлял половину их объема до дегидратации. Спустя 30 мин регидратации он восстанавливался, однако через 24 ч сокращался в среднем на 30%, что связано с уменьшением длины трихом в процессе реактивации.
После регидратации, независимо от способа обезвоживания, индекс сферичности статистически не различался, что говорит о сходных морфологических изменениях во время обезвоживания. Таким образом, измерение основных геометрических параметров клеток, регидратируемых после обезвоживания, позволило выявить, что восстановление размеров клеток происходит в течение 24-часовой реактивации в питательной среде.
Восстановление клетками А. platensis исходных размеров и формы лишь после довольно продолжительной реактивации подтверждает наличие существенных изменений клеточной стенки, определяющей форму и размер. Как видно из приведенных выше результатов, в процессе регидратации клетки приобретали первоначальный вид, однако при обезвоживании происходили существенные изменения в обмене веществ и энергии, а также частично повреждались клеточные структуры и, по-видимому, полная реактивация микроорганизмов требует большего времени [19].
На начальных этапах выхода из ангидробиоза количество воды в клетках повышается и одновременно увеличивается интенсивность дыхания [16]. Связано это с тем, что твердая структура сухого протоплазменного геля (рис. 4), обычная для состояния анабиоза, по мере увеличения содержания воды претерпевает изменения, характерные для набухающего геля: увеличивается размер промежутков в остове геля, повышается количество свободной воды в них, усиливается связь промежутков. С достижением определенного количества свободной воды протоплазма клетки начинает восстанавливаться, воссоздается связь структур клеток друг с другом, что и является условием для начала метаболизма. Возобновляется ассимиляция веществ, в дополнение к уже происходившей диссимиляции, создается их сочетание, что приводит сначала к слабой и ограниченной, а затем, при еще большем содержании воды, к полной жизнедеятельности [16].
Рис. 4.
Разлом обезвоженной клетки Arthrospira (Spirulina) platensis, вид сухого протоплазменного геля. Препарат приготовлен без химической фиксации (увеличение ×20 000).

Однако не все клетки восстанавливаются после обезвоживания, часть из них погибает при высушивании. Известно, что термическая сушка микробных клеток при умеренной температуре предполагает резкое изменение осмотического давления и вызывает гибель клеток [1]; напротив, медленное и постепенное повышение осмотического давления позволяет клеткам адаптироваться и приводит к повышению выживаемости клеток до 80%. Быстрый процесс сушки также приводит к повышению скорости гибели клеток во время хранения. Если обезвоживание будет слишком медленным, то под действием осмотического давления деформации клеток становятся критическими, что приводит к увеличению смертности из-за длительного воздействия стресса. Установлено, что микроорганизмы, обезвоженные в температурном диапазоне 8–25°С, более чувствительны к осмотическому давлению, вызванному дегидратацией по сравнению с температурой выше 25 и ниже 8°С. Причина этого связана с фазовым переходом мембраны при указанном диапазоне температуры, который может привести к увеличению чувствительности липидного бислоя, вызванного диффузией [1]. В наших исследованиях цианобактерии были обезвожены при температуре 30 и 60°С, что, вероятно, позволило клетками адаптироваться. Tomasseli [27] описывает у A. platensis специализированные клетки, по которым происходит трансцеллюлярный разрыв трихомы с формированием более коротких фрагментов. Возможно, эти клетки разрушались во время обезвоживания в нашем эксперименте.
Динамика реактивации цианобактерии из состояния ангидробиоза была рассмотрена подробно при помощи световой микроскопии (рис. 5). Во время реактивации непосредственно под микроскопом было отмечено относительно быстрое обводнение высушенных клеток и постепенное восстановление их морфометрических характеристик. Среди реактивирующихся трихом были обнаружены такие, в которых хорошо заметно разделение на жизнеспособные участки и необратимо поврежденные. Все процессы, происходящие при реактивации, были прослежены в динамике, начиная с момента увлажнения и до появления молодых нитей.
Рис. 5.
Динамика реактивации Arthrospira (Spirulina) platensis из состояния ангидробиоза: (а) – трихомы A. platensis через 5 мин после увлажнения (суммарное увеличение 631.2), стрелками показаны поврежденные концы трихом; (б) – трихомы A. platensis через 30 мин после увлажнения (суммарное увеличение 631.2); (в) – трихомы A. platensis, окрашенные красителем метиленовым синим, через 30 мин после увлажнения (суммарное увеличение 633); (г) – трихомы A. platensis, окрашенные красителем метиленовым синим, через 30 мин после увлажнения (суммарное увеличение 631.9), стрелками показаны клетки с плазмолизом; (д) – трихомы A. platensis через 1 ч после начала реактивации (увеличение 630); (е) – интактная нить A. platensis на фоне распавшихся трихом через 2 ч после начала реактивации (суммарное увеличение 631.5); (ж) – выделение жизнеспособных участков внутри реактивированных трихом A. platensis через 24 ч после начала реактивации (суммарное увеличение 202.4), стрелками показаны жизнеспособные участки трихом; (з) – трихома A. platensis через 24 ч после начала реактивации, окрашена метиленовым синим (суммарное увеличение 632.4); (и) – трихома A. platensis через 72 ч после начала реактивации (суммарное увеличение 631.2); (к) – трихома A. platensis через 96 ч после начала реактивации (суммарное увеличение 632.4).

На рис. 5а представлены трихомы спирулины через 5 мин после увлажнения. На фотографии отчетливо видны поврежденные концы трихом, которые отличаются по цвету и выглядят как пустые клетки. Вероятно, при обезвоживании цитоплазма клеток была необратимо повреждена. Через 30 мин трихомы оставались без изменений, были неподвижными, при этом процесс обводнения клеток продолжался и восстанавливался первоначальный объем (рис. 5б). После окрашивания трихом метиленовым синим при микроскопировании были выявлены клетки с сильным плазмолизом внутри внешне неповрежденных трихом (рис. 5в, 5г). Мертвые клетки не окрашивались, в то время как живые клетки характеризовались диффузным синим окрашиванием цитоплазмы. Клетки без плазмолиза были способны к дальнейшему развитию.
Через 1–2 ч от начала реактивации некоторые трихомы А. platensis распадались на отдельные клетки (рис. 5д). На рис. 5е (2 ч реактивации) представлена интактная нить A. platensis, вокруг нее расположены клетки распавшейся трихомы. Следует отметить, что отдельные клетки, вышедшие из состояния ангидробиоза, имели объемную форму и нормальную структуру цитоплазмы. Однако нити не сохранили своей целостности.
Через 24 ч при фазово-контрастных микроскопических исследованиях процесса реактивации A. platensis из анабиотического состояния в препаратах обнаружили невосстановившиеся клетки. Микроскопирование в белом свете показало, что у ряда трихом, сохранивших свою морфологическую структуру, наблюдается чередование живых и поврежденных клеток, окруженных единой оболочкой (рис. 5ж). При использовании фазово-контрастной микроскопии обнаружено, что в реактивирующихся трихомах наблюдаются жизнеспособные и необратимо поврежденные участки. При окрашивании таких трихом погибшая часть клеток не окрашивается, а в живых клетках цитоплазма приобретает голубовато-синюю окраску, свидетельствующую о паранекрозе (рис. 5з).
Через 72 ч структуры необратимо поврежденного участка трихомы постепенно подвергались автолизу (рис. 5и), а через 96 ч в культуре преобладали короткие трихомы, размеры которых варьировали от 20 до 60 мкм; они были жизнеспособны, имели сформировавшиеся концевые клетки (рис. 5к). Однако к делению клетки сразу не переходили. Процесс деления у некоторых трихом начинался через 2 недели, в то время как остальные трихомы были полностью реактивированы, но клетки не делились. Данный факт свидетельствует о стойких физиолого-биохимических изменениях в клетке. Лаг-фаза реактивированной культуры A. platensis значительно удлинялась, стадия экспоненциального роста наступала через 672 ч (4 нед.).
Согласно литературным данным [19], при выходе клеток из анабиотического состояния различают три этапа: увлажнение препарата (регидратацию), ликвидацию повреждений клеточных структур (репарацию) и восстановление до прежнего уровня численности культуры путем размножения оставшихся жизнеспособных клеток (рост и размножение клеток). Используя диффузное окрашивание, нам удалось проследить процессы, происходящие при регидратации и реактивации, и определить, какие клетки сохранили жизнеспособность. В нормальной живой клетке краситель аккумулируется в вакуолях, но если клетка подвергается какому-либо повреждению, то способность цитоплазмы концентрировать и “откладывать” краситель в виде гранул в вакуолях постепенно ослабевает и затем исчезает. Краситель начинает сорбироваться в цитоплазме, и под микроскопом обнаруживается ее диффузная окраска, которая является качественной реакцией, указывающей на состояние паранекроза. Паранекроз – это обратимое состояние, которое может привести клетку к гибели (некрозу) или к восстановлению.
Результаты проведенных исследований показали, что через 30 мин от начала реактивации A. platensis восстанавливает ширину клеток, при этом длина клеток больше, чем в контрольной культуре (рис. 3.). Другими словами, происходит некоторое разбухание клеток в результате действия сил осмотического давления. Происходящие процессы являются следствием структурных нарушений мембран, в результате которых образуются липидные поры [7]. Во время набухания клетки мембрана растягивается, что обусловливает рост мембранного натяжения. В этот момент, вероятно, происходит разрыв плазмодесм, и трихома спирулины дробится на отдельные клетки. Затем, при определенном пороговом уровне натяжения, появляются гидрофильные липидные поры [7], размер которых достаточен для выхода низкомолекулярных веществ. Выход веществ сопровождается снижением разности осмотического давления, при этом натяжение мембраны уменьшается и поры закрываются. Полного механического разрушения клетки в этом случае не происходит. Клетки восстанавливают свои прежние форму и объем. В ходе исследований наблюдали регидратацию (увлажнение) и репарацию (ликвидацию повреждений клеточных структур). Для перехода к процессу деления клеткам требуется определенное время, чтобы восстановить структуру и физиолого-биохимические процессы. Продолжительность этого периода зависит от характера и степени повреждений.
Устойчивыми к иссушению организмами считаются те, клетки которых остаются живыми при потере ≥ 90% воды, но таких организмов крайне мало и они, как правило, имеют небольшие размеры [18]. Известно, что некоторые мхи и печеночники могут восстановиться после 20–25 лет пребывания в высушенном состоянии [7]. Коловратки и тихоходки могут оставаться живыми до 9 лет. Некоторые виды цианобактерий (Nostoc commune) возобновили рост после 107 лет обезвоживания [28], а зеленая почвенная водоросль Protosiphon botryoides – через 43 года. Живые апланоспоры зеленой водоросли Haematococcus pluvialis были извлечены из высушенной на воздухе почвы после 27 лет хранения [28].
При рассмотрении других методов обезвоживания следует отметить, что во время лиофилизации на структуры клетки действуют некоторые отрицательные факторы: 1) кристаллы льда механически повреждают оболочку и внутриклеточные структуры (особую опасность они представляют при медленном замораживании, когда образуются более крупные кристаллы: на примере Scenedesmus rubescens продемонстрировано, что лиофилизация повреждает клеточную оболочку [29]); 2) из клетки не выделяется часть растворенных в клеточной жидкости электронов, которые при реактивации могут денатурировать белки; 3) при глубоком вакууме молекулы паров воды, обладающие большой кинетической энергией, могут механически повреждать важные участки клеточных структур (отрицательное действие проходящих через слой биомассы молекул воды под вакуумом научно доказано); 4) в целях устранения чрезмерно глубокого обезвоживания биомассы при лиофилизации применяются сложные защитные среды, содержащие гидрофильные вещества и вещества, защищающие клетки от отрицательного действия низких температур, например, глицерин; 5) при лиофилизации образуется пористая структура; 6) большое число экспериментальных данных показывает, что процесс лиофилизации вызывает мутации многих видов микроорганизмов [9]. Следует отметить, что процесс лиофилизации требует как начальных инвестиционных затрат, так и конкретных практических навыков от персонала [4], при этом она не обеспечивает абсолютной жизнеспособности сохраняемых клеток микроорганизмов. Однако установлено, что при лиофилизации А. platensis сохранила микроструктуру клеток. Данный факт указывает на то, что лиофильная сушка оптимально подходит для данного вида, несмотря на дорогую стоимость метода [6].
Высушивание микроводорослей и цианобактерий такими способами, как распылительная, вакуумная (L-высушивание), барабанная, солнечная и флеш-сушка неприемлемы для перевода клеток в состояние ангидробиоза и последующего сохранения с целью их оживления, т.к. процесс обезвоживания в силу технологических особенностей каждого из методов сопровождается повреждением клеточных оболочек, ухудшением качества продукта, а в некоторых случаях фотовыцветанием [2]. Апробация сушки поперечным потоком воздуха влажной взвеси А. platensis, содержащей 55–66% влаги в течение 14 ч при 62°C до остаточной влажности 4–8%, показала, что клеточные стенки оставались неповрежденными [2]. Данный процесс был дешевле, чем сушка в барабане, и быстрее, чем сушка на солнечной энергии. Однако жизнеспособность клеток не проверяли.
Учитывая, что А. platensis чрезвычайно чувствительна к замораживанию [11], разработан оптимальный режим криоконсервирования культуры А. platensis, который заключается в быстром охлаждении прямым погружением в жидкий азот суспензии клеток с криопротектором диметилсульфоксида в концентрации 10% [30]. После года хранения при температуре –196°С культура А. platensis оставалась жизнеспособной. К сожалению, авторы не указывают долю выживших клеток.
Таким образом, из множества разработанных способов обезвоживания водорослевой и микробной биомассы, для длительного сохранения клеток А. platensis в жизнеспособном состоянии подходят единичные методы, такие как лиофилизация и криосохранение. Учитывая их экономическую дороговизну и трудоемкость процессов, они доступны для больших концернов и институтов. В то время как предлагаемый нами способ перевода клеток в состояние ангидробиоза могут позволить себе небольшие предприятия и исследовательские группы. Cохранившие жизнеспособность цианобактерии обеспечат сохранение вида и восстановление его численности.
ЗАКЛЮЧЕНИЕ
1. Установлено, что дегидратация A. platensis при температуре 30 и 60°С в термостате вызывает статистически достоверные изменения морфометрических характеристик клеток: увеличение длины (при 60°С на 22%) и уменьшение их ширины (на 25–31%). При обезвоживании на силикагеле эти изменения были статистически не достоверны. Тем не менее, тенденция изменений была сходной.
2. Зарегистрировано, что во время реактивации первоначальные размеры клеток восстанавливались в течение 24 часов независимо от способа обезвоживания. Динамика процессов, происходящих во время реактивации, также не зависела от способа обезвоживания.
3. Во всех пробах зарегистрированы жизнеспособные клетки, которые после реактивации приступали к делению, а после продолжительной адаптационной фазы культура переходила на стадию линейного роста.
4. Во время реактивации проявляются повреждения структур клетки, возникшие в результате обезвоживания. В этот период происходит репарация полученных повреждений и автолиз необратимо поврежденных клеток. Нарушенные функции, по-видимому, компенсируются резервными механизмами клеток, в результате чего лаг-фаза культуры удлиняется.
5. Обезвоживание A. platensis в температурном диапазоне 30–60°С можно рекомендовать в качестве способа дегидратации с целью сохранения клеток в жизнеспособном состоянии.
Работа подготовлена по теме государственного задания Федерального государственного бюджетного учреждения науки Федерального исследовательского центра Института биологии южных морей им. А.О. Ковалевского Российской академии наук “Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса” (№ АААА-А18-118021350003-6).
Автор заявляет, что у него нет конфликта интересов. Статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Fu N., Chen X.D. Towards a maximal cell survival in convective thermal drying processes // Food Research International. 2011, V. 44. P. 1127. https://doi.org/10.1016/j.biortech.2014.10.139
Show K.Y., Lee D.J., Tay J.H., Lee T.M., Chang J.S. Microalgal drying and cell disruption – Recent advances // Bioresource Technology. 2015. V. 184. P. 258. https://doi.org/10.1016/j.biortech.2014.10.139
Hosseinizand H. Drying and co-pelletization of microalgae with sawdust: Ph.D. Tesis. Vancouver: University of British Columbia: Chemical and Biological Engineering. 2018. 122 p.
Duygu D.Y., Udoh A.U., Özer T., Erkaya I.A. The characteristics and importance of microalgae culture collections // Süleyman Demirel Üniversitesi Eğirdir Su Ürünleri Fakültesi Dergisi. 2017. V. 13. P. 80.
Nugroho W.S.K., Kim Do.-A., Kim D.-W., Koo1 B.-W., Hur Y.B., Kim H.J. Current advances in cryopreservation of microalgae // Journal of Marine Life Science. 2016. V. 1. P. 70. http://jmls.or.kr.
Lin L.P. Microstructure of spray-dried and freeze-dried microalgal powders // Food microstructure. 1985. V. 4. P. 341. https://digitalcommons.usu.edu/foodmicrostructure/vol4/iss2/17
Crowe J.H., Hoekstra F.A., Crowe L.M. Anhydrobiosis // Annu. Rev. Physiol. 1992. V. 54. P. 579.
Park H.K. Long-term preservation of bloom-forming Cyanobacteria by Cryopreservation // Algae. 2006. V. 21. P. 125.
Сидякина Т.М. Консервация микроорганизмов в коллекциях культур // Консервация генетических ресурсов. Пущино: ОНТИ НЦБИ. 1991. С. 81.
Stock W., Pinsee E., Decker S.D., Sefbom J., Blommaert L., Chepurnova O., Sabbe K., Vyverman W. Expanding the toolbox for cryopreservation of marine and freshwater diatoms // Sci. Rep. 2018. V. 8. P. 4279. https://doi.org/10.1038/s41598-018-22460-0
Day J.G., Fleck R.A. Cryo-injury in algae and the implications this has to the conservation of micro-algae // Microalgae Biotechnology. 2015. V. 1. P. 1. https://doi.org/10.1515/micbi-2015-0001
Marsalek B., Rojickova-Padrtova R. Long-tem maintenance of alga strains for use in biom assays and biotechnology // Arch. Hydrobiol. Suppl. Algol. Stud. 1988. V. 124. P. 121.
Lorenz M., Friedl T., Day J.G. Perpetual maintenance of actively metabolizing microalgal cultures // Algal culturing techniques / Ed. Andersen R.A. Academic Press. New York. 2005. P. 145.
Bewley J.D. Physiological aspects of desiccation tolerance // Ann. Rev. Plant. Physiol. 1979. V. 30. P. 195.
Нестеренко Т.В., Кузьмина Р.И. Реактивация микроводорослей из состояния сухого анабиоза // Вопросы управления биосинтезом низших растений / Под ред. Терскова И.А. Новосибирск: Наука, 1982. С. 139.
Кузьмина Р. И. Исследование анабиоза у водорослей // Альгология. 1992. Т. 3. С. 15.
Day J.G., Watanabe M.M., Morris G.J., Fleck R.A., McLellan M.R. Long-term viability of preserved eukaryotic alga // J. Appl. Phycol. 1997. V. 9. P. 121.
Holzinger A., Karsten U. Desiccation stress and tolerance in green algae: Consequences for ultrastructure, physiological, and molecular mechanisms // Front. Plant Sci. 2013. V. 4. P. 327. https://doi.org/10.3389/fpls.2013.00327
Бекер М.Е., Дамберг Б.Э., Рапопорт А.И. Анабиоз микроорганизмов. Рига: Зинатне. 1981. 252 с.
Rozenfelde L., Rapoport A.I. Anhydrobiosis in yeast: is it possible to reach anhydrobiosis for yeast grown in conditions with severe oxygen limitation? // Antonie van Leeuwenhoek. 2014. V. 106. P. 211.
Faucher O., Coupal B., Leduy A. Utilization of scawater – urea as a culture medium for Spirulina maxima // Can. J. Microbiol. 1979. V. 25. P. 752.
Методы физиолого-биохимического исследования водорослей в гидробиологической практике / Под ред. Сиренко Л.А. Киев: Наукова думка, 1975. 247 с.
Ровенский Ю.А. Растровая электронная микроскопия нормальных и опухолевых клеток. Москва: Медицина, 1979. 152 с.
Брянцева Ю.В. Индекс формы одноклеточных водорослей как новый морфометрический критерий // Экология моря. 2005. Вып. 67. С. 27.
Брянцева Ю.В., Лях А.П., Сергеева А.В. Расчет объемов и площадей поверхности одноклеточных водорослей Черного моря / Препринт / НАН Украины, ИнБЮМ. Севастополь. 2005. 25 с.
França M.B., Panek A.D., Eleutherio E.C.A. Oxidative stress and its effects during dehydration // Comparative Biochemistry and Physiology, Part A. 2007. V. 146. P. 621.
Tomasseli L. Morphology, ultrastructure and taxonomy of Arthrospira (Spirulina) maxima and Arthrospira (Spirulina) platensis // Spirulina platensis (Arthrospira): Physiology, Cell-biology and Biotechnology / Ed. Vonshak A. London: Taylor & Francis, 1997. P. 1.
Kapoore R.V., Huete-Ortega M., Day J.D., Okurowska K., Slocombe S.P., Stanley M.S., Vaidyanathan S. Effects of cryopreservation on viability and functional stability of an industrially relevant alga // Sci. Rep. 2019. V. 9. P. 2093. https://doi.org/10.1038/s41598-019-38588-6
Kröger M., Klemm M., Nelles V. Extraction behavior of different conditioned S. rubescens // Energies. 2019. V. 12. P. 1336. https://doi.org/10.3390/en12071336
Цуцаева А.А., Балыбердина Л.М., Ананьина А.Е., Гриша И.Г. Криоконсервирование культуры Spirulina platensis // Проблемы криобиологии. 2007. Т. 17. С. 168.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


