Физиология растений, 2020, T. 67, № 4, стр. 428-437
Физиолого-биохимические аспекты морозостойкости Оlea europaea L.
Т. Б. Губанова a, *, А. Е. Палий a
a Федеральное государственное бюджетное учреждение науки Никитский ботанический сад –
Национальный научный центр Российской академии наук
Ялта, Россия
* E-mail: gubanova-65@list.ru
Поступила в редакцию 02.09.2019
После доработки 15.10.2019
Принята к публикации 23.10.2019
Аннотация
Представлены результаты исследований морозостойкости сортов Olea europaea L. и ее подвида O. еuropаea subsp. cuspidatа (Wall. and G. Don) Cif. в условиях Южного берега Крыма (ЮБК), а также влияния температуры, близкой к значению абсолютного минимума (–15°С) на состояние фотосинтетического аппарата, активность каталазы, полифенолоксидазы, содержание пролина и фенольных соединений. Установлено, что в условиях ЮБК относительно высокая морозостойкость характерна для сорта Никитская. Слабоморозостойкими оказались сорта Асколяно, Кореджиоло, Раццо. Минимальная устойчивость выявлена у подвида O. еuropаea subsp. cuspidatа. У слабостойких сортов Раццо, Кореджиоло и O. еuropаea subsp. cuspidatа действие температуры –15°С привело к необратимым нарушениям в работе фотосинтетического аппарата, что проявилось в значительном снижении фотосинтетической активности сразу после окончания низкотемпературного воздействия (на 80.19, 50.0 и 89.78%, соответственно), а также коэффициента спада флуоресценции ниже витальной нормы. Спустя 24 ч у сортов Асколяно и Никитская отмечено замедление снижения параметров индукции флуоресценции хлорофилла (ИФХ). Выявлено, что отрицательные температуры способствуют снижению активности каталазы у слабоустойчивых генотипов O. europaea (в среднем на 40–60%), в отличие от морозостойкого сорта Никитская, у которого активность этого фермента практически не изменилась. Изменение активности полифенолоксидазы было разнонаправленным. У сортов Раццо и Кореджиоло отмечено возрастание полифенолоксидазной активности (19 и 24%, соответственно), а у подвида O. europaea subsp. cuspidata и сорта Никитская – снижение (на 8 и 37%, соответственно). Показано, что при действии отрицательных температур у представителей O. europaea происходит снижение концентрации пролина в тканях листьев (на 17–55%). Наиболее значительные изменения выявлены у сорта Кореджиоло (на 45.09%). Суммарное содержание фенольных соединений снижалось у всех слабоморозостойких сортов и O. europaea subsp. cuspidata на 7–42%, а у морозостойкого сорта Никитская – оставалось неизменным. Установлено, что отрицательные температуры вызывают необратимые изменения в работе фотосинтетического аппарата у слабоустойчивых представителей O. europaea. Выявлена связь степени морозостойкости изучаемых генотипов с активностью каталазы, а также с содержанием пролина и фенольных соединений в тканях листьев.
ВВЕДЕНИЕ
Вопросы морозостойкости растений и функционирования механизмов, обеспечивающих это жизненно важное свойство, несмотря на огромный объем накопленного экспериментального материала, не утратили актуальности в наши дни. Исследования механизмов адаптации растительных организмов к действию гидротермического стресса в большей части проводятся на примере травянистых модельных объектов, что позволяет за относительно короткий срок детально изучить отдельные звенья сложных адаптивных процессов. Информация о реакциях на действие отрицательных температур древесных вечнозеленых лиственных растений немногочисленна. Реализация механизмов морозостойкости у этой группы растительных организмов вызывают особый интерес в связи с тем, что у них даже в зимнее время метаболические процессы весьма интенсивны. Исследование работы фотосинтетического аппарата в условиях отрицательных температур является ключевым моментом в изучении физиологии устойчивости вечнозеленых растений, которые в зимнее время часто подвержены одновременному действию стимулирующего (высокая инсоляция) и ингибирующего (низкие и отрицательные температуры) фактора. В настоящее время известно, что в условиях интенсивной освещенности и отрицательной температуры избыток энергии, который не может быть использован в фотохимических реакциях, является одной из причин деструктивных изменений фотосинтетического аппарата [1]. К защитным реакциям относится увеличение доли тепловой диссипации с участием каротиноидов виолоксантинового цикла [2].
Ряд авторов отмечает высокую чувствительность процессов флуоресценции хлорофилла к температурному фактору. В частности, известно, что при действии разнообразных факторов характер кривой индукции флуоресценции хлорофилла (ИФХ) позволяет получить объективную информацию об изменениях фотосинтетических процессов, как связанных с развитием адаптационного синдрома, так и с необратимыми нарушениями в работе фотосинтетического аппарата, что в свою очередь позволяет получить объективную характеристику устойчивости изучаемого вида растения [3, с. 148–155].
Низкотемпературный стресс проявляется на всех уровнях организации растительного организма. На клеточном уровне морозные повреждения затрагивают прежде всего мембраны [6], при этом происходит увеличение уровня АФК, которое впоследствии может привести к перекисному окислению липидов, разрушению мембран, деградации белков и нарушению метаболической функции [7]. Для смягчения или защиты от индуцированного отрицательными температурами окислительного повреждения в растениях выработаны механизмы удаления АФК с помощью ферментативной и неферментативной антиоксидантных систем, в состав которых входят окислительно-восстановительные ферменты (супероксиддисмутаза, каталаза, пероксидаза и др.) и протекторные соединения (фенольные вещества, аскорбиновая кислота, пролин и др.) [8]. Немаловажную роль в ликвидации последствий действия отрицательных температур играет полифенолоксидаза, поскольку она помогает избежать серьезного окислительного повреждения, вызванного замораживанием [9]. При возникновении стрессовых условий изменение активности полифенолоксидазы связано с образованием химических барьеров, препятствующих дальнейшему распространению АФК. Таким образом, ферменты антиоксидантной системы и полифенолоксидаза, принимая участие в регуляции метаболизма, способствуют быстрой адаптации растения к изменяющимся условиям окружающей среды.
Маслина является одной из субтропических культур, которая часто выращивается в климатических условиях, граничащих с пределами их зимостойкости [10]. Исследования, проведенные ранее, показали, что существует корреляция между некоторыми физиолого-биохимическими характеристиками (размер и плотность устьиц, содержание фенольных соединений, общих растворимых белков, водорастворимых сахаров, экзосмос электролитов и др.) и морозостойкостью генотипов маслины [11, 12].
Поскольку действие отрицательных температур на древесные вечнозеленые растения затрагивает все звенья их жизнедеятельности, то цель наших исследований заключалась в выявлении связи степени морозостойкости у представителей Olea europaea с изменениями параметров ИФХ, активности окислительно-восстановительных ферментов и содержания некоторых криопротекторных соединений.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве материалов исследований были выбраны сорта Olea europaea L.: Никитская (селекция Никитского ботанического сада), Асколяно, Раццо, Кореджиоло (средиземноморского происхождения) и подвид O. europaea subsp. cuspidatа (Wall. and G. Don) Cif. Все растения достигли состояния полного плодоношения. С 2015 по 2018 гг. проводили визуальную оценку состояния растений после понижения температуры воздуха до отрицательных значений и в конце холодного периода, с учетом рекомендаций В.М. Бурдасова [13].
Для определения влияния отрицательных температур на состояние фотосинтетического аппарата генотипов O. europaea с различной степенью морозостойкости была проведена серия экспериментов по искусственному промораживанию однолетних побегов в течение 6 часов при температуре, близкой к значению абсолютного минимума на ЮБК –15°С. Опыты осуществляли в климатической камере Votsсh VT 4004 (“Vötsch Industrietechnik GmbH”, Германия) в период максимальной вероятности наступления морозов на ЮБК (третья декада января), с предварительной закалкой при 0°С не менее 6 часов. Градиент изменения температуры в камере составил 2°С в час [14, с. 4–6].
Интенсивность флуоресценции хлорофилла (ИФХ) измеряли с помощью портативного хронофлуориметра Флоратест (Институт кибернетики НАН Украины) [15]. Для интегральной оценки состояния фотосинтетического аппарата анализировали следующие показатели фотоиндукции флуоресценции [16, 17]: F0 – базовый уровень флуоресценции, зависящий от потерь энергии возбуждения во время миграции по пигментной матрице, а также от содержания молекул хлорофилла, не имеющих функциональной связи с реакционными центрами; Fpl – уровень флуоресценции в момент достижения ее временного замедления; Fm – максимальное значение флуоресценции; Fst – стационарный уровень флуоресценции, отмечаемый через три минуты после момента освещения – показатель количества хлорофиллов, не принимающих участия в передаче энергии на реакционные центры. В качестве расчетных параметров флюоресценции использовали: вариабельную флуоресценцию Fv = Fm – F0 (индикатор фотохимических окислительно-восстановительных процессов); характеристику тепловой диссипации энергии возбужденных молекул хлорофилла (Fm – Fst)/Fst; относительную фотосинтетическую активность (Fm – Fst)/Fm; коэффициент спада флуоресценции, эффективность квантового выхода фотосинтеза Fv/Fst (индекс жизнеспособности); эффективность световой фазы фотосинтеза Fv/Fm; количество невосстановленных Qа в реакционных центрах ФС II (Fpl – F0)/Fv.
Биохимические показатели определяли по общепринятым методикам: содержание пролина – по модифицированной методике Чинарда с использованием нингидринового реактива [18], суммы фенольных веществ – спектрофотометрическим методом с использованием реактива Фолина-Чокальтеу [19, с. 35–40]. Активность каталазы (КФ 1.11.1.6) определяли титриметрическим методом [20, с. 72], полифенолоксидазы (КФ 1.14.18.1) – колориметрически в присутствии пирокатехина и п-фенилендиамина [20, с. 43–46], с использованием спектрофотометра Evolution 220 UV/VIS (“Thermo Scientific”, США).
Компонентный состав фенольных соединений определяли методом высокоэффективной жидкостной хроматографии [21] на хроматографе Dionex UltiMate 3000 (“Thermo Scientific”, США) с диодноматричным детектором DAD-3000. Для проведения анализа была использована аналитическая хроматографическая колонка ZORBAX Eclipse Plus C18, 4.6 м × 250 мм × 5 мкм. Применяли градиентный режим элюирования. Подвижная фаза В – ацетонитрил, С – 0.1% раствор муравьиной кислоты в деионизированной воде: 0–5 мин 5% В, 5–35 мин – подъем от 5 до 30% В, 35–40 мин подъем от 30 до 90% В, 40–41 мин подъем до 100% В, 41–46 мин – 100% В, 46–51 мин снижение от 100% В до 5% В, 51–55 мин 5% В. Скорость потока 0.7 мл/мин. Температура термостата колонок 400°С. Объем пробы 7 мкл. Идентификацию пиков производили на основании совпадения времени удерживания аналита и стандартного образца, а также совпадения УФ-спектров. Расчет количественного содержания индивидуальных компонентов производили по калибровочным графикам зависимости площади пика от концентрации вещества, построенным по растворам индивидуальных веществ. В качестве стандартов использовали лютеолин-7-О-глюкозид, апигенин-7-О-глюкозид, олеуропеин и рутин (“Sigma-Aldrich”, США). Для обеспечения однородности результатов концентрации суммы фенольных соединений и отдельных компонентов рассчитывали в пересчете на сырой вес.
Физиолого-биохимические эксперименты проводили в 3-кратной биологической и в 3-кратной аналитической повторностях. Каждый эксперимент был повторен 2 раза. Для статистической обработки и факторного анализа (ANOVA) использовали программы MS Excel 2007 и Statistica 6.0. Достоверность различий между вариантами рассчитывали по t-критерию Стьюдента при 5% уровне значимости. В таблицах и на графиках представлены средние значения определений и их стандартные ошибки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате многолетнего изучения устойчивости O. europaea к действию отрицательных температур определена степень морозостойкости и ее изменение в течение холодного периода на ЮБК. Установлено, что изучаемые генотипы различаются по степени устойчивости: относительно устойчивым оказался сорт Никитская, сорта Асколяно, Кореджиоло, Раццо проявляли более низкую морозостойкость, а подвид O. еuropаea subsp. cuspidata – минимальную. Резистентность к действию отрицательных температур у O. еuropаea в течение холодного периода на ЮБК динамична. Ее максимум приходится на вторую половину декабря – начало января. Негативное влияние на реализацию потенциальной морозостойкости оказывают теплые погодные условия в осенне-зимний период (среднесуточная температура +7…+10°С), поскольку они способствуют позднему завершению ростовых процессов. Анализ повреждений, вызванных температурой –15°С (в контролируемых условиях), которая соответствует значению абсолютного минимума на ЮБК, показал, что у сортов маслины их интенсивность различна. В большей степени чувствительными к такому температурному воздействию оказались сорта Кореджиоло, Асколяно, Раццо и подвид O. еuropаea subsp. cuspidatа. У морозостойкого сорта Никитская наблюдались повреждения листьев (в пределах 10–15% от их количества), расположенных в базальной части однолетнего побега и единичные случаи обмерзания апикальной части побегов. У сортов Кореджиоло, Асколяно, Раццо обмерзание составило 90, 60 и 80% листьев, соответственно. Наиболее значительные морозные повреждения, вызванные действием указанной температуры, были у подвида O. еuropаea subsp. cuspidatа: практически полное обмерзание листвы, нарушение целостности камбия и проводящей системы, распространившееся в базипетальном направлении по побегу до 10–12 см. Анализ научной литературы показал, что исследования влияния температурного стресса на фотосинтетическую активность и кинетику флуоресценции многочисленны. В настоящее время установлено, что низкотемпературный стресс связан с уменьшением рециклирования фосфатов и фотофосфорилирования, замедлением фотосинтетического транспорта электронов и возрастанием вероятности фотоингибирования [22–24]. В связи с выше сказанным, нами была проведена серия экспериментов по оценке состояния фотосинтетического аппарата генотипов O. europaea с различной степенью морозостойкости после действия температуры –15°С (табл. 1, рис. 1).Параметры кривых ИФХ в контрольном варианте (до воздействия отрицательной температуры) у слабоустойчивых сортов O. europaea – Кореджиоло и Асколяно, а также подвида O. europaea subsp. cuspidatа по уровню базовой флуоресценции имели близкие значения. Максимальное значение F0 отмечено у сорта Раццо, что свидетельствует о существенных затратах энергии возбуждения и сравнительно большем количестве молекул хлорофилла, не связанных с реакционными центрами. Морозостойкий сорт Никитская по этому параметру занимает промежуточное положение. Существенные различия у генотипов O. europaea выявлены в уровне максимальной флуоресценции (Fm). Самым низким значением параметра Fm характеризовался подвид O. europaea subsp. cuspidatа, а высоким – сорта Никитская и Раццо. Коэффициент спада флуоресценции у всех изучаемых сортов в контрольном варианте не выходил за пределы нормы витальности. Аналогичная картина отмечена при анализе стационарного уровня флуоресценции: максимальные значения этого параметра наблюдались у сортов Никитская и Раццо, а минимальные – у Асколяно и подвида O. europaea subsp. cuspidatа. Сравнение параметров Fm и Fst до воздействия низкотемпературного фактора позволяет сделать обоснованное предположение о том, что в фотосинтетическом аппарате неустойчивых к отрицательным температурам генотипов (например, подвида O. europaea subsp. cuspidatа) большая часть хлорофилла в пределах фотосистемы входит в реакционные центры. У морозостойкого сорта Никитская соотношение этих параметров значительно выше, что, вероятно, связано с наличием некоторого “пула” хлорофиллов, обеспечивающих стабильность фотосинтетических процессов в стрессовых условиях. Максимальные значения относительной фотосинтетической активности ((Fm – Fst)/Fst) наблюдались у сортов Раццо и Никитская.
Таблица 1.
Изменение параметров ИФХ (в отн. ед.) листьев представителей O. europaea под влиянием отрицательной температуры (–15°С; 6 ч)
| Генотип | F0 | Fpl | Fm | Fst | Fv | (Fm – Fst)/Fst | (Fm – Fst)/Fm | Fv/Fst | Fv/Fm | (Fpl – F0)/Fv |
|---|---|---|---|---|---|---|---|---|---|---|
| Контроль | ||||||||||
| O. europaea ssp. cuspidatа | 229 ± 6ж | 320 ± 5к | 501 ± 9и | 250 ± 6к | 272 ± 7и | 1.01 ± 0.20в | 0.50 ± 0.02г | 1.08 ± 0.02з | 0.54 ± 0.02в | 0.33 ± 0.01г |
| Асколяно | 272 ± 8г | 501 ± 9д | 938 ± 11д | 357 ± 9е | 666 ± 8е | 1.62 ± 0.31б, в | 0.62 ± 0.03б | 1.86 ± 0.04д | 0.75 ± 0.03а | 0.34 ± 0.01г |
| Раццо | 400 ± 5а | 997 ± 10а | 1872 ± 21а | 576 ± 9а | 1472 ± 12а | 2.25 ± 0.20а | 0.69 ± 0.01а | 2.56 ± 0.05а | 0.79 ± 0.01а | 0.41 ± 0.04в |
| Кореджиоло | 264 ± 9г | 576 ± 8г | 1080 ± 25г | 392 ± 7г | 816 ± 10г | 1.76 ± 0.12б | 0.64 ± 0.02б | 2.08 ± 0.10в | 0.76 ± 0.02а | 0.38 ± 0.01в |
| Никитская | 325 ± 4б | 736 ± 6б | 1530 ± 21б | 496 ± 8б | 1205 ± 13б | 2.08 ± 0.31а, б | 0.68 ± 0.02а, б | 2.43 ± 0.20б | 0.77 ± 0.03а | 0.34 ± 0.01г |
| Сразу после действия температуры –15°С | ||||||||||
| O. europaea ssp. cuspidatа | 95 ± 2.4и | 102 ± 5л | 113 ± 3м | 111 ± 6м | 18 ± 2м | 0.20 ± 0.10д | 0.02 ± 0.01в | 0.1 ± 0.016м | 0,16 ± 0.01ж | 0,39 ± 0.02в |
| Асколяно | 240 ± 4е | 432 ± 4ж | 768 ± 5е | 304 ± 8з | 528 ± 9ж | 1.52 ± 0.22б, в | 0.60 ± 0.03б, в | 1.74 ± 0.04е | 0.69 ± 0.02б | 0.36 ± 0.02в, г |
| Раццо | 250 ± 6е | 309 ± 9к | 346 ± 7л | 282 ± 9и | 96 ± 4л | 0.23 ± 0.01д | 0.18 ± 0.01е | 0.34 ± 0.02л | 0.28 ± 0.01е | 0.61 ± 0.03а |
| Кореджиоло | 300 ± 5в | 456 ± 5е | 560 ± 9ж | 376 ± 6д | 260 ± 8и | 0.49 ± 0.01г | 0.32 ± 0.02д | 0.69 ± 0.01и | 0.46 ± 0.02г | 0.60 ± 0.01а |
| Никитская | 324 ± 8б | 650 ± 8в | 1046 ± 12г | 373 ± 8д | 722 ± 9д | 1.80 ± 0.22б | 0.64 ± 0.03б | 1.93 ± 0.21г | 0.69 ± 0.03б | 0.45 ± 0.01б |
| Через 24 часа | ||||||||||
| O. europaea ssp. cuspidatа | * | * | * | * | * | * | * | * | * | * |
| Раццо | * | * | * | * | * | * | * | * | * | * |
| Асколяно | 17 6 ± 10 з | 336 ± 6и | 528 ± 10з | 224 ± 4л | 352 ± 6з | 1.36 ± 0.21в | 0.57 ± 0.01в | 1.57 ± 0.21ж | 0.67±0.03б | 0.45 ± 0.01б |
| Кореджиоло | 256 ± 7г, е | 352 ± 9з | 416 ± 8к | 336 ± 7ж | 160 ± 5к | 0.24 ± 0.02д | 0.19 ± 0.01е | 0.48 ± 0.01к | 0.38 ± 0.01д | 0.60 ± 0.02а |
| Никитская | 304 ± 5в | 656 ± 10в | 1168 ± 13в | 416 ± 8в | 864 ± 8в | 1.81 ± 0.11б | 0.64 ± 0.01б | 2.08 ± 0.21в | 0.74 ± 0.06б | 0.41 ± 0.01в |
Рис. 1.
Индукционные кривые флуоресценции хлорофилла листьев представителей Olea europaea. 1 – O. europaea spp. cuspidata, 2 – Кореджиоло, 3 – Асколяно, 4 – Никитская, 5 – Раццо.
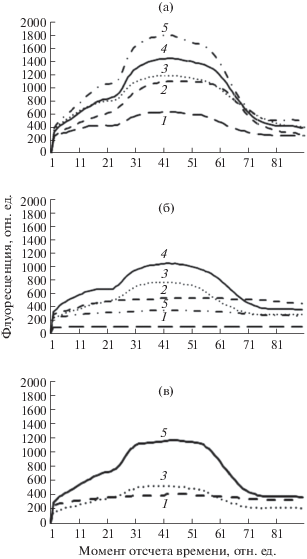
Параметр (Fpl – F0)/Fv, соответствующий количеству невосстановленных Qа в реакционных центрах ФС II, у всех изучаемых генотипов O. europaea в контрольном варианте имел близкие значения. Параметр Fv/Fm, определяющий эффективность световой фазы фотосинтеза, у сортов O. europaea не имел существенных различий до воздействия отрицательной температуры. В то же время, по сравнению с сортами, у подвида O. europaea subsp. cuspidatа этот показатель был ниже в среднем на 30%.
Анализ параметров ИФХ у генотипов O. europaea показал, что их фотосинтетическая активность имеет сортовые особенности. Наиболее значительные отличия по форме кривой ИФХ и ее характеристикам выявлены у подвида O. europaea subsp. cuspidatа.
Действие температуры –15°С в течение 6 ч привело к изменению параметров ИФХ у всех изучаемых объектов. У подвида O. europaea subsp. cuspidatа и сорта Раццо отмечено чрезвычайное снижение базового уровня флуоресценции – на 58.52 и 37.57%, соответственно, что свидетельствует о необратимых процессах, вероятно, связанных с деструкцией хлорофилла. У этих же генотипов выявлено резкое падение относительной фотосинтетической активности в результате развития низкотемпературного стресса на 80.19 и 89.78%, соответственно. Наличие необратимых нарушений в фотосинтетическом аппарате у подвида O. europaea subsp. cuspidatа и сорта Раццо подтверждается значениями коэффициента спада флуоресценции (индекса жизнеспособности) и отсутствием выраженных пиков на кривой ИФХ. У сорта Кореджиоло действие отрицательной температуры также привело к снижению максимального уровня флуоресценции (на 48.14%), что может быть связано с разрушением светособирающих комплексов. При этом практически не изменилось количество молекул хлорофилла, не принимающих участия в передаче энергии к реакционным центрам (Fst). Однако наблюдалось снижение более чем на 50% таких параметров, как относительная фотосинтетическая активность, эффективность световой фазы и коэффициента спада флуоресценции, ниже витальной нормы, что свидетельствует об инактивации фотосинтеза у этого сорта. Подтверждением развития стрессового состояния сразу после окончания низкотемпературного воздействия у сортов Асколяно и Никитская является снижение максимума и коэффициента спада флуоресценции, характеризующего квантовый выход фотосинтеза. Однако эти изменения не являлись критическими: Fv/Fst ≥ 1.50–2.50 [16]. Также у этих сортов отмечено незначительное снижение эффективности световой фазы фотосинтеза (на 8% у сорта Асколяно и на 10.39% у сорта Никитская). Действие отрицательной температуры также оказало влияние на уровень относительной фотосинтетической активности, причем эти изменения у сорта Никитская составили 13.46%, что почти в два раза больше, чем у сорта Асколяно. Выявленные изменения, с нашей точки зрения, характеризуют наличие обратимых нарушений в течение световой фазы фотосинтеза, более выраженных у сорта Асколяно. У морозостойкого сорта Никитская более чувствительными к действию отрицательных температур оказались процессы восстановления реакционных центров c окисленным Qa – их количество увеличилось на 32.35%, в то время как у более чувствительного к отрицательным температурам сорта Асколяно оно практически не изменилось.
Анализ характера изменений параметров и формы кривой ИФХ через 24 часа, после окончания низкотемпературного воздействия, показал, что у сорта Кореджиоло они были необратимыми. У сорта Асколяно большая часть параметров продолжала снижаться; в частности, наблюдалось замедление фотохимических окислительно-восстановительных процессов, при этом происходило увеличение количества невосстановленных реакционных центров. Тем не менее, изменения ключевых параметров, таких как относительная фотосинтетическая активность, коэффициент спада флуоресценции, а также индекс жизнеспособности, были незначительными. Это, с нашей точки зрения, связано с наличием у сорта Асколяно физиолого-биохимических механизмов, замедляющих скорость нарастания стрессового состояния. В отличие от сорта Асколяно, у морозостойкого сорта Никитская изменения параметров ИФХ носили другой характер. В данном случае наблюдалось возрастание уровня максимальной, стабилизирующей и вариабельной флуоресценции, а также параметров Fv/Fst и Fv/Fm, определяющих эффективность световой фазы фотосинтеза. С нашей точки зрения, полученные результаты говорят не только о снижении уровня стресса у этого сорта O. europaea, но и об активации репарационных механизмов, нормализующих работу фотосинтетического аппарата после окончания действия стрессора. Подтверждением этому является тот факт, что у морозостойкого сорта Никитская через 24 часа после окончания действия температуры некоторые параметры ИФХ (F0, Fv/Fm, (Fpl – F0)/Fv) практически не отличались от их значений в контроле.
Анализ активности каталазы и полифенолоксидазы в листьях маслины до воздействия отрицательных температур показал, что изучаемые сортообразцы имеют существенные различия в данных характеристиках. Так, листья сорта Асколяно обладают максимальной активностью каталазы и минимальной – полифенолоксидазы. Самая низкая каталазная и высокая полифенолоксидазная активность отмечена у неустойчивого подвида O. europaea subsp. cuspidata. Остальные сорта O. europaea характеризовались близкими значениями активности этих ферментов, за исключением сорта Раццо, у которого полифенолоксидазная активность в некоторой степени снижена (табл. 2).
Таблица 2.
Активность ферментов в листьях Olea europaea до и после действия температуры –15°С
| Генотип | Вариант опыта | Активность каталазы, мл О2/(г мин) |
Активность полифенолоксидазы, усл. ед./(г с) |
|---|---|---|---|
| Асколяно | Контроль | 6.80 ± 0.17а | 0.050 ± 0.002е |
| Опыт | 5.53 ± 0.14б | 0.050 ± 0.002е | |
| O. europaea ssp. cuspidata | Контроль | 3.83 ± 0.10д | 0.200 ± 0.006б |
| Опыт | 1.28 ± 0.03ж | 0.184 ± 0.005в | |
| Кореджиоло | Контроль | 4.68 ± 0.11в | 0.202 ± 0.006б |
| Опыт | 1.26 ± 0.04ж | 0.251 ± 0.008а | |
| Раццо | Контроль | 4.67 ± 0.12в | 0.084 ± 0.003в |
| Опыт | 3.40 ± 0.10е | 0.100 ± 0.004д | |
| Никитская | Контроль | 4.55 ± 0.13г | 0.184 ± 0.005в |
| опыт | 4.68 ± 0.11в | 0.117 ± 0.004г |
В результате действия температуры –15°С наблюдалось снижение активности каталазы у всех генотипов, за исключением морозостойкого сорта Никитская. Самое значительное падение активности этого фермента выявлено у чувствительных к действию отрицательных температур сорта Кореджиоло и подвида O. europaea subsp. cuspidata, более чем на 60%. Изменение активности полифенолоксидазы в опытных вариантах происходило разнонаправленно. В листьях сортов Раццо и Кореджиоло она возрастала на 19 и 24% соответственно, у подвида O. europaea subsp. cuspidata и сорта Никитская – падала на 8% и 37% соответственно, а у Асколяно оставалась неизменной.
По литературным данным, развитие адаптационного синдрома у O. europaea при нарастающем действии отрицательных температур сопровождается увеличением активности антиоксидантных ферментов (каталазы, пероксидазы, аскорбатпероксидазы) и полифенолоксидазы [9, 12, 25]. В то же время имеется информация о снижении активности каталазы в листьях маслины при температуре ниже –10°С [26], что согласуется с полученными нами данными. В нашем эксперименте активность полифенолоксидазы возрастала не у всех исследуемых генотипов. Выявленные противоречия, вероятно, связаны с произрастанием конкретных генотипов на северной границе культигенного ареала маслины, а также со скоростью понижения температуры и длительностью температурного воздействия в условиях лабораторного опыта. Также существенное значение имеет факт, что начальные повреждающие температуры для многих сортов находятся в пределах –8…–10°С, а температуры –12°С и ниже являются критическими [27].
При исследовании содержания протекторных соединений установлено, что в контрольном варианте содержание пролина колебалось в пределах 43–72 мкг/г, суммы фенольных соединений – 1036–1332 мг/100 г, лютеолин-7-О-глюкозида – 235–345 мг/100 г, рутина – 79–114 мг/100 г, олеуропеина – 450–1850 мг/100 г (табл. 3). Максимальное содержание пролина выявлено у сорта Никитская, суммы фенольных соединений – у подвида O. europaea subsp. cuspidata, лютеолин-7-О-глюкозида, рутина и олеуропеина – у сорта Кореджиоло.
Таблица 3.
Содержание протекторных соединений в листьях маслины Olea europaea до и после действия температуры –15°С
| Генотип | Пролин, мкг/г |
Сумма ФС, мг/100 г | Лютеолин-7-О-глюкозид, мг/100 г | Рутин, мг/100 г |
Олеуропеин, мг/100 г |
|
|---|---|---|---|---|---|---|
| Асколяно | Контроль | 51.6 ± 1.52г | 1249 ± 38б | 235 ± 24б | 86.8 ± 8.7в | 611 ± 61в |
| Опыт | 43.0 ± 1.08д | 1166 ± 35в | 293 ± 29а,б | 81.0 ± 8.0в | 882 ± 80б | |
| O. europaea ssp. cuspidata | Контроль | 64.2 ± 1.96б | 1332 ± 33а | 241 ± 24б | 81.5 ± 8.1в | 674 ± 68в |
| Опыт | 34.2 ± 1.03е | 766 ± 21е | 187 ± 19в | 135.0 ± 13.5а,б | 307 ± 31д | |
| Кореджиоло | Контроль | 42.8 ± 1.07д | 1036 ± 28г | 345 ± 35а | 114.0 ± 11.0 б | 1850 ± 185а |
| Опыт | 19.3 ± 0.48ж | 800 ± 25е | 247 ± 25б | 151.0 ± 15.1а | 702 ± 70в | |
| Раццо | Контроль | 55.6 ± 1.67в | 1232 ± 36б | 330 ± 33а | 112.5 ± 1.3б | 1840 ± 184а |
| Опыт | 32.1 ± 0.96е | 916 ± 23д | 241 ± 24б | 143.0 ± 14.3а | 680 ± 68в | |
| Никитская | Контроль | 72.8 ± 1.82а | 1216 ± 30б | 257 ± 26б | 79.0 ± 7.9в | 450 ± 45г |
| Опыт | 42.8 ± 1.05д | 1248 ± 31б | 71.0 ± 7.1г | 54.9 ± 5.5г | 202 ± 20е | |
Воздействие отрицательных температур приводило к снижению уровня пролина на 17–55% в листьях всех исследуемых генотипов. Наиболее значительно концентрация пролина падала у сорта Кореджиоло. Такая картина является типичной реакцией маслины на низкотемпературный стресс. Поскольку пролин в качестве криопротектора участвует в неферментативной регуляции ПОЛ, то и снижение его концентрации может быть обусловлено реализацией защитных реакций [26].
Неоднократно отмечалась, что роль фенольных соединений в устойчивости растений к отрицательным температурам связана с их высокой биологической активностью и широким разнообразием функций в растительном организме, в частности – с участием в процессах регуляции роста и неферментативной защиты растения от АФК [28]. В настоящее время известно о высоких концентрациях фенольных соединений в листьях и плодах маслины, которые представлены фенольными кислотами и спиртами, флавоноидами и секо-иридоидами [29]. При этом одним из важнейших метаболитов маслины является олеуропеин [30]. Однако большая часть исследований этого соединения посвящена его фармакологическим свойствам. Информация о роли олеуропеина непосредственно в организме растений O. europaea отрывочна и противоречива. В частности, испанскими учеными констатируется связь содержания олеуропеина и его предшественников гидрокситирозола и тирозола со степенью устойчивости некоторых сортов маслины к низкотемпературному стрессу [9, 25].
Для выявления значения фенольных соединений в морозостойкости маслины изучено изменение концентрации данной группы веществ в контролируемых условиях. Установлено, что суммарное содержание фенольных соединений снижалось у всех слабоморозостойких сортов и O. europaea subsp. cuspidata на 7–42%, а у морозостойкого сорта Никитская оставалось неизменным. Также происходили значительные изменения концентраций индивидуальных фенольных соединений. Так, содержание лютеолин-7-О-глюкозида и олеуропеина падало у всех генотипов, за исключением сорта Асколяно. Содержание рутина росло у сорта Раццо и подвида O. europaea subsp. cuspidata, у сортов Кореджиоло и Никитская падало, а у сорта Асколяно оставалось неизменным.
На основе полученных данных можно предположить участие как суммы фенольных соединений, так и их индивидуальный вклад в механизмы устойчивости маслины к отрицательным температурам. Снижение концентрации этих веществ отмечено практически у всех сортов сразу после воздействия стрессового фактора. Вероятно, что действие критических температур приводит к активному расходованию данной группы соединений растительным организмом в качестве антиоксидантов.
Результаты проведенных исследований позволяют заключить, что действие температуры, близкой к значению абсолютного минимума на ЮБК, на слабоморозостойкие генотипы O. europaea приводит к инактивации фотосинтетических процессов сразу после окончания действия стрессора. Наиболее чувствительным к низкотемпературному воздействию у устойчивого сорта Никитская и слабоустойчивого Асколяно оказались параметры, характеризующие эффективность световой фазы фотосинтеза и относительную фотосинтетическую активность. Однако у этих сортов изменения параметров ИФХ носили обратимый характер, о чем свидетельствуют значения индекса жизнеспособности. Необходимо отметить, что в характеристиках флуоресценции до стрессового воздействия у изучаемых представителей O. europaea также выявлены различия. В частности, сорта с низкой морозостойкостью и подвид O. europaea subsp. cuspidatа значительно отличались от морозостойкого сорта Никитская как по уровню начальной флуоресценции, так и по ее максимальному значению. Эти отличия могут быть связаны с сортовыми особенностями и позволяют предположить, что высокая чувствительность фотосинтетического аппарата к действию отрицательных температур у сортов Раццо, Кореджиоло и подвида O. europaea subsp. cuspidatа связана с большей потерей энергии возбуждения во время ее транспортировки от светособирающих комплексов, по сравнению с морозостойким сортом Никитская. Отдельно следует отметить, что сорт Никитская значительно отличается по соотношению параметров Fm и Fst, что показывает наличие некоторого “пула” хлорофилла, обеспечивающего относительную стабильность фотосинтетических процессов в стрессовых условиях. Установлено, что у спустя 24 часа после окончания стрессового воздействия у слабоустойчивого сорта Асколяно и морозостойкого сорта Никитская интенсивность изменений параметров ИФХ уменьшилась, что, вероятно, связано со стабилизацией фотосинтетических процессов. При этом у резистентного сорта Никитская через сутки после действия отрицательной температуры базовый уровень флуоресценции и эффективность световой фазы фотосинтеза практически не отличались от контрольных.
Исследования изменений в активности окислительно-восстановительных ферментов и содержания некоторых биологически активных веществ показали, что развитие низкотемпературного стресса сопровождается специфическими изменениями как в работе ферментов, так и в концентрации фенольных соединений и пролина. Выявлено, что у чувствительных к действию отрицательных температур генотипов O. europaea активность каталазы существенно снизилась, а у морозостойкого сорта Никитская практически не изменилась. Поскольку отрицательные температуры способствуют активации процессов образования АФК, а в нейтрализации их токсичных продуктов принимает участие каталаза, то сохранение ее нормальной активности имеет существенное значение для поддержания гомеостаза в растительном организме в целом и, в частности, для сохранения фотосинтетической функции. Изменения полифенолоксидазной активности в условиях действия критических температур происходили разнонаправленно, что, возможно, связано как с индивидуальными сортовыми особенностями, так и со степенью криорезистентности.
Результаты исследования влияния отрицательных температур на концентрацию фенольных соединений и пролина в тканях листьев представителей O. europaea позволили сделать вывод о связи изменения их содержания с реализацией защитных механизмов. Установлено, что у всех изучаемых генотипов происходит снижение содержания пролина, суммы фенольных соединений и одного из ключевых веществ в метаболизме маслины европейской – олеуропеина, сразу после окончания действия температуры –15°С. Полученные данные свидетельствуют об участии этих веществ в первичных неспецифических реакциях на действие стрессора.
Таким образом, в результате проведенных исследований получена характеристика морозостойкости генотипов маслины в условиях Южного берега Крыма и выявлены особенности работы фотосинтетического аппарата, изменения ферментативной активности и содержания протекторных веществ в листьях данной культуры в связи со степенью устойчивости к действию отрицательных температур.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Adams W.W.I., Demmig-Adams B., Rosenstiel T.N., Ebbert V. Dependence of photosynthesis and energy dissipation activity upon growth form and light environment during the winter // Photosynth. Res. 2001. V. 67. P. 51. https://doi.org/10.1023/A:1010688528773
Demming-Adams B. Carotenoides and photoprottction in plants. A role for xanthophyll zeaxanthin // Biochim. Biophys. Acta. 1990. V. 10. P. 2401. https://doi.org/10.1016/0005-2728(90)90088-L
Гаевский Н.А., Моргун В.Н. Использование переменной и замедленной флуоресценции хлорофилла для изучения фотосинтеза растений // Физиология растений. 1993. Т. 40. С. 119.
Бородин И.Ф., Будаговский А.В., Будаговская О.Н., Будаговский И.А., Судник Ю.А. Применение эффекта фотоиндуцированной изменчивости оптических свойств хлорофиллсодержащих тканей для диагностики функционального состояния растений // Доклады РАСХН. 2008. № 5. С. 62.
Гольцев В.Н., Кузманова М.А., Каладжи Х.М., Аллахвердиев С.И. Переменная и замедленная флуоресценция хлорофилла а – теоретические основы и практическое приложение в исследовании растений. Ижевск–Москва: Институт компьютерных исследований, 2014. 220 с.
Levitt J. Responses of Plants to Environmental Stresses. New York: Academic Press, 1980. 497 p.
Lin S.Z., Zhang Z.Y., Liu W.F., Lin Y.Z., Zhang Q., Zhu B.Q. Role of glucose-6-phosphate dehydrogenase in freezing-induced freezing resistance of Populus suaveolens // J. Plant Physiol. Mol. Biol. 2005. V. 31. P. 34.
Mittler R. Oxidative stress, antioxidants and stress tolerance // Trends Plant Sci. 2002. V. 7. P. 405. https://doi.org/10.1016/s1360-1385(02)02312-9
Ortega-García F., Peragón J. The response of phenylalanine ammonia-lyase, polyphenol oxidase and phenols to cold stress in the olive tree (Olea europaea L. cv. Picual) // J. Sci. Food Agric. 2009. V. 89. P. 1565. https://doi.org/10.1002/jsfa.3625
Bartolozzi F., Rocchi P., Camerini F., Fontanazza G. Changes of biochemical parameters in olive (Olea europaea L.) leaves during an entire vegetative season, and their correlation with frost resistance // Acta Hortic. 1999. V. 474. P. 435. https://doi.org/10.17660/ActaHortic.1999.474.89
Roselli G., Venora G. Relationship between stomatal size and winter hardiness in the olive // Acta Hortic. 1990. V. 286. P. 89. https://doi.org/10.17660/ActaHortic.1990.286.15
Cansev A., Gulen H., Eris A. Cold-hardiness of olive (Olea europaea L.) cultivars in cold-acclimated and non-acclimated stages: seasonal alteration of antioxidative enzymes and dehydrin-like proteins // J. Agric. Sci. 2009. V. 147. P. 51. https://doi.org/10.1017/S0021859608008058
Бурдасов В.М. Методические указания по определению элементов зимостойкости садовых растений. Москва: ВАСХНИЛ, 1984. 20 с.
Лищук А.И. Физиологические и биофизические методы в селекции плодовых культур: методические рекомендации. Москва: ВАСХНИЛ, 1991. 58 с.
Romanov V.A., Galelyuka I.B., Sarakhan Ie.V. Portable fluorometer Floratest and specifics of its application // Sensor Electronics and Microsystem Technology. 2010. V. 1(7). № 3. P. 39.
Будаговская О.Н., Будаговский А.В., Будаговский И.А. Лазерная диагностика растений: методические рекомендации. Мичуринск: “Мичуринск”, 2010. 54 с.
Stirbet A., Govindjee J. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and Photosystem II: Basics and applications of the OJIP fluorescence transient // J. Photochem. Photobiol. B. 2011. V. 104. P. 236. https://doi.org/10.1016/j.jphotobiol.2010.12.010
Андрющенко В.К., Саянова В.В., Жученко А.А. Модификация метода определения пролина для выявления засухоустойчивых форм Lycopersicon Tourn // Изв. АН Молд. ССР. Сер. биол. и хим. наук. 1981. № 4. С. 55.
Методы технохимического контроля в виноделии / Под ред. В.Г. Гержиковой. Симферополь: Таврида, 2002. 259 с.
Ермаков А.И. Методы биохимического исследования растений. Ленинград: Колос, 1987. 456 с.
Plazonic A., Bucar F., Males Z., Mornar A., Nigovi B., Kujundzij N. Identification and quantification of flavonoids and phenolic acids in burr parsley (Caucalis platycarpos L.), using high-performance liquid chromatography with diode array detection and electrospray ionization mass spectrometry // Molecules. 2009. V. 14. № 7. P. 2466. https://doi.org/10.3390/molecules14072466
Kalaji H., Govindjee, Goltsev V., Bosa K., Allakhverdiev S.I., Strasser R. Experimental in vivo measurements of light emission in plants: A perspective dedicated to David Walker // Photosynth. Res. 2012. V. 114. P. 69. https://doi.org/10.1007/s11120-012-9780-3
Goltsev V., Zaharieva I., Chernev P., Kouzmanova M., Kalaji H.M., Yordanov I., Krasteva V., Alexandrov V., Stefanov D., Allakhverdiev S.I., Strasser R.J. Drought-induced modifications of photosynthetic electron transport in intact leaves: Analysis and use of neural networks as a tool for a rapid non-invasive estimation // Biochim. Biophys. Acta. 2012. V. 1817. № 8. P. 1490. https://doi.org/10.1016/j.bbabio.2012.04.018
Yordanov I., Stefanov D., Krasteva V., Gourmanova M., Goltsev V. Drought stress responses in plants – molecular biology, physiology and agronomical aspects // J. Agric. Sci. 2012. V. 4. P. 7.
Ortega-Garcıa F., Peragon, J. Phenol metabolism in the leaves of the olive tree (Olea europaea L.) cv. Picual, Verdial, Arbequina, and Frantoio during Ripening // J. Agric. Food Chem. 2010. V. 58. P. 12440. https://doi.org/10.1021/jf102827m
Hashempour A., Ghasemnezhad M., Fottohi Ghazvini R., Sohani M.M. The physiological and biochemical responses to freezing stress of olive plants treated with salicylic acid // Physiol. Plant. 2014. V. 61. P .476. https://doi.org/10.1134/S1021443714040098
Губанова Т.Б., Браилко В.А., Палий А.Е. Морозостойкость некоторых вечнозеленых видов семейств Oleaceae и Caprifoliaceae на Южном берегу Крыма // Бюллетень Никитского ботанического cада. 2017. Вып. 125. С. 103.
Saibandith B., Spencer J.P., Rowland I.R., Commane D.M. Olive polyphenols and the metabolic syndrome // Molecules. 2017. V. 22. P. 1082. https://doi.org/10.3390/molecules22071082
Silva S., Gomes L., Leitao F., Coelho A.V., Boas L.V. Phenolic compounds and antioxidant activity of Olea europaea L. fruits and leaves // Food Sci. Technol. Int. 2006. V. 12 P. 385. https://doi.org/10.1177/1082013206070166
Karakaya S.N. Olive tree (Olea europaea) leaves: potential beneficial effects on human health // Nutr. Rev. 2009. V. 67. P. 632. https://doi.org/10.1111/j.1753-4887.2009.00248.x
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


