Физиология растений, 2020, T. 67, № 4, стр. 339-356
Генетический контроль развития запасающего корня
К. А. Кузнецова a, И. Е. Додуева a, *, А. А. Паутов b, Е. Г. Крылова b, Л. А. Лутова a
a Санкт-Петербургский государственный университет,
кафедра генетики и биотехнологии
Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет, кафедра ботаники
Санкт-Петербург, Россия
* E-mail: wildtype@yandex.ru
Поступила в редакцию 22.11.2019
После доработки 13.01.2020
Принята к публикации 13.01.2020
Аннотация
Формирование запасающих органов растений, в частности – запасающего корня, является примером специализации растений к аккумуляции веществ. В связи с важным экономическим значением корнеплодных сельскохозяйственных культур, изучение генетических механизмов развития запасающего корня является весьма актуальным. Тем не менее, генетический контроль развития запасающего корня в настоящий момент изучен довольно слабо. Основную массу запасающего корня двудольных растений, как правило, занимают сильно паренхиматизированные вторичные проводящие ткани (флоэма и/или ксилема), которые формируются в результате пролиферации клеток камбия и специализированы к аккумуляции питательных веществ. В настоящее время выявлен целый ряд регуляторов развития камбия; в контроле активности этой меристемы участвует система WOX-CLAVATA (включающая в себя сигнальные пептиды CLE, их рецепторы и их мишени – гомеодомен-содержащие транскрипционные факторы WOX), а также транскрипционные факторы других семейств и фитогормоны. В обзоре представлены современные данные о механизмах регуляции активности камбия, дифференцировки проводящих тканей и запасания питательных веществ, а также данные о консервативных и специфических регуляторах развития запасающих корней у наиболее изученных корнеплодных культур – редиса, репы, свеклы, моркови, батата и кассавы.
ВВЕДЕНИЕ
В процессе онтогенеза различные органы растений могут претерпевать метаморфозы – видоизменения, связанные со сменой выполняемых функций или условий функционирования. Одним из примеров такого изменения является формирование специализированных запасающих вегетативных органов, служащих для накопления питательных веществ. Способность к формированию запасающих органов (в частности – запасающих корней) неоднократно возникала в эволюции и является свойством многих многолетних и двулетних растений. Эти органы обеспечивают переживание растениями неблагоприятных условий (холод, засуха) в состоянии покоя, чтобы в следующем благоприятном сезоне дать начало новому растению [1]. В связи с этим, селекционный отбор растений с запасающим корнем шел не только в сторону формирования более крупных корней, но и в сторону адаптации к различным широтам, что привело к появлению разнообразных культурных генотипов. Например, кассава (маниок) очень устойчива к засухе и способна расти на краевых почвах, представляя собой одну из основных продовольственных культур в большей части тропической Африки [2]. Возобновление роста и развития обеспечивается метаболическими ресурсами, накопленными в основном в форме крахмала или растворимых сахаров. Именно эта особенность запасающих органов, в частности, запасающих корней, обусловливает их экономическую значимость для человека: например, на сахарную свеклу приходится 20% мирового производства сахара [3]. Понимание механизмов, используемых растением для формирования запасающих органов, является не только фундаментальным вопросом в биологии развития, но важной практической задачей в плане удовлетворения потребностей в питании растущего населения Земли. Запасающие корни характерны для растений семейств капустные (репа, редька, брюква), зонтичные (морковь, пастернак, петрушка), амарантовые (свекла), астровые (цикорий, георгина), вьюнковые (батат), молочайные (кассава) и т.д. (табл. 1). Формирование запасающих корней сопровождается у разных растений интенсивным разрастанием запасающей паренхимы вторичной ксилемы и/или вторичной флоэмы, а также первичной коры.
Таблица 1.
Наиболее известные виды растений, формирующие запасающие корни.
| Семейство | Вид, подвид, сортогруппа | Тип запасающего корня | Основная запасающая ткань | Ссылка |
|---|---|---|---|---|
| Капустные (Brassicaceae) | Репа (Brassica rapa subsp. rapa) | Корнеплод | Ксилема | 6, 86 |
| Брюква (Brassica napus var. napobrassica) | Корнеплод | Ксилема | 99 | |
| Редис и редька (Raphanus sativus subsp. sativus) | Корнеплод | Ксилема | 5, 60, 82–84 | |
| Мака перуанская (Lepidium meyenii) | Корнеплод | Ксилема | 87 | |
| Зонтичные (Apiaceae) | Морковь (Daucus carota subsp. sativus) | Корнеплод | Флоэма | 90–92 |
| Пастернак (Pastinaca sativa) | Корнеплод | Ксилема | 66 | |
| Петрушка (Petroselinum crispum) | Корнеплод | Ксилема (?) | ||
| Арракача (Arracacia xanthorrhiza) | Корнеплод | Ксилема (?) | ||
| Амарантовые (Amaranthaceae) | Свекла (Beta vulgaris) | Корнеплод | Ксилема | 66, 88, 89 |
| Бобовые (Fabaceae) | Хикама (Pachyrhizus erosus) | Корнеплод | Ксилема (?) | |
| Астровые (Asteraceae) | Цикорий (Cichorium, разные виды) | Корнеплод | Ксилема (?) | 100 |
| Скорцонера (Scorzonera hispanica) | Корнеплод | Ксилема (?) | 100 | |
| Георгина (Dahlia, разные виды) | Корнеклубень | Ксилема | 100 | |
| Вьюнковые (Convolvulaceae) | Батат (Ipomoea batatas) | Корнеклубень | Ксилема | 7, 11, 13, 30, 61, 93–95 |
| Молочайные (Euphorbiaceae) | Кассава (маниок) (Manihot esculenta) | Корнеклубень | Ксилема | 97, 98 |
По происхождению выделяют два основных типа запасающих корней [4]: 1) корнеплоды, представленные разросшимся стержневым корнем; у некоторых видов растений (например, редис, свекла) корнеплод представляет собой композитную структуру, верхняя часть которой является производной гипокотиля, и 2) корнеклубни, или корневые шишки, – разрастания боковых или придаточных корней в мочковатой корневой системе (например, у батата, кассавы и георгины); на корнеклубнях могут развиваться придаточные почки, которые служат для вегетативного размножения. Корнеплоды, в свою очередь, делятся на два типа в зависимости от того, в какой ткани – ксилеме или флоэме – имеет место разрастание и запасание питательных веществ: например, морковь формирует корнеплод флоэмного типа, а репа – ксилемного типа.
Среди корнеплодов выделяют: 1) монокамбиальные, у которых рост утолщением обеспечивается активностью одного камбиального кольца – такие корнеплоды характерны для представителей семейства Brassicaceae – редиса, редьки, репы и брюквы [5, 6], и 2) поликамбиальные, при развитии которых имеет место аномальный рост: из клеток перицикла закладываются дополнительные кольца камбия, дающие начало третичным флоэме и ксилеме; такие корнеплоды характерны для свеклы [3]. Основными запасающими тканями в корнеклубнях батата и кассавы являются как ксилема, так и флоэма, большой вклад в развитие корнеклубней вносит аномальный рост [7–9].
Интересно, что в пределах некоторых родов и видов растений может иметь место широкое разнообразие по способности к формированию запасающих органов. Ярким примером такого полиморфизма являются представители рода Brassica. Так, в пределах вида Brassica rapa имеются как подвиды, образующие запасающий корень (репа Brassica rapa subsp. rapa), так и подвиды с другими запасающими органами (например, для пекинской капусты Brassica rapa subsp. pekinensis и бок-чой Brassica rapa subsp. chinensis характерны разросшиеся черешки листьев, накапливающие сахара, а для кольраби Brassica rapa var. Gongylodes – запасающий стебель), или вовсе не формирующие запасающих органов (например, желтый сарсон Brassica rapa subsp. trilocularis и полевая капуста Brassica rapa subsp. oleifera) [6]. Среди сложноцветных возможно формирование корнеплодов ксилемного типа (цикорий Cichorim intybus, скорцонера Scorzonera hispanica), корнеклубней (георгина Dahlia variabilis), а также настоящих клубней – модифицированных побегов (топинамбур Helianthus tuberosus) и т.д. [10]. Вероятно, это связано с тем, что способность к развитию запасающих органов, в том числе запасающих корней, в эволюции могла возникать независимо несколько раз в пределах одного семейства, что было показано на примере представителей рода Brassica [6] и семейства Вьюнковых [11]. Считается, что основную роль в эволюции запасающих органов, по крайней мере, в семействе Brassicaceae, сыграла доместикация [6, 12]. Близкородственные формы растений, формирующие запасающий корень, и растения, для которых функция запасания не характерна, зачастую имеют общий набор генов, но различаются анатомически, что свидетельствует о ключевом значении регуляторных механизмов, меняющих уровни экспрессии генов в корне в разных условиях [11].
Формирование корней, специализированных на накоплении запасных веществ, связано с тремя основными процессами: 1) активностью меристемы камбия, обеспечивающей образование обширных зон паренхимных клеток, 2) аккумуляцией питательных веществ в паренхиме ксилемы и/или флоэмы: прежде всего, крахмала и/или фруктанов, иногда также сахарозы. Кроме того, у растений с запасающим корнем наблюдается пониженный уровень биосинтеза лигнина в корневой системе, и считается, что в процессе доместикации растений с запасающим корнем (в частности, кассавы и батата) важную роль сыграл “сдвиг” метаболизма от биосинтеза фенилпропаноидов к биосинтезу крахмала [13], и 3) сигнальной коммуникацией стебля и корня. Надземная часть растения является источником сигналов (микроРНК, гормонов, сахаров), которые поступают в корень по флоэме и могут определять модификацию его развития как запасающего органа. Синтез таких сигналов в надземной части растения в свою очередь индуцируется различными внешними факторами (фотопериод, температура и т.д.) или сигналами, поступающими из корня (например, нитраты, фосфаты) [14, 15]. Кроме того, огромное значение для коммуникации стебля и корня имеют сигнальные пептиды, которые могут синтезироваться в корне и рецептироваться в надземной части растения и наоборот [16].
Наш обзор посвящен генетическим механизмам, лежащим в основе развития запасающих корней. К настоящему времени данные об этих механизмах получены для ряда сельскохозяйственных культур – редиса, репы, свеклы, батата и кассавы.
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ РАЗВИТИЯ КАМБИЯ И ДИФФЕРЕНЦИРОВКИ ПРОВОДЯЩИХ ЭЛЕМЕНТОВ
Камбий – вторичная латеральная меристема, обеспечивающая формирование вторичных проводящих тканей растений, которое сопровождается утолщением корня и стебля (вторичный рост). В формировании кольца камбия в корне участвуют две первичные латеральные меристемы – прокамбий и перицикл [17, 18]. Камбиальная зона разнородна и включает в себя камбиальные инициали (стволовые клетки) и материнские клетки флоэмы и ксилемы (клетки-предшественницы), и делится на три домена – проксимальный домен, состоящий из материнских клеток ксилемы, дистальный домен, включающий в себя материнские клетки флоэмы, и центральный домен, состоящий из стволовых клеток. Клетки разных доменов камбия сходны морфологически, но очень четко различаются по характеру экспрессии генов разных групп: экспрессия всех генов, регулирующих развитие камбия, укладывается в какой-то из трех основных графиков – с пиками в стволовых клетках камбия, инициалях ксилемы и инициалях флоэмы соответственно [18]. Долгое время оставался открытым вопрос о существовании в камбии организующего центра – характерной для апикальных меристем небольшой группы клеток, экспрессирующей один из генов семейства WOX (см. ниже) и подавляющей дифференцировку прилегающих к ней стволовых клеток. Недавно было показано, что роль организующего центра камбия выполняет слой клеток проксимального домена, непосредственно примыкающий к ксилеме [17]. Также недавние исследования [17, 18] экспериментально подтвердили теорию однорядного камбия, сформулированную 150 лет назад немецким ботаником Карлом Густавом Санио (Karl Gustav Sanio), согласно которой каждая стволовая клетка камбия, претерпевая асимметричные периклинальные деления, продуцирует как ксилемные, так и флоэмные клетки-предшественницы. В свою очередь, клетки-предшественницы на периферии камбиальной зоны делятся симметрично и дифференцируются в проксимальном или дистальном направлениях, в результате чего к центру камбий откладывает клетки вторичной ксилемы, а к периферии – клетки вторичной флоэмы. В составе вторичных ксилемы и флоэмы дифференцируются проводящие и механические элементы разных типов, клетки осевой паренхимы и радиальных лучей. Являясь специализированными проводящими тканями и производными камбия, флоэма и ксилема также служат источниками сигналов, определяющих развитие “породившей” их меристемы: так, по ксилеме и ее клеткам-предшественницам поступает ИУК, необходимая для позиционирования организующего центра камбия, а из флоэмы – пептиды TDIF, поддерживающие его пролиферативную активность (см. ниже). Деятельность камбия, как и других меристем, зависит от баланса пролиферации стволовых клеток и дифференцировки специализированных типов клеток. В настоящее время выявлен ряд регуляторов развития камбия, среди которых множество ТФ разных групп, а также взаимодействующие с ними фитогормоны (рис. 1).
Рис. 1.
Генная сеть, регулирующая активность камбия и развитие проводящей системы растений (подробности в тексте). Контроль деления клеток камбия: ТФ WOX4 [19] и WOX14 [20], с WOX4 взаимодействует ТФ НАМ4 [21]. Экспрессию WOX4 регулируют пептиды TDIF и их рецептор TDR [52, 53]. ЦК, регулируют экспрессию генов CYCD, ANT и PEAR [24, 25]. Контроль дифференцировки ксилемы: Пептиды TDIF и их рецептор TDR через взаимодействие TDR/PXY с киназами GSK3 [49] активируют ТФ ARF, в том числе ARF5/МР [50], который: а) регулирует экспрессию гена TMO5;ТФ TMO5 и LHW обеспечивают спецификацию ксилемы [28], б) подавляет пролиферацию камбия, активируя экспрессию генов ARR A-типа [50] и подавляя экспрессию WOX4 [27]. Пептид CLE10 подавляет дифференцировку сосудов, ингибируя экспрессию генов ARR А-типа [58]. Пептид CLE19 – предполагаемый активатор дифференцировки сосудов [59, 60]. ТФ HD-Z-IP III регулируют полярный транспорт ИУК и дифференцировку ксилемы [23], подавляют экспрессию PEAR [24]. ТФ KNOX стимулируют дифференцировку ксилемы, подавляя экспрессию BOP [22]. ТФ VND и SND регулируют поздние этапы дифференцировки сосудов [32, 33]. Контроль развития флоэмы: Пептиды CLE25 и CLE45 и их рецепторы CLERK-CLV2 и BAM3-SERK регулируют спецификацию флоэмы [57]. ТФ APL и LBD1 подавляют дифференцировку клеток-предшественниц флоэмы по ксилемному пути [34, 35]. Также к регуляторам развития проводящей системы относятся некоторые ТФ MADS [7, 29, 30] и рецепторные киназы MOL1 и RUL1 [56].
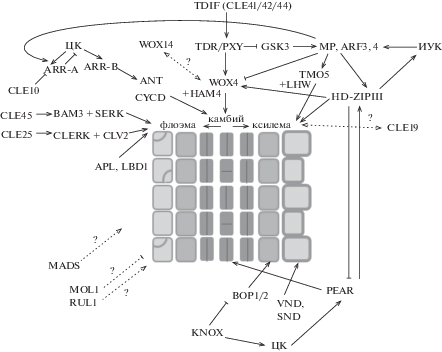
Среди ТФ, регулирующих развитие камбия и дифференцировку проводящих тканей, особого упоминания заслуживают три семейства ТФ с гомеодоменом: WUSCHEL-RELATED HOMEOBOX (WOX), KNOTTED-RELATED HOMEOBOX (KNOX) и HOMEODOMAIN-LEUCINE ZIPPER класса III (HD-ZIPIII). Отдельные представители семейства ТФ WOX известны как регуляторы поддержания стволовых клеток в меристемах: так, в регуляции активности камбия участвуют WOX4 [19] и его возможный “дублер” WOX14 [20], при этом с WOX4 взаимодействует его кофактор – ТФ HAIRY MERISTEM 4 (НАМ4), относящийся к семейству GRAS [21]. ТФ KNOX – центральные регуляторы развития апикальной меристемы побега, кроме того, ТФ SHOOT MERISTEMLESS (STM) и KNOTTED-LIKE OF ARABIDOPSIS THALIANA 1 (KNAT1), необходимы для дифференцировки сосудов и ксилемных волокон. Для этой их функции важна KNOX-зависимая репрессия транскрипции генов, кодирующих ТФ BLADE-ON-PETIOLE1 и 2 (BOP1/2), которые также известны как регуляторы границы листовых примордиев [22]. ТФ HD-ZIPIII–PHABULOSA (PHB), CORONA (CNA), REVOLUTA (REV) и ARABIDOPSIS THALIANA HOMEOBOX 8 (ATHB8) необходимы для создания канала полярного транспорта ИУК и ранних этапов дифференцировки ксилемы [17, 23]. Кроме того, недавно была выявлена их функция в поддержании организующего центра камбия – центральную роль в этом процессе играет ТФ ATHB8. Активность HD-ZIPIII в организующем центре камбия необходима также для поддержания центрального домена камбиальной зоны и экспрессии его маркеров – генов WOX4 и ANT (см. ниже) [17].
Антагонистами HD-ZIPIII являются мобильные ТФ группы PHLOEM EARLY DOF 1 и 2 (PEAR1/2), которые транспортируются из флоэмы и стимулируют периклинальные деления клеток камбия: ТФ HD-ZIPIII подавляют экспрессию генов PEAR, тогда как ТФ PEAR являются прямыми активаторами экспрессии генов, кодирующих ТФ HD-ZIPIII [24]. Еще один регулятор активности камбия – ТФ AINTEGUMENTA (ANT), относящийся к семейству APETALA 2: его ген экспрессируется в стволовых клетках камбия и необходим для их пролиферации [25]. В регуляции активности камбия принимают участие некоторые ИУК-регулируемые ТФ семейства AUXIN RESPONSE FACTOR (ARF), в частности, ARF5/MONOPTEROS (МР) – регулятор экспрессии генов PINFORMED (PIN), кодирующих белки полярного транспорта ИУК [26]. Было показано, что МР ограничивает количество стволовых клеток камбия, напрямую подавляя экспрессию гена WOX4; в тоже время, ARF3 и 4 являются позитивными регуляторами WOX4 и активаторами камбия [27]. Еще одна мишень ТФ МР – ген, кодирующий ТФ TARGET OF MONOPTEROS5 (TMO5), относящийся к семейству basic helix-loop-helix (bHLH): при взаимодействии с другим ТФ bHLH, LONESOME HIGHWAY (LHW), он обеспечивает спецификацию протоксилемы в эмбриогенезе и метаксилемы в постэмбриональном развитии [28].
К числу регуляторов развития камбия и ксилемы также относятся отдельные представители семейства ТФ с MADS-боксом (от MCM1, AG, DEFA, SRF). Наиболее известной функцией ТФ этого семейства у растений является контроль генеративного развития: переход к цветению, формирование флоральной меристемы, контроль идентичности органов цветка и т.д. Вместе с тем, отдельные представители MADS семейства ТФ участвуют также в развитии корня у арабидопсис [29] и развитии запасающих органов – клубня картофеля [30] и корнеклубня батата [7, 31]. В частности, у батата ген SRD1, кодирующий ТФ MADS, экспрессируется в клетках камбия и активируется ИУК, а его сверхэкспрессия вызывает усиленную пролиферацию клеток камбия и метаксилемы [7].
Важнейшим событием в дифференцировке элементов ксилемы являются формирование лигнифицированной вторичной клеточной стенки, полное или частичное разрушение поперечных стенок между члениками сосудов (образование перфорации) и отмирание протопласта. Оба процесса находятся под контролем ТФ с NAC-доменом VASCULAR-RELATED NAC DOMAIN PROTEIN (VND6, VND7) и SECONDARY WALL-ASSOCIATED NAC DOMAIN PROTEIN (SND1). В опытах по сверхэкспрессии генов VND и SND установлено, что мишенями ТФ SND, вероятно, являются гены, контролирующие синтез компонентов вторичной клеточной стенки, таких как целлюлоза и лигнин, тогда как мишенями ТФ VND – гены, участвующие в контроле программируемой клеточной смерти при отмирании протопластов сосудов [32, 33].
К специфическим регуляторам дифференцировки флоэмы относится ТФ ALTERED FLOEM DEVELOPMENT (APL), принадлежащий к семейству MYB. По всей видимости, программы дифференцировки флоэмы и ксилемы конкурентно ингибируют друг друга, поскольку сверхэкспрессия APL подавляет дифференцировку ксилемы, а у мутанта apl происходит замещение флоэмы на ксилемоподобные клетки [34]. ТФ LATERAL ORGAN BOUNDARIES 1 (LBD1) участвует в ранних этапах дифференцировки флоэмы: экспрессия гена LBD1 наблюдается в дистальном домене камбия, где сосредоточены клетки-предшественницы флоэмы и негативно регулируется ауксинами. У мутантов по LBD1 имеет место снижение количества флоэмы и активация экспрессии генов KNOX, которые стимулируют дифференцировку ксилемы [35].
Фитогормональная регуляция развития камбия играет центральную роль в контроле деления его клеток и дифференцировке проводящих тканей. Так, для закладки прокамбия в эмбриогенезе, последующего формирования камбия и перехода к вторичному росту важно антагонистическое взаимодействие ИУК и ЦК. Асимметричное распределение этих гормонов имеет место в стеле корня арабидопсис, начиная с ранних этапов ее развития в эмбриогенезе, при этом ИУК локализуется в первичной ксилеме и прилегающих к ней клетках перицикла, тогда как ЦК сосредоточены в прокамбии и первичной флоэме [36]. В целом, можно сказать, что ИУК вносит основной вклад в развитие ксилемы, а ЦК – флоэмы и камбия, но в действительности все обстоит не так однозначно. Действительно, ИУК необходима для спецификации ксилемы: ИУК-регулируемый MP/ARF5 напрямую регулирует экспрессию генов TMO5 и HD-ZIP III, которые контролируют этот процесс [17, 27]. С другой стороны, ИУК вносит вклад в поддержание камбия, поскольку активность взаимодействующих ИУК-регулируемых ТФ TMO5 и LHW необходима для периклинальных делений клеток камбия [37], а активность ИУК-регулируемых ТФ HD-ZIPIII – для позиционирования и поддержания организующего центра камбия [17]. Высокий уровень ИУК в проксимальном домене камбия поддерживается благодаря системе полярного транспорта, которая обеспечивает базипетальный транспорт ИУК, синтезированной в побеге, по молодым сосудистым элементам и клеткам-предшественницам ксилемы [38].
Роль ЦК в развитии проводящей системы растений заключается в контроле спецификации камбия и пролиферации его клеток: в частности, множественные мутанты с нарушением биосинтеза ЦК или их рецепции не формируют камбий [36, 39]. В стеле корня арабидопсис ЦК сосредоточены в камбии и флоэме [36], где они активируют экспрессию генов, отвечающих за клеточные деления: в центральном домене камбия – гена ANT и гена CYCD3;1, кодирующего циклин класса D [25], а во флоэме и дистальном домене камбия – генов PEAR [24]. При этом в камбии, как и в других меристемах, проявляется антагонистическое взаимодействие ЦК и ИУК: ЦК негативно регулируют экспрессию генов PIN1 и PIN7, контролирующих полярный транспорт ИУК, тогда как ИУК индуцирует экспрессию гена ARABIDOPSIS HISTIDINE PHOSPHOTRANSFER PROTEIN 6 (AHP6), продуктом которого является негативный регулятор ответа на ЦК [36].
Помимо ИУК и ЦК свою роль в развитии камбия играют и другие гормоны: гиббереллины, этилен, брассиностероиды, стриголактоны; особое место занимает пептидная регуляция активности камбия с помощью CLAVATA-подобной системы.
Гиббереллины транспортируются в стелу корня и гипокотиля из стебля [40], накапливаются в ксилемной зоне и стимулируют дифференцировку одревесневающих элементов ксилемы – сосудов и ксилемных волокон [41]. В этом функция гиббереллинов совпадает с функцией ТФ KNOX, тем не менее, ТФ KNOX известны как антагонисты гиббереллинов: гены биосинтеза этих гормонов являются мишенями негативной регуляции ТФ KNOX [42]. Предполагается, что биосинтез гиббереллинов или их транспорт в стелу корня находится под контролем ТФ WOX14: сверхэкспрессия гена WOX14 увеличивает уровень активных гиббереллинов в стеле, а дефекты развития у мутанта wox14 компенсируются добавлением гиббереллинов [43].
Этилен стимулирует деление клеток камбия, увеличивая площадь камбия и ксилемы. Ген ACО (ACC OXIDASE), контролирующий лимитирующую стадию биосинтеза этилена, экспрессируется исключительно в дифференцирующейся вторичной ксилеме [44]. Мутанты арабидопсис со сверхпродукцией этилена ethylene overproducing (eto1, eto2) характеризуются повышенной частотой клеточных делений в камбии и увеличением площади ксилемы, тогда как мутанты с нарушением передачи сигнала этилена ethylene insensitive (ein2, ein5) имеют противоположный фенотип. Снижение количества клеток камбия и ксилемы характерно также для мутантов с потерей функции этилен-регулируемого ТФ ERF1 (Ethylene Response Factor); активация экспрессии гена ERF1 у мутантов tdr/pxy свидетельствует о возможном антагонистическом взаимодействии TDR/PXY-зависимого и этилен-зависимого путей регуляции активности камбия [45].
Стриголактоны стимулируют активность камбия и вторичный рост: мутанты арабидопсис more axillary branches (max), имеющие нарушения в биосинтезе или пути передачи сигнала стриголактонов, характеризуются снижением вторичного роста стебля и корня [46]. Гены семейства SUPPRESSOR OF MAX 2 (SMAX2)-LIKE (SMXL3, SMXL4 и SMXL5) кодируют репрессоры передачи сигнала стриголактонов, а также являются важными регуляторами образования флоэмы: у двойных и тройных мутантов по этим генам нарушено образование ситовидных элементов и снижен уровень экспрессии генов, отвечающих за спецификацию флоэмы [47].
Брассиностероиды позитивно регулируют дифференцировку ксилемы: количество сосудов зависит от уровня биосинтеза этих гормонов [48], а мутации по генам, кодирующим брассиностероид-зависимые ТФ BRASSINAZOLE-RESISTANT1 (BZR1) и BRI1-EMS-SUPPRESSOR 1 (BES1), снижают количество клеток камбия и ксилемы в проводящих пучках [49]. Особое место в брассиностероид-зависимой регуляции активности камбия занимают белки семейства Glycogen Synthase Kinase 3 (GSK3) – BRASSINOSTEROID INSENSITIVE 2 (BIN2), BIN2-LIKE1 (BIL1) и BIL2. Они являются негативными регуляторами передачи сигнала брассиностероидов, осуществляя ингибирующее фосфорилирование ТФ BZR1 и BES1, кроме того, они взаимодействуют с белком TDR/PXY – рецептором CLE-пептидов TDIF и компонентом CLAVATA-подобной системы, играющей центральную роль в балансе камбия и ксилемы [49] (см. ниже). Кроме того, GSK3 могут регулировать ответ на ИУК: фосфорилировать ИУК-зависимые ТФ ARF, высвобождая их из комплексов с транскрипционными репрессорами. Так, мишенью киназы BIL1 является ТФ МР – ключевой регулятор дифференцировки ксилемы [51].
К числу важнейших регуляторов активности камбия и развития проводящей системы растений относятся гормоны пептидной природы CLE (CLAVATA3/EMBRYO SURROUNDING REGION-RELATED). Среди них основную роль в процессах вторичного роста играют CLE-пептиды группы В, также называемые TRACHEARY ELEMENT DIFFERENTIATION INHIBITORY FACTOR (TDIF) [52]. У арабидопсис к этой группе относятся пептиды CLE41/44 и CLE42, которые синтезируются во флоэме и поступают в камбий, где, взаимодействуя с рецептором TDR/PXY (TDIF RECEPTOR/PHLOEM INTERCALATED WITH XYLEM), регулируют экспрессию гена WOX4 [53]. Таким образом, активность камбия регулируется c участием одной из систем “WOX-CLAVATA”, включающей в себя пептиды CLE, их рецептор и мишень – ТФ WOX; подобные системы, согласно многочисленным данным, являются консервативными регуляторными модулями, действующими в разных типах меристем [54]. Пептиды TDIF в камбии выполняют две функции – контроль асимметричных делений клеток камбия и подавление дифференцировки клеток камбия в сосуды: обработка растений экзогенными TDIF или сверхэкспрессия их генов приводит к усилению пролиферации клеток камбия, а также к нарушению развития сосудов при нормальном строении флоэмы. Для обеспечения правильной ориентации деления клеток камбия важен градиент концентрации пептидов TDIF, который в норме создается при поступлении TDIF из флоэмы; изменение этого градиента (например, при сверхэкспрессии гена CLE41) приводит к изменению ориентации клеточных делений и нарушению упорядоченной структуры стелы (“перемешиванию” зон ксилемы, флоэмы и камбия, изменению направления роста проводящих элементов). TDIF-зависимый контроль направления клеточных делений в камбии зависит от наличия функционально активного рецептора TDR/PXY (мутант tdr/pxy также характеризуется перекрыванием ксилемы и флоэмы), но не зависит от активности ТФ WOX4 [55]. Регуляция дифференцировки камбиальных клеток в клетки ксилемы происходит благодаря взаимодействию рецептора TDR/PXY с белками семейства GSK3, участвующими в передаче сигнала брассиностероидов (см. выше). При связывании пептидов TDIF с рецептором TDR/PXY происходит диссоциация комплекса TDR/PXY с GSK3, что приводит к инактивации GSK3–следствием этого является подавление дифференцировки ксилемы [49].
Антагонистом регуляторного модуля TDIF-TDR, по-видимому, является близкая к TDR/PXY рецепторная киназа MORE LATERAL GROWTH 1 (MOL1), потеря функции ее у мутантов вызывает интенсификацию процессов вторичного роста. По-видимому, MOL1 негативно регулирует пролиферацию клеток камбия независимо от TDR/PXY. Еще одна рецепторная киназа, играющая роль в регуляции активности камбия –REDUCED LATERAL GROWTH 1 (RUL1): поскольку мутанты с потерей ее функции имеют сниженную активность камбия, предполагается, что RUL1 – еще один активатор пролиферации камбия. Лиганды и мишени этих рецепторных киназ неизвестны [56].
Помимо TDIF, в регуляции развития проводящей системы растений могут участвовать и другие пептиды CLE. Например, в развитии флоэмы в корне арабидопсис участвуют пептиды CLE25 и CLE45, связывающиеся с разными рецепторными комплексами [57]. Пептид CLE10 негативно регулирует развитие сосудов, благодаря ингибированию экспрессии генов ARR типа А, ARR5 и ARR6, кодирующих репрессоры передачи сигнала ЦК [58]. Пептид CLE19, напротив, считается активатором развития ксилемы: сверхэкспрессия гена CLE19 приводит к образованию ксилемных “островков”, не связанных с проводящей системой растения, в органах цветка арабидопсис и капусты [59], а также повышает количество элементов ксилемы – сосудов и одревесневшей ксилемной паренхимы – в запасающем корне редиса [60].
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ЗАПАСАНИЯ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ В КОРНЕ
Запасающие корни выполняют функцию накопления углеводов (в основном в виде крахмала) как источников питания для многолетних или двулетних видов растений. Генетический контроль отложения запасающих веществ в корне является сложным, многогранным и не полностью изученным процессом. На основании полученных в последние годы данных [11, 13, 61] можно сказать, что ведущими “трендами” в развитии запасающего корня у разных видов растений является, во-первых, увеличение содержания крахмала и сахаров и, во-вторых, снижение уровня биосинтеза лигнина в корне.
Крахмал, представляющий собой смесь полимеров альфа-глюкозы – линейного (амилозы) и разветвленного (амилопектина), является основной формой углеводов, откладывающейся в запасающих корнях: например, в корнеплоде кассавы массовая доля крахмала составляет 70–80% [62]. В запасающих тканях растений крахмал образует гранулы разной формы и размеров (диаметром 0.1–200 мкм), имеющие полукристаллическую структуру. Основное место синтеза и накопления крахмала в корне – пластиды (амилопласты). Углеводы, служащие сырьем для его синтеза, поступают в корень из надземной части растения по флоэме в виде сахарозы и затем распределяются в тканях корня как по плазмодесмам, так и при помощи мембранных транспортеров [63]. В дальнейшем поступившая в корень сахароза расщепляется до гексоз, которые могут использоваться для биосинтеза крахмала или снова превращаться в сахарозу и накапливаться в вакуолях (например, в корне сахарной свеклы). Синтез крахмала катализируют несколько групп ферментов, которые высоко консервативны у разных видов растений [64]. На первом этапе осуществляется фосфорилирование aльфа-глюкозы с образованием аденозиндифосфат глюкозы (АДФ-глюкозы) под действием фермента АДФГ-пирофосфорилазы. Затем с участием АДФ-глюкозы под действием фермента глюкозилтрансферазы синтезируется олигосахарид, состоящий из 2–4 остатков глюкозы, который далее служит акцептором для присоединения глюкозных остатков от АДФ-глюкозы при синтезе полимера. Образование неразветвленных цепочек амилозы катализируют ферменты группы АДФГ-крахмалглюкозилтрансфераз: с помощью этого фермента остаток глюкозы от АДФ-глюкозы переносится на четвертый атом углерода молекулы глюкозы в составе первичного акцептора, в результате чего образуется альфа-1,4 связь и глюкозная цепь удлиняется на один остаток. В англоязычной литературе эти ферменты также называют крахмал-синтазами (Starch Synthase, SS). Синтез разветвленных молекул амилопектина осуществляется с участием ферментов, принадлежащих к семейству глюкозид-гидролаз: они расщепляют альфа-1,4-глюкановые цепочки и переносят их на ОН-группу шестого углеродного атома одного из глюкозных остатков другой цепи, образуя альфа-1,6 связи. В англоязычной литературе ферменты, участвующие в разветвлении крахмала, называют “ферменты ветвления” (Branching Enzymes, BE). Наряду с ВЕ, выделяют также Debranching Еnzymes (DBE) – изоамилазы и декстриназы, которые гидролизуют α-1,6-связи и высвобождают линейные цепочки.
Накопление соответствующих ферментов или активация экспрессии генов, их кодирующих, были выявлены в протеомных и транскриптомных исследованиях запасающих корней у разных видов культурных растений [11, 13, 61]. В то же время, корни близких видов растений, не образующих корнеплодов или корнеклубней, содержат мало паренхимных клеток и накапливают мало крахмала [11], а также характеризуются низким уровнем экспрессии генов, отвечающих за биосинтез крахмала [13].
Виды семейства сложноцветных в качестве основного резервного вещества также откладывают фруктаны – полимеры фруктозы: например, у топинамбура фруктаны составляют до 80% массы клубня. Обычно в запасающих органах сложноцветных накапливаются фруктаны инулинового типа, которые состоят из множества связанных молекул β-D-фруктозы и одной молекулы α-D-глюкозы. Синтез инулиновых фруктанов проходит в два этапа. На первом этапе, который катализируется ферментом сахароза-сахароза-фруктозилтрансферазой (SST), из двух молекул сахарозы образуются глюкоза и трисахарид 1-кестоза; при этом сахароза является и донором, и акцептором фруктозильных остатков. Далее происходит полимеризация фруктана под действием фермента фруктан-фруктан-фруктозилтрансферазы (FFT), который переносит новые фруктозильные единицы на акцепторную молекулу фруктана [65].
Интересным исключением среди растений с запасающим корнем является сахарная свекла (Beta vulgaris), которая накапливает сахарозу вместо полисахаридов. Примечательно, что такая особенность выявлена не только у культурных форм свеклы, но и у их дикого предка – свеклы морской (B. vulgaris ssp. maritima): предполагается, что эта стратегия появилась у нее как результат адаптации к условиям засоления. При этом гены, кодирующие ферменты биосинтеза крахмала, присутствуют в геноме сахарной свеклы и экспрессируются на высоком уровне при образовании корнеплода. Предположение о повышенной активности амилаз, расщепляющих крахмал, в корнеплоде свеклы не подтвердилось – то есть способность сахарной свеклы к аккумуляции в корне сахарозы вместо крахмала до настоящего времени является загадкой [66].
Лигнин, представляющий собой смесь ароматических полимеров – производных фенилпропана, входит в состав одревесневших клеточных стенок растительных клеток (в особенности – стенок проводящих элементов). Биосинтез лигнина – сложный процесс, который включает в себя биосинтез мономеров лигнина и их полимеризацию. Роль в регуляции содержания лигнина в клетке играют как ферменты, катализирующие биосинтез монолигнолов, так и ферменты лакказы, катализирующие синтез полимеров лигнина [67]. Одной из особенностей запасающих корней является снижение накопления лигнина по сравнению с незапасающими [13, 68]. Отчасти это связано с особенностями анатомии запасающих корней, а именно – с образованием большого количества запасающей паренхимы со слабо лигнифицированными клеточными стенками. С другой стороны, по крайней мере, у батата установлена взаимосвязь между метаболизмом фенилпропаноидов и крахмала в процессе развития запасающего корня: у трансгенных растений с повышенным уровнем биосинтеза лигнина наблюдалось снижение количества сахарозы и гексоз в листьях и, соответственно, уровня крахмала в корне, а также существенно снижалось утолщение запасающих корней. У этих растений также был выявлен высокий уровень деградации крахмала как в листьях, так и в корне, что позволяет предположить перераспределение фотоассимилятов в сторону накопления лигнина [13].
РОЛЬ КОММУНИКАЦИИ НАДЗЕМНОЙ И ПОДЗЕМНОЙ ЧАСТЕЙ РАСТЕНИЯ В РАЗВИТИИ ЗАПАСАЮЩЕГО КОРНЯ
Развитие запасающего корня, очевидно, зависит от надземной части, которая является источником метаболитов и регуляторов роста. Во-первых, фотосинтезирующие листья поставляют углеводы для построения тканей корня, но не стоит забывать и о том, что, помимо построения клеточных стенок и запасания в виде крахмала, сахара, поступающие в корень из надземной части растения, также могут выполнять функцию сигнальных молекул и регуляторов роста. Так, известно, что от уровня сахарозы зависит уровень экспрессии генов CYCD, определяющих переход клетки к делению [69]. Удлинение и вторичный рост корней разных видов растений зависит от уровня сахарозы, транспортируемой из листьев: на проростках арабидопсис было показано, что поступающая из семядолей сахароза является необходимым и достаточным сигналом, регулирующим рост корня независимо от фитогормонов [70]. Из надземной части в корень поступают также гормоны, регулирующие его развитие, в первую очередь – ИУК, а также и другие сигналы “дальнего действия”, например, белки и РНК, определяющие модификацию программы развития корня по типу запасающего органа.
К регуляторным пептидам, которые транспортируются из листьев в нижележащие органы растений, относятся продукты генов семейства FLOWERING LOCUS T (FT). У арабидопсис короткий белок FT выполняет функцию флоригена – мобильного сигнала в фотопериодическом контроле цветения, который синтезируется в листьях и транспортируется в апикальную меристему побега [71]. В дальнейшем была выявлена роль FT-подобных белков в развитии запасающих органов: впервые это их свойство было продемонстрировано на примере клубня картофеля, формирование которого связано с интенсивным вторичным ростом и зависит от длины дня [72]. Участие белков семейства FT в развитии луковиц у лилейных [73, 74] позволяет предположить их роль как универсальных регуляторов развития запасающих органов растений. У сахарной свеклы [75] и кассавы [76] выявлены по два белка FT, регулирующих переход к цветению, но их функции в развитии запасающих корней не изучены. Возможно, белки FT могут регулировать формирование запасающего корня: по крайней мере, для ряда растений показана зависимость утолщения корня от длины дня [77].
По флоэме осуществляется также базипетальный транспорт определенных мРНК и малых РНК, в том числе принимающих участие в регуляции вторичного роста. К таким регуляторам относятся, в частности, мРНК, кодирующие гомеодомен-содержащие ТФ семейства BEL. Известно, что эти ТФ могут образовывать гетеродимеры с ТФ KNOX, регулируя развитие листьев и других органов растений [78]. У картофеля при выращивании в условиях короткого дня имеет место перемещение ТФ StBEL5, StBEL11 и StBEL29 по флоэме из листьев в столоны, при этом StBEL5 взаимодействует в столоне с ТФ POTATO HOMEOBOX 1 (POTH1) из семейства KNOX [79]. Cверхэспрессия StBEL5 у картофеля приводит к активации генов метаболизма ИУК (YUCCA) и ЦК (IPT, LOG), что позволяет предположить роль ТФ StBEL5 в регуляции их экспрессии при развитии клубня [80]. Ортологи StBEL5 и POTH1 выявлены у кассавы, батата, редиса, моркови и свеклы. Предполагается, что они могут быть регуляторами вторичного роста корня и стимулировать формирование корнеплода через регуляцию фитогормонального баланса: по крайней мере, у свеклы в промоторных областях генов YUCCA, IPT, ARF8 и GA20Ox выявлены консервативные мотивы для связывания димеров BEL5-POTH1 [15, 81]. Известно, что в стабилизации мРНК при их транспорте по флоэме участвуют белки-шапероны консервативного для растений и животных семейства PTB (Рolypyrimidine Тract binding Рrotein): у картофеля в транспорте мРНК BEL5 принимают участие белки StPTB1 и StPTB6; их ортологи выявлены у многих корнеплодных растений [81].
Помимо мРНК, в развитии запасающих органов растений также участвуют малые РНК, транспортируемые по флоэме, в частности miR156 и miR172, играющие противоположные роли в контроле перехода от ювенильной к взрослой фазе развития растений: была выявлена их роль в развитии клубней картофеля, и их ортологи выявлены у других корнеплодных растений [15].
Таким образом, данные о сигналах, поступающих из стебля и регулирующих развитие запасающих органов растений, получены главным образом на клубнях картофеля, тогда как у корнеплодных растений их изучение находится на начальном этапе. Вероятно, данные о таких сигналах в развитии запасающего корня будут получены в ближайшее время.
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ РАЗВИТИЯ ЗАПАСАЮЩЕГО КОРНЯ У РАЗНЫХ ВИДОВ РАСТЕНИЙ
К настоящему времени на разных видах растений были получены данные о генетическом контроле развития запасающего корня: в частности, проведены широкомасштабные транскриптомные исследования, выявившие основные гены, экспрессия которых значительно повышается или снижается в запасающих корнях.
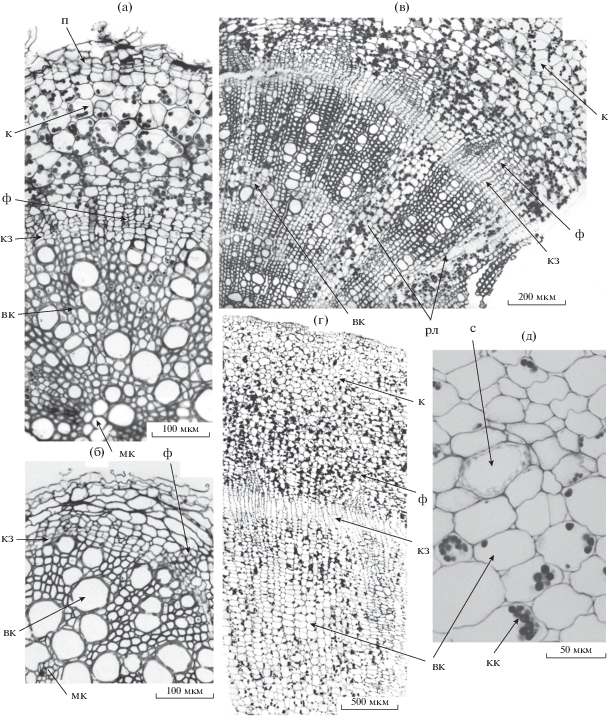
Виды семейства Brassicacea – редис (Raphanus sativus) и репа (Brassica rapa) формируют монокамбиальный корнеплод ксилемного типа. Согласно анатомическим исследованиям, большая часть их корнеплода занята клетками вторичной ксилемы, среди которых преобладают тонкостенные паренхимные клетки, в них происходит отложение и хранение запасных веществ. Накопление крахмала в корнеплодах капустных также происходит в широких паренхимных лучах, разделяющих тяжи из сосудов и мелких паренхимных клеток. Именно сильное развитие ксилемной паренхимы отличает культурные виды капустных от дикорастущих и зависит от активности камбия (рис. 2) [5].
Рис. 2.
Фрагменты поперечных срезов корней двух форм Brassica napus, брюквы (B. napus subsp. rapifera) и рапса (B. napus L.), различающихся по способности к развитию запасающей паренхимы: а, в–д – срезы запасающих корней брюквы возрастом 20 (а), 40 (в) и 60 (г, д) дней; б – поперечный срез незапасающего корня рапса, возраст растения 20 дней. п – перидерма, к – кора, ф – вторичная флоэма, кз – камбиальная зона, вк – вторичная ксилема, мк – метаксилема, рл – радиальные лучи, с – сосуд, кк – крахмальные зерна в амилопластах запасающей паренхимы.
В результате транскриптомного анализа разных стадий развития корнеплода редиса (R. sativus) [82–84], были выделены несколько групп транскриптов, уровни которых наиболее существенно возрастают в процессе роста и развития корнеплода. Среди них наиболее широко представлены гены, регулирующие деление (некоторые гены циклинов и циклин-зависимых киназ) и растяжение клеток (гены, кодирующие ферменты дестабилизации клеточной стенки – экспансины и ксилоглюкан-эндотрансгликозилазы) [84], регуляторы различных метаболических путей и сигналинга (например, гены, кодирующие ТФ разных семейств и компоненты МАР-киназного каскада), а также гены-регуляторы биосинтеза и метаболизма крахмала и сахарозы и биосинтеза вторичных метаболитов [82, 84]. Также при развитии корнеплода редиса было отмечено повышение уровней экспрессии некоторых генов, регулирующих метаболизм и/или передачу сигнала фитогормонов – ИУК (гены GH3, регулирующие синтез коньюгатов ИУК, гены транскрипционных репрессоров AUX/IAA и малых ауксин-регулируемых РНК SAUR), ЦК (гены ARR А-типа), этилена (гены, кодирующие ТФ ERF) и АБК (гены, кодирующие рецептор PYR1 и протеинфосфатазу PP2C58, участвующую в передаче сигнала АБК) [84].
С помощью транскриптомного анализа также было показано, что при росте корнеплода редиса имеет место накопление большого количества разнообразных микроРНК – среди них представлены как ранее не идентифицированные микроРНК, так и те, мишенями которых являются выявленные регуляторы вторичного роста корня, такие, как гены экспансинов и гены, кодирующие ТФ семейств NF-YA и bHLH [83].
Два кандидата на роль регуляторов развития корнеплодов были выявлены среди многочисленных генов СLE редиса – это СLE41, гомологи которого у арабидопсис и других растений выполняют функции регулятора деления клеток камбия и репрессора дифференцировки ксилемы [52, 53] и CLE19, для которого предполагается роль как стимулятора дифференцировки сосудов [59]: для этих генов было показано многократное возрастание уровней экспрессии при росте корнеплода редиса и локализация экспрессии в строго определенных тканях корнеплода (CLE41 во флоэме и камбии, CLE19 в ксилеме). В опытах по сверхэкспрессии CLE41 и CLE19 у редиса посевного R. sativus и его дикого предка R. raphanistrum было показано, что CLE41 вызывает разрастание проводящих пучков, увеличение количества клеток камбия и тонкостенной ксилемной паренхимы, тогда как CLE19 повышает количество одревесневающих элементов ксилемы, в особенности толстостенной паренхимы с механическими функциями [60, 85].
У репы (B. rapa) (рис. 2) с помощью методов маркер-опосредованной селекции были выявлены локусы количественных признаков, ассоциированные с признаками “увеличенный диаметр корня”, “увеличенная длина корня”, “увеличенная масса корня”. Транскриптомный анализ трех стадий развития корнеплода репы, как и в случае редиса, выявил повышение экспрессии ряда генов, кодирующих экспансины, а также генов, вовлеченных в метаболизм сахарозы и крахмала – таких, как ген SuSy, продуктом которого является сахарозосинтаза. Также при росте корнеплода репы было показано повышение экспрессии ряда генов, кодирующих ТФ разных групп. Среди них регуляторы активности камбия (HB8) и дифференцировки коры и эндодермы (SCARECROW), а также 4 гена, кодирующие ТФ семейства MADS. Также в растущем корнеплоде репы было выявлено повышение уровня некоторых микроРНК, таких, как miR156a, miR172a и miR157, функции которых предположительно связаны с развитием ксилемы [86].
Hearn с соавт. [6] провели сравнительный транскриптомный анализ гипокотилей и корней у форм Brassica, различающихся по способности к запасанию: пекинской капусты и кале, не формирующих запасающего корня и стебля, репы, формирующей корнеплод, и кольраби, формирующей запасающий стебель. В результате были выявлены дифференциально экспрессирующиеся гены, предположительно участвующие в развитии запасающих органов. Среди генов, повышающих уровни экспрессии в запасающих корне и стебле, следует отметить гены-регуляторы развития камбия (HB8 и REVOLUTA из семейства HD‑Z-IP III; компоненты систем WOX-CLAVATA – ген ТФ WOX4, камбий-специфичные рецепторы пептидов CLE PXY/TDR, RUL1 и MOL1, а также рецептор CLV1, действующий в апикальных меристемах), гены, кодирующие ТФ других семейств (например, регулятора эндодермы SCARECROW), гены экспансинов; у кольраби также показана активация экспрессии генов ARF5 и ARF17, кодирующих ИУК-зависимые ТФ.
Транскриптомный анализ трех стадий развития запасающего корня был проведен также для южноамериканской корнеплодной культуры из семейства капустных под названием мака перуанская (она же клоповник Мейена, Lepidium meyenii). Среди генов, экспрессия которых повышается в растущем корнеплоде маки, наиболее широко были представлены гены, участвующие в метаболизме сахарозы и крахмала, а также гены гормонального сигналинга и регуляторы биосинтеза вторичных метаболитов [87].
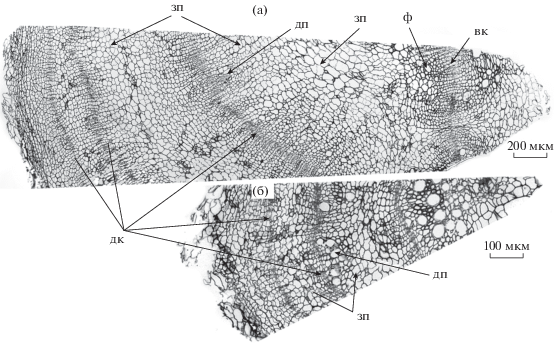
Свекла (Beta vulgaris) формирует поликамбиальный корнеплод, в развитии которого центральное место занимает аномальный вторичный рост – закладка дополнительных колец камбия к периферии от центрального цилиндра (рис. 3). Накопление сахарозы – основного запасаемого вещества в корнеплоде свеклы – имеет место главным образом в паренхимных клетках, возникающих при делении дополнительных колец камбия. Именно в этих клетках имеет место экспрессия генов сахарозосинтазы, причем внутри паренхимных клеток сахарозосинтаза локализуется вблизи тонопласта, что, вероятно, имеет значение для запасания сахарозы внутри вакуолей [88].
Рис. 3.
Фрагменты поперечных срезов корнеплодов двух форм Beta vulgaris, сахарной свеклы B. vulgaris subsp. vulgaris var. altissima (а) и мангольда B. vulgaris subsp. vulgaris var. cicla (б), демонстрирующих разную степень развития запасающей паренхимы (возраст растений 60 дней): дк – добавочный камбий, дп – добавочный проводящий пучок, зп – запасающая паренхима (вторичная межпучковая ткань), вк – вторичная ксилема, ф – вторичная флоэма.
Zhang с соавт. [89] провели транскриптомный анализ запасающего корня свеклы на пяти стадиях: начальная стадия роста, стадия перехода к быстрому росту, стадия быстрого роста, стадия перехода к накоплению сахарозы и стадия замедленного роста с активным накоплением сахарозы. Наибольшее количество дифференциально экспрессирующихся генов было выявлено на второй и третьей стадиях. Так, при росте запасающего корня свеклы был выявлен повышенный уровень экспрессии гена CYCD3, а также генов пектиназ, бета-глюкозидаз, динеинов и кинезинов, которые вероятно, участвуют в процессах деления клеток и растяжения клеточных стенок при росте корнеплода. Транскриптомный анализ корнеплода свеклы также выявил повышение уровней экспрессии большого количества генов, задействованных в регуляции биосинтеза и метаболизма фитогормонов – брассиностероидов (2 из 4 генов стероидгидролаз CYP90B1), ИУК (5 из 16 генов семейства YUCCA и 4 из 5 генов GH3), ЦК (5 из 13 генов IPT), гиббереллинов (6 из 13 генов GA3-ox и 5 из 11 генов GA20-ox) – при росте запасающего корня. Гены, регулирующие передачу сигнала этих гормонов, также повышают уровни экспрессии при развитии корнеплода свеклы: это гены, задействованные в передаче сигнала брассиностероидов (2 из 5 генов BZR), ИУК (7 из 17 генов ARF и 7 из 16 генов AUX/IAA;17 из 38 генов SAUR), ЦК (20 из 38 генов ARR В-типа и 6 из 9 генов ARR А-типа). Повышение уровней экспрессии при росте корнеплода отмечено для генов SS (Sucrose Synthase), SPS (Sucrose Phosphate Synthase) и SI (Sucrose Invertase), продуктами которых являются ферменты метаболизма сахарозы, а также генов, кодирующих ТФ разных семейств, в частности обширного семейства WRKY, представители которого у растений задействованы в разнообразных процессах – от эмбриогенеза и развития корня до ответа на стресс [89].
Морковь (Daucus carota subsp. sativus L.) формирует корнеплод флоэмного типа. Основным отличием корня культурной моркови от корня ее дикого предка (D. carota subsp. commutatus) является снижение содержания лигнина, значительное увеличение содержания флоэмной паренхимы, запасающей сахара, накопление каротиноидов, а также сниженное количество боковых корней [90, 91]. Сравнительный транскриптомный анализ разных стадий развития корня у дикой и посевной моркови выявил в зрелом корне последней изменение уровней экспрессии большого количества генов. Так, наиболее значимое повышение уровней экспрессии было показано для генов, участвующих в регуляции пост-трансляционных модификаций белков (в частности, убиквитинирования), а наибольшее снижение экспрессии – для генов, регулирующих редокс-сигналинг. Среди генов, потенциально имеющих отношение к развитию запасающего корня, у посевной моркови было выявлено повышение уровней экспрессии ряда генов-регуляторов клеточного цикла, развития проводящей системы и метаболизма сахаров и каротиноидов, а также генов, кодирующих ТФ разных семейств [91, 92], в то же время, наблюдалось снижение уровней экспрессии генов, действующих в пути биосинтеза лигнина [90].
В ксилемной паренхиме растущего корнеплода другого вида семейства зонтичных – пастернака (Pastinaca sativa), было выявлено накопление крахмала и активация экспрессии генов его биосинтеза: APS (ADP-glucose Pyrophosphorylase Small Subunit), APL (ADP-glucose Pyrophosphorylase Large Subunit), SS (Soluble Starch Synthase), GBSS (Granule Bound Starch Synthase), SBE (Starch Branching Enzyme), ISA (Isoamylase) и т.д. [66].
Запасающие корни батата (Ipomoea batatas) относятся к типу корнеклубней, где интенсивный вторичный рост и накопление крахмала происходят в боковых и придаточных корнях мочковатой корневой системы. Морфологически процесс развития корня батата включает в себя три стадии: образование волокнистых корней (fibrous root) диаметром до 2 мм, стадию молодых запасающих корней диаметром 2–5 мм и стадию зрелых запасающих корней диаметром более 5 мм. При инициации запасающих корней батата имеет место активная пролиферация клеток камбия и формирование обширной зоны ксилемы, а также аномальный вторичный рост, связанный с заложением дополнительного камбия вокруг отдельных сосудов или их групп [61, 93]. Развитие запасающих, но не волокнистых корней батата связано с запасанием большого количества крахмала, тогда как лигнификация проводящих элементов наблюдается преимущественно на стадии волокнистых корней, но препятствует росту корнеклубней батата на более поздних стадиях [93]. Изучение молекулярных механизмов развития корнеклубней батата начато довольно давно: в 2003 г. You с соавт. [94] получили библиотеку кДНК молодых запасающих корней, в которой среди дифференциально экспрессирующихся были выявлены гены, кодирующие ТФ с MADS-боксом и ТФ семейства NAС. Сравнение библиотек кДНК волокнистых и запасающих корней, проведенное Tanaka с соавт. [95], также выявило в запасающем корне повышенную экспрессию гена IBKN1 семейства KNOX1 и гена, кодирующего рецептор-подобную киназу.
В дальнейшем секвенирование транскриптомов разных стадий развития корней батата с помощью технологий NGS позволило выявить много потенциальных регуляторов этого процесса. Так, Firon с соавт. [61] при сравнении транскриптомных профилей волокнистых и молодых запасающих корней батата выявили в последних повышение экспрессии генов, участвующих в накоплении крахмала и углеводном метаболизме, а также генов, задействованных в контроле деления клеток и поддержания меристем (гены, кодирующие ТФ KNOX классов I и II, циклины классов А и D, гены циклин-зависимой киназы А и ее активаторов).
Ponniah с соавт. [96] провели сравнение транскриптомов растущих корней Ipomoea batatas и его дикого предка Ipomoea trifida. Среди генов, экспрессия которых повышается при развитии корня только у культурного батата, были отмечены гены метаболизма крахмала, а также ген ионного транспортера KEA5 (K+efflux antiporter), и ген рецепторной киназы ERECTA, участвующей в сигналинге фитогормонов и регуляции развития камбия. В то же время, в корне I. trifida отмечено усиление экспрессии генов биосинтеза лигнина.
Eserman с соавт. [11] провели сравнительный транскриптомный анализ разных стадий развития корней у четырех видов семейства вьюнковых, относящихся к трибам Ipomoeeae и Merremieae и различающихся по способности к формированию запасающего корня. Основные отличия видов с запасающим корнем заключались в повышении уровней экспрессии генов, регулирующих метаболизм сахарозы и синтез крахмала, а также некоторых генов, кодирующих ТФ (например, ортологов WOX4).
Кассава (Manihot esculenta) имеет мочковатую корневую систему, состоящую из корней двух типов – волокнистых и запасающих, которые различаются по составу ксилемы: в волокнистых корнях она, помимо сосудов, содержит много ксилемных волокон, тогда как у запасающих большую часть ксилемы занимают тонкостенные паренхимные клетки, накапливающие крахмал. Было показано, что в волокнистых корнях кассавы по сравнению с запасающими корнями значительно повышены уровни экспрессии некоторых генов группы VND [97]. В то же время, при росте запасающего корня имеет место повышение уровня ЦК, а также активация экспрессии генов KNOX класса I и гена MADS MeAGL20 [98].
Итак, транскриптомный анализ запасающих корней у разных видов растений позволил выявить ряд сходных черт, таких, как активация экспрессии генов клеточного цикла и генов, регулирующих растяжение клеток, меристем-специфичных генов (в том числе генов, кодирующих компоненты систем WOX-CLAVATA), генов, участвующих в биосинтезе, метаболизме и передаче сигнала различных фитогормонов, а также генов различных ТФ – например, MADS и WRKY. Эти данные позволяют предположить существование общих механизмов развития запасающих корней у растений.
ЗАКЛЮЧЕНИЕ
В связи с широким распространением и большим значением корнеплодных культур, развитие запасающего корня – один из наиболее важных экономически значимых признаков сельскохозяйственных растений. Способность к формированию запасающего корня возникла в эволюции некоторых двулетних и многолетних растений как механизм адаптации к переживанию длительных неблагоприятных условий, и была использована и закреплена человеком при доместикации [6, 11]. Запасающий корень – комплексный признак, который включает в себя как минимум две составляющих: контроль разрастания корня в радиальном направлении (вторичный рост) и накопление сахаров (крахмала, фруктанов, сахарозы). В последние годы с привлечением транскриптомных, протеомных и метаболомных исследований были получены данные о генетическом контроле этих процессов у многих видов сельскохозяйственных растений с запасающими корнями [82–98]. Вместе с тем, для большого количества видов сельскохозяйственных корнеплодных культур исследования генетического контроля развития запасающего корня не проводились или находятся на самом начальном этапе [99, 100]. Интересно, что в сравнительных исследованиях транскриптомов культурных растений с корнеплодами и их бескорнеплодных диких предков был получен ряд данных, свидетельствующих о существовании консервативных механизмов регуляции развития запасающих корней у разных видов [6, 11, 92], которые, по-видимому, были многократно “использованы” в эволюции при независимом возникновении способности к формированию запасающих корней в разных семействах.
Пожалуй, одной из наиболее перспективных (и наименее изученных на генетическом уровне) тем исследований в этом направлении является зависимость развития запасающих корней от факторов окружающей среды (длины дня, доступности воды, уровня азотного питания), а также от сигналов, поступающих из надземной части растений. В настоящее время роль средовых факторов и коммуникации разных частей растения в функции запасания были изучены на молекулярно-генетическом уровне на примере развития клубней картофеля; впрочем, исследования, проведенные в последние годы на запасающих органах разных видов растений, позволили выявить ряд аналогичных механизмов, действующих и в запасающем корне [15]. Таким образом, дальнейшее изучение механизмов развития запасающих корней является перспективным направлением генетики развития растений, которое открывает новые возможности для научно обоснованной селекции корнеплодных форм.
Работа выполнена при поддержке грантов Российского фонда фундаментальных исследований 18-04-01017 и Российского научного фонда 16-16-10011.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Chapin F.S., Schulz E.D., Mooney H.A. The ecology and economics of storage in plants // Annu. Rev. Ecol. Syst. 1990. V. 21. P. 423.
Ferraro V., Piccirillo C., Tomlins K., Pintado M.E. Cassava (Manihot esculenta Crantz) and yam (Dioscorea spp.) crops and their derived foodstuffs: safety, security and nutritional value // Crit. Rev. Food. Sci. Nutr. 2016. V. 56. P. 2714.
Draycott A.P. Sugar Beet. Suffolk: Blackwell Publ., 2006.
Фёдоров А.А., Кирпичников М.Э., Артюшенко З.Т. Атлас по описательной морфологии высших растений: Стебель и корень. Москва: Изд-во АН СССР. 1962. 352 с.
Zaki H.E.M., Takahata Y., Yokoi S. Analysis of the morphological and anatomical characteristics of roots in three radish (Raphanus sativus L.) cultivars that differ in root shape // J. Hortic. Sci. Biotechnol. 2012. V. 87. P.172.
Hearn D.J., O’Brien P., Poulsen T.M. Comparative transcriptomics reveals shared gene expression changes during independent evolutionary origins of stem and hypocotyl/root tubers in Brassica (Brassicaceae) // PLoS One. 2018. V.13(6): e0197166.
Noh S.A., Lee H.-S., Huh E.J., Huh G.H., Paek K.-H., Shin J.S., Bae J.M. SRD1 is involved in the auxin-mediated initial thickening growth of storage root by enhancing proliferation of metaxylem and cambium cells in sweet potato (Ipomoea batatas) // J. Exp. Bot. 2010. V. 61. P. 1337.
Chaweewan Y., Taylor N. Anatomical assessment of root formation and tuberization in cassava (Manihot esculenta Crantz) // Trop. Plant Biol. 2015. V. 8 (1). P. 1.
Siebers T., Catarino B., Agusti J. Identification and expression analyses of new potential regulators of xylem development and cambium activity in cassava (Manihot esculenta) // Planta. 2017. V. 245(3). P. 539.
Appezzato-da-Glória B., Cury G., Soares M.K.M., Rocha R., Hayash A.H. Underground systems of Asteraceae species from the Brazilian cerrado // J. Torrey Bot. Soc. 2008. V. 135. P. 103.
Eserman L.A., Jarret R.L., Leebens-Mack J.H. Parallel evolution of storage roots in morning glories (Convolvulaceae) // BMC Plant Biol. 2018. V. 18(1):95.
Cheng F., Wu J., Cai C., Fu L., Liang J., Borm T., Zhuang M., Zhang Y., Zhang F., Bonnema G., Wang X. Genome resequencing and comparative variome analysis in Brassica rapa and Brassica oleracea collection // Sci. Data. 2016. V. 20. 3:160119.
Wang H., Yang J., Zhang M., Fan W., Firon N., Pattanaik S., Yuan L., Zhang P. Altered phenylpropanoid metabolism in the maize Lc-expressed sweet potato (Ipomoea batatas) affects storage root development // Sci. Rep. 2016. V. 6: 18645.
Navarro C., Cruz-Oró E., Prat S. Conserved function of FLOWERING LOCUS T (FT) homologues as signals for storage organ differentiation // Curr. Opin. Plant Biol. 2015. V. 23. P. 45.
Natarajan B., Kondhare K.R., Hannapel D.J., Banerjee A.K. Mobile RNAs and proteins: Prospects in storage organ development of tuber and root crops // Plant Sci. 2019. V. 284. P. 73.
Ганчева М.С., Маловичко Ю.В., Полюшкевич Л.О., Додуева И.Е., Лутова Л.А. Пептидные гормоны растений // Физиология растений. 2019. Т. 66. С. 83.
Smetana O., Mäkilä R., Lyu M., Amiryousefi A., Sánchez Rodríguez F., Wu M.F., Solé-Gil A., Leal Gavarrón M., Siligato R., Miyashima S., Roszak P., Blomster T., Reed J.W., Broholm S., Mähönen A.P. High levels of auxin signalling define the stem-cell organizer of the vascular cambium // Nature. 2019. V. 565. P. 485.
Shi D., Lebovka I., López-Salmerón V., Sanchez P., Greb T. Bifacial cambium stem cells generate xylem and phloem during radial plant growth // Development. 2019. V. 146(1): dev171355.
Ji J., Strable J., Shimizu R., Koenig D., Sinha N., Scanlon M.J. WOX4 promotes procambial development // Plant Physiology. 2010. V. 152. P. 1346.
Etchells J.P., Provost C.M., Mishra L., Turner S.R. WOX4 and WOX14 act downstream of the PXY receptor kinase to regulate plant vascular proliferation independently of any role in vascular organisation // Development. 2013. V. 140. P. 2224.
Zhou Y., Liu X., Engstrom E.M., Nimchuk Z.L., Pr-uneda-Paz J.L., Tarr P.T., Yan A., Kay S.A., Meyerowitz E.M. Control of plant stem cell function by conserved interacting transcriptional regulators // Nature. 2015. V. 517. P. 377.
Woerlen N., Allam G., Popescu A., Corrigan L., Pautot V., Hepworth S.R. Repression of BLADE-ON-PETIOLE genes by KNOX homeodomain protein BREVIPEDICELLUS is essential for differentiation of secondary xylem in Arabidopsis root // Planta. 2017. V.245. P. 1079.
Baima S., Possenti M., Matteucci A., Wisman E., Altamura M.M., Ruberti I., Morelli G. The Arabidopsis ATHB-8 HD-zip protein acts as a differentiation-promoting transcription factor of the vascular meristems // Plant Physiol. 2001. V. 126. P. 643.
Miyashima S., Roszak P., Sevilem I., Toyokura K., Blob B., Heo J.O., Mellor N., Help-Rinta-Rahko H., Otero S., Smet W., Boekschoten M., Hooiveld G., Hashimoto K., Smetana O., Siligato R., et al. Mobile PEAR transcription factors integrate positional cues to prime cambial growth // Nature. 2019. V. 565. P. 490.
Randall R.S., Miyashima S., Blomster T., Zhang J., Elo A., Karlberg A., Immanen J., Nieminen K., Lee J.Y., Kakimoto T., Blajecka K., Melnyk C.W., Alcasabas A., Forzani C., Matsumoto-Kitano M., et al. AINTEGUMENTA and the D-type cyclin CYCD3;1 regulate root secondary growth and respond to cytokinins // Biol. Open. 2015. V. 4. P. 1229.
Krogan N.T., Marcos D., Weiner A.I., Berleth T. The auxin response factor MONOPTEROS controls meristem function and organogenesis in both the shoot and root through the direct regulation of PIN genes // New Phytol. 2016. V. 212. P. 42.
Brackmann K., Qi J., Gebert M., Jouannet V., Schlamp T., Grünwald K., Wallner E.S., Novikova D.D., Levitsky V.G., Agustí J., Sanchez P., Lohmann J.U., Greb T. Spatial specificity of auxin responses coordinates wood formation // Nat. Commun. 2018. V. 9. P. 875.
Ohashi-Ito K., Oguchi M., Kojima M., Sakakibara H., Fukuda H. Auxin-associated initiation of vascular cell differentiation by LONESOME HIGHWAY // Development. 2013. V. 140. P. 765.
Alvarez-Buylla E.R., García-Ponce B., Sánchez M.P., Espinosa-Soto C., García-Gómez M.L., Piñeyro-Nelson A., Garay-Arroyo A. MADS-box genes underground becoming mainstream: plant root developmental mechanisms // New Phytol. 2019. V. 223. P. 1143.
Gao H., Wang Z., Li S., Hou M., Zhou Y., Zhao Y., Li G., Zhao H., Ma H. Genome-wide survey of potato MADS-box genes reveals that StMADS1 and StMADS13 are putative downstream targets of tuberigen StSP6A // BMC Genomics. 2018. 19(1):726.
Ku A.T., Huang Y.S., Wang Y.S., Ma D., Yeh K.W. IbMADS1 (Ipomoea batatas MADS-box 1 gene) is involved in tuberous root initiation in sweet potato (Ipomoea batatas) // Annals of Botany. 2008. V. 102. P. 57.
Kubo M., Udagawa M., Nishikubo N., Horiguchi G., Yamaguchi M., Ito J., Mimura T., Fukuda H., Demura T. Transcription switches for protoxylem and metaxylem vessel formation // Genes Dev. 2005. V. 19. P. 1855.
Ohashi-Ito K., Oda Y., Fukuda H. Arabidopsis VASCULAR-RELATED NAC-DOMAIN6 directly regulates the genes that govern programmed cell death and secondary wall formation during xylem differentiation // Plant Cell. 2010. V. 22. P. 3461.
Bonke M., Thitamadee S., Mähönen A.P., Hauser M.T., Helariutta Y. APL regulates vascular tissue identity in Arabidopsis // Nature. 2003. V. 426. P. 181.
Yordanov Y.S., Regan S., Busov V. Members of the LATERAL ORGAN BOUNDARIES DOMAIN transcription factor family are involved in the regulation of secondary growth in Populus // Plant Cell. 2010. V. 22. P. 3662.
Bishopp A., Help H., El-Showk S., Weijers D., Scheres B., Friml J., Benková E., Mähönen A.P., Helariutta Y. A mutually inhibitory interaction between auxin and cytokinin specifies vascular pattern in roots // Curr. Biol. 2011. V. 21. P. 917.
Ohashi-Ito K., Saegusa M., Iwamoto K., Oda Y., Katayama H., Kojima M., Sakakibara H., Fukuda H. A bHLH complex activates vascular cell division via cytokinin action in root apical meristem // Curr. Biol. 2014. V. 24. P. 2053.
Bennett T., Hines G., van Rongen M., Waldie T., Sawchuk M.G., Scarpella E., Ljung K., Leyser O. Connective auxin transport in the shoot facilitates communication between shoot apices // PLoS Biol. 2016. V.14:e1002446.
Matsumoto-Kitano M., Kusumoto T., Tarkowski P., Kinoshita-Tsujimura K., Václavíková K., Miyawaki K., Kakimoto T. Cytokinins are central regulators of cambial activity // PNAS. 2008. V. 105. P. 20027.
Ragni L., Nieminen K., Pacheco-Villalobos D., Sibout R., Schwechheimer C., Hardtke C.S. Mobile gibberellin directly stimulates Arabidopsis hypocotyl xylem expansion // Plant Cell. 2011. V. 23. P. 1322.
Mauriat M., Moritz T. Analyses of GA20ox- and GID1-over-expressing aspen suggest that gibberellins play two distinct roles in wood formation // Plant J. 2009. V. 58. P. 989.
Jasinski S., Piazza P., Craft J., Hay A., Woolley L., Rieu I., Phillips A., Hedden P., Tsiantis M. KNOX action in Arabidopsis is mediated by coordinate regulation of cytokinin and gibberellin activities // Curr. Biol. 2005. V. 15. P. 1560.
Denis E., Kbiri N., Mary V., Claisse G., Conde E., Silva N., Kreis M., Deveaux Y. WOX14 promotes bioactive gibberellin synthesis and vascular cell differentiation in Arabidopsis // Plant J. 2017. V. 90. P. 560.
Love J., Björklund S., Vahala J., Hertzberg M., Kangasjärvii J., Sundberg B. Ethylene is an endogenous stimulator of cell division in the cambial meristem of Populus // PNAS. 2009. V. 106. P. 5984.
Etchells J.P., Provost C.M., Turner S.R. Plant vascular cell division is maintained by an interaction between PXY and ethylene signalling // PLOS Genet. 2012. V. 8:e1002997.
Agusti J., Herold S., Schwarz M., Sanchez P., Ljung K., Dun E.A., Brewer P.B., Beveridge C.A., Sieberer T., Sehr E.M., Greb T. Strigolactone signaling is required for auxin-dependent stimulation of secondary growth in plants // PNAS. 2011. V. 108. P. 20242.
Wallner E.S., López-Salmerón V., Belevich I., Poschet G., Jung I., Grünwald K., Sevilem I., Jokitalo E., Hell R., Helariutta Y., Agustí J., Lebovka I., Greb T. Strigolactone- and Karrikin-Independent SMXL Proteins Are Central Regulators of Phloem Formation // Curr. Bio-l. 2017. V. 27. P. 1241.
Yamamoto R., Fujioka S., Demura T., Takatsuto S., Yoshida S., Fukuda H. Brassinosteroid levels increase drastically prior to morphogenesis of tracheary elements // Plant Physiol. 2001. V. 125. P. 556.
Kondo Y., Ito T., Nakagami H., Hirakawa Y., Saito M., Tamaki T., Shirasu K., Fukuda H. Plant GSK3 proteins regulate xylem cell differentiation downstream of TDIF-TDR signalling // Nat. Commun. 2014. V. 24 (5):3504.
Han S., Cho H., Noh J., Qi J., Jung H.J., Nam H., Lee S., Hwang D., Greb T., Hwang I. BIL1-mediated MP phosphorylation integrates PXY and cytokinin signalling in secondary growth // Nat. Plants. 2018. V. 4. P. 605.
Sehr E.M., Agusti J., Lehner R., Farmer E.E., Schwarz M., Greb T. Analysis of secondary growth in the Arabidopsis shoot reveals a positive role of jasmonate signalling in cambium formation // Plant J. 2010. V. 63. P. 811.
Ito Y., Nakanomyo I., Motose H., Iwamoto K., Sawa S., Dohmae N., Fukuda H. Dodeca-CLE peptides as suppressors of plant stem cell differentiation // Science. 2006. V. 313. P. 842.
Hirakawa Y., Kondo Y., Fukuda H. Regulation of vascular development by CLE peptide receptor systems // J. Integr. Plant Biol. 2010. V. 52. P. 8.
Додуева И.Е., Творогова В.Е., Азарахш М., Лебедева М.А., Лутова Л.А. Стволовые клетки растений: единство и многообразие // Вавиловский журнал генетики и селекции. 2016. Т. 20. С. 441.
Etchells J.P., Turner S.R. The PXY-CLE41 receptor ligand pair defines a multifunctional pathway that controls the rate and orientation of vascular cell division // Development. 2010. V. 137. P. 767.
Gursanscky N.R., Jouannet V., Grünwald K., Sanchez P., Laaber-Schwarz M., Greb T. MOL1 is required for cambium homeostasis in Arabidopsis // Plant J. 2016. V. 86. P. 210.
Ren S.C., Song X.F., Chen W.Q., Lu R., Lucas W.J., Liu C.M. CLE25 peptide regulates phloem initiation in Arabidopsis through a CLERK-CLV2 receptor complex // J. Integr. Plant Biol. 2019. V. 61. P. 1043.
Kondo Y., Hirakawa Y., Kieber J.J., Fukuda H. CLE peptides can negatively regulate protoxylem vessel formation via cytokinin signaling // Plant Cell Physiol. 2011. V. 52. P. 37.
Fiers M., Hause G., Boutilier K., Casamitjana-Martinez E., Weijers D., Offringa R., van der Geest L., van Lookeren C.M., Liu C.M. Expression of the CLV3/ESR-like gene CLE19 in Arabidops is leads to a consumption of root meristem // Gene. 2004. V. 327. P. 37.
Gancheva M.S., Dodueva I.E., Lebedeva M.A., Tvorogova V.E., Tkachenko A.A., Lutova L.A. Identification, expression, and functional analysis of CLE genes in radish (Raphanus sativus L.) storage root // BMC Plant Biology. 2016. V. 16 (Suppl.1):7.
Firon N., La Bonte D., Villordon A., Kfir Y., Solis J., Lapis E., Perlman T.S., Doron-Faigenboim A., Hetzroni A., Althan L., Adani Nadir L. Transcriptional profiling of sweet potato (Ipomoea batatas) roots indicates down-regulation of lignin biosynthesis and up-regulation of starch biosynthesis at an early stage of storage root formation // BMC Genomics. 2013. V.14: 460.
Ceballos H., Sánchez T., Morante N., Fregene M., Dufour D., Smith A.M., Denyer K., Pérez J.C., Calle F., Mestres C. Discovery of an amylose-free starch mutant in cassava (Manihot esculenta Crantz) // J. Agric. Food Chem. 2007. V. 55. P. 7469.
Hennion N., Durand M., Vriet C., Doidy J., Maurousset L., Lemoine R., Pourtau N. Sugars en route to the roots. Transport, metabolism and storage within plant roots and towards microorganisms of the rhizosphere // Physiol Plant. 2019. V.165. P. 44.
Pfister B., Zeeman S.C. Formation of starch in plant cells // Cell Mol. Life Sci. 2016. V. 73. P. 2781.
Van den Ende W. Multifunctional fructans and raffinose family oligosaccharides. Front. Plant Sci. 2013. 4:247.
Turesson H., Andersson M., Marttila S., Thulin I., Hofvander P. Starch biosynthetic genes and enzymes are expressed and active in the absence of starch accumulation in sugar beet tap-root // BMC Plant Biol. 2014. V. 14: 104.
Liu Q., Luo L., Zheng L. Lignins: biosynthesis and biological functions in plants // Int. J. Mol. Sci. 2018. V. 19(2). pii: E335.
Yang J., An D., Zhang P. Expression profiling of cassava storage roots reveals an active process of glycolysis/gluconeogenesis // J. Integr. Plant. Biol. 2011. V. 53. P. 193.
Riou-Khamlichi C., Huntley R., Jacqmard A., Murray J.A. Cytokinin activation of Arabidopsis cell division through a D-type cyclin // Science. 1999. V. 283. P. 1541.
Kircher S., Schopfer P. Photosynthetic sucrose acts as cotyledon-derived long-distance signal to control root growth during early seedling development in Arabidopsis // PNAS. 2012. V. 109. P. 11217.
Corbesier L., Vincent C., Jang S., Fornara F., Fan Q., Searle I., Giakountis A., Farrona S., Gissot L., Turnbull C., Coupland G. FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis // Science. 2007. V. 316. P. 1030.
Navarro C., Abelenda J.A., Cruz-Oro´ E., Cuéllar C.A., Tamaki S., Silva J., Shimamoto K., Prat S. Control of flowering and storage organ formation in potato by FLOWERING LOCUS T // Nature. 2011. V. 478. P. 119.
Lee R., Baldwin S., Kenel F., McCallum J., Macknight R. FLOWERING LOCUS T genes control onion bulb formation and flowering // Nat. Commun. 2013. V. 4. P. 2884.
Noy-Porat T., Cohen D., Mathew D., Eshel A., Kamenetsky R., Flaishman M.A. Turned on by heat: differential expression of FT and LFY-like genes in Narcissus tazetta during floral transition // J. Exp. Bot. 2013. V. 64. P. 3273.
Pin P.A., Benlloch R., Bonnet D., Wremerth-Weich E., Kraft T., Gielen J.J., Nilsson O. An antagonistic pair of FT homologs mediates the control of flowering time in sugar beet // Science. 2010. V. 330. P. 1397.
Adeyemo O.S., Hyde P.T., Setter T.L. Identification of FT family genes that respond to photoperiod, temperature and genotype in relation to flowering in cassava (Manihot esculenta, Crantz) // Plant Reprod. 2019. V. 32. P. 181.
Guoa R., Lia W., Wang X., Chen B., Huang Z., Liu T., Chen X., Xuhana X., Laia Z. Effect of photoperiod on the formation of cherry radish root // Sci. Hort. 2019. V. 244. P. 193.
Di Giacomo E., Iannelli M., Frugis G. TALE and shape: How to make a leaf different // Plants. 2013. V. 2. P. 317.
Ghate T.H., Sharma P., Kondhare K.R., Hannapel D.J., Banerjee A.K. The mobile RNAs, StBEL11 and S-tBEL29, suppress growth of tubers in potato // Plant Mol. Biol. 2017. V. 93. P. 563.
Lin T., Sharma P., Gonzalez D.H., Viola I.L., Hannapel D.J. The impact of the long-distance transport of a BEL1-Like messenger RNA on development // Plant Physiol. 2013. V. 161. P. 760.
Kondhare K.R., Kumar A., Hannapel D.J., Banerjee A.K. Conservation of polypyrimidine tract binding proteins and their putative target RNAs in several storage root crops // BMC Genomics. 2018. V. 19. P. 1.
Wang Y., Pan Y., Liu Z., Zhu X., Zhai L., Xu L., Yu R., Gong Y., Liu L. De novo transcriptome sequencing of radish (Raphanus sativus L.) and analysis of major genes involved in glucosinolate metabolism // BMC Genomics. 2013. V. 14 (1): 836.
Yu R., Wang Y., Xu L., Zhu X., Zhang W., Wang R., Gong Y., Limera C., Liu L. Transcriptome profiling of root microRNAs reveals novel insights into taproot thickening in radish (Raphanus sativus L.) // BMC Plant Biol. 2015. V. 3. P. 15.
Xie Y., Xu L., Wang Y., Fan L., Chen Y., Tang M., Luo X., Liu L. Comparative proteomic analysis provides insight into a complex regulatory network of taproot formation in radish (Raphanus sativus L.) // Hortic. Res. 2018. V. 5: 51.
Ганчева М.С., Додуева И.Е., Лутова Л.А. Роль пептида CLE41 в развитии запасающей паренхимы корня у представителей рода Raphanus // Физиология растений. 2018. Т. 65. С. 279.
Li J., Ding Q., Wang F., Zhang Y., Li H., Gao J. Integrative analysis of mRNA and miRNA expression profiles of the tuberous root development at seedling stages in turnips // PLoS One. 2015. V. 10. P. 1.
Shang R.G., Yang P., Wang B.Y., Zhao Z.L. Transcriptome analysis of maca (Lepidium meyenii) root at different developmental stages // Appl. Plant Sci. 2018. 6(12):e01206.
Fugate K.K., Eide J.D., Martins D.N., Grusak M.A., Deckard E.L., Finger F.L. Colocalization of sucrose synthase expression and sucrose storage in the sugar beet taproot indicates a potential role for sucrose catabolism in sucrose accumulation // J. Plant Physiol. 2019. 240:153016.
Zhang Y.-F., Li G.-L., Wang X.-F., Sun Y.-Q., and Zhang S.-Y. Transcriptomic profiling of taproot growth and sucrose accumulation in sugar beet (Beta vulgaris L.) at different developmental stages // PLoS One. 2017. V. 12(4):e0175454.
Wang G.L., Huang Y., Zhang X.Y., Xu Z.S., Wang F., Xiong A.S. Transcriptome-based identification of genes revealed differential expression profiles and lignin accumulation during root development in cultivated and wild carrots // Plant Cell Rep. 2016. V. 35. P. 1743.
Rong J., Lammers Y., Strasburg J.L., Schidlo N.S., Ariyurek Y., de Jong T.J., Klinkhamer P.G., Smulders M.J., Vrieling K. New insights into domestication of carrot from root transcriptome analyses // BMC Genomics. 2014. 15:895.
Machaj G., Bostan H., Macko-Podgórni A., Iorizzo M., Grzebelus D. Comparative Transcriptomics of root development in wild and cultivated carrots // Genes (Basel). 2018. 9(9).
Villordon A.Q., La Bonte D.R., Firon N., Kfir Y., Pressman E., Schwartz A. Characterization of adventitious root development in sweet potato // Hortiscience. 2009. V. 44. P. 651.
You M.K., Hur C.G., Ahn Y.S., Suh M.C., Shin J.S., Bae J.M. Identification of genes possibly related to storage root induction in sweet potato // FEBS Letters. 2003. V. 536. P. 101.
Tanaka M., Takahata Y., Nakatani M. Analysis of genes developmentally regulated during storage root formation of sweet potato // Journal of Plant Physiology. 2005. V. 162. P. 91.
Ponniah S.K, Thimmapuram J., Bhide K., Kalavacharla V., Manoharan M. Comparative analysis of the root transcriptomes of cultivated sweet potato (Ip-omoea batatas [L.] Lam) and its wild ancestor (I-pomoea trifida [Kunth] G. Don) // BMC Plant Bio-l. 2017; 17:9.
Siebers T., Catarino B., Agusti J. Identification and expression analyses of new potential regulators of xylem development and cambium activity in cassava (Manihot esculenta) // Planta. 2017. V. 245. P. 539.
Sojikul P., Saithong T., Kalapanulak S., Pisuttinusart N., Limsirichaikul S., Tanaka M., Utsumi Y., Sakurai T., Seki M., Narangajavana J. Genome-wide analysis reveals phytohormone action during cassava storage root initiation // Plant Mol. Biol. 2015. V. 88. P. 531.
Lu K., Wei L., Li X., Wang Y., Wu J., Liu M., Zhang C., Chen Z., Xiao Z., Jian H., Cheng F., Zhang K., Du H., Cheng X., Qu C., et al. Whole-genome resequencing reveals Brassica napus origin and genetic loci involved in its improvement // Nat. Commun. 2019. V. 10(1):1154.
Hodgins K.A., Lai Z., Oliveira L.O., Still D.W., Scascitelli M., Barker M.S., Kane N.C., Dempewolf H., Kozik A., Kesseli R.V., Burke J.M., Michelmore R.W., Rieseberg L.H. Genomics of Compositae crops: reference transcriptome assemblies and evidence of hybridization with wild relatives // Mol. Ecol. Resour. 2014. V. 14. P. 166.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


