Физиология растений, 2020, T. 67, № 5, стр. 501-511
Влияние ионов кадмия на некоторые биофизические параметры и ультраструктуру клеток Ankistrodesmus sp. В-11
Б. К. Заядан a, А. К. Садвакасова a, *, Д. Н. Маторин b, Н. Р. Акмуханова a, М. Кокосинский c, Н. П. Тимофеев b, Х. Балоуч a, М. О. Бауенова a
a Казахский национальный университет им. аль-Фараби
Алматы, Казахстан
b Московский государственный университет им. М. В. Ломоносова
Москва, Россия
c Университет им. Адама Мицкевича
Познань, Польша
* E-mail: asem182010@gmail.com
Поступила в редакцию 11.10.2019
После доработки 18.12.2019
Принята к публикации 23.12.2019
Аннотация
Изучено влияние низких концентраций ионов кадмия на процессы роста, фотосинтеза и ультраструктуру клеток микроводоросли Ankistrodesmus sp. В-11. При добавлении в среду кадмия в концентрациях 0.005–0.02 мг/л происходило значительное снижение числа клеток Ankistrodesmus sp. В‑11 по сравнению с контролем. Полное прекращение роста клеток наблюдали при добавлении кадмия в концентрации выше 0.05 мг/л. Отмечены ультраструктурные изменения в расположении тилакоидов в строме, расхождение мембран с образованием межтилакоидных пространств и существенным повышением вакуолизации клеток микроводорослей. С использованием флуориметра М-РЕА-2, позволяющим одновременно измерять в микросекундном интервале индукционные кривые флуоресценции и окислительно-восстановительные превращения компонентов ФСI, показано, что ионы кадмия ингибируют электронный транспорт в ФСII. Происходит уменьшение квантового выхода электронного транспорта в ФСII (φEo), индекса производительности (PIABS) и замедление восстановления пигмента P700, а также увеличение рассеивания энергии (DI0/RC) и ΔpH-зависимого нефотохимического тушения (qE). Наиболее чувствительным параметром оказался индекс производительности (PIABS), который можно предложить для обнаружения раннего токcичеcкого дейcтвия ионов кадмия на водоросли.
ВВЕДЕНИЕ
Одним из наиболее токсичных тяжелых металлов как для растительных, так и для теплокровных организмов является кадмий. Он поступает в водную среду обитания не только в результате промышленной деятельности человека, но и в ходе таких природных процессов, как вулканическая активность, выщелачивание горных пород и прочее [1, 2]. Накапливаясь в донных отложениях, кадмий оказывает токсическое действие на водные организмы. Этот металл является типичным политропным химическим элементом, способным взаимодействовать с различными структурами клетки и вызывать спектр негативных биохимических сдвигов: от ингибирования активности ферментов до повреждения мембранных структур клетки [3]. Известно, что кадмий активирует процессы перекисного окисления липидов, препятствуя работе системы антиоксидантной защиты, вызывая при этом окислительный стресс [4]. Мигрируя по пищевым цепям, он представляет угрозу экологической безопасности для живых систем. Токсичность кадмия у растений проявляется в задержке роста, хлорозе, генотоксичности, торможении метаболизма корней и фотосинтеза [3, 5]. Токсичные концентрации кадмия для фотосинтезирующих организмов часто находятся в пределах нескольких мкМ. На фотосинтез этот металл влияет многообразно: на содержание и состав пигментов, фотосинтетический электронный поток, тилакоидную структуру, работу цикла Кальвина–Бенсона [5–8]. Предполагают, что указанные концентрации кадмия действуют на фотосинтез на уровне ФСII, ингибируя выделение кислорода [5]. Таким образом, кадмий относится к числу наиболее опасных тяжелых металлов и представляет серьезную экологическую опасность [9].
Для оценки состояния водных экосистем, в том числе при изучении последствий, вызванных загрязнением кадмием, в качестве организмов-биоиндикаторов используются микроводоросли. Они являются одними из удобных объектов, широко применяемых в биомониторинге, поскольку в большей степени, чем многоклеточные организмы, чувствительны к загрязнениям. Высокая удельная поверхность их клеток способствует быстрому накоплению токсикантов [10], при этом в качестве тест-функций микроводорослей часто используют интегральные характеристики смертности, прироста культуры, изменение ультраструктуры и фотосинтеза. Преимущества использования фотосинтеза в качестве тест-функции обусловлены его чувствительностью к действию многих загрязнений.
Флуоресцентные методы оценки могут дать подробную информацию об активности фотосинтетического аппарата при токсическом действии [5, 8, 11–14]. Такие методы позволяют получать информацию о состоянии микроводорослей в режиме реального времени. В последнее время для оценки работы фотосинтетического аппарата высших растений и культур водорослей начинают использовать методы измерения индукционных кривых флуоресценции с высоким временным разрешением (от 10 мкс) при возбуждении мощной вспышкой света [12–15]. Измерение индукционных кривых флуоресценции с высоким разрешением занимает всего несколько секунд и проводится на приборах типа PAM и PEA. Появились приборы, в которых наряду с регистрацией флуоресценции возможно измерять редокс-превращения переносчиков ФСI, то есть одновременно следить за отдельными реакциями ФСII и ФСI [11, 13, 14, 16, 17].
Несмотря на то, что действию солей кадмия посвящено значительное количество работ, степень изученности влияния солей этого металла на отдельные стадии световых реакций фотосинтеза и ультраструктуру клеток водорослей остается недостаточной. Подобные исследования на водорослях Ankistrodesmus sp. В-11 не проводились.
Цель работы – изучение изменения процессов роста, фотосинтеза и ультраструктуры клеток микроводоросли Ankistrodesmussp. В-11 в присутствии в среде различных концентраций ионов кадмия, а также выявление наиболее чувствительных параметров флуоресценции хлорофилла для использования при биотестировании.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование микроводоросли. Одноклеточная культура Ankistrodesmus sp. В-11 получена из коллекции фототрофных микроорганизмов Казахского национального университета им. аль-Фараби. Культуры выращивали в люминостате с досвечиванием лампами дневного света со сменой дня и ночи (12/12 ч), освещенностью 3–5 тыс. люкс и температуре 22 ± 2°С. Содержимое емкостей перемешивали 2 раза в сутки для улучшения газообмена, уменьшения оседания клеток и прилипания их к стенкам сосуда. Для опытов использовали культуру клеток водорослей в фазе логарифмического роста (4–7 сут) с исходной плотностью 400 тыс. кл/мл и содержавшую не менее 95% живых клеток. Для опытов брали только синхронизированные культуры. Для этого культуры в течение двух суток выдерживали в полной темноте при комнатной температуре в стерильном цилиндре. Верхний слой молодых клеток, не перемешивая, переносили в стерильную питательную среду Прата [18].
Исследование влияния кадмия на динамику роста культуры. В опытах кадмий использовали в виде соли CdS04 · 8Н2O (ОАО “Реактив”, Россия) для приготовления исходного концентрированного маточного раствора, который разводили стерильной дистиллированной водой до нужной концентрации и добавляли в культуру однократно при постановке эксперимента. Исследуемые концентрации кадмия составили 0.002, 0.005, 0.02, 0.05 и 0.2 мг/л. В экспериментах клетки из активно растущей культуры инокулировали в 500 мл колбы с 200 мл среды без (контроль) или с кадмием и подращивали в течение 2–10 суток при круглосуточном освещении. Рост культуры определяли путем подсчета числа клеток в камере Горяева [18].
Исследование биофизических показателей. Индукционные кривые быстрой (БФ) и замедленной (ЗФ) флуоресценции хлорофилла, а также окислительно-восстановительные превращения компонентов ФСI, главным образом Р700, измеряли одновременно с помощью прибора Multi-function Plant Efficiency Analyser (М-РЕА-2, “Hansatech Instruments”, Великобритания) [14, 16, 17]. Регистрацию быстрой и замедленной флуоресценции производили при чередовании красного света (интенсивность 1500 мкЕ/(м2с), 625 нм) и темновых интервалов малой длительности, достаточных для регистрации ЗФ. Динамика ЗФ отражала изменения интенсивности свечения в диапазоне 0.1–0.9 мс в интервалах между импульсами действующего света. Изменения поглощения при длине волны 820 нм отражают редокс-состояние компонентов ФСI, главным образом P700, реакционного центра ФСI. Интенсивность модулирующего света при длине волны 820 ± 25 нм составляла 1000 мкЕ/(м2с). Полученные данные нормировали на значение при t = 0.7 мс (MRO) [14]. Характеристики и протокол измерений на M-PEA-2 подробно описан ранее [14, 16]. Поскольку для измерения редокс-состояния P700 необходимы повышенные концентрации водорослей, клетки концентрировали на мембранном фильтре и выдерживали в темноте в течение 10 мин во влажном состоянии. Контрольные измерения флуоресценции на суспензиях S. quadricauda в кюветах с помощью флуориметра Aqua-Pen САР–С 100 (“Photon Systems Instruments”, Чехия) показали, что применение процедуры обогащения проб на фильтре не оказывало влияния на физиологическое состояние клеток [11]. В кратковременных токсикологических экспериментах на M-PEA-2 использовали 10% среду Прата для предотвращения связывания токсиканта.
Для количественного анализа характеристик первичных процессов фотосинтеза на основе OJIP параметров кинетической кривой был использован так называемый JIP-тест [12, 15]. JIP-тест использует следующие параметры кривой индукции флуоресценции: интенсивность при 20 мкс (FO), 2 мс (FJ), 30 мс (FI), 6 с (F6s), а также FP (FM, максимальная интенсивность флуоресценции) и M0 (площадь над кинетической кривой OJIP, но ниже уровня FM). Эти измеряемые величины использовали для расчета следующих параметров:
FV = FM – FO – максимальная переменная флуоресценция;
FV/FM – максимальный квантовый выход первичной фотохимической реакции в открытых реакционных центрах ФС II: FV/FM = φPo;
VJ – относительная амплитуда фазы O-J (после 2 мс освещения). Отражает количество закрытых РЦ по отношению к общему числу РЦ, которые могут быть закрыты; VJ = (FJ –FO)/(FM – FO);
VI – относительная амплитуда фазы O-I (после 30 мс освещения). Отражает способность ФС I и ее акцепторов окислять пул пластохинонов; VI = = (FI – FO)/(FM – FO);
φEo – квантовый выход электронного транспорта за пределы (при t = 0): φEo = 1 – (FO/FM)]*(1 – – VJ) где VJ = (FJ – FO)/FV;
DI0/RC = (ABS/RC) – M0(1/VJ) – общее количество энергии, рассеиваемой одним реакционным центром (RC) в виде тепла, флуоресценции или переноса к другой фотосистеме при t = 0;
ABS/RC – поток энергии, поглощаемый одним активным реакционным центром (РЦ), характеризует относительный размер антенны (ABS): ABS/RC = M0/VJ(1/φPo) = (M0/VJ)/[(FM –FO)/FM)];
PIABS – индекс производительности, показатель функциональной активности ФС II, отнесенный к поглощаемой энергии: PIABS = [1 – ‒ (FO/FM)]/(M0/VJ)*[(FM – FO)/FO]*[(1 – VJ)/VJ];
qE – способность к рН-индуцированному нефотохимическому тушению флуоресценции: qE = = (FM – F6s)/FV.
Все измерения проводили не менее чем в пяти повторностях. На рисунках представлены данные средних значений.
Электронная микроскопия. Ультраструктуру клеток микроводорослей анализировали с помощью трансмиссионной электронной микроскопии. Образцы Ankistrodesmus sp. В-11 были собраны центрифугированием при комнатной температуре в течение 30 мин при 3000 об/мин на центрифуге Rotina 380R (“Hettich”, Германия) и фиксированы 2% глутаровым альдегидом в 0.1 М какодиловом буфере (рН = 7.2) в течение 2 ч. Образцы промывали трижды в этом же буфере и фиксировали при 4°С в 1% OsO4. После обезвоживания в этаноле и ацетоне, образцы окрашивали 2% раствором водного уранацилацетата. (рН = = 5.0). В конце образцы были погружены в эпоксидную смолу Spurr [19]. Ультратонкие срезы (90 нм) вырезали алмазным ножом с помощью ультрамикротом Ultracut (“Leica”, Германия). Клеточные структуры анализировали при помощи электронного микроскопа Jem 1200 EXII (“JEOL”, Япония). Эта часть работы была выполнена в лаборатории электронной и конфокальной микроскопии в Университете им. Адама Мицкевича в Познани (Польша).
РЕЗУЛЬТАТЫ
Для оценки жизнеспособности Ankistrodesmus sp. В-11 в условиях загрязнения водной среды ионами кадмия было изучено влияние этого металла в различных концентрациях на показатели роста и развития микроводоросли в модельных опытах (динамику роста штамма, ультраструктуру клеток и изменение фотосинтетических параметров данной культуры).
Влияние кадмия на динамику роста микроводоросли
Кривые скорости роста Ankistrodesmus sp. В-11 в присутствии в среде разных концентрациях кадмия представлены на рисунке 1. Исходное количество клеток в начале эксперимента составляло 400 тыс кл/мл. Установлено, что исследуемая культура Ankistrodesmus sp. В-11 растет в среде с содержанием кадмия в концентрациях 0.002–0.005 мг/л. Наименьшая концентрация металла 0.002 мг/л близка к концентрациям ПДК для водных объектов. При этом общая численность клеток на протяжении всего эксперимента при данной концентрации была на уровне контроля. При концентрации кадмия в среде 0.005 мг/л численность клеток была на 36% ниже уровня контроля, но, несмотря на это, на протяжении всего опыта рост культуры продолжался в течение 8 суток культивирования, как в контроле. Затем отмечали снижение темпов роста аналогично контролю.
Рис. 1.
Влияние различных концентраций кадмия на динамику роста клеток микроводоросли Ankistrodesmus sp. В-11: 1 – контроль, 2 − 0.002 мг/л Cd2+, 3 − 0.005 мг/л Cd2+, 4 − 0.02 мг/л Cd2+, 5 − 0.05 мг/л Cd2+, 6 − 0.2 мг/л Cd2+.

Увеличение концентрации кадмия до 0.02 мг/л вызывало резкое снижение относительной численности клеток по сравнению с контролем уже после первых суток культивирования, что свидетельствует о высокой чувствительности культуры Ankistrodesmus sp. В-11 к исследуемой концентрации кадмия. При этом на 6 сутки культивирования общее число клеток (максимальная точка) составляло только 38% от контроля.
Еще более слабый рост числа клеток или его отсутствие наблюдали при концентрации кадмия 0.05 мг/л и выше (рис. 1). Необходимо отметить, что, если в контроле в течение всего эксперимента численность клеток увеличивалась (до 8 суток), то в варианте опыта с максимальной концентрацией кадмия 0.2 мг/л она оставалась практически неизменной в течение первых трех суток, после чего наблюдали выцветание культуры клеток микроводоросли. Наблюдаемое постепенное снижение роста клеток культуры после 8 суток культивирования в контроле и в вариантах опыта с концентрациями кадмия 0.002−0.005 мг/л, возможно, связано с уменьшением количества биогенных элементов и накоплением метаболитов, ингибирующих рост микроводорослей [20].
Влияние кадмия на световые реакции фотосинтеза микроводоросли
Проведенные исследования Ankistrodesmus sp. В-11 показали, что максимальный квантовый выход первичных фотохимических реакций FV/FM (φPo) у контрольных клеток находился на уровне 0.6 (табл. 1). В присутствии соли кадмия в концентрациях 0.05 и 0.2 мг/л уже через сутки инкубации происходило снижение этого параметра. Следует отметить, что при кратковременной (24 ч) инкубации водорослей с кадмием спектры поглощения суспензий водорослей (данные не показаны) практически не менялись, что свидетельствует об отсутствии влияния ионов этого металла на пигментный аппарат в данный период.
Таблица 1.
Средние значения параметров OJIP-теста индукционной кинетики флуоресценции микроводорослей Ankistrodesmus sp. В-11 при действии различных концентраций кадмия через 24 ч инкубации
| Параметры | Контроль | 0.05 мг/л | 0.2 мг/л |
|---|---|---|---|
| FV/FM | 0.6 ± 0.02 | 0.52 ± 0.03* | 0.46 ± 0.02* |
| FV/FO | 1.73 ± 0.05 | 1.44 ± 0.06* | 1.24 ± 0.04* |
| VJ | 0.65 ± 0.03 | 0.67 ± 0.02 | 0.73 ± 0.03* |
| VI | 0.86 ± 0.03 | 0.86 ± 0.04 | 0.89 ± 0.04 |
| φEo | 0.21 ± 0.01 | 0.17 ± 0.02* | 0.12 ± 0.02* |
| PIABS | 0.24 ± 0.02 | 0.12 ± 0.02 * | 0.06 ± 0.03 * |
| ABS/RC | 3.2 ± 0.4 | 4.48 ± 0.03 * | 5.1 ± 0.2 * |
| DI0/RC | 1.29 ± 0.04 | 2.14 ± 0.05 * | 2.75 ± 0.05* |
| qE | 1.63 ± 0.04 | 1.86 ± 0.03 * | 1.89 ± 0.04* |
Для детальной оценки изменений фотосинтетической активности в клетках Ankistrodesmus sp. В-11 были одновременно измерены индукционные параметры быстрой и замедленной флуоресценции, а также редокс-состояние переносчиков ФСI (главным образом, Р700.) На рисунке 2а представлены кинетические кривые индукции флуоресценции (OJIP), нормированные по уровню FO. У контрольных клеток кривая флуоресценции соответствовала кривой, описанной в литературе [12, 15, 16]. В кинетике индукции флуоресценции контрольной культуры в ответ на свет высокой интенсивности наблюдали несколько стадий, известных как O-J-I-P переходы. Начальный уровень О соответствует интенсивности флуоресценции хлорофилла при “открытых” РЦ ФС II (FO), когда все акцепторы QА окислены. Фаза O-J обусловлена светоиндуцированным восстановлением QА, тогда как следующие фазы отражают, главным образом, дальнейшее накопление восстановленного QА, обусловленное снижением его реокисления в результате восстановления акцепторов QB и пула пластохинонов (РQ).
Рис. 2.
Индукционные кривые быстрой флуоресценции (а), замедленной флуоресценции (б), изменение в отражении при длине волны 820 нм (в), у клеток микроводорослей Ankistrodesmus sp. В-11 при действии различных концентраций кадмия: 1 – контроль, 2, 3 инкубация клеток в течение 24 ч в присутствии кадмия 0.05 и 0.2 мг/л, соответственно. Быстрая флуоресценция нормирована на FO. Интенсивность действующего красного света 1500 мкЕ/(м2с). Одновременные измерения всех трех сигналов выполнены на приборе М-РЕА-2.
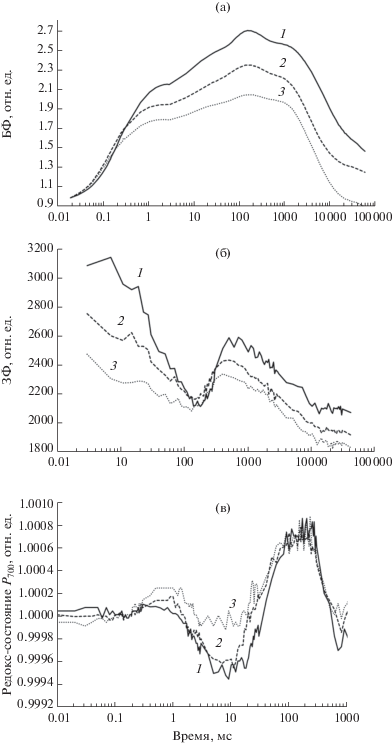
Для проведения количественного анализа характеристик первичных процессов фотосинтеза на основе параметров кинетической кривой O-J-I-P флуоресценции использовали JIP-тест (табл. 1). В присутствии в среде соли кадмия менялась форма кривой O-J-I-P и наблюдалось снижение вклада фотохимической фазы J-I-P, что свидетельствует о нарушении потока электронов от ФСII в пул хинонов (табл. 1) [12, 15]. Квантовый выход электронного транспорта в ФСII (φEo) у клеток в присутствии ионов кадмия снижен. То есть одно из первых мест действия кадмия локализовано на акцепторной части ФС II. Увеличение ОJ-фазы приводит к возрастанию параметра Vj, что указывает на увеличение доли QB невосстанавливающихся РЦ от ФСII. Фаза JI (3–30 мс) соответствует восстановлению пула РQ, а параметр VI является хорошим индикатором состояния редокс-состояния пула PQ в темноте [15]. Обнаружено, что в присутствии ионов кадмия не наблюдалось изменений этого параметра, что указывает на отсутствие влияния металла на наличие окисленных молекул PQ сайта QB у водорослей.
Параметр ABS/RC, связанный с размером светособирающей антенны на РЦ, у клеток водорослей в присутствии кадмия увеличен относительно контроля, что связано со снижением у них доли активных РЦ, которое обусловлено нарушением биосинтеза белка D1 [6].
Параметр PIABS является обобщенным показателем функциональной активности ФСII, [12, 14]. Он имеет более высокие показатели у контрольных клеток по сравнению с клетками в присутствии кадмия. Низкие показатели параметра PIABS (индекс производительности) у обработанных кадмием водорослей указывают на низкую функциональную активность ФСII, в основном из-за снижения доли активных РЦ и повышения тушения возбужденных состояний в антенне. Уменьшение эффективности передачи энергии возбуждения со светособирающего комплекса на РЦ должно сопровождаться увеличением рассеивания неиспользуемой световой энергии. Действительно, эффективность рассеивания энергии (DI0/RC) у клеток в присутствии кадмия находится на высоком уровне. Это коррелирует с увеличением у них ΔpH-зависимого нефотохимического тушения qE, которое рассчитывается по спаду флуоресценции после достижения максимума (qE = (FM – F6s)/FV). Увеличение нефотохимического тушения отмечено при регистрации методом РАМ флуорометрии [7, 21].
Миллисекундная ЗФ возникает в результате вторичной реакции рекомбинации переносчиков в РЦ ФСII, а ее интенсивность зависит от величины электрохимического градиента протонов на тилакоидной мембране, который снижает энергию активации реакции обратной рекомбинации [13, 14, 16]. Поэтому определение параметров ЗФ является одним из методов, позволяющих следить за изменением градиента протонов на мембране тилакоидов клетки. Полученный в эксперименте максимум на кривой ЗФ в миллисекундном диапазоне совпадает с фазой возрастания J-I на индукционной кривой быстрой флуоресценции (рис. 2б). Образование этого пика обусловлено накоплением излучательных редокс-состояний, отвечающих за обратную рекомбинацию зарядов и испускание квантов ЗФ (т.е. высвечивающие состояния), а также усилением ЗФ за счет образующегося электрического потенциала на мембране (∆ψ). Пик ЗФ в секундном диапазоне связывают с фотоиндуцированным образованием трансмембранного градиента протонов (∆pH), который также снижает энергию активации излучательных переходов (испускание ЗФ) в РЦ ФСII [14, 17]. У клеток в присутствии кадмия значительно снижена интенсивность ЗФ на индукционной кривой при 1050 мс и 1 c (рис. 2), что, вероятно, связано с уменьшением нециклического транспорта и, соответственно, уменьшением энергизации мембран тилакоидов.
Измерение модулированного отражения при 820 нм позволяет следить за реакциями переносчиков пластоцианина и, главным образом, Р700 (РЦ ФСI). После включения света наблюдалось начальное окисление Р700 с последующим его восстановлением (рис. 2в). При этом сигналы флуоресценции, отражающие восстановление QА, и процессы восстановления Р700, выходили на плато примерно синхронно. Параллельное накопление восстановленных форм Р700 и QА отражало восстановление переносчиков на всем участке ЭТЦ между фотосистемами в связи с отсутствием оттока электронов из акцепторной части ФСI в условиях, когда ферредоксин-НАДФ-редуктаза (ФНР) инактивирована инкубацией в темноте. При длительном освещении (~1–10 с) наблюдали вторую волну окисления Р700, которую можно объяснить оттоком электронов от ФСI при активации ФНР и ферментов цикла Кальвина [14].
При обработке низкими концентрациями кадмия водоросли сохраняют способность Р700 к окислению при включении света (рис. 2в). Однако у них наблюдалось снижение скорости восстановления Р700 от ФСII. Это согласуется с данными анализа индукционных кривых быстрой флуоресценции. При больших концентрациях кадмия наблюдали подавление реакций окисления Р700 в ФСI.
Влияние кадмия на ультраструктуру микроводоросли
Ультраструктуру клеток микроводорослей изучали с помощью трансмиссионной электронной микроскопии через 4 суток культивирования, когда клетки находились в фазе активного роста. Исследование проводили в присутствии в среде ионов кадмия в концентрации 0.05 мг/л. Контролем служили клетки Ankistrodesmus sp. В-11 в фазе интенсивного роста, выращенные в оптимальных условиях.
На ультратонких срезах в контрольном варианте в клетках Ankistrodesmus sp. В-11 обнаруживались органеллы, структуры и включения, характерные для данного вида (рис. 3а). Клеточная стенка гладкая, тонкая, бесцветная, с типичным для зеленых микроводорослей строением, состоящая из наружного целлюлозо-пектинового слоя и плазмолеммы. Цитоплазма клетки пронизана неравномерно расположенной системой канальцев. В клетках хорошо различимы область ядра с крупным электронно-плотным ядрышком, митохондрии. Имеются такие клеточные включения, как крахмальные зерна. Хлоропласт один пристеночный, выстилающий почти всю периферическую часть клетки, без пиреноида; тилакоиды заполняют всю строму и имеют типичное для Ankistrodesmus расположение: от периферии к центру клетки. В плоскости среза контуры тилакоидов следуют параллельно друг другу и одновременно изгибаются. Мембраны, образующие тилакоиды, плотно прижаты друг к другу.
Рис. 3.
Ультраструктура клеток Ankistrodesmus sp. В-11: а – ультраструктура клеток в контроле; б – ультраструктурные изменения клеток в присутствии соли кадмия в концентрации 0.5 мг/л; в – хлоропласт в контроле; г – набухшие хлоропласты с увеличенным межтилакоидным пространством. Обозначения: v – вакуоль, Chl – хлоропласт, t – тилакоиды, Pl – плазмолемма, N – ядрышко, m – митохондрия, Ga – аппарат Гольджи, Sg – крахмальное зерно, Em – электроноплотный материал. Звездочки указывают зону увеличения межтилакоидного пространства. Масштаб: a – ×10K; б – ×4000; в – ×75K; г – ×50K.
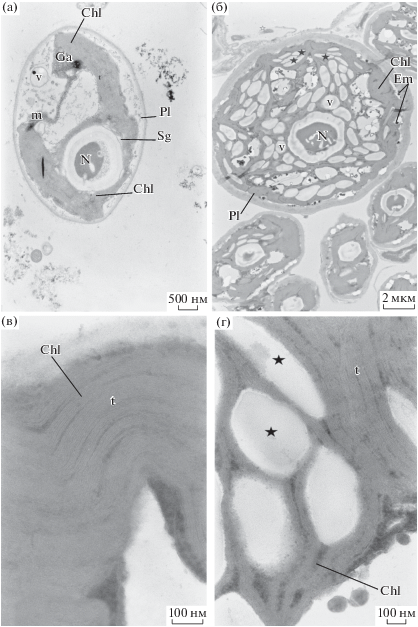
Электоронно-микроскопическое исследование структуры клеток Ankistrodesmus sp. В-11 в опытном варианте показало, что через 96 ч после воздействия кадмия в концентрации 0.05 мг/л наблюдаемые изменения в ультраструктуре клеток микроводоросли затрагивали фотосинтетический аппарат (рис. 3б). В частности, модификации касались расположения тилакоидов в строме: необходимо отметить увеличение расстояния между ними, дезинтеграцию тилакоидов, а также увеличение внутритилакоидных пространств (рис. 3в, г). Также в некоторых клетках появлялись электронно-плотные включения неидентифицированной природы.
Необходимо отметить возрастающую активность аппарата Гольджи: практически во всех клетках в опыте обнаружено большое количество экскреторных вакуолей по сравнению с контролем. Во многих клетках отмечено набухание хлоропластов и расхождение мембран, их вакуолизация, а также увеличение межтилакоидного пространства (рис. 3б). Помимо описанных изменений, также наблюдаются незначительные отслоения клеточной стенки от протопласта и изменения природной формы клеток, что, по-видимому, связано с изменением проницаемости цитоплазматической мембраны (рис. 3б).
ОБСУЖДЕНИЕ
Согласно литературным данным, микроводоросли весьма чувствительны к наличию в среде металлов [8, 10, 22]. При этом было обнаружено, что отклики водорослей на добавки в среду летальных и сублетальных концентраций тяжелых металлов существенно различаются [23]. Различия в чувствительности микроводорослей разных штаммов таксономических групп обусловлены неодинаковыми механизмами действия тяжелых металлов, а также особенностями метаболизма, и морфологией водорослевых клеток. В результате проведенных нами исследований установлено, что при добавлении в питательную среду кадмия в концентрациях начиная с 0.005 мг/л наблюдается значительное достоверное снижение числа клеток Ankistrodesmus sp. В-11 по сравнению с контролем.
Современные представления о переносе электрона по фотосинтетической ЭТЦ предполагают последовательное участие двух фотосистем (ФСII и ФСI), при котором переносчики, восстановленные ФСII, служат донорами электронов для ФСI. Связь между ФСII и ФСI проявляется во флуоресценции хлорофилла, уровень которой зависит от редокс-состояния хинонного акцептора Qa. Фотореакция ФС II восстанавливает Qa, повышая уровень флуоресценции, а активность ФСI приводит к окислению Qa и снижению флуоресценции [12]. Кинетики световой индукции переменной флуоресценции в миллисекундном диапазоне отражают изменения электронного транспорта внутри ФСII и между ФСII и ФСI [13–15].
Измерения показателей функциональной активности ФСII таких величин, как FV/FM (максимальный квантовый выход ФСII) и PIABS (индекс производительности), доказывает, что кадмий вызывал инактивацию ФСII, что согласуется с данными об их токсическом действии на ФСII, полученными ранее для других фотосинтетических объектов [5, 7, 24].
Одновременная регистрация индукционных кривых быстрой и замедленной флуоресценции, а также редокс-состояния Р700 на приборе M-PEA-2 позволили выявить первичные стадии воздействия ионов кадмия на реакции фотосинтеза у водорослей Ankistrodesmus sp. В-11. Анализ индукционных кривых показал, что одно из первых мест действия соединений кадмия локализовано на акцепторной части ФСII между QА и QВ. Уменьшение квантового выхода электронного транспорта в ФСII приводило к ингибированию значения индекса производительности (PIABS). Этот параметр оказался более чувствительным по сравнению с FV/FM и может быть рекомендован в биотестировании качества воды в естественных и искусственных водоемах. Уменьшение количества активных РЦ и изменение электронного транспорта способствовало нарастанию нефотохимических потерь, связанных с увеличением квантовой эффективности рассеивания энергии (DI0/RC) и ΔpH-зависимого нефотохимического тушения (qE). На высших растениях показано, что соли кадмия могут влиять на кислород-выделяющий комплекс ФСII. [5, 6]. В наших экспериментах снижение параметра FV/FO, связанного с изменениями на донорном участке ФСII при концентрациях 0.05 мг/л, также указывает на возможность воздействия соединений кадмия на донорном участке ФСII. Уменьшение параметра FV/FO при действии кадмия ранее отмечалось на зеленой микроводоросли Scenedesmus obliquus [21].
В отличие от ФСII, реакции окисления Р700 у водорослей Ankistrodesmus sp. В-11 менее чувствительны к кадмию. Возможной причиной ингибирования тяжелыми металлами фотосинтетического электронного транспорта являются изменения в ультраструктуре хлоропластов, в частности, повреждение тилакоидов.
Известно, что металлы сильно влияют на ультраструктуру микроводорослей. При действии металлов могут формироваться атипичные клетки, обнаруживаются ядерные включения и изменения в составе запасающих продуктов. Кроме этого в присутствии тяжелых металлов наблюдаются нарушения ультраструктуры хлоропластов, что, в свою очередь, является одной из важных причин снижения содержания пигментов и в целом уменьшения интенсивности фотосинтеза [25].
Полученные нами результаты свидетельствуют о том, что кадмий вызывает изменения ультраструктуры, которые затрагивают, в первую очередь, фотосинтетический аппарат. В частности, модификации касались расположения тилакоидов в строме, увеличения расстояния между ними, дезинтеграции тилакоидов, а также увеличения межтилакоидных пространств, что приводит к снижению фотосинтетической активности. Кроме того, наблюдается существенное повышение вакуолизации клеток за счет структурных изменений цитоплазматической мембраны. Полученные нами результаты об изменениях структуры клетки под действием кадмия согласуются с данными других авторов [1]. Сообщается, что при культивировании цианобактерий в средах с солями тяжелых металлов выявлены изменения ультраструктуры их клеток. Так, рядом авторов установлено утолщение клеточной стенки, плазмолиз (отслоение клеточной стенки от протопласта) под влиянием ионов тяжелых металлов, отмечена деструкция тилакоидных мембран. В нуклеоплазме выявлено увеличение полифосфатных гранул, по-видимому, играющих важную роль в связывании ионов металлов и их детоксикации. Отмечено что, цитоплазма теряла характерную зернистость, и в ней появлялись обширные светлые участки [26].
Сходные изменения ультраструктуры в клетках цианобактерий А. flos-aquae наблюдали в присутствии 0.05 мМ меди, где авторами отмечено значительное увеличение межтилакоидных пространств и увеличение полифосфатных гранул [27]. Cообщается о влиянии кадмия и ртути на ультраструктуру клеток Synechocystis sp. PCC 6803, где отмечается нарушение целостности хлоропластов, нарушение тилакоидов и увеличение количества и размеров полифосфатных гранул [1]. В частности, при действии кадмия изменяется структура внешней мембраны хлоропластов, а также мембран тилакоидов. Искривление и растяжение этих мембран может являться следствием изменения соотношения по степени насыщенности жирных кислот мембранных фосфолипидов, гидролиза липидов и освобождения жирных кислот [28]. Кроме того, в присутствии тяжелых металлов отмечено уменьшение количества гран и нарушение их структуры. Граны приобретают неправильную форму и содержат меньшее количество тилакоидов [28]. Экспериментально показана интенсивная активизация формирования деструктивных вакуолей в клетках зеленых микроводорослей Chlamydomonas reinhardtii и Dunaliella salina под воздействием селена и катамина, где разрушение клеток осуществлялось в результате выхода содержимого вакуолей в цитоплазму и ядро [29]. Аналогичные результаты получены по исследованию влияния кадмия, меди и ртути на ультраструктуру клеток Chlamydomonas acidophila [30]. При этом отмечается, что наибольшее ультраструктурное изменение клеток микроводорослей вызвано кадмием, по сравнению с другими металлами. Установлено повышение уровня экскреторных вакуолей, а также увеличение гранул крахмала, уменьшение размера пиреноидов и митохондрий [30].
Аналогичные изменения муреинового слоя были продемонстрированы у штаммов под влиянием различных тяжелых металлов: A. flos-aquae – к Cd2+, A. variabilis и Synechococcus – к Zn2+, Bacillus stearothermophilus – к Ca2+ и Sr2+. Как известно, клеточная стенка является первой преградой для тяжелых металлов [4]. На первой стадии металлы адсорбируются на клеточной поверхности и затем поступают внутрь клетки путем пассивного или активного транспорта. Металлы, достигая клеточной мембраны и связываясь с различными лигандами и функциональными группами типа –COOH, –SH, –NH2, –P3O4 и др., присутствующими в цитоплазматической мембране, приводят к изменению проницаемости цитоплазматической мембраны и выбросу ионов Na+ и K+. Подобный выброс ионов Na+ и K+ как показатель изменения проницаемости мембраны отмечался у клеток Nostoc muscorum после экспозиции к Ni2+ Cr2+ Pb2+ и Ag2+ [22].
В целом полученные нами экспериментальные данные свидетельствуют о влиянии кадмия в концентрации 0.05 мг/л на скорость роста и на ультраструктуру клеток Ankistrodesmus sp. В-11. Отмеченные нарушения в структуре хлоропластов вызывают инактивацию кислородвыделяющих центров ФСII и, как следствие, замедление электронного транспорта. Результатом этих изменений является снижение фотосинтетической активности водорослей, которая может быть оперативно диагностирована при измерении индукционных кривых флуоресценции хлорофилла.
Полученные в рамках данной работы результаты могут быть использованы в ходе проведения оценки экологического состояния водных экосистем, загрязненных ионами тяжелых металлов.
Работа выполнена в рамках проекта АР05131743 “Разработка научно-методических основ технологии биомониторинга и прогнозирования состояния загрязненных водных экосистем с применением фототрофных микроорганизмов”, финансируемым Министерством образования и науки Республики Казахстан. Также в статье использованы результаты, полученные при финансовой поддержке по Гранту РФФИ-N20-04-00465.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Arunakumara K.K., Xuecheng Z. Heavy metal bioaccumulation and toxicity with special reference to microalgae // J. Ocean Univ. Chin. 2008. V. 7. P. 60.
Andresen E., Küpper H. Cadmium toxicity in plants // Met. Ions Life Sci. 2013. V. 11. P. 395. https://doi.org/10.1007/978-94-007-5179-8_13
Babula P., Adam V., Opatrilova R., Zehnalek J., Havel L., Kizek R. Uncommon heavy metals, metalloids and their plant toxicity // Environ. Chem. Lett. 2008. V. 6. P. 189.
Tasleem J.A., Mudsser A., Kehkashan S., Arif A., Inho C., Qazi M., Rizwanul H. Heavy metals and human health: Mechanistic Insight into Toxicity and Counter Defense System of Antioxidants // Int. J. Mol. Sci. 2015. V. 16. P. 29592.
Joshi M.K., Mohanty P. Chlorophyll a fluorescence as a probe of heavy metal ion toxicity in plants // Chl. Fluor.: A Sign. of Photos. 2004. P. 637. https://doi.org/10.1007/978-1-4020-3218-9_25
Faller P., Kienzler K., Krieger-Liszkay A. Mechanism of Cd2+ toxicity: Cd2+ inhibits photoactivation of photosystem II by competitive binding to the essential Ca2+ site // Biochim. Biophys. Acta. 2005. V. 1706. P. 158.https://doi.org/10.1016/j.bbabio.2004.10.005
Xue Z., Gao H., Zhao S. Effects of cadmium on the photosynthetic activity in mature and young leaves of soybean plants // Environ. Sci. Pollut Res. Int. 2014. V. 21. P. 4656. https://doi.org/10.1007/s11356-013-2433-z
Kumar K.S., Dahms H.U., Lee J.S., Kim H.C., Lee W.C., Shin K.H. Algal photosynthetic responses to toxic metals and herbicides assessed by chlorophyll a fluorescence // Ecotoxicol Environ Saf. 2014. V. 104. P. 51.
Касимов Н.С. Экогеохимия городских ландшафтов. Москва: изд-во Московского ун-та. 1995. 327 с.
Заядан Б.К., Маторин Д.Н. Биомониторинг водных экосистем на основе микроводорослей. Москва: Альтекс. 2015. 252 с.
Маторин Д.Н., Тодоренко Д.А., Сейфуллина Н.Х., Заядан Б.К., Рубин А.Б. Влияние наночастиц серебра на параметры флуоресценции хлорофилла и реакции Р700 зеленой водоросли Chlamydomonas reinhardtii // Микробиология. 2014. Т. 83. С. 33.
Strasser R.J., Tsimilli-Michael M., Srivastava A. Analysis of the chlorophyll a fluorescence transient. In Chlorophyll a Fluorescence: A Signature of Photosynthesis. Advances in Photosynthesis and Respiration; Papageorgiou, G., Govindjee, Eds.; Springer: Dordrecht // The Netherlands. 2004. V. 19. P. 321.
Маторин Д.Н., Рубин А.Б. Флуоресценции хлорофилла высших растений и водорослей. Москва–Ижевск ИКИ-РХД. 2012. 256 с.
Гольцев В.Н., Каладжи М.Х., Кузманова М.А., Аллахвердиев С.И. Переменная и замедленная флуоресценция хлорофилла a – теоретические основы и практическое приложение в исследовании растений. Москва–Ижевск: Институт компьютерных исследований. 2014. 220 с.
Lazár D., Schansker G. Models of chlorophyll a fluorescence transients // Photosynthesis in silico. Springer Netherlands. 2009. P. 85.
Strasser R.J., Tsimilli-Michael M., Qiang S., Goltsev V. Simultaneous in vivo recording of prompt and delayed fluorescence and 820-nm reflection changes during drying and after rehydration of the resurrection plant Haberlearhodopensis // Biochim. Biophys. Acta. 2010. V. 1797. P. 1313.
Oukarroum A., Goltsev V., Strasser R.J. Temperature effects on pea plants probed by simultaneous measurements of the kinetics of prompt fluorescence, delayed fluorescence and modulated 820 nm reflection // Plos one. 2013. V. 8. P. 1. https://doi.org/10.1371/journal.pone.0059433
Заядан Б.К., Акмуханова Н.Р., Садвакасова А.К. Каталог коллекции культур микроводорослей и цианобактерий. Алматы: “Абзал-Ай”. 2017. 135 с.
Spurr A.R. A low-viscosity epoxy resin embedding medium for electron microscopy // J. Ultrastruct. Res. 1969. V. 23. P. 31.
Akira S., Litiana Q.V., Norihide K., Shigetoh M. Evaluation of the sensitivity of marine microalgal strains to the heavy metals, Cu, As, Sb, Pb and Cd // Environ. Int. 2005. V. 31. P. 713.
Mallick N., Mohn F.H. Use of chlorophyll fluorescence in metal-stress research: a case study with the green microalga Scenedesmus // Ecotoxicol. Environ. Saf. 2003. V. 55. P. 64.
Ji Y., Xie X., Wang G. Effects of the heavy metal cadmium on photosynthetic activity and the xanthophyll cycle in Phaeodactylum tricornutum // J. Oceanol. Limnol. 2018, V. 36. P. 2194.
Naorbe M.C., SerranoA.E. Effects of heavy metals on cell density, size, specific growth rate and chlorophyll a of Tetraselmis tetrathele under controlled laboratory conditions // AACL Bioflux. 2018. V. 11. P. 589.
Плеханов С.Е., Чемерис Ю.К. Ранние эффекты токсического действия цинка, кобальта, кадмия на фотосинтетическую активность водоросли Chlorellapyrenoidosa Chick S-39 // Известия РАН. Сер. биол. 2003. Т. 5. С. 610.
Ипатова В.И. Адаптация водных растений к стрессовым абиотическим факторам среды. М.: Графикон-принт. 2005. 224 с.
Xu S., Miao A., Xiao L., Yang L. Cadmium Toxicity to Microcystis aeruginosa PCC 7806 and Its Microcystin-Lacking Mutant Bin Huang // Plos one. 2015. https://doi.org/10.1371/journal.pone.0116659
Surosz W., Palinska K. A. Ultrastructural changes induced by selected cadmium and copper concentrations in the cyanobacterium Phormidium: interactionwith salinity // J. Plant Physiol. 2000. V. 157. P. 643.
Попова А.Ф., Паршикова Т.В., Кемп Р. Влияние катамина на структурно-функциональные характеристики клеток ChlamydomonasreinhardtiiDang // Альгология. 2004. Т. 14. С. 229.
Реунова Ю.А., Айздайчер Н.А., Христофорова Н.К., Реунов А.А. Влияние селена на рост и ультраструктуру морской одноклеточной водоросли Dunaliella salina (Chlorophyta) // Рус. жур. морской биологии. 2007. Т. 33. С. 125.
Nishikawa K., Yamakoshi Y., Uemura I., Tominaga N. Ultrastructural changes in Chlamydomonas acidophila (Chlorophyta) induced by heavy metals and polyphosphate metabolism // FEMS Microbiol. Ecol. 2003. V. 44. P. 253.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


