Физиология растений, 2020, T. 67, № 5, стр. 451-469
Хлоридные каналы и транспортеры семейства CLC у растений
О. И. Неделяева a, *, А. В. Шувалов a, Ю. В. Балнокин a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: olga.nedelyaeva@yandex.ru
Поступила в редакцию 06.02.2020
После доработки 16.03.2020
Принята к публикации 17.03.2020
Аннотация
Белки семейства хлоридных каналов CLC (ChLoride Channel) обнаружены у прокариот и эукариот. Семейство включает анионные каналы и анион/протонные антипортеры. В растениях белки CLC обнаруживаются в разных тканях и разных внутриклеточных мембранах. Белки CLC выполняют множество функций и играют важную роль в ключевых физиологических процессах, таких как нитратное и хлоридное гомеостатирование, проявляющееся как на уровне клетки, так и целого растения, регуляция трансмембранного электрического потенциала мембран органелл и рН их люменов, участие в распределении de novo синтезированных белков по внутриклеточным компартментам, формирование механизмов, лежащих в основе устойчивости растений к стрессовым факторам биотической и абиотической природы и ряде других процессов. В обзоре приводится информация об известных на сегодняшний день белках CLC растений, гены которых идентифицированы на молекулярно-генетическом и функциональном уровнях, приводятся и обсуждаются данные о белках CLC из Arabidopsis thaliana и других видов растений с акцентом на результаты, полученные в последнее десятилетие. Рассматриваются функциональные и структурные аспекты растительных CLC-белков, их физиологическая роль в нормальных и стрессовых условиях. Приводится гипотеза об участии эндосом и локализованных в эндосомальных мембранах белках семейства CLC в анионном гомеостатировании цитоплазмы. Кратко рассматриваются возможные направления дальнейших исследований семейства CLC растений.
ВВЕДЕНИЕ
Название семейства хлоридных каналов (CLC – ChLoride Channel) произошло от первого открытого белка этого семейства CLC-0, обнаруженного в электрическом органе ската Torpedo californica и оказавшегося потенциал-зависимым хлоридным каналом [1]. Долгое время считалось, что белки этого семейства участвуют только в пассивном транспорте хлорид-иона, то есть как и CLC-0 являются хлоридными каналами. Клонирование похожих генов из других организмов и исследование функций кодируемых ими белков путем экспрессии в ооцитах шпорцевой лягушки [2] привело к открытию многих родственных генов [3]. Обнаружили, что семейство CLC включает не только анионные каналы, но и анион/протонные антипортеры. Последние могут осуществлять вторично-активный транспорт анионов в обмен на протоны, используя в качестве источника энергии градиент электрохимического потенциала протонов.
Белки семейства хлоридных каналов являются мембранными интегральными белками, которые включают 10−12 трансмембранных доменов [4]. Все эукариотические CLC содержат два гидрофильных регуляторных CBS-домена (цистатионин-β-синтетазных домена) [5]. Еще одной особенностью белков семейства CLC является наличие трех аминокислотных мотивов, участвующих в формировании анион-проводящего пути: (1) GxGxPE, (2) GKxGPxxH, (3) PxxGxLF [6–8]. Мотив (1) является селективным фильтром [8, 9]. Присутствие в нем серина (GSGxPE) определяет его хлоридную специфичность [10, 11], а пролина (GPGxPE) – нитратную специфичность [12, 13]. Анион/протонным антипортерам свойственно наличие двух ключевых консервативных глутаматов − “воротного” и “протонного”. У Escherichia coli воротный и протонный глутаматы занимают положения 148 (E148) и 203 (E203) соответственно [9, 14]. Воротный глутамат отвечает за воротный процесс, контролирующий его ионную проводимость [9]. У анионных каналов этого семейства может присутствовать лишь один, а именно воротный глутамат. Протонный глутамат участвует в сопряжении переноса аниона с противоположно направленным транспортом протона [14]. Воротный глутамат находится в мотиве (2) – GKEGPxxH. Протонный глутамат расположен в четвертой позиции, следующей за мотивом (3) – PxxGxLFxxxE [4]. Белки CLC могут функционировать в мономерной и гомодимерной формах. Каждый мономер образует ион-проводящий путь [5].
Представители семейства CLC широко распространены среди организмов, они найдены у прокариот, грибов, животных и растений. Девять представителей этого семейства обнаружено у млекопитающих [15], семь найдено у Arabidopsis thaliana [7]. Цитрусовые, соя, кукуруза, рис и тополь содержат в своих геномах от 5 до 9 генов СLC [16]. Семнадцать генов CLC идентифицировано у Nicotiana tabacum [17] и 22 гена у Brassica napus [18].
Филогенетический анализ последовательностей белков семейства СLC у растений показывает, что бóльшая часть известных белков этого семейства образует “эукариотическую” ветвь. Остальные белки CLC растений в наибольшей степени родственны бактериальным CLC и формируют далеко отстоящую от эукариот “прокариотическую” ветвь. На рис. 1 представлена дендрограмма, построенная нами на основе последовательностей белков CLC, кодируемых клонированными из растений генами. Обе ветви присутствуют на дендрограмме, как и в работе [19].
Рис. 1.
Филогенетическое дерево, иллюстрирующее степень сходства между белками семейства CLC S. cerevisiae, E. coli и растений (A. thaliana, O. sativa, N. tabacum, G. max, Z. mays, P. trifoliate, T. halophila, S. altissima). EcCLCA (P37019), E-cCLCB (P76175.2), Gef1p (P37020.2), AtCLCa (NP_198905.1), AtCLCb (NP_189353.1), AtCLCc (NP_199800.1), AtCLCd (NP_197996.1), AtCLCe (NP_001190924.1), AtCLCf (Q8RXR2.2), AtCLCg (NP_198313.2), NtCLC1 (NP_001312418.1), NtCLC2 (AAD29679.1), OsCLC-1 (BAB97267.1), OsCLC-2 (BAB97268.1), GmCLC1 (AAY43007.1), GmCLCb1 (KRH06955.1), GmCLCb2 (XP_003553925.1), GmCLCc1 (XP_003533268.2), GmCLCc2 (XP_006599656.1), GmCLCd1 (XP_003517583.1), GmCLCd2 (XP_006590397.1), GmCLCg (XP_003542650.1), ZmCLCc (AAP04392.2), ZmCLCd (AGR03817.1), PtrCLC1 (Cs2g25150), PtrCLC2 (Cs3g03450), PtrCLC3 (Cs4g05340), PtrCLC4 (Cs4g07570), PtrCLC5 (Cs9g06580), PtrCLC6 (orange1.1t03372), ThCLC-a (ADD09860.1), SaCLCa1 (ANG09048.1), SaCLCc1 (AVQ93350.1). Все последовательности белков взяты из NCBI, за исключением последовательностей P. trifoliate, полученных из базы данных (http://citrus.hzau.edu.cn/cgi-bin/orange/search). Подгруппа I – “эукариотическая” ветвь, подгруппа II – “прокариотическая” ветвь. Филогенетическое дерево построили в программе MEGA X v. 10.0.1 (https://www.megasoftware.net/) методом максимального правдоподобия, основанном на модели Джонса-Тейлора-Торнтона. Проведено 100 бутсреп-репликаций, в узлах указаны значения бутстреп-поддержки.

Являясь анионными каналами и анион/протонными антипортерами, белки семейства CLC участвуют во множестве процессов и физиологических функций. О важной роли белков CLC свидетельствуют генетические болезни млекопитающих, вызываемые нарушениями в первичной структуре генов CLC, такие, например, как идиопатическая эпилепсия, синдром Баттера, болезнь Дента, остеопетроз и многие виды миопатии [3]. У растений белки CLC вовлечены в устьичные движения, в транспорт анионов из цитоплазмы в вакуоль, осморегуляцию и поддержание тургора, формирование устойчивости к биотическим и абиотическим стрессам. Так же как представители CLC других царств, CLC растений играют важную роль в везикулярном транспорте, регулируя рН люменов органелл и их мембранный потенциал [20, 21].
Лучше всего изучены белки семейства CLC у млекопитающих. Данные о них представлены в ряде исчерпывающих обзоров [15, 22–25]. Меньше известно о представителях семейства CLC растений. Вместе с тем за время, прошедшее после опубликования последних обзоров, посвященных семейству CLC растений [7, 26], о нем появилось много новой информации. Значительная часть новых данных традиционно получена с использованием модельного растения A. thaliana. Наряду с этим существенно увеличился перечень видов растений, у которых представители CLC идентифицированы на молекулярно-генетическом и функциональном уровнях. Полученная за это время информация о семействе CLC растений нуждается в систематизации и обобщении, что и явилось мотивацией для написания данного обзора. В настоящем обзоре приводятся и обсуждаются данные о белках семейства CLC из A. thaliana и других видов растений с акцентом на результаты, полученные в последнее десятилетие. Рассматриваются функциональные и структурные аспекты растительных CLC-белков, их физиологическая роль в нормальных и стрессовых условиях.
СЕМЕЙСТВО БЕЛКОВ CLC У ARABIDOPSIS THALIANA
Семейство CLC у A. thaliana включает 7 белков, которые локализованы во внутриклеточных мембранах: AtCLCa, AtCLCb, AtCLCc, AtCLCd, AtCLCe, AtCLCf и AtCLCg [27–29] (рис. 2.). Уровень экспрессии генов AtCLCa-g в значительной степени зависит от ткани и органа растения, а также от стадии его развития [19]. Почти все представители семейства AtCLC экспрессируются в сосудистых тканях, что предполагает участие этих белков в дальнем транспорте ионов [19]. Исключением являются AtCLCc и AtCLCe. AtCLCc экспрессируется преимущественно в замыкающих клетках устьиц [19, 30], а AtCLCe – в фотосинтезирующих тканях [19]. AtCLCa-AtCLCc и AtCLCg локализованы в вакуолярных мембранах [19, 29–32], AtCLCe – в тилакоидах хлоропластов [28], а AtCLCd и AtCLCf – в аппарате Гольджи [19, 20, 28].
Рис. 2.
Внутриклеточная локализация белков семейства CLC у A. thaliana (по [7] с изменениями). Все белки семейства CLC локализованы во внутриклеточных мембранах: AtCLCa-c и AtCLCg – в тонопласте, AtCLCd и AtCLCf – в мембранах АГ, AtCLCe – в тилакоидах.
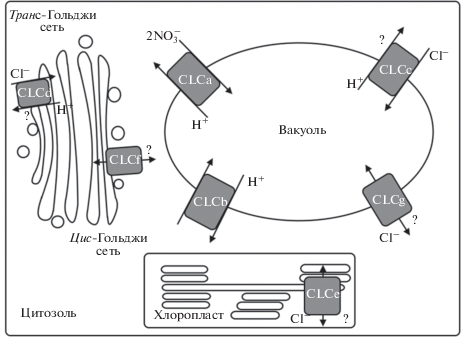
Функции белков семейства CLC у A. thaliana остаются до конца не выясненными. Транспорт анионов и анионная селективность в прямых экспериментах продемонстрированы только для двух представителей этого семейства – AtCLCa и AtCLCb [31, 32]. В аминокислотных последовательностях AtCLCa-AtCLCd содержатся оба консервативных глутамата, как протонный, так и воротный [26]. AtCLCg содержит только протонный глутамат, а AtCLCe и AtCLCf – только воротный глутамат. Это дает основание предположить, что AtCLCa-AtCLCd функционируют как анион/протонные антипортеры, а у AtCLCe-AtCLCg – другой механизм транспорта анионов [19, 26]. Ниже приведено подробное описание каждого представителя семейства CLC у A. thaliana.
AtCLCa был первым исследованным на функциональном уровне потенциал-зависимым ${\text{NO}}_{3}^{ - }$/H+-антипортером семейства хлоридных каналов у A. thaliana [31, 33].
На растениях дикого типа (ДТ) и нокаут-мутантах clca методом локальной фиксации потенциала на выделенных вакуолях был продемонстрирован перенос анионов через мембрану белком AtCLCa. Перенос анионов был сопряжен со встречным потоком протонов, стехиометрия ${\text{NO}}_{3}^{ - }$/H+ обмена составляла 2 : 1. Селективность AtCLCa убывала в ряду ${\text{NO}}_{3}^{ - }$ ≈ I– > Br– > Cl– > ${\text{SO}}_{4}^{{2 - }}$ > глутамат. AtCLCa транспортировал ${\text{NO}}_{3}^{ - }$ в вакуоль при физиологических значениях мембранного потенциала и концентрациях ${\text{NO}}_{3}^{ - }$ в цитозоле (–40…–20 мВ и 4.2–19.2 мМ соответственно) [31].
Методом локальной фиксации потенциала также показано, что замена воротного глутамата Glu-203 AtCLCa на аланин (E203A) путем сайт-направленного мутагенеза привела к разобщению анион/H+-проводимости. Транспорт аниона у этого мутанта не сопровождался транспортом H+ [12]. Замещение протонного глутамата Glu-270 аланином (E270A) привело к прекращению переноса ионов AtCLCa [12]. Однако замена обеих аминокислот в последовательности белка AtCLCa (E203A, E270A) привела к тому же эффекту, что и замена только воротного глутамата. Транспорт Сl–, разобщенный с переносом H+, у белка A-tCLCa (E203A, E270A) восстанавливался [12]. Предполагается, что Glu-270 важен для транспорта и аниона, и протона [7]. Пролин в положении 160 отвечает за нитратную селективность белка AtCLCa и его проводимость. Замена пролина у AtCLCa на серин в положении 160 привела к изменению селективности белка. AtCLCa(P160S) транспортировал Сl– с большей эффективностью, чем ${\text{NO}}_{3}^{ - }$ [13]. Результаты цитированных работ указывают на вовлечение AtCLCa в ${\text{NO}}_{3}^{ - }$ гомеостаз и pH-статирование цитоплазматического и вакуолярного компартментов, а также на участие ключевых глутаматов и мотива селективного фильтра в регуляции анион/протонного обмена через тонопласт.
На важную функциональную роль белка AtCLCa указывают результаты исследования экспрессии и активности промотора его гена. AtCLCa экспрессируется во всех органах и на всех стадиях онтогенеза A. thaliana. Наибольший уровень транскрипции гена наблюдается в листьях. Показано, что количество транскриптов AtCLCa было наибольшим у 2-недельных растений и заметно снижалось с их возрастом [19]. Активность промотора AtCLCa, измеренная с помощью репортерного фермента β‑глюкуронидазы, проявлялась уже у проростков A. thaliana и обнаруживалась во всех органах взрослых растений [19]. Наибольшая активность промотора гена была найдена в устьичных клетках семядолей и зрелых листьях [34].
Экспрессия AtCLCa в 5–10 раз выше экспрессии остальных генов семейства AtCLC [32]. Количество транскриптов AtCLCa возрастает в корнях и надземных органах в ответ на добавление нитрата в среду культивирования [32, 33]. Экспрессия AtCLCa изменяется в течение суток. На протяжении почти всего темнового периода количество транскриптов AtCLCa было в 2–3 раза больше, чем в световой период. Предполагается, что AtCLCa участвует в запасании нитрат-иона в вакуолях в течение ночи, когда восстановление ${\text{NO}}_{3}^{ - }$ подавлено [32].
Помимо регуляции экспрессии гена AtCLCa на транскрипционном уровне имеются данные о регуляции активности этого транспортера некоторыми метаболитами. Фосфатидилинозитол-3,5-бисфосфат (PI(3,5)P2) подавляет активность AtCLCa, что стимулирует закисление вакуолярного люмена [36]. Методом локальной фиксации потенциала на выделенных из клеток A. thaliana вакуолях продемонстрировано, что АТФ обратимо ингибирует транспортную активность AtCLCa. АДФ и АМФ не подавляют активность AtCLCa. С-конец белка AtCLCa, обращенный в цитозоль и содержащий два CBS-мотива, участвует в узнавании и связывании АТФ. Однако АМФ конкурирует с АТФ за сайт связывания AtCLCa, препятствуя ингибиторному эффекту АТФ. Подобного эффекта не обнаружено для АДФ. Аффинность нуклеотидов к белку AtCLCa убывает в ряду АТФ ≈ АМФ > АДФ. Сайт-направленный мутагенез AtCLCa, приводящий к замене аспартата на аланин (D753A), полностью нивелировал ингибиторный эффект АТФ, что свидетельствует о непосредственном участии аспартата в положении 753 в регуляторном связывании с АТФ. Таким образом, размер запасного пула нитрата, определяемого активностью AtCLCa, может регулироваться изменением отношения АТФ/АМФ, которое определяется скоростью метаболических процессов, например, фотосинтеза и ассимиляции нитрата [37].
AtCLCa принимает непосредственное участие в ближнем транспорте нитрата, осуществляя перенос этого аниона из цитоплазмы в вакуоль, а также в накоплении нитрата в целом растении. Нокаут-мутанты clca обладают ярко-выраженным фенотипом. Содержание нитрата при стандартной концентрации этого аниона в питательной среде (10−50 мМ) в корнях и надземных органах мутантов было в 2 раза ниже, а содержание нитрита и малата в 1.5–2 раза выше, чем у растений ДТ [33, 38]. Мутация clca приводит к перераспределению нитрата между внутриклеточными компартментами. Накопление нитрата снижается в вакуоли, и, соответственно, увеличивается концентрация ${\text{NO}}_{3}^{ - }$ в цитозоле клеток [39]. Предполагается, что увеличение содержания нитрата в клетках корня является индуктором экспрессии нитратного транспортера AtNRT1.5, участвующего в загрузке нитрата в ксилему, и подавляет экспрессию AtNRT1.8, отвечающего за обратное поступление нитрата в клетку из ксилемы [39]. В результате изменения экспрессии этих генов увеличивается содержание нитрата в ксилемном соке и в цитозоле клеток надземных органов мутанта clca, что вызывает повышение активности нитратредуктазы и глутаминсинтетазы. Повышение активности этих ферментов, в свою очередь, приводит к возрастанию эффективности утилизации азота (NUE – Nitrogen Use Efficiency) у мутантов clca по сравнению с растениями ДТ [18, 39] (рис. 3). Наряду с этим в корнях мутанта clca подавляется экспрессия генов нитратных транспортеров AtNPF6.3(NRT1.1), AtNRT2.1 и AtNRT-2.5, отвечающих за поглощение нитрата из почвы, что может быть следствием повышения концентрации нитрата и/или нитрита в цитозоле клеток корня [38].
Рис. 3.
Гипотеза, объясняющая участие транспортера AtCLCa в дальнем транспорте нитрата (по [39] с изменениями). AtCLCa отвечает за ближний транспорт нитрата, регулируя его распределение между вакуолью и цитозолем. Транспортеры AtNRT1.5 и AtNRT1.8 осуществляют транспорт нитрата в ксилему и из ксилемы, соответственно. При повышении концентрации ${\text{NO}}_{3}^{ - }$ в цитоплазме AtNRT1.5 загружает нитрат в ксилему, при снижении цитоплазматической концентрации ${\text{NO}}_{3}^{ - }$ последний переносится из ксилемы в цитоплазму белком AtNRT1.8. Обозначения: НР – нитратредуктаза, ГС – глутаминсинтетаза.

Мутация clca приводит к изменению уровней экспрессии остальных генов семейства CLC, что, вероятно, связано с потребностью восстановить ионный баланс тканей. Экспрессия AtCLCb-AtCLCd, AtCLCf и AtCLCg возрастает в 2−10 раз, а экспрессия AtCLCe в 2−3 раза снижается. Механизмы, лежащие в основе зависимости экспрессии генов CLC и нитратных транспортеров от экспрессии AtCLCa, остаются невыясненными [38].
AtCLCa осуществляет не только компартментацию нитрата в вакуолях. Wege с соавторами показали, что во время закрывания устьиц, происходящего в ответ на действие АБК, через AtCLCa происходит обратный выход анионов из вакуоли в цитозоль [34]. Направление переноса ${\text{NO}}_{3}^{ - }$ (вход/выход) через белок AtCLCa зависит от фосфорилирования/дефосфорилирования треонина в положении 38 (Thr38) на N-конце AtCLCa, обращенном в цитоплазму. Thr38 является основной мишенью киназы OST1 (Open Stomata1 kinase) и необходим для модуляции активности AtCLCa в ответ на действие АБК. Фосфорилирование Thr38 киназой OST1 приводит к увеличению выходящего анионного тока через вакуолярную мембрану, что является необходимым условием для закрывания устьиц [34]. В этой работе, а также в фосфопротеомном исследовании [40] обнаружен второй сайт фосфорилирования AtCLCa (Ser40) на N-конце, расположенный рядом с первым. Однако до настоящего времени функция Ser40 не определена.
Направление анионного транспорта через AtCLC-a может регулироваться фосфатазой PP2A (Protein Phosphatase 2A). Показано взаимодействие каталитической субъединицы С5 этого фермента с AtCLCa [41]. Таким образом, AtCLCa осуществляет транспорт нитрата через тонопласт в двух направлениях: из цитоплазмы в вакуоль и из вакуоли в цитоплазму в зависимости от потребности клетки. Это означает, что физиологическая роль AtCLCa не сводится к созданию вакуолярного нитратного пула, этот белок участвует также в реутилизации накопленного ранее в вакуолях нитрата [42, 43]. AtCLCa также важен для регуляции устьичных движений, как открывания, так и закрывания устьиц.
AtCLCb – второй ${\text{NO}}_{3}^{ - }$/Н+-антипортер тонопласта, осуществляющий перенос нитрата через тонопласт. По аминокислотной последовательности AtCLCb в наибольшей степени сходен с AtCLCa [32].
Исследование экспрессии AtCLCb и активности промотора этого гена показало, что паттерны экспрессии AtCLCb отчасти совпадают с таковыми AtCLCa. Однако AtCLCb экспрессируется преимущественно на ранних стадиях развития растений. Наибольшая экспрессия наблюдается в гипокотиле, семядолях и корнях проростков, а также лепестках и тычиночных нитях цветков растений [19, 32].
Повышение концентрации нитрата в питательной среде приводит к небольшой индукции экспрессии AtCLCb [32]. Экспрессия AtCLCb значительно изменяется в течение суток. Количество транскриптов гена постепенно возрастает на протяжении всего темнового периода, достигая максимального значения в предрассветные часы (увеличивается в 20 раз), и затем снижается в течение светового периода до исходного уровня. Это может быть связано с участием AtCLCb в транспорте накопленного в течение ночи нитрата из вакуоли в цитоплазму для последующей ассимиляции этого аниона в световой период [32].
С помощью метода локальной фиксации потенциала было показано, что перенос анионов через AtCLCb сопряжен с противоположно направленным током протонов. Анионная проводимость AtCLCb убывает в ряду ${\text{NO}}_{3}^{ - }$ > Br– > Cl– > малат– = = I– [32].
Нокаут-мутанты clcb не отличаются от растений ДТ по морфологическим признакам и содержанию ионов при выращивании растений на средах с разным ионным составом и при разной продолжительности фотопериода. На основании того, что у мутанта clcb повышена экспрессия гена AtCLCa [32], можно предположить, что отсутствие белка AtCLCb компенсируется бóльшим количеством AtCLCa. Вероятно, белок A-tCLCb, как и AtCLCa, участвует в накоплении нитрата в вакуолях [32].
По-видимому, активность AtCLCb модулируется путем фосфорилирования/дефосфорилирования аминокислотной последовательности. Показано, что серин в положении 39 (S39) на N-конце AtCLCb является сайтом фосфорилирования [40]. Необходимо также отметить присутствие треонина в аминокислотной последовательности AtCLCb в положении 37 (Thr37), аналогичного Thr38 белка AtCLCa. Очень вероятно, что Thr37 AtCLCb, так же как Thr38 AtCLCa, является сайтом фосфорилирования протеинкиназы OST1 [34]. В работе [41] выявлено взаимодействие AtCLCb с субъединицей С5 фосфатазы PP2A. Вышеприведенные данные дают основание предположить, что AtCLCb, как и AtCLCa, может переносить нитрат в двух направлениях, регулируя его концентрацию в вакуоли и цитозоле в зависимости от внешних факторов, потребностей и физиологического состояния растительного организма. По-видимому, два ${\text{NO}}_{3}^{ - }$/Н+-антипортера тонопласта AtCLCa и AtCLCb могут функционально замещать друг друга.
AtCLCc – хлоридный транспортер тонопласта, локализованный преимущественно в устьичных клетках [30]. Обнаружено, что AtCLCc играет важную роль в регуляции движения устьиц, солеустойчивости растений и, вероятно, может участвовать в гомеостазе нитрата [30, 45]. Показано, что AtCLCc экспрессируется преимущественно в клетках устьиц и пыльце. Обработка эпидермы листьев АБК индуцирует экспресcию AtCLCc как в клетках эпидермы, так и в замыкающих клетках устьиц [30].
Нокаут-мутанты clcc (Col-0, Ws) отличаются нарушенной регуляцией устьичной проводимости при действии света и АБК. После 2 ч освещения апертура устьиц у мутантов была на треть меньше, чем у растений ДТ. Обработка АБК не приводила к закрыванию устьиц у мутанта. Вследствие нарушения регуляции движения устьиц температура листьев у clcc была выше, чем у растений ДТ. Содержание Cl– в клетках устьиц у мутанта было меньше, по сравнению с таковым у растений ДТ [30].
Мутация clcc не влияет на развитие растений и их морфологию, а также на фертильность пыльцы. Однако мутанты clcc характеризуются повышенной чувствительностью к NaCl [30]. Надземные органы мутантных растений при засолении содержали больше хлорид-иона, чем растения ДТ [29].
QTL-анализ (Quantitative Trait Loci), направленный на поиск локусов хромосом, ответственных за накопление нитрата, показал, что AtCLCc может участвовать в гомеостазе этого аниона [45]. В подтверждение этому в побегах растений clcc A. thaliana экотипа No-0 было снижено содержание ${\text{NO}}_{3}^{ - }$ и цитрата и увеличено содержание малата [45].
Белок AtCLCc (Col-0) содержит 2 сайта фосфорилирования, в частности серины S27 и S672 на N- и C-концах, соответственно [40, 46]. Фосфорилирование S672 индуцировалось обработкой растений хлористым натрием [46]. Показано также взаимодействие N- (1-92) и C-(562-779) концевых частей белка AtCLCc с субъединицей С5 фосфатазы PP2A [41], что предполагает регуляцию активности AtCLCc за счет фосфорилирования/дефосфорилирования его аминокислотной последовательности.
AtCLCd был первым анионным транспортером растений, который обнаружили в компартментах, участвующих в эндоцитозном мембранном трафике. Показано, что AtCLCd находится в мембранах транс-Гольджи сети, где он колокализован с Н+-АТФазой V-типа, [19, 20, 27, 28]. Наиболее вероятно, AtCLCd вовлечен в регуляцию рН и концентрации хлорида в люмене транс-Гольджи сети и поздних эндосом. Предполагается, что этот белок участвует в транспорте Cl– в эндосомальный люмен для компенсации накапливающихся там положительных зарядов вследствие функционирования H+-АТФазы и стимулирует этим закисление люмена, которое необходимо для эндоцитозного и секреторного процессов [20].
Активность промотора гена AtCLCd наблюдалась во всех органах и тканях, уровень активности промотора зависел от стадии развития и органа растений. Наиболее заметной активность промотора AtCLCd была в корнях и семядолях проростков, гидатодах и цветках, особенно в пыльниках и пыльце [20]. С помощью вестерн-блоттинга белок AtCLCd детектировали во всех органах, наибольшее количество этого белка было в стручках [27].
Нокаут-мутанты clcd не отличаются от растений ДТ по морфологии, ростовым параметрам и содержанию ионов при разных концентрациях Cl– и ${\text{NO}}_{3}^{ - }$ в среде. Однако рост корней мутантов подавляется на слабо кислых средах (рН 6.8−6.2). Мутанты clcd характеризуются повышенной чувствительностью к блокатору Н+-АТФазы V-типа конканамицину А [20].
Обнаружено, что AtCLCd выполняет роль негативного регулятора PAMP-индуцируемого (Pathogen-Associated Molecular Pattern) иммунитета растений, по-видимому, за счет участия в трафике рецептора FLS2 (Flagellin-Sensitive 2) [47]. Мутанты clcd отличались большей устойчивостью к вирулентному штамму бактерий Pseudomonas syringae. Мутация clcd приводила к усиленным ранним и поздним ответам при действии элиситоров (flg22, elf18 или хитина). Обработка элиситорами привела к повышению уровня АФК в тканях и большему отложению каллозы у мутанта clcd по сравнению с растениями ДТ. Вместе с этим, экспрессия PAMP-индуцируемых генов (FRK1 – Flg22-induced Receptor-like Kinase 1, At1g51890, At2g17740), а также гена позднего ответа (PR1 – Pathogenesis-Related gene 1) значительно возрастала у мутанта clcd после обработки flg22 по сравнению с растениями ДТ. Сверхэкпрессия AtCLCd в растениях A. thaliana привела к противоположным эффектам, растения становились более восприимчивыми к действию патогена. Показано, что экспрессия AtCLCd регулируется сигнальными комплексами, включающими PAMP-распознающий рецептор FLS2 и киназы SERK3 и SERK4 (Somatic Embryogenesis Receptor-like Kinase). Связывание элиситоров с этими комплексами приводит к подавлению экспрессии как AtCLCd, так и остальных представителей семейства CLC A. thaliana [47].
AtCLCe локализован в тилакоидных мембранах хлоропластов [28]. Исследование флуоресценции хлорофилла у мутантов clce и растений ДТ выявило участие белка AtCLCe в световых реакциях фотосинтеза [19, 28]. При этом мутация clce не влияла на параметры роста растений [28]. Исследования кинетики индукции флуоресценции и темновой релаксации возбужденного состояния хлорофилла a продемонстрировали у мутанта clce лишь незначительные изменения в свето-зависимом переносе е– в ЭТЦ хлоропластов. У мутантов, однако, наблюдались изменения в соотношении электрической (Δψ) и химической (ΔрН) составляющих протондвижущей силы (Δρ), которая формировалась на свету, а также нарушения в ультраструктуре хлоропластов [48]. Авторы высказали предположение, что AtCLCe участвует в экспорте хлорид-иона из тилакоидного люмена при переходе от условий освещения к темноте и играет лишь второстепенную роль в транспорте Сl– в люмен тилакоидов в световых реакциях фотосинтеза [48].
Кроме того, имеются данные, свидетельствующие об участии белка AtCLCe в гомеостазе нитрата. Мутация clce приводит к фенотипическим проявлениям, сходным с таковыми у мутантных растений clca. Мутанты clce характеризуются пониженным содержанием нитрата и повышенным содержанием нитрита и малата по сравнению с растениями ДТ. На возможное участие белка AtCLCe в гомеостазе нитрата указывают также данные, которые были получены при поиске у A. thaliana локусов хромосом, ответственных за накопление нитрата (QTL-анализ) [45]. Тем не менее функции белков AtCLCa и AtCLCe не дублируют друг друга, на что указывает участие AtCLCe в процессах ионного гомеостатирования тилакоидов [38]. Ген AtCLCe экспрессируется, главным образом, в надземных органах – листьях, розетках и стручках. Уровень экспрессии AtCLCe сопоставим с уровнем экспрессии AtCLCf и значительно ниже, чем уровень экспрессии генов AtCLCa-AtCLCd [19, 38]. Высказано предположение, что существует взаимодействие (“cross-talk”) между генами AtCLCe, AtCLCa и генами семейств нитратных транспортеров [38].
AtCLCf локализован преимущественно в цис-Гольджи компартментах и в меньшем количестве – в транс-Гольджи сети [28]. Комплементация геном AtCLCf мутантного штамма дрожжей Saccharomyces cerevisiae Δgef1 (мутант по единственному гену семейства CLC в этом организме, кодирующему Cl– транспортер Gef1p) показала, что продукт гена AtCLCf также, по-видимому, транспортирует хлорид-ионы [28]. AtCLCf экспрессируется во всех органах A. thaliana [19]. Согласно результатам этой же работы, содержание транскриптов гена AtCLCf в органах зависит от возраста растений, оно увеличивается в ходе онтогенеза. Предполагается участие этого белка во внутриклеточном везикулярном трафике через его вовлечение в ионное гомеостатирование аппарата Гольджи и транс-Гольджи сети. Функция AtCLCf может отчасти совпадать с функцией AtCLCd [28]. Наряду с этим, имеются данные QTL-анализа, свидетельствующие о возможном участии продукта гена AtCLCf в накоплении нитрата у A. thaliana [45]. A-tCLCf остается наименее изученным на сегодняшний день белком семейства AtCLC, не до конца выяснены его транспортная функция и физиологическая роль.
AtCLCg локализован в тонопласте и может участвовать в депонировании Сl– в вакуоли при солевом стрессе [19, 29]. Нокаут-мутанты по этому гену имеют ярко выраженный фенотип. Параметры роста – сырая масса, длина корня, количество боковых корней – у мутантов clcg снижены по сравнению с растениями ДТ при выращивании на засоленных средах. Мутанты накапливают больше Сl– в надземных органах и SO42- в корнях в условиях засоления [29].
AtCLCg по аминокислотной последовательности наиболее сходен с AtCLCc. Экспрессия AtCLCg подавляется в мутанте clcc, и наоборот, экспрессия AtCLCс снижается в мутанте clcg, что предполагает взаимодействие этих генов [29]. Физиологические функции белков AtCLCg и AtCLCс не дублируют друг друга, каждый из них вносит свой специфический вклад в солеустойчивость растения: двойной мутант clccclcg не отличается повышенной чувствительностью к NaCl по сравнению с мутантами по одному из генов, clcc или clcg [29].
Наибольшая активность промотора AtCLCg наблюдается в клетках мезофилла, флоэме, в клетках паренхимы зоны корневых волосков, гидатодах и прилегающих к ним зонах листовой пластинки. Высокая активность промотора AtCLCg в гидатодах может свидетельствовать об участии AtCLCg в экскреции Cl–-ионов во внешнюю среду в условиях засоления. Наличие активности промотора гена в клетках флоэмы наряду с высоким содержанием хлорида в побегах мутантов дают основание предположить, что AtCLCg может быть вовлечен в рециркуляцию Cl–. Возможно также участие этого белка в загрузке ксилемы хлоридом. AtCLCg в клетках паренхимы корня, расположенных в зоне корневых волосков, может регулировать цитозольную концентрацию Cl– и способствовать компартментации этого аниона в вакуоли в условиях засоления [29].
СЕМЕЙСТВО CLC БЕЛКОВ У ДРУГИХ РАСТЕНИЙ
Полноразмерные последовательности генов семейства CLC клонированы не только из A. thaliana, но также и из ряда других растений: табака (Nicotiana tabacum) [21, 49, 50], риса (Oryza sativa) [51, 52], сои (Glycine max) [16, 53], (Glycine soja) [16], кукурузы (Zea mays) [54–56], понцируса трехлисточкового (Poncirus trifoliate) [57, 58], солеисключающего галофита Thellungiella halophila [59] и э-угалофита Suaeda altissima [60, 61].
Первым клонированным геном CLC из растений был NtCLC1, продукт которого близок по аминокислотной последовательности AtCLCc [49]. NtCLC1 экспрессировался во всех органах N. tabacum. Наибольшая экспрессия наблюдалась в стеблях. Белок NtCLC1, экспрессированный в ооцитах лягушки, опосредовал медленно активируемый входящий ток в ответ на гиперполяризацию плазматической мембраны и был проницаем для Сl–, ${\text{NO}}_{3}^{ - }$, I–, Br– и в меньшей степени для малата, ${\text{SO}}_{4}^{{2 - }}$ и глутамата [49, 50]. Белок NtCLC1 локализован в эндоплазматичеком ретикулуме (ЭПР) и, как показали эксперименты с pH-чувствительным флуоресцентным красителем pHluorin, слитым с тетрапептидом HDEL (pHluorin-HDEL), удерживающим белки в ЭПР, участвует в регуляции pH люмена ЭПР, приводя к его защелачиванию [21]. С помощью секретируемой формы GFP (secGFP) было продемонстрировано участие NtCLC1 в секреции белков [21]. Промоторную активность NtCLC-1 детектировали во всех органах растений. Вероятно, NtCLC1 участвует в росте и развитии растений. Об этом свидетельствует тот факт, что высота растений и размер цветков двойного нокаут-мутанта nbclca nbclcb по гомологичным NtCLC1 генам близкородственного вида N. benthamiana меньше, чем у растений ДТ [21]. NtCLC1 вовлечен также в вирусный патогенез растений табака. Показано взаимодействие NtCLC1 с белком 6К2 потивируса PVY (Potato virus Y). Предполагается, что вирус PVY, связываясь с транспортером NtCLC1, активирует последний, что вызывает изменение рН люмена ЭПР и последующее образование из ЭПР вирус-содержащих везикул, доставляющих вирусные частицы к плазмалемме и способствующих этим системной инфекции [21].
Связь белков семейства CLC c вирусным патогенезом была обнаружена также у растений томата Solanum lycopersicum, пораженных вироидом веретеновидности клубней картофеля. Транскрипция гомолога AtCLCb у томата, SlCLCb, замалчивалась малыми РНК вироида за счет деградации мРНК SlCLCb [62]. Вирус-индуцируемый сайленсинг SlCLCb вызывал замедление роста и курчавость листьев [62], что предполагает важную роль белка SlCLCb в росте и развитии растений. Однако функцию SlCLCb на клеточном уровне еще предстоит изучить.
В геноме N. tabacum, кроме вышеописанного NtCLC1, обнаружено еще 16 генов семейства CLC, NtCLC2-NtCLC17 [17]. Однако транскрипты пяти из них (1, 4, 11, 14, 16) не были обнаружены в органах и тканях растений в этой работе. Гены 6, 7, 9, 10, 17 экспрессировались главным образом в стебле, 3, 5, 8, 12, 13 – в почках, 15 – в пестике. В условиях солевого стресса количество транскриптов всех генов возрастало в надземных органах, а генов 2, 3 и 12 также в корнях. Подавление в растениях N. benthamiana экспрессии генов, гомологичных генам 2 и 13 из N. tabacum, привело к снижению и увеличению, соответственно, содержания хлорида в надземных органах [17], что предполагает участие этих генов в дальнем транспорте Сl–-иона.
Из риса (O. sativa) клонировано 2 гена семейства CLC, OsCLC-1 и OsCLC-2, гомологичных гену NtCLC1. OsCLC-1 экспрессировался во всех тканях, тогда как OsCLC-2 – только в корнях, узлах и междоузлиях стебля, а также в листовом влагалище. Белки OsCLC-1 и OsCLC-2 локализованы в тонопласте и участвуют в транспорте Сl– через вакуолярную мембрану [52]. Эти белки важны для роста и развития растений риса, на что указывает подавление роста нокаут-мутантов по генам OsCLC-1 и OsCLC-2. Уровень транскриптов OsCLC-1 возрастал в корнях и листьях проростков риса при наличии в среде NaCl, экспрессия OsCLC-2 не зависела от присутствия NaCl в среде. Высказано предположение, что OsCLC-1 участвует в процессах, ответственных за солеустойчивость растений, осуществляя, по-видимому, компартментацию ионов Сl– в вакуоли [52]. Физиологическая роль OsCLC-2 остается невыясненной.
Семейство хлоридных каналов полностью клонировано из умеренно-солеустойчивого культурного вида сои G. max и солеустойчивого дикорастущего вида сои G. soja [16]. Оно включает 8 генов: CLC1, b1, b2, c1, c2, d1, d2 и g. Все гены семейства CLC G. max и G. soja экспрессировались в корнях, стеблях и листьях растений. Индукция экспрессии CLC1, b1, b2, c1 и c2 в условиях солевого шока в органах сои предполагает участие продуктов этих генов в процессах, ответственных за формирование свойства солеустойчивости [16].
GmCLC1 более детально был исследован в работах [53, 63, 64]. В электрофизиологических экспериментах с использованием ооцитов лягушки установлено, что GmCLC1 является Сl–/Н+-антипортером. Белок GmCLC1 локализован в тонопласте, участвует в компартментации ионов Сl– в вакуолях клеток и играет важную роль в солеустойчивости этого вида растений. GmCLC1 транспортирует Сl– и ${\text{NO}}_{3}^{ - }$ [16, 63]. Экспрессия GmCLC1 повышает солеустойчивость трансгенных растений A. thaliana за счет снижения поступления иона Сl– в надземные органы [64]. Повышенная устойчивость к солевому стрессу наблюдалась также в растениях тополя, экспрессирующих GmCLC1 [65].
GsCLCc2 является потенциал-зависимым, вакуолярным транспортером, участвующим в переносе Сl– в вакуоль и вносящим вклад в устойчивость растений G. max к солевому стрессу. Проводимость GsCLCc2 убывала в ряду Br– ≥ I– > Сl– > ${\text{NO}}_{3}^{ - }$. Трансгенные растения G. max с оверэкспрессией GsCLCc2 отличались большей солеустойчивостью [16]. Несмотря на присутствие в последовательности белка GsCLCc2 обоих консервативных глутаматов, перенос ионов, опосредованный этим транспортером, не зависел от рН. GsCLCc2 функционировал как анионный канал [16].
Клонированы полноразмерные кодирующие последовательности генов белков ZmCLCc и ZmCLCd из кукурузы [54–56]. ZmCLCc локализован в митохондриях. Предполагается, что ZmCLCc участвует в транспорте Сl–, на что указывает снижение потоков Сl– и I– через внутреннюю мембрану митохондрий антителами к этому белку. Показано также вовлечение ZmCLCc в обеспечение устойчивости Z. mays к низким температурам. Установлено, что холодовой стресс индуцирует экспрессию этого белка в проростках кукурузы. Экспрессия ZmCLCc была выше у линий кукурузы, отличавшихся большей холодоустойчивостью при прорастании семян и развитии растений [54].
Было обнаружено, что ZmCLCd экспрессируется в листьях, корнях и стеблях. Наибольший уровень транскрипции ZmCLCd наблюдался в листьях. Растения A. thaliana со сверхэкспрессией ZmCLCd отличались повышенной устойчивостью к холодовому стрессу, засолению, засухе и окислительному стрессу [56]. Транспортная функция и локализация ZmCLCd не исследованы до настоящего времени.
Шесть генов семейства CLC, PtrCLC1-PtrCLC6, обнаружены в геноме понцируса трехлисточкового P. trifoliate и клонированы [57, 58]. Гены PtrCLC экспрессируются во всех тканях, наибольшая экспрессия была в листьях, наименьшая – в корнях, а также экспрессия PtrCLC изменялась в ответ на варьирование концентраций нитрата в среде и на засоление [58]. Гетерологичная экспрессия PtrCLC2 в растениях A. thaliana дикого типа и нокаут-мутанта clcc приводила к повышению солеустойчивости трансгенных растений по сравнению с нетрансформированными растениями за счет снижения содержания Сl–-иона в побегах. Предполагается, что белки семейства PtrCLC вовлечены в ${\text{NO}}_{3}^{ - }$- и Сl–-гомеостатирование [57].
Из солеисключающего галофита Thellungiella halophila – растения, как и A. thaliana, принадлежащего семейству Brassicaceae, клонирован ген ThCLC-a [59]. ThCLC-a локализован в вакуолярной мембране, где он, по-видимому, участвует в транспорте ${\text{NO}}_{3}^{ - }$ через тонопласт и накоплении этого аниона в вакуолях. ThCLC-a экспрессировался во всех органах галофита, уровень его экспрессии в корнях был выше, чем в побегах. Экспрессия ThCLC-a индуцировалась в ответ на добавление ${\text{NO}}_{3}^{ - }$ в среду культивирования. Содержание ${\text{NO}}_{3}^{ - }$ было снижено в побегах и корнях растений T. halophila c пониженной экспрессией ThCLC-a по сравнению с растениями ДТ. Содержание ${\text{NO}}_{3}^{ - }$ в тканях у растений A. thaliana со сверхэкспрессией ThCLC-a было больше, чем у растений ДТ в условиях дефицита ${\text{NO}}_{3}^{ - }$ [59].
Секвенирование транскриптома листьев соле- и засухоустойчивого растения Arabidopsis pumila позволило идентифицировать гены ApCLCa, ApCLCс и ApCLCd. На основании того, что экспрессия A-pCLCa значительно индуцировалась в ответ на солевой стресс, предполагается участие продукта этого гена в формировании свойства солеустойчивости A. pumila [66].
Клонированы два гена, SaCLCa1 и SaCLCc1, семейства хлоридных каналов из эугалофита Suaeda altissima [60, 61]. Белок SaCLCc1 участвует в транспорте Сl– [60], а SaCLCa1, вероятно, – в транспорте ${\text{NO}}_{3}^{ - }$ [61]. Экспрессия SaCLCc1 в клетках мутанта Δgef1 S. cerevisiae приводила к комплементации мутации (восстановлению роста мутанта на селективных средах) [60], в то время как экспрессия S-aCLCa1 – не приводила. Замена пролина в селективном фильтре SaCLCa1 на серин (P188S) привела к частичному восстановлению роста клеток Δgef1 [61]. SaCLCa1 и SaCLCc1 экспрессируются в корнях и листьях S. altissima. Экспрессия SaCLCa1 индуцировалась в корнях дефицитом нитрата в среде или засолением среды хлористым натрием, что предполагает участие SaCLCa1 в регуляции поступления ${\text{NO}}_{3}^{ - }$ в надземные органы. Экспрессия SaCLCc1 возрастала в листьях в ответ на засоление NaCl, что может быть связано с участием SaCLCc1 в накоплении Сl– в надземных органах [61].
В геноме Cucumis sativus идентифицированы гены CsCLCa, CsCLCc и CsCLCg, гомологичные генам вакуолярных белков AtCLCa, AtCLCc и AtCLCg [67]. В корнях наибольший уровень экспрессии наблюдали у CsCLCa и CsCLCg, наименьший – у CsCLCc. Дефицит ${\text{NO}}_{3}^{ - }$ в среде подавлял экспрессию CsCLCa и CsCLCg и не влиял на экспрессию CsCLCc. Внесение ${\text{NO}}_{3}^{ - }$ в питательную среду растений, выращивавшихся при дефиците NO3, приводило к индукции CsCLCa и CsCLCc в корнях [67]. Предполагается, что CsCLCa играет ведущую роль в накоплении ${\text{NO}}_{3}^{ - }$ в вакуолях клеток огурца [67], как это показано и для AtCLCa.
В геноме чайного растения Camellia sinensis обнаружено 8 представителей семейства CLC – C-sCLC1-8 [68]. Предполагается участие белков семейства CLC в накоплении ионов F– в листьях C. sinensis, обладающего устойчивостью к этому аниону и относящегося к гипераккумуляторам фторид-ионов [68]. Результаты исследования экспрессии генов CsCLC при обработке растений ионами Сl– или F– позволяют предположить, что CsCLC4-8, CsCLC6 и CsCLC7 участвуют в транспорте и депонировании в вакуолях Сl–, а C-sCLC1-3 – фторид-иона. Однако необходимы дальнейшие исследования для подтверждения предполагаемых функций белков CsCLC [68].
В геноме аллотетраплоидного рапса Brassica napus (B. rapa x B. oleracea) обнаружено 22 гена семейства CLC: BnaCLCa1-4, BnaCLCb1-4, BnaCLCc1-4, BnaCLCd1-2, BnaCLCe1-2, BnaCLCf1-4, BnaCLCg1-2 [18]. Идентифицирована их экзон-интронная структура, выявлены предполагаемые цис-действующие элементы в промоторах генов этого семейства и консервативные мотивы соответствующих им белков [18]. По-видимому, белки BnaCLCa и BnaCLCb, аналогично белкам AtCLCa и AtCLCb, играют важную роль в гомеостазе нитрата. Так же как AtCLCa, экспрессия BnaCLCa1-4 индуцировалась в корнях и побегах при добавлении ${\text{NO}}_{3}^{ - }$ в среду. BnaCLCa3 отводится ведущая роль в транспорте ${\text{NO}}_{3}^{ - }$ через вакуолярную мембрану, как это предполагается для AtCLCa, поскольку экспрессия этого гена в ответ на добавление ${\text{NO}}_{3}^{ - }$ возрастала больше, чем экспрессия других генов BnaCLCa [18]. Внесение нитрата в среду индуцировало также экспрессию BnaCLCb в побегах. Следует отметить, что в корнях в условиях дефицита ${\text{NO}}_{3}^{ - }$ в среде экспрессия генов BnaCLCb1, BnaCLCb3 и BnaCLCb4 была на высоком уровне и снижалась в ответ на добавление к среде ${\text{NO}}_{3}^{ - }$ [18]. В корнях экспрессия BnaCLCb4 также индуцировалась у линии B. napus с высоким NUE в условиях дефицита нитрата в среде [69].
В таблице 1 суммированы вышеприведенные данные о белках семейства CLC у A. thaliana и других растений.
Таблица 1.
Семейство белков CLC у A. thaliana и других растений
| Белки CLC | Локализация | Функция | Селективный фильтр | Е1481 | Е2031 | Физиологическая роль | Ссылки |
|---|---|---|---|---|---|---|---|
| AtCLCa | Тонопласт | ${\text{2NO}}_{3}^{ - }$/1H+-обмен | GPGIP | E | E | Накопление в вакуоли/отток из вакуоли ${\text{NO}}_{3}^{ - }$, открывание/закрывание устьиц | [12, 13, 26, 31, 33, 34] |
| AtCLCb | Тонопласт | ${\text{NO}}_{3}^{ - }$/H+-обмен | GPGIP | E | E | Накопление в вакуоли/отток из вакуоли ${\text{NO}}_{3}^{ - }$? | [26, 27, 32,] |
| AtCLCc | Тонопласт | Сl–/H+-обмен? | GSGIP | E | E | Регуляция устьичных движений, солеустойчивость, гомеостаз ${\text{NO}}_{3}^{ - }$? | [19, 26, 30, 45] |
| AtCLCd | транс-Гольджи сеть | Сl–/H+-обмен? | GSGIP | E | E | Мембранный трафик, стимуляция закисления люмена везикул? | [19, 20, 26–28] |
| AtCLCe | Тилакоиды | Сl–-канал? | ESAGK | E | S | Регуляция ионного гомеостаза пластид и соотношения Δψ и ΔрН протондвижущей силы (Δρ) | [26, 28, 38, 45, 48] |
| AtCLCf | цис- и транс- Гольджи сеть | Сl–-канал? | EILDQ | E | T | Не известна | [19, 26, 28, 45] |
| AtCLCg | Тонопласт | Сl–-канал? | GSGIP | A | E | Накопление Сl– в вакуолях клеток мезофилла, солеустойчивость, рециркуляция Сl–?, гуттация? | [26, 29] |
| ThCLC-a | Тонопласт | ${\text{NO}}_{3}^{ - }$/H+-обмен? | GPGIP | Е | Е | Накопление ${\text{NO}}_{3}^{ - }$ в вакуоли | [59] |
| OsCLC-1 | Тонопласт | Сl–/H+-обмен? | GSGIP | Е | Е | Накопление Сl– в вакуолях, рост и развитие растений, формирование солеустойчивости | [52] |
| OsCLC-2 | Тонопласт | Сl–/H+-обмен? | GSGIP | Е | Е | Рост и развитие растений, накопление Сl– в вакуолях? | |
| GmCLC1 | Тонопласт | Сl– ≈ ${\text{NO}}_{3}^{ - }$/H+-обмен | GPGIP | Е | Е | Депонирование Сl– в вакуолях клеток корня, формирование солеустойчивости | [16, 53, 63–65] |
| Gm/GsCLCb1 | ? | ${\text{NO}}_{3}^{ - }$/H+-обмен? | GPGIP | Е | Е | Не известна | [16] |
| Gm/GsCLCb2 | ? | ${\text{NO}}_{3}^{ - }$/H+-обмен? | GPGIP | Е | Е | Не известна | |
| Gm/GsCLCc1 | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Не известна | |
| GsCLCc2 | Тонопласт | Сl–-канал | GSGIP | Е | Е | Гомеостаз Сl– и ${\text{NO}}_{3}^{ - }$, солеустойчивость | |
| GmCLCc2 | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Не известна | |
| Gm/GsCLCd1 | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Не известна | |
| Gm/GsCLCd2 | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Не известна | |
| Gm/GsCLCg | ? | Сl–-канал? | GSGIP | A | G | Не известна | |
| NtCLC1 | ЭПР | Сl–/H+-обмен? | GSGIP | Е | Е | Регуляция рН люмена ЭПР, секреция белков, рост и развитие растений | [21, 49, 50] |
| NtCLC2 | ? | ${\text{NO}}_{3}^{ - }$/H+-обмен? | GPGIP | Е | Е | Не известна | GenBank: AF133209.1 |
| ZmCLCc | Мембраны митохондрий | Сl–/H+-обмен? | GSGIP | Е | Е | Холодоустойчивость | [54] |
| ZmCLCd | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Холодо-, засухо-, солеустойчивость, устойчивость к тепловому и окислительному стрессам | [55, 56] |
| PtrCLC1(a,b) | ? | ${\text{NO}}_{3}^{ - }$/H+-обмен? | GPGIP | Е | Е | Накопление ${\text{NO}}_{3}^{ - }$? | [57, 58] |
| PtrCLC2(c) | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Солеустойчивость? | |
| PtrCLC3(g) | ? | Канал? | GSGIP | A | Е | Солеустойчивость, засухоустойчивость? | |
| PtrCLC4(f) | ? | Канал? | EILNQ | E | T | ||
| PtrCLC5(d) | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Не известна | |
| PtrCLC6(e) | ? | Канал? | YALSL | E | S | Не известна | |
| SaCLCa1 | ? | ${\text{NO}}_{3}^{ - }$/H+-обмен? | GPGIP | Е | Е | Регуляция содержания ${\text{NO}}_{3}^{ - }$ в цитоплазме, участие в загрузке ксилемы? | [61] |
| SaCLCc1 | ? | Сl–/H+-обмен? | GSGIP | Е | Е | Депонирование Сl– в вакуолях надземных органах? | [60] |
ПРЕДПОЛАГАЕМОЕ УЧАСТИЕ Cl–/H+-АНТИПОРТЕРОВ ЭНДОСОМ В ПРОЦЕССАХ, ОТВЕТСТВЕННЫХ ЗА УСТОЙЧИВОСТЬ РАСТЕНИЙ К NaCl
Локализованные в эндосомальных мембранах Cl–/H+- и Na+/H+-антипортеры, такие, например, как AtCLCd, AtCLCf [20, 27, 19, 28 ], AtNHX5 и AtNHX6 [70] могут быть непосредственно вовлечены в Cl–- и Na+-гомеостатирование цитоплазмы клеток растений в условиях солевого стресса. Эндосомы, поглощающие ионы Cl– и Na+ с помощью Cl–/H+- и Na+/H+-антипортеров, могут сливаться с тонопластом и/или плазмалеммой, экспортируя Cl– и Na+, соответственно, в вакуоль и/или апопласт.
Активность электрогенного Cl–/H+-антипортера была продемонстрирована нами во фракции, обогащенной мембранами аппарата Гольджи (АГ), выделенной из корня эугалофита S. altissima [71]. Как было показано с помощью флуоресцентного pH-индикатора пиранина, загруженного в везикулы, и сафранина О, индикатора электрического потенциала (∆ψ), при создании на выделенных везикулах концентрационного градиента Cl– (∆рCl), направленного из наружной среды в везикулярный люмен, происходил выход H+ наружу (защелачивание люмена) и генерация ∆ψ, отрицательного внутри везикул. Поддержание длительного ∆рCl-зависимого транспорта H+ из везикул требовало присутствия в среде проникающих катионов, тетрафенилфосфония+ или трис+, которые нейтрализовывали отрицательные заряды, поступающие в везикулярный люмен в ходе Cl–/H+-обмена [71].
В соответствии с предполагаемым везикулярным транспортом Cl– и вовлечением в этот процесс Cl–-транспортеров, электронно-микроскопические исследования ультраструктуры клеток S. altissima обнаружили в цитоплазме клеток растений, выращенных в условиях засоления, интенсивное образование мембранных структур разного размера, в том числе мультивезикулярных тел. Больше всего их скапливалось в зонах, прилегающих к тонопласту и плазмалемме. Методом электронной цитохимии, основанном на формировании электронно-плотных гранул AgCl после обработки тканей ионами серебра, в этих же зонах была обнаружена аккумуляция Cl–, что, возможно, указывает на стимулированное хлористым натрием слияние наружной мембраны Cl–-содержащих эндосом с тонопластом и плазмалеммой [72].
Стимуляция образования мембранных структур в цитоплазме под действием NaCl и их слияние с вакуолями было показано также в клетках интактных растений и суспензионной культуры A. thaliana [73–76], суспензионных культур мангрового растения Bruguiera sexangula и ячменя [77] и в клетках интактного растения Chenopodium a-lbum [78]. Существенный вклад в их формирование вносили мембраны АГ и пост-Гольджи везикулы – именно те структуры, в которых были локализованы AtCLCd [20], AtNHX-5, AtNHX-6 [70].
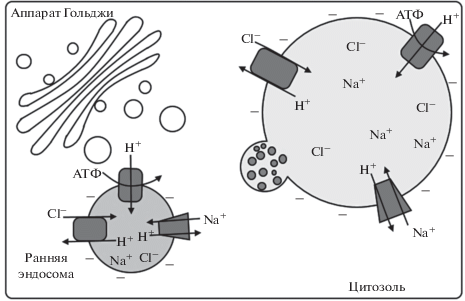
Выше приведенные данные предполагают следующий механизм согласованного функционирования Cl–/H+-антипортера, Na+/H+-антипортера и H+-АТФазы V-типа в эндосомах (рис. 4). V‑АТФаза транспортирует Н+ внутрь эндосом, в результате чего на эндосомальной мембране образуются концентрационный градиент Н+ (ΔрН) и электрический потенциал (Δψ). Для поддержания работы АТФазы необходимо нейтрализовывать положительные заряды, накапливающиеся на внутренней стороне эндосомальных мембран. Эту функцию выполняет Cl–/H+-антипортер, переносящий внутрь везикул отрицательно заряженные хлорид-ионы, а в обратном направлении положительно заряженные протоны. В результате создаваемый АТФазой Δψ конвертируется в ΔрН. Последний используется как источник энергии электронейтральным Na+/H+-антипортером для аккумуляции ионов Na+ ранними эндосомами, которые после созревания в поздние эндосомы переносятся к соответствующей мембране-акцептору и, сливаясь с ней, экспортируют Na+ и Cl– из цитоплазмы. Вовлечение пост-Гольджи структур в различные ветви везикулярного транспорта, по-видимому, играет важную роль в Cl–- и Na+-гомеостатировании цитоплазматических органелл в условиях солевого стресса. Известно, что транс-Гольджи сеть является клеточным компартментом, в котором пересекаются эндоцитозный и секреторный пути; через транс-Гольджи сеть осуществляется рециркуляция эндоцитозных везикул к плазмалемме; первичные транспортные везикулы, образующиеся из плазмалеммы при эндоцитозе, сливаются также с мембранами транс-Гольджи сети. Часть ранних эндосом и продуктов их слияния с транспортными везикулами созревает в поздние эндосомы (ПЭ) /мультивезикулярные тела (МВТ)/превакуолярные компартменты (ПВК), отсортировывая мембранные белки и липиды для доставки в тонопласт или плазмалемму, а часть белков и липидов в вакуолярный люмен или периплазматическое пространство [79–81]. Ионы Na+ и Cl–, поглощенные клеткой в условиях солевого стресса, могут быть компартментализованы структурами транс-Гольджи сети и ее производными при участии эндосомальных форм ионных транспортеров, таких как AtCLCd [20], AtNHX-5, AtNHX-6 [70], и экспортированы затем из цитоплазмы эндосомами в вакуоль или периплазматическое пространство.
Рис. 4.
Предполагаемый механизм вовлечения эндосомальных форм ионных транспортеров в экспорт Cl– и Na+ из цитоплазмы в вакуоль. Ранние эндосомы накапливают Cl– и Na+ в результате согласованного функционирования эндосомальных форм Cl–/H+-антипортера, Na+/H+- антипортера и H+-АТФазы V-типа и созревают в поздние эндосомы. Наружная мембрана поздних эндосом сливается с тонопластом, доставляя Cl– и Na+ в вакуоль. В нижней левой части рисунка изображена ранняя эндосома, в мембране которой функционируют Cl–/H+-антипортер, Na+/H+- антипортер и H+-АТФаза V-типа. В верхней правой части рисунка изображена поздняя эндосома на стадии слияния ее наружной мембраны с тонопластом.
ЗАКЛЮЧЕНИЕ
Приведенные в обзоре данные свидетельствуют о вовлечении белков семейства CLC у растений во множество процессов и физиологических функций. Важнейшим из них является нитратное и хлоридное гомеостатирование, участие белков CLC в котором на уровне клетки и целого организма хорошо доказано. ${\text{NO}}_{3}^{ - }$- и Cl–-гомеостатирование необходимо для роста и развития растений, а также для обеспечения устойчивости растений к хлоридному засолению, водному дефициту и другим неблагоприятным факторам среды. Одной из важнейших задач является поиск и исследование изоформ CLC, локализованных в мембранах АГ и пост-Гольджи везикул и участвующих таким образом в везикулярном транспорте ${\text{NO}}_{3}^{ - }$ и Cl– в клетке. Подавляющая часть исследований транспорта NO3– и Cl– белками CLC проведена на модельном растении A. thaliana. Функции и физиологическая роль представителей семейства CLC у других растений только начинают изучаться. Имеются лишь отрывочные сведения об участии этих белков в распределении ионов ${\text{NO}}_{3}^{ - }$ и Cl– в системе целого растения. До конца непонятен механизм, с помощью которого белки CLC регулируют трансмембранный электрический потенциал (Δψ) и рН люменов органелл у растений, включая A. thaliana, а также у дрожжей. Имеющиеся на этот счет сведения и выдвинутые на их основе гипотезы противоречивы. Необходимость исследования механизмов, с помощью которых такая регуляция осуществляется, представляется очевидной. Регуляция рН люменов цитоплазматических компартментов, в частности транс-Гольджи сети, ответственной за внутриклеточное распределение белков (sorting), чрезвычайно важна для везикулярного транспорта. Последний играет ключевую роль в ремоделировании белкового и липидного состава мембран, которое происходит в ответ на внутренние и внешние стимулы. К последним относятся стрессовые факторы биотической и абиотической природы. Регуляция везикулярного транспорта белками семейства CLC поэтому является важной составляющей процессов, определяющих устойчивость растений к этим факторам. Исследование роли белков семейства CLC в регуляции везикулярного транспорта является одной из актуальных задач клеточной физиологии.
Авторы выражают благодарность д.б.н., в.н.с. лаборатории транспорта ионов и солеустойчивости ИФР РАН Поповой Л.Г. за критическое чтение рукописи, сделанные замечания и рекомендации.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Miller C., White M.M. A voltage-dependent chloride conductance channel from Torpedo electroplax membrane // Ann. N. Y. Acad. Sci. 1980. V. 341. P. 534. https://doi.org/10.1111/j.1749-6632.1980.tb47197.x
Jentsch T.J., Steinmeyer K., Schwarz G. Primary structure of Torpedo marmorata chloride channel isolated by expression cloning in Xenopus oocytes // Nature. 1990. V. 348. P. 510. https://doi.org/10.1038/348510a0
Miller C. ClC chloride channels viewed through a transporter lens // Nature. 2006. V. 440. P. 484. https://doi.org/10.1038/nature04713
Barbier-Brygoo H., Vinauger M., Colcombet J., Ephritikhine G., Frachisse J.M., Maurel C. Anion channels in higher plants: functional characterization, molecular structure and physiological role // Biochim. Biophys. Acta, Biomembr. 2000. V. 1465. P. 199. https://doi.org/10.1016/S0005-2736(00)00139-5
Accardi A. Structure and gating of CLC channels and exchangers // J. Physiol. 2015. V. 593. P. 4129. https://doi.org/10.1113/JP270575
Fahike C., Yu H.T., Beck C.L., Rhodes T.H., George J. Pore-forming segments in voltage-gated chloride channels // Nature. 1997. V. 390. P. 529. https://doi.org/10.1038/37391
Barbier-Brygoo H., De Angeli A., Filleur S., Frachisse J.-M., Gambale F., Thomine S., Wege S. Anion channels/transporters in plants: from molecular bases to regulatory networks // Annu. Rev. Plant Biol. 2011. V. 62. P. 25. https://doi.org/10.1146/annurev-arplant-042110-103741
Dutzler R., Campbell E.B., Cadene M., Chait B.T., MacKinnon R. X-ray structure of a CIC chloride channel at 3.0 Å reveals the molecular basis of anion selectivity // Nature. 2002. V. 415. P. 287. https://doi.org/10.1038/415287a
Dutzler R., Campbell E.B., MacKinnon R. Gating the selectivity filter in ClC chloride channels // Science. 2003. V. 300. P. 108. https://doi.org/10.1126/science.1082708
Picollo A., Malvezzi M., Houtman J.C.D., Accardi A. Basis of substrate binding and conservation of selectivity in the CLC family of channels and transporters // Nat. Struct. Mol. Biol. 2009. V. 16. P. 1294. https://doi.org/10.1038/nsmb.1704
Zifarelli G., Pusch M. Conversion of the 2Cl–/1H+ antiporter ClC-5 in a NO3¯/H+ antiporter by a single point mutation // EMBO J. 2009. V. 28. P. 175. https://doi.org/10.1038/emboj.2008.284
Bergsdorf E.Y., Zdebik A.A., Jentsch T.J. Residues important for nitrate/proton coupling in plant and mammalian CLC transporters // J. Biol. Chem. 2009. V. 284. P. 11184. https://doi.org/10.1074/jbc.M901170200
Wege S., Jossier M., Filleur S., Thomine S., Barbier-Brygoo H., Gambale F., De Angeli A. The proline 160 in the selectivity filter of the Arabidopsis NO3¯/H+ exchanger AtCLCa is essential for nitrate accumulation in planta // Plant J. 2010. V. 63. P. 861. https://doi.org/10.1111/j.1365-313X.2010.04288.x
Accardi A., Walden M., Nguitragool W., Jayaram H., Williams C., Miller C. Separate ion pathways in a Cl–/H+ exchanger // J. Gen. Physiol. 2005. V. 126. P. 563. https://doi.org/10.1085/jgp.200509417
Jentsch T.J., Pusch M. CLC chloride channels and transporters: structure, function, physiology, and disease // Physiol. Rev. 2018. V. 98. P. 1493. https://doi.org/10.1152/physrev.00047.2017
Wei P., Che B., Shen L., Cui Y., Wu S., Cheng C., Liu F., Li M.W., Yu B., Lam H.M. Identification and functional characterization of the chloride channel gene, G-sCLC-c2 from wild soybean // BMC Plant Biol. 2019. V. 19:121. https://doi.org/10.1186/s12870-019-1732-z
Zhang H., Jin J., Jin L., Li Z., Xu G., Wang R., Zhang J., Zhai N., Chen Q., Liu P., Chen X., Zheng Q., Zhou H. Identification and analysis of the chloride channel gene family members in tobacco (Nicotiana tabacum) // Gene. 2018. V. 676. https://doi.org/10.1016/j.gene.2018.06.073
Liao Q., Zhou T., Yao J.Y., Han Q.F., Song H.X., Guan C.Y., Hua Y.P., Zhang Z.H. Genome-scale characterization of the vacuole nitrate transporter Chloride Channel (CLC) genes and their transcriptional responses to diverse nutrient stresses in allotetraploid rapeseed // PLoS One. 2018. V. 13: e0208648. https://doi.org/10.1371/journal.pone.0208648
Lv Q., Tang R., Liu H., Gao X., Li Y., Zheng H., Zhang H. Cloning and molecular analyses of the Arabidopsis thaliana chloride channel gene family // Plant Sci. 2009. V. 176. P. 650. https://doi.org/10.1016/j.plantsci.2009.02.006
von der Fecht-Bartenbach J., Bogner M., Krebs M., Stierhof Y.D., Schumacher K., Ludewig U. Function of the anion transporter AtCLC-d in the trans-Golgi network // Plant J. 2007. V. 50. P. 466. https://doi.org/10.1111/j.1365-313X.2007.03061.x
Sun H., Shen L., Qin Y., Liu X., Hao K., Li Y., Wang J., Yang J., Wang F. CLC-Nt1 affects Potato Virus Y infection via regulation of endoplasmic reticulum luminal Ph // New Phytol. 2018. V. 220. P. 539. https://doi.org/10.1111/nph.15310
Jentsch T.J. CLC Chloride Channels and transporters: from genes to protein structure, pathology and physiology // Crit. Rev. Biochem. Mol. Biol. 2008. V. 43. P. 3. https://doi.org/10.1080/10409230701829110
Jentsch T.J. Discovery of CLC transport proteins: cloning, structure, function and pathophysiology // J. Physiol. 2015. V. 593. P. 4091. https://doi.org/10.1113/JP270043
Stauber T., Weinert T., Jentsch T.J. Cell biology and physiology of CLC chloride channels and transporters // Comprehensive Physiology. 2012. V. 2. P. 1701. https://doi.org/10.1002/cphy.c110038
Poroca D.R., Pelis R.M., Chappe V.M. ClC channels and transporters: structure, physiological functions, and implications in human chloride channelopathies // Front. Pharmacol. 2017. V. 8: 151. https://doi.org/10.3389/fphar.2017.00151
Zifarelli G., Pusch M. CLC transport proteins in plants // FEBS Lett. 2010. V. 584. P. 2122. https://doi.org/10.1016/j.febslet.2009.12.042
Hechenberger M., Schwappach B., Fischer W.N., Frommer W.B., Jentsch T.J., Steinmeyer K. A family of putative chloride channels from Arabidopsis and functional complementation of a yeast strain with a CLC gene disruption // J. Biol. Chem. 1996. V. 271. P. 33632. https://doi.org/10.1074/jbc.271.52.33632
Marmagne A., Vinauger-Douard M., Monachello D., De Longevialle A.F., Charon C., Allot M., Rappaport F., Wollman F.A., Barbier-Brygoo H., Ephritikhine G. Two members of the Arabidopsis CLC (chloride channel) family, AtCLCe and AtCLCf, are associated with thylakoid and golgi membranes, respectively // J. Exp. Bot. 2007. V. 58. P. 3385. https://doi.org/10.1093/jxb/erm187
Nguyen C.T., Agorio A., Jossier M., Depré S., Thomine S., Filleur S. Characterization of the chloride channel-like, AtCLCg, involved in chloride tolerance in Arabidopsis thaliana // Plant Cell Physiol. 2015. V. 57. P. 764. https://doi.org/10.1093/pcp/pcv169
Jossier M., Kroniewicz L., Dalmas F., Le Thiec D., Ephritikhine G., Thomine S., Barbier-Brygoo H., Vavasseur A., Filleur S., Leonhardt N. The Arabidopsis vacuolar anion transporter, AtCLCc, is involved in the regulation of stomatal movements and contributes to salt tolerance // Plant J. 2010. V. 64. P. 563. https://doi.org/10.1111/j.1365-313X.2010.04352.x
De Angeli A., Monachello D., Ephritikhine G., Frachisse J.M., Thomine S., Gambale F., Barbier-Brygoo H. The nitrate/proton antiporter AtCLCa mediates nitrate accumulation in plant vacuoles // Nature. 2006. V. 442. P. 939. https://doi.org/10.1038/nature05013
von der Fecht-Bartenbach J., Bogner M., Dynowski M., Ludewig U. CLC-b-mediated NO3¯/H+ exchange across the tonoplast of Arabidopsis vacuoles // Plant Cell Physiol. 2010. V. 51. P. 960. https://doi.org/10.1093/pcp/pcq062
Geelen D., Lurin C., Bouchez D., Frachisse J.M., Lelièvre F., Courtial B., Barbier-Brygoo H., Maurel C. Disruption of putative anion channel gene AtCLC-a in Arabidopsis suggests a role in the regulation of nitrate content // Plant J. 2000. V. 21. P. 259. https://doi.org/10.1046/j.1365-313X.2000.00680.x
Wege S., De Angeli A., Droillard M.J., Kroniewicz L., Merlot S., Cornu D., Gambale F., Martinoia E., Barbier-Brygoo H., Thomine S., Leonhardt N., Filleur S. Phosphorylation of the vacuolar anion exchanger AtCLCa is required for the stomatal response to abscisic acid // Sci. Signaling. 2014. V. 7: ra65. https://doi.org/10.1126/scisignal.2005140
Gifford M.L., Dean A., Gutierrez R.A., Coruzzi G.M., Birnbaum K.D. Cell-specific nitrogen responses mediate developmental plasticity // PNAS. 2008. V. 105. P. 803. https://doi.org/10.1073/pnas.0709559105
Carpaneto A., Boccaccio A., Lagostena L., Di Zanni E., Scholz-Starke J. The signaling lipid phosphatidylinositol-3,5-bisphosphate targets plant CLC-a anion/H+ exchange activity // EMBO Rep. 2017. V. 18. P. 1100. https://doi.org/10.15252/embr.201643814
De Angeli A., Moran O., Wege S., Filleur S., Ephritikhine G., Thomine S., Barbier-Brygoo H., Gambale F. ATP binding to the C terminus of the Arabidopsis thaliana nitrate/proton antiporter, AtCLCa, regulates nitrate transport into plant vacuoles // J. Biol. Chem. 2009. V. 284. P. 26526. https://doi.org/10.1074/jbc.M109.005132
Monachello D., Allot M., Oliva S., Krapp A., Daniel-Vedele F., Barbier-Brygoo H., Ephritikhine G. Two anion transporters AtClCa and AtClCe fulfil interconnecting but not redundant roles in nitrate assimilation pathways // New Phytol. 2009. V. 183. P. 88. https://doi.org/10.1111/j.1469-8137.2009.02837.x
Han Y.L., Song H.X., Liao Q., Yu Y., Jian S. F., Lepo J.E., Liu Q., Rong X.M., Tian C., Zeng J., Guan C.Y., Ismail A.M., Zhang Z.H. Nitrogen use efficiency is mediated by vacuolar nitrate sequestration capacity in roots of Brassica napus // Plant Physiol. 2016. V. 170. P. 1684. https://doi.org/10.1104/pp.15.01377
Whiteman S.A., Serazetdinova L., Jones A.M.E., Sanders D., Rathjen J., Peck S.C., Maathuis F.J.M. Identification of novel proteins and phosphorylation sites in a tonoplast enriched membrane fraction of Arabidopsis thaliana // Proteomics. 2008. V. 8. P. 3536. https://doi.org/10.1002/pmic.200701104
Hu R., Zhu Y., Wei J., Chen J., Shi H., Shen G., Zhang H. Overexpression of PP2A-C5 that encodes the catalytic subunit 5 of protein phosphatase 2A in Arabidopsis confers better root and shoot development under salt conditions // Plant, Cell Environ. 2017. V. 40. P. 150. https://doi.org/10.1111/pce.12837
Харитонашвили Е.В., Черный С.Г., Алехина Н.Д. Формирование запасного пула нитрата в корнях проростков пшеницы // Физиология растений. 1993. Т. 40. С. 443.
Измайлов С.Ф. Насыщение и использовнаие фондов нитрата в листьях гороха и сахарной свеклы // Физиология растений. 2004. Т. 51. С. 211.
Bläsing O.E., Gibon Y., Günther M., Höhne M., Morcuende R., Osuna D., Thimm O., Usadel B., Scheible W.R., Stitt M. Sugars and circadian regulation make major contributions to the global regulation of diurnal gene expression in Arabidopsis // Plant Cell. 2005. V. 17. P. 3257. https://doi.org/10.1105/tpc.105.035261
Harada H., Kuromori T., Hirayama T., Shinozaki K., Leigh R.A. Quantitative trait loci analysis of nitrate storage in Arabidopsis leading to an investigation of the contribution of the anion channel gene, AtCLC-c, to variation in nitrate levels // J. Exp. Bot. 2004. V. 55. P. 2005. https://doi.org/10.1093/jxb/erh224
Vialaret J., Di Pietro M., Hem S., Maurel C., Rossignol M., Santoni V. Phosphorylation dynamics of membrane proteins from Arabidopsis roots submitted to salt stress // Proteomics. 2014. V. 14. P. 1058. https://doi.org/10.1002/pmic.201300443
Guo W., Zuo Z., Cheng X., Sun J., Li H., Li L., Qiu J.L. The chloride channel family gene CLCd negatively regulates pathogen-associated molecular pattern (PAMP)-triggered immunity in Arabidopsis // J. Exp. Bot. 2014. V. 65. P. 1205. https://doi.org/10.1093/jxb/ert484
Herdean A., Nziengui H., Zsiros O., Solymosi K., Garab G., Lundin B., Spetea C. The Arabidopsis thylakoid chloride channel AtCLCe functions in chloride homeostasis and regulation of photosynthetic electron transportn // Front. Plant Sci. 2016. V. 7: 115. https://doi.org/10.3389/fpls.2016.00115
Lurin C., Geelen D., Barbier-Brygoo H., Guern J., Maurel C. Cloning and functional expression of a plant voltage-dependent chloride channel // Plant Cell. 1996. V. 8. P. 701. https://doi.org/10.1105/tpc.8.4.701
Lurin C., Güclü J., Cheniclet C., Carde J.P., Barbier-Brygoo H., Maurel C. CLC-Nt1, a putative chloride channel protein of tobacco, co-localizes with mitochondrial membrane markers // Biochem. J. 2000. V. 348. P. 291. https://doi.org/10.1042/0264-6021:3480291
Diédhiou C.J., Golldack D. Salt-dependent regulation of chloride channel transcripts in rice // Plant Sci. 2006. V. 170. P. 793. https://doi.org/10.1016/j.plantsci.2005.11.014
Nakamura A., Fukuda A., Sakai S., Tanaka Y. Molecular cloning, functional expression and subcellular localization of two putative vacuolar voltage-gated chloride channels in rice (Oryza sativa L.) // Plant Cell Physiol. 2006. V. 47. P. 32. https://doi.org/10.1093/pcp/pci220
Li W.Y.F., Wong F.L., Tsai S.N., Phang T.H., Shao G., Lam H.M. Tonoplast-located GmCLC1 and GmNHX1 from soybean enhance NaCl tolerance in transgenic bright yellow (BY)-2 cells // Plant, Cell Environ. 2006. V. 29. P. 1122. https://doi.org/10.1016/j.diamond.2005.12.024
Tampieri E., Baraldi E., Carnevali F., Frascaroli E., De Santis A. The activity of plant inner membrane anion channel (PIMAC) can be performed by a chloride channel (CLC) protein in mitochondria from seedlings of maize populations divergently selected for cold tolerance // J. Bioenerg. Biomembr. 2011. V. 43. P. 611. https://doi.org/10.1007/s10863-011-9386-z
Yang G., Zou H., Wu Y., Liu H., Yuan Y. Identification and characterisation of candidate genes involved in chilling responses in maize (Zea mays L.) // Plant Cell, Tissue Organ Cult. 2011. V. 106. P. 127. https://doi.org/10.1007/s11240-010-9900-8
Wang S., Su S.Z., Wu Y., Li S.P., Shan X.H., Liu H.K., Wang S., Yuan Y.P. Overexpression of maize chloride channel gene ZmCLC-d in Arabidopsis thaliana improved its stress resistance // Biol. Plant. 2015. V. 59. P. 55. https://doi.org/10.1007/s10535-014-0468-8
Wei Q., Liu Y., Zhou G., Li Q., Yang C., Peng S. Overexpression of CsCLCc, a chloride channel gene from Poncirus trifoliata, enhances salt tolerance in Arabidopsis // Plant Mol. Biol. Rep. 2013. V. 31. P. 1548. https://doi.org/10.1007/s11105-013-0592-1
Wei Q.J., Gu Q.Q., Wang N.N., Yang C.Q., Peng S.A. Molecular cloning and characterization of the chloride channel gene family in trifoliate orange // Biol. Plant. 2015. V. 59. P. 645. https://doi.org/10.1007/s10535-015-0532-z
Zhou C., Wang H., Zhu J., Liu Z. Molecular cloning, subcellular localization and functional analysis of ThCLC-a from Thellungiella halophila // Plant Mol. Biol. Rep. 2013. V. 31. P. 783. https://doi.org/10.1007/s11105-012-0545-0
Nedelyaeva O.I., Shuvalov A.V., Mayorova O.V., Yurchenko A.A., Popova L.G., Balnokin Y.V., Karpichev I.V. Cloning and functional analysis of SaCLCc1, a gene belonging to the chloride channel family (CLC), from the halophyte Suaeda altissima (L.) Pall. // Dokl. Biochem. Biophys. 2018. V. 481. P. 186. https://doi.org/10.1134/S1607672918040026
Nedelyaeva O.I., Shuvalov A.V., Karpichev I.V., Beliaev D.V., Myasoedov N.A., Khalilova L.A., Khramov D.E., Popova L.G., Balnokin Y.V. Molecular cloning and characterisation of SaCLCa1, a novel protein of the chloride channel (CLC) family from the halophyte Suaeda altissima (L.) Pall. // J. Plant Physiol. 2019. V. 240: 152995. https://doi.org/10.1016/j.jplph.2019.152995
Adkar-Purushothama C.R., Iyer P.S., Perreault J.P. Potato spindle tuber viroid infection triggers degradation of chloride channel protein CLC-b-like and Ribosomal protein S3a-like mRNAs in tomato plants // Sci. Rep. 2017. V. 7: 8341. https://doi.org/10.1038/s41598-017-08823-z
Wong T.H., Li M.W., Yao X.Q., Lam H.M. The GmCLC1 protein from soybean functions as a chloride ion transporter // J. Plant Physiol. 2013. V. 170. P. 101. https://doi.org/10.1016/j.jplph.2012.08.003
Wei P., Wang L., Liu A., Yu B., Lam H.M. GmCLC1 confers enhanced salt tolerance through regulating chloride accumulation in soybean // Front Plant Sci. 2016. V. 7: 1082. https://doi.org/10.3389/fpls.2016.01082
Sun W., Deng D., Yang L., Zheng X., Yu J., Pan H., Zhuge Q. Overexpression of the chloride channel gene (GmCLC1) from soybean increases salt tolerance in transgenic Populus deltoides P. euramericana “Nanlin895”. Plant Omics. 2013. V. 6. P. 347.
Yang L., Jin Y., Huang W., Sun Q., Liu F., Huang X. Full-length transcriptome sequences of ephemeral plant Arabidopsis pumila provides insight into gene expression dynamics during continuous salt stress // BMC Genomics. 2018. V. 19: 717. https://doi.org/10.1186/s12864-018-5106-y
Migocka M., Warzybok A., Papierniak A., Kłobus G. ${\text{NO}}_{3}^{ - }$/H+ antiport in the tonoplast of cucumber root cells is stimulated by nitrate supply: evidence for a reversible nitrate-induced phosphorylation of vacuolar ${\text{NO}}_{3}^{ - }$/H+ antiport // PLoS One. 2013. V. 8: e73972. https://doi.org/10.1371/journal.pone.0073972
Xing A., Ma Y., Wu Z., Nong S., Zhu J., Sun H., Tao J., Wen B., Zhu X., Fang W., Li X., Wang Y. Genome-wide identification and expression analysis of the CLC superfamily genes in tea plants (Camellia sinensis) // Funct. Integr. Genomics. 2020 (in press). https://doi.org/10.1007/s10142-019-00725-9
Li Q., Ding G., Yang N., White P.J., Ye X., Cai H., Lu J., Shi L., Xu F. Comparative genome and transcriptome analysis unravels key factors of nitrogen use efficiency in Brassica napus L. // Plant, Cell Environ. 2019 (in press). https://doi.org/10.1111/pce.13689
Bassil E., Ohto M., Esumi T., Tajima H., Zhu Z., Cagnac O., Belmonte M., Peleg Z., Yamaguchi T., Blumwald E. The Arabidopsis intracellular Na+/H+ antiporters NHX5 and NHX6 are endosome associated and necessary for plant growth and development // Plant Cell. 2011. V. 23. P. 224. https://doi.org/10.1105/tpc.110.079426
Shuvalov A.V., Orlova J.V., Khalilova L.A., Myasoedov N.A., Andreev I.M., Belyaev D.V., Balnokin Y.V. Evidence for the functioning of a Cl−/H+ antiporter in the membranes isolated from root cells of the halophyte Suaeda altissima and enriched with Golgi membranes // Russ. J. Plant Physiol. 2015. V. 62. P. 45. https://doi.org/10.1134/S1021443715010124
Balnokin Y.V., Kurkova E.B., Khalilova L.A., Myasoedov N.A., Yusufov A.G. Pinocytosis in the root cells of a salt-accumulating halophyte Suaeda altissima and its possible involvement in chloride transport // Russ. J. Plant Physiol. 2007. V. 54. P. 797. https://doi.org/10.1134/S102144370706012X
Hamaji K., Nagira M., Yoshida K., Ohnishi M., Oda Y., Uemura T., Goh T., Sato M.H., Morita M.T., Tasaka M., Hasezawa S.I., Nakano A., Hara-Nishimura I., Maeshima M., Fukaki H. et al. Dynamic aspects of ion accumulation by vesicle traffic under salt stress in Arabidopsis // Plant Cell Physiol. 2009. V. 50. P. 2023. https://doi.org/10.1093/pcp/pcp143
Baral A., Irani N.G., Fujimoto M., Nakano A., Mayor S., Mathew M.K. Salt-induced remodeling of spatially restricted clathrin-independent endocytic pathways in Arabidopsis root // Plant Cell. 2015. V. 27. P. 1297. https://doi.org/10.1105/tpc.15.00154
Orlova Y.V., Sergienko O.V., Khalilova L.A., Voronkov A.S., Fomenkov A.A., Nosov A.V., Popova L.G., Shuvalov A.V., Ryabova A.V., Balnokin Y.V. Sodium transport by endocytic vesicles in cultured Arabidopsis thaliana (L.) Heynh. cells // In Vitro Cell. Dev. Biol.: Plant. 2019. V. 55. P. 359. https://doi.org/10.1007/s11627-019-10005-7
Khalilova L.A., Sergienko O.V., Orlova Y.V., Myasoedov N.A., Karpichev I.V., Balnokin Y.V. Arabidopsis thaliana mutant with T-DNA insertion in the Flot1 (At5g2525) gene promotor possesses increased resistance to NaCl // Russ. J. Plant Physiol. 2020. V. 67. P. 275. https://doi.org/10.1134/S1021443720020077
Mimura T., Kura-Hotta M., Tsujimura T., Ohnishi M., Miura M., Okazaki Y., Mimura M., Maeshima M., Washitani-Nemoto S. Rapid increase of vacuolar volume in response to salt stress // Planta. 2003. V. 216. P. 397. https://doi.org/10.1007/s00425-002-0878-2
Ivanova T.V., Maiorova O.V., Orlova Y.V., Kuznetsova E.I., Khalilova L.A., Myasoedov N.A., Balnokin Y.V., Tsydendambaev V.D. Cell ultrastructure and fatty acid composition of lipids in vegetative organs of Chenopodium a-lbum L. under salt stress conditions // Russ. J. Plant Physiol. 2016. V. 63. P. 763. https://doi.org/10.1134/S1021443716060054
Jaillais Y., Fobis-Loisy I., Miège C., Gaude T. Evidence for a sorting endosome in Arabidopsis root cells // Plant J. 2008. 53. P. 237. https://doi.org/10.1111/j.1365-313X.2007.03338.x
Feraru E., Feraru M.I., Asaoka R., Paciorek T., De Rycke R., Tanaka H., Nakano A., Frimla J. BEX5/RabA1b regulates trans-Golgi network-to-plasma membrane protein trafficking in Arabidopsis // Plant Cell. 2012. V. 24. P. 3074. https://doi.org/10.1105/tpc.112.098152
Cui Y., Shen J., Gao C., Zhuang X., Wang J., Jiang L. Biogenesis of plant prevacuolar multivesicular bodies // Mol Plant. 2016. V. 9. P. 774. https://doi.org/10.1016/j.molp.2016.01.011
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


