Физиология растений, 2020, T. 67, № 5, стр. 525-537
Сравнительный анализ динамики экспрессии генов первичного метаболизма и хлоропластных транспортеров Chlamydomonas reinhardtii при разных трофических условиях
Р. К. Пузанский a, b, Д. А. Романюк c, М. Ф. Шишова a, *
a Санкт-Петербургский государственный университет,
кафедра физиологии и биохимии растений
Санкт-Петербург, Россия
b Ботанический институт им. В.Л.Комарова Российской академии наук,
лаборатория динамики растительного покрова Арктики
Санкт-Петербург, Россия
c Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии,
лаборатория генетики растительно-микробных взаимодействий
Санкт-Петербург, Россия
* E-mail: mshishova@mail.ru
Поступила в редакцию 07.12.2019
После доработки 19.03.2020
Принята к публикации 20.03.2020
Аннотация
Chlamydomonas reinhardtii P.A.Dangeard ‒ зеленая одноклеточная водоросль, способная усваивать ацетат. Трофический режим существенно влияет на ее рост и метаболизм. Действие трофических условий на периодическую культуру интерферирует с изменениями среды и метаболизма микроводорослей, происходящими в процессе развития культуры. Цель работы заключалась в оценке влияния ацетата на изменение экспрессии 32 генов, кодирующих ферменты центрального метаболизма и пластидные транспортеры, во время роста периодических культур C. reinhardtii cc-124. Профили транскрипции в условиях автотрофии существенно отличались от таковых в присутствии ацетата. Наиболее сильное влияние трофического режима было установлено в период лог-фазы роста культуры. В присутствии ацетата зарегистрирована более интенсивная экспрессия гена ACS2, кодирующего пластидную ацетил-КоА синтазу, а также генов, кодирующих субъединицы ферментов, направляющих ацетильные группы в синтез жирных кислот. Повышенная экспрессия генов PCK1 и PPT1 при миксотрофии может объясняться включением углерода ацетата в глюконеогенез. В присутствии ацетата наблюдался высокий уровень экспрессии генов метаболизма крахмала. Автотрофные условия характеризовались повышенным накоплением транскриптов генов, кодирующих субъединицы цитратлиазы, что, возможно, связано с ростом выхода ацетильных групп из цикла Кребса. Наряду с этим, более высокий уровень экспрессии показан для генов пластидных транспортеров, участвующих в экспорте сахаров из пластиды, что сопряжено с перераспределением восстановительной способности в клетке. Отмечено, что на уровне транскрипции в процессе развития усиливаются сходства миксотрофной культуры с автотрофной.
ВВЕДЕНИЕ
Микроводоросли встречаются в экотопах с различными, часто меняющимися, световыми и газовыми режимами, что может ограничивать интенсивность фотоавтотрофного питания и, тем самым, быть причиной появления способности усваивать экзогенные органические субстраты. Chlamydomonas reinhardtii способна метаболизировать ряд экзогенных субстратов, в том числе ацетат, который поддерживает как гетеротрофный рост, так и значительно стимулирует рост культуры водоросли при освещении [1].
Смена трофического режима ведет к изменению вклада источников энергии и углерода в метаболизм клетки и перераспределению ресурсов между процессами деления клетки, катаболизма, синтеза и депонирования [2, 3]. Направленность и интенсивность изменений зависят как от степени специализации организма, так и от его физиологического статуса. Добавление ацетата в среду культивирования C. reinhardtii приводит к перестройкам фотосинтетического аппарата, при этом может наблюдаться как ингибирование фотосинтетического выделения кислорода и фиксации углекислого газа [4], так и рост активности фотосинтетического аппарата [5]. Наряду с этим, усвоение ацетата сопровождается ростом интенсивности дыхания [6]. Также наблюдается стимуляция депонирования крахмала и липидов под действием ацетата [7]. В основе перестроек метаболизма в процессе развития культуры и адаптации к трофическим условиям лежат изменения интенсивности ферментативных реакций первичного метаболизма. Этому соответствуют данные о влиянии трофических факторов на протеом хламидомонады [8, 9]. Белковый спектр, в свою очередь, может регулироваться на уровне транскрипции [10, 11]. Одним из механизмов регуляции активности ферментных реакций является изменение количества ферментов или транспортеров, которое, в свою очередь, может регулироваться и на уровне транскрипции.
Включение ацетата в метаболизм начинается с образования комплекса с коферментом А. В клетках хламидомонады этот процесс реализуется двумя способами. Первый осуществляется ферментом ацетил-КоА-синтазой (ACS), напрямую синтезирующим ацетил-КоА. Второй путь включает этап фосфорилирования ацетата ферментом ацетаткиназой (ACK) и синтез ацетил-КоА фосфоацетилтрансферазой (PAT). Хламидомонада обладает двумя ферментными АСК-PAT системами. Система ACK2–PAT1 была выявлена в митохондриях, а система ACK1-PAT2 локализована, предположительно, в хлоропластах [12]. Далее ацетил может быть включен ферментом цитратсинтазой (CIS) в цикл трикарбоновых кислот, выход из которого осуществляется цитратлиазой (ACL) [13]. Еще один механизм, обеспечивающий отток углерода из цикла Кребса и активацию глюконеогенеза, заключается в преобразовании оксалоацетата в фосфоенолпируват, которое осуществляется фосфоенолпируваткарбоксикиназой (PCK) [3]. Усвоенные ацетильные группы также могут поступать в путь синтеза жирных кислот в результате активности фермента ацетил-КоА-карбоксилазы (ACC) или с помощью ацилтрансфераз, к числу которых относится 3-оксоацил-[ацил-переносящий белок] (АПБ) синтаза III, (KASIII, FabH) [3].
Присутствие экзогенного углерода вызывает изменение ассимиляционных реакций фотосинтеза и метаболизма сахаров [8, 14]. В связи с этим особый интерес представляет регуляция активности таких ферментов, как фруктозобисфосфатальдолаза (FBA), участвующая в гликолизе, глюконеогенезе, цикле Кальвина и пентозофосфатном пути (ПФП) (здесь и далее данные о функциях ферментов получены из баз данных NCBI, KEGG, ChmyCyc и приведены в табл. 1). Ключевыми ферментами также являются триозофосфатизомераза (TPIC), участвующая в гликолизе, глюконеогенезе и цикле Кальвина; транскетолаза (TRK) – фермент цикла Кальвина и ПФП, РУБИСКО – ключевой фермент цикла Кальвина, трансальдолаза (TAL) – фермент ПФП, гексокиназа (HXK) – ключевой фермент гликолиза.
Таблица 1.
Перечень генов C. reinhardtii с указанием кодируемых ферментов и транспортеров
| Символ | Продукт | Роль в метаболизме | ||
|---|---|---|---|---|
| ACK1 | Ацетаткиназа 1 | Метаболизм ацетата | ||
| ACK2 | Ацетаткиназа 2 | |||
| ACS1 | Ацетил-КоА-синтаза 1 | |||
| ACS2 | Ацетил-КоА-синтаза 2 | |||
| CIS2 | Цитратсинтаза | Вход ацетильных групп в цикл Кребса | ||
| ACLA1 | АТФ-цитратлиаза α-субъединица | Вывод ацетильных групп из цикла Кребса | ||
| ACLB1 | АТФ-цитратлиаза β-субъединица | |||
| PCK1 | Фосфоенолпируваткарбоксикиназа | Вывод углерода из цикла Кребса в глюконеогенез | ||
| BCC1 | Биотин-карбоксил переносящий белок | Синтез жирных кислот; субъединицы ацетил-КоА-карбоксилазы |
||
| CHLREDRAFT_184945 | Субъединица α карбоксилтрансферазы, | |||
| CHLREDRAFT_122970 | Биотинкарбоксилаза, | |||
| CHLREDRAFT_123419 | Перенос ацильных групп | |||
| RBCS1 | Малая субъединица Рубиск | Цикл Кальвина | ||
| TPIC | Триозофосфатизомераза | Окислительный пентозофосфатный цикл | Цикл Кальвина | Гликолиз/глюконеогенез |
| FBA3 | Фруктозо-1,6-бисфосфатальдолаза | |||
| TRK1 | Транскетолаза 1 | |||
| TAL2 | Трансальдолаза 2 | |||
| HXK1 | Гексокиназа 1 | Гликолиз/глюконеогенез | ||
| CHLREDRAFT_111372 | Карбогидраткиназа Pfkb типа | Метаболизм пентоз | ||
| CHLREDRAFT_137300 | Фосфорилаза крахмала | Деградация крахмала и олигосахаридов | ||
| AMYB1 | β-амилаза 1 | |||
| AGA1 | α-галактозидаза | |||
| STA11 | 4-α-глюканотрансфераза | |||
| CHLREDRAFT_195672 | α,α-трегалаза | |||
| SBE3 | Крахмал-ветвящий фермент | Синтез крахмала | ||
| APE2 | Вывод продуктов фотосинтеза из пластиды; триозофосфатный шунт | Пластидные транспортеры | ||
| TPT2 | Переносчик триозофосфатов | |||
| OMT1 | Пластидный 2-оксоглутарат/малат антипортер | Обмен карбоксилатов между пластидой и цитозолем; малатный шунт | ||
| LCI20 | 2-оксоглутарат/малат антипортер | |||
| PPT1 | Пластидный фосфат/фосфоенолпируват антипортер | Транспорт фосфоенолпирувата | ||
| MEX1 | Экспортер мальтозы | Ввод/вывод сахаров из пластиды | ||
| HXT1 | Пластидный переносчик гексоз | |||
Изменение метаболизма сахаров может приводить к изменению баланса между депонированием и мобилизацией крахмала. Важную роль в синтезе крахмала играет разветвляющий фермент (SBE). Деградация крахмала начинается с фосфоролиза под действием фосфорилазы крахмала (PHOB), гидролиз осуществляется амилазами (например, β‑амилазой, AMYB), промежуточные продукты распада метаболизируются глюкантрансферазами (табл. 1).
Особенностью клеток зеленых микроводорослей является тесное взаимодействие различных органелл в ходе метаболизма. Примером может служить особое биохимическое и физиологическое значение пластиды хламидомонады [12, 15]. Из этого вытекает физиологическое значение пластидных транспортеров микроводорослей, интерес к которым набирает силу в последние годы [16]. Показано, что подготовительная фаза гликолиза (“верхняя часть”) локализована в пластидах, а синтез АТФ (“нижняя часть”) – в цитозоле [3]. Пластидные транспортеры трехуглеродных соединений связывают подготовительный и окислительный этапы гликолиза и, тем самым, являются элементом регуляции направленности метаболических потоков гликолиза и глюконеогенеза [3]. Особую роль играют транспортеры триозофосфатного шунта, поддерживающего энергетический баланс между пластидой и цитозолем, такие как TPT2 и APE2. Когда уровень НАД(Ф) · H и АТФ в компартменте (пластиде или цитозоле) низок, глицеральдегид-3-фосфат (G3P) окисляется до 3-фосфоглицерата (3-PGA) с образованием АТФ и НАДФ · H. Затем 3-PGA транспортируется в другой компартмент, где он будет восстановлен до G3P и снова возвращен в исходный компартмент с низким уровнем энергии и восстановительной способности. При фотоавтотрофии основным местом синтеза АТФ, восстановленных коферментов и триоз является хлоропласт, а при гетеротрофии – цитозоль. Возможно, данные реакции могут протекать в цитозоле и хлоропласте в разных направлениях, в зависимости от трофических условий и работы транспортеров. В результате формируется цикл, снабжающий хлоропласт дополнительной энергией и восстановительной способностью или, напротив, выводящий их из органеллы [3]. Важную роль в энергетической связи пластиды и цитозоля играет также малатный шунт, компонентами которого являются локализованные в мембране хлоропласта транспортеры OMT и LCI20, предположительно являющиеся транспортерами малата и оксалоацетата или 2-оксоглутарата [17, 18]. Необходимо обратить внимание на фосфат/фосфоенолпируватный антипортер PPT1, являющийся звеном в пути углерода из цикла Кребса в глюконеогенез. Поскольку пластида является компартментом синтеза сахаров в процессе фотосинтеза и деградации крахмала, также как и местом начала гликолитического пути, пластидные транспортеры сахаров должны играть важную роль в метаболизме клетки. В пластидах хламидомонады обнаружены транспортеры гексоз HXT1 и мальтозы MEX1.
Анализ активности перечисленных ферментов и транспортеров имеет большое значение для расшифровки влияния трофических факторов, как на специфические этапы отдельных метаболических путей, так и на метаболизм в целом. К сожалению, подобные исследования практически отсутствуют. Не установлены и пути регуляции этих ферментов и транспортеров, в том числе на транскрипционном уровне.
Одним из широко распространенных способов выращивания микроводорослей является периодическое культивирование. При таком способе культивирования популяция микроорганизмов развивается в среде, которая с момента посева не обновляется и не снабжается дополнительно минеральными или органическими нутриентами. Его преимуществами являются универсальность, простота процедуры поддержания, отсутствие необходимости в сложном дополнительном оборудовании, масштабируемость и надежность. Особенностью периодической культуры являются непрерывные изменения среды и взаимосвязанные с ними изменения физиологического статуса клеток [19–22].
Показано, что экспрессия некоторых генов, кодирующих ферменты центрального метаболизма, динамично меняется в процессе роста культуры C. reinhardtii [13, 19, 22]. Однако участие трофических условий в регуляции экспрессии во многом не определено. В связи с этим, особый интерес представляет анализ влияния ацетата на уровень экспрессии генов, кодирующих ферменты первичного метаболизма и пластидные транспортеры в условиях развивающейся периодической культуры.
МАТЕРИАЛЫ И МЕТОДЫ
Объект и условия культивирования. Культура Chlamydomonas reinhardtii сс-124 wild type mt-[137c] была получена из коллекции кафедры генетики и биотехнологии биологического факультета Санкт-Петербургского государственного университета. Штамм cc-124, используемый в работе, является двойным мутантом по генам, кодирующим нитратредуктазу и транскрипционный фактор NIT2, и не способен расти на среде, содержащей нитрат. Для культивирования использованы среды, в которых в качестве источника азота используется не нитрат, а аммоний. При этих условиях эффекты, связанные с мутациями не проявляются. Культуры поддерживали аксенично при миксотрофных условиях на среде TAP (Tris Acetate Phosphate) [23] или автотрофных условиях на среде ТМ (Tris Minimal, отличается от TAP отсутствием ацетата). Культуры выращивали при постоянном освещении люминесцентными лампами холодного света с интенсивностью 3000 люкс (~42 мкмоль фотонов ФАР/(м2 с)), при комнатной температуре ~23°C. Культуры поддерживали в конических стеклянных колбах объемом 500 мл (250 мл среды), закупоренных ватными пробками. Для определения фаз роста культур измеряли их плотность с использованием камеры Горяева: в случае миксотрофной культуры – ежесуточно, в случае автотрофной – раз в трое суток. Данные представлены на рисунке в дополнительных материалах (Supplementary Fig. S1 ). Каждая биологическая повторность соответствовала отдельной культуре. Пробы последовательно отбирали из каждой культуры 4 раза в процессе ее развития. В начале экспоненциального роста (первые сутки для миксотрофных, третьи – для автотрофных), его середине (вторые сутки для миксотрофных, шестые – для автотрофных), второй половине – завершении экспоненциального роста (четвертые сутки для миксотрофных и двенадцатые сутки для автотрофных) и в стационарной фазе (шестые сутки для миксотрофных и двадцатые – для автотрофных).
Выделение РНК. 107–108 клеток осаждали центрифугированием (5 мин, 3000 g, 4°С). Клетки ресуспендировали в 1 мл реактива Пурзол (PureZOL™, Bio-Rad, США) и перемешивали на вортексе. Гомогенат замораживали и хранили при –80°C, после оттаивания пробы инкубировали при комнатной температуре 5–10 мин. После чего гомогенат очищали от остатков клеток центрифугированием при 12000 g в течение 10 мин при 4°C. К гомогенату добавляли 0.2 мл хлороформа, интенсивно перемешивали 15–20 секунд и затем выдерживали 5 минут при комнатной температуре, периодически перемешивая. Затем пробу центрифугировали при температуре 4°С в течение 15 мин при 12500 g. После центрифугирования отбирали водную фазу и к ней добавляли 0.5 мл изопропанола, после инкубировали 10 мин при комнатной температуре. Далее, пробу 10 мин центрифугировали при температуре 4°С при 12 500 g и удаляли супернатант. Для промывания осадка к нему добавляли 1 мл 75% этанола, перемешивали на вортексе и центрифугировали 5 мин при 4°С и 12 500 g, затем супернатант удаляли. В завершении осадок подсушивали и растворяли в 20–25 мкл деионизированной воды, обработанной диэтилпирокарбонатом (DEPC). Качество и количество выделенной РНК проверяли спектрофотометрически по соотношению поглощения света с длинами волн 260/230 и 260/280 нм (значения близки к 2 для качественного препарата) с использованием спектрофотометра NanoDrop 1000 (Thermo Fisher Scientific, США). Пробы хранили при –80°С.
Получение кДНК. Очистку препарата РНК от примеси ДНК осуществляли ДНКазой (DNase I, RNase-free, Thermo Fisher Scientific, США), согласно инструкциям производителя. Синтез кДНК осуществлялся с использованием Oligo(dT) праймеров (“Бигль”, Россия) и M-MuLV обратной транскриптазы (Thermo Fisher Scientific, США), согласно инструкции производителя, с применением ингибитора РНКаз (Thermo Scientific RiboLock RNase Inhibitor, США). Пробы хранили при –80°С.
ПЦР в реальном времени. Перечень генов интереса приведен в таблице 1. Информация о последовательностях генов была получена из базы NCBI. Праймеры разрабатывали с использованием программы Beacon-Designer 8 (Sigma Aldrich). Разработанные и использованные последовательности праймеров приведены в таблице 2. Длина праймеров составляла около 20 нуклеотидов, длина ампликона 80–250 нуклеотидов, предсказанная температура плавления около 60°С. Оценку качества праймеров проводили путем постановки реакции ПЦР в реальном времени с последующим анализом кривых накопления продуктов реакции и кривых плавления, а также длины синтезированных фрагментов с помощью электрофореза в полиакриламидном геле. ПЦР-РВ проводили в присутствии SYBR Green I (“Синтол”, Россия) на амплификаторе CFX96 (BioRad, США) в следующем режиме: сначала 95°С – 7 минут, затем 40 циклов 95°С – 15 с, 60°С – 50 с.
Таблица 2.
Последовательности праймеров к генам, анализируемым в работе
| Локус | Название | Праймеры |
|---|---|---|
| CHLREDRAFT_129982 | ACK1 | CCTGTCGGGTCGGCAGTG GTGGTCCTTGGCGGGAATCT |
| CHLREDRAFT_128476 | ACK2 | GCGTCTTGGTCCTGAAC ACATTCTCCTTGATGAAATCC |
| CHLREDRAFT_196544 | ACLA1 | TGCCTATCCAGGTGGTTCAGTTCA CGGGCGGTGGCGAAATCAAT |
| CHLREDRAFT_186611 | ACLB1 | CGAGACTCCATCTGTCGCTGCT CTGCGGAAGGAGGCGTAGTTGAT |
| CHLREDRAFT_194063 | ACS1 | CTGACTCTATTGTTGCGAAGG CGTTGATGTTGGACTGGC |
| CHLREDRAFT_139750 | ACS2 | GCAGGACAAGCAACAGTACGAGG TCCAGGCAGTTGTAGGCGATG |
| CHLREDRAFT_116873 | AGA1 | GATGACTGCTGGATGGAGAA TACACGCCGAACTTGAGG |
| CHLREDRAFT_183141 | AMYB1 | AGCCAGTGCGTTCTCAGA AAGCGGTCCTCGTCTATCATT |
| CHLREDRAFT_205633 | APE2 | GCTCGTCCGTGCTGTTCTTCA CCTTCTTGTGCTTGTGCTTGCT |
| CHLREDRAFT_185478 | BCC1 | CCGAGGAGGTTGAGGCTGCTA CAGGCTGAAACGCTTGCTCTTC |
| CHLREDRAFT_111372 | – | GCTTCCCGACCTTCTTTG CCGCCCACAATGATGATG |
| CHLREDRAFT_122970 | – | GCGGCGAGATTGCTGTG GGGATGTTGAGGTAGGACT |
| CHLREDRAFT_123419 | – | GCCTCCTACGCCAACATCCACAT GCATCACCAGCCAGTCCACAGA |
| CHLREDRAFT_137300 | – | GTTGTGGAGGGCGACGA TGTGGCAGCGGTGTTCT |
| CHLREDRAFT_184945 | – | CGGTATCGGCAGCATCAAT ACATCTCACGCAGGTTCAC |
| CHLREDRAFT_195672 | – | GACTCCTACTGGGTCATCCTGGG CAGGCTGAAACGCTTGCTCTTC |
| CHLREDRAFT_194915 | CIS2 | AACACCACCGCCGTCATC TCACATCAATCACCTCCGTCG |
| CHLREDRAFT_24459 | FBA3 | GCCCTGATGATGAAGTCGTCGG CAACGGTGCCAGCGGTCTT |
| CHLREDRAFT_21582 | HXK1 | CACTCGGCATCCTCATCCTA CGTCGGCAGCATCATCAT |
| CHLREDRAFT_196325 | HXT1 | CTGATCGGCGTGCTGCTGTTC ACGGAGGATGAGAAGTAGACCAGGG |
| CHLREDRAFT_205915 | LCI20 | GCGGCGACCACCAATGAGAT GCGACTTGATGATGGGCACAAAGA |
| CHLREDRAFT_205893 | MEX1 | GATGGAAGGGCGACGGACAAC CATTCTGGACGACTTGCGGAAGC |
| CHLREDRAFT_185488 | OMT1 | GGAGTGCCTGAACAACAAC AGAAGTAGTGCGAGTAGAAGT |
| CHLREDRAFT_19661 | PCK1 | TTATGAACAACGCCCGCATCC GCTCAGTCACGCCCATCTCAGT |
| CHLREDRAFT_144475 | PPT1 | GTCAAGTCGTGGCAGCAGTT GAAGAAGGGCGTCGTGGAG |
| CHLREDRAFT_82986 | RBCS1 | CTGAAGCCCGCCGTCAAGG AGAGGAGGCAGGTAGGAGAAGGT |
| CHLREDRAFT_195590* | RPL19 | TCGGTTCTGAACTGCGGTCTG CGGGCTGCTTACGGAAGATGA |
| CHLREDRAFT_94079 | SBE3 | CCAACTGCGTCACCATCG GCTTCATCACCTCAATCCACTT |
| CHLREDRAFT_140452 | STA11 | GCTCATCAAGGACGGACTGC ACTGCCACCACGCCAACT |
| CHLREDRAFT_196431 | TAL2 | CCGCCTTTCCACCATTGT GCTGTTGCTGTTCTTGCC |
| CHLREDRAFT_26265 | TPIC | ACGAGGTGGTGGCGAAGAAGACT GGCGTCCAGAACCTTGAACACAGA |
| CHLREDRAFT_182319 | TPT2 | GCTCTGCAAAGGCACCAAGTTCAA GCCCTTATCGGACTCGCCATCT |
| CHLREDRAFT_141319 | TRK1 | CGACGCCATCAACAAGTCCAAGT TCGTAGCCAGTCAGGTGCATCAT |
Математический анализ и визуализация данных. В качестве референсного гена был использован ген RPL19, который кодирует рибосомный белок L19. Стабильность уровня экспрессии этого гена ранее была установлена для стрессовых условий [24]. Расчет относительной экспрессии проводили по формуле:
где Сtr – цикл выхода референсного гена, а Ctq – гена интереса.
Динамика накопления продукта его экспрессии в процессе развития культуры хламидомонады при разных трофических условиях была протестирована в данной работе в ходе дополнительного эксперимента. Измерения проводили в трех биологических и трех аналитических повторностях (Supplementary Table S1 ).
Анализ данных проводили в среде языка R [25]. Для парного сравнения применяли тест Манна-Уитни-Вилкоксона (MWW). Для коррекции Р‑значения использовали FDR (False Discovery Rate).
На первом этапе было проведено снижение размерности методом главных компонент (Principal Component Analysis, PCA). PCA является методом без учителя (т.е. без учета принадлежности наблюдений к определенному классу). PCA позволяет выявить несколько скрытых переменных, главных компонент, которые описывают большую долю дисперсии в экспериментальных данных. В процессе выполнения PCA матрица исходных данных раскладывается на две. Первая матрица счетов позволяет представить наблюдения в пространстве низкой размерности. Вторая матрица нагрузок представляет собой ковариации измеренных параметров и счетов. Использование PCA позволяет глубоко проникнуть в структуру данных, путем представления объектов, описывающихся большим числом признаков в пространстве небольшого числа новых переменных, определяющих дисперсию измеренных параметров. В результате появляется возможность оценить сходства и различия объектов, наличие групп, определить выпадающие наблюдения, выдвинуть и проверить гипотезы о действии факторов [26]. PCA выполнен с помощью пакета pcaMethods. Использовали метод сингулярного разложения (Single Value Decomposition). Данные были стандартизированы (M = 0, SD = 1).
(O)PLS-DA – метод близок к PCA, но основан на комбинированном разложении двух матриц. Первая матрица дескрипторов содержит экспериментальные измерения, такие, как относительная экспрессия генов. Вторая матрица ответов включает в себя априорные данные, например, принадлежность объекта к классу. В результате мы получаем матрицу счетов, где объекты представлены в пространстве меньшей размерности, но уже так, что различия между классами максимальны. Также мы получаем матрицу факторных нагрузок, которая характеризует связь между параметрами и новыми главными компонентами, которая отражает разницу классов. Кроме того, для каждой переменной мы получаем значение VIP (Variable Importance in Projection), которое показывает значимость переменной для классификации. Если VIP > 1, то переменная считается значимо связанной с различием классов. При OPLS-DA различия классов связываются с одной компонентой, что упрощает интерпретацию при бинарной классификации [27]. OPLS-DA выполнен в пакете ropls. Достоверность моделей оценивали по значениям R2Y, Q2Y, и их вероятности после пермутации. В качестве оценки связи переменной с различием классов использовали VIP (Variable Importance in Projection).
РЕЗУЛЬТАТЫ
Общие различия авто- и миксотрофных культур
В данной работе проанализирована экспрессия 32 генов, кодирующих ферменты первичного метаболизма и пластидные транспортеры C. reinhardtii. Чтобы выявить и визуализировать сходства и различия профилей экспрессии клеток авто- и миксотрофных культур, был проведен PCA. На графике матрицы счетов (рис. 1) профили экспрессии автотрофных и миксотрофных культур разделены в пространстве первых трех PC. Кроме того, наблюдалась кластеризация проб согласно возрасту культуры. Нужно отметить, что по мере старения культур различия между авто- и миксотрофными культурами сглаживались. Поскольку профили экспрессии характеризовались кластеризацией, соответствующей трофическому статусу, на следующем этапе была проведена классификация по этому признаку и отбор переменных, наибольшим образом связанных с различиями классов, методом OPLS-DA. Модель включала одну ортогональную компоненту, R2X = 0.39, R2Y = 0.94, Q2Y = 0.91, P ≤ 0.05, следовательно, можно говорить о значимом различии профилей экспрессии авто- и миксотрофных культур. Моделирование с помощью OPLS показало, что c предиктивной компонентой, отражающей влияние трофических условий выращивания культуры, связано около 26% дисперсии относительного уровня экспрессии генов. Данная доля хотя и невысока, но довольно существенна. Относительно невысокое значение можно объяснить тем, что развитие культуры оказывало бóльшее действие на состояние транскрипционного профиля, чем трофические условия. На рисунке 2 визуализировано выявленное методом OPLS-DA влияние трофических условий на уровни экспрессии генов. Отметим, что в миксотрофных клетках уровень экспрессии генов ACS2, CHLREDRAFT_137300, CHLREDRAFT_184945, RBCS1, PCK1, CHLREDRAFT_195672, LCI20 был выше (положительные нагрузки предиктивной компоненты, VIP > 1). При автотрофии более высокий уровень экспрессии (отрицательные нагрузки предиктивной компоненты, VIP > 1) наблюдался для генов ACLA, ACLB, PPT1, HXT1, AMYB1, ACK1.
Рис. 1.
График матрицы счетов, полученный методом PCA при анализе профилей экспрессии генов автотрофных и миксотрофных культур Chlamydomonas reinhardtii. Цвет соответствует трофическому статусу: темный – миксотрофные, светлый – автотрофные клетки. Символы соответствуют возрасту культуры (сутки после посева): кружки – 1, треугольники с вершиной вверху – 2, кресты прямые – 3, кресты косые – 4, ромбы – 6, треугольники с вершиной внизу – 12, перечеркнутые квадраты – 20.
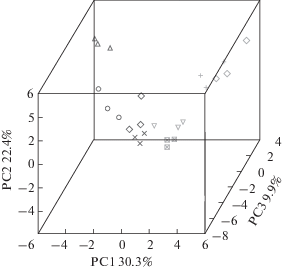
Рис. 2.
Визуализация дифференциальной активности генов, кодирующих ферменты центрального метаболизма и пластидные транспортеры, в зависимости от трофических условий на всем протяжении роста культуры Chlamydomonas reinhardtii выявленной с помощью OPLS-DA (VIP > 1). Темно-серый – уровень экспрессии выше в миксотрофных культурах, серый – в автотрофных, светло-серый – достоверные различия не выявлены (VIP < 1).

Различия авто- и миксотрофных культур в период экспоненциального роста
В связи с тем, что различия в профилях экспрессии максимальны в период экспоненциального роста, сравнение экспрессии генов авто- и миксотрофных культур было проведено именно на этом этапе развития (1, 2 сутки для миксотрофных и 3, 6 сутки для автотрофных культур). Модель включала одну ортогональную компоненту, R2X = 0.68, R2Y = 0.98, Q2Y = 0.95, P ≤ 0.05. Оказалось, что c предиктивной компонентой, связано около 46% дисперсии относительного уровня экспрессии генов. Бóльшая доля дисперсии, связанная с влиянием трофических условий, обусловлена уменьшением доли дисперсии, связанной с возрастом культуры, поскольку рассматриваются только 2 смежные временные точки. На рисунке 3 выявленные различия визуализированы на схеме метаболических потоков. В период экспоненциального роста при миксотрофии был значительно выше уровень экспрессии генов ACS2, CHLREDRAFT_137300, PCK1, LCI20, STA11, RBCS1, CHLREDRAFT_123419, CHLREDRAFT_184945, OMT1, CHLREDRAFT_122970 и TPIC. При автотрофии клетки хламидомонады в этот период характеризовались более высоким уровнем накопления продуктов экспрессии генов ACLA1, ACLB1, ACK1, AMYB1, PPT1, HXT1, HXK1 и AGA1.
Рис. 3.
Визуализация дифференциальной активности генов, кодирующих ферменты центрального метаболизма и пластидные транспортеры, в зависимости от трофических условий в экспоненциальной фазе роста культуры Chlamydomonas reinhardtii выявленной с помощью OPLS-DA (VIP > 1). Темно-серый – уровень экспрессии выше в миксотрофных культурах, серый – в автотрофных, светло-серый – достоверные различия не выявлены (VIP < 1).

Различия авто- и миксотрофных культур в более поздний период
Далее было проведено сравнение уровня экспрессии генов интереса в авто- и миксотрофных культурах в период завершения лог-фазы и начала стационарной фазы (4, 6 сутки для миксотрофных и 12, 20 сутки для автотрофных культур). OPLS-DA модель включала одну ортогональную компоненту, R2X = 0.69, R2Y = 0.96, Q2Y = 0.91, P ≤ 0.05. Доля дисперсии, связанная с предиктивной компонентой, составляла 31%, что в полтора раза ниже, чем таковая доля при сравнении культур в фазе экспоненциального роста. Можно заключить, что, в целом, различия в экспрессии генов между культурами сглаживаются на поздних стадиях развития. На рисунке 4 (ордината) представлены графики нагрузок предиктивной компоненты OPLS-DA модели. К различиям авто- и миксотрофных культур, описанным выше, добавляется высокий уровень экспрессии гена BCC1, кодирующего субъединицу ацетил-КоА синтазы.
Рис. 4.
График SUS-plot (Shared and Unique Structures): рассеяние генов в пространстве нагрузок предиктивных компонент, полученных при OPLS-DA анализе различий профилей экспрессии авто- и миксотрофных культур Chlamydomonas reinhardtii: абсцисса – модель для культур в фазе экспоненциального роста (1, 2 сутки для миксотрофных и 3, 6 сутки для автотрофных культур), ордината – для периода завершения фазы роста и стационарной фазы (4, 6 сутки для миксотрофных и 12, 20 сутки для автотрофных культур.
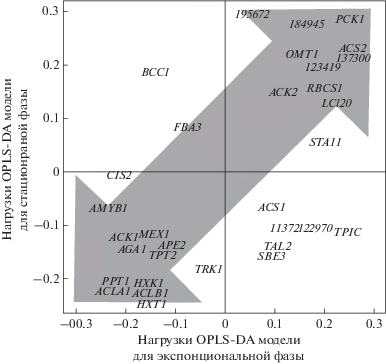
Далее был проведен сравнительный анализ различий профилей экспрессии миксотрофных и автотрофных культур на стадиях экспоненциального роста и период завершения лог-фазы и начала стационарной фазы. Для этого был построен график (рис. 4) рассеяния генов в пространстве нагрузок предиктивных компонент, полученных при OPLS-DA анализе различий профилей экспрессии клеток культур, растущих при авто- и миксотрофных условиях и находящихся в фазе экспоненциального роста (абсцисса) и в период завершения роста/стационарной фазе (ордината). Наблюдалась корреляция этих параметров (r = 0.64 p = 10-4), и бóльшая часть проанализированных генов имела одинаковые знаки нагрузок в обеих моделях. Это свидетельствует о сохранении сходной картины различий между авто- и миксотрофными культурами на всем протяжении развития культуры.
Связь старения миксотрофной культуры и смещения трофического статуса
Как было сказано выше, экспрессия генов существенно меняется в процессе роста миксотрофной культуры. Возможно одним из факторов, определяющих характер паттерна экспрессии, является исчерпание ацетата на этапе старения. Для выявления значения этого трофического фактора проведено сравнение изменений экспрессии генов интереса при переходе миксотрофной культуры от экспоненциального роста (1–2 сутки) к стационарной фазе (4–6 сутки). В связи с тем, что степень автотрофной составляющей растет с возрастом миксотрофной культуры, в сравнение включены различия между растущими и стационарными автотрофными культурами. В результате были построены графики SUS-plot. На рисунке 5a представлено рассеяние генов в пространстве нагрузок предиктивных компонент полученных при OPLS-DA моделировании различий между авто- и миксотрофными культурами, находящимися в фазе экспоненциального роста (абсцисса), и миксотрофными культурами в экспоненциальной и стационарной фазах (ордината). Отметим, что возрастные изменения экспрессии генов интереса, происходящие в миксотрофной культуре достоверно коррелировали с разницей между трофическими условиями (r = 0.45, p = 0.01). Существенно отклонялась от этой закономерности группа генов, обведенная пунктирной линией. Для них было характерно снижение уровня экспрессии при старении культуры как при авто-, так и при миксотрофии (рис. 5б).
Рис. 5.
Выявление связи типа питания и старения миксотрофной и автотрофной культур на уровне экспрессии генов. Графики SUS-plot (Shared and Unique Structures): (а) – рассеяние уровней экспрессии генов в пространстве нагрузок предиктивных компонент полученных при OPLS-DA анализе различий авто и миксотрофных культур, находящихся в фазе роста (абсцисса) и при сравнении миксотрофных культур в экспоненциальной и стационарной фазах (ордината); (б) – рассеяние уровней экспрессии генов в пространстве нагрузок предиктивных компонент полученных при OPLS-DA анализе различий культур в экспоненциальной и стационарной фазах: автотрофных (абсцисса) и миксотрофных (ордината).

ОБСУЖДЕНИЕ
C. reinhardtii обладает пластидными и непластидными формами ферментов метаболизма ацетата. Возможно, одной из функций такого разделения служит распределение ацетильных групп между биохимическими процессами компартментов клетки. К пластидным, прежде всего, относится синтез жирных кислот, тогда как к цитозольным и митохондриальным ‒ цикл Кребса и его модификации. ACS2 был единственным из четырех проанализированных генов, кодирующих ферменты, связанные с начальным этапом ассимиляции ацетата, уровень экспрессии которого повышался при наличии метаболита в среде. Данный ген кодирует пластидную форму ацетил-КоА синтазы. Необычным, на первый взгляд, кажется более высокий при автотрофии уровень экспрессии гена, кодирующего ацетаткиназу (ACK1). Однако ферментная система ACK1-PAT2, предположительно, также локализованная в хлоропластах, вероятно, вовлечена не столько в утилизацию ацетата, сколько в другие процессы, например, анаэробный метаболизм [28]. Можно заключить, что ацетат активирует пластидный путь ассимиляции посредством активации гена ACS2 с последующим включением экзогенных ацетильных групп в синтез жирных кислот.
С этим предположением согласуется бóльший уровень экспрессии гена CHLREDRAFT_184945, кодирующего одну из субъединиц ацетил-КоА-карбоксилазы и CHLREDRAFT_123419, кодирующего FabH (3-оксоацил-[ацил-переносящий белок] синтазу III, KASIII). К отличиям миксотрофных культур от автотрофных на поздних стадиях добавляется более высокий уровень экспрессии гена BCC1, кодирующего еще одну субъединицу ацетил-КоА-карбоксилазы, что может быть результатом дальнейшего усиления синтеза липидов при старении миксотрофной культуры [29]. С другой стороны, подтверждается предположение о связи уровня синтеза липидов с уровнем экспрессии генов, кодирующих АСС, что было неочевидно с точки зрения данных, имеющихся в литературе [19]. Возможно, влияние уровня активности ацетил-КоА-карбоксилазы на уровень синтеза жирных кислот и липидов определяется обилием ацетильных групп. При автотрофии, когда ацетильных групп немного, связи между уровнем транскрипции генов этого фермента и уровнем синтеза липидов и жирных кислот не наблюдается [19, 22], по-видимому, в силу избыточной активности фермента. С другой стороны, если в среде присутствует ацетат, интенсивный синтез ацетил-КоА ферментом ACS2 может привести к тому, что именно ацетил-КоА-карбоксилаза может стать “бутылочным горлышком”, ограничивающим синтез жирных кислот. Это может объяснять повышение экспрессии генов, кодирующих субъединицы этого фермента при наличии ацетата в среде в сочетании с ростом уровня содержания липидов [30].
Интенсификация синтеза липидов при миксотрофии может быть связана с повышением уровня экспрессии гена TPIC, поскольку фермент TPIC участвует в синтезе “углеродных скелетов” для TAG. Ранее повышение содержания этого фермента наблюдалось при миксотрофии [8].
Приток экзогенных ацетильных групп в пути синтеза жирных кислот должен повлечь снижение их выхода из ЦТК. Считается, что цитратлиаза (ACLB1, ACLA1) обеспечивает выход ацетильных групп, в первую очередь, для синтеза жирных кислот. Более высокий уровень экспрессии генов ACLB1, ACLA1 при автотрофии можно объяснить тем, что в отсутствии ацетата, являющегося источником ацетил-КоА, баланс распределения ацетильных групп между ЦТК и прочими метаболическими процессами должен сместиться в сторону выхода ацетилов из цикла Кребса.
С ассимиляцией ацетата может быть связана и повышенная экспрессия гена PCK1, кодирующего фосфоенолпируваткарбоксикиназу, выводящую углерод из цикла Кребса в глюконеогенез.
Менее очевидной кажется причина роста экспрессии RBCS1. Возможно, это связано с увеличением активности фотосинтеза при миксотрофии, в результате роста уровня дыхания и выделения CO2. Однако это предположение не согласуется с различиями в экспрессии других генов, кодирующих ферменты цикла Кальвина.
Более высокий уровень экспрессии CHLREDRAFT_13700, кодирующего фосфорилазу крахмала, и CHLREDRAFT_195672, кодирующего трегалазу, и STA11, кодирующего 4-α-глюканотрансферазу, указывает на бóльшую интенсивность метаболизма крахмала при миксотрофии. В свою очередь, для автотрофных клеток была свойственна высокая экспрессия гена AMYB1, вовлеченного в деградацию крахмала (рис. 3), что, возможно, свидетельствует о роли крахмала в качестве резервного метаболита, синтез которого зависит от уровня глюкозы. Продуктом активности AMYB1 является и мальтоза, следовательно, усиление экспрессии гена, кодирующего пластидный экспортер мальтозы MEX1, согласуется с увеличением содержания мальтозы и других олигосахаридов при автотрофии.
Усиление экспрессии при автотрофных условиях показали еще два гена пластидных транспортеров: HXT1, PPT1. Различия с меньшим уровнем значимости также показал ген триозофосфатного транспортера – TPT2. Выявленное увеличение уровня экспрессии генов пластидных транспортеров может отражать интенсификацию обмена между пластидой и цитозолем при автотрофном метаболизме. Это соответствует большему содержанию в автотрофных клетках сахаров, источником которых являются как непосредственно процессы фотосинтеза, так и деградация крахмала. Повышенное при миксотрофии накопление транскриптов LCI20, кодирующих пластидный антипортер, связанный с малатным шунтом, обеспечивающим обмен восстановительной способностью между пластидой и митохондриями [3], можно связать с ее перераспределением от фиксации углерода в пластиде к процессу генерации энергии в митохондриях. Это, возможно, является следствием появления нового источника восстановленного углерода в форме ацетата.
Поскольку периодическая культура является динамически развивающейся системой, особое внимание следует уделить влиянию фазы развития на различия культур в различных трофических условиях. Оказалось, что различия между автотрофными и миксотрофными культурами, в целом, сходны на стадии роста и стационарной фазы (рис. 4). Тем не менее, влияние развития на эти различия присутствовало. Так в стационарной фазе экспрессия BCC1 была выше при миксотрофии, чем при автотрофии и, наоборот, положительная регуляция ацетатом активности ряда генов, характерная для миксотрофии в экспоненциальной фазе, уже не наблюдалась в стационарной. Можно заключить, что различия в экспрессии генов между культурами с возрастом сглаживались.
Значимым наблюдением, можно считать то, что на уровне профиля транскрипции в процессе развития миксотрофной культуры наблюдается дрейф в сторону автотрофных культур. Лишь небольшая часть проанализированных генов (на рис. 5а гены выделены пунктирной линией) не укладывается в эту закономерность. Возможно уровень экспрессии этих генов падает со старением, как в авто-, так и миксотрофных условиях (рис. 5б), и это искажает влияние на них исчерпания уровня ацетата в среде. В тоже время значительного сходства в изменениях экспрессии генов при старении культуры при авто- и миксотрофных условиях не наблюдалось (рис. 5б), хотя большая группа генов характеризовалась снижением уровня экспрессии при исследованных типах питания (выделены пунктиром). Таким образом, в действии старения на профили экспрессии можно выделить две главные составляющие: во-первых, происходило снижение уровня экспрессии бóльшей части генов, связанное с падением физиологической активности [21] и, во-вторых, в миксотрофной культуре происходило изменение баланса миксотрофии и автотрофии в пользу последней, что также реализовалось и на уровне транскрипционного профиля.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (грант № 19-04-00655; а также государственного задания Ботанического института им. В.Л. Комарова Российской академии наук № АААА-А18-118032390136-5).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Harris E., Stern D., Witman G. The Chlamydomonas Sourcebook. 2nd ed. Amsterdam: Elsevier, 2009.
Johnson X., Alric J. Interaction between starch breakdown, acetate assimilation, and photosynthetic cyclic electron flow in Chlamydomonas reinhardtii // J. Biol. Chem. 2012. V. 287. P. 26445. https://doi.org/10.1074/jbc.m112.370205
Johnson X., Alric J. Central carbon metabolism and electron transport in Chlamydomonas reinhardtii: Metabolic constraints for carbon partitioning between oil and starch // Eukaryotic Cell. 2013. V. 12. P. 776. https://doi.org/10.1128/ec.00318-12
Heifetz P., Förster B., Osmond C., Giles L., Boynton J. Effects of Acetate on Facultative Autotrophy in Chlamydomonas reinhardtii assessed by photosynthetic measurements and stable isotope analyses // Plant Physiol. 2000. V. 122. P. 1439. https://doi.org/10.1104/pp.122.4.1439
Fischer B., Wiesendanger M., Eggen R. Growth condition-dependent sensitivity, photodamage and stress response of Chlamydomonas reinhardtii exposed to high light conditions // Plant Cell Physiol. 2006. V. 47. P. 1135.
Fett J., Coleman J. Regulation of periplasmic carbonic anhydrase expression in Chlamydomonas reinhardtii by acetate and pH // Plant Physiol. 1994. V. 106. P. 103.
Fan J., Yan C., Andre C., Shanklin J., Schwender J., Xu C. Oil accumulation is controlled by carbon precursor supply for fatty acid synthesis in Chlamydomonas reinhardtii // Plant Cell Physiol. 2012. V. 53. P. 1380. https://doi.org/10.1093/pcp/pcs082
Weiss J., May P., Kempa S., Irgang S., Recuenco-Munoz L., Pietzke M., Schwemmer T., Rupprecht J., Egelhofer V., Weckwerth W. Targeted proteomics for Chlamydomonas reinhardtii combined with rapid subcellular protein fractionation, metabolomics and metabolic flux analyses // Mol. Biosyst. 2010. V. 6. P. 1018. https://doi.org/10.1039/b920913a
Höhner R., Barth J., Magneschi L., Jaeger D., Niehues A., Bald T., Grossman A., Fufezan C., Hippler M. The metabolic status drives acclimation of iron deficiency responses in Chlamydomonas reinhardtii as revealed by proteomics based hierarchical clustering and reverse genetics // Mol. Cell. Proteomics. 2013. V. 12. P. 2774. https://doi.org/10.1074/mcp.m113.029991
Semenenko V., Zvereva M., Kuptsova E., Klimova L., Vladimirova M. Metabolite Regulation of the chloroplast genome expression and the chloroplast-cytoplasm regulatory relationships // Proc. Life Sci. 1984. P. 128. https://doi.org/10.1007/978-3-642-69686-2_14
Goodenough U., Blaby I., Casero D., Gallaher S.D., Goodson C., Johnson S., Lee J.-H., Merchant S.S., Pellegrini M., Roth R., Rusch J., Singh M., Umen J.G., Weiss T.L., Wulan T. The path to triacylglyceride obesity in the sta6 strain of Chlamydomonas reinhardtii // Eukaryotic Cell. 2014. V. 13. P. 591. https://doi.org/10.1128/ec.00013-14
Terashima M., Specht M., Naumann B., Hippler M. Characterizing the anaerobic response of Chlamydomonas reinhardtii by quantitative proteomics // Mol. Cell. Proteomics. 2010. V. 9. P. 1514. https://doi.org/10.1074/mcp.m900421-mcp200
Deng X., Cai J., Fei X. Effect of the expression and knockdown of citrate synthase gene on carbon flux during triacylglycerol biosynthesis by green algae Chlamydomonas reinhardtii // BMC Biochem. 2013. V. 14. P. 38. https://doi.org/10.1186/1471-2091-14-38
Boyle N., Morgan J. Flux balance analysis of primary metabolism in Chlamydomonas reinhardtii // BMC Systems Biology. 2009. V. 3. P. 4. https://doi.org/10.1186/1752-0509-3-4
Winck F., Páez Melo D., González Barrios A. Carbon acquisition and accumulation in microalgae Chlamydomonas: Insights from “omics” approaches // J. Proteomics. 2013. V. 94. P. 207. https://doi.org/10.1016/j.jprot.2013.09.016
Marchand J., Heydarizadeh P., Schoefs B., Spetea C. Ion and metabolite transport in the chloroplast of algae: lessons from land plants // Cell. Mol. Life Sci. 2018. V. 75. P. 2153. https://doi.org/10.1007/s00018-018-2793-0
Atteia A., Adrait A., Brugiere S., Tardif M., van Lis R., Deusch O., Dagan T., Kuhn L., Gontero B., Martin W., Garin J., Joyard J., Rolland N. A Proteomic survey of Chlamydomonas reinhardtii mitochondria sheds new light on the metabolic plasticity of the organelle and on the nature of the -proteobacterial mitochondrial ancestor // Mol. Biol. Evol. 2009. V. 26. P. 1533. https://doi.org/10.1093/molbev/msp068
Terashima M., Specht M., Hippler M. The chloroplast proteome: a survey from the Chlamydomonas reinhardtii perspective with a focus on distinctive features // Curr. Genet. 2011. V. 57. P. 151. https://doi.org/10.1007/s00294-011-0339-1
Lv H., Qu G., Qi X., Lu L., Tian C., Ma Y. Transcriptome analysis of Chlamydomonas reinhardtii during the process of lipid accumulation // Genomics. 2013. V. 101. P. 229. https://doi.org/10.1016/j.ygeno.2013.01.004
Пузанский Р.К., Шаварда А.Л., Шишова М.Ф. Динамика метаболома клеток автотрофной культуры Chlamydomonas reinhardtii в период экспоненциальной и стационарной фазы роста // Вестник Санкт-Петербургского университета. 2015. Т. 60. № 3. С. 104.
Puzanskiy R., Tarakhovskaya E., Shavarda A., Shishova M. Metabolomic and physiological changes of Chlamydomonas reinhardtii (Chlorophyceae, Chlorophyta) during batch culture development // J. Appl. Phycol. 2017. V. 30. P. 803. https://doi.org/10.1007/s10811-017-1326-9
Puzanskiy R., Romanyuk D., Shishova M. Coordinated alterations in gene expression and metabolomic profiles of Chlamydomonas reinhardtii during batch autotrophic culturing // Bio. 2018. V. 63. P. 87. https://doi.org/10.21638/spbu03.2018.110
Gorman D., Levine R. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi //Proc. Natl. Acad. Sci. USA. 1965. V. 54. P. 1665. https://doi.org/10.1073/pnas.54.6.1665
Liu C., Wu G., Huang X., Liu S., Cong B. Validation of housekeeping genes for gene expression studies in an ice alga Chlamydomonas during freezing acclimation // Extremophiles. 2012. V. 16. P. 419. https://doi.org/10.1007/s00792-012-0441-4
R Core Team. A Language and Environment for Statistical Computing. Vienna, Austria: R Foundation for Statistical Computing, 2018.
Jolliffe I., Cadima J. Principal component analysis: a review and recent developments // Philos. T. Roy. Soc. A. 2016. V. 374. P. 20150202. https://doi.org/10.1098/rsta.2015.0202
Bylesjö M., Rantalainen M., Cloarec O., Nicholson J., Holmes E., Trygg J. OPLS discriminant analysis: combining the strengths of PLS-DA and SIMCA classification // J. Chemometr. 2006. V. 20. P. 341. https://doi.org/10.1002/cem.1006
Yang D., Song D., Kind T., Ma Y., Hoefkens J., Fiehn O. Lipidomic analysis of Chlamydomonas reinhardtii under nitrogen and sulfur deprivation // PLoS ONE. 2015. V. 10: e0137948. https://doi.org/10.1371/journal.pone.0137948
Humby P., Snyder E., Durnford D. Conditional senescence in Chlamydomonas reinhardtii (Chlorophyceae) // J. Phycol. 2013. V. 49. P. 389. https://doi.org/10.1111/jpy.12049
Moon M., Kim C., Park W., Yoo G., Choi Y., Yang J. Mixotrophic growth with acetate or volatile fatty acids maximizes growth and lipid production in Chlamydomonas reinhardtii // Algal Res. 2013. V. 2. P. 352. https://doi.org/10.1016/j.algal.2013.09.003
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


