Физиология растений, 2020, T. 67, № 5, стр. 538-546
Изменение активности антиоксидантных ферментов при низкотемпературном закаливании Nicotiana tabacum L. и Secale cereale L.
В. Н. Попов a, *, Н. В. Нарайкина a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: vnpopov@mail.ru
Поступила в редакцию 17.01.2020
После доработки 04.03.2020
Принята к публикации 06.03.2020
Аннотация
Исследовали изменения активности супероксиддисмутазы (СОД), аскорбат-пероксидазы (АПО) и каталазы (КАТ) у растений Nicotiana tabacum L. и Secale cereale L. при низкотемпературном закаливании. Установлено, что в растениях табака происходит транзиторный рост содержания МДА в начале периода закаливания с последующей активацией СОД, АПО и КАТ. В отличие от табака, у озимой ржи содержание МДА и активность СОД, АПО и КАТ на протяжении всего периода закаливания оставались на уровне незакаленных растений. В клетках табака большая часть активности СОД была обнаружена в хлоропластах (90%), тогда как на долю других клеточных структур приходилось всего 10% от суммарной активности, идентифицированной в ПААГ. В клетках озимой ржи активность СОД распределялась между хлоропластами и другими клеточными компартментами равномерно (46% в хлоропластах и 54% вне хлоропластов). Распределение активности АПО и КАТ в клетках табака и озимой ржи было идентичным: вся АПО была сосредоточена в хлоропластах, в то же время вся каталазная активность проявлялась вне хлоропластов. Сделан вывод о том, что растения табака и озимой ржи демонстрировали разные стратегии антиоксидантной защиты в условиях действия низких закаливающих температур. Растения табака обеспечивали защиту от окислительных повреждений в процессе низкотемпературного закаливания за счет повышения активности СОД, АПО и КАТ. Растения озимой ржи были способны избегать развития окислительного стресса при закаливании за счет равномерного распределения активности СОД в клетках, поддержания конститутивной активности СОД, АПО и КАТ, а также, вероятно, за счет накопления низкомолекулярных антиоксидантов.
ВВЕДЕНИЕ
Большинство растений на Земле подвергаются действию разных неблагоприятных факторов, в том числе действию холода (низких положительных температур) и мороза (температуры ниже 0°С). Для растений, произрастающих в зоне умеренного климата, способность переносить действие низких температур имеет решающее значение для выживания в условиях холодового стресса разной продолжительности и интенсивности [1].
Принято считать, что одной из основных причин повреждения растений при гипотермии может быть окислительный стресс, вызванный повышенным содержанием АФК [2]. Низкие температуры могут вызывать смещение баланса оксидантов/антиоксидантов в сторону оксидантов, что и является причиной развития окислительного стресса. Чаще всего мишенью синглетного кислорода (1О2), супероксидного анион-радикала (${\text{O}}_{2}^{{\centerdot - }}$), пероксида водорода (H2O2) и гидроксильного радикала (ОН•) становятся молекулы липидов, содержащие полиненасыщенные жирные кислоты. В процессе ПОЛ снижается количество полиненасыщенных жирных кислот, что приводит к повышению вязкости клеточных мембран, нарушению работы связанных с мембранами ферментных систем и гибели клетки [2].
В природных условиях понижение температуры, как правило, происходит постепенно, давая возможность растениям адаптироваться к гипотермии. Считается, что различия в эффективности закаливания разных видов растений могут быть связаны в том числе с функционированием антиоксидантной системы, регулирующей уровень АФК и продуктов ПОЛ в клетке [3]. Система антиоксидантной защиты включает высокомолекулярные и низкомолекулярные компоненты. К первым относятся ферменты антиоксидантной защиты, важнейшими из которых являются супероксиддисмутаза (СОД), аскорбат-пероксидаза (АПО) и каталаза (КАТ), тогда как ко вторым – такие соединения, как аскорбиновая кислота, каротиноиды, антоцианы, α-токоферол, глутатион и др. [4].
Опубликован значительный массив данных, характеризующих развитие окислительного стресса и работу антиоксидантных ферментов в условиях низких температур у разных по устойчивости к гипотермии видов растений. Так, при исследовании сортов риса, отличающихся по устойчивости к холоду, после 14 суток охлаждения при 9°С большинство растений чувствительного к холоду сорта погибали, а устойчивого – выживали [5]. Содержание МДА у чувствительного к холоду сорта за время охлаждения увеличивалось почти в 5 раз, тогда как у холодоустойчивого сорта существенных изменений содержания МДА выявлено не было [5]. Установлено, что холодостойкие сорта реагируют на действие низкой положительной температуры повышением активности СОД, АПО и КАТ, в то время как у чувствительных к холоду сортов риса наблюдалось снижение активности всех антиоксидантных ферментов [6].
Во время закаливания растений гороха при температуре 4°С было обнаружено увеличение активности СОД, АПО и КАТ. Повышение активности антиоксидантных ферментов сопровождалось ростом устойчивости растений к морозу, что свидетельствует о непосредственном влиянии этих ферментов на развитие устойчивости к низкой температуре [7]. Показано, что во время закаливания проростков озимой и яровой пшеницы при 2°С происходило снижение активности АПО и КАТ, что не помешало этим растениям после закаливания выдержать промораживание при –6°С [8].
Таким образом, представлено большое количество противоречивых данных, описывающих изменение активности СОД, АПО и КАТ в ответ на действие гипотермии, что не позволяет сделать однозначный вывод о роли этих антиоксидантных ферментов в низкотемпературном закаливании растений. Результаты экспериментов сильно зависят от видовых особенностей, фаз развития растений и режимов холодовой обработки. Кроме того, существенным недостатком большинства публикаций является отсутствие экспериментальных данных о локализации исследуемых антиоксидантных ферментов в клетке. В связи с этим целью нашей работы являлось исследование особенностей локализации и функционирования основных антиоксидантных ферментов (СОД, АПО, КАТ) у растений табака и озимой ржи при низкотемпературном закаливании.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. Объектами исследования являлись теплолюбивое растение табак (Nicotiana tabacum L., сортотип Samsun) и морозостойкая озимая рожь (Secale cereale L., с. Пурга). Растения выращивали в почвенной культуре в камерах фитотрона ИФР РАН при температуре 22°С, 16-часовом фотопериоде и освещенности 100 мкмоль/(м2с). Для опытов использовали растения в возрасте четырех недель. Закаливание растений проводили в течение 5 суток в климатической камере KBW-240 (“Binder”, Германия) при следующих условиях: табак – температура +8°С, 16-часовой фотопериод и освещенность 100 мкмоль/(м2 с), озимая рожь – температура +2°С, 16-часовой фотопериод и освещенность 100 мкмоль/(м2 с). Данные режимы закаливания были подобраны в ходе предварительных опытов. За время низкотемпературного закаливания у растений табака и озимой ржи подвядания листьев не наблюдалось. Содержание воды в листьях обоих видов исследованных растений в динамике закаливания оставалось на уровне незакаленных растений. Отбор проб проводили в динамике закаливания на 1, 3 и 5 сутки. В качестве контроля использовали растения, не подвергнутые воздействию закаливающей температуры.
Устойчивость растений к гипотермии. Для оценки устойчивости N. tabacum и S. cereale к низким температурам незакаленные и закаленные 5-суточные растения обоих видов охлаждали (0°С) и промораживали (от –2°С до –8°С) в течение 1 суток в климатической камере MIR-153 (“Sanyo”, Япония). Степень устойчивости незакаленных и закаленных растений оценивали по выходу электролитов (в %) из листовой ткани в водную фазу. Для этого электропроводность водных экстрактов определяли при помощи кондуктометра SG7-ELK (“Mettler Toledo”, Швейцария). Выход электролитов из тканей листьев (V, в %) рассчитывали по формуле: V = 100 × (Lо/Lk), где Lо – электропроводность исследуемого образца до или после холодовой экспозиции и Lk – электропроводность того же образца после кипячения [9].
Определение содержания МДА. Об интенсивности процессов ПОЛ судили по накоплению одного из продуктов окисления – МДА. Содержание МДА определяли по реакции с тиобарбитуровой кислотой. Навеску листьев (300 мг) гомогенизировали в 5 мл среды выделения (0.1 М трисНСI буфер, рН 7.6, содержащий 0.35М NaCI). К 3 мл гомогената добавляли 2 мл 0.5% тиобарбитуровой кислоты в 20% трихлоруксусной кислоте, инкубировали при 95°С в течение 30 минут, охлаждали, фильтровали и регистрировали оптическую плотность при длине волны 532 нм. В качестве контроля использовали среду выделения с реагентом. Содержание МДА рассчитывали в мкмоль/г сырой массы [10].
Выделение растворимого белка. Для выделения белка из листьев навеску последних (~300 мг) гомогенизировали в жидком азоте, помещали в пробирку и затем приливали два объема среды выделения (50 мМ трис-НСl, рН 7.6, 3 мМ ЭДТА, 250 мМ сахароза, 3.6 мМ цистеин, 5 мМ аскорбиновая кислота, 3 мМ MgCl2, 2 мМ ДТТ, 2 мМ ФМСФ). Образцы центрифугировали в течение 20 мин при 16 000 g и отбирали супернатант с раствором белка. Для выделения белка из интактных хлоропластов навеску листьев (5 г) гомогенизировали в буфере (0.33 М сорбит, 50 мМ трицин рН 8.0, 2 мМ ЭДТА, 1 мМ МgCl2, 5 мМ меркаптоэтанол). Гомогенат фильтровали через 2 слоя Miracloth (США). Полученный фильтрат центрифугировали при 2000 g. Осадок ресуспендировали в буфере, наслаивали на ступенчатый градиент перкола (40/80%) и центрифугировали при 5000 g. Интактные хлоропласты отбирали на границе 40% и 80% перкола. Для подтверждения интактности хлоропласты просматривали под световым микроскопом Axio Imager D1 (“Karl Zeiss”, Германия) в светлом поле и в режиме флуоресценции (возбуждение λ = 540 − 580 нм, эмиссия λ = 593 − 668 нм). Полученные хлоропласты разрушали, подвергая их нескольким циклам замораживания-оттаивания в среде выделения, центрифугировали в течение 20 мин при 16 000 g и отбирали супернатант с раствором белка. [11].
Определение активности антиоксидантных ферментов в ПААГ. Для этого проводили электрофорез в нативных условиях по методу Орнстейна и Дэвиса в ПААГ в камере Bio-Rad Mini PROTEAN Tetra (“Bio-Rad”, США). Для СОД и АПО использовали 15% гель толщиной 1 мм. Для КАТ применяли 10% гель толщиной 0.75 мм. В лунки вносили по 20 мкг (СОД, АПО) и по 7 мкг (КАТ) белка с добавлением сахарозы для “утяжеления” образца и 2 мкл 0.5% бромфенолового синего. Электрофорез проводили при 4°С в течение 2.5 ч при напряжении 180 В (СОД, АПО) и в течение 20 ч при напряжении 80 В (КАТ) с использованием источника тока PowerPac™ Universal Power Supply (“Bio-Rad”, США). Продолжительность электрофореза и напряжение электрического тока подбирали в предварительных опытах.
Для визуализации активности СОД гели инкубировали в 50 мМ Трис-НСl (рН 7.6) с добавлением 30 мкМ рибофлавина и 245 мкМ нитро-синего тетразолия (НСТ), выдерживали в течение 30 мин в темноте на шейкере, после чего промывали 50 мМ Трис-НСl, рН 7.6 и переносили на свет, где гель приобретал фиолетовую окраску, а участки геля, в которых проявлялась активность СОД, оставались более светлыми по сравнению с фоном [12]. Визуализацию активности АПО проводили по методу Миттлер и Зилинскас [13], а КАТ – посредством инкубации геля в 4 мМ растворе Н2О2 и последующего окрашивания в 1% растворе FeCl3 и K3[Fe(CN)6] [14]. Гели сканировали, инвертировали и анализировали с помощью программы 1DScan (“Scanalitics”, США).
Определение суммарной активности антиоксидантных ферментов. Активность СОД (КФ 1.15.1.1) в листьях табака и озимой ржи определяли при помощи метода, основанного на способности СОД конкурировать с НСТ за супероксидные радикалы, и выражали в ед. активности/г сырой массы [15].
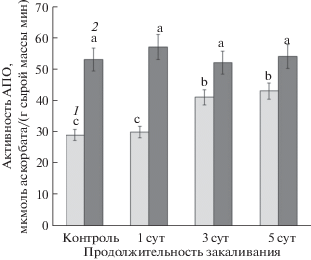
Активность АПО (КФ 1.11.1.11) в листьях определяли по методу, основанному на регистрации снижения оптической плотности раствора при окислении аскорбата, и выражали в мкмоль аскорбата/(г сырой массы мин) [16].
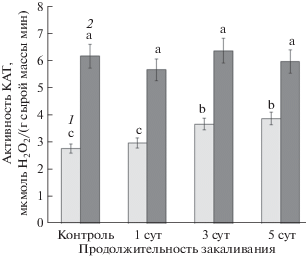
Активность КАТ (КФ 1.11.1.6) в листьях измеряли по скорости деградации H2O2 согласно Кумар и Ноулес и выражали в мкмоль H2O2/(г сырой массы мин) [15].
Во всех экспериментах биологическая повторность измерений была 6-кратной, аналитическая – 3–4-кратной. Каждый эксперимент повторяли не менее 3–4 раз. Результаты экспериментов обработаны статистически с помощью программы SigmaPlot 12.3. На рис. 2, 3, 4 представлены результаты типичных экспериментов. На гистограммах и в таблицах представлены средние значения и их стандартные ошибки. Достоверность различий между средними значениями оценена по t-критерию Стьюдента для 95% уровня значимости (P < 0.05). Достоверно различающиеся между собой величины обозначены разными надстрочными буквами.
Рис. 1.
Изменение содержания МДА в листьях растений табака и озимой ржи при низкотемпературном закаливании (1 – табак, 2 – озимая рожь). Достоверные различия средних значений при P < 0.05 отмечены разными латинскими буквами над барами.

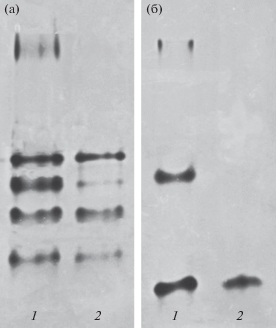
Рис. 2.
Изоферментный спектр СОД в листьях и хлоропластах растений табака (а) и озимой ржи (б) (1 – лист, 2 – хлоропласт).
РЕЗУЛЬТАТЫ
Устойчивость растений к гипотермии
Выход электролитов из листьев табака и озимой ржи до охлаждения и промораживания находился на минимальном уровне, характерном для этих растений: 9–10% для табака и 5–6% для озимой ржи (табл. 1). Незакаленные растения табака существенно повреждались уже при 0°С (выход электролитов 55.1%). При температуре –2°С все эти растения погибали (выход электролитов 93.5%). Закаленные растения табака при температурах вплоть до –2°С повреждались незначительно (выход электролитов не более 26.6%) и погибали после промораживания при –4°С. У незакаленных растений озимой ржи существенный уровень повреждений наблюдался только после промораживания при температуре –6°С (выход электролитов 67.0%), а гибель наступала при температуре –8°С. У растений озимой ржи, прошедших процедуру закаливания, выход электролитов не превышал 25.5% даже при температуре промораживания –8°С, что свидетельствует о сохранении жизнеспособности данных растений.
Таблица 1.
Выход электролитов (%) из клеток листьев незакаленных и закаленных растений табака и озимой ржи, подвергнутых охлаждению (0°С) и промораживанию (от –2°С до –8°С) в течение 1 суток
| Вариант опыта | Табак | Озимая рожь | ||
|---|---|---|---|---|
| незакаленные растения | закаленные растения | незакаленные растения | закаленные растения | |
| До промораживания | 10.0 ± 1.2 | 9.2 ± 1.3 | 5.4 ± 1.0 | 6.2 ± 0.9 |
| 0°С | 55.1 ± 2.2 | 11.5 ± 1.7 | 5.1 ± 1.3 | 5.5 ± 1.1 |
| –2°С | 93.5 ± 4.8 | 26.6 ± 3.8 | 11.0 ± 1.7 | 6.5 ± 2.0 |
| –4°С | – | 89.5 ± 5.2 | 26.5 ± 2.8 | 8.4 ± 1.5 |
| –6°С | – | – | 67.0 ± 4.1 | 24.3 ± 3.4 |
| –8°С | – | – | 90.4 ± 4.0 | 25.5 ± 2.9 |
Содержание МДА
Данные по содержанию МДА в листьях исследуемых растений при низкотемпературном закаливании представлены на рис. 1. До начала закаливания растения табака отличались от озимой ржи примерно на 20% большим содержанием МДА. В процессе закаливания у растений табака наблюдалось резкое увеличение содержания МДА (~ в 1.5 раза) уже после первых суток холодовой экспозиции. В дальнейшем содержание МДА в листьях табака постепенно снижалось и к 5 суткам закаливания опускалось несколько ниже уровня контрольных значений. У растений озимой ржи на 1, 3 и 5 сутки низкотемпературного закаливания содержание МДА сохранялось на уровне контрольных растений (~3 мкмоль/г сырой массы).
Активность антиоксидантных ферментов в ПААГ
Результаты экспериментов по определению активности исследуемых антиоксидантных ферментов в ПААГ представлены на рис. 2, 3 и 4. В ходе работы мы выделяли белки из листьев и хлоропластов растений табака и озимой ржи для последующего определения активности антиоксидантных ферментов в ПААГ. Такой подход позволил нам определить активность изоформ исследуемых ферментов, локализованных в хлоропластах и за их пределами. В листьях растений табака было визуализировано 5 изоформ СОД, сильно различающихся по активности в геле, 4 из которых точно соответствовали изоформам, обнаруженным в хлоропластах. У озимой ржи из 3 обнаруженных изоформ СОД лишь одна соответствовала изоформе хлоропластной локализации (рис. 2). При определении активности АПО у обоих исследуемых видов было обнаружено по 2 изоформы данного фермента, причем все они были локализованы в хлоропластах (рис. 3). В листьях табака и озимой ржи было выявлено по одной изоформе КАТ. Поскольку в хлоропластах обоих видов растений активности КАТ обнаружено не было, можно констатировать, что вся активность данного фермента сосредоточена в других компартментах растительной клетки (рис. 4). Представленные на рис. 2, 3 и 4 изоферментные спектры исследуемых антиоксидантных ферментов были характерны как для контрольных, так и для закаленных растений. За время низкотемпературного закаливания количество изоформ СОД, АПО, КАТ и их положение на геле не изменялись.
Обработка полученных данных с помощью программы 1DScan позволила установить закономерности распределения активности антиоксидантных ферментов в клетках растений табака и озимой ржи. Из данных, представленных в таблице 2, видно, что в клетках табака большая часть активности СОД была обнаружена в хлоропластах (90%), тогда как на долю других клеточных структур приходилось всего 10% от суммарной активности СОД, идентифицированной в ПААГ. В клетках озимой ржи активность СОД распределялась между хлоропластами и другими клеточными компартментами практически поровну (46% в хлоропластах и 54% вне хлоропластов). Распределение активности АПО и КАТ в клетках табака и озимой ржи было идентичным: 100% активности АПО было сосредоточено в хлоропластах, а 100% активности КАТ было обнаружено вне хлоропластов. Распределение активности исследованных ферментов между хлоропластами и другими клеточными компартментами за время низкотемпературного закаливания существенно не изменялось.
Таблица 2.
Распределение активности антиоксидантных ферментов в клетках растений табака и озимой ржи (в % от суммарной активности в ПААГ)
| Антиоксидантные ферменты | Табак | Озимая рожь | ||
|---|---|---|---|---|
| активность в хлоропластах | активность вне хлоропластов | активность в хлоропластах | активность вне хлоропластов | |
| СОД | 90.0 ± 3.0 | 10.0 ± 3.0 | 46.0 ± 4.0 | 54.0 ± 4.0 |
| АПО | 100 | 0 | 100 | 0 |
| КАТ | 0 | 100 | 0 | 100 |
Активность СОД
Результаты экспериментов по определению активности СОД в листьях растений табака и озимой ржи при низкотемпературном закаливании продемонстрированы на рис. 5. Незакаленные растения озимой ржи превосходили табак в 1.5 раза по активности СОД. В процессе закаливания активность СОД у озимой ржи колебалась незначительно и к концу периода закаливания возвращалась к контрольным значениям. У табака активность СОД за время закаливания плавно росла и достигала максимальных значений (61 ед. активности/г сырой массы) на 5 сутки закаливания.
Активность АПО
Из данных, представленных на рис. 6, видно, что активность АПО в контрольных растениях озимой ржи почти в 2 раза превышала величину активности в клетках табака. В процессе закаливания активность АПО табака росла и достигала максимальных значений (~1.5-кратный рост по отношению к контролю) к 5 суткам закаливания. У растений озимой ржи в течение пяти суток воздействия закаливающей температуры достоверных изменений активности АПО не наблюдалось.
Активность КАТ
Данные по активности КАТ в листьях растений табака и озимой ржи при низкотемпературном закаливании представлены на рис. 7. До закаливания активность КАТ у озимой ржи более чем в 2 раза превышала активность этого фермента у табака. В ходе закаливания активность КАТ у озимой ржи не изменялась, а у табака – плавно увеличивалась, достигая максимума (~ на 30% больше контроля) к 5 суткам низкотемпературного закаливания.
ОБСУЖДЕНИЕ
Низкотемпературное закаливание – процесс формирования свойств холодо- и морозостойкости растений в соответствующих генотипу условиях. Закаливание является сложным, интегральным процессом, протекающим на всех уровнях структурной организации организма и затрагивающим практически все функции растения [17]. Антиоксидантная система растений является одним из элементов, участвующих в формировании устойчивости растений к гипотермии. Ферментативные и низкомолекулярные компоненты антиоксидантной системы обеспечивают поддержание баланса между генерацией и детоксикацией АФК и предотвращают окислительные повреждения клеточных структур [18].
Для исследования работы антиоксидантных ферментов в условиях низких температур важно правильно оценивать влияние температуры на растения. Одна и та же температура может быть закаливающей для одних видов растений и повреждающей для других [17]. Полученные нами данные по выходу электролитов показали, что оба вида исследуемых растений существенно повышали свою устойчивость к гипотермии в результате низкотемпературного закаливания. Растения озимой ржи ожидаемо продемонстрировали значительно более высокую эффективность закаливания по сравнению с табаком.
ПОЛ – одно из основных проявлений окислительного стресса, интенсивность которого наиболее часто определяют по содержанию конечного продукта реакции – МДА, который рассматривается как один из маркеров окислительного стресса [19]. Полученные в ходе нашей работы данные показали серьезные различия в интенсивности окислительного стресса у исследуемых видов растений. У морозостойкой озимой ржи содержание МДА в течение всего периода закаливания оставалось стабильным, что свидетельствует об отсутствии проявлений окислительного стресса при закаливающей температуре. Напротив, у теплолюбивого табака наблюдался существенный (~ в 1.5 раза) рост содержания МДА в 1 сутки закаливания. Поскольку в ходе дальнейшего закаливания содержание МДА в листьях табака постепенно снижалось до уровня контрольных значений и не препятствовало эффективному закаливанию, то можно предположить, что всплеск содержания МДА в начале периода закаливания носил не повреждающий, а сигнальный характер. Действительно, последнее время АФК и продукты ПОЛ все больше рассматриваются в качестве сигнальных молекул, вовлеченных в передачу внутриклеточных сигналов, регулирующих экспрессию генов и активность стресс-протекторных систем [20]. Сигнальная функция АФК и продуктов ПОЛ реализуется через регуляцию кальциевого статуса клеток путем влияния на поступление ионов Са2+ как вторичного мессенджера в цитозоль [21], МАП-киназную активность [22], а также сигнализацию с участием факторов транскрипции, регулирующих ответы растений на действие абиотических факторов среды [23].
В наших экспериментах растения табака демонстрировали устойчивый рост активности всех исследованных антиоксидантных ферментов, начиная с 3 суток периода закаливания. Это хорошо согласуется с гипотезой о сигнальном характере резкого увеличения содержания МДА в первые сутки закаливания. Можно предположить, что транзиторный рост продуктов ПОЛ вызывал активацию транскрипционных факторов, влияющих на экспрессию генов антиоксидантных ферментов. Синтез de novo белков СОД, АПО и КАТ приводил к повышению активности всех этих ферментов в клетках, что позволяло растениям табака избегать окислительных повреждений при низкотемпературном закаливании.
В отличие от табака, у озимой ржи активность СОД, АПО и КАТ на протяжении всего периода закаливания оставалась на уровне незакаленных растений. При этом растения озимой ржи демонстрировали отсутствие признаков окислительных повреждений и высокую эффективность закаливания к морозу. Такие результаты свидетельствуют в пользу наличия у озимой ржи других механизмов антиоксидантной защиты, не связанных с повышением активности основных антиоксидантных ферментов в процессе низкотемпературного закаливания. Известны эксперименты, показывающие, что озимая рожь отличается от других растений (в том числе и от других видов озимых злаков) повышенным уровнем конститутивной морозоустойчивости [24]. А также озимая рожь проявляет специфические особенности функционирования антиоксидантной системы, в частности, имеет высокий конститутивный уровень пролина и антоцианов в тканях, который существенно возрастает в процессе низкотемпературного закаливания [25]. Кроме этого показано, что озимая рожь превосходит другие озимые злаки по их способности в ходе закаливания накапливать сахара, которые рассматриваются в качестве низкомолекулярных антиоксидантов [17]. Поэтому можно предположить, что растения озимой ржи были способны избегать развития окислительного стресса при закаливании как за счет поддержания конститутивной активности СОД, АПО и КАТ, так и за счет накопления в клетках большого количества низкомолекулярных антиоксидантов.
Для понимания особенностей функционирования антиоксидантной системы растений важно иметь данные не только об активности антиоксидантных ферментов, но и об их локализации в клетке. Известно, что СОД представлена различными молекулярными формами, которые локализованы в хлоропластах, митохондриях, пероксисомах и цитоплазме [26]. АПО локализована в хлоропластах, цитоплазме, пероксисомах и митохондриях. АПО является основным ферментом, расщепляющим H2O2 в хлоропластах, где содержатся 2 изоформы АПО, одна из которых стромальная, а другая связана с тилакоидами со стороны стромы [27]. Основным местом локализации КАТ являются пероксисомы [28], хотя выявлены случаи присутствия КАТ в цитозоле и клеточной стенке [29].
В ходе нашей работы обнаружено по 2 изоформы АПО, локализованные исключительно в хлоропластах обоих видов исследуемых растений. В тоже время в хлоропластах табака и озимой ржи не было обнаружено активности КАТ, что сообщалось ранее [28]. Что касается СОД, то в клетках табака четыре изоформы СОД (90% активности) были локализованы в хлоропластах и лишь одна изоформа (10% активности) – за пределами хлоропластов. У озимой ржи в хлоропластах была локализована одна изоформа СОД, обеспечивающая 46% суммарной активности, тогда как в других клеточных структурах обнаруживались еще 2 изоформы (54% активности). По нашему мнению, такие особенности локализации СОД могли иметь существенное значение для антиоксидантной защиты клеток исследуемых видов растений. Известно, что в оптимальных условиях вегетации основным источником ${\text{O}}_{2}^{{\centerdot - }}$ является электрон-транспортная цепь хлоропластов, но в условиях стресса интенсивность генерации ${\text{O}}_{2}^{{\centerdot - }}$ в митохондриях, пероксисомах и цитозоле значительно возрастает, что может провоцировать развитие окислительного стресса [30]. Поэтому можно предположить, что концентрация большей части активности СОД в хлоропластах, по-видимому, ограничивала возможности клеток табака контролировать генерацию супероксидного анион-радикала, при гипотермии образующегося в больших количествах не только в хлоропластах, но и в других клеточных структурах. Это приводило к транзиторному росту содержания МДА в начале периода закаливания и последующей активации всех исследованных антиоксидантных ферментов. Напротив, в клетках озимой ржи активность СОД было распределена равномерно, что позволяло этому ферменту эффективно обезвреживать ${\text{O}}_{2}^{{\centerdot - }}$ не только в хлоропластах, но и в других клеточных компартментах.
Таким образом, на основе проведенных экспериментов и литературных данных можно констатировать, что растения табака и озимой ржи демонстрировали разные стратегии антиоксидантной защиты в условиях действия низких закаливающих температур. Растения табака обеспечивали поддержание баланса оксидантов/антиоксидантов в процессе низкотемпературного закаливания за счет повышения активности СОД, АПО и КАТ. Растения озимой ржи были способны избегать развития окислительного стресса при закаливании за счет равномерного распределения активности СОД в клетках, поддержания конститутивной активности всех исследованных антиоксидантных ферментов, а также, вероятно, за счет накопления низкомолекулярных антиоксидантов.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках государственного задания (номер темы АААА-А19-119080690056-3).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Larcher W. Physiological Plant Ecology. Ecophysiology and Stress Physiology of Functional Groups. Springer: Berlin, Heidelberg, New York, 2003. 513 p.
Moller I.M., Jensen P.E., Hansson A. Oxidative Modifications to Cellular Components in Plants // Annu. Rev. Plant Biol. 2007. V. 58. P. 459.
Janda T., Szalai G., Rios-Gonzalez K., Veisz O., Paldi E. Comparative study of frost tolerance and antioxidant activity in cereals // Plant Science. 2003. V. 164. P. 301. https://doi.org/10.1016/S0168-9452(02)00414-4
Колупаев Ю.Е. Антиоксиданты растительной клетки и их роль в АФК-сигналинге и устойчивости растений // Успехи соврем. биол. 2016. Т. 136. С. 181.
Kim S., Tai T.H. Evaluation of seedling cold tolerance in rice cultivars: a comparison of visual ratings and quantitative indicators of physiological changes // Euphyt-ica. 2011. V. 178. P. 437.
Guo Z., Ou W., Lu S., Zhong Q. Differential responses of antioxidative system to chilling and drought in four rice cultivars differing in sensitivity // Plant Physiol. Biochem. 2006. V. 44. P. 828.
Bezirganoglu I., Uysal P., Yigit O.R. Cold stress resistance and the antioxidant enzyme system in Pisum sativ-um // The J. Anim. Plant Sci. 2018. V. 28. P. 561.
Apostolova P., Yordanova R., Popova L. Response of antioxidative defence system to low temperature stress in two wheat cultivars // Gen. Appl. Plant Physiol. 2008. V. 34. P. 281.
Campos P.S., Quartin V., Ramalho J.C., Nunes M.A. Electrolyte Leakage and Lipid Degradation Account for Cold Sensitivity in Leaves of Coffea sp. Plants // J. Plant Physiol. 2003. V. 160. P. 283.
Лукаткин А.С., Голованова В.С. Интенсивность перекисного окисления липидов в охлажденных листьях теплолюбивых растений // Физиология растений. 1988. Т. 35. С. 773.
Lang E.G.E., Mueller S.J., Hoernstein S.N.W., Porankiewicz-Asplund J., Vervliet-Scheebaum M., Reski R. Simultaneous Isolation of Pure and Intact Chloroplasts and Mitochondria from Moss as the Basis for Sub-cellular Proteomics // Plant Cell Rep. 2011. V. 30. P. 205.
Miszalski Z., Lesak I.S, Niewiadomska E., Baczek-Kwinta R., Lüttge U., Ratajczak R. Subcellular localization and stress responses of superoxide dismutase isoforms from leaves in the C3-CAM intermediate halophyte Mesembryanthemum crystallinum L // Plant, Cell Envir. 1998. V. 21. P. 169.
Mittler R., Zilinskas B.A. Detection of ascorbate peroxidase activity in native gels by in-hibition of the ascorbate dependent reduction of nitroblue tetrazolium // Anal Biochem. 1993. V. 212. P. 540.
Zimmermann P., Heinlein Ch., Orendi G., Zentgraf U. Senescence-specific regulation of catalases in Arabidopsis thaliana (L.) Heynh // Plant Cell Envir. 2006. V. 29. P. 1049. https://doi.org/10.1111/j.1365-3040.2005.01459.x
Kumar G.N., Knowles N.R. Changes in lipid peroxidation and lipolytic and free-radical scavenging enzyme during aging and sprouting of potato (Solanum tuberosum L.) seed-tubers // Plant Physiol. 1993. V. 102. P. 115.
Nakano Y., Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts // Plant and Cell Physiol. 1981. V. 22. P. 867. https://doi.org/10.1093/oxfordjournals.pcp.a076232
Трунова Т.И. Растение и низкотемпературный стресс. 64-е Тимирязевское чтение. М.: Наука, 2007. 54 с.
Suzuki N., Mittler R. Reactive Oxygen Species and Temperature Stresses: A Delicate Balance Between Signaling and Destruction // Physiol. Plantarum. 2006. V. 126. P. 45.
Shulaev V., Oliver D.J. Metabolic and proteomic markers for oxidative stress. New tools for reactive oxygen species research // Plant Physiol. 2006. V. 141. P. 367.
Креславский В.Д., Лось Д.А., Аллахвердиев С.И., Кузнецов Вл.В. Сигнальная роль активных форм кислорода при стрессе у растений // Физиология растений. 2012. Т. 59. С. 163.
Mori I.C., Schroeder J.I. Reactive Oxygen Species Activation of Plant Ca2+ Channels: A Signaling Mechanism in Polar Growth, Hormone Transduction, Stress Signaling, and Hypothetically Mechanotransduction // Plant Physiol. 2004. V. 135. P. 702.
Pitzschke P., Hirt H. Mitogen Activated Protein Kinases and Reactive Oxygen Species Signaling in Plants // Plant Physiol. 2006. V. 141. P. 351.
Jaspers P., Kangasjдrvi J. Reactive Oxygen Species in Abiotic Stress Signaling // Physiol. Plant. 2010. V. 138. P. 405.
Колупаев Ю.Е., Рябчун Н.И., Вайнер А.А., Ястреб Т.О., Обозный А.И. Активность антиоксидантных ферментов и содержание осмолитов в проростках озимых злаков при закаливании и криострессе // Физиология растений. 2015. Т. 62. С. 533.
Колупаев Ю.Е., Ястреб Т.О., Обозный А.И., Рябчун Н.И., Кириченко В.В. Конститутивная и индуцированная холодом устойчивость проростков ржи и пшеницы к окислительному стрессу // Физиология растений. 2015. Т. 63. С. 346.
Alscher R.G., Erturk N., Heath L.S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants // J. Exp. Bot. 2002. V. 53. P. 1331. https://doi.org/10.1093/jexbot/53.372.1331
Foyer C.H., Noctor G. Redox regulation in photosynthetic organisms: signaling, acclimatin, and practical implications // Antioxid. Redox Signal. 2009. V. 11. P. 861.
Реунов А.В. Пероксисомы растений: роль в метаболизме активных форм кислорода и опосредованных ими процессах // Успехи соврем. биол. 2014. Т. 134. С. 48.
O’Brien J.A., Daudi A., Butt V.S., Bolwell G.P. Reactive oxygen species and their role in plant defense and cell wall metabolism // Planta. 2012. V. 236. P. 765.
Foyer C.H., Noctor G. Redox Homeostis and Antioxidant Signaling: A Metabolic Interface between Stress Perception and Physiological Responses // Plant Cell. 2005. V. 17. P. 1866.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений