Физиология растений, 2020, T. 67, № 5, стр. 554-560
Влияние дефицита фитохромов на активность аскорбатпероксидазы и фенилаланин-аммоний-лиазы и экспрессию генов APX1, tAPX, sAPX и PAL в листьях растений Arabidopsis thaliana при действии УФ-А и красного света
А. Н. Шмарев a, *, Г. Н. Ширшикова a, В. Ю. Любимов a, В. Д. Креславский a, b
a Институт фундаментальных проблем биологии Российской академии наук, “Федеральный исследовательский центр “Пущинский научный центр биологических исследований Российской академии наук”
Пущино, Россия
b Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: shurik_bx_04@mail.ru
Поступила в редакцию 30.12.2019
После доработки 04.03.2020
Принята к публикации 05.03.2020
Аннотация
Изучено влияние УФ-А радиации (10 Вт/м2, 2 ч) и модифицирующего действия кратковременного облучения красным светом (КС) (1.8 Вт/м2, 20 мин) на фотохимическую активность фотосистемы II (ФСII) (Fv/Fm), а также активность аскорбатпероксидазы (АсП) и фенилаланин-аммоний-лиазы (ФАЛ) в листьях 26–28-дневных растений Аrabidopsis thaliana дикого типа (ДТ) и мутантов: hy3, дефицитного по фитохрому В (ФхВ), и hy2, дефицитного по синтезу фитохромобилина. УФ-А снижал фотохимическую активность ФСII, а также активность АсП и ФАЛ. Облучение КС увеличивало активность ФАЛ только у ДТ и hy3. Обнаружено увеличение уровня экспрессии генов APX1, sAPX, tAPX и PAL, кодирующих ферменты АсП и ФАЛ, при действии КС и УФ-А. Так, экспрессия гена APX1 у ДТ и hy3 возрастала при облучении КС и УФ-А, а у мутанта hy2 – только при действии УФ-А. Экспрессию гена tAPX у ДТ увеличивал только КС, тогда как экспрессия sAPX не увеличивалась ни в одном из вариантов. У мутанта hy2 экспрессия вышеописанных генов снижалась при действии КС. При совместном действии КС и УФ-А (КС, затем УФ) негативный эффект УФ-А на активность общего пула АсП снимался КС только у ДТ и hy3. Частичное снятие эффекта негативного действия УФ-А на активность ФСII в результате предоблучения растений КС связано, вероятно, с увеличением активности антиоксидантных ферментов. Это хорошо заметно у растений ДТ, ФСII которых более чувствительна к КС-облучению, чем у мутантов с дефицитом фитохромов. Мы полагаем, что устойчивость ФСII к УФ-А радиации зависит от потенциала антиоксидантной системы растений, который возрастает при повышении доли активной формы фитохрома в его общем пуле в результате предоблучения растений КС и частично реализуется через индукцию транскрипционной активности антиоксидантных генов.
ВВЕДЕНИЕ
Растения имеют несколько систем фоторецепции. Одна из них – фитохромная система, которая у разных растений включает в себя определенные наборы фитохромов. Например, у Arabidopsis thaliana основные – это фитохром А (ФхA) и фитохром В (ФхB), а минорные – C, D и E, но могут быть и другие в зависимости от вида растений. Фитохромы поглощают свет преимущественно в красной области спектра и работают вместе с сигнальными системами, которые индуцируют в растениях широкий спектр физиологических процессов: от прорастания семян до цветения и плодоношения [1, 2]. Под контролем фитохромной системы находятся также ответные реакции растений на действие различных повреждающих факторов, таких как неблагоприятные температуры, засоление, засуха, УФ-излучение [3–5]. Для исследования фитохромных эффектов удобным объектом является растение A. thaliana, так как его геном полностью расшифрован, и имеется большое количество мутантов, дефицитных по тем или иным фитохромам.
Известно, что основным фоторецептором у зеленых растений является ФхB, реагирующий на красный свет (КС), тогда как ФхA поглощает дальний красный свет (ДКС) и преобладает в этиолированных проростках [1, 6–8]. Фитохромы арабидопсиса C, D и E являются дополнительными для КС-восприятия. Фоторецептор ФхВ участвует в низкоэнергетических реакциях, вызванных кратковременной обработкой КС относительно низкой интенсивности, но он также может принимать участие и в высокоэнергетических процессах, вызванных длительным действием КС [6, 9]. Фитохромная регуляция фотосинтетических процессов заметно проявляется в стрессовых условиях, в частности, при действии УФ-радиации [5]. Так, при исследовании hy2 мутанта арабидопсиса с нарушенным синтезом хромофора у всех типов фитохрома была обнаружена пониженная устойчивость ФСII и ФА в целом к УФ-А по сравнению с диким типом арабидопсиса. УФ-излучение уменьшало максимальный и эффективный фотохимические квантовые выходы ФСII намного сильнее в мутанте hy2 по сравнению с диким типом [10]. При этом предосвещение мутанта hy2 КС (664 нм) не влияло на активность ФСII и уровень H2O2 в листьях, облученных УФ. Аналогичные тенденции обнаружены с использованием мутанта, дефицитного по фитохромам А и В одновременно, при действии УФ-В радиации [11, 12]. Согласно литературе, эффекты фитохромов на ФА связаны, прежде всего, с их воздействием на активность ферментов, которые регулируют различные метаболические процессы, в частности, биосинтез низкомолекулярных антиоксидантов и фотосинтетических пигментов, а также, во многих случаях, на уровень экспрессии генов, регулируемых светом [3, 10, 13–15]. Один из ключевых ферментов антиоксидантной защиты аскорбатпероксидаза (АсП) локализован, в основном, в хлоропластах и является там основным ферментом, утилизирующим перекись водорода. Ранее было обнаружено, что уровень экспрессии гена APX1 контролируется фитохромом, вероятно ФхВ [16], что согласуется с более высокой устойчивостью ФА растений с повышенным уровнем активной формы фитохрома к УФ-радиации [5]. Известно также, что фитохромная система регулирует содержание флавоноидов, вероятно, через активность ключевых ферментов их биосинтеза [14].
Цель работы – анализ влияния дефицита содержания фитохромов на активность ключевого фермента в биосинтезе флавоноидов ФАЛ и фермента антиоксидантной защиты АсП у растений A. thaliana, а также уровней экспрессии кодирующих их генов при кратковременном действии таких световых факторов, как КС и УФ-А.
МАТЕРИАЛЫ И МЕТОДЫ
Объект. Исследования проводили на растениях Arabidopsis thaliana дикого типа (ДТ, экотип Columbia-0) и мутантах: hy2, в котором ингибирован биосинтез фитохромобилина (хромофор фитохрома) и который, следовательно, дефицитен по всем типам фитохромов, и hy3, дефицитного по апобелку ФхВ. Растения выращивали на белом свету, используя 40 Вт люминесцентные лампы, в течение 26–28 дней в контролируемых условиях с фотопериодом 12 ч при температуре 22 ± 1°С днем, 18 ± 1°С ночью и освещенности 120 мкмоль квантов/(м2 с).
Условия облучения УФ и КС. Растения облучали УФ-А, полученным с помощью ультрафиолетовой лампы T8 18W BLB (“Selecta”, Польша) с λmax = 365 нм (12 Вт/м2, 2 ч). КС получали от матриц (35 х 25 см) светодиодов (“TH NEON Ltd.”, Россия), характеристики которых были верифицированы с помощью широкодиапазонного спектрометра S100 (“Solar Laser Systems”, Беларусь. КС: λм = 656 нм, λ1/2 = 26 нм). Время облучения КС – 20 мин (интенсивность 1.8 Вт/м2). УФ-облучение растений проводили сразу после темнового периода. Облучение или предоблучение (перед УФ) КС также проводили сразу после темнового периода (12 ч).
Измерения флуоресценции хлорофилла. Фотосинтетическую активность ФСII измеряли с помощью метода быстрой флуоресценции хлорофилла а (БФл, JIP-тест). Перед измерениями листья закрепляли внутри измерительной ячейки и выдерживали в темноте в течение 15 мин. Индукционные кривые БФл, OJIP-переходы (возрастание выхода флуоресценции Хл а от минимальной до максимальной интенсивности) записывали с помощью флуориметра, описанного ранее [17]. На основе индукционных кривых БФл Хла рассчитывали следующие параметры флуоресценции: F0 – минимальный уровень флуоресценции (F), Fm – максимальный ее уровень и Fv – переменная флуоресценция, определяемая как разность между Fm и F0 [18].
Измерение активности ФАЛ (КФ 4.3.1.5). Активность ФАЛ измеряли в суммарном белковом экстракте из листьев. 1 г свежезамороженного материала растирали в 5-кратном объеме (вес/объем) 0.1М Na-боратного буфера (рН 8.8), содержащего 1.0 мМ ЭДТА, 1.0 мМ ДТТ, 25 мг/мл нерастворимого PVP. Экстракцию выполняли на холоде в течение 40–60 мин при осторожном перемешивании. Полученный гомогенат центрифугировали в течение 20 мин при 15 000 g (+ 4°С), осадок отбрасывали, а надосадочную жидкость использовали в качестве экстракта фермента [19]. Содержание белка определяли по методу Bradford [20]. Активность ФАЛ устанавливали спектрофотометрически при 290 нм по образованию транс-коричной кислоты [21] на спектрофотометре GENESYS 10 (“Termo Spectronic”, США). Реакционная смесь содержала 0.1 М Na-боратного буфера (рН 8.8), 1.0 мМ L-фенилаланина и экстракт ферментов (общий объем смеси 2 мл). Инкубацию проводили в течение 1 ч при + 40°С. Контролем служили пробы, в которые вместо экстракта добавляли боратный буфер. Реакцию останавливали добавлением в реакционную смесь 0.5 мл 1М ТХУ. Активность ФАЛ выражали в единицах оптической плотности (∆E/мг белка).
Измерение активности АсП (КФ 1.11.1.11). Для приготовления гомогената и ферментативных экстрактов брали облученные и необлученные листья растения арабидопсис (0.5 г) и гомогенизировали вручную в ступке с 4.5 мл охлажденного 30 мМ K-фосфатного буфера, рН 7.0, содержащего 0.1 мМ ЭДТА, 2% PVP (мол. м. 25 000). Гомогенаты центрифугировали при 12 000 g в течение 10 мин. Супернатант использовали для определения активности АсП. Активность АсП определяли по окислению аскорбата [22], регистрируемому по снижению поглощения при 290 нм (коэффициент экстинкции 2.8 мМ/см) на спектрофотометре GENESYS 10 (“Termo Spectronic”, США). Реакционная смесь (3мл) содержала 30 мМ К-фосфатный буфер (рН 7.0), 0.5 мМ аскорбат, 0.1 мМ ЭДТА и ферментативный экстракт. Реакцию начинали, добавляя 0.1 мл 0.3 мМ пероксида водорода.
Количественная ПЦР в реальном времени (ПЦР–РВ). Выделение суммарной РНК проводили с использованием реагента TRIzol (“Invitrogen”, США) согласно инструкции производителя. Для синтеза первой цепи кДНК использовали набор Revert Aid™ First Strandc DNA Synthesis Kit (“Fermentas”, Литва) по рекомендации производителя. Амплификацию кДНК, а также анализ продуктов ПЦР–РВ проводили на приборе iCycler IQ5 (“Bio-Rad”, США) с использованием готовой реакционной смеси с интеркалирующим красителем SYBR Green I (qPCRmix-HS SYBR, “Евроген”, Россия). В качестве внутреннего контроля в реакциях ПЦР–РВ был использован ген арабидопсиса UBQ5 (AT3G62250) [23]. Праймеры к нуклеотидным последовательностям исследуемых генов были подобраны с использованием программы Oligo. Последовательности праймеров к генам: AT3G62250 (UBQ5): прямой – GACGCTTCATCTCGTCC, обратный – CCACAGGTTGCGTTAG; AT1G07890 (APX1): прямой – GATAGGTCTGGCTTCGAAGGT, обратный – ATGTGGGCCTCAGCGTAATCA; AT4G08390 (sAPX): прямой – GTACACGAAAGAAGGACCTGGAGCA, обратный – TTCAAGGATTACGCTGTAGCCCATG; AT1G77490 (tAPX): прямой CTCCCGAGGGCATAGTCATTGAAA, обратный – AGTGGACAAGAGGACCAAAACG. Для PAL-генов AT2G37040 (PAL1), AT3G53260 (PAL2), AT5G04230 (PAL3) и AT3G10340 (PAL4) – вырожденные праймеры: прямой: ACCCGTTRATGCAGAARCTGAGACA, обратный: AGCTCCGTTCCACTCBTTGAGACA, R – A/G, B – C/T/G. Условия ПЦР–РВ: 95°C – 3 мин (1 цикл); 95°C – 30 с, 60°C – 30 с, 72°C – 30 с (50 циклов). В конце каждой реакции проводили анализ кривых плавления для контроля чистоты продукта и специфичности амплификации. Обработка результатов выполнялась так, как описано в [24]. Вся информация о генах арабидопсиса была получена из базы данных “The Arabidopsis Information Resource” (http://www.arabidopsis.org).
Статистическую обработку данных и построение графиков осуществляли с помощью SigmaPlot 11.0. Результаты представлены как среднее из трех биологических и 3−4 аналитических повторностей со среднеквадратической ошибкой. Статистически достоверное отличие результатов оценивали, используя критерий Стьюдента при P < 0.05.
РЕЗУЛЬТАТЫ
Максимальный фотохимический квантовый выход ФСII (Fv/Fm) у растений арабидопсиса и его мутантов (hy3, hy2) в норме не отличался и составлял величину 0.79 (табл. 1). При облучении растений УФ-А (2 ч) максимальный фотохимический квантовый выход снижался у ДТ и мутантов hy3, hy2 на 9, 12 и 13%, соответственно.
Таблица 1.
Влияние УФ-А на максимальный квантовый фотохимический выход ФСII в листьях растений A. thaliana при облучении (УФ) или предоблучении с последующим облучением (КС-УФ). Показаны средние из 12 повторов ± SD.
| Вариант | Контроль | УФ | КС-УФ |
|---|---|---|---|
| ДТ | 0.791 ± 0.004 | 0.723 ± 0.008 | 0.775 ± 0.013 |
| hy3 | 0.792 ± 0.007 | 0.696 ± 0.014** | 0.712 ± 0.010* |
| hy2 | 0.791 ± 0.008 | 0.686 ±0.012 | 0.684 ± 0.010* |
При предоблучении ДТ растений КС (20 мин) и последующим облучении УФ-А величина Fv/Fm у ДТ снижалась незначительно, а у мутантов hy3 и hy2 предоблучение КС почти не влияло на квантовый выход.
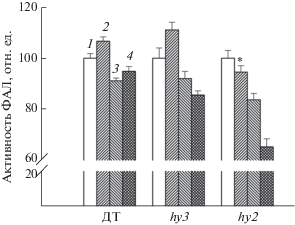
При облучении УФ-А (2 ч) активность фермента ФАЛ снижалась у ДТ и мутанта hy3 на 9%, тогда как у мутанта hy2 – на 16% (рис. 1). При облучении листьев растений арабидопсиса КС отмечена тенденция повышения активности ФАЛ у ДТ и hy3 (на 7–11%), а у hy2 активность снижалась на 15–20%. Это можно объяснить дефицитом только одного ФхВ у hy3 и дефицитом всех фитохромов у мутанта hy2, у которого дефицит фитохромобилина по всем типам фитохрома. Облучение листьев арабидопсиса сначала КС, а затем УФ-А приводило к частичному восстановлению активности ФАЛ у ДТ, отсутствию восстановления у hy3 и еще большему снижению активности у растений hy2.
Рис. 1.
Зависимость активности ФАЛ в листьях арабидопсиса (ДТ, hy2, hy3) от различных облучений:1 – контроль (без облучения), 2 – КС (20 мин), 3 – УФ (2 ч), 4 – КС-УФ (20 мин + 2 ч). Активность фермента до облучения принята за 100%, n = 5. * – Разница между контролем и обработками недостоверна (P > 0.05).
Еще один фермент, который участвует в реакции растений на стресс – фермент антиоксидантной защиты АсП, и ее задача – нейтрализовать избыточное количество перекиси водорода. При воздействии УФ-А радиации (2 ч) на листья растений арабидопсиса активность АсП снижалась на 20–30% как у ДТ, так и у мутантов hy2 и hy3 (рис. 2). Облучение КС листьев растений ДТ и hy3 не влияло на активность АсП, тогда как у hy2 активность снижалась на 15%. Облучение листьев арабидопсиса сначала КС, а затем УФ-А приводило к частичному восстановлению активности АсП, когда предоблучение КС снимает эффект УФ у ДТ и hy3, но не снимает, а усиливает его у hy2.
Рис. 2.
Зависимость активности АсП в листьях арабидопсиса (ДТ, hy2, hy3) от различных облучений: 1 – контроль (без облучения), 2 – КС (20 мин), 3 – УФ (2 ч), 4 – КС-УФ (20 мин + 2 ч). Активность фермента до облучения принята за 100%, n = 5. * – Разница между контролем и обработками недостоверна (P > 0.05).

Экспрессия генов, кодирующих ферменты антиоксидантной защиты, заметно изменяется под действием УФ. Так, уровень экспрессии генов PAL, кодирующих ФАЛ, под действием УФ повышался в 2.7 раза у ДТ и почти в 2 раза у фитохромных мутантов (рис. 3). Еще большее повышение уровня экспрессии наблюдали для гена одной из ключевых локализованных в цитозоле пероксидаз – пероксидазы 1 (АРХ1), уровень экспрессии которого повышался в 3 раза у ДТ и в 4 и 5.5 раз у hy2 и hy3, соответственно (рис. 4). При этом уровни экспрессии генов тилакоидной tAPX (у ДТ и hy3) и стромальной sAPX (у hy3) пероксидаз немного снижались, тогда как у hy2 экспрессия этих генов достоверно не изменялась. Облучение КС в течение 20 мин не оказывало значительного влияния на уровень экспрессии PAL-генов как у ДТ, так и у hy2 и hy3 (рис. 3). Активность же экспрессии генов аскорбатпероксидаз при облучении КС изменялась значительно. Экспрессия гена АРХ1 возрастала в 3 раза у ДТ и hy3, а у hy2 оставалась на прежнем уровне. Уровень экспрессии гена tAPX повышался в 2 раза у ДТ, а гена sAPX у мутанта hy3 достоверно не изменялся, тогда как у hy2 уровни экспрессии этих генов снижались.
Рис. 3.
Уровни экспрессии PAL-генов у растений арабидопсиса: 1 – ДТ, 2 – hy2, 3 – hy3 при обработке КС (20 мин) и УФ-А (2 ч). Исходный уровень экспрессии принят за 1 (отрезок внутри рисунка). * – Разница между контролем и обработками недостоверна (P > 0.05).

Рис. 4.
Уровни экспрессии генов аскорбатпероксидаз: 1 – APX1, 2 – sAPX, 3 – tAPX, при обработке КС (20 мин) и УФ-А (2 ч), в растениях арабидопсиса: (a) – ДТ, (б) – hy2, (в) – hy3. Исходный уровень экспрессии принят за 1 (отрезок внутри рисунка), n –5. * – Разница между контролем и обработками недостоверна (P > 0.05).

ОБСУЖДЕНИЕ
Известно, что ФА (особенно ФСII) является одной из наиболее чувствительных к действию УФ-радиации клеточных систем [25]. Действительно, в наших опытах облучение УФ-А приводило к снижению фотохимической активности ФСII (табл. 1). Имеется много данных, что негативное действие УФ-А-радиации на биологические объекты сопровождается активацией различных защитных механизмов [26, 27]. Такие механизмы работают как при действии самой УФ-радиации, так и в комбинации со светом в видимой области. При этом активация защитных механизмов возможна как при прямом поглощении кванта света, так и в результате вовлечения различных фоторегуляторных рецепторов и соответствующих сигнальных систем [9, 28].
Свет в видимой области может индуцировать смещение баланса оксидантов и антиоксидантов в сторону антиоксидантов, активировать восстановление поврежденной ФСII и индуцировать светозависимую диссипацию поглощенной энергии в тепло [27]. Эти механизмы могут проявляться с участием различных фитохромов, активированных КС. В частности, баланс про-/антиоксидантов может смещаться путем как прямой активации красным светом ферментов, например, СОД и каталазы [26], так и индукции компонентов антиоксидантной системы, представленных низкомолекулярными антиоксидантами и ферментами антиоксидантной защиты.
Мы проверили защитное действие КС в ответе ФА растений A. thaliana ДТ и мутантов hy2 и hy3 на УФ-А-облучение (табл. 1). Если у ДТ проявлялось небольшое защитное действие при предоблучении КС, т.е. частичное снятие ингибирующего действия УФ-радиации на первичные фотохимические процессы фотосинтеза, то у мутантов подобный эффект не наблюдался. По-видимому, это связано с дефицитом у мутантов фитохромов, прежде всего, ФхВ, так как только при его дефиците негативное действие УФ не снималось.
Обнаруженные эффекты пониженной устойчивости ФСII мутанта hy2 к негативному действию УФ-А также можно объяснить активацией ряда ферментов у ДТ и пониженной активностью этих ферментов у мутанта. Мы проверили действие УФ-радиации на активность ключевого фермента фенилпропаноидного пути синтеза флавоноидов ФАЛ у ДТ и мутантов. УФ-радиация снижала активность ФАЛ у всех образцов (рис. 1). При этом КС сам по себе повышал активность ФАЛ только у ДТ и hy3. Этот факт свидетельствует о том, что повышение доли активной формы фитохрома может индуцировать активность ФАЛ. Действительно, негативное действие УФ на активность ФАЛ частично снималось предоблучением КС только у ДТ, но не проявлялось у мутанта hy2, который дефицитен по всем типам фитохрома. Наличие же эффекта увеличения активности фермента ФАЛ при облучении КС у ДТ и его отсутствие у hy3, дефицитного по ФхВ, может свидетельствовать о вовлечении ФхВ в процессы регуляции активности этого фермента.
Хотя мы не обнаружили увеличение активности АсП при облучении КС, тем не менее, из наших данных по сравнению действия УФ и КС-УФ у мутантов и ДТ следует, что Фх-система влияет на активность этого фермента. Это предположение согласуется с тем, что КС активировал уровень экспрессии генов аскорбатпероксидаз tAPX, sAPX, APX1. Это было обнаружено только у ДТ и hy3, а у мутанта hy2 такой эффект стимуляции экспрессии отсутствовал. Этот факт согласуется с предположением о вовлечении фитохромной системы в регуляцию активности этих ферментов. По нашим данным КС действует на активность АсП не прямо, но опосредованно. Однако механизм этого влияния неясен. Скорее всего КС действует сначала на фитохромы, вероятно, на фитохром В, а затем активная форма фитохрома регулирует активность этих ферментов. Видно, что под действием УФ радиации уровни экспрессии генов ФАЛ и АсП значительно возрастали, а активность данных ферментов снижалась. Этот факт мы объясняем деградацией ферментов при действии УФ.
Имеются данные, что под действием КС повышается содержание флавоноидов, биосинтез которых регулируется активностью таких ключевых ферментов, как ФАЛ и халконсинтаза [29]. Мы обнаружили слабое влияние изменений содержания активной формы фитохрома, индуцированное КС, на уровень экспрессии генов PAL и, как это показано ранее, CHS [14]. Следовательно, имеется слабое влияние фитохромной системы на уровень экспрессии этих генов у растений арабидопсиса.
ЗАКЛЮЧЕНИЕ
В литературе имеются данные о вовлеченности фитохромной системы в защитные и адаптационные механизмы ФА при действии стрессовых факторов различной природы [5]. Однако существует мало детальных данных о путях реализации защитных эффектов, развивающихся при действии стрессоров. Рассматриваются несколько стресс-защитных механизмов, в которых может участвовать фитохромная система, в том числе сдвиг про/-антиоксидантного баланса в сторону антиоксидантов [14, 30]. Одним из механизмов реализации такого действия Фх системы может быть регуляция активности антиоксидантных ферментов с помощью фитохромной системы. С целью проверки этой гипотезы в нашей работе рассмотрено влияние дефицита фитохромов и изменение содержания активной формы фитохрома на активность двух ключевых ферментов: синтеза флавоноидов – ФАЛ и антиоксидантной защиты – АсП в ответных реакциях ФА на УФ-А-облучение. Для этого использовали мутанты, дефицитные по фитохрому В (hy3) и по всем фитохромам (hy2). Обнаружено, что повышение содержания активной формы ФхВ частично снимает УФ-индуцированое снижение активности ферментов ФАЛ и АсП у ДТ, но не у мутанта hy2, дефицитного по всем фитохромам. Влияние Фх-системы может реализоваться как путем прямой активации ферментов, так и влиянием фитохромов на биосинтез ферментов, например, на уровне транскрипции. Однако прямое действие КС на активность ферментов мы не обнаружили, но выявили заметное КС-индуцированное повышение уровня экспрессии генов APX1, tAPX и sAPX только у ДТ и hy3, но не у hy2. Полученные результаты согласуются с гипотезой о реализации защитного действия Фх-системы при воздействии УФ-радиации на ФА через Фх-регулируемое усиление активности ключевых ферментов.
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Quail P.H. Phytochromes // Curr. Biol. 2010. V. 20. P. 504.
Carvalho R.F., Campos M.L., Azevedo R.A. The role of phytochrome in stress tolerance // J. Integr. Plant Biol. 2011. V. 53. P. 920.
Gavassi M.A., Monteiro C.C., Campos M.L., Melo H.C., Carvalho R.F. Phytochromes are key regulators of abiotic stress responses in tomato // Sci. Hortic. 2017. V. 222. P. 126.
Mani P., Guruprasad K.N. Regulation of growth and development in phytochrome mutants of Arabidopsis thaliana by solar UV // Acta Physiol. Plant. 2015. V. 37. P. 111.
Kreslavski V.D., Los D.A., Schmitt F-J., Zharmukhamedov S.K., Kuznetsov Vl.V., Allakhverdiev S.I. The impact of the phytochromes on photosynthetic processes // BBA – Bioenergetics. 2018. V. 1859. P. 400.
Casal J.J., Sánchez R.A., Botto J.F. Modes of action of phytochromes // J. Exp. Bot. 1998. V. 49. P. 127.
Hu W., Franklin K.A., Sharrock R.A., Jones M.A., Harmer S.L., Lagarias J.C. Unanticipated regulatory roles for Arabidopsis phytochromes revealed by null mutant analysis // Proc. Natl. Acad. Sci. U.S.A. 2013. V. 110. P. 1542.
Zhao J., Zhou J.-J., Wang Y.-Y., Gu J.-W., Xie X.-Z. Positive Regulation of Phytochrome B on Chlorophyll Biosynthesis and Chloroplast Development in Rice // Rice Sci. 2013. V. 20. 243.
Kreslavski V.D., Carpentier R., Klimov V.V., Allakhverdiev S.I. Transduction mechanisms of photoreceptor signals in plant cells (review) // J. Photochem. Photobiol. C. Photochem. Rev. 2009. V. 10. P. 63.
Kreslavski V.D., Lyubimov V.Yu., Shirshikova G.N., S-hmarev A.N., Kosobryukhov A.A., Schmitt F.J., Friedrich T., Allakhverdiev S.I. Preillumination of lettuce seedlings with red light enhances the resistance of photosynthetic apparatus to UV-A // J. Photochem. Photobiol. B. 2013. V. 122. P. 1.
Kreslavski V.D., Kosobryukhov A.A., Schmitt F.-J., Se-menova G.A., Shirshikova G.N., Khudyakova A.Yu., Allakhverdiev S.I. Photochemical activity and the structure of chloroplasts in Arabidopsis thaliana L. mutants deficient in phytochrome A and B // Protoplasma. 2017. V. 254. P. 1283.
Khudyakova A.Yu., Kreslavski V.D., Shirshikova G.N., Zharmukhamedov S.K., Kosobryukhov A.A., Allakhverdiev S.I. Resistance of Arabidopsis thaliana L. photosynthetic apparatus to UV-B is reduced by deficit of phytochromes B and A // J. Photochem. Photobiol. B. 2017. V. 169. P. 41.
Синещеков В.А. Фитохром А: полиморфизм и функциональность. М.: Научный мир. 2013. 162 с.
Kreslavski V.D., Shirshikova G.N., Lyubimov V.Yu., Shmarev A.N., Boutanaev A., Kosobryukhov A.A., Schmitt F.-J., Friedrich T., Allakhverdiev S.I. Effect of pre-illumination with red light on photosynthetic parameters and pro-/antioxidant balance in wild type and mutant hy2 Arabidopsis thaliana in response to UV-A // J. Photochem. Photobiol. B. 2013. V. 127. P. 229.
Inagaki N., Kinoshita K., Kagawa T., Tanaka A., Ueno O., Shimada H., Takano M. Phytochrome B mediates the regulation of chlorophyll biosynthesis through Transcriptional Regulation of ChlH and GUN4 in Rice Seedlings // Rice Sci. 2013. V. 20. P. 243.
Kreslavski V.D., Schmitt F.-J., Keuer C., Friedrich T., Shirshikova G.N., Zharmukhamedov S.K., Kosobryukhov A.A., Allakhverdiev S.I. Response of the photosynthetic apparatus to UV-A and red light in the phytochrome B-deficient Arabidopsis thaliana L. hy3 mutant // Photosynthetica. 2016. V. 54. P. 321.
Kreslavski V.D., Lankin A.V., Vasilyeva G.K., Lyubimov V.Yu., Semenova G.N., Schmitt F.J., Friedrich T., Allakhverdiev S.I. Effects of polyaromatic hydrocarbons on photosystem II activity in pea leaves // Plant Physiol. Biochem. 2014. V. 81. P. 135.
Stirbe A., Govindjee. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and photosystem II: basics and applications of the OJIP fluorescence transient // J. Photochem. Photobiol. B. 2011. V. 104. P. 36.
Персиянова Е.В., Киселев К.В., Булгаков В.П., Тимченко Н.Ф., Чернодед Г.К., Журавлев Ю.Н. Индукция защитных реакций в каллусных культурах женьшеня при взаимодействии с патогеном человека Yersinia pseudotuberculosis // Физиология растений. 2008. Т. 55. С. 554.
Bradford M.M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding // Anal. Biochem. 1976. V. 72. P. 248.
Zucker M. Induction of phenylalanine-deaminase by light and its relations to chlorogenic acid synthesis in potato tuber tissue // J. Plant Physiology. 1965. V. 40. P.779.
Nakano Y., Asada K. Hydrogen Peroxide Is Scavenged by Ascorbate-Specific Peroxidase in Spinach Chloroplasts // Plant Cell Physiol. 1981. V. 22. P. 867.
Gutierrez L., Mauriat M., Guénin S., Pelloux J., Lefebvre J.F., Louvet R., Rusterucci C., Moritz T., Guerineau F., Bellini C., Van Wuytswinkel O. The lack of a systematic validation of reference genes: a serious pitfall undervalued in reverse transcription-polymerase chain reaction (RT-PCR) analysis in plants // Plant Biotechnol. J. 2008. V. 6. P. 609.
Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR // Nucleic Acids Res. 2001. V. 29. P. e45.
Barber J., Andersson B. Too much of a good thing: light can be bad for photosynthesis // Trends Biochem. Sci. 1992. V. 17. P. 61.
Владимиров Ю.А., Клебанов Г.И., Борисенко Г.Г., Осипов А.Н. Молекулярно-клеточные механизмы действия низкоинтенсивного лазерного облучения // Биофизика. 2004. Т. 49. С. 339.
Kosobryukhov A.A., Lyubimov V.Yu., Kreslavski V.D. Adaptive mechanisms of photosynthetic apparatus to UV radiation. In: Stress Responses in Plants Mechanisms of Toxicity and Tolerance (Bhumi Nath Tripathi, Maria Müller Eds.) – Switzerland: Springer International Publishing. 2015. Ch. 3. P. 59.
Kreslavski V.D., Shmarev A.N., Lyubimov V.Yu., Semenova G.A., Zharmukhamedov S.K., Shirshikova G.N., Khudyakova A.Yu., Allakhverdiev S.I. Response of photosynthetic apparatus in Arabidopsis thaliana L. mutant deficient in phytochrome A and B to UV-B // Photosynthetica. 2018. V. 56. P. 418.
Gerhardt K.E., Lampi M.A., Greenberg B.M. The effects of far-red light on plant growth and flavonoid accumulation in Brassica napus in the presence of ultraviolet B radiation // Photochem. Photobiol. 2008. V. 84. P. 1445.
Любимов В.Ю., Креславский В.Д., Ширшикова Г.Н., Кособрюхов А.А. Регуляция фитохром-активирующим облучением прооксидантно-антиоксидантного потенциала листьев высших растений и стрессустойчивость фотосинтетического аппарата // Известия КГТУ. 2014. № 34. С. 167.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


