Физиология растений, 2020, T. 67, № 5, стр. 547-553
Роль ω3-ацил-липидных десатураз жирных кислот в низкотемпературном закаливании Solanum tuberosum L.
В. Н. Попов a, *, Н. В. Нарайкина a, В. П. Пчелкин a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: vnpopov@mail.ru
Поступила в редакцию 10.11.2019
После доработки 04.12.2019
Принята к публикации 05.12.2019
Аннотация
Исследовали роль ω3-ацил-липидных десатураз жирных кислот в низкотемпературном закаливании (7 суток при 3°С) растений картофеля (Solanum tuberosum L., cорт. Юбилей Жукова). Показано, что транскрипция всех трех имеющихся в геноме картофеля ω3-ацил-липидных десатураз существенно различалась в ответ на действие низкой температуры. Содержание транскриптов гена FAD3 резко снижалось в первые сутки и не восстанавливалось до конца периода закаливания, ген FAD7 экспрессировался конститутивно на протяжении почти всего адаптационного периода, а содержание транскриптов гена FAD8 резко возрастало в первые сутки закаливания. Суммарная доля триеновых жирных кислот (ЖК), синтез которых осуществляют ω3-ацил-липидные десатуразы, за время закаливания увеличивалась на 3%, что является существенной величиной для растений картофеля. Закаленные растения отличались от незакаленных повышенным отношением видимый фотосинтез/темновое дыхание, большим содержанием растворимых сахаров (в 2.5 раза) и более высокой устойчивостью к отрицательным температурам (–2 и –3°С). Сделано предположение, что увеличение доли триеновых ЖК, локализованных главным образом в тилакоидных мембранах хлоропластов картофеля, направлено на сохранение процесса фотосинтеза в условиях низких температур. Поддержание фотосинтетической активности во время низкотемпературного закаливания обеспечивало растения фотоассимилятами, которые служат основным источником энергии и метаболитов, необходимых для формирования повышенной устойчивости растений картофеля к гипотермии.
ВВЕДЕНИЕ
Среди многообразия абиотических стрессовых воздействий, которым подвергается растение на протяжении всего периода вегетации, одним из самых распространенных является гипотермия, во многом определяющая географическое распространение дикорастущих и сельскохозяйственных растений на планете [1]. Решение вопросов холодоустойчивости растений имеет не только фундаментальное, но и большое практическое значение, т. к. выявление механизмов формирования устойчивости к низким температурам позволит значительно снизить потери урожая сельскохозяйственных культур от действия холода и мороза [2].
Картофель – важная продовольственная культура, сильно страдающая от действия низких температур в условиях умеренного климата. Реальная урожайность картофеля существенно ниже его потенциальной продуктивности, причем одним из главных ограничивающих урожай факторов является недостаточная устойчивость растений картофеля к весенним заморозкам [3]. Одна из основных причин повреждения растительных клеток при охлаждении – снижение текучести бислоя мембранных липидов [4]. Это явление приводит к потере барьерных свойств мембран, нарушению разделения клетки на компартменты, сбоям в функционировании электрон-транспортных цепей хлоропластов и митохондрий и, в конечном итоге, к гибели всей клетки [5, 6]. Однако растительная клетка способна регулировать физические свойства мембран посредством изменения количества двойных связей в цепях жирных кислот (ЖК) мембранных липидов. За образование двойных связей в цепях ЖК липидов отвечают ферменты десатуразы ЖК, которые катализируют превращение одинарной (С–С) связи между атомами углерода в ацильных цепях ЖК в двойную (С=С) [7].
Десатуразы ЖК растений делят на растворимые ацил-АПБ-десатуразы и мембранные ацил-липидные десатуразы. Ацил-АПБ-десатуразы локализуются в строме хлоропластов, ацил-липидные – в тилакоидных мембранах пластид и эндоплазматическом ретикулуме [8]. Порядок работы десатураз имеет строгую последовательность. Первая двойная связь формируется в положении ∆9. Мононенасыщенные ЖК с одной двойной связью в положении ∆9 служат субстратом для работы следующих десатураз, образующих двойные связи в положениях ∆12(ω6). Образовавшиеся в результате десатурации диеновые ЖК с двумя двойными связями, в свою очередь, служат субстратом для ω3(∆15)-десатураз, что приводит к появлению ЖК с тремя двойными связями (триеновые ЖК) [9]. В условиях гипотермии для поддержания текучести мембран клеток растений ключевым фактором является температура плавления ЖК, входящих в состав мембранных липидов. Известно, что температура плавления насыщенной стеариновой кислоты (18:0) составляет 70°С, моноеновой олеиновой кислоты (18:1) 13°С, диеновой линолевой кислоты (18:2) –9°С, а триеновой α-линоленовой кислоты (18:3) –17°С [8]. Поскольку именно триеновые ЖК имеют наибольшее значение для сохранения жидкостных свойств мембран при низких температурах, цель работы – исследование роли ω3-ацил-липидных десатураз, осуществляющих синтез ЖК с тремя двойными связями, в процессе формирования холодостойкости Solanum tuberosum L. при низкотемпературном закаливании.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. Объектом исследования служили растения картофеля (Solanum tuberosum L. cорта Юбилей Жукова), которые выращивали из клубней в течение 3 недель в почвенной культуре при температуре 22°С, освещенности 100 мкмоль/(м2 с) и 16-часовом фотопериоде в камере фитотрона ИФР РАН. Закаливание растений проводили в климатической камере KBW-240 (“Binder”, Германия) в условиях 16-часового фотопериода и освещенности 100 мкмоль/(м2 с) при температуре 3°С в течение 7 суток. В качестве контроля использовали незакаленные растения того же возраста.
Выделение РНК и ОТ-ПЦР. Для выделения РНК использовали листья 3–4 ярусов с растений контрольной группы (22°С) и растений, которые находились в условиях закаливающей температуры в течение 2 ч, а также 1, 3, 5 и 7 суток. Тотальную РНК из листьев выделяли с использованием набора Spectrum Plant Total RNA Kit (“Sigma”, США) согласно протоколу производителя. Реакцию обратной транскрипции проводили с помощью набора реагентов и протокола MMLV RT Kit (“Евроген”, Россия). Полученную кДНК использовали для проведения ПЦР в реальном времени на амплификаторе CFX96 Touch Real-Time PCR Detection System (“Bio-Rad”, США) с набором реагентов qPCRmix-HS SYBR kit (“Евроген”, Россия). Расчет относительного содержания мРНК гена в пробе проводили методом вычисления величины нормализованной экспрессии (ΔΔCt). Показатели эффективности ОТ-ПЦР, рассчитанные методом калибровочных кривых для всех пар праймеров, были учтены при проведении анализа [10]. Праймеры для амплификации генов десатураз ЖК подбирали с использованием базы данных NCBI (www.ncbi.nlm.nih.gov) и интернет-ресурса Primer3Plus. Для исследования были взяты следующие гены: ID:102596735 (FAD3) (F) CTGGAAAAGAAGGATCACA, (R) TAAGAACCGCGAGTGGA; ID:102597672 (FAD7) (F) TCTACCCTTTCCCTTGCTGGCA, (R) CATTGCCGTCCAGCAGACAGT; ID:102597287 (FAD8) (F) CATTGGCTCGCTGCAAGTGC, (R) GGCA-ATTTTTCTTCATGGCCATGG. В качестве референсных были использованы гены фактора элонгации 1-α (EF1a) ID: 102577640 (F) GGCCAACAGACAAACCCCTCC, (R) GCCTCGTGGTGCATCTCAACA и рибосомального белка L2 (L2) ID: DQ252497 (F) GGAGCCAAAAAGATTGTGCCC, (R) AGCAGTTCCTCTTCACACGG. Подтверждение данных о субклеточной локализации исследуемых десатураз осуществляли в программе прогнозирования субклеточной локализации эукариотического белка DeepLoc-1.0 (www.cbs.dtu.dk/ services/DeepLoc/).
Определение состава ЖК суммарных липидов. Для определения состава и содержания жирных кислот липидов картофеля, навески по 5 г листьев фиксировали в кипящем изопропаноле, содержавшем 0.001% антиоксиданта ионола, и затем гомогенизировали. Растворитель отгоняли. Сухой остаток растворяли в CH3OH, к которому добавляли CH3COCl в качестве катализатора переэтерификации; полученную смесь выдерживали при точке кипения в течение 1 ч [11]. Метиловые эфиры ЖК (МЭЖК) анализировали методом ГЖХ-МС на приборе Agilent 7890A GC (“Agilent Technologies Inc.”, США) с 60-метровой капиллярной колонкой с внутренним диаметром 0.25 мм (DB-23, № US8897617H) [12]. Для оценки уровня ненасыщенности ЖК в липидах мембран растений картофеля рассчитывали индекс ненасыщенности (ИН): ИН = ΣРiei/100, где Рi – содержание i-той ЖК (%), ei – число двойных связей в i-той ЖК [13].
СО2-газообмен растений. Изучение СО2-газообмена растений картофеля проводили на установке открытого типа с инфракрасным газоанализатором URAS 2T (Германия) при 22 и 3°С для незакаленных и закаленных растений, соответственно, т.е. при температурах, идентичных температурам вегетации и холодового закаливания. Измерения газообмена включали определение скорости видимой ассимиляции СО2 и темнового дыхания, которые выражали в мг СО2/г сухой массы в час. Сухую массу проб определяли путем высушивания навески листьев при температуре 80°С до постоянного веса. На основе этих параметров рассчитывали отношение видимый фотосинтез/темновое дыхание [14].
Определение содержания сахаров. Навески листьев (~500 мг) фиксировали 96% кипящим этанолом. Ткань растирали в фарфоровой ступке и сахара извлекали трехкратной экстракцией 80% этанолом. В полученных экстрактах определяли содержание глюкозы – глюкозооксидазным методом, сахарозы и фруктозы – по методу Рое. Полученные результаты выражали в мг/г сырой массы [15].
Устойчивость растений к гипотермии. Для оценки устойчивости Solanum tuberosum L. к низким температурам закаленные и незакаленные растения промораживали при температурах –2 и –3°С в течение одних суток в климатической камере MIR-153 (“Sanyo”, Япония). Степень устойчивости незакаленных и закаленных растений оценивали по выходу электролитов (в %) из листовой ткани в водную фазу. Для этого электропроводность водных экстрактов определяли при помощи кондуктометра SG7-ELK (“Mettler Toledo”, Швейцария). Выход электролитов из тканей листьев (V, в %) рассчитывали по формуле: V = = 100(Lо/Lk), где Lо – электропроводность исследуемого образца до или после холодовой экспозиции и Lk – электропроводность того же образца после кипячения [16].
Во всех экспериментах биологическая повторность измерений была 6-кратной, аналитическая – 3–4-кратной. Результаты экспериментов обработаны статистически с помощью программы SigmaPlot 12.3. В таблице и на гистограммах представлены средние значения и их стандартные ошибки. Достоверность различий между средними значениями оценена по t-критерию Стьюдента для 95% уровня значимости (P < 0.05). Достоверно различающиеся между собой величины обозначены разными надстрочными буквами.
РЕЗУЛЬТАТЫ
Относительное содержание транскриптов генов десатураз
Результаты исследования изменения относительного содержания транскриптов генов ω3-ацил-липидных десатураз ЖК в динамике низкотемпературного закаливания представлены на рис. 1. За единицу принято нормализованное содержание транскриптов исследуемых генов у незакаленных растений. Показано, что в течение первых 2 ч действия закаливающей температуры (3°С) относительное содержание транскриптов гена FAD3 не изменялось, гена FAD7 увеличивалось на 20%, а гена FAD8 возрастало более чем в 1.5 раза. В варианте посуточного отбора проб (1, 3, 5 и 7 суток закаливания) наблюдалось 3-кратное снижение уровня транскриптов гена FAD3 в период 1–7 суток закаливания. Содержание транскриптов гена FAD7 первые трое суток периода закаливания поддерживалось примерно на 20% выше уровня незакаленных растений и, преодолев спад на пятые сутки, возрастало почти до уровня контроля в конце адаптационного периода. Уровень транскриптов гена FAD8 возрастал почти в 4 раза в первые сутки закаливания, а затем резко снижался в 10 раз по отношению к незакаленным растениям.
Рис. 1.
Изменение относительного содержания транскриптов генов ω3-ацил-липидных десатураз жирных кислот растений картофеля в динамике низкотемпературного закаливания (1 – незакаленные растения, 2 – 2 ч закаливания, 3 – 1 сут закаливания, 4 – 3 сут закаливания, 5 – 5 сут закаливания, 6 – 7 сут закаливания). Достоверные различия средних значений при P < 0.05 отмечены разными латинскими буквами над барами.

Состав жирных кислот суммарных липидов
Данные по составу и содержанию ЖК липидов хлоропластов картофеля представлены в таблице 1. В суммарных липидах, выделенных из листьев незакаленных растений, были идентифицированы десять С15-С20-ЖК, основными представителями которых были пальмитиновая (16:0), гексадекатриеновая (16:3n-3) линолевая (18:2n-6) и α-линоленовая (18:3n-3), причем на долю последней приходилось 37.1% от суммы всех ЖК. После низкотемпературного закаливания (3°С, 7 суток) в липидах листьев картофеля была обнаружена миристиновая кислота (14:0) в незначительном количестве, которая отсутствовала в варианте незакаленных растений. Преобладающими ЖК липидов, как и до закаливания, оставались пальмитиновая (16:0), гексадекатриеновая (16:3n-3) линолевая (18:2n-6) и α-линоленовая (18:3n-3). Анализ содержания ЖК показал, что в процессе закаливания происходило достоверное увеличение содержания гексадекатриеновой и α-линоленовой ЖК с одновременным снижением содержания пальмитиновой ЖК. Такие изменения в ЖК-составе приводили к существенному росту величины ИН (с 1.696 до 1.799) за время закаливания.
Таблица 1.
Изменение содержания жирных кислот липидов листьев растений картофеля при низкотемпературном закаливании
| ЖК | Содержание ЖК, % от суммы | |
|---|---|---|
| незакаленные растения | закаленные растения | |
| 14:0 | – | 0.7 ± 0.1a |
| 15:0 | 0.3 ± 0.1a | 0.1 ± 0.1a |
| 16:0 | 30.8 ± 0.6a | 27.0 ± 0.4b |
| 16:1n-9 | 3.6 ± 0.4a | 3.3 ± 0.1a |
| 16:2n-6 | 0.8 ± 0.1a | 0.8 ± 0.2a |
| 16:3n-3 | 6.8 ± 0.3a | 8.3 ± 0.1b |
| 18:0 | 2.2 ± 0.1a | 2.2 ± 0.1a |
| 18:1n-9 | 1.7 ± 0.1a | 2.0 ± 0.2a |
| 18:2n-6 | 15.5 ± 0.3a | 16.3 ± 0.4a |
| 18:3n-3 | 37.1 ± 0.4a | 38.5 ± 0.2b |
| 20:0 | 1.2 ± 0.2a | 0.8 ± 0.2a |
| ИН | 1.696 ± 0.011a | 1.799 ± 0.009b |
СО2-газообмен растений
При закаливании растений картофеля были обнаружены значительные изменения параметров СО2-газообмена растений, которые измеряли при температуре 22°С в случае незакаленных и 3°С в случае закаленных растений, то есть при температурах, идентичных температурам вегетации и холодового закаливания. Из данных, представленных на рис. 2, видно, что показатели интенсивности как фотосинтеза, так и дыхания за время закаливания снижались, но в разной степени. Величина видимого фотосинтеза уменьшалась в 2 раза (с 9.2 до 4.4 мг СО2/г сухой массы в час), а интенсивность темнового дыхания растений картофеля уменьшалась почти в 4 раза (с 6.1 до 1.6 мг СО2/г сухой массы в час). За счет этого происходило увеличение отношения видимый фотосинтез/темновое дыхание с 1.5 у назакаленных растений картофеля до 2.7 у закаленных.
Содержание сахаров
На рис. 3 приведены результаты определения содержания сахаров в листьях растений картофеля до и после закаливания. Хорошо видно, что в процессе закаливания в листьях картофеля происходило накопление растворимых сахаров. После 7 суток закаливания при 3°С содержание глюкозы в листьях возрастало на 70%, сахарозы более чем в 2 раза, а фруктозы – почти в 7 раз. Столь значительное накопление фруктозы объясняется тем, что исходное ее содержание в исследуемых растениях до закаливания было значительно ниже по сравнению с уровнем других растворимых сахаров. При этом суммарное количество растворимых сахаров (фруктозы, глюкозы и сахарозы) за время низкотемпературного закаливания увеличилось в 2.5 раза, что является очень существенным повышением для растений картофеля.
Устойчивость растений к гипотермии
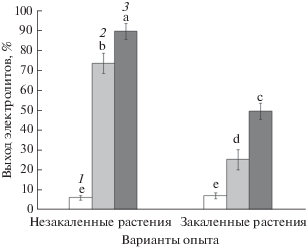
Для определения эффективности низкотемпературного закаливания растения картофеля промораживали при температурах –2 и –3°С в течение одних суток с последующим определением выхода электролитов в водную фазу из тканей листьев. Незакаленные и закаленные растения до промораживания практически не отличались по выходу электролитов (~7%) (рис. 4). После промораживания при температурах –2 и –3ºС выход электролитов у незакаленных растений резко возрастал (до 73 и 89%, соответственно), что свидетельствует об очень высокой степени повреждения клеток и гибели целых растений. У растений, прошедших процедуру закаливания (3°С, 7 суток), выход электролитов не превышал 25% (при температуре промораживания –2°С) и 49% (при температуре промораживания –3ºС), что свидетельствует о сохранении жизнеспособности данных растений.
Рис. 4.
Выход электролитов (%) из клеток листьев незакаленных и закаленных растений картофеля, подвергнутых промораживанию (1 – до промораживания, 2 – после промораживания при температуре –2°С в течение 1 сут, 3 – после промораживания при температуре –3°С в течение 1 сут). Достоверные различия средних значений при P < 0.05 отмечены разными латинскими буквами над барами.
ОБСУЖДЕНИЕ
Наиболее подробно десатуразы ЖК и их вклад в формирование устойчивости организма к охлаждению изучены у цианобактерий [17, 18]. Для высших растений большая часть информации о роли десатураз в устойчивости к гипотермии получена при изучении мутантов Arabidopsis thaliana с инактивированными генами различных десатураз [19, 20]. Что касается объекта нашего исследования Solanum tuberosum, то в его геноме аннотировано около 50 генов, кодирующих различные виды десатураз. Имеется 17 генов, кодирующих растворимые стеароил-АПБ десатуразы, которые создают первую двойную связь в положении Δ9 ЖК в связанной с ацил-переносящим белком (АПБ) форме. Еще 19 генов кодируют Δ12-ацил-липидные десатуразы. Также имеется несколько специфичных Δ8- и Δ4-десатураз сфинголипидов. При этом в геноме картофеля обнаружено всего 3 гена, кодирующих ω3-десатуразы, две из которых локализованы в эндоплазматическом ретикулуме (FAD3, FAD8) и одна в хлоропластах (FAD7), что делает эти десатуразы привлекательным объектом для исследования методом ОТ-ПЦР с последующим анализом содержания транскриптов соответствующих генов.
Наши исследования показали, что транскрипция всех имеющихся в геноме Solanum tuberosum L. ω3-ацил-липидных десатураз существенно различалась в ответ на действие низкой температуры. Содержание транскриптов гена FAD3 резко снижалось уже в первые сутки и не восстанавливалось до конца периода закаливания; ген FAD7 экспрессировался конститутивно на протяжении почти всего адаптационного периода, и только содержание транскриптов гена FAD8 резко возрастало в первые сутки закаливания. В литературе имеется много свидетельств индукции транскрипции ω3-десатураз низкими температурами у разных видов растений [21, 22]. Судя по полученным нами данным, у картофеля к числу индуцируемых низкими температурами на уровне транскрипции генов можно отнести только ген FAD8, кодирующий ω3-ацил-липидную десатуразу, работающую в эндоплазматическом ретикулуме.
Поскольку синтез мРНК является первым звеном в цепочке целого каскада реакций “транскрипция → синтез белков десатураз → синтез ненасыщенных ЖК”, мы провели исследование изменений ЖК-состава липидов листьев картофеля при закаливании. Из всех ЖК, идентифицированных в листьях картофеля, достоверный рост относительного содержания продемонстрировали лишь гексадекатриеновая и α-линоленовая ЖК (~1.5% каждая). Это свидетельствует о том, что стратегия закаливания клеток картофеля направлена на увеличение в составе мембранных липидов доли ЖК с тремя двойными связями, которые имеют наименьшую температуру плавления и наиболее эффективны для поддержания текучести мембран. Феномен повышения степени ненасыщенности ЖК липидов биологических мембран при понижении температуры окружающей среды описан для многих живых организмов. В максимальной степени он проявляется у цианобактерий, в клетках которых при снижении температуры с 38 до 22°С содержание 18:3 ЖК возрастает на 10–15% [23]. У растений рост относительного содержания триеновых ЖК ограничивается, как правило, всего лишь несколькими процентами от их общей суммы, что объясняется, по-видимому, конститутивно высоким уровнем α-линоленовой ЖК в мембранных липидах растений [24].
Среди всех мембран растительной клетки, хлоропластные мембраны играют особую роль в формировании устойчивости растений к низким температурам, поскольку именно в хлоропластах происходит фотосинтез – основной источник энергии, необходимой для перестройки метаболизма клетки в период закаливания. Тилакоиды хлоропластов отличаются максимальным уровнем ненасыщенности ЖК, главным образом, за счет высокого относительного содержания α-линоленовой кислоты. Эта ЖК отличается от прочих своей способностью принимать спиральную конформацию, что позволяет включающим ее липидам образовывать комплексы с мембранными белками и пигментами при построении фотосинтетических субъединиц, которые обеспечивают возможность переноса электронов по электронтранспортной цепи хлоропластов в процессе фотосинтеза [25]. Важная роль триеновых ЖК в работе фотосинтетического аппарата при гипотермии была показана с использованием тройного мутанта A. thaliana fad3-2/fad7-2/fad8, оказавшегося очень чувствительным к фотоингибированию [26]. В наших экспериментах интенсивность видимого фотосинтеза растений картофеля за 7 суток закаливания уменьшалась существенно меньше, чем интенсивность темнового дыхания. Такой характер СО2-газообмена приводил к увеличению отношения видимый фотосинтез/темновое дыхание, что может рассматриваться как положительное свойство, позволяющее растению накапливать значительное количество сахаров в процессе низкотемпературного закаливания [27]. Действительно, закаленные растения картофеля в 2.5 раза превосходили незакаленные по содержанию растворимых сахаров (фруктозы, глюкозы и сахарозы), что является одним из важнейших факторов, обеспечивающих устойчивость растений к низким температурам [28]. Результаты наших экспериментов по морозоустойчивости растений картофеля полностью подтверждают эти данные. Так, на фоне накопления сахаров в клетках происходил существенный рост устойчивости закаленных растений к отрицательным температурам (–2 и –3°С), что свидетельствует о высокой эффективности закаливания растений картофеля.
Таким образом, на основе полученных данных можно предположить следующую схему работы ω3-ацил-липидных десатураз в клетках растений картофеля при гипотермии. Локализованная в эндоплазматическом ретикулуме ω3-десатураза FAD8 реагировала на закаливающую температуру резким транзиторным ростом содержания транскриптов в начальный период закаливания. Это, по-видимому, создавало предпосылки для синтеза de novo белка десатуразы FAD8 и десатурации ЖК в эндоплазматическом ретикулуме, откуда триеновые ЖК в липид-связанной форме могут транспортироваться в плазмалемму [29]. Локализованная в хлоропластах ω3-десатураза FAD7 экспрессировалась конститутивно на протяжении почти всего периода закаливания, что создавало условия для стабильного синтеза триеновых ЖК в тилакоидных мембранах хлоропластов. В этих мембранах происходили процессы поглощения квантов света и переноса электронов по электронтранспортной цепи, приводившие к синтезу АТФ и НАДФ·Н, которые затем расходовались в реакциях темновой стадии фотосинтеза [30]. Стабильная работа электронтранспортной цепи хлоропластов критически зависит от жидкостных свойств тилакоидных мембран, которые определяются содержанием триеновых ЖК. Увеличение доли триеновых ЖК, локализованных главным образом в тилакоидных мембранах хлоропластов картофеля, по-видимому, было направлено на сохранение процесса фотосинтеза в условиях низких температур. Поддержание фотосинтетической активности во время низкотемпературного закаливания обеспечивало растения фотоассимилятами – основным источником энергии и метаболитов, необходимых для формирования повышенной устойчивости растений картофеля к гипотермии.
Работа выполнена при финансовой поддержке Минобрнауки РФ в рамках государственного задания (номер темы АААА-А19-119080690056-3).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Xin Z., Browse J. Cold comfort farm: the acclimation of plants to freezing temperatures // Plant Cell Environ. 2000. V. 23. P. 893.
Jan N., Mahboob-ul-Hussain, Andrab K. I. Cold resistance in plants: A mystery unresolved // J. Biotechnol. 2009. V.12. P. 1.
Титов А.Ф., Акимова Т.В., Таланова В.В., Топчиева Л.В. Устойчивость растений в начальный период действия неблагоприятных температур. М.: Наука, 2006. 143 с.
Lyons J.M. Chilling injury in plants // Annu. Rev. Plant Physiol. 1973. V. 24. P. 445.
Лось Д.А. Молекулярные механизмы холодоустойчивости растений // Вестник РАН. 2005. Т. 75. С. 338.
Moller I.M., Jensen P.E., Hansson A. Oxidative modifications to cellular components in plants // Annu. Rev. Plant Biol. 2007. V. 58. P. 459.
Harwood J.L. Lipids: structure and function // The biochemistry of plants / Ed. P.K.Stumpf. New York: Acad. Press, 1980. P. 1.
Лось Д.А. Десатуразы жирных кислот. М.: Научный мир, 2014. 372 с.
Los D.A., Murata N. Structure and expression of fatty acid desaturases // Biochim. Biophys. Acta. 1998. V. 1394. P. 3.
Rao X., Huang X., Zhou Z., Lin X. An improvement of the ΔΔCT method for quantitative real-time polymerase chain reaction data analysis // Biostat. Bioinform. Biomath. 2013. Vol. 3. P. 71.
Маали Амири Р., Голденкова-Павлова И.В., Юрьева Н.О., Пчелкин В.П., Цыдендамбаев В.Д., Верещагин А.Г., Дерябин А.Н., Трунова Т.И., Лось Д.А., Носов А.М. Жирнокислотный состав липидов растений картофеля, трансформированных геном ∆12-десатуразы цианобактерий // Физиология растений. 2007. Т. 54. С. 678.
Сидоров Р.А., Жуков А.В., Верещагин А.Г., Цыдендамбаев В.Д. Низшие алкиловые эфиры жирных кислот из плодов бересклета // Физиология растений. 2012. Т. 59. С. 362.
Lyons J.M., Weaton T.A., Pratt H.K. Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plants // Plant Physiol. 1964. V. 39. P. 262.
Климов С.В. Холодовое закаливание растений – результат поддержания повышенного отношения фотосинтез/дыхание при низких температурах // Известия РАН. Серия биологическая. 2003. Т. 30. С. 57.
Туркина М.В., Соколова С.В. Методы определения моносахаридов и олигосахаридов // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. С. 7.
Campos P.S., Quartin V., Ramalho J.C., Nunes M.A. Electrolyte Leakage and Lipid Degradation Account for Cold Sensitivity in Leaves of Coffea sp. Plants // J. Plant Physiol. 2003. V. 160. P. 283.
Los D.A., Ray M.K., Murata N. Differences in the control of the temperature-dependent expression of four genes for desaturases in Synechocystis sp. PCC 6803 // Mol. Microbiol. 1997. V. 25. P. 1167.
Mironov K.S., Sidorov R.A., Kreslavski V.D., Bedbenov V.S., Tsydendambaev V.D., Los D.A. Cold-induced gene expression and ω3 fatty acid unsaturation is controlled by red light in Synechocystis // J. Photochem. Photobiol. 2014. V. 137 P. 84.
Iba K. Acclimative response to temperature stress in higher plants: approaches of gene engineering for temperature tolerance // Ann. Rev. Plant Biol. 2002. Vol. 53. P. 225. https://doi.org/10.1146/annurev.arplant.53.100201.160729
Chen M., Thelen J.J. ACYL-LIPID DESATURASE2 is required for chilling and freezing tolerance in Arabidopsis // Plant Cell. 2013. V. 25. P. 1430.
Teixeira M.C., Carvalho I.S., Brodelius M. ω-3 fatty a-cid desaturase genes isolated from purslane (Portulaca oleracea L.): expression in different tissues and response to cold and wound stress // J. Agric. Food Chem. 2010. V. 58. P. 1870.
Matteucci M., D’Angeli S., Errico S., Lamanna R., Perrotta G., Altamura M.M. Cold affects the transcription of fatty acid desaturases and oil quality in the fruit of Olea europaea L. genotypes with different cold hardiness // J. Exp. Bot. 2011. V. 62. P. 3403.
Wada H., Murata N. Temperature-induced changes in the fatty acid composition of the cyanobacterium Synechocystis PCC6803 // Plant Physiol. 1990. V. 92. P. 1062.
Lee S.H., Ahn S.J., Im Y.J., Cho K., Chung C.-C., Cho B.H., Han O. Differential Impact of Low Temperature on Fatty Acid Unsaturation and Lipoxygenase Activity in Figleaf Gourd and Cucumber Roots // Biochem. Biophys. Res. Commun. 2005. V. 330. P. 1194.
Верещагин А.Г. Липиды в жизни растений. 66-е Тимирязевское чтение. М.: Наука, 2007. 78 с.
Vijayan P., Browse J. Photoinhibition in Mutants of Arabidopsis Deficient in Thylakoid Unsaturation // Plant Physiol. 2002. V.129. P. 876. https://doi.org/10.1104/pp.004341
Климов С.В. Повышенное соотношение фотосинтез/дыхание при низких температурах – важное условие холодового закаливания озимой пшеницы // Физиология растений. 1998. Т. 45. С. 419.
Zuther E., Schulz E., Childs L.H., Hincha D.K. Clinal variation in the non-acclimated and cold-acclimated freezing tolerance of Arabidopsis thaliana accessions // Plant Cell Environ. 2012. V. 35. P. 1860. https://doi.org/10.1111/j.1365-3040.2012.02522.x
Arondel V., Kader J.C. Lipid transfer in plants // Experientia. 1990. V. 46. P. 579.
Бухов Н.Г. Динамическая световая регуляция фотосинтеза // Физиология растений. 2004. Т. 51. С. 825.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений




