Физиология растений, 2020, T. 67, № 6, стр. 661-672
Различия в низкотемпературной устойчивости растений Arabidopsis thaliana и их нечувствительных к этилену мутантов связаны с активностью антиоксидантных ферментов
М. С. Синькевич a, Н. В. Нарайкина a, *, Г. П. Алиева a, Н. В. Астахова a, Т. И. Трунова a, И. Е. Мошков a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: narai@yandex.ru
Поступила в редакцию 21.01.2020
После доработки 06.03.2020
Принята к публикации 06.03.2020
Аннотация
Изучали приобретенную в результате закаливания устойчивость к холоду растений арабидопсиса (Arabidopsis thaliana Heynh. (L.)) экотипа Columbia (Col-0) и его нечувствительных к этилену мутантов etr1-1 (ethylene resistant 1) и ein2-1 (ethylene insensitive 2). После 5-суточного закаливания при 2°С у всех трех генотипов повышалась устойчивость к действию отрицательных температур. Однако, как до, так и после закаливания наблюдались различия в их устойчивости: выживаемость растений Col-0 была выше, чем у мутантов, а 50% выход электролитов у закаленных мутантов происходил при более высокой температуре (на 1°С и более), чем у Col-0. Поскольку в период закаливания только у мутантов выявлено повышение интенсивности процессов ПОЛ, являющихся индикатором продукции АФК и окислительного стресса в целом, было сделано предположение о различии в эффективности антиоксидантной системы у изучаемых генотипов арабидопсиса. Для проверки этой гипотезы у всех трех генотипов в динамике закаливания были изучены изменения общей активности ключевых антиоксидантных ферментов СОД (супероксиддисмутаза) и каталазы и их изоферментов. Показано, что у мутантов общая активность СОД, как при температуре выращивания, так и на протяжении всего периода закаливания была ниже, чем у растений Col-0. На основании анализа активности изоферментов была выявлена связь снижения общей активности СОД у мутантов с пониженной активностью изоформ Cu/Zn-СОД (при 22°С и в начале закаливания), что подтверждено пониженным относительным содержанием транскриптов генов CSD1 и CSD2 Cu/Zn-СОД у мутантов по сравнению с Col-0. Снижение общей активности каталазы, по-видимому, обусловлено низкой активностью CAT2 (изоформы каталазы). Представленные нами данные указывают на принципиальную возможность контроля активности Cu/Zn-СОД и каталазы с участием этиленового сигнала в процессе закаливания арабидопсиса к гипотермии.
ВВЕДЕНИЕ
История изучения механизмов устойчивости растений к низким температурам насчитывает уже не один десяток лет [1]. Эта важная фундаментальная проблема физиологии растений тесно связана с производством сельскохозяйственных культур, урожаи которых снижаются при действии низких температур, морозов и заморозков. К настоящему времени достигнуты существенные успехи в изучении физиолого-биохимических [2, 3] и молекулярных [4, 5] основ устойчивости и адаптации растений к гипотермии, однако некоторые механизмы закаливания и их регуляция до сих пор не до конца ясны, несмотря на обилие фактического материала [5, 6]. Arabidopsis thaliana является удобным модельным организмом в молекулярно-биологических, генетических и физиологических исследованиях механизмов холодостойкости, и, как следствие, одним из наиболее хорошо изученных растительных организмов [6]. Несмотря на то, что на формирование устойчивости растений во время закаливания влияет множество процессов, среди них торможение роста является одним из основополагающих факторов, определяющих ход закаливания и уровень достигнутой устойчивости к гипотермии [3, 4, 7]. В связи с этим изучению роли фитогормонов в этих процессах были посвящены многие работы, причем значительное количество публикаций касается гибберелинов, ауксинов, абсцизовой кислоты и даже брассиностероидов [5, 8], но роль этилена в этом отношении остается менее изученной [8]. Однако в одной из работ [9] было обнаружено возрастание выделения этилена при холодовой экспозиции и высказано предположение о прямой взаимосвязи между его биосинтезом и степенью конститутивной и развиваемой в процессе закаливания холодоустойчивости, а в работе [10] была показана пониженная конститутивная устойчивость мутантов арабидопсиса etr1-1 (ethylene resistant 1) и ein2-1 (ethylene insensitive 2) по сравнению с Col-0.
В 2012 г. появилась работа, связывающая путь этиленового сигнала с широко известным путем CBF (C-repeat binding factor), регулирующим устойчивость к нескольким видам стресса, в том числе холодовому [11]. В следующей работе эти же авторы [12] показали, что у мутантов арабидопсиса (etr1-1, ein2-1), нечувствительных к этилену, повышена экспрессия ключевых защитных генов, на основании чего они cделали выводы о том, что наличие этиленового сигнала отрицательно влияет на устойчивость. Среди этих защитных генов в работе упоминаются такие, как гены СОД (супероксиддисмутаза) и каталазы, обеспечивающие защиту от окислительного стресса, возникающего при действии многих неблагоприятных факторов, в том числе, и низкой температуры. Согласно такому предположению, у мутантов снимается репрессия защитных генов, и, следовательно, негативное влияние этилена на устойчивость арабидопсиса. Причем устойчивость арабидопсиса в этой работе была определена прямым методом путем воздействия слабых отрицательных температур (–1°С), как правило, не вызывающих повреждения и образование льда у этих растений. Помимо этого, Shi et al. [12] измеряли уровень повреждения мембран и по выходу электролитов из листьев растений, однако не после действия гипотермии, а лишь под влиянием АЦК (1-аминоциклопропан-1-карбоновая кислота) – предшественника этилена. Таким образом, в указанных работах [11, 12] отсутствует параллельное подтверждение различий в приобретенной генотипами устойчивости, вместо чего об устойчивости к гипотермии авторы судили визуально по выживаемости, а о влиянии этилена – по выходу электролитов, что недостаточно корректно для выводов проделанной ими работы. В работе других авторов [13] эти выводы были поставлены под сомнение, так как у трансгенных растений арабидопсиса и винограда этилен положительно регулировал холодостойкость путем сверхэкспрессии гена VaERF057, кодирующего фактор транскрипции ERF (ethylene response factor), являющийся одним из основных участников сигнального пути этилена. После охлаждения сверхэкспрессирующих ERF трансгенных растений, содержание МДА было ниже, а активности СОД, пероксидазы и каталазы были выше, по сравнению с растениями дикого типа. Кроме того, у трансгенной линии с повышенной экспрессией VaERF05 повышалась интенсивность транскрипции связанных со стрессом 32 генов, в том числе CBF1-3. Напротив, применение аминоэтоксивинилглицина (ингибитора биосинтеза этилена) снижало толерантность винограда к холоду. Таким образом, на данный момент в литературе существует противоречие между результатами работ, одни из которых указывают на пониженную устойчивость этилен-нечувствительных мутантов [10–12], а другие – на повышенную по сравнению с Col-0 [13]. При этом недостаточно комплексных работ, включающих анализ механизмов участия этилена в формировании устойчивости в процессе закаливания к низким температурам.
Поскольку, согласно данным авторов [11], в результате мутации и после закаливания изменяется экспрессия генов СОД, мы предположили, что чувствительность к этилену в период закаливания растений может влиять на функционирование ключевых компонентов антиоксидантной системы и, в первую очередь, на ферментативную составляющую. Для проверки этой гипотезы нами были исследованы динамика общей активности СОД и каталазы во время закаливания, а также их изоферментов с параллельным определением устойчивости разными методами. Таким образом, цель данной работы состояла в изучении влияния этилена на формирование устойчивости к гипотермии при низкотемпературном закаливании чувствительных и нечувствительных к этому гормону генотипов арабидопсиса и, в частности, в связи с изменением активности ключевых антиоксидантных ферментов.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили растения арабидопсиса (Arabidopsis thaliana Heynh. (L.)), экотип Columbia (Col-0) и нечувствительные к этилену мутанты etr1-1 и ein2-1. Семена растений получены из Nottingham Arabidopsis Stock Centre (Великобритания). Мутанты растений A. thaliana с измененной чувствительностью к этилену являются удобным объектом для изучения роли этого гормона в регуляции формирования устойчивости растений к холоду в процессе закаливания. Благодаря легко детектируемой специфической реакции этиолированных проростков на обработку этиленом (так называемому “тройному ответу” – замедлению роста корня и гипокотиля в длину; радиальному набуханию гипокотиля; образованию апикальной петельки) были выделены и генетически охарактеризованы нечувствительные к этилену мутанты по генам ETR1 [14], CTR1 и EIN2, которые кодируют рецептор этилена и компоненты пути передачи его сигнала, соответственно. У мутанта etr1-1 поврежден один из рецепторов (ETR1), вследствие чего у него снижено связывание этилена на 80% от контрольной величины, и он оказался полностью нечувствителен к этилену [14]. У мутанта ein2-1 поврежден один из белков сигнального каскада (EIN2), ответственный за передачу сигнала на этилен-регулируемые транскрипционные факторы ERF [15]. Фенотипически мутант etr1-1 почти не отличался от растений дикого типа, тогда как мутант ein2-1 характеризовался сниженным ростом. Показано, что присутствующий в растении этилен воспринимается рецептором ETR, затем сигнал передается в геном через каскад промежуточных белков: CTR, EIN, EIL [15].
Растения выращивали в камере фитотрона ИФР РАН на почвенной смеси, приготовленной на основе верхового торфа “Агробалт-С” (“Росторфинвест”, Россия) при температуре 22°С, 8-часовом фотопериоде и освещенности 100 мкмоль фотонов/(м2с) до 7–8- недельного возраста. Выбор 8-часового режима светового дня был обусловлен тем, что арабидопсис является факультативно длиннодневным растением, но при использовании короткого дня достигает необходимой для исследования биомассы розетки, не переходя в фазу цветения, что особенно важно при формировании устойчивости, т.к. цветущие растения плохо закаливаются. Для биохимических исследований использовали листья 5–6 ярусов, а для оценки устойчивости – целые растения.
Закаливание продолжительностью от одних до пяти суток проводили в климатической камере KWB-240 (“Binder”, Германия) при температуре 2°С, освещенности 50 мкмоль фотонов/(м2с) и 16-часовом фотопериоде. Температура и продолжительность закаливания были подобраны ранее [16]. Контролем служили растения, не подвергавшиеся низкотемпературному закаливанию.
Устойчивость растений до и после действия закаливающей температуры тестировали, помещая целые растения в климатическую камеру при 0°С, снижали температуру в течение часа до –3°С и выдерживали растения в данных условиях 1 сутки, предоставляя растениям возможность пройти вторую фазу закаливания для реализации присущей морозостойким видам устойчивости к отрицательным температурам. Затем снижали температуру в течение часа последовательно на 1°С до –4°С, –5°С, –6°С, –7°С и –8°С, выдерживая растения при каждой из них в течение суток. После промораживания при указанных температурах проводили суточное оттаивание растений при 4°С. Выживаемость оценивали после 3 суток отращивания при 22°С на свету. Помимо выживаемости, устойчивость оценивали по общепринятому методу Hepburn, на основании измерения выхода электролитов из клеток, и выражали ее в процентах к максимальному, измеренному после кипячения растений, выходу электролитов по формуле:
где Н – устойчивость, EL – максимальный выход электролитов, EL = 100%(Eохл – Еисх)/(Екип – Еисх), Eисх – выход электролитов до охлаждения, Eохл – выход электролитов после охлаждения, Eкип – выход электролитов после кипячения, соответственно.Интенсивность окислительных процессов определяли на основании содержания МДА – одного из конечных продуктов ПОЛ. Содержание МДА определяли по методу, основанному на реакции с тиобарбитуровой кислотой [16], и выражали в процентах к исходным значениям до закаливания.
Выделение растворимых белков из листьев проводили в буферном растворе, содержащем 50 мМ трис-HCl, рН 7.6, 3 мМ ЭДТА, 250 мМ сахарозу, 3.6 мМ цистеин, 5 мМ аскобиновую кислоту, 3 мМ MgCl2, 2мМ ДТТ, 2 мМ ФМСФ (фенилметилсульфонилфторид) [17]. Экстракт обессоливали на колонках PD-10 midiTrap G-25 (“GE Healthcare”, США) и использовали для дальнейшего определения активности ферментов.
Активность СОД определяли по методу, основанному на генерации супероксидных анион-радикалов в реакции фотоокисления рибофлавина, которая усиливается индикаторной ловушкой – нитро-синим тетразолием (НСТ) [17]. За единицу активности СОД принимали 50% ингибирование образования формазана в реакции с НСТ. Активность СОД выражали в единицах активности/г сырой массы.
Для определения изоферментного состава СОД использовали электрофорез в неденатурирующих условиях согласно распространенному методу Ornstain-Davis в 15% разделяющем ПААГ (толщина геля – 1 мм) на приборе Mini PROTEAN Tetra (“Bio-Rad”, США). В каждую лунку вносили по 20–40 мкг белка с добавлением 225 мг/мл сахарозы для “утяжеления” образца и 2 мкл/мл 0.5% бромфенолового синего. Электрофорез проводили при 4°С в течение 2 ч при напряжении 180 В с использованием источника тока PowerPac™ Universal Power Supply (“Bio-Rad”, США). Для проверки выравнивания содержания белка в пробах один из гелей окрашивали в течение 1 ч 0.1% Кумасси G-250, предварительно зафиксировав его в течение 30 мин в растворе, в состав которого входили 10% (NH4)2SO4, 3% H3PO4 и 20% этанол, согласно стандартной процедуре. Количество белка в пробе определяли бицинхониновым методом.
Для визуализации активности изоферментов СОД гели в течение 30 мин инкубировали в темноте в растворе Трис-НСl буфера (50 мМ, рН 7.6) с добавлением 30 мкМ рибофлавина и 245 мкМ НСТ, затем промывали буферным раствором и переносили на яркий свет, где они приобретали фиолетовую окраску. Участки геля, в которых проявлялась активность СОД, оставались прозрачными [18]. Об активности изоформ СОД судили визуально – по степени обесцвечивания фона.
Для определения типов изоформ СОД был использован ингибиторный анализ. Перед окрашиванием гели отдельно выдерживали в 3 мМ растворе цианида калия (KCN) или в 5 мМ пероксида водорода (H2O2) в течение 30 мин [18]. Далее окрашивание гелей проводили, как описано в предыдущем абзаце.
Активность каталазы определяли по методу, основанному на скорости реакции разложения H2O2 [16]. Активность каталазы выражали в ммоль H2O2/(г белка * мин).
Для определения изменения активности изоферментов каталазы проводили электрофорез в неденатурирующих условиях в 10% ПААГ (толщина геля – 0.75 мм), при 4°С в течение 20 ч при напряжении 80 В. Каждый образец содержал по 7 мкг белка. Окрашивание гелей проводили по методу, основанному на восстановлении гексацианоферрата (III) калия (K3(Fe(CN)6)) Н2О2 до гексацианоферрата (II) калия (K4(Fe(CN)6)) и последующей реакцией гексацианоферрата (II) калия с хлоридом железа (III) (FeCl3) с образованием окрашенного соединения – берлинской лазури [19]. Поскольку каталаза разлагает Н2О2, в локусах ее локализации окрашивания не происходило. Для визуализации активности изоферментов каталазы гели инкубировали в 4 мМ растворе Н2О2 в Трис-НСl буфере (50 мМ, рН 7.6) в течение 5 мин, промывали в буферном растворе без Н2О2 и затем проводили специфическое окрашивание на активность каталазы раствором, содержащим 1% гексацианоферрата (III) калия и 1% хлорида железа (III). Гели инкубировали в растворе для окрашивания до появления светлых полос на зеленом фоне в течение 5 мин. Для количественного сравнения активности изоформ каталазы гели сканировали, инвертировали изображение и анализировали с помощью программы ONE-Dscan V 1.3 (“Scanalitics, CSP Inc.”, США). Об относительной активности каталазы судили по интенсивности окрашивания треков по сравнению с Col-0 внутри одного геля.
Для выделения тотальной РНК из листьев растений использовали набор Spectrum Plant Total RNA Kit (“Sigma”, США), согласно протоколу производителя. Содержание РНК оценивали при помощи спектрофотометра ND-1000 (“Nanodrop Inc.”, США). Чистоту выделенной РНК оценивали по соотношению OD260/OD280, которое всегда было не ниже 2, целостность выделенной РНК оценивали по результатам ПЦР-анализа.
Для проведения реакции обратной транскрипции использовали набор реагентов и протокол MMLV RT Kit (“Евроген”, Россия). Полученную кДНК использовали для проведения ПЦР в реальном времени (ПЦР-РВ) с помощью амплификатора CFX96 Touch Real-Time PCR Detection System (“Bio-Rad”, США), используя набор реагентов qPCRmix-HS SYBR kit (“Евроген”, Россия). Расчет относительного содержания транскриптов гена проводили с помощью ΔΔCT метода и выражали в относительных единицах (относительный уровень транскриптов по сравнению со значением до закаливания). Эффективности ОТ-ПЦР, рассчитанные методом калибровочных кривых для всех пар праймеров, учитывали при проведении анализа [20]. Праймеры к исследуемым генам Cu/Zn-СОД подобраны с использованием базы данных NCBI и интернет-ресурса Primer3Plus: CSD1 (AT1G08830) – (F) AGATTCCTCTTACTGGACCAAACTC, (R) TGCGTTTCCAGTAGCCAGGC; CSD2 (AT2G28190) – (F) TCCGCGGCGTCTCTCTCAAC, (R) TCGCCGCGGAAACAACTGTC; CSD3 (AT5G18100) – (F) CCACCGAACGAGGAAGAGCG, (R) ATGCACAACAACCG-CCCTCC; также были подобраны праймеры к референсным генам: фактору элонгации 1α eEF1a (AT5G22220) – (F) TCCCATCTTCTAAGCGGCAGC, (R) TCAGCAACAGCTCCAC-CACC; актину ACT2 (AT3G18780) – (F) AACAGCAGAGCGGGAAATTG, (R) GCAGCTTCCATTCCCACAAA.
Статистическую обработку данных проводили с использованием программы SigmaPlot 12.3. Проводили проверку соответствия входных данных нормальному распределению, затем применяли t-критерий Стьюдента, Р = 0.05. На рисунках и в таблицах представлены средние арифметические значения опыта, состоящего из трех–шести повторностей (по 3 растения в каждой) и их стандартные ошибки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее нами было установлено повышение устойчивости к низкой температуре при закаливании арабидопсиса экотипа Col-0 [16], в связи с чем в настоящей работе внимание, прежде всего, было сосредоточено на определении способности мутантов арабидопсиса, нечувствительных к этилену, закаливаться к низкой температуре и выявлении отличий их устойчивости от таковой у растений Col-0. Для этого все три генотипа закаливали и промораживали. Визуальная оценка устойчивости показала, что незакаленные растения обоих мутантов, нечувствительных к этилену, существенно повреждались после действия температуры –4°С, что выражалось в инфильтрации и появлении темно-зеленой окраски листьев, а также потере их тургора, тогда как все незакаленные растения Col-0 выживали (рис. 1). На рисунке также видно, что розетки закаленных растений Col-0 полностью выживали после воздействия –7°С, у мутантов имелись повреждения, степень которых сложно оценить визуально, однако растения Col-0 в результате закаливания повышали свою устойчивость в большей степени, и часть из них выживала даже после действия температуры –8оС, при которой все мутанты погибали.
Рис. 1.
Растения арабидопсиса (Arabidopsis thaliana) экотипа Col-0 и его нечувствительные к этилену мутанты etr1-1 и ein2-1 после суточного действия различных повреждающих температур: (1) незакаленные после –4°С, (2) закаленные после –7°С, (3) закаленные после –8°С.

Помимо визуального наблюдения, после промораживания в тех же условиях была определена устойчивость (Н) закаленных и незакаленных растений всех генотипов по выходу электролитов (как величине, обратной устойчивости). Данный показатель отражает состояние целостности или, наоборот, степень повреждения мембран клеток и даже их гибели, вследствие чего позволяет количественно оценить различия в устойчивости изучаемых растений. Как и при визуальной оценке, показано, что все три генотипа способны закаливаться при выбранном режиме охлаждения, но температуры, при которых достигается 50% выход электролитов, различаются у растений Col-0 и мутантов etr1-1 и ein2-1 на 1 и 2 градуса, соответственно (таблица 1). То есть растения арабидопсиса Col-0 приобретают более высокую устойчивость в процессе закаливания, чем его нечувствительные к этилену мутанты. Таким образом, оба метода определения устойчивости указывают на повышенную устойчивость растений Col-0, а не мутантов.
Таблица 1.
Устойчивость (Н) закаленных при 2°С в течение 5 суток и незакаленных растений арабидопсиса (Arabidopsis thaliana) экотипа Col-0 и его нечувствительных к этилену мутантов etr1-1 и ein2-1 к действию повреждающих температур, % от полного выхода электролитов
| T, °С | Незакаленные | Закаленные | ||||
|---|---|---|---|---|---|---|
| Сol-0 | etr1-1 | ein2-1 | Сol-0 | etr1-1 | ein2-1 | |
| –4°С | 86.9 ± 3.4 | 85.1 ± 2.3 | 51.9 ± 4.6б | 96.3 ± 1.2 | 93.6 ± 1.5 | 78.8 ± 2.5 |
| –5°С | 80.5 ± 4.2 | 59.9 ± 3.1 а | 28.3 ± 5.2б | 92.4 ± 2.7 | 91.2 ± 2.3 | 63.7 ± 5.6 |
| –6°С | 10.7 ± 3.2 | 4.2 ± 1.8 | 3.4 ± 1.2 | 86.6 ± 4.7 | 76.4 ± 3.5 | 5.1 ± 1.2 |
| –7°С | – | – | – | 76.6 ± 4.2 | 60.7 ± 4.8 | – |
| –8°С | – | – | – | 65.3 ± 5.6 | 57.5 ± 3.2 | – |
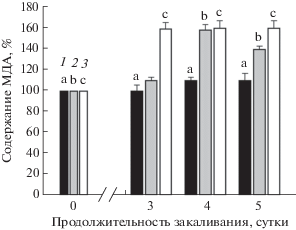
Для подтверждения полученных данных устойчивость растений была дополнительно определена путем измерения интенсивности процессов ПОЛ. Как известно, этот процесс отражает не только уровень устойчивости и состояние мембран клеток, но и соотношение генерации АФК с нейтрализацией их антиоксидантной системой, что проявляется в уровне повреждения мембран при вызванном охлаждением окислительном стрессе. На рисунке 2 показано, что интенсивность ПОЛ в процессе закаливания возрастала у мутантов, в то время как у Col-0 она достоверно не изменялась. Следует отметить, что интенсивность ПОЛ в процессе закаливания наиболее значительно повышалась у мутанта ein2-1, у которого она была почти на 60% выше на третьи сутки закаливания, по сравнению с показателями до закаливания, и сохранялась на этом уровне до пятых суток. У etr1-1 содержание МДА возрастало на 60% лишь на четвертые сутки, а далее несколько снижалось, оставаясь все же выше, по сравнению с Col-0.
Рис. 2.
Изменение интенсивности ПОЛ арабидопсиса по содержанию МДА у экотипа Col-0 (1) и его нечувствительных к этилену мутантов etr1-1 (2) и ein2-1 (3) в процессе закаливания при 2°С в течение 5 суток. % к контролю. Разные буквы указывают на достоверность различий между средними значениями вариантов при уровне значимости P ≤ 0.05.
На основании этих данных и наших измерений генерации АФК [21] можно предположить наличие у мутантов более слабой антиоксидантной системы, чем у растений Col-0. Для проверки такого предположения нами в процессе закаливания трех генотипов арабидопсиса была изучена динамика активности ключевых антиоксидантных ферментов СОД и каталазы in vitro и их изоферментов in situ. Прежде всего необходимо было выявить, имеются ли различия между генотипами в общей активности СОД как важного фермента, обеспечивающего первую линию защиты от АФК за счет нейтрализации супероксидного анион-радикала, а затем, при их наличии, попытаться определить, за счет активности каких изоферментов они происходят.
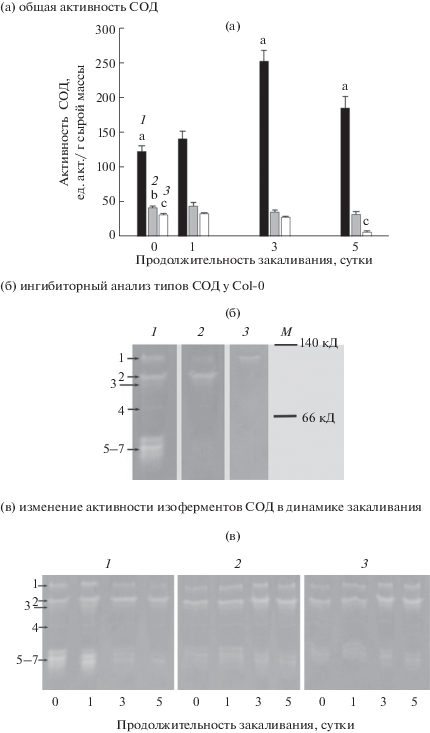
Определение общей активности СОД in vitro показало, что она была выше у устойчивых к холоду растений Col-0, по сравнению с мутантами, как до закаливания, так и в процессе действия закаливающих температур. На рисунке 3а видно, что, если в процессе выращивания у растений Col-0 общая активность СОД составляла примерно 125 ед. акт./г сырой массы, то у мутанта etr1-1 она была втрое, а у мутанта ein2-1 – вчетверо ниже. В процессе закаливания у Col-0 происходило достоверное повышение общей активности СОД в 2 раза с максимумом на третьи сутки. К пятым суткам закаливания ее активность несколько снижалась, оставаясь все же на 50% выше, по сравнению с незакаленным контролем. У etr1-1, по сравнению с Col-0, общая активность СОД мало изменялась в процессе закаливания, а у ein2-1 даже снижалась к пятым суткам закаливания. На основании этих данных можно заключить, что одной из возможных причин более низкой устойчивости мутантов к холоду является недостаточная активность антиоксидантных ферментов, и прежде всего, СОД. Поскольку в растениях этот фермент представлен несколькими типами изоформ, следующий этап работы был посвящен исследованию изменений активности изоферментов СОД в динамике закаливания растений всех трех генотипов.
Рис. 3.
(а) Динамика изменения общей активности СОД в процессе закаливания арабидопсиса экотипа Col-0 (1) и его нечувствительных к этилену мутантов etr1-1 (2) и ein2-1 (3) при 2°С в течение 5 суток. Разные буквы указывают на достоверность различий между средними значениями вариантов при уровне значимости P ≤ 0.05; (б) идентификация типов СОД у вегетирующих растений арабидопсиса экотипа Col-0 при помощи ингибиторного анализа: 1 – без ингибиторов, 2 – с добавлением 5 мМ KCN, 3 – с добавлением 3 мМ H2O2, М – маркеры молекулярного веса; (полоса 1 – Mn-COД, полосы 2-4 – Fe-СОД, полосы 5-7 – Cu/Zn-СОД); (в) изменения активности изоферментов СОД в процессе закаливания арабидопсиса экотипа Col-0 (1) и его нечувствительных к этилену мутантов etr1-1 (2) и ein2-1 (3) при 2°С в течение 5 суток.
Согласно литературным данным, в геноме арабидопсиса обнаружено семь генов, кодирующих семь соответствующих изоферментов СОД, отличающихся по металлу кофактора и субклеточной локализации: гены CSD1, CSD2 и CSD3 – кодируют Cu/Zn-СОД, которые локализуются в цитоплазме, хлоропластах и пероксисомах, соответственно; гены FSD1, FSD2 и FSD3 кодируют Fe-СОД, локализующуюся в хлоропластах, а ген MSD1 – митохондриальную Mn-SOD [22, 23].
С использованием ингибиторного анализа СОД в геле нативного электрофореза у растений изученных генотипов были идентифицированы все три типа СОД, при этом изоферментный спектр был представлен всеми семью известными для арабидопсиса изоформами, которые были определены как одна Mn-, три Cu/Zn- и три Fe-SOD (рис. 3б). Эти результаты соответствуют данным, полученным с помощью анализа последовательностей генома A. thaliana [23, 24].
Для оценки вклада активности отдельных изоформ в изменение общей активности СОД в динамике закаливания растений арабидопсиса Col-0 и мутантов, нечувствительных к этилену, нами были проанализированы изменения степени обесцвечивания изоферментов СОД в геле (рис. 3в). Видно, что у Col-0 наибольшим изменениям подвергаются изоформы Cu/Zn-типа, причем их активность достигает максимума в 1 сутки закаливания. Вероятно, общее повышение активности в процессе закаливания растений Col-0 обусловлено вкладом именно Cu/Zn-изоформ. В то же время обнаружено, что у нечувствительных к этилену мутантов как до, так в течение всего периода закаливания наблюдалась низкая активность трех Cu/Zn-SOD изоформ, причем у всех трех генотипов на пятые сутки закаливания проявлялась активность только двух Cu/Zn-SOD. На основании полученных данных можно предположить, что пониженная общая активность СОД у мутантов определялась существенным снижением активности Cu/Zn-СОД. Подобные явления описаны и в литературе, когда при кратковременном облучении растений шалфея UV-В происходило некоторое ингибирование общей активности СОД в течение первых 30 ч эксперимента за счет заметного снижения активности Fe-СОД и Cu/Zn- СОД [25].
Поскольку в результате мутации арабидопсиса, в том числе и после закаливания, изменялась экспрессия генов СОД [11], а также в соответствии с выше приведенными данными о снижении активности Cu/Zn-СОД, у etr1-1 и ein2-1 в процессе закаливания нами был изучен относительный уровень транскриптов трех генов Cu/Zn-СОД: CSD1, CSD2 и CSD3. Кроме того, Cu/Zn-СОД, возможно, являются наиболее важными изоформами СОД, и их роль в ответных реакциях растений на стресс подтверждается повышенной экспрессией в условиях действия разных стрессоров [22–24]. Показано, что до закаливания (конститутивно, при 22°С) относительное содержание транскриптов генов всех трех Cu/Zn-СОД было сходным у генотипов Col-0 и etr1-1, в то время как у ein2-1 оно было вдвое выше. В результате закаливания у всех изученных генотипов характер экспрессии генов CSD был сходным, а различия носили только количественный характер: индукция транскрипции генов CSD1 и CSD2 у Col-0 происходила в 4 раза, а у ein2-1 в 2 раза выше. Экспрессия CSD3 снижалась вдвое у всех генотипов (таблица 2). Таким образом, были подтверждены данные Shi et al. [11] о повышенной экспрессии защитных двух генов Cu/Zn-СОД, однако, как мы видим из анализа общей активности СОД и исследования активности ее изоферментов, активности Cu/Zn-СОД в процессе закаливания этих растений были снижены. На данном примере видно, почему для определения устойчивости растений недостаточным является измерение только лишь уровня транскриптов защитных генов, необходимо также определение активности соответствующих ферментов. Существующее несовпадение активности изоформ СОД с интенсивностью транскрипции соответствующих генов активно обсуждается в литературе. Так, предполагается, что активность цитозольной изоформы Cu/Zn-СОД определялась наличием ее мРНК, а активность пластидной изоформы Fe-СОД регулировалась на субстратном (аллостерическом) уровне, а не на уровне изменения транскриптов гена FSD [25]. Кроме того, показано, что экспрессия CSD1 и CSD2 у растений арабидопсиса повышалась в ответ на действие озона, UV-B и света высокой интенсивности [25], то есть CSD2 участвует в защите растений от фотоокислительного стресса. Это подтверждается фенотипическим анализом нокдауна-мутанта csd2, который отличался низкой фотосинтетической активностью, меньшим содержанием хлорофилла и медленным ростом. Также выявлено, что активность белка CSD2 не отражает характер регуляции мРНК CSD2, что предполагает наличие трансляционного или посттрансляционного уровня контроля белка CSD2 [23, 26]. Одним из описанных механизмов регуляции транскрипции CSD1 и CSD2 при окислительном стрессе на посттранскрипционном уровне является подавление экспрессии miRNA, которая служит супрессором мРНК CSD1 и CSD2 [26]. Таким образом, несмотря на имеющиеся работы, посвященные регуляции активности Cu/Zn изоформ СОД у растений, в том числе регуляции активности СОД этиленом при закаливании к действию отрицательных температур, отсутствие комплексного анализа на разных уровнях регуляции затрудняет формирование целостной картины по данному вопросу.
Таблица 2.
Изменение относительного содержания транскриптов генов CSD1, CSD2 и CSD3 Cu/Zn-SOD растений арабидопсиса (Arabidopsis thaliana) экотипа Col-0 и его нечувствительных к этилену мутантов etr1-1 и ein2-1 после низкотемпературного закаливания при 2°С, в течении 5 суток (относительные единицы транскрипции определены методом ΔΔCT. За единицу принято нормализованное содержание транскриптов исследуемых генов до закаливания)
| Генотип | Наименование гена | ||
|---|---|---|---|
| CSD1 | CSD2 | CSD3 | |
| Сol-0 | 3.89 ± 0.4а | 3.73 ± 0.3а | 0.55 ± 0.02 |
| etr1-1 | 2.79 ± 0.2б, г | 3.43 ± 0.4б | 0.4 ± 0.02б |
| ein2-1 | 2.03 ± 0.4в, д | 1.91 ± 0.5в, д | 0.44 ± 0.02в |
В клетках растений присутствует еще один важный фермент – каталаза, обладающий ключевой для антиоксидантной системы функцией. Каталаза расщепляет H2O2, энергонезависимым путем, в том числе образующийся в результате активности СОД, в отличие от пероксидаз, нуждающихся в восстановителях (аскорбат, фенолы). Как видно на рисунке 4а, уже до закаливания общая активность каталазы у обоих мутантов была ниже по сравнению с растениями дикого типа: у etr1-1 она составляла 85%, а у ein2-1 – 50% от активности этого фермента у растений Col-0. К первым суткам закаливания общая активность каталазы у растений дикого типа несколько снижалась, оставаясь до конца этого периода примерно на одном уровне. У etr1-1 общая активность каталазы при закаливании также снижалась (на 60% к третьим суткам), однако к пятым суткам закаливания она восстанавливалась до уровня незакаленных растений. В процессе закаливания общая активность каталазы у ein2-1 (до закаливания она была самой низкой среди изученных генотипов) поддерживалась на немного более высоком уровне на протяжении всего периода закаливания по сравнению с показателями до закаливания. К пятым суткам закаливания общая активность каталазы была сравнима у всех трех генотипов.
Рис. 4.
Динамика общей активности (а) и изоферментного спектра (б) каталазы в ходе закаливания арабидопсиса экотипа Col-0 (1) и его нечувствительных к этилену мутантов etr1-1 (2) и ein2-1 (3) при 2°С в течение 5 суток. Разные буквы указывают на достоверность различий между средними значениями вариантов при уровне значимости P ≤ 0.05.
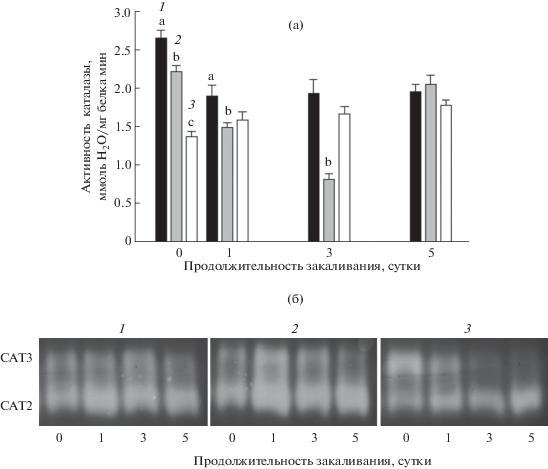
Для определения относительного вклада активности изоформ каталазы в изменение ее общей активности (рис. 4а) была проанализирована степень обесцвечивания изоформ каталазы в геле в нативных условиях, а, следовательно, и относительная активность изоферментов в динамике закаливания растений всех трех генотипов по сравнению с Col-0 (рис. 4б). Известно, что у A. thaliana САТ1 (изоформа каталазы) проявляет активность в пыльце и семенах, САТ2 – в листьях, а САТ3 – в проводящих тканях [27]. Основываясь на этих данных, а также на опубликованных результатах исследования изоформ каталаз арабидопсиса методом нативного электрофореза и иммунодетекции с антителами к каталазе [18], можно предположить, что у изученных нами растений Col-0 наиболее активная изоформа соответствует гомотетрамеру CAT2 фотосинтетических тканей, а вторая обнаруженная в геле изоформа относится к CAT3 сосудов. На рисунке 4б хорошо заметно, что у Col-0 и etr1-1 арабидопсиса активность каталазы CAT2 значительно выше активности изоформы CAT3 и, по-видимому, определяет изменения общей активности фермента.
Оцифровка данных в программе ONE-Dscan V 1.3 инвертированных гелей показала, что интенсивность окрашивания, следовательно, и активность изоформы САТ3 у растений арабидопсиса Col-0, в процессе закаливания повышалась, однако к пятым суткам закаливания заметно снижалась и составляла 20% от уровня незакаленных растений. Активность CAT2 как до, так и в процессе закаливания Col-0 была выше активности CAT3 более чем в 6 раз. У etr1-1 при закаливании наблюдался такой же характер изменений активности обеих изоформ. У ein2-1, наоборот, до закаливания активность CAT3 была в 5 раз выше CAT2, по сравнению с Col-0 и etr1-1, но в процессе закаливания она значительно снижалась, по сравнению с этими генотипами. Активность CAT2 у ein2-1 до закаливания, наоборот, была ниже, чем у Col-0 и etr1-1, но в процессе закаливания наблюдалась тенденция к повышению ее активности, хотя и в заметно меньшей степени, чем у двух других генотипов.
Таким образом, исходя из анализа относительной активности изоформ каталазы в геле, можно предположить, что общая активность каталазы у растений Col-0 и мутанта etr1-1 определялась, главным образом, за счет САТ2 как до, так и в процессе закаливания, при этом активность САТ3 существенно снижалась. В то же время у мутанта ein2-1 до охлаждения активность САТ3 была выше, чем САТ2, однако в период закаливания активность перераспределилась между изоформами, в результате чего к пятым суткам закаливания активность САТ2 у этого мутанта становилась сравнимой с активностью этого фермента у других генотипов (при околонулевой активности САТ3). Эти данные совпадают с данными по общей активности каталазы на 5 сутки закаливания, различия по которой нивелируются у всех трех генотипов.
Следует отметить, что у всех трех генотипов общая активность каталазы, измеренная и выраженная в соответствии с классическим методом в ммоль Н2О2/мин, снижалась к концу первых суток закаливания, тогда как анализ геля (визуально и в программе ONE-Dscan V 1.3) показывает, что у Col-0 и etr1-1 за этот же период происходит повышение активности фермента. Это может быть связано с тем, что метод оценки активности внутри одного геля позволяет оценить только относительный вклад изоформ в общую активность.
Как и в случае СОД, экспрессия генов каталазы регулируется различными путями [28]. Одним из них является регуляция на уровне транскрипции. В регуляции экспрессии генов каталазы могут участвовать рецепторы красного и синего света, она может изменяться также при обработке H2O2, абсцизовой кислотой [28], салициловой кислотой, оксидом азота, H2S и др. [29]. Другой способ регуляции активности каталазы находится на посттранскрипционном уровне. Одним из хорошо описанных механизмов регуляции в растениях является снижение повторного синтеза каталазы в стрессорных условиях [27]. Каталаза является светочувствительным белком, который имеет высокую скорость оборота, и стресс-факторы, такие как холод, засоление и свет высокой интенсивности, могут вызвать снижение активности или количества молекул белка за счет ускоренной инактивации или снижения способности замещать белок. Было показано, что ресинтез САТ1 ржи посттранскрипционно контролировался метилированием мРНК, которое стимулировалось синим светом и перекисями [27].
На основании литературных и полученных нами данных можно предположить, что активность изоформ каталазы может быть связана с чувствительностью к этилену посредством нескольких рецепторов.
Таким образом, можно заключить, что при низкотемпературном закаливании арабидопсиса, в отличие от теплолюбивых растений, не происходит резкого повышения интенсивности ПОЛ, что указывает на присущую данному виду высокоэффективную конститутивную антиоксидантную защиту. Нами было показано, что мутанты, нечувствительные к этилену как до, так и после закаливания, имеют пониженную устойчивость к холоду по сравнению с Col-0 (рис. 1, 3, таблица 1). В то же время они сохраняют способность закаливаться в тех же условиях, что и растения Col-0, хотя критическая температура 50% выхода электролитов наступает у них при более высокой температуре. Кроме того, выявлено, что в условиях выращивания и низкотемпературного закаливания, несмотря на индукцию транскрипции генов CSD1 и CSD2, нечувствительные к этилену мутантные растения обладают пониженной общей активностью СОД (рис. 3а) и каталазы (рис. 4а), причем в случае СОД это можно объяснить снижением активности Cu/Zn-изоформ, особенно в начале закаливания (рис. 3в). Полученные данные позволяют сделать предположение о регуляции генов Cu/Zn изоформ СОД с помощью этиленового сигнального каскада. Что касается каталазы, то ее общая активность, определявшаяся активностью CAT2, была также выше у растений Col-0, по сравнению с мутантами, причем как до, так и после закаливания. Следует отметить также, что общая активность СОД снижалась у мутантов в большей степени по сравнению с общей активностью каталазы (как минимум втрое, тогда как общая активность каталазы на 5 сутки закаливания сравнима у всех трех генотипов). Таким образом, пониженная активность такой важной ферментативной составляющей антиоксидантной системы, как СОД и каталаза, в процессе закаливания, по-видимому, приводит к повышенной интенсивности ПОЛ и снижению устойчивости к низкой температуре у мутантов, нечувствительных к этилену.
Работа выполнена при финансовой поддержке Минобрнауки РФ в рамках государственного задания (номер темы АААА-А19-119080690056-3).
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Туманов И.И. Физиология закаливания и морозостойкости растений // М.: Наука. 1979. 352 с.
Титов А.Ф., Акимова Т.В., Таланова В.В., Топчиева Л.В. Устойчивость растений в начальный период действия неблагоприятных температур. М.: Наука, 2006. 143 с.
Трунова Т.И. Растение и низкотемпературный стресс. 64-е Тимирязевскoе чтение. М.: Наука, 2007. 54 с.
Курбидаева А.С., Новокрещёнова М.Г. Генетический контроль устойчивости растений к холоду // Генетика. 2011. Т. 47. № 3. С. 735.
John R., Anjum N.A., Sopory S.K., Akram N.A., Ashraf M. Some key physiological and molecular processes of cold acclimation // Biol. Plant. 2016. V. 60. P. 603.
Liu Y., Dang P., Liu L., He C. Cold acclimation by the CBF–COR pathway in a changing climate: Lessons from Arabidopsis thaliana // Plant Cell Reports. 2019. Vol. 38. P. 511. http://doi: https://doi.org/10.1007/s00299-019-02376-3
Dubois M., Van den Broeck L., Inzé D. The pivotal role of ethylene in plant growth. Trends in Plant Science. 2018. V. 23. P. 311. https://doi.org/10.1016/j.tplants.2018.01.003
Gamalero E., Glick B.R. Ethylene and abiotic stress tolerance in plants. P. Ahmad and M.N.V. Prasad (eds.). Environmental adaptations and stress tolerance of plants in the Era of climate change. 2012. P. 395. https://doi.org/10.1007/978-1-4614-0815-4_18
Catala R., Lopez-Coborro R., Castellano M.M., Angosto T., Alonso J.M., Ecker J.R., Salinas J. The Arabidopsis14‑3-3 Protein RARE COLD INDUCIBLE 1A links low-temperature response and ethylene biosynthesis to regulate freezing tolerance and cold acclimation // The Plant Cell. 2014. V. 26. P. 3326. https://doi.org/10.1105/tpc.114.127605
Попов В.Н., Дерябин А.Н., Астахова Н.В., Антипина О.В., Суворова Т.А., Алиева Г.П., Мошков И.Е. Этилен-нечувствительные мутанты арабидопсиса etr1-1 ein2-1 имеют пониженную устойчивость к гипотермии // ДАН. 2019. Т. 487. № 3. С. 338.
Shi Y., Tian S., Hou L., Huang X., Zhang X., Guo H., Yang S. Ethylene signaling negatively regulates freezing tolerance by repressing expression of CBF and Type-A ARR genes in Arabidopsis // The Plant Cell. 2012. V. 24. P. 2578. https://doi.org/10.1105/tpc.112.098640
Shi Y., Ding Y., Yang S. Cold signal transduction and its interplay with phytohormones during cold acclimation // Plant Cell Physiol. 2015. V. 56. P. 7. https://doi.org/10.1093/pcp/pcu115
Sun X., Zhao T., Gan S., Ren X., Fang L., Karungo S.K., Wang Y., Chen L., Li S., Xin H. Ethylene positively regulates cold tolerance in grapevine by modulating the expression of ETHYLENE RESPONSE FACTOR 057 // Sci. Rep. 2016. V. 6. P. 1. https://doi.org/10.1038/srep24066
Bleecker A.B., Estelie M.A., Somerville C., Kende H. Insensitivity to ethylene conferred by a dominant mutation in Arabidopsis thaliana // Science. 1988. V. 241. P. 1086.
Ju C., Chang C. Mechanistic insights in ethylene perception and signal transduction // Plant Physiol. 2015. V. 169. P. 85. http://doi/https://doi.org/10.1104/pp.15.00845
Синькевич М.С., Селиванов А.А., Антипина О.В., Кропочева Е.В., Алиева Г.П., Суворова Т.А., Астахова Н.В., Мошков И.Е. Активность антиоксидантных ферментов у растений Arabidopsis thaliana при закаливании к гипотермии // Физиология растений. 2016. Т. 63. С. 777.https://doi.org/10.7868/S0015330316060105
Нарайкина Н.В., Синькевич М.С., Демин И.Н., Селиванов А.А., Мошков И.Е., Трунова Т.И. Изменения активности изоформ СОД при низкотемпературной адаптации у растений картофеля (Solanum tuberosum L.) дикого типа и трансформированных геном Δ12-ацил-липидной десатуразы // Физиология растений. 2014. Т. 61. С. 359.
Miszalski Z., Lesak I.S., Niewiadomska E., Baczek-Kwinta R., Lüttge U., Ratajczak R. Subcellular localization and stress responses of superoxide dismutase isoforms from leaves in the C3CAM intermediate halophyte Mesembryanthemum crystallinum L. // Plant, Cell Envir. 1998. V. 21. P. 169.
Zimmermann P., Heinlein Ch., Orendi G., Zentgraf U. Senescence-specific regulation of catalases in Arabidopsis thaliana (L.) Heynh. // Plant Cell Envir. 2006. V. 29. P. 1049.
Rao X., Huang X., Zhou Z., Lin X. An improvement of the ΔΔCT method for quantitative real-time polymerase chain reaction data analysis // Biostat. Bioinforma. Biomath. 2013. V. 3. P. 71.
Синькевич М.С. Антиоксидантная система растений арабидопсиса при закаливании к холоду // Материалы научной конференции с международным участием и школы молодых ученых “Сигнальные системы растений: от рецептора до ответной реакции организма”. 2016. С. 250.
Saibi W., Brini F. Superoxide dismutase (SOD) and abiotic stress tolerance in plants: an overview // Superoxide dismutase / Ed. Magliozzi S. Nova Science Publishers, Inc. 2018. P. 101.
Kliebenstein D.J., Monde R.-A., Last R.L. Superoxide dismutase in Arabidopsis: An eclectic enzyme family with disparate regulation and protein localization // Plant Physiol. 1998. V. 118. P. 637. https://doi.org/10.1104/pp.118.2.637
Alscher R.G., Ertuk N., Heath L.S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants // J. Exp. Bot. 2002. V. 53. P. 1331.
Радюкина Н.Л., Шашукова А.В., Макарова С.С. Кузнецов Вл.В. Экзогенный пролин модифицирует дифференциальную экспрессию генов супероксиддисмутазы в растениях шалфея при UV-В облучении. Физиология растений. 2011. Т. 58. С. 673.
Sunkar R., Kapoor A., Zhu J.-K. Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance // The Plant Cell. 2006. V. 18. P. 2051. https://doi.org/10.1105/tpc.106.041673
Mhamdi A., Queval1 G., Chaouch S., Vanderauwera S., Van Breusegem F., Noctor G. Catalase function in plants: a focus on Arabidopsis mutants as stress-mimic models // J. Exp. Bot. 2010. V. 61. P. 4197. https://doi.org/10.1093/jxb/erq282
Yang T., Poovaiah B.W. Hydrogen peroxide homeostasis: Activation of plant catalase by calcium/calmodulin // Proc. Natl. Acad. Sci. U. S. A. 2002. V. 99. P. 4097. https://doi.org/10.1073/pnas.052564899
Колупаев Ю.Е., Карпец Ю.В., Кабашникова Л.Ф. Антиоксидантная система растений: клеточная компартментация, защитные и сигнальные функции, механизмы регуляции // Прикладная биохимия и микробиология. 2019. Т. 55. С. 419.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


