Физиология растений, 2020, T. 67, № 6, стр. 654-660
Фосфолипиды эмбриогенных и неэмбриогенных клеточных линий Larix sibirica Ledeb.
Н. В. Семёнова a, *, В. Н. Шмаков a, Ю. М. Константинов a, Л. В. Дударева a
a Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: tashasemyonova@mail.ru
Поступила в редакцию 14.02.2020
После доработки 16.04.2020
Принята к публикации 16.04.2020
Аннотация
Изучен состав фосфолипидов (ФЛ) эмбриогенных и неэмбриогенных клеточных линий лиственницы сибирской (Larix sibirica Ledeb.). Выявлены существенные межлинейные различия состава и содержания фосфолипидов. Установлено, что доминирующими фосфолипидами эмбриогенных клеточных линий являются фосфатидилхолины (ФХ) и фосфатидилэтаноламины (ФЭ), в то время как для неэмбриогенных клеточных линий обнаружено высокое содержание фосфатидной кислоты (ФК) (более 64% от суммы ФЛ). Отношение ФХ/ФЭ – параметр, характеризующий структуру и функциональность мембран, для эмбриогенных клеточных линий в 1.4–3.8 раз выше, чем для неэмбриогенных, что, вероятно, связано с необходимостью вовлечения этих ФЛ в процессы дифференциации тканей. Показано, что содержание фосфатидилинозитов (ФИ) достоверно различалось для эмбриогенных и неэмбриогенных клеточных линий и составляло 0.50–1.06 мг/г и 0.17–0.34 мг/г сухого веса, соответственно. Обнаруженные различия в составе ФЛ между клеточными линиями с разным эмбриогенным потенциалом могут свидетельствовать о важной роли этих липидов в процессах эмбриогенеза на стадии формирования зародышей.
ВВЕДЕНИЕ
Одним из перспективных направлений в биотехнологии микроклонального размножения древесных растений в культуре in vitro является соматический эмбриогенез, благодаря которому соматические клетки растений массово формируют растения, идентичные материнскому генотипу [1]. Для большинства видов хвойных, в том числе для лиственницы сибирской, получение соматических зародышей остается трудновыполнимой задачей, в первую очередь из-за недостатка сведений об условиях и механизмах индукции соматического эмбриогенеза у голосеменных растений [2]. В частности, роль липидных компонентов в индукции и развитии эмбриогенеза в культуре in vitro у хвойных остается малоизученной. Имеются единичные работы, посвященные этой проблеме [3, 4],но в целом в вопросах липидного обмена у хвойных растений пока нет полной ясности, особенно это касается состава и содержания липидов в культуре тканей видов, принадлежащих к отделу Pinophyta.
Известно, что липидный состав клеток и тканей изменяется в зависимости от их физиологического состояния, кроме того, содержание и состав липидов всех клеточных органелл различаются в зависимости от вида, внутри вида и в онтогенезе растений [5]. В тоже время важно подчеркнуть, что многие липиды, в том числе фосфолипиды (ФЛ) являются не только структурными компонентами клеточных мембран, но и важными сигнальными молекулами, которые регулируют наряду с другими соединениями рост и развитие растений, а также клеточный ответ на изменения окружающей среды [6, 7]. Даже незначительные изменения в составе мембранных ФЛ могут привести к резким изменениям в структуре мембран, вызывая серьезные нарушения в функциях и жизнеспособности клеток [6]. Что касается культивирования растительных тканей, то для некоторых покрытосеменных растений в литературе имеются сведения о влиянии ФЛ на процессы роста и развития в культуре in vitro. Так, установлено, что добавление хлорида холина как предшественника фосфатидилхолинов (ФХ) в питательную среду при выращивании культуры одиночных клеток приводило к созреванию большего количества соматических зародышей Cajanus cajan, кроме того, культура демонстрировала ускоренный рост клеток [8]. Показано, что увеличение скорости поглощения ФХ и мио-инозитола при добавлении их в среду культивирования каллусов Brassica napus является проявлением их специфической роли в регуляции мембранносвязанных ферментов [9]. Все вышесказанное указывает на важную роль ФЛ в клеточном метаболизме у растений как in vivo, так и in vitro. Очевидно, что изучение особенностей состава ФЛ в культуре растительных клеток с разным эмбриогенным потенциалом представляет значительный интерес в фундаментальном и прикладном отношениях. Хотя в литературе имеются отдельные сведения о ФЛ составе органов и тканей некоторых хвойных: хвои [10] и меристематических тканей почек [11], однако работ, посвященных детальному изучению состава и содержания ФЛ в культуре in vitro хвойных растений, до последнего времени не проводилось.
Цель работы – проведение сравнительного анализа содержания фосфолипидов в эмбриогенных на ранней стадии развития и неэмбриогенных клеточных линиях лиственницы сибирской (Larix sibirica Ledeb.).
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. В качестве растительного материала использовались эмбриогенные и неэмбриогенные клеточные линии лиственницы сибирской, полученные И.Н. Третьяковой с соавт. [1, 2] в Институте леса им. В.Н. Сукачева СО РАН (г. Красноярск). Клеточные линии L. sibirica поддерживались на питательной среде АИ [2]. В качестве регуляторов роста использовали 2.4-дихлорфеноксиуксусную кислоту (2 мг/л) и 6-бензиламинопурин (0.5 мг/л). Для изучения состава и содержания ФЛ каллусов лиственницы сибирской использовали эмбриогенные долгоживущие клеточные линии Кл2, Кл6, Кл4, Кл10 на стадии пролиферации эмбрионально-суспензорной массы и неэмбриогенные клеточные линии Кл31, Кл23.
Экстракция липидов. Для экстракции липидов навеску растительного материала (0.5 г) фиксировали в жидком азоте и растирали до получения гомогенной массы [12]. Затем добавляли 10 мл смеси хлороформ : метанол (2:1 v/v) с добавлением ионола в качестве антиоксиданта из расчета 0.00125 г на 100 мл смеси хлороформ : метанол, тщательно перемешивали и оставляли на 30 мин до полной диффузии липидов в растворитель. Количественно переносили раствор в делительную воронку через фильтр, трижды промывая ступку и фильтр смесью растворителей. Для лучшего расслаивания добавляли воду. Для анализа суммарных липидов отделяли нижнюю хлороформную фракцию. Хлороформ (ОСЧ, стабилизированный 0.005% массовой долей амилена) из липидного экстракта удаляли под вакуумом с помощью роторного испарителя RVO-64 (Чехия).
Фосфолипиды. Для обнаружения и идентификации ФЛ в растительном материале использовали специфические реагенты: для фосфорсодержащих компонентов молибденовый синий [13], для аминосодержащих липидов – 0.2% раствор нингидрина в ацетоне [14], пластинки проявляли над водяным паром кипящей водяной бани. ФЛ количественно определяли с помощью двумерной аналитической тонкослойной хроматографии по неорганическому фосфору методом Васьковского [13], который используется наряду с современными масс-спектрометрическими методами. Для этого на ТСХ пластинку (Sorbfil ПТСХ-АФ-В, Россия) наносили экстракт липидов. Для разделения липидов использовали двумерную систему: первое направление – хлороформ : метанол : 28%NH4OH : бензол (65 : 30 : 10 : 5), второе направление – хлороформ : метанол : ацетон : уксусная кислота : вода : бензол (70:30:5:4:1:10). После разделения смеси липидов ФЛ обнаруживали опрыскиванием 10% серной кислотой в этаноле с последующим нагреванием пластинки до проявления пятен. Силикагель из зон, содержащих разделенные ФЛ, переносили микрошпателем в жаростойкие пробирки, добавляли в каждую 0.05 мл 72% хлорной кислоты. Для холостых проб отбирали силикагель, взятый с чистого участка нижней части хроматограммы, площадью, равной средней величине хроматографической зоны. Сжигание проводили на песчаной бане при 180–200°С в течение 20 мин. После охлаждения в пробирки вносили по 0.45 мл рабочего реагента, для которого к 5.5 мл исходного молибдатного реагента добавляли 26 мл 1N серной кислоты, и доводили объем до 100 мл дистиллированной водой. Исходный молибдатный реагент готовили следующим образом: к 10 г молибдата натрия добавляли 60 мл 4N HCl, 0.4 г гидрозина солянокислого добавляли к 14 мл 4N HCl, два реактива соединяли и нагревали 20 мин на кипящей водяной бане, затем добавляли к холодному раствору 14 мл концентрированной серной кислоты и доводили объем до 100 мл дистиллированной водой (реактив хранился в посуде из темного стекла при комнатной температуре). Смесь в пробирке тщательно перемешивали с помощью шейкера. Пробирки помещали на кипящую водяную баню на 15 мин, охлаждали, силикагель удаляли центрифугированием (10 мин при 700 g) и измеряли величину оптической плотности полученного раствора при 815 нм на спектрофотометре УФ-ВИД Specord S100 (“Analitik Jena”, Германия). Количество фосфора в ФЛ определяли по калибровочной кривой, используя для ее построения аликвотные части стандартного раствора фосфата (Na2HPO4). Для перерасчета использовали коэффициенты, которые представляют собой отношение молекулярной массы каждого ФЛ к атомной массе фосфора. В данном исследовании использовали пересчет фосфора в ФЛ путем умножения на средний коэффициент 25. Результаты представлены в мг ФЛ / г сухого веса образца.
Статистическая обработка. В таблицах представлены средние данные из 4–5 биологических повторностей и их стандартные отклонения. Статистическую обработку экспериментальных данных осуществляли с использованием пакета статистического анализа в среде Microsoft Office Excel 2010. Нормальность распределения полученных значений определяли по критерию Шапиро-Уилка. Статистическую значимость различий сравниваемых средних значений оценивали с помощью t-критерия (P < 0.001).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты определения содержания общих липидов и ФЛ в четырех эмбриогенных и двух неэмбриогенных клеточных линиях лиственницы сибирской представлены в табл. 1. Можно видеть, что абсолютное содержание суммарных липидов в эмбриогенных линиях было достоверно выше, чем в неэмбриогенных. Такая же тенденция сохраняется и для абсолютного содержания ФЛ – 5.5–9.3 мг/г сухого веса для эмбриогенных и 2.1–4.9 мг/г сухого веса для неэмбриогенных клеточных линий, соответственно. Таким образом, суммарное содержание ФЛ было достоверно выше для эмбриогенных клеточных линий, чем для неэмбриогенных (табл. 1). При этом наиболее высоким содержанием ФЛ среди эмбриогенных клеточных линий отличались линии Кл6 (9.3 мг/г сухого веса) и Кл4 (9.1 мг/г сухого веса), а наименьшим линия Кл2 (5.5 мг/г сухого веса). Установленное в наших экспериментах суммарное содержание ФЛ в клеточных линиях лиственницы заметно ниже по сравнению с результатами, полученными для каллусной культуры айвы бенгальской (Aegle marmelos), где содержание ФЛ составило – 14.5–16.0 мг/г сухого веса для неморфогенных каллусов [15] и неморфогенных каллусов дурмана индейского (Datura innoxia), для которого этот показатель составил 15.1 мг/г сухого веса [16]. Вероятно, более низкое содержание ФЛ по сравнению с каллусной культурой айвы и дурмана характерно для клеточных линий лиственницы сибирской и является видоспецифическим признаком.
Таблица 1.
Содержание липидов и фосфолипидов в эмбриогенных и неэмбриогенных клеточных линиях лиственницы сибирской L. sibirica
| Липиды, мг/г сухого веса клеточной линии | Клеточные линии | |||||
|---|---|---|---|---|---|---|
| Кл4(э) | Кл6(э) | Кл2(э) | Кл10(э) | Кл23(нэ) | Кл31(нэ) | |
| ФЛ | 9.1 ± 0.6 | 9.3 ± 0.6 | 5.5 ± 0.3 | 7.5 ± 0.7 | 2.1 ± 0.2 | 4.9 ± 0.3 |
| Сумма ОЛ | 43.6 ± 3.3 | 55.2 ± 4.5 | 49.9 ± 2.1 | 45.5 ± 4.2 | 35.8 ± 2.7 | 38.9 ± 0.6 |
Среди ФЛ в клеточных линиях с разным эмбриогенным потенциалом были идентифицированы следующие типы: ФХ, фосфатидилэтаноламины (ФЭ), фосфатидилсерины (ФС), фосфатидилинозиты (ФИ), фосфатидилглицерины (ФГ), дифосфатидилглицерины (ДФГ), фосфатидная кислота (ФК) (табл. 2). При этом ФЭ, ФС, ФК, ФИ были обнаружены у всех клеточных линий. Доминирующими ФЛ для эмбриогенных клеточных линий были ФХ и ФЭ (табл. 2), для неэмбриогенных линий доминирующим ФЛ была ФК (табл. 2). Однако следует отметить, что линия Кл2 отличалась в этом отношении от других эмбриогенных линий: относительное содержание ФК в составе этой линии составило 50%.
Таблица 2.
Содержание ФЛ в эмбриогенных и неэмбриогенных клеточных линиях лиственницы сибирской L. sibirica
| Клеточные линии | Тип ФЛ | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| ФХ | ФЭ | ФИ | ФК | ФС | ФГ | ДФГ | ФЛн | ||
| Кл4 (э) | мг/г с.в. Кл | 2.92 ± 0.34 | 2.1 ± 0.17 | 0.89 ± 0.08 | 1.57 ± 0.16 | 0.42 ± 0.04 | 0.31 ± 0.07 | 0.51 ± 0.08 | 0.40 ± 0.04 |
| % от ΣФЛ | 32.02 | 23.03 | 9.76 | 17.21 | 4.60 | 3.40 | 5.59 | 4.39 | |
| Кл6 (э) | мг/г с.в. Кл | 3.49 ± 0.29 | 2.59 ± 0.24 | 1.06 ± 0.25 | 1.62 ± 0.30 | – | 0.10 ± 0.03 | 0.44 ± 0.05 | – |
| % от ΣФЛ | 37.53 | 27.85 | 11.40 | 17.42 | – | 1.08 | 4.73 | – | |
| Кл2 (э) | мг/г с.в. Кл | 0.43 ± 0.02 | 0.40 ± 0.09 | 0.50 ± 0.08 | 2.74 ± 0.19 | 0.47 ± 0.05 | 0.45 ± 0.09 | 0.48 ± 0.12 | – |
| % от ΣФЛ | 7.86 | 7.31 | 9.14 | 50.09 | 8.59 | 8.23 | 8.78 | – | |
| Кл10 (э) | мг/г с.в. Кл | 2.49 ± 0.32 | 1.64 ± 0.23 | 0.55 ± 0.12 | 1.19 ± 0.23 | 0.12 ± 0.05 | 0.51 ± 0.09 | 0.43 ± 0.07 | 0.52 ± 0.09 |
| % от ΣФЛ | 33.42 | 22.01 | 7.38 | 15.97 | 1.61 | 6.85 | 5.77 | 6.98 | |
| Кл23 (нэ) | мг/г с.в. Кл | 0.14 ± 0.00 | 0.18 ± 0.02 | 0.17 ± 0.02 | 1.62 ± 0.19 | – | – | 0.00007 ± ± 0.00 | – |
| % от ΣФЛ | 6.63 | 8.53 | 8.06 | 76.77 | – | – | 0.003 | – | |
| Кл31 (нэ) | мг/г с.в. Кл | 0.32 ± 0.07 | 0.79 ± 0.12 | 0.34 ± 0.07 | 3.15 ± 0.21 | – | 0.08 ± 0.02 | 0.18 ± 0.03 | – |
| % от ΣФЛ | 6.58 | 16.25 | 7.00 | 64.81 | – | 1.65 | 3.70 | – | |
Примечание. ФЛ – фосфолипиды, ФХ – фосфатидилхолины, ФЭ – фосфатидилэтаноламины, ФС – фосфатидилсерины,ФИ – фосфатидилинозиты, ФГ – фосфатидилглицерины, ДФГ – дифосфатидилглицерины, ФК – фосфатидная кислота, ФЛн – неидентифицированный ФЛ, э – эмбриогенные клеточные линии, нэ – неэмбриогенные клеточные линии, с.в. Кл – сухой вес клеточной линии, ΣФЛ – сумма фосфолипидов. В таблице приведены средние значения из 4-5 биологических повторностей и их стандартные отклонения, различия значимы при P < 0.001.
Для эмбриогенных клеточных линий нами были обнаружены значительно более высокие относительные содержания ФХ и ФЭ. Так, эмбриогенные клеточные линии достоверно отличались от неэмбриогенных по высокому содержанию ФХ (0.43–3.49 мг/г сухого веса) (табл. 2). При этом Кл2 отличалась наиболее низким абсолютным содержанием ФХ (0.43 мг/г сухого веса) по сравнению с другими эмбриогенными линиями. Кл2 также содержала меньшее, чем другие эмбриогенные клеточные линии, количество ФЭ (0.40 мг/г и 1.64–2.59 мг/г сухого веса, соответственно) и чем неэмбриогенная линия Кл31 (0.79 мг/г сухого веса) (табл. 2). В литературе имеются сведения по относительному содержанию этих ФЛ для культуры in vitro некоторых видов растений. Например, для соматических зародышей культуры Glycine max [17] и морфогенных каллусов D. innoxia [16] относительное содержание ФХ составляло 38 и 33%, соответственно. В наших экспериментах относительное содержание ФХ достигало 37.5% (Кл6) для эмбриогенных линий, в то время как неэмбриогенные линии содержали значительно меньшее количество ФХ – 6.5%. Относительное содержание ФЭ для эмбриогенных клеточных линий лиственницы сибирской достигало 27.8%, что согласуется с данными для D. innoxia, однако для культуры G. max содержание этого ФЛ составляло 6.4%. Для неэмбриогенных и эмбриогенных клеточных линий черешни (Prunus avium) установлено, что ФХ является для них основным ФЛ [18]. Авторами отмечено, что средний уровень ФХ в эмбриогенных тканях был в 9 раз выше, чем в неэмбриогенных каллусах. Для эмбриогенных клеточных линий P. avium также было показано значительно более высокое количество ФЭ (примерно в 5 раз) по сравнению с неэмбриогенными. Как уже упоминалось ранее, в работе [9], посвященной влиянию сахарозы, мио-инозитола и ФХ на процессы индукции и дифференциации каллусов B. napus, авторы наблюдали быстрое нарастание скорости поглощения этих соединений регенерирующей каллусной тканью после переноса на среду, стимулирующую регенерацию. Авторы делают вывод, что эти соединения, в том числе ФХ, играют важную роль на самых ранних стадиях дифференцировки, и изменения в их содержании могут быть полезны в качестве возможного раннего прогностического теста на органогенную способность каллусов. ФХ и ФЭ являются двумя наиболее распространенными видами ФЛ в эукариотических клетках. ФХ – основной источник диглицеридов, ФК, лизофосфатидной и арахидоновой кислот, которые могут далее метаболизироваться в сигнальные молекулы [19]. Достаточно высокие содержания ФХ позволяют клеткам контролировать избирательную проницаемость мембран для ионов и воды [10]. ФЭ играет основную роль в мембранной архитектуре – он имеет коническую форму с небольшой полярной головной группой относительно поперечного сечения гидрофобных хвостов [19]. По этой причине он способен образовывать обращенные неламеллярные структуры, например, гексагональную.
Рассчитанное по результатам наших экспериментов отношение ФХ/ФЭ (рис. 1) для эмбриогенных клеточных линий лиственницы было достоверно выше в 1.4–3.8 раз, чем для неэмбриогенных. В целом этот показатель для эмбриогенных клеточных линий во всех случаях был выше 1, а для неэмбриогенных – ниже 0.8. В работе [20] показано, что для каллусов риса (Oryza sativa) соотношение ФХ/ФЭ составляло 1.1, однако при добавлении в среду холина этот показатель увеличивался до 1.7. Авторы сделали вывод, что холин является перспективным агентом для стимуляции быстрой пролиферации культур O. sativa. Отношение ФХ/ФЭ для эмбриогенных линий P. avium было выше в 12 и более раз в отличие от неэмбриогенных линий [18], а для неморфогенных каллусов D. innoxia [16] составило 1.2, в то время как для его морфогенных каллусов, образующих побеги, эта величина составила около 1.5. Зачастую в работах, посвященных изучению ФЛ у растений и грибов, подверженных действию различных стрессоров, а также в условиях культуры in vitro, используют отношение ФХ/ФЭ как параметр, зависящий от особенностей структуры мембраны, влияющих на ее функциональность [21]. Для ламеллярных мембранных структур характерно более высокое значение отношения ФХ/ФЭ, в то время как снижение этого отношения показывает образование различных гексагональных структур в мембране. Снижение отношения ФХ/ФЭ способствует процессу дегидратации, увеличению проницаемости мембран и может приводить к их повреждению и нарушению целостности, что, в свою очередь, вызывает образование каналов, через которые осуществляется пассивный транспорт воды [21].
Рис. 1.
Отношение содержания ФХ/ФЭ у эмбриогенных и неэмбриогенных клеточных линий лиственницы сибирской L. sibirica: э – эмбриогенные клеточные линии, нэ – неэмбриогенные клеточные линии. Приведенные данные представляют среднее ± SD (n = 4–5).
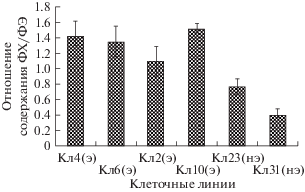
В целом, исходя из полученных нами и литературных данных, логично предположить, что высокое относительное содержание ФХ и ФЭ, а также высокие показатели отношения ФХ/ФЭ, по-видимому, сопровождают и, возможно, в какой-то степени определяют активные ростовые процессы у эмбриогенных клеточных линий в процессе развития культуры. В наших экспериментах абсолютные содержания ФК для неэмбриогенной Кл23 и эмбриогенных клеточных линий достоверно не различались (1.19–2.74 мг/г сухого веса) (табл. 2). Достоверные различия по этому признаку с эмбриогенными линиями найдены только для одной неэмбриогенной линии Кл31, но не для Кл23. Можно предположить, что такие различия в абсолютном содержании ФК между неэмбриогенными линиями обусловлены низким общим содержанием ФЛ у Кл23. Что касается относительного содержания ФК для неэмбриогенных клеточных линий, оно было более 64% от общего содержания ФЛ (76.8% – Кл23 и 64.8% – Кл31), в то время как для эмбриогенных ее относительное содержание было заметно ниже – от 16 (Кл10) до 50% (Кл2). Эти результаты позволяют заключить, что ФК является основным типом ФЛ неэмбриогенных клеточных линий лиственницы сибирской. Литературные данные в основном подтверждают, что высокое содержание ФК характерно для неэмбриогенных тканей. ФК, самый простой мембранный ФЛ, является липидным медиатором регуляции ряда клеточных процессов, таких как сигнальная трансдукция, мембранный транспорт и перестройка цитоскелета [22]. У растений ФК служит вторичным мессенджером и реагирует изменением содержания в ответ на различные биотические и абиотические стрессы, включая засуху, засоление, ранение, холод, гибель клеток [22]. Для арабидопсиса показано, что у двойного мутанта по генам биосинтеза ФЛ cds1cds2 содержание ФК было в 6 раз больше, чем у дикого типа [23]. В связи с этим авторы пришли к выводу, что высокое содержание ФК вызывает дефекты деления и удлинения клеток. Поскольку ФК содержится в неэмбриогенных линиях в значительно больших относительных количествах по сравнению с эмбриогенными, а также с учетом литературных данных можно предположить, что высокое содержание ФК способно оказывать негативное влияние на способность культуры in vitro к эмбриогенезу. Известно, что ФИ – субстрат для полифосфоинозитов (ПФИ), которые, в свою очередь, обеспечивают пролиферацию клеток и организацию в них цитоскелета, транспорт везикул к вакуоли и т.п. [7], могут функционировать как сигнальные липиды [24]. ПФИ играют важную роль при формировании клеточной полярности и дифференцировке клеток при развитии растений [24]. В наших экспериментах установлено, что абсолютное содержание ФИ достоверно различается для эмбриогенных и неэмбриогенных клеточных линий (табл. 2). Для эмбриогенных линий оно составило 0.50–1.06 мг/г сухого веса (11.9–20.3 мг/г общих липидов (ОЛ), порядка 10% от суммы ФЛ), в то время как для неэмбриогенных 0.17–0.34 мг/г сухого веса (4.7–9.0 мг/г ОЛ, порядка 7% от суммы ФЛ). В литературе имеются данные о различиях между уровнями ФИ при сравнительном анализе липидного состава мембран клеток на разных стадиях дифференцировки. Так, содержание ФИ для неморфогенного каллуса D. innoxia составило 9% (1.8 мг/г сухого веса) от суммы полярных липидов, а для морфогенных каллусов достигало 18% (4.7 мг/г сухого веса) от суммы полярных липидов [16]. Для морфогенных клеточных линий озимой пшеницы также зафиксировано высокое содержание ФИ (50 мг/г ОЛ) [25]. Обнаружено, что содержание ФИ для эмбриогенных клеточных линий P. avium выше более чем в 2 раза по сравнению с неэмбриогенными [18]. Авторами ранее упомянутой работы [23] отмечено не только увеличение содержания ФК для двойного мутанта по генам cds1cds2, участвующим в синтезе ФЛ, но и низкое содержание ФИ (6% от суммы ФЛ) по сравнению с диким типом. Авторы связывают резкое снижение уровня ФИ у нежизнеспособных мутантов с дефектами клеточного деления. В целом, в эмбриогенных и морфогенных клеточных линиях наблюдается более высокое содержание ФИ по сравнению с неэмбриогенными и неморфогенными.
В составе ФЛ клеточных линий лиственницы сибирской в минорных количествах обнаружены ДФГ, ФГ и ФС (табл. 2). При этом ФС обнаружен только в эмбриогенных клеточных линиях Кл4 (0.42 мг/г сухого веса), Кл2 (0.47 мг/г сухого веса), Кл10 (0.12 мг/г сухого веса). В основном ФС содержится в мембранах в незначительных количествах, однако, помимо его структурной функции, он участвует, по-видимому, и в других клеточных процессах. Например, обнаружено, что мутация гена pss1-1, кодирующего фосфатидилсеринсинтазу 1 у арабидопсиса, вызывает нарушение деления клеток и их удлинения [26]. Содержание ДФГ также было выше в 2 и более раза (0.43–0.51 мг/г сухого веса) для эмбриогенных линий, чем для неэмбриогенных. В клетках линии Кл23 нами обнаружены следовые количества этого ФЛ. Известно, что ДФГ (кардиолипин) является характерным ФЛ внутренней мембраны митохондрий [27]. Показано, что нехватка ДФГ в митохондриях сопровождается падением мембранного потенциала, снижением синтеза АТФ и в целом митохондриальной функции, а его отсутствие приводит к дестабилизации суперкомплексов дыхательной цепи [28]. Нами был обнаружен ФГ в эмбриогенных клеточных линиях Кл4 (0.31 мг/г сухого веса), Кл6 (0.10 мг/г сухого веса), Кл2 (0.45 мг/г сухого веса), Кл10 (0.51 мг/г сухого веса) и в неэмбриогенной линии Кл31 (0.08 мг/г сухого веса). Известно, что в растительных клетках ФГ в основном является ФЛ тилакоидных мембран, однако он может встречаться и в других клеточных мембранах [29]. Например, мембраны митохондрий также содержат ФГ [27], кроме того ФГ является важным источником ДФГ [30], который в свою очередь, как уже было сказано ранее, играет важную роль в процессах дыхания у растений. Можно предположить, что ФС, ФГ и ДФГ, несмотря на относительно небольшое содержание, также могут принимать участие в эмбриогенезе клеточных линий лиственницы сибирской, поскольку известно, что эти ФЛ важны для нормального функционирования процессов роста и развития у растений [26, 28, 30].
Анализ полученных результатов показывает, что содержание и качественный состав ФЛ в культуре in vitro закономерно различаются между клеточными линиями с разным эмбриогенным потенциалом. Эмбриогенные клеточные линии содержат больше ФХ, ФЭ, наиболее распространенных форм ФЛ, необходимых для формирования мембран клеток и клеточных органелл. Для эмбриогенных клеточных линий также характерны высокие значения отношения содержаний этих двух типов липидов (ФХ/ФЭ), показателя, свидетельствующего о функциональном состоянии клеточных мембран. Низкие его значения могут указывать на увеличение проницаемости мембран и даже на их повреждение. Соответствующее содержание ФХ и ФЭ на фоне высокого отношения ФХ/ФЭ обеспечивают наряду с другими функционально важными ФЛ активный рост эмбриогенных клеточных линий в процессе развития культуры на ранних стадиях культивирования. Полученные нами данные свидетельствуют в пользу представлений о том, что ФХ играет важную роль на самых ранних стадиях дифференцировки. Особый интерес представляют результаты анализа содержания ФИ. Установлено, что для тканей эмбриогенных клеточных линий характерно значительно более высокое содержание этого ФЛ. Вероятно, это является критически важным для эмбриогенеза, поскольку известно, что низкие содержания ФИ вызывают дефекты клеточного деления.
В целом, полученные результаты позволяют предположить, что ФЛ, в первую очередь, ФХ, ФЭ и ФИ, участвуют в процессах эмбриогенеза в тканях лиственницы сибирской in vitro на ранних стадиях культивирования. Следует отметить, что выявленные нами особенности состава ФЛ эмбриогенных клеточных линий Larix sibirica могут быть полезны наряду с другими маркерами, такими как олеиновая кислота [3], при скрининге клеточных линий с целью отбора материала для клонального размножения хвойных в культуре in vitro.
Работа выполнена с использованием оборудования ЦКП “Биоаналитика” СИФИБР СО РАН. Авторы выражают благодарность д.б.н., проф. И.Н. Третьяковой (Институт леса СО РАН, г. Красноярск) за предоставление исходного растительного материала лиственницы сибирской.
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Третьякова И.Н., Ворошилова Е.В., Шуваев Д.Н., Пак М.Э. Перспективы микроклонального размножения хвойных в культуре in vitro через соматический эмбриогенез // Хвойные бореальной зоны. 2012. Т. 30. С. 180.
Третьякова И.Н. Эмбриогенные клеточные линии и соматический эмбриогенез в культуре in vitro у лиственницы сибирской // ДАН. 2013. Т. 450. С. 122.
Макаренко С.П., Шмаков В.Н., Дударева Л.В., Столбикова А.В., Семёнова Н.В., Третьякова И.Н., Константинов Ю.М. Жирнокислотный состав суммарных липидов эмбриогенных и неэмбриогенных каллусных линий лиственницы // Физиология растений. 2016. Т. 63. С. 267.
Семёнова Н.В., Шмаков В.Н., Пак М.Э., Третьякова И.Н., Константинов Ю.М., Дударева Л.В. Особенности состава нейтральных липидов эмбриогенных и неэмбриогенных клеточных линий Larix sibirica Ledeb. // Биологические мембраны. 2020. Т. 37. С. 215.
Лось Д.А. Структура, регуляция экспрессии и функционирование десатураз жирных кислот // Успехи биол. химии. 2001. Т. 41. С. 163.
Чиркова Т.В. Клеточные мембраны и устойчивость растений к стрессовым воздействиям // Соросовский образовательный журнал. 1997. № 9. С. 12.
Джамеев В.Ю. Фосфолипидный сигналинг у растений // Вiсник Харкiвського нацiонального аграрного унiверситету. Серiя бiологiя. 2014. Вип. 3 (33). С. 80.
Kumar N.U., Gnanaraj M., Sindhujaa V., Viji M., Monoharan K. A microdroplet cell culture based high frequency somatic embryogenesis system for pigeonpea, Cajanus cajan (L.) Millsp. // Indian J. Exp. Biol. 2015. V. 53. P. 600.
Zur I., Skoczowski A., Pienkowski S., Dubert F. Kinetics of 14C-labelled sucrose, myo-inositol and phosphatidylcholine uptake during induction and differentiation in Brassica napus callus culture // Acta Physiol. Plant. 2002.V. 24. P. 11.
Pukacki P.M. The effect of industrial air pollution on membrane lipid composition of Scots pine (Pinus sylvestris L.) needles // Acta Soc. Bot. Pol. 2004. V. 73. P. 187.
Алаудинова Е.В., Миронов П.В. Поваляева В.А. Исследование молекулярной структуры фосфатидилэтаноламинов и фосфатидилсеринов меристем почек Picea obovata L. в состоянии низкотемпературной устойчивости // Вестник КрасГАУ. 2010. С. 104.
Folch J., Lees M., Sloane Stanley G.H. A simple method for the isolation and purification of total lipids from animal tissues // J. Biol. Chem. 1957. V. 226. P. 497.
Vaskovsky V.E., Latyshev N.A. Modified Jungnickel’s reagent for detecting phospholipids and other phosphorus compounds on thin-layer chromatograms // J. Chromatogr. A. 1975. V. 115. P. 246.
Kates M. Techniques of lipidology: Isolation, analysis and identification of lipids. 2 ed. Amsterdam-NY-Oxford: Elsevier, 1986. 464 p.
Bhardwaj L., Merillon J.-M., Ramawat K.G. Changes in the composition of membrane lipids in relation to differentiation in Aegle marmelos callus cultures // Plant Cell Tiss. Org. 1995. V. 42. P. 33.
Monoharan K., Prasad R., Guha-Mukherjee S. Greening and shoot-defferentiation related lipid changes in callus cultures of Datura innoxia // Phytochemistry. 1987. V. 26. № 2. P. 407.
Guschina I.A., Everard J.D., Kinney A.J., Quant P.A., Harwood J.L. Studies on the regulation of lipid biosynthesis in plants: application of control analysis to soybean // Biochim. Biophys. Acta. 2014. V. 1838. P. 1488.
Reidiboym-Talleux L., Grenier-De March G. Lipid and fatty acid composition in non-embryogenic calli and embryogenic tissues in wild cherry (Prunus avium) // Physiol. Plant. 1999. V. 105. P. 513.
Gibellini F., Smith T.K. The Kennedy pathway – de novo synthesis of phosphatidylethanolamine and phosphatidylcholine // IUBMB Life. 2010. V. 62. P. 414.
Sathishkumar R., Monoharan K. Lipid changes due to growth-factor supplements in callus and plasma membrane-enriched fraction of rice cultures // Phytochemistry. 1996. V. 43. P. 1171.
Wu J., Seliskar D.M., Gallagher J.L. The response of plasma membrane lipid composition in callus of the halophyte Spartina patens (Poaceae) to salinity stress // Am. J. Bot. 2005. V. 92. P. 852.
Xue H.-W., Chen X., Mei Y. Function and regulation of phospholipid signaling in plants // Biochem. J. 2009. V. 421. P. 145.
Zhou Yo., Peisker H., Weth A., Baumgartner W., Dormann P., Frentzen M. Extraplastidal cytidinediphosphate diacylglycerol synthase activity is required for vegetative development in Arabidopsis thaliana // Plant J. 2013. V. 75. P. 867.
Munnik T., Nielsen E. Green light for polyphosphoinositide signals in plants // Curr. Opin. Plant Biol. 2011. V. 14. P. 489.
Filek M., Pazurkiewicz-Kocot K., Dubert F., Marcinska I., Biesaga-Koscielniak. Changes of surface potential and phospholipid composition of winter wheat callus cells grown at 5 and 25°C // J. Agron. Crop Sci. 1993. V. 171. P. 243.
Liu Ch., Yin H., Gao P., Hu X., Yang J., Liu Zh., Fu X., Luo D. PHOSPHATIDYLSERINE SYNTHASE1 is required for inflorescence meristem and organ development in Arabidopsis // J. Integr. Plant Biol. 2013. V. 55. P. 682.
Bligny R., Douce R. A precise localization of cardiolipin in plant cells // Biochim. Biophys. Acta. 1980. V. 617. P. 254.
Рахманкулова З.Ф. Дыхательные суперкомплексы растительных митохондрий: структура и возможные функции // Физиология растений. 2014. Т. 61. С. 765.
Babiychuk E., Muller F., Eubel H., Braun H.-P., Frentzen M., Kushnir S. Arabidopsis phosphatidylglycerophosphate synthase 1 is essential for chloroplast differentiation, but is dispensable for mitochondrial function // Plant J. 2003. V. 33. P. 899.
Michaud M., Prinz W.A., Jouhet J. Glycerolipid synthesis and lipid trafficking in plant mitochondria // The FEBS Journal. 2016. V. 284. P. 376.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


