Физиология растений, 2021, T. 68, № 1, стр. 103-112
Рост культуры Porphyridium purpureum (Porphyridiales, Rhodophyta) и продукция B-фикоэритрина при различной освещенности
И. Н. Гудвилович a, *, А. С. Лелеков a, Е. И. Мальцев b, М. С. Куликовский b, А. Б. Боровков a
a Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр
“Институт биологии южных морей им. А. О. Ковалевского Российской академии наук”
Севастополь, Россия
b Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: gudirina2008@yandex.ru
Поступила в редакцию 08.04.2020
После доработки 25.04.2020
Принята к публикации 25.04.2020
Аннотация
Красный пигмент B-фикоэритрин (B-ФЭ), относящийся к группе фикобилипротеинов (ФБП), входит в состав светособирающего пигментного комплекса красной микроводоросли Porphyridium purpureum (Bory) Drew et Ross, а его количество в клетках определяется уровнем облучённости и обеспеченности азотом. С практической точки зрения, B-ФЭ является ценным природным пигментом, биотехнологический потенциал которого используется в нутрицевтике, фармацевтике, пищевой и косметической промышленности, а также в биомедицинских исследованиях и клинической диагностике. В экспериментах с P. purpureum довольно часто оценивают динамику численности клеток и содержание фотосинтетических пигментов, однако в большинстве экспериментов плотность культуры невысока, хотя известно, что у данного вида она может достигать 10 г/л сухого вещества. В связи с вышеизложенным, целью данной работы являлось изучение особенностей накопления и продукции ФБП в плотной культуре P. purpureum при различной освещенности. Проведенный молекулярно-генетический анализ подтвердил таксономическую принадлежность культуры P. purpureum. Водоросли выращивали в фотобиореакторах плоскопараллельного типа при средней освещённости 5, 10 и 15 кЛк. При исследовании микроводоросли P. purpureum в качестве показателей использовали динамику плотности культуры, содержание B-ФЭ и продукционные характеристики. Показано, что прирост плотности культуры микроводоросли, соответствующий расчетной концентрации азота в питательной среде, получен только для варианта с освещенностью 5 кЛк. Увеличение освещённости до 10 и 15 кЛк вызывало снижение как максимальной, так и средней продуктивности культуры в 2.5–3.5 раза. Экспериментально установлено, что самое высокое содержание B-ФЭ в клетках и культуре P. purpureum (5.5% сухого вещества и 74 мг/л соответственно) наблюдалось при освещённости 5 кЛк. Определен характер изменения содержания B-ФЭ в культуре P. purpureum в зависимости от удельной освещенности клеток микроводоросли: концентрация пигмента гиперболически снижалась с ростом удельной освещенности. Таким образом, уровень освещённости клеток микроводоросли P. purpureum оказывал значительное влияние на ростовые характеристики культуры (скорость роста, скорость синтеза и выход B-ФЭ): более низкий уровень поверхностной освещённости являлся предпочтительным для выращивания P. purpureum. Подход, предложенный в работе, позволяет снизить материальные затраты при культивировании P. purpureum с сохранением высокой скорости роста культуры.
ВВЕДЕНИЕ
За последние десятилетия была показана высокая биологическая ценность веществ, синтезируемых в клетках микроводорослей, таких как: пигменты, липиды и углеводы [1–3]. Именно благодаря этому биотехнология микроводорослей получила новое направление развития, когда выращивание осуществляют для получения биологически активных компонентов биомассы. Высокая ценность и востребованность таких пигментов, как хлорофиллы, каротиноиды и фикобилипротеины, позволила поставить вопрос о промышленном получении натуральных пигментов из микроводорослей [4–6].
Одноклеточная красная микроводоросль Porphyridium purpureum (Bory) Drew et Ross привлекает внимание исследователей широким спектром синтезируемых веществ различной природы. С прикладной точки зрения эта микроводоросль, в первую очередь, представляет интерес как источник сульфатированных экзополисахаридов, эссенциальных жирных кислот, а также пигментов, относящихся к группе фикобилипротеинов (ФБП), которые у красных водорослей входят в состав фикобилисом [2, 3, 5, 7–9]. Все это, а также отсутствие данных о наличии токсичных веществ в биомассе P. purpureum, позволяет использовать продукты синтеза в качестве биологически активных добавок (БАД), а отсутствие целлюлозной клеточной стенки значительно облегчает и удешевляет процесс извлечения ценных компонентов [1, 2, 5, 8, 10, 11].
Использование натуральных природных пигментов приобретает все большее значение для косметологии, фармакологии и производства продуктов питания. Доказано, что пигменты микроводорослей оказывают выраженное положительное влияние на организм человека, обладая антиоксидантным, антиканцерогенным, противовоспалительным действием, а также антиангиогенным и нейропротекторным эффектами. С практической точки зрения, ФБП являются ценными природными веществами, биотехнологический потенциал которых уже используется или перспективность которого показана при использовании в нутрицевтике, фармацевтике, пищевой и косметической промышленности, а также в биомедицинских исследованиях и клинической диагностике [1, 3, 4, 8, 9].
Известно, что биохимический состав и скорость роста культур микроводорослей отличается у разных видов и штаммов, при этом на выход ценных компонентов также оказывают влияние множество различных факторов, важнейшие из которых: тип и конструкция фотобиореактора, параметры культивирования (состав питательной среды, освещённость, условия аэрации, pH, температура и др.) [2, 4, 6, 7, 12, 13]. Свет является главным фактором среды, который определяет скорость протекания реакций фотосинтеза, излучение и спектральный состав могут изменить метаболизм и биохимический состав культур микроводорослей. В клетках микроводорослей свет поглощается светособирающими пигментными комплексами (ССК) и далее предается в реакционные центры первой (П700) и второй (П680) фотосистем. Общая тенденция, представленная в литературе: микроводоросли с фикобилисомами, как правило, предпочитают низкую освещенность (~10–50 моль фотонов/(м2 с), в то время как многие другие виды водорослей, например, большинство динофлагеллят или зеленые, обычно нуждаются в более высокой интенсивность света (~60–100 моль фотонов/(м2 с) [3, 10, 14–17]. ФБП Porphyridium (B-фикоэритрин, R-фикоцианин и аллофикоцианин), входящие в состав ФС II, являются пигментами белковой природы, и их количество в клетках, в первую очередь, определяется уровнем облученности и обеспеченности азотом. Одним из наиболее изученных ФБП является B-фикоэритрин (B-ФЭ), входящий в состав ССК P. purpureum и придающий красную окраску его культуре [10, 15]. В экспериментах с P. purpureum довольно часто оценивают динамику численности клеток и содержание фотосинтетических пигментов [7–9, 11, 12, 18]. Однако в большинстве экспериментов плотность культуры невысока, хотя известно, что у данного вида она может достигать и 10 г/л сухого вещества [10].
В связи с вышеизложенным, целью данной работы являлось изучение особенностей накопления и продукции ФБП в плотной культуре P. purpureum при различной освещённости.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования выполнялись на базе Отдела биотехнологий и фиторесурсов ФИЦ ИнБЮМ (г. Севастополь). Объектом исследования являлся штамм IBSS-70 красной микроводоросли Porphyridium purpureum (Bory) Drew et Ross (Rhodophyta) из коллекции Научно-образовательного центра коллективного пользования ФИЦ ИнБЮМ “Коллекция гидробионтов Мирового океана”.
Выращивание осуществляли на питательной среде для морских красных водорослей [15]: (состав: NaNO3 – 1.2 г/л, NaH2PO4 ⋅ 2H2O – 0.45 г/л, EDTA-Na2 – 0.037 г/л, FeC6H5O7 ⋅ 3H2O – 0.0265 г/л, MnCl2 ⋅ 4H2O – 0.004 г/л, Co(NO3)2 ⋅ 6H2O – 0.0031 г/л, (NH4)6Mo7O24 ⋅ 4H2O – 0.0009 г/л, K2Cr2(SO4)2 ⋅ 4H2O – 0.0017 г/л). Среду готовили на стерилизованной морской воде.
Культуру P. purpureum, которая была использована в качестве инокулята, предварительно выращивали в фотобиореакторах плоскопараллельного типа при освещённости 5 кЛк. Далее, культивирование продолжили в фотобиореакторах того же типа с рабочим объемом 1 л и толщиной слоя 2 см при круглосуточном искусственном освещении. В качестве осветителя использовали световую решетку из 18 Вт люминесцентных ламп; средняя освещённость на поверхности фотобиореакторов составляла 5, 10 и 15 кЛк. Интенсивность освещения на поверхности фотобиореактора регистрировали при помощи люксметра Ю-116 с погрешностью не более 5% от измеряемой величины. Температуру поддерживали на уровне 26–28°С, рН среды – 8–9. Барботаж культур осуществляли аквариумным компрессором Hailea ACO-308 воздухом без дополнительного введения углекислого газа; скорость подачи воздуха была одинакова для фотобиореакторов и составляла около 0.5 л/л культуры в минуту. Барботаж осуществляли через аквариумный распылитель воздуха, представляющий собой пластиковую трубку длиной 5 см, диаметром 5 мм, у которой диаметр пор не превышает 0.1 мм.
Молекулярно-генетические исследования проводились на базе лаборатории молекулярной систематики водных растений ИФР РАН. ДНК исследуемого штамма IBSS-70 экстрагировали с помощью набора HelixTM (“Bio-Rad Laboratories”, США) в соответствии с протоколом производителя. Амплификацию баркодингового участка V4 ядерного гена 18S рДНК длинной 435 п.н. проводили с помощью пары праймеров D512 и D978 [19]. Условия амплификации: начальная денатурация – 5 мин при 95°С, последующие 35 циклов: денатурация при 94°С – 30 с, отжиг праймеров – 40 с при 52°С, элонгация – 50 с при 72°С; окончательное удлинение – 5 мин при 72°С.
Полученный ПЦР-продукт визуализировали методом горизонтального электрофореза в агарозном геле (1%) и окрашивали SYBR® Safe (“Life Technologies”, США). Очистку ПЦР-продукта проводили смесью FastAP, 10× FastAP Buffer, Exonuclease I (“Thermo Fisher Scientific”, США) и воды.
Редактирование и сборку полученной консенсусной последовательности осуществляли путем сопоставления прямых и обратных хроматограмм при помощи программ Ridom TraceEdit (ver. 1.1.0) и Mega7. Нуклеотидные последовательности выравнивали с помощью программы Mafft v7, используя модель E-INS-i. После этого проводили окончательное выравнивание – визуально определяли и удаляли неспаренные участки в начале и в конце полученной матрицы. Общая длина выравнивания составила 464 п.н.
Филогенетические деревья строились методами максимального правдоподобия (ML) и Байеса (BI). Набор молекулярно-генетических данных анализировался с использованием байесовского метода, реализованного в программе Beast ver. 1.10.1. [20]. Для выравненной нуклеотидной матрицы наиболее подходящая модель нуклеотидных замен, параметр формы α и доля неизменных сайтов (pinvar) оценивались с использованием байесовского информационного критерия (BIC) с помощью программы jModelTest 2.1.10 [21]. В качестве модели видообразования использовалось дерево-предшественник типа Yule. Расчетная сходимость параметров, эффективный размер выборки (ESS) и период выгорания проверялись с помощью программы Tracer ver. 1.7.1. [20]. Байесовский анализ проводился со следующими параметрами: случайное начальное дерево, количество запусков – 2, число параллельных цепочек – 4, количество поколений – 1 × 107, запись параметров каждого сотого поколения и параметр отжига – 25%. Деревья ML строили в онлайн программе RA×ML [22] с проверкой их устойчивости 1000 бутстреп-репликами. Просмотр и редактирование деревьев осуществляли в программах FigTree (ver. 1.4.2) и Adobe Photoshop CC (19.0).
Содержание сухого вещества в культуре определяли ежедневно весовым, а также фотометрическим методами [23]. Оптическую плотность культуры P. purpureum измеряли на фотометре Unico 2100 в кюветах с рабочей длиной 5 мм. Пробы для определения содержания ФБП отбирали через 2–3 суток на различных фазах роста накопительной культуры после тщательного перемешивания. Суспензию культуры P. purpureum, полученную в эксперименте, центрифугировали в течение 10 мин, надосадочную жидкость сливали, осаждённую биомассу использовали для определения ФБП. Количественное содержание ФБП определяли спектрофотометрическим методом [23]. Для этого проводили экстракцию биомассы P. purpureum фосфатным буфером (0.05 М; рН = = 7–7.5). Спектры экстрактов пигментов промеряли на регистрирующем спектрофотометре СФ-2000 в диапазоне длин волн 400–800 нм с шагом 0.1 нм. Регистрировали оптическую плотность полученных экстрактов в области характеристических максимумов поглощения В-фикоэритрина (545 нм), R-фикоцианина (615 нм) и аллофикоцианина (650 нм), а также при 750 нм (для учета неспецифического поглощения раствора). Концентрацию пигментов в водном экстракте определяли по [15], используя значения оптической плотности для соответствующих длин волн.
Рассчитывали средние арифметические ($\bar {x}$), стандартные отклонения (S), основные ошибки средних, доверительные интервалы для средних (Δ$\bar {x}$). Все расчеты проводили в программах Libre Office и Scidavis для уровня значимости α = 0.05. В таблицах и на графиках представлены средние значения и рассчитанные доверительные интервалы ($\bar {x}$ ± Δ$\bar {x}$) для трех повторностей. В некоторых случаях, чтобы избежать загромождения рисунков, доверительные интервалы на графиках не обозначены, а ошибка не превышала 10%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
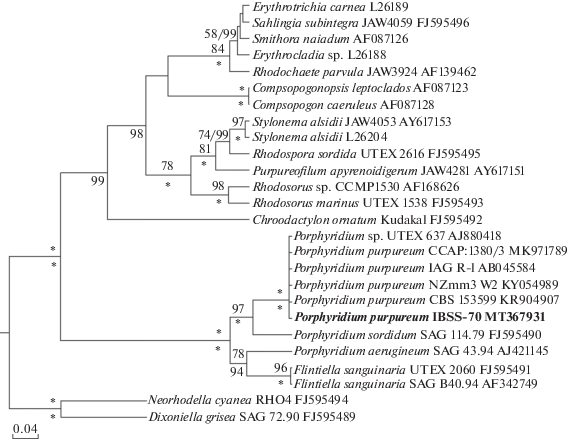
Проверка таксономического статуса исследуемого штамма IBSS-70 проводилась реконструкцией филогенетических связей методами максимального правдоподобия (ML, где LB – значение бутстрепа) и Байеса (BI, где PP – апостериорная вероятность). Как и в предыдущих исследованиях, касающихся вопросов филогении красных водорослей [24, 25], все включенные в анализ последовательности P. purpureum образовали единую кладу с максимальной статистической поддержкой (LB 100, PP 100) (рис. 1). В состав этой клады вошел как штамм IBSS-70, так и наиболее часто используемые в филогении Porphyridiophyceae штаммы P. purpureum CCAP 1380/3, Porphyridium sp. UTEX 637, P. purpureum IAG R-1, P. purpureum NZmm3W2 и P. purpureum CBS 153599. Остальные виды красных водорослей, содержащиеся в выборке, разбились на клады, соответствующие современному пониманию филогении Rhodophyta [24].
Рис. 1.
Байесовское филогенетическое дерево для штамма Porphyridium purpureum IBSS-70, сконструированное на основе анализа нуклеотидных последовательностей участка V4 18S рДНК для 26 представителей Rhodophyta. В качестве внешней группы выбраны представители порядка Dixoniellales. Общая длина выравнивания 464 п.н. Исследуемый штамм выделен жирным шрифтом. Для всех представителей указан номер штамма и номера доступа к последовательностям в GenBank. Над горизонтальными линиями показаны значения бутстрепа для ML-анализа (<50 не указаны), под горизонтальными линиями – значения Байесовских апостериорных вероятностей (<90 не указаны). * обозначена 100% статистическая поддержка. Модель нуклеотидных замен HKY+I+G, α = 0.3770 и pinvar = 0.2350.
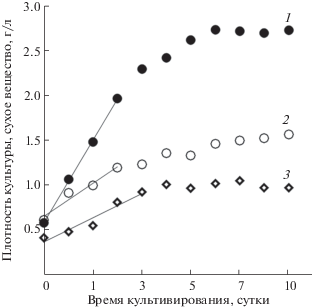
Начальная плотность культуры P. purpureum для всех вариантов эксперимента составляла около 0.5 г/л сухого вещества. За первые 5 суток выращивания прирост биомассы для варианта с самой низкой поверхностной освещенностью составил 1.8 г/л сухого вещества, а для двух остальных вариантов – в 3 раза ниже (0.6 и 0.7 г/л сухого вещества соответственно). Таким образом, за 5 суток выращивания культуры P. purpureum ее плотность увеличилась в 2.4, 2.5 и 4.7 раза (при освещенности 15, 10 и 5 кЛк соответственно) (рис. 2).
Рис. 2.
Динамика плотности культуры Porphyridium purpureum при различной освещенности: (1) 5 кЛк; (2) 10 кЛк; (3) 15 кЛк.
По литературным данным для синтеза 1 г биомассы P. purpureum (при оптимальных условиях) с нормальным содержанием белка (40–50%) необходимо около 70 мг азота [10]. Поэтому возможный прирост биомассы Porphyridium за весь период выращивания по расчетам мог составить 2.0–2.4 г/л сухого вещества [10, 26]. Близкие к расчетным значения этого параметра (2.1 г/л сухого вещества) наблюдались только для варианта эксперимента с освещённостью 5 кЛк. При повышении освещённости наблюдаемый прирост был значительно ниже потенциально возможного (в 2.3 и 3.3 раза для 10 и 15 кЛк соответственно) (табл. 1).
Таблица 1.
Продукционные характеристики накопительной культуры P. purpureum при различной освещенности
| Освещенность, кЛк | Количество
азота в среде, мг/л |
Прирост биомассы сухого вещества, г/л | Продуктивность, г/(л сут) |
||
|---|---|---|---|---|---|
| расчет | реальный | макс | средн. за 5 сут | ||
| 5 | 150 | 2.4 | 2.1 | 0.46 | 0.37 |
| 10 | 0.9 | 0.18 | 0.15 | ||
| 15 | 0.6 | 0.13 | 0.12 | ||
При освещенности 5 кЛк максимальная и средняя продуктивность культуры P. purpureum на линейном участке роста, а также прирост биомассы были значительно выше (в среднем, в 2.5–3.5 раза), чем в вариантах с более высокой освещенностью. Увеличение освещенности вызывало снижение продуктивности культуры, что, в итоге, приводило к существенной потере урожая биомассы P. purpureum. В большинстве случаев при интенсивном выращивании микроводорослей факторами, ограничивающими рост культуры, являются освещенность и обеспеченность элементами минерального питания клеток культуры. По литературным данным для выращивания P. purpureum предпочтительнее использовать более низкие освещенности [3, 10]. Ранее полученные данные показали возможность получения плотной культуры данного вида с продуктивностью около 0.5 г/(л сут) сухого вещества при поверхностной освещенности 20 кЛк, однако, в этом случае толщина рабочего слоя культуры была в 2.5 раза больше, чем в данном эксперименте [18]. По-видимому, увеличение поверхностной освещенности и, соответственно, удельной освещенности клеток, вызвало фотоингибирование роста культуры P. purpureum, даже при условии оптимальности прочих условий выращивания [10]. Кроме того, была отмечена коричневая окраска клеток культуры, наиболее интенсивная для варианта с максимальной освещённостью что, как правило, свидетельствует о нарушении процессов синтеза пигментов группы ФБП вследствие воздействия стрессовых условий.
Полученные данные свидетельствуют о негативном влиянии повышенного уровня облученности, нарушающего процессы биосинтеза ФБП в клетках культуры P. purpureum, несмотря на достаточное обеспечение элементами минерального питания (табл. 1).
В проведенном эксперименте некоторое лимитирование процессов роста и биосинтеза культуры P. purpureum начальной концентрацией азота в среде могло наблюдаться только для варианта с максимальной продукцией биомассы (5 кЛк) (табл. 1). О дефиците азота в среде в этом варианте также свидетельствовало наблюдаемое снижение содержания B-ФЭ в биомассе и в культуре P. purpureum (рис. 3) после 6-х суток и завершения стадии активного роста [3, 10].
Рис. 3.
Содержание В-фикоэритрина в клетках (а) и в культуре P. purpureum (б) при различной освещённости. (1) 5 кЛк; (2) 10 кЛк; (3) 15 кЛк.
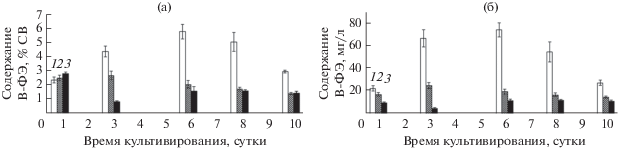
За 3 суток накопительного культивирования изменение содержания B-ФЭ в клетках P. purpureum для всех вариантов эксперимента имело разнонаправленный характер: при освещенности 5 кЛк оно увеличилось в 1.9 раза, при 10 кЛк – существенно не изменилось, а при 15 кЛк – снизилось в 3.4 раза по сравнению с первоначальными значениями (рис. 3а). При дальнейшем выращивании содержание B-ФЭ в клетках P. purpureum продолжало повышаться только в условиях минимальной освещенности (5 кЛк); таким образом, за 6 суток концентрация пигмента выросла в 2.6 раза (рис. 3а). Последующее снижение содержания B-ФЭ в клетках P. purpureum для этого варианта после 6-х суток культивирования совпадает с переходом культуры на стадию замедления роста и стационарную (рис. 3). В соответствии с приведенными выше расчетами, концентрация азота в питательной среде, по-видимому, была исчерпана, что вызвало как остановку роста культуры, так и процессов синтеза ФБП.
После 3 суток выращивания P. purpureum содержание B-ФЭ (в клетках и в культуре) при 10 кЛк несколько снизилось и далее до окончания эксперимента оставалось стабильным. При освещённости 15 кЛк после значительного снижения содержания B-ФЭ к 3-м суткам наблюдалось его повышение в 2 раза с последующей стабилизацией до окончания эксперимента.
Динамика изменения B-ФЭ в культуре P. purpureum, в основном, совпадала с направленностью изменения содержания данного пигмента в биомассе микроводоросли. Наибольший рост концентрации пигмента также был зарегистрирован для варианта с освещенностью 5 кЛк: содержание B-ФЭ увеличилось в 3.3 раза с 1 по 6 сутки культивирования, достигнув 74 мг/л, что являлось максимальным для условий данного эксперимента (рис. 3б). Снижение B-ФЭ после перехода культуры P. purpureum на стадию замедления роста и стационарную отмечено многими исследователями и связано с исчерпанием азота в среде и наблюдающейся на этом фоне деградацией ФБП, представляющих собой белковые комплексы [3, 6, 27]. Следует отметить, что снижение содержания B-ФЭ, обусловленное азотным лимитированием, наблюдалось только для варианта с минимальной освещенностью. Для двух других вариантов, учитывая, что прирост биомассы составил 25 и 38% от расчетного (для вариантов 15 и 10 кЛк соответственно), характер изменения содержания данного пигмента, по-видимому, определялся не концентрацией элементов минерального питания в среде, а уровнем освещенности клеток культуры. Заданный в эксперименте уровень освещенности 10 и 15 кЛк, по-видимому, являлся завышенным и ингибировал как ростовые процессы, так и процессы синтеза ФБП. Признано, что содержание в клетках P. purpureum фотосинтетических пигментов, особенно B-ФЭ, ввиду его локализации в антеннах, может являться чувствительным индикатором уровня освещенности клеток [12, 16]. Снижение содержания B-ФЭ, входящего в светособирающие комплексы ФС II, в клетках P. purpureum к 6-м суткам в вариантах эксперимента с повышенной освещенностью до крайне низких величин на фоне остановки роста культуры, указывает на серьезные нарушения процессов биосинтеза в клетках, что может приводить даже к гибели культуры [10].
Относительное содержание пигментов в клетках или биомассе микроводорослей является не только непостоянной величиной и может изменяться в десятки раз, но и характеризуется значительной нелинейностью в процессе роста культуры [28]. Ранее была предложена модель, которая позволяет прогнозировать динамику содержания пигментов, в том числе фикобилиновой природы, при культивировании микроводорослей с заданной внешней освещенностью [28]. Модель основана на предположении, что наблюдаемая скорость изменения концентрации пигмента является алгебраической суммой скоростей синтеза, фотодеструкции и восстановления части фотоокисленных пигментов:
(1)
$\begin{gathered} \beta = {{\beta }_{{{\text{st}}}}} + \left( {{{\beta }_{0}} - {{\beta }_{{{\text{st}}}}}} \right) \times \\ \times \,\,{{e}^{{ - {{\mu }_{{\text{m}}}}t}}}\left( {c\sin \sqrt {{{\mu }_{\pi }}{{\mu }_{i}}} t + \cos \sqrt {{{\mu }_{\pi }}{{\mu }_{i}}} t} \right) \\ \end{gathered} $Предлагаемая модель позволяет описать явление “ложного старта”, наблюдаемое при резком повышении освещенности клеток микроводорослей. В этом случае функция имеет явно выраженный минимум, который характеризуется параметрами βext и text и совпадает с полученными экспериментальными данными (рис. 4).
Рис. 4.
Динамика содержания В-фикоэритрина в клетках P. purpureum при 15 кЛк. Аппроксимация экспериментальных данных уравнением (1).
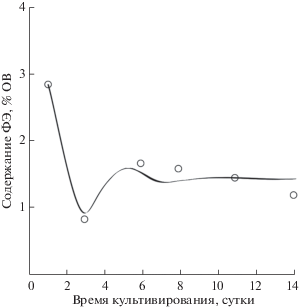
Анализируя характер кривой, следует отметить, что на начальном этапе фотодеструктивное окисление B-ФЭ преобладает над его синтезом, поэтому величина β уменьшается. Момент запуска накопительной культуры P. purpureum сопровождается резким увеличением облученности, приходящейся на единицу биомассы. В таких условиях помимо изменения содержания пигментов происходит перестройка всего фотосинтетического аппарата клеток [13]. Высокое соответствие теоретических и экспериментальных данных (R2 = 0.95) позволяет сделать вывод о том, что именно при учете процессов фотодеструктивного окисления пигментов с возможностью их последующего восстановления можно объяснить явление так называемого “ложного старта” динамики относительного содержания B-ФЭ при резком изменении облученности клеток P. purpureum. Таким образом, предлагаемая модель может быть использована для прогнозирования динамики содержания пигментов при культивировании P. purpureum с заданной внешней освещенностью.
Известно, что продукция ФБП зависит как от скорости роста культуры, так и от содержания данных пигментов в клетках микроводоросли [7, 18]. Наибольшая продуктивность по B-ФЭ накопительной культуры P. purpureum зарегистрирована для варианта эксперимента с поверхностной освещенностью 5 кЛк (табл. 2).
Таблица 2.
Скорость синтеза B-ФЭ и его содержание в культуре P. purpureum при различной освещенности
| Освещенность, кЛк |
Скорость
синтеза B-ФЭ, мг/(л сут) |
Выход B-ФЭ за 6 сут, мг/л |
|---|---|---|
| 5 | 10.3 | 74 |
| 10 | 1.4 | 20 |
| 15 | 0.4 | 12 |
Поскольку повышение поверхностной освещенности в 3 раза (от 5 до 15 кЛк) приводит к уменьшению как содержания B-ФЭ в клетках P. purpureum, так и скорости роста культуры в 3 раза, то и продуктивность по данному пигменту снижается более чем в 6 раз, что также свидетельствует об угнетении биосинтеза ФБП. В общем, характер изменения продуктивности культуры P. purpureum по B-ФЭ совпадал с таковым у ранее рассчитанных ростовых параметров: средняя наблюдаемая скорость синтеза B-ФЭ и суммарный выход данного пигмента при освещённости 5 кЛк значительно превышают значения аналогичных характеристик культуры при повышенной освещенности (табл. 2).
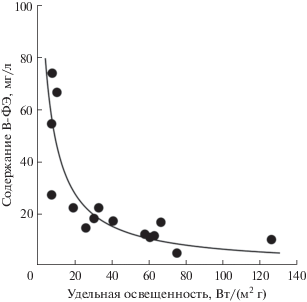
На основании экспериментальных данных была получена классическая зависимость содержания B-ФЭ от удельной облученности: концентрация пигмента гиперболически снижалась с ростом удельной освещенности клеток P. purpureum (рис. 5). При малых интенсивностях света содержание пигмента (β) достигало максимального значения βmax. С увеличением интенсивности света значения β снижались и в пределе достигали некоторого минимального значения βmin. При удельной облученности около 10 Вт/(м2 г) наблюдался “компенсационный пункт” фотосинтеза: дальнейшее снижение облученности приводило к “выцветанию” пигмента [29]. Отметим, что каждая точка такой кривой является квазистационарным состоянием, которое определяется уровнем внешней освещенности и плотности культуры. Однако это состояние достигается в течение некоторого времени, при этом динамика переходного процесса во времени носит сложный нелинейный характер согласно (1).
Рис. 5.
Зависимость содержания В-фикоэритрина в культуре P. purpureum от удельной облученности. Аппроксимация экспериментальных данных уравнением (2).
Ранее была предложена модель, которая позволяет прогнозировать содержание пигментов при культивировании микроводорослей с заданной внешней освещенностью [30]. В стационарном процессе (непрерывная культура) величина относительного содержания пигмента в биомассе водоросли определяется отношением установившихся концентраций пигмента и биомассы. Отношение содержания пигмента к максимально возможному (без процесса деструкции) определяется отношением концентраций пигментов: наблюдаемых и максимальных. Наблюдаемая концентрация определяется балансом синтезированных и разрушенных пигментов. Сведение математических форм записи происходящих процессов в единое целое приводит к следующей математической модели светозависимого содержания пигментов в клетках микроводорослей с учетом скорости роста:
(2)
$\beta = {{\beta }_{{\max }}}\frac{{\mu {{F}_{{\text{d}}}}}}{{\mu {{F}_{{\text{d}}}} + {{I}_{{\text{a}}}}}},$Среда обитания водорослей характеризуется неоднородностью и постоянно изменяющимися световыми условиями. В результате адаптации к свету происходит структурно-функциональная перестройка фотосинтетического аппарата, направленная на более эффективное использование энергии светового потока. Концентрация пигментов в клетках является важнейшим показателем, который характеризует способность растительных клеток поглощать световую энергию. Модель (2) позволяет прогнозировать содержание B-ФЭ при различной освещенности и демонстрирует, что максимальное накопление пигментов будет в диапазоне освещенности 7–10 Вт/(м2 г). Продуктивность культуры была также значительно выше при освещенности 10–20 Вт/(м2 г) (в среднем, в 3–5 раз), чем в вариантах с более высокой освещённостью. Таким образом, при низкой освещённости клеток микроводоросли P. purpureum, незначительно превышающей компенсационный пункт фотосинтеза, наблюдается как рост продуктивности культуры, так и рост содержания B-ФЭ, что предопределяет высокую продукцию пигментов культурой, а низкий уровень поверхностной освещённости является предпочтительным для выращивания P. purpureum.
Существенные различия по условиям освещенности клеток отражались не только на содержании ФБП в культуре P. purpureum, но и на их соотношениях. При этом значения соотношений B-ФЭ/R-ФЦ и BВ-ФЭ/АФЦ при 5 кЛк были значительно выше (в среднем, в 2–3 раза) на всем протяжении эксперимента, по сравнению с вариантами с более высоким уровнем освещенности, что свидетельствует о более высокой доле B-ФЭ при низкой освещенности (рис. 6).
Рис. 6.
Соотношение B-ФЭ/R-ФЦ (а) и B-ФЭ/АФЦ (б) в культуре P. purpureum при различной освещенности. (1) 5 кЛк; (2) 10 кЛк; (3) 15 кЛк.
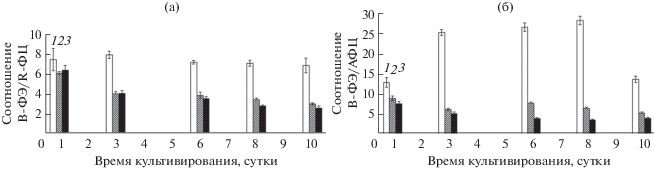
Следует отметить, что изменение содержания ФБП P. purpureum происходило неравномерно. Значения соотношения B-ФЭ/R-ФЦ на протяжении эксперимента снижались для вариантов эксперимента 10 и 15 кЛк, причем максимальное снижение (на 60%) и минимальные значения данного соотношения (2.5) зарегистрированы для освещенности 15 кЛк (рис. 6а). Соотношение B-ФЭ/АФЦ для вариантов эксперимента 10 и 15 кЛк также имело тенденцию к снижению на протяжении всего периода культивирования, причем минимальное значение (3.5) также зарегистрировано для варианта с максимальной освещенностью (рис. 6б). При освещенности 5 кЛк соотношение B-ФЭ/ R-ФЦ оставалось достаточно стабильным на протяжении всего эксперимента, несмотря на значительные изменения содержания B-ФЭ как в культуре, так и в клетках P. purpureum, что свидетельствует об отсутствии выраженного влияния световых условий на соотношение этих пигментов. В целом, культура P. purpureum при низкой освещенности (5 кЛк) характеризовалась значительно более высокой долей B-ФЭ по отношению к R-ФЦ и АФЦ по сравнению с другими вариантами эксперимента, что соответствует современным представлениям о влиянии освещённости на количественные соотношения ФБП. Повышенная освещенность в эксперименте вызывала уменьшение значений соотношений B-ФЭ/R-ФЦ и B‑ФЭ/АФЦ в культуре P. purpureum до крайне низких значений (рис. 6). Уменьшение значения соотношения B-ФЭ/АФЦ для варианта с освещенностью 5 кЛк отмечено после 8-х суток эксперимента, что совпадало с переходом культуры на стационарную фазу роста и вероятным исчерпанием элементов минерального питания в среде. Уменьшение индекса B-ФЭ/АФЦ в 2–4 раза, наблюдаемое при развитии азотного дефицита у P. purpureum (рис. 6б, 5 кЛк), свидетельствует о преимущественной деградации B-ФЭ по сравнению с АФЦ, находящимся в сердцевине антенных структур, что согласуется с литературными данными о большей лабильности фикоэритрина как светособирающего пигмента [16, 18].
Ранее было показано, что продуктивность P. purpureum по биомассе может достигать 0.5 г/(л сут), а по B-ФЭ – 30–50 мг/(л сут) [7, 18, 27]. Следует отметить, что продуктивность P. purpureum в проведенном эксперименте при 5 кЛк достигала 0.4 г/(л сут) и получена при освещенности в 4 раза ниже, чем в указанном выше опыте [18], а также без дополнительного введения СО2 в газовоздушную смесь. Полученные результаты демонстрируют возможность значительно уменьшить затраты на энергетическую составляющую при выращивании P. purpureum с сохранением высокой скорости роста культуры. Успешное решение задачи повышения скорости синтеза B-ФЭ позволит повысить рентабельность выращивания P. purpureum как источника этого ценного природного пигмента.
В заключении, следует отметить, что проведенный молекулярно-генетический анализ подтвердил таксономическую принадлежность штамма IBSS-70 к P. purpureum. Определены продукционные характеристики накопительной культуры P. purpureum в диапазоне поверхностной освещенности 5–15 кЛк. Прирост плотности культуры микроводоросли, соответствующий расчетной концентрации азота в питательной среде, получен только для варианта эксперимента с освещенностью 5 кЛк. Самое высокое содержание B-ФЭ как в клетках, так и в культуре P. purpureum (5.5% сухого вещества и 74 мг/л) также наблюдалось при минимальной освещённости (5 кЛк). Определён характер изменения содержания B-ФЭ в культуре P. purpureum в зависимости от удельной освещённости клеток микроводоросли: максимальное содержание пигмента наблюдалось при освещенности порядка 10 Вт/(м2 г). Предложена модель, позволяющая прогнозировать содержание B-ФЭ при различной освещенности. Показано, что световой параметр культивирования оказывал значительное влияние на скорость роста микроводоросли P. purpureum, скорость синтеза и выход B-ФЭ: более низкий уровень поверхностной освещенности являлся предпочтительным для выращивания P. purpureum. Предложенный подход позволяет получать 0.4 г/(л сут) биомассы P. purpureum, содержащей значительные количества B-ФЭ. Таким образом, в условиях эксперимента важнейшим фактором, определяющим продукционные характеристики культуры P. purpureum, являлся световой, что нужно учитывать при его культивировании.
Работа выполнена в рамках темы Госзадания Федерального исследовательского центра “Институт биологии южных морей имени А. О. Ковалевского Российской академии наук” № АААА-А18-118021350003-6, а также при поддержке гранта Российского научного фонда (проект № 18-74-00095).
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Borowitzka M.A. Microalgae as source of pharmaceutical and other biologically active compounds // J. Appl. Phycol. 1995. V. 7. P. 3. https://doi.org/10.1007/BF00003544
Razaghi A., Godhe A., Albers E. Effects of nitrogen on growth and carbohydrate formation in Porphyridium cruentum // Cent. Eur. J. Biol. 2014. V. 9. P. 156. https://doi.org/10.2478/s11535-013-0248-z
Manirafasha E., Ndikubwimana T., Zeng X., Lu Y., Jinget K. Phycobiliprotein: Potential microalgae derived pharmaceutical and biological reagent // Biochem. Eng. J. 2016. V. 109. P. 282. https://doi.org/10.1016/j.bej.2016.01.025
Цоглин Л.Н., Пронина Н.А. Биотехнология микроводорослей. М.: Научный мир, 2013. 184 с.
Asgharpour M., Rodgers B., Hestekin J.A. Eicosapentaenoic acid from Porphyridium cruentum: increasing growth and productivity of microalgae for pharmaceutical products // Energies. 2015. V. 8. P. 10487. https://doi.org/10:3390/en80910487
Fuentes-Grunewald C., Bayliss C., Zanain M., Pooley C., Scolamacchia M., Silkina A. Evaluation of batch and semi-continuous culture of Porphyridium purpureum in a photobioreactor in high latitudes using Fourier Transform Infrared spectroscopy for monitoring biomass composition and metabolites production // Bioresour. Technol. 2015. V. 189. P. 357. https://doi.org/10.1016/j.biortech.2015.04.042
Fabregas J., Garcia D., Morales E., Dominguez A., Otero A. Renewal rate of semicontinuous cultures of the microalga Porphyridium cruentum modifies phycoerythrin, exopolysaccharide and fatty acid productivity // J. Ferment. Bioeng. 1998. V. 86. P. 477. https://doi.org/10.1016/S0922-338X(98)80155-4
Kathiresan S., Sarada R., Bhattacharya S., Ravishankar A. Culture media optimization for growth and phycoerythrin production from Porphyridium purpureum // Biotechnol. Bioeng. 2006. V. 96. P. 456. https://doi.org/10.1002/bit.21138
Sosa-Hernández J.E., Rodas-Zuluaga L.I., Castillo-Zacarías C., Rostro-Alanís M., Cruz R.; Carrillo-Nieves D., Salinas-Salazar C., Grunewald C.F., Llewellyn C.A., Olguín E.J., Lovitt R.W., Iqbal H.M.N., Parra-Saldívar R. Light intensity and nitrogen concentration impact on the biomass and phycoerythrin production by Porphyridium purpureum // Mar. Drugs. 2019. V. 17. P. 460. https://doi.org/10.3390/md17080460
Упитис В.В., Пакалне Д.С., Шулце И.Ф. Оптимизация минерального питания красной морской водоросли Porphyridium сruentum // Известия АН Латвийской ССР. 1989. Т. 505. С. 95.
Судьїна О.Г., Шнюкова Э.І., Мушак П.О., Лось С.І., Фомішина Р.М., Тупік Н.Д., Лозова Г.І., Золотарьова О. К. Біохімія червоних водоростей. Київ: Інститут ботаніки ім. М.Г. Холодного НАН України, 2007. 320 с.
Velea S., Ilie L., Filipescu L. Optimization of Porphyridium purpureum culture growth using two variables experimental design: light and sodium bicarbonate // Sci. Bull. – Univ. “Politeh.” Bucharest, Ser. B. 2011. V. 73. P. 81.
Тренкеншу Р.П. Влияние света на рост микроводорослей в непрерывной культуре невысокой плотности // Вопросы современной альгологии. 2019. № 1 (19). С. 1. https://doi.org/10.33624/2311-0147-2019-1(19)-1-7
Jahn W., Steinbiss J., Zetsche K. Light intensity adaptation of the phycobiliprotein content of the red alga Porphyridium // Planta. 1984. V. 16. P. 536. https://doi.org/10.1007/BF00407086
Стадничук И.Н. Фикобилипротеины. Биологическая химия. М.: Мир, 1990. 196 с.
Algarra P., Ruediger W. Acclimation processes in the light harvesting complex of the red alga Porphyridium purpureum (Bory) Drew et Ross, according to irradiance and nutrient availability // Plant Cell Environ. 1993. V. 16. P. 149. https://doi.org/10.1111/j.1365-3040.1993.tb00856.x
Sánchez-Saavedra M. del P., Castro-Ochoa F.Y., Nava-Ruiz V.M., Ruiz-Güereca D.A., Villagómez-Aranda A.L., Siqueiros-Vargas F., Molina-Cárdenas C.A. Effects of nitrogen source and irradiance on Porphyridium cruentum // J. Appl. Phycol. 2018. V. 30. P. 783. https://doi.org/10.1007/s10811-017-1284-2
Gudvilovich I.N., Borovkov A.B. Production characteristics of the microalga Porphyridium purpureum (Bory) Drew Ross (Rhodophyta) in batch and quasi-continuous culture // Int. J. Algae. 2014. V. 16. P. 271. https://doi.org/10.1615/InterJAlgae.v16.i3.70
Zimmermann J., Jahn R., Gemeinholzer B. Barcoding diatoms: evaluation of the V4 subregion on the 18S rRNA gene, including new primers and protocols // Org. Divers. Evol. 2011. V. 11. P. 173.
Drummond A.J., Rambaut A. BEAST: Bayesian evolutionary analysis by sampling trees // BMC Evol. Biol. 2007. V. 7. P. 214.
Darriba D., Taboada G.L., Doallo R., Posada D. jModelTest 2: more models, new heuristics and parallel computing // Nat. Methods. 2012. V. 9. P. 772. https://doi.org/10.1038/nmeth.2109
Stamatakis A., Hoover P., Rougemont J. A rapid bootstrap algorithm for the RAxML web–servers // Syst. Biol. 2008. V. 75. P. 758. https://doi.org/10.1080/10635150802429642
Методы физиолого-биохимического исследования водорослей в гидробиологической практике. Киев: Наук. думка, 1975. 247 с.
Hara Y., Yokoyama A., Kim J.H. Systematic relationship of unicellular red algae: from phenetics to the phylogeny // Algae. 2000. V. 15. P. 7.
Yokoyama A., Scott J.L., Zuccarello G.C., Kajikawa M., Hara Y., West J.A. Corynoplastis japonica gen. et sp. nov. and Dixoniellales ord. nov. (Rhodellophyceae, Rhodophyta) based on morphological and molecular evidence // Phycol. Res. 2009. V. 57. P. 278. https://doi.org/10.1111/j.1440-1835.2009.00547
Тренкеншу Р.П., Терсков И.А., Сидько Ф.Я. Плотные культуры морских микроводорослей // Известия СО АН СССР. Серия биологических наук. 1981. Т. 1. С. 75.
Li T., Xu J., Wu H., Jiang P., Chen Z., Xiang W. Growth and Biochemical Composition of Porphyridium purpureum SCS-02 under Different Nitrogen Concentrations // Mar. Drugs. 2019. V. 17. P. 124. https://doi.org/10.3390/md17020124
Тренкеншу Р.П., Лелеков А.С. Моделирование роста микроводорослей в культуре. Севастополь: ООО “Константа”, 2017. 152 с.
Falkowski P.G., Owens T.G. Light-shade adaptation. Two strategies in marine phytoplankton. // Plant Phycol. 1980. V. 66. P. 592. https://doi.org/10.1104/pp.66.4.592
Тренкеншу Р.П., Боровков А.Б., Ширяев А.В. Математическая модель светозависимого содержания пигментов в клетках морских микроводорослей в хемостате // Экология моря. 2005. Т. 69. С. 58.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


