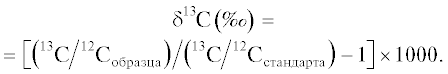Физиология растений, 2021, T. 68, № 1, стр. 93-102
Индукция CAM-фотосинтеза у Hylotelephium triphyllum (Haw.) Holub (Crassulaceae) в условиях европейского Северо-Востока России
Т. К. Головко a, И. Г. Захожий a, *, Г. Н. Табаленкова a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
* E-mail: zakhozhiy@ib.komisc.ru
Поступила в редакцию 24.03.2020
После доработки 24.04.2020
Принята к публикации 25.04.2020
Аннотация
Исследовали сезонные и суточные изменения титруемой кислотности клеточного сока, содержание органических кислот и активность ФЕП-карбоксилазы в листьях очитника трехлистного (очитка пурпурного) Hylotelephium triphyllum (Haw.) Holub. В период генеративного развития растений кислотность клеточного сока возрастала в утренние часы с увеличением содержания малата, активность ФЕП-карбоксилазы повышалась в вечерние часы на фоне снижения его концентрации, что свидетельствует о переходе c C3-фотосинтеза на CAM-тип. Интенсивность ß-карбоксилирования фосфоенолпирувата была наиболее выражена в фазу массового цветения на фоне повышения температуры и снижения влагообеспеченности растений. Установлено, что CAM-фотосинтез не вносит существенного вклада в углеродный баланс и продуктивность растений, о чем свидетельствуют величины изотопной дискриминации 13C органического вещества листьев (δ13C около –27‰) и других органов, близкие к изотопной сигнатуре C3-видов. Функционирование CAM в период цветения – плодоношения способствует сохранению фотосинтетического аппарата и реализации репродуктивного потенциала растений H. triphyllum, обитающих на легко теряющих влагу песчано-с-упесчаных почвах в условиях гумидного климата таежной зоны европейского Северо-Востока.
ВВЕДЕНИЕ
Метаболизм по типу толстянковых (Crassulaceae Acid Metabolism, CAM), или CAM-фотосинтез, осуществляют примерно 6% всех видов сосудистых растений [1]. Существует мнение, что появлению в эволюции растений с CAM-типом фотосинтеза способствовали аридизация климата и снижение содержания CO2 в атмосфере [2, 3]. Особенностью CAM является то, что первичная фиксация углекислоты (в форме ${\text{HCO}}_{3}^{ - }$) происходит при участии ФЕП-карбоксилазы в цитоплазме клеток хлоренхимы ночью, когда устьица открыты. Акцептором CO2 служит фосфоенолпируват (ФЕП), образующийся в процессе гликолитического распада запасных углеводов. Образовавшийся при фиксации CO2 малат переносится в вакуоли. Днем при закрытых устьицах идет обратный транспорт малата в цитоплазму, где происходит его декарбоксилирование. Реассимиляция CO2 осуществляется в цикле Кальвина-Бенсона с участием РуБФ-карбоксилазы/оксигеназы (C3-путь). Следовательно, в одной клетке функционируют две карбоксилазы. Хотя цена восстановления моля CO2 при участии CAM выше, чем по C3-пути, снижение транспирационных потерь на единицу ассимилированного углерода обеспечивает преимущество CAM-растений над C3-растениями в сухих местообитаниях.
CAM-фотосинтез отличается высокой физиологической и метаболической пластичностью [4]. Экспрессия CAM зависит от генотипа, онтогенетических (фаза развития) и внешних факторов (влагообеспеченность, температурный режим, засоление, освещенность, фотопериод). Продолжительность малатного цикла, динамика пула углеводов и вклад ночной фиксации CO2 в нетто-накопление углерода (прирост биомассы) могут существенно варьировать. Другими словами, диапазон CAM-растений довольно широкий: от видов, близких к C3-растениям, до видов, облигатных CAM. Промежуточную позицию занимают факультативные CAM-виды, которые запускают CAM или выходят из него в зависимости от условий среды и/или стадии развития.
Hylotelephium triphyllum является одним из немногочисленных представителей сем. Crassulaceae (толстянковые) на Севере [5, стр. 22‒28]. Виды данного семейства широко распространены по всему земному шару, однако большая их часть сосредоточена в аридных районах. Суккулентные черты и CAM-тип фотосинтеза отражают адаптацию этих растений к сухому и теплому климату.
Миграция толстянковых в северном направлении способствовала приобретению свойств гемикриптофитов и криптофитов (погружение почек возобновления в почву, сокращение онтогенеза, отмирание надземной части в период холодов и т.п.). Сохранив суккулентные черты, растения успешно осваивали местообитания с нестабильным водоснабжением.
Ранее нами было показано, что фотосинтетический аппарат толстянковых, обитающих в условиях холодного климата, хорошо адаптирован к низким положительным и умеренным температурам, что позволяет растениям обеспечить уровень метаболизма, необходимый для реализации жизненной стратегии на Севере [6].
Цель работы – изучение индукции и роли CAM у растений Hylotelephium triphyllum, произрастающих в природно-климатических условиях среднетаежной зоны европейского Северо-Востока России.
МАТЕРИАЛЫ И МЕТОДЫ
Очитник трехлистный (Hylotelephium triphyllum (Haw.) Holub) – многолетнее поликарпическое травянистое растение до 50 см в высоту. Побеги монокарпические, моноциклические, чаще одиночные или по два-три, плотно облиственные, неразветвленные. Листорасположение очередное, супротивное, листья уплощенные продолговато-яйцевидной формы с толстой кутикулой. Соцветие многоцветковое, цветки малиновые, пурпуровые, многочисленные. Подземная часть состоит из клубневидно-утолщенных корней и небольшого корневища. Размножается генеративным (семенами) и вегетативным способом (частями стеблей и корневища). В генеративный период особи H. triphyllum вступают в возрасте 4‒5 лет и старше. Продолжительность генеративного периода составляет 5‒6 лет. Сформированные семена полноценные с высокой всхожестью. Корневище укороченное, расположено на небольшой глубине, от него отходят хорошо развитые клубневидно утолщенные придаточные корни веретеновидной формы. Данный вид обычен в лесной зоне, встречается на опушках, полянах, среди кустарников по лугам. На территории Республики Коми обычными местонахождениями являются пойменные кустарники, склоны, осветленные смешанные леса, вырубки, бечевники. Встречается на террасах в пойме, надпойме и прирусловой части поймы. Произрастает на глинистой, песчаной и супесчаной почве, известняках, сланцевых обнажениях и скалах.
Полевые исследования проведены в подзоне средней тайги Республики Коми. Климат района умеренно континентальный, характеризуется сравнительно длинной холодной снежной зимой и умеренно теплым коротким летом. Средняя температура самого теплого месяца июля около +16°C, а самого холодного месяца января −16°C. Средняя суточная температура воздуха выше 10°С наблюдается 90 дней в году. Среднегодовое количество осадков составляет 700 мм, испарение с поверхности суши – 450 мм. Исследования проводили в течение вегетационного периода 2016 ‒ 2019 гг. В работе использовали растения, обитающие на дерново-слоистой песчано-супесчаной хорошо дренируемой почве в заливаемой части пойменной террасы левого берега р. Вымь (62°16′19.4′′ N 50°39′29.1′′ E). Участок находится в окрестностях Ляльского лесобиологического стационара Института биологии Коми НЦ УрО РАН.
Сведения о температуре воздуха и количестве осадков были получены из открытых архивов сайта “Расписание Погоды” (https://rp5.ru) и Автоматизированной Информационной Системы Обработки Режимной Информации – АИСОРИ (http://aisori.meteo.ru/ClimateR). Использовали данные для метеостанции г. Сыктывкара (синоптический индекс 23805), удаленной от местообитания исследуемых растений на 68 км. Расчет суммы активных температур выше 15°С и суммы осадков осуществляли для 20-дневного периода, предшествующего дате отбора растительных образцов. Микроклиматические условия – освещенность, температуру воздуха и почвы в местообитании растений регистрировали с помощью портативной метеостанции LI-1400 (“LI-COR”, США) с набором метеорологических датчиков.
Погодные условия вегетационного периода 2016 г. характеризовались повышенной по отношению к среднемноголетнему показателю температурой воздуха и близкому к норме количеству осадков с мая по июль (табл. 1). Вегетационные периоды 2017 и 2019 гг. были сравнительно прохладными с обильными осадками. Близкая к климатической норме погода наблюдалась в 2018 г.
Таблица 1.
Погодные условия вегетационного периода в годы проведения исследований (по данным для метеостанции г. Сыктывкара, синоптический индекс 23805)
| Годы | Среднемесячная температура (°С) / Сумма осадков (мм) | |||
|---|---|---|---|---|
| май | июнь | июль | август | |
| 2016 | 11.5/35 | 14.6/51 | 19.9/70 | 18.1/171 |
| 2017 | 5/54 | 12.4/98 | 18.3/79 | 16/83 |
| 2018 | 8.1/77 | 13.5/76 | 19.4/87 | 14.5/52 |
| 2019 | 10.9/84 | 13.6/90 | 15.3/134 | 11.3/111 |
| Среднемноголетние показатели |
8.5/41 | 14.3/59 | 17.5/73 | 14.2/59 |
Зрелые листья отбирали с верхней трети побегов 20‒30 типичных растений в разное время суток в период вегетативного роста (май – июнь), бутонизации – цветения (июнь – июль) и плодоношения (август). Часть свежесобранных листьев использовали для определения содержания сухого вещества и показателей водного обмена. Для насыщения водой листья размещали на фильтровальной бумаге в чашках Петри, заливали дистиллированной водой и выдерживали в закрытых чашках в течение 12 ч. Длительность экспозиции определяли в предварительном опыте. Относительное содержание воды (ОСВ) в листьях рассчитывали по формуле:
Дневной водный дефицит (ВД) находили по формуле:
Для определения титруемой кислотности зафиксированные в жидком азоте образцы листьев (1.5 г) гомогенизировали в 10 мл дистиллированной воды, полученный экстракт центрифугировали в течение 10 мин при 12 000 g и отбирали надосадочную жидкость. Общую кислотность супернатанта определяли методом потенциометрического титрования раствором гидрооксида натрия (NaOH), используя pH-метр Hanna HI 8519 (“Hanna Instruments”, США). Суммарное содержание органических кислот в листьях выражали в экв. [H+]/г сырой массы.
Для анализа углеводов и органических кислот зафиксированный в жидком азоте растительный материал подвергали лиофильной сушке. Определение содержания водорастворимых низкомолекулярных углеводов выполняли спектрофотометрическим методом по колориметрированию избытка щелочного раствора гексацианоферрата (III) калия (K3[Fe(CN)6]) после реакции с редуцирующими сахарами [7]. Здесь и далее при выполнении спектрофотометрических измерений применяли двулучевой спектрофотометр Shimadzu UV-1700 (“Shimadzu”, Япония).
Для определения содержания и состава свободных органических кислот и моносахаридов навеску (100 мг) образца лиофильно высушенных листьев дважды экстрагировали свежими порциями (по 10 мл) дистиллированной воды при температуре 40°С. Полученный экстракт высушивали под вакуумом и подвергали силированию смесью, состоящей из N,O-бис(триметилсилил)трифтор-ацетамида (BSTFA) и триметилхлорсилана (TMCS) в пиридине в соответствии с рекомендациями фирмы-производителя (https://www.sigmaaldrich.com/ Graphics/Supelco/objects/4800/4747.pdf). Идентификацию триметилсилильных производных органических кислот и моносахаридов осуществляли на основании сопоставления масс-спектров и индексов удерживания стандартов и компонентов анализируемых растворов после проведения ГЖХ анализа на хромато-масс-спектрометре TRACE DSQ (“Thermo Fisher Scientific”, США). Количественное определение целевых компонентов проводили с помощью метода ГЖХ с пламенно-ионизационным детектированием на приборе Кристалл 200М (“Хроматэк”, Россия). В качестве внутреннего стандарта использовали гексадекан (C16H34).
Определение активности ФЕП-карбоксилазы в растительном материале проводили по методике, описанной в статье [8] с незначительными модификациями. В работе использовали коммерческие реактивы производства “Sigma-Aldrich” (Германия). Зафиксированные в жидком азоте образцы листьев (500 мг) гомогенизировали в 5 мл 50 ммоль Tris HCl буфера (pH 8.2), содержащем 1 ммоль ЭДТА, 5 ммоль сульфата магния (MgSO4), 2 ммоль ДТТ, 1% Тритона X-100, 20% глицерина, 50 мг поливинилполипирролидона (ПВПП) и 20 мкл смеси ингибиторов протеаз (Protease Inhibitor Cocktail for plant cell and tissue extracts, DMSO solution). Гомогенат центрифугировали 10 мин при 12 000 g и отделяли от осадка. Процедуру выделения проводили при 4°С. Активность ФЕП-карбоксилазы в полученном экстракте определяли спектрофотометрически, оценивая изменение оптической плотности при 340 нм в реакции окисления НАД·H в присутствии малатдегидрогеназы (MДГ). Для чего к реакционной среде – 50 ммоль Tris HCl буфер (pH 8.2) (2.95 мл), содержащий 10 Ед МДГ, 0.2 ммоль НАД∙H, 5 ммоль сульфата магния (MgSO4) и 5 ммоль гидрокарбоната натрия (NaHCO3) добавляли аликвоту (50 мкл) экстракта ФЭП-карбоксилазы. Реакцию окисления НАД∙H инициировали путем добавления раствора ФЕП, конечная концентрация которого в реакционной среде составляла 2 ммоль. Скорость окисления НАД∙H измеряли в течение 3 мин после добавления ФЕП. Активность ФЕП- карбоксилазы определяли при 25°С и выражали в расчете на хлорофилл. Содержание хлорофиллов определяли в ацетоновых экстрактах растительного материала спектрофотометрически [9].
Изотопный состав углерода (соотношение изотопов 13C/12C) в растительных образцах исследовали на базе ЦКП “Геонаука” Института геологии Коми НЦ УрО РАН. Измерения проводились методом проточной масс-спектрометрии на аналитическом комплексе, включающем элементный анализатор Flash EA 1112 (“Thermo Fisher Scientific”, США) сопряженный c масс-спектрометром Delta V Adnantage (“Thermo Fisher Scientific”, США). Отклонение изотопной сигнатуры 13C/12C исследуемого образца от сигнатуры стандартного образца рассчитывали по формуле:
Результаты оценки δ13C растительных образцов приведены в промилле относительно стандарта PDB (Pee Dee Belemnite).
Все анализы проводили в 3-5-кратной биологической повторности. Для сравнения средних величин применяли дисперсионный анализ ANOVA (критерий Дункана). Расчеты осуществляли при заданном уровне значимости P ≤ 0.05. На рисунках и в таблицах представлены средние арифметические значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Особенности роста и развития растений Hylotelephium triphyllum. Многолетние наблюдения показали, что отрастание побегов растений начинается в первой–второй декадах мая в зависимости от продолжительности и силы весеннего половодья. Несмотря на высокую влагообеспеченность, сначала рост побегов замедленный, видимо из-за недостатка тепла и запаса углерода. По мере формирования листовой поверхности активность ростовых процессов возрастала. В период цветения высота растений составляла 35‒45 см, сырая масса побега – около 30 г, а на долю листьев приходилось в среднем 30‒35% массы побега. Линейный рост побега H. triphyllum детерминирован, появление новых метамеров прекращается с переходом растений к генеративному развитию.
Фаза цветения растений приурочена к самому теплому месяцу вегетационного периода – июлю (табл. 1). При среднемесячной температуре воздуха около 18°С максимальные температуры воздуха над поверхностью почвы могут достигать 28‒30°С. При ясном небе в полуденные часы на уровне растений нами были зарегистрированы температуры воздуха в пределах 30‒35°С, а почвы на глубине 5 см – 27‒30°С. Относительная влажность воздуха составляла 45‒50%, а влажность почвы не превышала 20%.
Относительное содержание воды в функционально зрелых листьях в фазу вегетативного роста составляло в среднем 90‒92% (табл. 2). В период бутонизации – цветения величина ОСВ снижалась до 80–85%, в отдельных случаях – до 75% (табл. 2). Следует отметить, что отделенные листья хорошо удерживали воду, видимо вследствие накопления осмотически активных соединений, а также низкой устьичной и кутикулярной транспирации. В лабораторных условиях сырая масса листьев практически не менялась в течение суток и более (данные не приводятся).
Таблица 2.
Относительное содержание воды (ОСВ) и дневной водный дефицит (ВД) в листьях Hylotelephium triphyllum в период вегетативного роста и начала плодоношения
| Дата | ОСВ, % | ВД, % | Доля сухого вещества, % |
|---|---|---|---|
| 25–26.05.2016 | 91.4 ± 5.8 | 7.6 ± 0.4 | 7.6 ± 0.7 |
| 25–26.07.2016 | 74.7 ± 4.6 | 24.3 ± .5 | 7.4 ± 0.7 |
Кислотность клеточного сока и содержание малата. Одним из основных индикаторов функционирования CAM-фотосинтеза служат циклические изменения кислотности клеточного сока листьев растений, связанные с суточной динамикой накопления и утилизации органических кислот. Исследования титруемой кислотности (ТК) клеточного сока листьев H. triphyllum в разные годы и периоды вегетации позволили выявить сезонные и суточные изменения величины этого показателя (рис. 1, табл. 3). Из представленных на рис. 1 данных видно, что уровень ТК значительно повышался во второй половине вегетации (июль–август). В этот период были отмечены и более значительные суточные изменения величины ТК. Так, в июле (фаза массового цветения) кислотность клеточного сока в ранние утренние часы достигала 96 мкмоль [Н+]/г сырой массы, к полудню она снижалась в 5 раз, а к ночи вновь заметно возрастала до 27 мкмоль [Н+]/г сырой массы. В конце мая (фаза вегетативного роста) величина ТК не превышала 6 мкмоль [Н+]/г сырой массы и была стабильна в течение суток. Сходные закономерности изменения кислотности клеточного сока в период генеративного развития растений были отмечены и в другие годы (табл. 3). При этом более выраженная динамика величины ТК была зарегистрирована в более теплом 2016 г., чем в 2018 г.
Рис. 1.
Суточные изменения титруемой кислотности клеточного сока листьев Hylotelephium triphyllum в разные периоды вегетации (данные 2017 г.): 1 – 25–27 мая, 2 – 19–22 июня, 3 – 18–21 июля, 4 – 14–15 августа. Различные латинские буквы обозначают статистически значимые изменения величины показателя в течение суток (P ≤ 0.95).
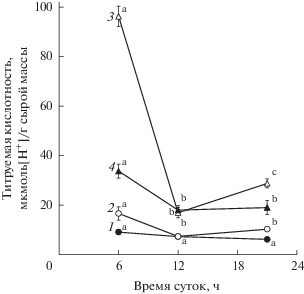
Таблица 3.
Суточная динамика титруемой кислотности (мкмоль [Н+]/г сырой массы) клеточного сока листьев Hylotelephium triphyllum в период генеративного развития растений
| Время суток, ч | 2016 г. | 2018 г. | ||
|---|---|---|---|---|
| 2 июля | 27 июля | 3 июля | 30 июля | |
| 6:00 | 84.8 ± 4.2а | 156.5 ± 7.6а | 43.5 ± 1.3а | 77.3 ± 2.6а |
| 12:00 | 15.3 ± 1.1b | 26.8 ± 2.0b | 29.1 ± 1.7b | 53.1 ± 5.2 b |
| 18:00 | 13.9 ± 1.3b | 16.1 ± 0.9с | 15.1 ± 1.0с | 20.5 ± 1.1с |
| 22:00 | 31.8 ± 2.6с | 30.4 ± 1.9b | 27.9 ± 2.4b | 21.8 ± 3.2с |
Суточные изменения кислотности клеточного сока в фазу цветения соответствовали динамике содержания малата (табл. 4). Максимальное накопление малата зарегистрировано в ранние утренние часы, в полуденное время его содержание было в 6.5 раз меньше. К ночи концентрация малата вновь повышалась, но не достигала величин, отмеченных в ранние утренние часы. Содержание других карбоновых кислот изменялось в той же манере, что и малата, однако их концентрация была существенно меньше. Следовательно, их вклад в кислотность клеточного сока листьев, по сравнению с малатом, незначительный.
Таблица 4.
Суточная динамика содержания карбоновых кислот (мкмоль/г сырой массы) и титруемой кислотности клеточного сока (мкмоль [Н+]/г сырой массы) в листьях Hylotelephium triphyllum, (данные 18‒20 июля 2017 г.)
| Время суток, ч | Малат | Цитрат + изоцитрат | Сукцинат | Титруемая кислотность |
|---|---|---|---|---|
| 6:00 | 35.6 ± 1.8a | 5.0 ± 0.2а | 1.5 ± 0.2а | 96.2 ± 4.2а |
| 12:00 | 5.4 ± 0.1b | 2.0 ± 0.1b | 0.5 ± 0.1b | 16.9 ± 2.0b |
| 21:00 | 12.7 ± 0.2c | 2.1 ± 0.1b | 0.7 ± 0.1b | 28.2 ± 1.8c |
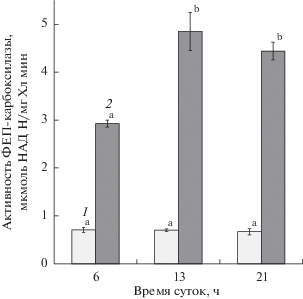
Активность ФЕП-карбоксилазы. ФЕП-карбоксилаза является ключевым ферментом, осуществляющим первичную фиксацию углекислоты у растений с CAM и C4-типом фотосинтеза. Мы исследовали активность фермента в листьях H. triphyllum в фазу вегетативного роста (май) и в период цветения (июль) (рис. 2). Листья отрастающих побегов характеризовались низким и стабильным в течение суток уровнем активности ФЕП-карбоксилазы. В фазу цветения активность ФЕП-карбоксилазы была в 4‒7 раз выше и изменялась в течение суток. В начале ночи уровень активности ФЕП-карбоксилазы был в 1.5 раза выше, чем в ранние утренние часы. При этом повышение активности фермента наблюдалось уже в полуденное время, на фоне снижения пула органических кислот.
Рис.2.
Суточная динамика активности ФЕП-карбоксилазы в листьях Hylotelephium triphyllum: 1 – май 2019 г., 2 – август 2018 г. Различные латинские буквы обозначают статистически значимые изменения величины показателя в течение суток (P ≤ 0.95).
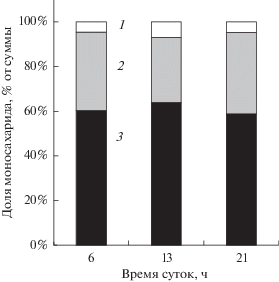
Содержание растворимых сахаров. В период генеративного развития растений содержание растворимых углеводов в листьях H. triphyllum существенно изменялось в течение суток (рис. 3). Максимум накопления сахаров отмечали во второй половине дня. При этом в начале июля (начало цветения) фонд сахаров в дневные часы был в 1.5 раза больше, чем в начале августа (начало плодоношения). В оба срока в фонде углеводов, как правило, доминировали моносахара, их доля составляла в среднем 70%. Дисахариды были представлены в основном сахарозой. В составе моносахаров присутствовали седогептулоза (около 60%), фруктоза (35‒40%) и глюкоза (менее 5%) (рис. 4).
Рис. 3.
Содержание растворимых углеводов в фазе начала цветения (а) и начала плодоношения (б) в листьях Hylotelephium triphyllum (данные 2 июля и 3 августа 2018 г., соответственно): 1 – моносахариды, 2 – сумма растворимых сахаров. Различные латинские буквы обозначают статистически значимые изменения величины показателя в течение суток (P ≤ 0.95).
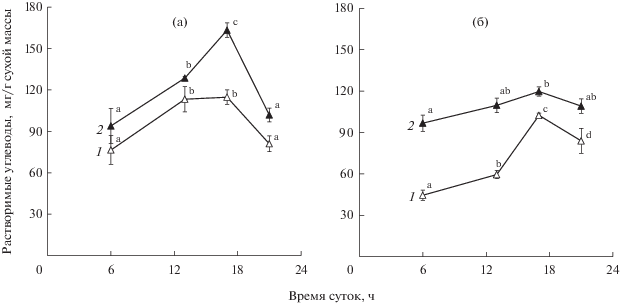
Рис. 4.
Относительная доля моносахаридов в листьях Hylotelephium triphyllum в фазу массового цветения (18–20 июля 2017 г.): 1 – глюкоза, 2 – фруктоза, 3 – седогептулоза.
Таким образом, нами установлено, что с переходом к генеративному развитию в листьях H. triphyllum повышается кислотность клеточного сока, увеличивается содержание малата, возрастает уровень активности ФЕП-карбоксилазы. В фазу цветения наблюдаются выраженные суточные изменения этих показателей. Фаза цветения приходится на наиболее теплый период вегетации (июль).
ОБСУЖДЕНИЕ
Факультативный CAM используют однолетние и многолетние растения, которые в условиях достаточного водоснабжения реализуют C3-тип фотосинтеза для поддержания высокой скорости роста. При неблагоприятных воздействиях (дефицит влаги, высокие температуры, засоление) такие виды переходят на CAM. Индукция CAM служит механизмом снижения потери влаги и поддержания фотосинтетической активности. По имеющимся в литературе данным переход на CAM позволяет сэкономить до 70% воды, теряемой при транспирации за день [10].
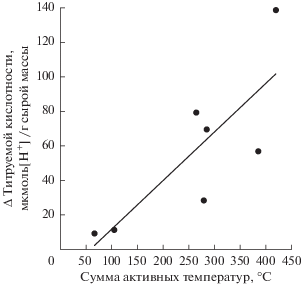
Известно, что CAM-тип фотосинтеза связан с суточной ритмикой органических кислот. Закономерные суточные изменения кислотности клеточного сока и содержания малата в листьях H. triphyllum наблюдались нами в период генеративного развития (рис. 1; табл. 3, 4). Переход к генеративному развитию отмечен в конце июня, а фаза массового цветения приходилась на середину июля – месяца с наиболее теплой погодой. В период отрастания побегов (май) кислотность клеточного сока была низкой и постоянной в течение суток. Мы проанализировали зависимость величины, характеризующей разность между максимальными и минимальными за сутки значениями показателя титруемой кислотности клеточного сока (Δ ТК), от погодных условий июня‒июля. Выявлено, что величины Δ ТК, полученные в разные годы и сроки вегетации, зависели достоверно от суммы активных температур (>15°С) за период (20 суток), предшествующий дате изучения суточной динамики ТК (рис. 5). Чем больше тепла получали растения, тем сильнее была выражена суточная динамика титруемой кислотности и больше величина Δ ТК. В то же время количество выпавших осадков не оказало значимого влияния на величину Δ ТК (данные не приводятся), вероятно, из-за низкой способности дерново-слоистой песчано-супесчаной почвы удерживать влагу. Несмотря на осадки, в июле нами было отмечено снижение содержания влаги в корнеобитаемом слое почвы до 10‒15% полной влагоемкости. В результате уменьшилась оводненность и увеличился водный дефицит листьев (табл. 2).
Рис. 5.
Зависимость разности между максимальной и минимальной величинами титруемой кислотности клеточного сока (Δ ТК) листьев Hylotelephium triphyllum от суммы активных температур выше 15°C за 20‑суточный период, предшествующий дате определений суточной динамики титруемой кислотности (обобщенные данные за июнь–июль 2016–2019 гг.). Результаты корреляционного анализа: коэффициент корреляции Пирсона r = 0.811, уровень значимости P = 0.027.
Регуляция CAM-фотосинтеза в течение суток связана с суточным ритмом активности ФЕП-карбоксилазы. Считается, что активная (нечувствительная к накоплению малата) форма фермента присутствует у CAM-растений ночью [11]. Однако у некоторых CAM- видов ФЕП-карбоксилаза может оставаться активной в течение нескольких часов после начала фотопериода. Например, у C3-CAM-вида Clusia minor она была активной (фосфорилированной) еще в течение 3 ч после включения света [12].
У исследованных нами растений H. triphyllum активность ФЕП-карбоксилазы в ранние утренние часы была почти вдвое ниже, чем в начале ночи. Причем повышение уровня активности фермента начиналось уже в первой половине дня. Известно, что фотопериод, интенсивность и спектральный состав светового потока могут оказывать существенное влияние на индукцию CAM посредством увеличения синтеза ФЕП-карбоксилазы и модуляции активности фермента [13, 14]. Анализируя суточные изменения активности фермента в листьях H. triphyllum, следует учитывать особенности светового режима, связанные с географическим положением района проведения исследований и, в первую очередь, продолжительность фотопериода. Так, в середине июля восход солнца наблюдается в 2 ч 23 мин, заход в 21 ч 04 мин, а сумерки длятся более 2 ч.
Ранее было показано, что в листьях H. triphyllum отсутствует специализированная водозапасающая ткань [6, стр. 31‒32] и они характеризуются высокой водоудерживающей способностью. Этому способствует накопление осмотически активных соединений – растворимых сахаров и органических кислот.
Растворимые сахара играют важную роль во всех процессах жизнедеятельности, поскольку могут действовать как сигнальные молекулы, контролирующие экспрессию генов, которые регулируют метаболизм, развитие и устойчивость растений к стрессу [15]. Поэтому углеводный статус может иметь особое значение для видов с факультативным CAM. Наши данные свидетельствуют о сравнительно высоком содержании в листьях растений H. triphyllum растворимых сахаров, преимущественно моносахаридов, отличающихся наибольшей биологической активностью. Среди моносахаридов доминировала седогептулоза. О способности некоторых видов CAM-растений накапливать этот сахар известно давно, однако роль седогептулозы до конца не выяснена [16]. Полагают, что синтез седогептулозы связан с цитозольным окислительным пентозофосфатным путем и она участвует в поддержании углеродного и фосфорного гомеостаза в клетке при повышенной концентрации CO2.
Несмотря на многочисленные исследования, все еще остаются плохо понятыми механизмы восприятия и трансдукции сигнала, формирования адекватного биохимического ответа CAM-растений [17, 18]. Не ясно, в какой мере эти механизмы универсальны для всех видов с факультативным CAM. У отдельных видов индукция CAM связана с онтогенетическим развитием. Следовательно, в регуляции экспрессии CAM генов могут участвовать гормоны, циркадные ритмы и другие факторы, способные синхронизировать онтогенетические события в соответствии с изменения во внешней среде. Онтогенетически запрограммированную индукцию C3-CAM перехода можно рассматривать как способ обеспечения положительного баланса углерода и ресурсов для репродукции при предсказуемом ухудшении водоснабжения [4, 19]. У исследованного нами H. triphyllum выраженное функционирование CAM-пути наблюдалось в период генеративного развития и коррелировало с поступлением тепла на фоне снижения влагообеспеченности растений.
Для оценки вклада CAM в продукционный процесс мы определяли соотношение стабильных изотопов углерода (С12/С13) в биомассе различных органов H. triphyllum. Как известно, фракционирование изотопов углерода при фотосинтезе в сильной степени зависит от биохимического механизма связывания углерода и существенно отличается у видов с различными типами фиксации атмосферного CO2 [20]. У растений с C3-типом углеродного метаболизма величина изотопной дискриминации (δ13C) варьирует в пределах от –21 до ‒35‰, а у C4-видов от –18 до –9‰. Промежуточную позицию занимают растения с CAM-типом углеродного метаболизма. Если величина δ13C органического вещества листьев составляет –30…–25‰, можно говорить о минимальном вкладе ß-карбоксилирования ФЕП в общий углеродный баланс [21, 22].
Величина δ13C органического вещества листьев H. triphyllum варьировала в пределах от –27.3 до –28.4 ‰ (рис. 6). Обогащение пула углерода легким изотопом в первой половине вегетации (май–июнь) обусловлено тем, что растения находятся в благоприятных для роста условиях и фотосинтетическая ассимиляция углерода осуществляется по C3-пути. Интенсивному росту способствуют длинный день и достаточное количество влаги в почве после половодья. Во второй половине вегетации (июль–август) отмечено небольшое повышение содержания в листьях тяжелого изотопа, что связано с индукцией CAM. В период плодоношения (середина августа) величина δ13C органического вещества генеративных органов составляла –27.9 ‰, стеблей –27.5 ‰, почек возобновления –27.4 ‰ и утолщенных придаточных корней –27.3 ‰. Тот факт, что величина δ13C утолщенных придаточных корней была наименее отрицательна, указывает на возможность аллокации углерода, ассимилированного при CAM-фотосинтезе в запасающие органы. Использованием запасных веществ для формирования надземной биомассы побегов можно объяснить тенденцию к обогащению органического вещества листьев тяжелым изотопом углерода в период весеннего отрастания (май). Вместе с тем нельзя исключить влияние постфотосинтетических процессов фракционирования изотопов углерода, которые также приводят к изменению сигнатуры изотопного состава органического вещества подземных органов относительно δ13C листьев [23].
Рис. 6.
Сезонные изменения величины δ13C органического вещества листьев Hylotelephium triphyllum (данные 2017 г.)

Вопрос о том, насколько точно величина δ13C отражает вклад ночной и дневной фиксации CO2 у CAM-растений, остается дискуссионным [24]. Поэтому судя только по величине δ13C трудно оценить роль ассимиляции CO2 посредством ß-карбоксилирования ФЕП в углеродном балансе C3-CAM вида H. triphyllum. Обогащение биомассы H. triphyllum легким изотопом углерода подтверждает, что в природных условиях таежной зоны растения в большей мере использовали C3-тип фотосинтетического метаболизма, чем CAM-путь.
Итак, нами выявлена сезонная и суточная динамика показателей, служащих индикаторами C3-CAM перехода. Закономерные изменения кислотности клеточного сока, содержания малата и активности ФЕП-карбоксилазы в листьях свидетельствуют об индукции CAM у растений H. triphyllum в период генеративного развития. Установлено, что CAM-фотосинтез не вносит существенного вклада в углеродный баланс и продуктивность растений. Функционирование CAM в период цветения – плодоношения способствует сохранению фотосинтетического аппарата и реализации репродуктивного потенциала растений, обитающих на легко теряющих влагу песчано-супесчаных почвах в условиях гумидного климата таежной зоны европейского Северо-Востока России.
Работа выполнена в рамках темы госбюджетных НИОКТР “Физиология и стресс-устойчивость фотосинтеза растений и пойкилогидрических фотоавтотрофов в условиях Севера” (№ АААА-А17-117033010038-7).
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Silvera K., Neubig K.M., Whitten W.M., Williams N.H., Winter K., Cushman J.C. Evolution along the crassulacean acid metabolism continuum // Funct. Plant Bio-l. 2010 V. 37. P. 995. https://doi.org/10.1071/FP10084
Raven J.A., Spicer R.A. The evolution of crassulacean acid metabolism // Crassulacean acid metabolism. Biochemistry, ecophysiology and evolution / Eds. Winter K., Smith J.A.C. Berlin: Springer-Verlag, 1996. P. 360.
Keerle J.E., Rundel P.W. Evolution of CAM and C4 carbon-concentrating mechanisms // Int. J. Plant Sci. 2003 V.164. P. 55. https://doi.org/10.1086/374192
Dodd A.N., Borland A.M., Haslam R.P., Griffiths H., Maxwell K. Crassulacean acid metabolism: plastic, fantastic // J. Exp. Bot. 2002. V. 53. P. 569. https://doi.org/10.1093/jexbot/53.369.569
Головко Т.К., Далькэ И.В., Бачаров Д.С., Бабак Т.В., Захожий И.Г. Толстянковые в холодном климате. СПб.: Наука, 2007. 205 с.
Golovko T.K., Dalke I.V., Bacharov D.S. Mesostructure and activity of photosynthetic apparatus for three crassulacean species grown in cold climate // Russ. J. Plant Physiol. 2008. V. 55. P. 603. https://doi.org/10.1134/S1021443708050038
Brushwood D.E. Modification of the potassium ferricyanide reducing sugar test for sugars from extracts of cotton fiber // J. Cotton Sci. 2000. V.4. P. 202
Theng V., Agarie S., Nose A. Regulatory properties of phosphoenolpyruvate carboxylase in crassulacean acid metabolism plants: diurnal changes in phosphorylation state and regulation of gene expression // Plant Prod. Sci. 2007. V. 10 P. 171. https://doi.org/10.1626/pps.10.171
Методика измерений массовой доли пигментов спектрофотометрическим методом (фиксация и экстракция диметилкетоном). Cвидетельство об аттестации методики измерений № 88-17641-077-01.00076-2014. 2014. Сыктывкар. 24 с.
Borland A.M. A model for the partitioning of photosynthetically fixed carbon during the C3-CAM transition in Sedum telephium // New Phytol. 1996. V. 134. P. 433. https://doi.org/10.1111/j.1469-8137.1996.tb04360.x
Carter P.J., Fewson C.A., Nimmo G.A., Wilkins M.B. Roles of circadian rhythms, light and temperature in the regulation of phosphoenolpyruvate carboxylase in crassulacean acid metabolism // Crassulacean acid metabolism. Biochemistry, ecophysiology and evolution / Eds. Winter K., Smith J.A.C. Berlin: Springer-Verlag, 1996. P. 46.
Borland A.M., Griffiths H. A comparative study on the regulation of C3 and C4 carboxylation processes in the constitutive crassulacean acid metabolism (CAM) plants Kalanchoe daigremontiana and the C3-CAM intermediate Clusia minor // Planta. 1997. V. 201. P. 368 https://doi.org/10.1007/s004250050079
Cockburn W., Whitelam G. C., Broad A., Smith J. The participation of phytochrome in the signal transduction pathway of salt stress responses in Mesembryanthemum crystallinum L. // J. Exp. Bot. 1996. V. 47. P. 647. https://doi.org/10.1093/jxb/47.5.647
Gawronska K., Romanowska E., Miszalski Z., Niewiadomska E. Limitation of C3-CAM shift in the common ice plant under high irradiance // J. Plant Physiol. 2013. V. 170. P. 129. https://doi.org/10.1016/j.jplph.2012.09.019
Ceusters N., van den Ende W., Ceusters J. Exploration of sweet immunity to enchance abiotic stress tolerance in plants: lessons from CAM // Progress in Botany Vol. 78 / Eds. Cánovas F., Lüttge U., Matyssek R. Cham: Springer, 2016. P. 145. https://doi.org/10.1007/124_2016_1
Ceusters J., Godts C., Peshev D., Vergauwen R., Dyubankova N., Lescrinier E., De Proft M.P., Van den Ende W. Sedoheptulose accumulation under CO2 enrichment in leaves of Kalanchoë pinnata: a novel mechanism to enhance C and P homeostasis? // J. Exp. Bot. 2013. Vol. 64. P. 1497. https://doi.org/10.1093/jxb/ert010
Cushman J.C., Taybi T., Bohnert H.J. Induction of crassulacean acid metabolism – molecular aspects // Photosynthesis. Advances in photosynthesis and respiration, V 9. / Eds. Dordrecht: Springer, 2000. P. 551.
Winter K., Holtum J.A.M. Facultative crassulacean acid metabolism (CAM) plants: powerful tools for unraveling the functional elements of CAM photosynthesis // J. Exp. Bot. 2014. V. 65. P. 3425. https://doi.org/10.1093/jxb/eru063
Herppich W., Herppich M., Dieter J.W. The irreversible C3 to CAM shift in well-watered and salt-stressed plants of Mesembryanthemum crystallinum is under strict ontogenetic control // Bot. Acta. 1992. V. 105. P34. https://doi.org/10.1111/j.1438-8677.1992.tb00264.x
Farquhar G.D., Ehleringer J.R., Hubick K.T. Carbon isotope discrimination and photosynthesis // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1989. V. 40. P. 503. https://doi.org/10.1146/annurev.pp.40.060189.002443
Brugnoli E., Farquhar G.D. Photosynthetic fractionation of carbon isotopes // Photosynthesis. Advances in photosynthesis and respiration, V. 9. / Eds. Leegood R.C., Sharkey T.D., Caemmerer S. Dordrecht: Springer, 2000. P. 399.
Griffiths H. Carbon isotope discrimination and the integration of carbon assimilation pathways in terrestrial CAM plants // Plant Cell Environ. 1992. V. 15. P. 1051. https://doi.org/10.1111/j.1365-3040.1992.tb01655.x
Badeck F.W., Tcherkez G., Nogués S., Piel C., Ghashghaie J. Post-photosynthetic fractionation of stable carbon isotopes between plant organs – a widespread phenomenon // Rapid Commun. Mass Spectrom. 2005. V. 19. P. 1381. https://doi.org/10.1002/rcm.1912
Winter K., Holtum J.A.M. How closely do the δ13 values of crassulacean acid metabolism plants reflect the proportion of CO2 fixed during day and night? // Plant Physiol. 2002. V. 129. P.1843. https://doi.org/10.1104/pp.002915
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений